Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Farelerin Motor Korteksinde LazerE Bağlı Beyin Hasarı
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Erratum Notice
Özet
Burada sunulan protokol beyin hasarı bir kemirgen modeli oluşturmak için bir teknik gösterir. Burada açıklanan yöntem lazer ışınlama kullanır ve motor korteks hedefler.
Özet
Deneysel kemirgen modellerinde inme indükleme için yaygın bir teknik geçici içerir (genellikle MCAO-t olarak gösterilir) veya kalıcı (MCAO-p olarak belirlenmiş) orta serebral arter tıkanıklığı (MCA) bir kateter kullanarak. Ancak bu genel kabul görmüş tekniğin bazı sınırlamaları vardır ve böylece geniş kullanımını sınırlandırmıştır. Bu yöntemle inme indüksiyonu genellikle iskemik alanın lokalizasyonu nda ve boyutunda yüksek değişkenlik, periyodik kanama oluşumları ve yüksek ölüm oranları ile karakterizedir. Ayrıca, geçici veya kalıcı prosedürlerden herhangi birinin başarıyla tamamlanması uzmanlık gerektirir ve genellikle yaklaşık 30 dakika sürer. Bu protokolde, kemirgen modellerinde beyin hasarının indüklemesi ve incelenmesi için alternatif bir yöntem olarak hizmet edebilen bir lazer ışınlama tekniği sunulmuştur.
Kontrol ve MCAO gruplarında sıçanlar ile karşılaştırıldığında, lazer indüksiyon ile beyin hasarı vücut ısısı, infarkt hacmi, beyin ödemi, intrakraniyal kanama ve mortalite azaltılmış değişkenlik gösterdi. Ayrıca, lazer kaynaklı bir yaralanma kullanımı, hem motor korteks inanın hem de striatal dokuların tahrip edildiği MCAO deneylerinin aksine sadece motor kortekste beyin dokularında hasara yol açtı.
Bu araştırmadan elde edilen bulgular lazer ışınlama motor kortekste beyin hasarı indükleyen alternatif ve etkili bir teknik olarak hizmet olabileceğini düşündürmektedir. Yöntem ayrıca yordamı tamamlamak için süreyi kısaltır ve uzman işleyicileri gerektirmez.
Giriş
Küresel olarak, inme ölüm ikinci önde gelen nedeni ve sakatlık üçüncü önde gelen nedeni1. İnme de ağır sakatlık yol açar, genellikle tıbbi personel ve akrabalarıekstra bakım gerektiren. Bu nedenle, bozukluk ile ilişkili komplikasyonları anlamak ve daha olumlu sonuçlar için potansiyelini artırmak için bir ihtiyaç vardır.
Hayvan modellerinin kullanımı hastalıkları anlamak için ilk adımdır. En iyi araştırma sonuçlarını sağlamak için, tipik bir model basit bir teknik, karşılanabilirlik, yüksek tekrarlanabilirlik ve minimum değişkenlik içerecektir. İskemik inme modellerinde belirleyiciler beyin ödemi hacmi, infarkt boyutu, kan-beyin bariyeri ölçüde (BBB) arıza, ve fonksiyonel bozukluk genellikle nörolojik şiddetpuanı2 ile değerlendirilir .
Kemirgen modellerinde en yaygın olarak kullanılan inme indüksiyon tekniği orta serebral arteri (MCA) geçici veya kalıcı olarak3. Bu teknik insanlarda olanlara benzer bir inme modeli üretir: bu konturlu alanı çevreleyen bir penumbra vardır, son derece tekrarlanabilir, ve iskemi süresi ve reperfüzyon düzenler4. Bununla birlikte, MCAO yöntemi bazı komplikasyonlar vardır. Teknik intrakranial kanama ve görme korteks ve sık sık ek sonuçlara yol ortak hipertermi bir disfonksiyon ile ipsilateral retina yaralanması eğilimli5,6,7. Diğer sınırlamalar indüklenen inme yüksek varyasyonları dahil (istenmeyen bölgelere iskemi olası uzantısı kaynaklanan, dış karotis arter bölgesi gibi), MCA yetersiz oklüzyon, ve erken reperfüzyon. Ayrıca, farklı suş ve boyutlarda sıçanlar çeşitli enfarktüs hacimleri8sergilerler. Bahsedilen tüm dezavantajlara ek olarak, MCAO modeli derin beyin bölgelerinde küçük izole inmeler neden olamaz, kateterizasyon için minimum damar boyutu gereksinimi açısından teknik olarak sınırlı olduğundan. Bu alternatif bir model için ihtiyaç daha kritik hale getirir. Başka bir yöntem, fototromboz, MCAO prosedürleri için olası bir alternatif sağlar ama verimliliği geliştirmek değildir9. Bu teknik ışıkla inme hedefleyen ve önceki modellerde bazı iyileştirmeler sunuyor. Ancak, fototromboz ikincil kombinasyonları ile ilişkili bir invaziv kraniyotomi gerektirir9.
Özetlenen eksikliklerin ışığında, burada sunulan protokol kemirgenlerde beyin hasarına neden olmak için yetenekli bir alternatif lazer tekniği sağlar. Lazer tekniğinin etki mekanizması, lazerin canlı dokular üzerinde verilen fototermal etkilerine dayanır ve bu da vücut dokuları tarafından ışık ışınlarının emilimine ve ısıya dönüştürülmesine yol açar. Lazer tekniği kullanmanın avantajları güvenliği ve manipülasyon kolaylığıdır. Bir lazerin kanamayı durdurmak için ısı üretme yeteneği tıpta çok önemli hale getirirken, belirli bir buluşma noktasında farklı ışınları yükseltebilme yeteneği lazerlerin hedef nokta10'unönünde duran sağlıklı dokuları yok etmekten kaçınmasını sağlar. Bu protokolde kullanılan lazer ışını, kemik gibi düşük sıvı bir ortamdan, enerjisini yaymadan ve/veya herhangi bir tahribata neden olmadan geçebilir. Beyin dokuları gibi yüksek sıvı bir ortama ulaştığında, enerjisini hedef dokuları yok etmek için kullanır. Teknik, bu nedenle, beynin uygun alanda sadece beyin hasarı neden olabilir.
Burada sunulan teknik, ışınlama düzeylerini düzenleme yeteneğinin muazzam bir miktar gösterdi, başından itibaren amaçlanan beyin hasarı seçilen varyasyonları üreten. Hem korteks hem de striatumu etkileyen orijinal MCAO'nun aksine, lazer tekniği beyin hasarının etkisini düzenlemeyi başardı ve sadece amaçlanan motor korteksüzerinde yaralanmaya neden oldu. Burada, lazer kaynaklı beyin hasarı protokolü ve sıçanların serebral korteks üzerinde yapılan işlem için temsili sonuçların bir özeti sağlanır.
Protokol
Aşağıdaki prosedür Avrupa Topluluğu'nun Deneysel Hayvanların Kullanımı Yönergeleri'ne göre yürütülmüştür. Deneyler, Negev'deki Ben-Gurion Üniversitesi Hayvan Bakım Komitesi tarafından da onaylandı.
1. Hayvan seçimi ve hazırlanması
- Bu işlem için hiçbir overt patoloji ile 300 ila 350 g ağırlığında 65 erkek Sprague-Dawley sıçan seçin. Küçük boyutu MCAO prosedürü için teknik zorluklar teşkil.
- Kafes başına 3 sıçan atayın ve en az 3 gün uyum sağlar.
2. MCAO prosedürü
- MCAO için 25 sıçan seçin ve prosedür11ile ilişkili %10-20 mortaliteye izin verin.
- McAO'yı standart bir teknik kullanarak gerçekleştirin, daha önce ayrıntılı olarak açıklandığı gibi12.
3. Lazer kaynaklı beyin hasarı deneysel prosedür
- Lazer grubu olarak işaretlenmiş bir gruba 20, başka bir kontrol grubuna (sahte işletilen) 20 fare atayın.
- Lazer grubu sıçanları 50J X 10 noktada lazer ışınlama ile aşağıdaki şekilde takın:
- Spontan havalandırma için izin oksijen% 2 izofluran karışımı ile anestezi sıçan. Çekilme refleksinin yokluğunu görmek için kuyruğu forsepslerle sıkıştırarak yeterli anestezi derinliği olup olmadığını kontrol edin.
- Rektal sıcaklık teredirısıtma yastığı kullanarak deneysel prosedür boyunca farenin temel vücut sıcaklığını 37 °C'de koruyun.
- Bir tıraş makinesi ile yerel saç çıkarın ve% 70 alkol ve% 0.5 klorheksidin glukonat ile dezenfekte. Dezenfeksiyon adımını iki kez daha tekrarlayın.
NOT: Cerrahi kesi büyüklüğü yaklaşık 3 cm olmalıdır. Kesi bölgesi etrafında en az 2 cm saç çıkarın. - Sıçanı stereotaksik bir baş tutucuya yatkın bir pozisyonda yerleştirin ve kafa derisini yanal olarak yansıtmak ve Bregma ile Lambda arasındaki alanı ortaya çıkarmak için 3 cm'lik bir kesi yapın.
- Burun konisi ile anestezi yi koruyun.
- 50J X 10 noktalarıyönetmek için Neodimyum-YAG (Nd-YAG) lazer (Nd-YAG) lazer (pik dalga boyu 1064 nm) kullanın, 1 s darbe süresi ile, sağ yarımküreüzerinde kafatasının maruz kalan alana.
- Lazer ışını üretmek için cihazın lazer üreten kısmının maruz kalan bölgeden 2 mm uzaklıkta olduğundan emin olun. Farklı enerji/yüzey kombinasyonlarının dikkatli bir şekilde değerlendirilmesi nden sonra 50J X 10 puan seçilmiştir. Bu kombinasyon verimlidir ve ikincibir 10'dandaha az bir süre için uygulamadan sonra kafatasıkemik yıkımına neden olmaz.
NOT: 2 mm lazer ışınının terminali (geçtiği optik kablodan) ile kafatası kemiği arasındaki mesafedir. Bir odaklama lens kullanılması durumunda, mesafe, merceğin istenilen hasar alanına odaklama eğim açısı dikkate alınarak hesaplanmalıdır. Uygun eğitim ve göz koruması da dahil olmak üzere bir lazer cihazı kullanırken uygun güvenliği sağlayın. - Cihazdan sıçan çıkarın ve 3-0 ipek cerrahi dikiş ile kafa derisi kapatın.
- Anesteziyi durdurun ve tedavi için fareyi kafesine geri getirin. Ameliyat sonrası ağrıyı hemen azaltmak için lokal olarak 0.1 mL 0.1 mL bupivacaine uygulayın.
NOT: Doğru yapılırsa işlemin tamamı 5 dakikadan az sürmelidir.
- Anestezi sonrası iyileşme sırasında herhangi bir sıkıntı belirtisi için sıçanı gözlemleyin. Anesteziortaya çıkmadan önce, postoperatif analjezi için 0.01mg/kg intramüsküler buprenorfin verin ve en az 48 saat boyunca her 12 saatte bir tekrarlanan dozlarla devam edin.
- Lazere maruz kalmadan kontrol fareleri aynı koşullara tabi türün.
4. Nörolojik şiddet skoru (NSS)
- Lazer kaynaklı beyin hasarından sonra nörolojik şiddet skoru 24 saat 43 puan13kullanarak değerlendirin. Daha önce ayrıntılıolarak 13,nörolojik açıkları, davranış bozuklukları, ışın dengeleme görevi ve refleksleri için hayvanlar test edin.
5. Yaralanma sonrası manipülasyonlar
- NSS değerlendirmesinden sonra sıçanları %20 oksijen ve %80 CO2'ye (ilham yoluyla) maruz bırakarak ötenazi sağlar ve sıçanı heparinize fosfat tamponlu salin (PBS, %0.9 NaCl) ile transkarnial olarak perfekte eder.
NOT: CO2'nin Kurumsal Hayvan Bakım ve Kullanım Komitesi yönergelerine uygun olarak önceden belirlenmiş bir oranda teslim edilmesini sağlamak. Bu adım %5 isofluran anestezi altında da yapılabilir. - Hasat beyinleri ve daha önceki bir protokol11açıklandığı gibi ileri inceleme için hazırlamak .
- Subaraknoid kanama (SAH) kafatasından izolasyon sonra tüm beynin görsel inceleme ile değerlendirin. Gerekirse bu amaçla mikroskop veya büyüteç kullanılabilir.
6. Beyin hasarının değerlendirilmesi
-
TTC boyama ile beyin enfarkt hacmi nin ve beyin ödeminin belirlenmesi
NOT: 2,3,5-Triphenyltetrazolium klorür (TTC) boyama beyin enfarktüs algılama için uygun bir işlemdir11.- Her biri 2 mm kalınlığında 6 koronal dilime bürünen beyinleri kesin.
- Her beyinden 30 dk 37 °C'de %0,05 TTC'de dilim ler yerleştirin.
- Boyama sonrasında, 1600 X 1600 dpiçözünürlüğe sahip bir optik tarayıcı ile dilimleri tarayın.
- Sabit beyin dilimlerinin lekesiz alanları enfarktlı12olarak tanımlanır.
- Bir görüntü işleme yazılımı kullanarak (örneğin, freeware Image J)6 koronal dilimin her biri için lekesiz enfarktüs alanı, ipsi- ve kontralateral hemisferleri ölçer.
- Toplam beynin yüzdesi olarak enfarkt edilen hacmi hesaplayın:
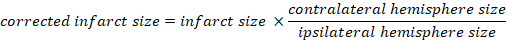
- Kaplan yöntemi ile beyin ödemi hesaplamak:
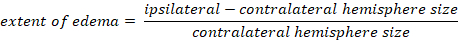
-
Kan beyin bariyerinin (BBB) kırılma sının boyutunun belirlenmesi
NOT: Lazer kaynaklı beyin hasarından sonra BBB kırılmasını 24 saat olarak değerlendirin:- %2 Evans Blue ile birlikte 4 mL/kg tuzlu çözeltiyi intravenöz olarak farelere kanüle edilmiş kuyruk damarı ile uygulayın ve çözeltinin 1 saat boyunca dolaşmasını bekleyin.
- Daha önce13açıklandığı gibi, son NSS 24 saat sonra% 20 oksijen ve% 80 CO2 (ilham yoluyla) onları maruz bırakarak sıçanlar ötanazi .
- İntravasküler lokalize boyayı aşağıdaki gibi hasat edin:
- Cerrahi pincettes ve cerrahi makas ile sıçanların göğüslerini açın.
- Sağ atriyumdan renksiz perfüzyon sıvısı elde edene kadar 110 mmHg kullanarak sol ventrikül ile soğutulmuş % 0.9 tuzlu hayvanlarperfit.
- Hasat beyinve 2 mm dilimler halinde rostrocaudally dilimleyin.
- Yaralı ve yaralanmamış hemisferleri ayrı ayrı değerlendirmek için sol beyin dilimlerini sağ kısımlardan ayırın.
- Tartın, harç ve havaneli kullanarak homojenize, ve sonra 24 saat için% 50 trikloroasetik asit beyin dokuları kuluçka.
- 20 dakika için 10.000 × g homojenize beyin dilimleri santrifüj.
- 1:3'te 1.5 mL etanol ile santrifüjlü beyinden süpernatantın 1 mL'sini karıştırın ve 620 nm uyarma dalga boyunda (10 nm bant genişliği) ve 680 nm emisyon dalga boyunda (10 nm bant genişliği) bir floresan dedektörü kullanarak kan-beyin bariyerinin kırılmasını değerlendirin.
NOT: Her iki sıçan grubu da BBB arızasını belirlemek için aynı protokolden geçer.
Sonuçlar
Kontrol veya deney gruplarında ölüm veya SAH kaydı bulunmamaktadır(Tablo 1). MCAO grubunda hem mortalite hem de SAH oranı %20 idi.
Her iki grubun sıçanlarında göreceli vücut ısısı değişiklikleri de benzerdi, her iki grubun değişkenlik farkı rağmen(Tablo 1).
Hem lazer (16 ± 1.1) hem de MCAO (20 ± 1.5) modellerinde, sham-operated kontrol grubuna göre anlamlı olarak daha kötü NSS vardı (1 ± 0.3; Tabl...
Tartışmalar
Lazer grubunda ölüm veya SAH olmadığı göz önüne alındığında, lazer tekniğinin minimal invaziv olduğunu varsaymak yanlış olmaz. Ölüm ve SAH birincil nedeni intrakranial basınç (ICP) bir yükseklik yol açan kan damarlarının hasarı, orijinal MCAO teknikleri gösterildiği gibi10. Lazer grubunda ölüm ve SAH yokluğu lazerlerin özel etkileri nedeniyle muhtemeldir: onlar kan damarları üzerinde doğrudan etkisi yoktur ve sızıntı durumunda pıhtılaşma neden olabilir. Dü?...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Soroka Üniversitesi Tıp Merkezi Anesteziyoloji Bölümü'ne ve Negev Ben-Gurion Üniversitesi laboratuvar personeline bu deneyin performansına yardımcı olan yardımcılarından dolayı teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride | SIGMA - ALDRICH | 298-96-4 | |
| 50% trichloroacetic acid | SIGMA - ALDRICH | 76-03-9 | |
| Brain & Tissue Matrices | SIGMA - ALDRICH | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 1.83604E+11 | |
| Centrifuge Sigma 2-16P | SIGMA - ALDRICH | Sigma 2-16P | |
| Compact Analytical Balances | SIGMA - ALDRICH | HR-AZ/HR-A | |
| Digital Weighing Scale | SIGMA - ALDRICH | Rs 4,000 | |
| Dissecting scissors | SIGMA - ALDRICH | Z265969 | |
| Eppendorf pipette | SIGMA - ALDRICH | Z683884 | |
| Eppendorf Tube | SIGMA - ALDRICH | EP0030119460 | |
| Ethanol 96 % | ROMICAL | Flammable Liquid | |
| Evans Blue 2% | SIGMA - ALDRICH | 314-13-6 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | model Infinite 200 PRO multimode reader | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Infusion Cuff | ABN | IC-500 | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 | |
| Multiset | TEVA MEDICAL | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Optical scanner | Canon | Cano Scan 4200F | |
| Petri dishes | SIGMA - ALDRICH | P5606 | |
| Scalpel blades 11 | SIGMA - ALDRICH | S2771 | |
| Sharplan 3000 Nd:YAG (neodymium-doped yttrium aluminum garnet) laser machine | Laser Industries Ltd | ||
| Stereotaxic head holder | KOPF | 900LS | |
| Sterile Syringe 2 ml | Braun | 4606027V | |
| Syringe-needle 27 G | Braun | 305620 |
Referanslar
- World Health Organization. Global health estimates: deaths by cause, age, sex and country, 2000-2012. World Health Organization. 9, (2014).
- Meadows, K. L. Experimental models of focal and multifocal cerebral ischemia: a review. Reviews in the Neurosciences. 29, 661-674 (2018).
- Durukan, A., Strbian, D., Tatlisumak, T. Rodent models of ischemic stroke: a useful tool for stroke drug development. Current Pharmaceutical Designs. 14, 359-370 (2008).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Li, F., Omae, T., Fisher, M. Spontaneous hyperthermia and its mechanism in the intraluminal suture middle cerebral artery occlusion model of rats. Stroke. 30, 2464-2470 (1999).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Zhao, Q., Memezawa, H., Smith, M. L., Siesjo, B. K. Hyperthermia complicates middle cerebral artery occlusion induced by an intraluminal filament. Brain Research. 649, 253-259 (1994).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Experimental and Translational Stroke Medicine. 1, 8 (2009).
- Choi, B. I., et al. Neurobehavioural deficits correlate with the cerebral infarction volume of stroke animals: a comparative study on ischaemia-reperfusion and photothrombosis models. Environmental Toxicology and Pharmacology. 33, 60-69 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedure Online. 21, 9 (2019).
- Bleilevens, C., et al. Effect of anesthesia and cerebral blood flow on neuronal injury in a rat middle cerebral artery occlusion (MCAO) model. Experimental Brain Research. 224, 155-164 (2013).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. (147), e58875 (2019).
- Boyko, M., et al. Morphological and neuro-behavioral parallels in the rat model of stroke. Behavioural Brain Research. 223, 17-23 (2011).
Erratum
Formal Correction: Erratum: Laser-Induced Brain Injury in the Motor Cortex of Rats
Posted by JoVE Editors on 2/07/2022. Citeable Link.
An erratum was issued for: Laser-Induced Brain Injury in the Motor Cortex of Rats. The Authors section was updated.
One of the author names was updated from:
Dmitri Frank
to
Dmitry Frank
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır