Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Lésion cérébrale induite au laser dans le cortex moteur des rats
* Ces auteurs ont contribué à parts égales
Dans cet article
Erratum Notice
Résumé
Le protocole présenté ici montre une technique pour créer un modèle de rongeur de lésions cérébrales. La méthode décrite ici utilise l’irradiation laser et cible le cortex moteur.
Résumé
Une technique courante pour induire l’AVC dans les modèles expérimentaux de rongeurs implique l’occlusion transitoire (souvent désignée comme MCAO-t) ou permanente (désignée comme MCAO-p) de l’artère cérébrale moyenne (MCA) à l’aide d’un cathéter. Cette technique généralement acceptée, cependant, a quelques limites, limitant ainsi son utilisation extensive. L’induction de l’AVC par cette méthode est souvent caractérisée par une grande variabilité dans la localisation et la taille de la zone ischémique, des occurrences périodiques d’hémorragie, et des taux de mortalité élevés. En outre, l’achèvement réussi de l’une des procédures transitoires ou permanentes nécessite une expertise et dure souvent environ 30 minutes. Dans ce protocole, une technique d’irradiation laser est présentée qui peut servir de méthode alternative pour induire et étudier les lésions cérébrales dans les modèles de rongeurs.
Comparé aux rats dans les groupes de commande et de MCAO, les dommages de cerveau par induction de laser ont montré la variabilité réduite dans la température de corps, le volume infarctus, l’oedème de cerveau, l’hémorragie intracrânienne, et la mortalité. En outre, l’utilisation d’une lésion induite par le laser a causé des dommages aux tissus cérébraux seulement dans le cortex moteur contrairement aux expériences MCAO où la destruction du cortex moteur et des tissus striataux est observée.
Les résultats de cette recherche suggèrent que l’irradiation laser pourrait servir comme une technique alternative et efficace pour induire des lésions cérébrales dans le cortex moteur. La méthode raccourcit également le temps d’achèvement de la procédure et ne nécessite pas de gestionnaires experts.
Introduction
À l’échelle mondiale, l’AVC est la deuxième cause de décès et la troisième cause d’invalidité1. L’AVC entraîne également un handicap grave, nécessitant souvent des soins supplémentaires de la part du personnel médical et de leurs proches. Il est donc nécessaire de comprendre les complications associées au trouble et d’améliorer le potentiel de résultats plus positifs.
L’utilisation de modèles animaux est la première étape pour comprendre les maladies. Pour assurer les meilleurs résultats de recherche, un modèle typique comprendrait une technique simple, une abordabilité, une reproductibilité élevée et une variabilité minimale. Les déterminants dans les modèles d’AVC ischémiques incluent le volume d’œdème cérébral, la taille infarctus, l’étendue de la rupture de la barrière hémato-encéphalique (BBB) et l’affaiblissement fonctionnel généralement évalué par le score de gravité neurologique2.
La technique d’induction de course la plus largement utilisée dans les modèles de rongeurs occluse l’artère cérébrale moyenne (MCA) transitoirement ou de façon permanente3. Cette technique produit un modèle de trait semblable à ceux chez l’homme : elle a une penumbra entourant la zone caressée, est très reproductible, et régule la durée de l’ischémie et la reperfusion4. Néanmoins, la méthode MCAO a quelques complications. La technique est sujette à l’hémorragie intracrânienne et des blessures à la rétine ipsilateral avec un dysfonctionnement du cortex visuel et l’hyperthermie commune qui conduisent souvent à des résultats supplémentaires5,6,7. D’autres limitations incluent des variations élevées dans l’avc induit (résultant de l’extension probable de l’ischémie aux régions involontaires, comme la région externe de l’artère carotide), l’occlusion insuffisante du MCA, et la reperfusion prématurée. En outre, les rats de différentes souches et tailles présentent divers volumes infarctus8. En plus de tous les inconvénients mentionnés, le modèle MCAO ne peut pas induire de petits accidents vasculaires cérébraux isolés dans les zones profondes du cerveau, parce qu’il est limité techniquement en termes d’exigence de la taille minimale du navire pour la cathétérisme. Cela rend le besoin d’un modèle alternatif d’autant plus critique. Une autre méthode, la photothrombose, offre une alternative possible aux procédures MCAO, mais n’améliore pas l’efficacité9. Cette technique cible les traits avec la lumière et offre quelques améliorations sur les modèles précédents. Cependant, la photothrombose nécessite une craniotomie invasive qui est associée à des compications secondaires9.
À la lumière des lacunes décrites, le protocole présenté ici fournit une technique laser alternative capable pour induire des lésions cérébrales chez les rongeurs. Le mécanisme d’action de la technique laser est basé sur les effets photothermaux du laser transmis sur les tissus vivants, ce qui conduit à l’absorption des faisceaux lumineux par les tissus du corps et leur conversion en chaleur. Les avantages de l’utilisation d’une technique laser sont sa sécurité et sa facilité de manipulation. La capacité d’un laser à produire de la chaleur pour arrêter le saignement le rend très important en médecine, tandis que sa capacité à amplifier différents faisceaux à un point de rencontre donné assure que les lasers évitent de détruire les tissus sains qui se dresse sur le chemin du point cible10. Le faisceau laser utilisé dans ce protocole peut passer à travers un milieu liquide faible, comme l’os, sans émettre son énergie et / ou causer une destruction. Une fois qu’il atteint un milieu liquide élevé, comme les tissus du cerveau, il utilise son énergie pour détruire les tissus cibles. La technique, par conséquent, ne peut induire des lésions cérébrales que dans la zone appropriée du cerveau.
La technique présentée ici a montré une énorme quantité de capacité à réguler ses niveaux d’irradiation, produisant les variations choisies de lésions cérébrales prévues dès le début. Contrairement au MCAO original qui affecte à la fois le cortex et le striatum, la technique laser a été en mesure de réguler l’impact des lésions cérébrales, induisant des blessures uniquement sur le cortex moteur prévu. Ici, le protocole de lésion cérébrale induite par le laser et un résumé des résultats représentatifs de la procédure effectuée sur le cortex cérébral des rats sont fournis.
Protocole
La procédure suivante a été menée conformément aux lignes directrices sur l’utilisation des animaux expérimentaux de la Communauté européenne. Les expériences ont également été approuvées par le Comité des soins aux animaux de l’Université Ben Gourion du Néguev.
1. Sélection et préparation des animaux
- Sélectionnez 65 rats mâles Sprague-Dawley pesant de 300 à 350 g sans pathologie manifeste pour cette procédure. La plus petite taille pose des difficultés techniques pour la procédure MCAO.
- Assignez 3 rats par cage et laissez-les s’adapter pendant au moins 3 jours.
2. Procédure MCAO
- Sélectionnez 25 rats pour MCAO permettant une mortalité de 10 à 20 % associée à la procédure11.
- Effectuer MCAO en utilisant une technique standard, comme décrit précédemment en détail12.
3. Procédure expérimentale de lésion cérébrale induite par le laser
- Assignez 20 rats à un groupe marqué comme groupe laser et 20 rats à un autre groupe témoin (opéré par imposture).
- Soumettre les rats du groupe laser à l’irradiation laser à 50J X 10 points de la manière suivante:
- Anesthétiser le rat avec un mélange de 2% d’isoflurane dans l’oxygène permettant la ventilation spontanée. Vérifiez suffisamment de profondeur anesthésique en pinçant la queue avec des forceps pour voir l’absence du réflexe de retrait.
- Maintenir la température corporelle du rat à 37 °C tout au long de la procédure expérimentale à l’aide d’un coussin chauffant régulé à la température rectale.
- Retirer les cheveux locaux à l’aide d’un rasoir et les désinfecter avec 70 % d’alcool et 0,5 % de gluconate de chlorhexidine. Répétez l’étape de désinfection deux fois de plus.
REMARQUE : La taille de l’incision chirurgicale doit être d’environ 3 cm. Retirer les cheveux d’au moins 2 cm autour de la zone d’incision. - Placez le rat sur un support de tête stéréotaxique dans une position sujette et faire une incision de 3 cm pour refléter le cuir chevelu de façon postérieure et pour exposer la zone entre Bregma et Lambda.
- Maintenir l’anesthésie par le cône de nez.
- Utilisez le laser Neodymium-YAG (Nd-YAG) (longueur d’onde maximale 1064 nm) pour administrer 50 pointsJ X 10, avec une durée d’impulsion de 1 s, à la zone exposée du crâne au-dessus de l’hémisphère droit.
- Assurez-vous que la partie génératrice laser de l’appareil se trouve à une distance de 2 mm de la zone exposée pour produire un faisceau laser. 50J X 10 points ont été sélectionnés après une évaluation minutieuse des différentes combinaisons énergie/surface. Cette combinaison est efficace et ne provoque pas la destruction osseuse du crâne après l’administration pour moins d’un deuxième10.
REMARQUE : 2 mm est la distance entre le terminal du faisceau laser (du câble optique qu’il traverse) et l’os du crâne. Dans le cas où une lentille de mise au point est utilisée, la distance doit être calculée en tenant compte de l’angle d’inclinaison de la lentille pour concentrer le faisceau dans la zone de dommages souhaitée. Assurer une sécurité adéquate lors de l’utilisation d’un appareil laser, y compris une formation appropriée et une protection oculaire. - Retirer le rat de l’appareil et fermer le cuir chevelu avec 3-0 sutures chirurgicales en soie.
- Interrompre l’anesthésie et retourner le rat dans sa cage pour la récupération. Administrer 0,1 mL de 0,25% bupivacaine localement pour réduire la douleur postopératoire immédiatement après la chirurgie.
REMARQUE : L’ensemble de la procédure doit durer moins de 5 min si elle est effectuée correctement.
- Observez le rat pour tout signe de détresse pendant la récupération post-anesthésie. Avant l’émergence de l’anesthésie, donner 0.01mg/kg buprénorphine intramusculaire pour l’analgésie postopératoire et continuer avec des doses répétées tous les 12 h pour au moins 48 h.
- Soumettre les rats de contrôle aux mêmes conditions sans les soumettre au laser.
4. Score de gravité neurologique (NSS)
- Évaluez le score de gravité neurologique 24 h après la lésion cérébrale induite par le laser à l’aide d’un score de 43 points13. Testez les animaux pour les déficits neurologiques, les perturbations de comportement, la tâche d’équilibrage de faisceau, et les réflexes, attribuant des scores plus élevés pour des incapacités plus graves, comme précédemment détaillé13.
5. Manipulations post-blessures
- Après l’évaluation du NSS, euthanasier les rats en les exposant à 20 % d’oxygène et à 80 % de CO2 (par inspiration) et en perfuse transcardiellement le rat avec de la solution saline tamponnée au phosphate héparinisé (PBS, 0,9 % de NaCl).
REMARQUE : Veiller à ce que le CO2 soit administré à un taux prédéterminé conformément aux lignes directrices du Comité des soins et de l’utilisation des animaux en établissement. Cette étape peut également être effectuée sous l’anesthésie isoflurane de 5%. - Récoltez les cerveaux et préparez-vous à un examen plus approfondi tel que décrit dans un protocoleantérieur 11.
- Évaluer l’hémorragie sous-arachnoïde (SAH) par l’examen visuel du cerveau entier après son isolement du crâne. Si nécessaire, un microscope ou des loupes peuvent être utilisés à cette fin.
6. Évaluation des lésions cérébrales
-
Détermination du volume infarctus du cerveau et de l’œdème cérébral par coloration TTC
NOTE : La coloration de chlorure de chlorure de 2,3,5-Triphenyltetrazium (TTC) est une procédure pratique pour la détection des infarctus du cerveau11.- Section des cerveaux récoltés en 6 tranches coronales, chacune d’épaisseur de 2 mm.
- Incuber l’ensemble de tranches de chaque cerveau pendant 30 min à 37 °C dans 0,05% TTC.
- Après coloration, numérisez les tranches à l’aide d’un scanner optique avec une résolution de 1600 X 1600 dpi.
- Les zones non tachées des tranches de cerveau fixes sont définies comme infroctées12.
- À l’aide d’un logiciel de traitement d’images (p. ex., freeware Image J),mesurez les hémisphères infarctus, ipsi- et contralatéral non tachés pour chacune des 6 tranches coronales.
- Calculer le volume infléqué en pourcentage du cerveau total :
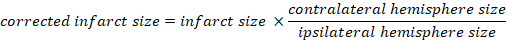
- Calculer l’oedème cérébral à l’aide de la méthode Kaplan :
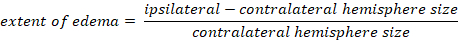
-
Détermination de l’étendue de la rupture de la barrière hémato-encéphalique (BBB)
REMARQUE : Évaluez la rupture de BBB 24 h après la lésion cérébrale induite par le laser comme suit :- Administrer 2% Evans Blue mélangé avec 4 mL/kg solution saline par voie intraveineuse aux rats via la veine de la queue cannulée et permettre à la solution de circuler pendant 1 h.
- Euthanasier les rats en les exposant à 20% d’oxygène et 80% de CO2 (via l’inspiration) 24 h après le dernier NSS, comme décrit précédemment13.
- Récoltez le colorant intravascular localisé comme suit :
- Ouvrez les coffres des rats avec des pincettes chirurgicales et des ciseaux chirurgicaux.
- Perfusez les animaux avec refroidi 0,9% saline via le ventricule gauche en utilisant 110 mmHg jusqu’à obtenir un liquide de perfusion incolore de l’atrium droit.
- Récoltez les cerveaux et coupez-les rostrocaudally en tranches de 2 mm.
- Séparez les tranches du cerveau gauche des parties droites pour évaluer séparément les hémisphères blessés et non blessés.
- Peser, homogénéiser à l’aide de mortier et de pilon, puis incuber les tissus cérébraux dans 50% d’acide trichloroacétique pendant 24 h.
- Centrifuge les tranches de cerveau homogénéisées à 10.000 × g pendant 20 min.
- Mélanger 1 mL du supernatant du cerveau centrifuge avec 1,5 mL d’éthanol à 96% à 1:3 et évaluer la rupture de la barrière hémato-encéphalique à l’aide d’un détecteur de fluorescence à 620 nm de longueur d’onde d’excitation (bande passante de 10 nm) et 680 nm de longueur d’onde d’émission (10 nm de bande passante).
REMARQUE : Les deux groupes de rats subissent le même protocole pour déterminer la dégradation de BBB.
Résultats
Aucun décès ou SAH n’a été enregistré dans les groupes témoins ou expérimentaux (Tableau 1). Le groupe MCAO avait un taux de mortalité de 20 % et de SAH.
Les changements relatifs de température corporelle chez les rats des deux groupes étaient également similaires, malgré une différence dans la variabilité des deux groupes (tableau 1).
Il y avait un NSS significativement pire dans les modèles laser (16 ± 1.1) et MC...
Discussion
Il est juste de supposer que la technique laser est mini-invasive, étant donné qu’aucun décès ou SAH s’est produit dans le groupe laser. La principale cause de décès et de SAH est les dommages aux vaisseaux sanguins qui conduit à une élévation de la pression intracrânienne (ICP), comme le montrent les techniques originales mcao10. L’absence de décès et de SAH dans le groupe laser est probablement due aux effets spécifiques des lasers : ils n’ont pas d’impact direct sur les v...
Déclarations de divulgation
Les auteurs n’ont rien à révéler.
Remerciements
Nous tenons à remercier le Département d’anesthésiologie du Centre Médical de l’Université de Soroka et le personnel de laboratoire de l’Université Ben-Gourion du Néguev pour leur aide dans la performance de cette expérience.
matériels
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride | SIGMA - ALDRICH | 298-96-4 | |
| 50% trichloroacetic acid | SIGMA - ALDRICH | 76-03-9 | |
| Brain & Tissue Matrices | SIGMA - ALDRICH | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 1.83604E+11 | |
| Centrifuge Sigma 2-16P | SIGMA - ALDRICH | Sigma 2-16P | |
| Compact Analytical Balances | SIGMA - ALDRICH | HR-AZ/HR-A | |
| Digital Weighing Scale | SIGMA - ALDRICH | Rs 4,000 | |
| Dissecting scissors | SIGMA - ALDRICH | Z265969 | |
| Eppendorf pipette | SIGMA - ALDRICH | Z683884 | |
| Eppendorf Tube | SIGMA - ALDRICH | EP0030119460 | |
| Ethanol 96 % | ROMICAL | Flammable Liquid | |
| Evans Blue 2% | SIGMA - ALDRICH | 314-13-6 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | model Infinite 200 PRO multimode reader | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Infusion Cuff | ABN | IC-500 | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 | |
| Multiset | TEVA MEDICAL | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Optical scanner | Canon | Cano Scan 4200F | |
| Petri dishes | SIGMA - ALDRICH | P5606 | |
| Scalpel blades 11 | SIGMA - ALDRICH | S2771 | |
| Sharplan 3000 Nd:YAG (neodymium-doped yttrium aluminum garnet) laser machine | Laser Industries Ltd | ||
| Stereotaxic head holder | KOPF | 900LS | |
| Sterile Syringe 2 ml | Braun | 4606027V | |
| Syringe-needle 27 G | Braun | 305620 |
Références
- World Health Organization. Global health estimates: deaths by cause, age, sex and country, 2000-2012. World Health Organization. 9, (2014).
- Meadows, K. L. Experimental models of focal and multifocal cerebral ischemia: a review. Reviews in the Neurosciences. 29, 661-674 (2018).
- Durukan, A., Strbian, D., Tatlisumak, T. Rodent models of ischemic stroke: a useful tool for stroke drug development. Current Pharmaceutical Designs. 14, 359-370 (2008).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Li, F., Omae, T., Fisher, M. Spontaneous hyperthermia and its mechanism in the intraluminal suture middle cerebral artery occlusion model of rats. Stroke. 30, 2464-2470 (1999).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Zhao, Q., Memezawa, H., Smith, M. L., Siesjo, B. K. Hyperthermia complicates middle cerebral artery occlusion induced by an intraluminal filament. Brain Research. 649, 253-259 (1994).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Experimental and Translational Stroke Medicine. 1, 8 (2009).
- Choi, B. I., et al. Neurobehavioural deficits correlate with the cerebral infarction volume of stroke animals: a comparative study on ischaemia-reperfusion and photothrombosis models. Environmental Toxicology and Pharmacology. 33, 60-69 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedure Online. 21, 9 (2019).
- Bleilevens, C., et al. Effect of anesthesia and cerebral blood flow on neuronal injury in a rat middle cerebral artery occlusion (MCAO) model. Experimental Brain Research. 224, 155-164 (2013).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. (147), e58875 (2019).
- Boyko, M., et al. Morphological and neuro-behavioral parallels in the rat model of stroke. Behavioural Brain Research. 223, 17-23 (2011).
Erratum
Formal Correction: Erratum: Laser-Induced Brain Injury in the Motor Cortex of Rats
Posted by JoVE Editors on 2/07/2022. Citeable Link.
An erratum was issued for: Laser-Induced Brain Injury in the Motor Cortex of Rats. The Authors section was updated.
One of the author names was updated from:
Dmitri Frank
to
Dmitry Frank
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon