Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Лазерная травма головного мозга в моторном кортексе крыс
* Эти авторы внесли равный вклад
В этой статье
Erratum Notice
Резюме
Протокол, представленный здесь показывает технику создания модели грызунов черепно-мозговой травмы. Описанный здесь метод использует лазерное облучение и нацелен на моторную кору.
Аннотация
Общий метод индуцирования инсульта в экспериментальных моделях грызунов включает в себя переходный (часто обозначаемый как MCAO-t) или постоянный (обозначенный как MCAO-p) окклюзия средней мозговой артерии (MCA) с помощью катетера. Однако этот общепринятый метод имеет некоторые ограничения, что ограничивает его широкое применение. Индукция инсульта с помощью этого метода часто характеризуется высокой изменчивостью локализации и размера ишемической области, периодическими случаями кровоизлияния и высокими показателями смертности. Кроме того, успешное завершение любой из переходных или постоянных процедур требует опыта и часто длится около 30 минут. В этом протоколе представлена техника лазерного облучения, которая может служить альтернативным методом для индуцирования и изучения черепно-мозговой травмы в моделях грызунов.
По сравнению с крысами в контрольных и MCAO групп, черепно-мозговая травма лазерной индукции показали снижение изменчивости температуры тела, объема инфаркта, отек мозга, внутричерепное кровоизлияние, и смертность. Кроме того, использование лазерной индуцированной травмы вызвало повреждение тканей головного мозга только в моторной коре, в отличие от экспериментов MCAO, где наблюдается разрушение как моторной коры, так и стриатальных тканей.
Результаты этого исследования показывают, что лазерное облучение может служить в качестве альтернативного и эффективного метода для индуцирования черепно-мозговой травмы в моторной коре. Метод также сокращает время завершения процедуры и не требует опытных обработчиков.
Введение
Во всем мире инсульт является второй по величине причиной смерти и третьей по счету причинойинвалидности 1. Инсульт также приводит к тяжелой инвалидности, часто требующей дополнительной помощи со стороны медицинского персонала и родственников. Существует, следовательно, необходимо понять осложнений, связанных с расстройством и улучшить потенциал для более положительных результатов.
Использование моделей животных является первым шагом к пониманию заболеваний. Для обеспечения наилучших результатов исследований типичная модель будет включать простую технику, доступность, высокую воспроизводимость и минимальную изменчивость. Детерминанты в моделях ишемического инсульта включают объем отеков мозга, размер инфаркта, степень распада гемового барьера (BBB) и функциональные нарушения, обычно оцениваемые с помощью неврологического баллатяжести 2.
Наиболее широко используемая методика индукции инсульта в моделях грызунов затмевает среднюю мозговую артерию (MCA) преходяще или постоянно3. Этот метод производит модель инсульта похож на те, в организме человека: он имеет полутени, окружающие погладил области, является весьма воспроизводимой, и регулирует продолжительность ишемии и reperfusion4. Тем не менее, метод MCAO имеет некоторые осложнения. Техника склонна к внутричерепным кровоизлияниям и повреждению ипсилатеральной сетчатки с дисфункцией зрительной коры и общей гипертермией, что часто приводит кдополнительным исходам 5,,6,,7. Другие ограничения включают высокие различия в индуцированном инсульте (в результате вероятного распространения ишемии на непреднамеренные регионы, такие как область внешней сонной артерии), недостаточное окклюзии MCA, и преждевременное реперфузии. Кроме того, крысы различных штаммов и размеров обладают различными инфарктными томами8. В дополнение ко всем упомянутым недостаткам, модель MCAO не может вызвать небольшие изолированные инсульты в глубоких областях мозга, поскольку она технически ограничена с точки зрения требования минимального размера сосуда для катетеризации. Это делает потребность в альтернативной модели еще более критической. Другой метод, фототромбоз, обеспечивает возможную альтернативу процедурам MCAO, но не повышает эффективность9. Этот метод цели инсульта со светом и предлагает некоторые улучшения на предыдущих моделях. Тем не менее, фототромбоз требует инвазивной краниотомии, которая связана со вторичными compications9.
В свете изложенных недостатков представленный здесь протокол предоставляет способную альтернативную лазерную технику для индуцирования черепно-мозговой травмы у грызунов. Механизм действия лазерной техники основан на фототермальных эффектах лазера на живые ткани, что приводит к поглощению световых лучей тканями организма и их превращению в тепло. Преимущества использования лазерной техники являются его безопасность и простота манипуляции. Способность лазера производить тепло, чтобы остановить кровотечение делает его очень важным в медицине, в то время как его способность усиливать различные лучи в данной точке встречи гарантирует, что лазеры избежать уничтожения здоровых тканей, что стоит на пути точкимишени 10. Лазерный луч, используемый в этом протоколе, может проходить через низкую жидкую среду, такую как кость, не излучая ее энергию и/или не вызывая никаких разрушений. Как только он достигает высокой жидкой среды, такой как ткани мозга, он использует свою энергию, чтобы уничтожить ткани-мишени. Техника, таким образом, может вызвать черепно-мозговую травму только в соответствующей области мозга.
Техника, представленная здесь, показала огромную способность регулировать свои уровни облучения, производя выбранные вариации черепно-мозговой травмы, предназначенные с самого начала. В отличие от оригинального MCAO, который влияет как коры и стриатума, лазерная техника была в состоянии регулировать воздействие черепно-мозговой травмы, вызывая травмы только на предполагаемой моторной коры. В этом случае предусмотрен протокол о лазерной черепно-мозговой травме и резюме репрезентативных результатов процедуры, выполняемой на коре головного мозга крыс.
протокол
Следующая процедура была проведена в соответствии с Руководящими принципами использования экспериментальных животных Европейского сообщества. Эксперименты были также одобрены Комитетом по уходу за животными в Университете Бен-Гуриона в Негеве.
1. Отбор и подготовка животных
- Выберите 65 самцов крыс Sprague-Dawley весом от 300 до 350 г без какой-либо явной патологии для этой процедуры. Меньший размер создает технические трудности для процедуры MCAO.
- Назначьте 3 крысы на клетку и дайте им адаптироваться в течение по крайней мере 3 дней.
2. Процедура MCAO
- Выберите 25 крыс для MCAO позволяет 10-20% смертности, связанные с процедурой11.
- Выполните MCAO с использованием стандартной техники, как описано ранее подробно12.
3. Лазерная индуцированная экспериментальная процедура черепно-мозговой травмы
- Назначьте 20 крыс группе, отмеченной как лазерная группа, и 20 крыс другой контрольной группе (фиктивной).
- Подвергайте крыс лазерной группы лазерному облучению на 50J X 10 точках следующим образом:
- Анестезия крысы со смесью 2% изофлюран в кислороде, что позволяет спонтанной вентиляции легких. Проверьте достаточную анестетичную глубину, ущипнув хвост щипами, чтобы увидеть отсутствие рефлекса вывода.
- Поддерживайте температуру тела крысы на уровне 37 градусов по Цельсию на протяжении всей экспериментальной процедуры с помощью регулируемой ректальной температуры нагревательной панели.
- Удалить местные волосы с бритвой и дезинфицировать с 70% алкоголя и 0,5% хлоргексидина глюконата. Повторите дезинфицирующее средство еще два раза.
ПРИМЕЧАНИЕ: Размер хирургического разреза должен быть примерно 3 см. Удалите волосы не менее 2 см вокруг области разреза. - Поместите крысу на стереотаксис держатель головы в склонном положении и сделать 3 см разрез, чтобы отразить кожу головы боковой и подвергать области между Брегма и Lambda.
- Поддерживайте анестезию через носовой конус.
- Используйте лазер Neodymium-YAG (Nd-YAG) (пик длины волны 1064 нм) для управления 50J X 10 pointsточек, с 1 с продолжительностью импульса, к открытой области черепа над правым полушарием.
- Убедитесь, что лазерная генерирующая часть аппарата находится на расстоянии 2 мм от открытой области для производства лазерного луча. 50J X 10 точек было выбрано после тщательной оценки различных комбинаций энергии/поверхности. Эта комбинация эффективна и не вызывает разрушение костей черепа после введения менее чем за секунду10.
ПРИМЕЧАНИЕ: 2 мм - это расстояние между терминалом лазерного луча (от оптического кабеля, через который он проходит) и черепной костью. В случае использования фокусировки объектива расстояние должно быть рассчитано с учетом угла наклона объектива для фокусировки луча в нужной области повреждения. Обеспечить надлежащую безопасность при использовании лазерного устройства, включая соответствующую подготовку и защиту глаз. - Снимите крысу с устройства и закройте кожу головы 3-0 шелковыми хирургическими швами.
- Прекратите анестезию и верните крысу в клетку для выздоровления. Администрирование 0,1 мл 0,25% bupivacaine локально, чтобы уменьшить послеоперационную боль сразу после операции.
ПРИМЕЧАНИЕ: Вся процедура должна длиться менее 5 минут, если выполняется правильно.
- Наблюдайте крысу для любых знаков дистресса во время восстановления столб-анестезии. До появления анестезии, дать 0.01mg/kg внутримышечного бупренорфина для послеоперационной анальгезии и продолжать с повторными дозами каждые 12 ч, по крайней мере 48 ч.
- Субъект управления крыс в тех же условиях, не подвергая их лазеру.
4. Неврологический балл тяжести (NSS)
- Оцените неврологическую тяжесть оценка 24 ч после лазерной индуцированной черепно-мозговой травмы с помощью 43-очковыйбалл 13. Проверьте животных на неврологические дефициты, нарушения поведения, луч балансировки задачи, и рефлексы, назначая более высокие баллы для более тяжелой инвалидности, как ранее подробно13.
5. Манипуляции после травмы
- После оценки NSS, усыплять крыс, подвергая их 20% кислорода и 80% CO2 (через вдохновение) и транскардиально perfuse крысы с гепаринизированным фосфат-буферизированным солевым раствором (PBS, 0.9% NaCl).
ПРИМЕЧАНИЕ: Убедитесь, что CO2 поставляется с заданной скоростью в соответствии с руководящими принципами Комитета по уходу и использованию животных. Этот шаг также может быть выполнен под 5% изофлюран анестезии. - Урожай мозгов и подготовиться к дальнейшему изучению, как описано в предыдущемпротоколе 11.
- Оцените субарахноидальное кровоизлияние (САХ) путем визуального обследования всего мозга после его изоляции от черепа. При необходимости для этого можно использовать микроскоп или увеличительные очки.
6. Оценка черепно-мозговой травмы
-
Определение объема инфаркта мозга и отек мозга путем окрашивания ТТК
ПРИМЕЧАНИЕ: 2,3,5-Triphenyltetrazolium хлорид (TTC) окрашивание является удобной процедурой для обнаружения инфарктамозга 11.- Раздел собранных мозгов на 6 корональных ломтиков, каждый толщиной 2 мм.
- Инкубировать набор ломтиков из каждого мозга в течение 30 мин при 37 градусов по Цельсию в 0,05% TTC.
- После окрашивания сканируйте ломтики с помощью оптического сканера с разрешением 1600 X 1600 dpi.
- Необленые области фиксированных ломтиков мозга определяются как infarcted12.
- С помощью программного обеспечения для обработки изображений (например, freeware Image J)измеряется неописуемая область, ipsi- и контралатеральное полушария для каждого из 6 коронных ломтиков.
- Рассчитайте объем инфаркта в процентах от общего объема мозга:
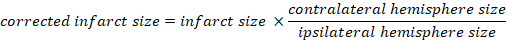
- Рассчитайте отек мозга с помощью метода Каплана:
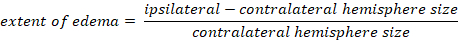
-
Определение степени разрыва гемового геммохатерного барьера (BBB)
ПРИМЕЧАНИЕ: Оцените поломку BBB 24 ч после лазерной индуцированной черепно-мозговой травмы следующим образом:- Администрирование 2% Эванс Синий смешанный с 4 мл / кг солевой раствор внутривенно крыс через канюленые хвостовой вены и позволяют раствору циркулировать в течение 1 ч.
- Euthanize крыс, подвергая их 20% кислорода и 80% CO2 (через вдохновение) 24 ч после последнего NSS, как описаноранее 13.
- Урожай внутрисосудисто локализованного красителя следующим образом:
- Откройте сундуки крыс хирургическими пинцетами и хирургическими ножницами.
- Perfuse животных с охлажденным 0,9% солевого раствора через левый желудочек с помощью 110 мм рт. ст. до получения бесцветной перфузионной жидкости из правого атриума.
- Урожай мозга и нарезать их rostrocaudally на 2 мм ломтиками.
- Отделить левые ломтики мозга от правой части для оценки раненых и не травмированных полушарий отдельно.
- Взвешивать, гомогенизировать с помощью раствора и пестика, а затем инкубировать ткани мозга в 50% трихлороацевой кислоты в течение 24 ч.
- Центрифуга гомогенизированных ломтиков мозга на 10000 и г в течение 20 мин.
- Смешайте 1 мл супернатанта из центрифугированного мозга с 1,5 мл этанола 96% при 1:3 и оцените разрыв гемового барьера с помощью детектора флуоресценции на длине волны возбуждения 620 нм (10 нм пропускной способности) и 680 Нм эмиссионной длины волны (10 нм пропускной способности).
ПРИМЕЧАНИЕ: Обе группы крыс проходят тот же протокол для определения BBB пробоя.
Результаты
Ни в контрольных, ни в экспериментальных группах (таблица1)не было зарегистрировано ни одного случая смерти или SAH. Уровень смертности в группе MCAO составил 20%.
Относительные изменения температуры тела у крыс обеих групп также были похожи, несмотря на разницу в изм...
Обсуждение
Справедливо предположить, что лазерная техника является минимально инвазивной, учитывая, что никаких смертей или SAH не произошло в лазерной группе. Основной причиной смерти и SAH является повреждение кровеносных сосудов, что приводит к повышению внутричерепного давления (ICP), как показа?...
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Благодарим кафедру анестезиологии Медицинского центра Университета Сороки и сотрудников лаборатории Университета Бен-Гуриона в Негеве за помощь в проведении этого эксперимента.
Материалы
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride | SIGMA - ALDRICH | 298-96-4 | |
| 50% trichloroacetic acid | SIGMA - ALDRICH | 76-03-9 | |
| Brain & Tissue Matrices | SIGMA - ALDRICH | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 1.83604E+11 | |
| Centrifuge Sigma 2-16P | SIGMA - ALDRICH | Sigma 2-16P | |
| Compact Analytical Balances | SIGMA - ALDRICH | HR-AZ/HR-A | |
| Digital Weighing Scale | SIGMA - ALDRICH | Rs 4,000 | |
| Dissecting scissors | SIGMA - ALDRICH | Z265969 | |
| Eppendorf pipette | SIGMA - ALDRICH | Z683884 | |
| Eppendorf Tube | SIGMA - ALDRICH | EP0030119460 | |
| Ethanol 96 % | ROMICAL | Flammable Liquid | |
| Evans Blue 2% | SIGMA - ALDRICH | 314-13-6 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | model Infinite 200 PRO multimode reader | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Infusion Cuff | ABN | IC-500 | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 | |
| Multiset | TEVA MEDICAL | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Optical scanner | Canon | Cano Scan 4200F | |
| Petri dishes | SIGMA - ALDRICH | P5606 | |
| Scalpel blades 11 | SIGMA - ALDRICH | S2771 | |
| Sharplan 3000 Nd:YAG (neodymium-doped yttrium aluminum garnet) laser machine | Laser Industries Ltd | ||
| Stereotaxic head holder | KOPF | 900LS | |
| Sterile Syringe 2 ml | Braun | 4606027V | |
| Syringe-needle 27 G | Braun | 305620 |
Ссылки
- World Health Organization. Global health estimates: deaths by cause, age, sex and country, 2000-2012. World Health Organization. 9, (2014).
- Meadows, K. L. Experimental models of focal and multifocal cerebral ischemia: a review. Reviews in the Neurosciences. 29, 661-674 (2018).
- Durukan, A., Strbian, D., Tatlisumak, T. Rodent models of ischemic stroke: a useful tool for stroke drug development. Current Pharmaceutical Designs. 14, 359-370 (2008).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Li, F., Omae, T., Fisher, M. Spontaneous hyperthermia and its mechanism in the intraluminal suture middle cerebral artery occlusion model of rats. Stroke. 30, 2464-2470 (1999).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Zhao, Q., Memezawa, H., Smith, M. L., Siesjo, B. K. Hyperthermia complicates middle cerebral artery occlusion induced by an intraluminal filament. Brain Research. 649, 253-259 (1994).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Experimental and Translational Stroke Medicine. 1, 8 (2009).
- Choi, B. I., et al. Neurobehavioural deficits correlate with the cerebral infarction volume of stroke animals: a comparative study on ischaemia-reperfusion and photothrombosis models. Environmental Toxicology and Pharmacology. 33, 60-69 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedure Online. 21, 9 (2019).
- Bleilevens, C., et al. Effect of anesthesia and cerebral blood flow on neuronal injury in a rat middle cerebral artery occlusion (MCAO) model. Experimental Brain Research. 224, 155-164 (2013).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. (147), e58875 (2019).
- Boyko, M., et al. Morphological and neuro-behavioral parallels in the rat model of stroke. Behavioural Brain Research. 223, 17-23 (2011).
Erratum
Formal Correction: Erratum: Laser-Induced Brain Injury in the Motor Cortex of Rats
Posted by JoVE Editors on 2/07/2022. Citeable Link.
An erratum was issued for: Laser-Induced Brain Injury in the Motor Cortex of Rats. The Authors section was updated.
One of the author names was updated from:
Dmitri Frank
to
Dmitry Frank
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены