É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Lesão cerebral induzida por laser no córtex motor de ratos
* Estes autores contribuíram igualmente
Neste Artigo
Erratum Notice
Resumo
O protocolo aqui apresentado mostra uma técnica para criar um modelo de roedor de lesão cerebral. O método descrito aqui usa irradiação a laser e tem como alvo o córtex motor.
Resumo
Uma técnica comum para induzir derrame em modelos experimentais de roedores envolve o transitório (muitas vezes denotado como MCAO-t) ou permanente (designado como MCAO-p) oclusão da artéria cerebral média (MCA) usando um cateter. Essa técnica geralmente aceita, no entanto, tem algumas limitações, limitando assim seu uso extensivo. A indução de AVC por este método é frequentemente caracterizada por alta variabilidade na localização e tamanho da área isquêmica, ocorrências periódicas de hemorragia e altas taxas de mortalidade. Além disso, a conclusão bem sucedida de qualquer um dos procedimentos transitórios ou permanentes requer perícia e muitas vezes dura cerca de 30 minutos. Neste protocolo, é apresentada uma técnica de irradiação a laser que pode servir como um método alternativo para induzir e estudar lesões cerebrais em modelos de roedores.
Quando comparada com ratos nos grupos de controle e MCAO, a lesão cerebral por indução a laser mostrou variabilidade reduzida na temperatura corporal, volume infarto, edema cerebral, hemorragia intracraniana e mortalidade. Além disso, o uso de uma lesão induzida pelo laser causou danos aos tecidos cerebrais apenas no córtex motor, ao contrário dos experimentos de MCAO, onde a destruição do córtex motor e dos tecidos estriais é observada.
Os achados desta investigação sugerem que a irradiação a laser pode servir como uma técnica alternativa e eficaz para induzir lesões cerebrais no córtex motor. O método também reduz o tempo para concluir o procedimento e não requer manipuladores especializados.
Introdução
Globalmente, o AVC é a segunda principal causa de morte e a terceira principal causa de incapacidade1. O AVC também leva a uma incapacidade grave, muitas vezes exigindo cuidados extras da equipe médica e dos parentes. Há, portanto, a necessidade de compreender as complicações associadas ao transtorno e melhorar o potencial de desfechos mais positivos.
O uso de modelos animais é o passo inicial para a compreensão das doenças. Para garantir os melhores resultados da pesquisa, um modelo típico incluiria uma técnica simples, acessibilidade, alta reprodutibilidade e variabilidade mínima. Os determinantes nos modelos de derrame isquêmico incluem volume de edema cerebral, tamanho do infarto, a extensão da quebra da barreira hematoencefálica (BBB) e comprometimento funcional geralmente avaliado via escore de gravidade neurológica2.
A técnica de indução de derrame mais utilizada em modelos roedores oclui a artéria cerebral média (MCA) transitoriamente oupermanentemente 3. Esta técnica produz um modelo de avc semelhante ao dos humanos: tem uma penumbra em torno da área acariciada, é altamente reprodutível, e regula a duração da isquemia e a reperfusão4. No entanto, o método MCAO tem algumas complicações. A técnica é propensa a hemorragia intracraniana e lesão na retina ipsilateral com disfunção do córtex visual e hipertermia comum que muitas vezes levam a resultados adicionais5,,6,7. Outras limitações incluem altas variações no AVC induzido (decorrentes da provável extensão da isquemia para regiões não intencionais, como a região da artéria carótida externa), oclusão insuficiente do MCA e reperfusão prematura. Além disso, ratos de diferentes cepas e tamanhos exibem vários volumes de infarto8. Além de todas as desvantagens mencionadas, o modelo MCAO não pode induzir pequenos derrames isolados em áreas cerebrais profundas, pois é limitado tecnicamente em termos de sua exigência de tamanho mínimo do vaso para cateterismo. Isso torna a necessidade de um modelo alternativo ainda mais crítica. Outro método, fototrombose, fornece uma possível alternativa aos procedimentos de MCAO, mas não melhora a eficiência9. Esta técnica visa o traçado com luz e oferece algumas melhorias nos modelos anteriores. No entanto, a fototrombose requer uma craniotomia invasiva que esteja associada a compicações secundárias9.
À luz das deficiências descritas, o protocolo aqui apresentado fornece uma técnica de laser alternativa capaz para induzir lesões cerebrais em roedores. O mecanismo de ação da técnica laser é baseado nos efeitos fototérmicos do laser transmitidos em tecidos vivos, o que leva à absorção de feixes de luz por tecidos corporais e sua conversão em calor. As vantagens de usar uma técnica a laser são sua segurança e facilidade de manipulação. A capacidade de um laser de produzir calor para parar o sangramento torna-o muito importante na medicina, enquanto sua capacidade de amplificar diferentes feixes em um determinado ponto de encontro garante que os lasers evitem destruir tecidos saudáveis que estão no caminho do pontoalvo 10. O raio laser usado neste protocolo pode passar por um meio líquido baixo, como o osso, sem emitir sua energia e/ou causar qualquer destruição. Uma vez que atinge um meio líquido elevado, como tecidos cerebrais, ele usa sua energia para destruir os tecidos alvo. A técnica, portanto, pode induzir lesões cerebrais apenas na área apropriada do cérebro.
A técnica aqui apresentada mostrou uma enorme quantidade de capacidade de regular seus níveis de irradiação, produzindo as variações escolhidas de lesão cerebral pretendida desde o início. Ao contrário do MCAO original que impacta tanto o córtex quanto o estriato, a técnica de laser foi capaz de regular o impacto da lesão cerebral, induzindo lesões apenas no córtex motor pretendido. Aqui, o protocolo de lesão cerebral induzido pelo laser e um resumo dos resultados representativos para o procedimento realizado no córtex cerebral dos ratos são fornecidos.
Protocolo
O procedimento a seguir foi realizado de acordo com as Diretrizes do Uso de Animais Experimentais da Comunidade Europeia. Os experimentos também foram aprovados pelo Comitê de Cuidados Com Animais da Universidade Ben-Gurion do Negev.
1. Seleção e preparação animal
- Selecione 65 ratos sprague-dawley machos pesando 300 a 350 g sem patologia arrota para este procedimento. O tamanho menor apresenta dificuldades técnicas para o procedimento de MCAO.
- Atribua 3 ratos por gaiola e deixe-os se adaptar por pelo menos 3 dias.
2. Procedimento de MCAO
- Selecione 25 ratos para MCAO permitindo 10— 20% de mortalidade associada ao procedimento11.
- Realize o MCAO utilizando uma técnica padrão, como descrito anteriormente no detalhe12.
3. Procedimento experimental de lesão cerebral induzida por laser
- Atribua 20 ratos a um grupo marcado como grupo laser e 20 ratos para outro grupo de controle (operado por farsas).
- Submeter os ratos do grupo laser à irradiação a laser a 50J X 10 pontos da seguinte maneira:
- Anesthetize rato com uma mistura de 2% de isoflurane em oxigênio permitindo a ventilação espontânea. Verifique se há profundidade anestésico suficiente beliscando a cauda com fórceps para ver a ausência do reflexo de retirada.
- Mantenha a temperatura corporal do núcleo do rato a 37 °C durante todo o procedimento experimental usando uma almofada de aquecimento regulada pela temperatura retal.
- Remova o cabelo local com uma máquina de barbear e desinfete com 70% de álcool e 0,5% de cloroexidina gluconato. Repita o passo de desinfecção mais duas vezes.
NOTA: O tamanho da incisão cirúrgica deve ser de aproximadamente 3 cm. Remova o cabelo pelo menos 2 cm ao redor da área de incisão. - Coloque o rato sobre um suporte de cabeça estereotaxic em uma posição propensa e faça uma incisão de 3 cm para refletir o couro cabeludo lateralmente e expor a área entre Bregma e Lambda.
- Mantenha a anestesia através do cone do nariz.
- Use laser Neodímio-YAG (Nd-YAG) (comprimento de onda de pico 1064 nm) para administrar 50J X 10 pontos,com 1 s de duração de pulso, à área exposta do crânio acima do hemisfério direito.
- Certifique-se de que a parte geradora de laser do aparelho esteja a uma distância de 2 mm da área exposta para produzir um raio laser. 50pontos J X 10 foram selecionados após avaliação cuidadosa de diferentes combinações de energia/superfície. Esta combinação é eficiente e não causa destruição óssea do crânio após a administração por menos de um segundo10.
NOTA: 2 mm é a distância entre o terminal do raio laser (a partir do cabo óptico pelo seu passar) e o osso do crânio. Caso seja usada uma lente focalizada, a distância deve ser calculada levando-se em conta o ângulo de inclinação da lente para focar o feixe na área desejada de dano. Certifique-se de segurança adequada ao usar um dispositivo laser, incluindo treinamento adequado e proteção ocular. - Retire o rato do dispositivo e feche o couro cabeludo com suturas cirúrgicas de seda 3-0.
- Descontinuar a anestesia e devolver o rato à sua gaiola para recuperação. Administre 0,1 mL de bupivacaína localmente para reduzir a dor pós-operatória imediatamente após a cirurgia.
NOTA: Todo o procedimento deve durar menos de 5 min se realizado corretamente.
- Observe o rato para qualquer sinal de aflição durante a recuperação pós-anestesia. Antes do surgimento da anestesia, dê buprenorfina intramuscular de 0,01mg/kg para analgesia pós-operatória e continue com doses repetidas a cada 12 h por pelo menos 48 h.
- Subsuem os ratos às mesmas condições sem subesá-los ao laser.
4. Escore de gravidade neurológica (NSS)
- Avalie o escore de gravidade neurológica 24 h após a lesão cerebral induzida pelo laser usando uma pontuação de 43 pontos13. Teste os animais para déficits neurológicos, distúrbios de comportamento, tarefa de balanceamento de feixes e reflexos, atribuindo pontuações mais altas para deficiências mais graves, conforme detalhado anteriormente13.
5. Manipulações pós-lesões
- Após a avaliação do NSS, eutanize os ratos expondo-os a 20% de oxigênio e 80% de CO2 (via inspiração) e transcardialmente perfundear o rato com soro fisco tamponado heparinizado (PBS, 0,9% NaCl).
NOTA: Certifique-se de que o CO2 seja entregue a uma taxa predeterminada de acordo com as diretrizes do Comitê Institucional de Cuidados e Uso de Animais. Esta etapa também pode ser realizada abaixo de 5% de anestesia isoflurane. - Colher cérebros e preparar-se para um exame mais aprofundado, conforme descrito em um protocolo anterior11.
- Avalie a hemorragia subaracnóide (SAH) através de exame visual de todo o cérebro após seu isolamento do crânio. Se necessário, um microscópio ou óculos de ampliação podem ser usados para este fim.
6. Avaliação da lesão cerebral
-
Determinando o volume de infarto cerebral e edema cerebral por manchas de TTC
NOTA: 2,3,5-Trihenyltetrazolium cloreto (TTC) é um procedimento conveniente para detecção de infarto cerebral11.- Selado os cérebros colhidos em 6 fatias coronais, cada uma com 2 mm de espessura.
- Incubar o conjunto de fatias de cada cérebro por 30 min a 37 °C em 0,05% TTC.
- Após a coloração, escaneie as fatias com um scanner óptico com uma resolução de 1600 X 1600 dpi.
- As áreas não manchadas das fatias cerebrais fixas são definidas como infartas12.
- Usando um software de processamento de imagem (por exemplo, freeware Image J) mede a área infarto não localizada, os hemisférios ipsi e contralateral para cada uma das 6 fatias coronais.
- Calcule o volume infartado como uma porcentagem do cérebro total:
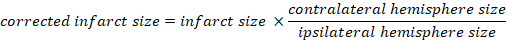
- Calcule o edema cerebral usando o método Kaplan:
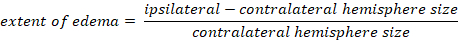
-
Determinando a extensão da quebra da barreira cerebral sanguínea (BBB)
NOTA: Avalie a quebra do BBB 24 h após a lesão cerebral induzida pelo laser da seguinte forma:- Administre 2% de Evans Blue misturado com solução salina de 4 mL/kg por via intravenosa aos ratos através da veia da cauda cristalina e permita que a solução circule por 1h.
- Eutanize os ratos expondo-os a 20% de oxigênio e 80% de CO2 (via inspiração) 24 h após o último NSS, como descrito anteriormente13.
- Colher o corante localizado intravascularmente da seguinte forma:
- Abra os peitos dos ratos com pincettes cirúrgicas e tesouras cirúrgicas.
- Perfuuse os animais com soro fisiológico de 0,9% refrigerado através do ventrículo esquerdo usando 110 mmHg até obter um líquido de perfusão incolor do átrio direito.
- Colhe os cérebros e corte-os rostrocaudally em fatias de 2 mm.
- Separe as fatias cerebrais esquerdas das porções direitas para avaliar os hemisférios feridos e não feridos separadamente.
- Pesar, homogeneizar usando argamassa e pilão, e depois incubar os tecidos cerebrais em ácido tricloroacético de 50% por 24 h.
- Centrifugar as fatias cerebrais homogeneizadas a 10.000 × g por 20 min.
- Misture 1 mL do supernacido do cérebro centrifugado com 1,5 mL de 96% de etanol em 1:3 e avalie a quebra da barreira hematoencefálica usando um detector de fluorescência a 620 nm comprimento de onda de excitação (largura de banda de 10 nm) e 680 nm de comprimento de onda de emissão (largura de banda de 10 nm).
NOTA: Ambos os grupos de ratos passam pelo mesmo protocolo para determinar o colapso do BBB.
Resultados
Não foram registradas mortes ou HAS nos grupos de controle ou experimental(Tabela 1). O grupo MCAO apresentou uma taxa de 20% de mortalidade e HAS.
As variações relativas da temperatura corporal nos ratos de ambos os grupos também foram semelhantes, apesar da diferença na variabilidade de ambos os grupos(Tabela 1).
Houve um NSS significativamente pior nos modelos laser (16 ± 1,1) e MCAO (20 ± 1,5), em comparação com o grupo...
Discussão
É justo supor que a técnica de laser é minimamente invasiva, dado que não ocorreu mortes ou HAS no grupo laser. A causa primária da morte e a HAS é o dano aos vasos sanguíneos que leva a uma elevação da pressão intracraniana (ICP), como mostrado nas técnicas originais de MCAO10. A ausência de morte e HAS no grupo laser é provavelmente devido aos efeitos específicos dos lasers: eles não têm impacto direto nos vasos sanguíneos e podem induzir coagulação em caso de vazamento. O bai...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Gostaríamos de agradecer ao Departamento de Anestesiologia do Centro Médico da Universidade de Soroka e à equipe de laboratório da Universidade Ben-Gurion do Negev por sua ajuda no desempenho deste experimento.
Materiais
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride | SIGMA - ALDRICH | 298-96-4 | |
| 50% trichloroacetic acid | SIGMA - ALDRICH | 76-03-9 | |
| Brain & Tissue Matrices | SIGMA - ALDRICH | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 1.83604E+11 | |
| Centrifuge Sigma 2-16P | SIGMA - ALDRICH | Sigma 2-16P | |
| Compact Analytical Balances | SIGMA - ALDRICH | HR-AZ/HR-A | |
| Digital Weighing Scale | SIGMA - ALDRICH | Rs 4,000 | |
| Dissecting scissors | SIGMA - ALDRICH | Z265969 | |
| Eppendorf pipette | SIGMA - ALDRICH | Z683884 | |
| Eppendorf Tube | SIGMA - ALDRICH | EP0030119460 | |
| Ethanol 96 % | ROMICAL | Flammable Liquid | |
| Evans Blue 2% | SIGMA - ALDRICH | 314-13-6 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | model Infinite 200 PRO multimode reader | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Infusion Cuff | ABN | IC-500 | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 | |
| Multiset | TEVA MEDICAL | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Optical scanner | Canon | Cano Scan 4200F | |
| Petri dishes | SIGMA - ALDRICH | P5606 | |
| Scalpel blades 11 | SIGMA - ALDRICH | S2771 | |
| Sharplan 3000 Nd:YAG (neodymium-doped yttrium aluminum garnet) laser machine | Laser Industries Ltd | ||
| Stereotaxic head holder | KOPF | 900LS | |
| Sterile Syringe 2 ml | Braun | 4606027V | |
| Syringe-needle 27 G | Braun | 305620 |
Referências
- World Health Organization. Global health estimates: deaths by cause, age, sex and country, 2000-2012. World Health Organization. 9, (2014).
- Meadows, K. L. Experimental models of focal and multifocal cerebral ischemia: a review. Reviews in the Neurosciences. 29, 661-674 (2018).
- Durukan, A., Strbian, D., Tatlisumak, T. Rodent models of ischemic stroke: a useful tool for stroke drug development. Current Pharmaceutical Designs. 14, 359-370 (2008).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Li, F., Omae, T., Fisher, M. Spontaneous hyperthermia and its mechanism in the intraluminal suture middle cerebral artery occlusion model of rats. Stroke. 30, 2464-2470 (1999).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Zhao, Q., Memezawa, H., Smith, M. L., Siesjo, B. K. Hyperthermia complicates middle cerebral artery occlusion induced by an intraluminal filament. Brain Research. 649, 253-259 (1994).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Experimental and Translational Stroke Medicine. 1, 8 (2009).
- Choi, B. I., et al. Neurobehavioural deficits correlate with the cerebral infarction volume of stroke animals: a comparative study on ischaemia-reperfusion and photothrombosis models. Environmental Toxicology and Pharmacology. 33, 60-69 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedure Online. 21, 9 (2019).
- Bleilevens, C., et al. Effect of anesthesia and cerebral blood flow on neuronal injury in a rat middle cerebral artery occlusion (MCAO) model. Experimental Brain Research. 224, 155-164 (2013).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. (147), e58875 (2019).
- Boyko, M., et al. Morphological and neuro-behavioral parallels in the rat model of stroke. Behavioural Brain Research. 223, 17-23 (2011).
Erratum
Formal Correction: Erratum: Laser-Induced Brain Injury in the Motor Cortex of Rats
Posted by JoVE Editors on 2/07/2022. Citeable Link.
An erratum was issued for: Laser-Induced Brain Injury in the Motor Cortex of Rats. The Authors section was updated.
One of the author names was updated from:
Dmitri Frank
to
Dmitry Frank
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados