Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Lesión cerebral inducida por láser en la corteza motora de ratas
* Estos autores han contribuido por igual
En este artículo
Erratum Notice
Resumen
El protocolo presentado aquí muestra una técnica para crear un modelo de roedor de lesión cerebral. El método descrito aquí utiliza irradiación láser y apunta a la corteza motora.
Resumen
Una técnica común para inducir accidente cerebrovascular en modelos experimentales de roedores implica la oclusión transitoria (a menudo denotada como MCAO-t) o permanente (designada como MCAO-p) de la arteria cerebral media (MCA) utilizando un catéter. Esta técnica generalmente aceptada, sin embargo, tiene algunas limitaciones, limitando así su uso extensivo. La inducción del accidente cerebrovascular por este método se caracteriza a menudo por una alta variabilidad en la localización y el tamaño del área isquémica, ocurrencias periódicas de hemorragia y altas tasas de mortalidad. Además, la finalización exitosa de cualquiera de los procedimientos transitorios o permanentes requiere experiencia y a menudo dura unos 30 minutos. En este protocolo, se presenta una técnica de irradiación láser que puede servir como un método alternativo para inducir y estudiar lesiones cerebrales en modelos de roedores.
En comparación con las ratas en los grupos de control y MCAO, la lesión cerebral por inducción láser mostró una menor variabilidad en la temperatura corporal, volumen de infarto, edema cerebral, hemorragia intracraneal y mortalidad. Además, el uso de una lesión inducida por láser causó daño a los tejidos cerebrales sólo en la corteza motora a diferencia de los experimentos MCAO donde se observa la destrucción de la corteza motora y los tejidos estriados.
Los resultados de esta investigación sugieren que la irradiación láser podría servir como una técnica alternativa y eficaz para inducir lesiones cerebrales en la corteza motora. El método también acorta el tiempo para completar el procedimiento y no requiere controladores expertos.
Introducción
A nivel mundial, el accidente cerebrovascular es la segunda causa de muerte y la tercera causa principal de discapacidad1. El accidente cerebrovascular también conduce a una discapacidad grave, a menudo requiere atención adicional del personal médico y sus familiares. Por lo tanto, es necesario comprender las complicaciones asociadas con el trastorno y mejorar el potencial de resultados más positivos.
El uso de modelos animales es el primer paso para entender las enfermedades. Para garantizar los mejores resultados de investigación, un modelo típico incluiría una técnica simple, asequibilidad, alta reproducibilidad y variabilidad mínima. Los determinantes en los modelos de accidente cerebrovascular isquémico incluyen el volumen de edema cerebral, el tamaño del infarto, la extensión de la descomposición de la barrera hematoencefálica (BBB) y el deterioro funcional generalmente evaluado a través de la puntuación de gravedad neurológica2.
La técnica de inducción por accidente cerebrovascular más utilizada en modelos de roedores ocluye la arteria cerebral media (MCA) transitoria o permanentemente3. Esta técnica produce un modelo de trazo similar a los de los seres humanos: tiene una penumbra que rodea el área acariciada, es altamente reproducible, y regula la duración de la isquemia y la reperfusión4. Sin embargo, el método MCAO tiene algunas complicaciones. La técnica es propensa a hemorragia intracraneal y lesiones a la retina ipsilateral con una disfunción de la corteza visual y hipertermia común que a menudo conducen a resultados adicionales5,,6,,7. Otras limitaciones incluyen altas variaciones en el accidente cerebrovascular inducido (que surgen de la extensión probable de la isquemia a regiones no deseadas, como la región externa de la arteria carótida), oclusión insuficiente del MCA y reperfusión prematura. Además, las ratas de diferentes cepas y tamaños exhiben varios volúmenes de infarto8. Además de todas las desventajas mencionadas, el modelo MCAO no puede inducir pequeños accidentes cerebrovasculares aislados en áreas cerebrales profundas, ya que está limitado técnicamente en términos de su requisito de tamaño mínimo del recipiente para el cateterismo. Esto hace que la necesidad de un modelo alternativo sea aún más crítica. Otro método, la fototrombosis, proporciona una posible alternativa a los procedimientos MCAO pero no mejora la eficiencia9. Esta técnica apunta a la carrera con la luz y ofrece algunas mejoras en los modelos anteriores. Sin embargo, la fototrombosis requiere una craneotomía invasiva que se asocia con compicaciones secundarias9.
A la luz de las deficiencias esbozadas, el protocolo presentado aquí proporciona una técnica láser alternativa capaz para inducir lesiones cerebrales en roedores. El mecanismo de acción de la técnica láser se basa en los efectos fototérmicos del láser impartidos en tejidos vivos, lo que conduce a la absorción de haces de luz por los tejidos del cuerpo y su conversión en calor. Las ventajas de utilizar una técnica láser son su seguridad y facilidad de manipulación. La capacidad de un láser para producir calor para detener el sangrado lo hace muy importante en la medicina, mientras que su capacidad para amplificar diferentes haces en un punto de encuentro dado asegura que los láseres evitan destruir los tejidos sanos que se interponen en el camino del punto de destino10. El rayo láser utilizado en este protocolo puede pasar a través de un medio líquido bajo, como el hueso, sin emitir su energía y / o causar ninguna destrucción. Una vez que alcanza un medio líquido alto, como los tejidos cerebrales, consume su energía para destruir los tejidos diana. La técnica, por lo tanto, puede inducir lesiones cerebrales sólo en el área apropiada del cerebro.
La técnica presentada aquí mostró una enorme cantidad de capacidad para regular sus niveles de irradiación, produciendo las variaciones elegidas de lesión cerebral previstas desde el principio. A diferencia del MCAO original que afecta tanto a la corteza como al estriado, la técnica láser fue capaz de regular el impacto de la lesión cerebral, induciendo lesiones sólo en la corteza motora prevista. Aquí, se proporciona el protocolo de lesión cerebral inducida por láser y un resumen de los resultados representativos para el procedimiento realizado en la corteza cerebral de ratas.
Protocolo
El siguiente procedimiento se llevó a cabo de conformidad con las Directrices para el uso de animales experimentales de la Comunidad Europea. Los experimentos también fueron aprobados por el Comité de Cuidado de Animales en la Universidad Ben-Gurion del Negev.
1. Selección y preparación de animales
- Seleccione 65 ratas macho Sprague-Dawley que pesen de 300 a 350 g sin patología general para este procedimiento. El tamaño más pequeño plantea dificultades técnicas para el procedimiento MCAO.
- Asigne 3 ratas por jaula y déjelas adaptarse durante al menos 3 días.
2. Procedimiento MCAO
- Seleccione 25 ratas para MCAO permitiendo una mortalidad del 10—20% asociada con el procedimiento11.
- Realice MCAO utilizando una técnica estándar, como se describió anteriormente en el detalle12.
3. Procedimiento experimental de lesión cerebral inducida por láser
- Asigne 20 ratas a un grupo marcado como grupo láser y 20 ratas a otro grupo de control (operado por sham).
- Somete a las ratas del grupo láser a irradiación láser a 50J X 10 puntos de la siguiente manera:
- Anestesiar rata con una mezcla de 2% de isoflurano en oxígeno permitiendo la ventilación espontánea. Compruebe si hay suficiente profundidad anestésica pellizcando la cola con fórceps para ver la ausencia del reflejo de abstinencia.
- Mantener la temperatura corporal central de la rata a 37 oC durante todo el procedimiento experimental utilizando una almohadilla de calentamiento regulada por temperatura rectal.
- Retire el vello local con una afeitadora y desinfecte con 70% de alcohol y 0,5% de gluconato de clorhexidina. Repita el paso de desinfección dos veces más.
NOTA: El tamaño de la incisión quirúrgica debe ser de aproximadamente 3 cm. Retire el vello de al menos 2 cm alrededor del área de la incisión. - Coloque la rata en un soporte de cabeza estereotaxico en una posición propensa y haga una incisión de 3 cm para reflejar el cuero cabelludo lateralmente y exponer el área entre Bregma y Lambda.
- Mantener la anestesia a través del cono nasal.
- Utilice láser de neodimio-YAG (Nd-YAG) (longitud de onda máxima 1064 nm) para administrar 50J X 10 puntos,con 1 s de duración del pulso, al área expuesta del cráneo por encima del hemisferio derecho.
- Asegúrese de que la parte generadora láser del aparato esté a una distancia de 2 mm del área expuesta para producir un rayo láser. Se seleccionaron 50 puntos J X 10 después de una cuidadosa evaluación de diferentes combinaciones de energía y superficie. Esta combinación es eficiente y no causa destrucción ósea del cráneo después de la administración por menos de un segundo10.
NOTA: 2 mm es la distancia entre el terminal del rayo láser (desde el cable óptico que pasa a través) y el hueso del cráneo. En caso de que se utilice una lente de enfoque, la distancia debe calcularse teniendo en cuenta el ángulo de inclinación de la lente para enfocar el haz en el área de daño deseada. Garantice la seguridad adecuada cuando utilice un dispositivo láser, incluido el entrenamiento adecuado y la protección ocular. - Retire la rata del dispositivo y cierre el cuero cabelludo con suturas quirúrgicas de seda 3-0.
- Suspenda la anestesia y devuelva la rata a su jaula para su recuperación. Administrar 0,1 ml de 0,25% de bupivacaína localmente para reducir el dolor postoperatorio inmediatamente después de la cirugía.
NOTA: Todo el procedimiento debe durar menos de 5 minutos si se realiza correctamente.
- Observe a la rata en busca de signos de angustia durante la recuperación posterior a la anestesia. Antes de la aparición de la anestesia, dar 0.01mg/kg buprenorfina intramuscular para la analgesia postoperatoria y continuar con dosis repetidas cada 12 h durante al menos 48 h.
- Sujeto controlar ratas a las mismas condiciones sin someterlas al láser.
4. Puntuación de gravedad neurológica (SEN)
- Evaluar la puntuación de gravedad neurológica 24 h después de la lesión cerebral inducida por láser utilizando una puntuación de 43 puntos13. Pruebe a los animales en busca de déficits neurológicos, alteraciones del comportamiento, tarea de equilibrio de haces y reflejos, asignando puntuaciones más altas para discapacidades más graves, como se detallaba anteriormente13.
5. Manipulaciones posteriores a la lesión
- Después de la evaluación del SEN, eutanasia a las ratas exponiéndolas a un 20% de oxígeno y un 80% de CO2 (a través de la inspiración) y perfume la rata transcardiamente con solución salina con fosfato heparinizado (PBS, 0,9% NaCl).
NOTA: Asegúrese de que el CO2 se entregue a una tarifa predeterminada de acuerdo con las directrices del Comité Institucional de Cuidado y Uso de Animales. Este paso también se puede realizar bajo 5% de anestesia isoflurano. - Cosecha el cerebro y prepárate para un examen posterior como se describe en un protocolo anterior11.
- Evaluar la hemorragia subaracnoidea (SAH) a través del examen visual de todo el cerebro después de su aislamiento del cráneo. Si es necesario, se puede utilizar un microscopio o una lupa para este fin.
6. Evaluación de la lesión cerebral
-
Determinar el volumen del infarto cerebral y el edema cerebral mediante tinción TTC
NOTA: 2,3,5-Triphenyltetrazolium cloruro (TTC) tinción es un procedimiento conveniente para la detección de infarto cerebral11.- Secise los cerebros cosechados en 6 rodajas coronales, cada una de 2 mm de espesor.
- Incubar el conjunto de rodajas de cada cerebro durante 30 min a 37oC en 0,05% TTC.
- Después de la tinción, escanee las rodajas con un escáner óptico con una resolución de 1600 X 1600 ppp.
- Las áreas no manchadas de las rebanadas cerebrales fijas se definen como infarto12.
- El uso de un software de procesamiento de imágenes (por ejemplo, freeware Image J) mide el área infarta no mantenida, hemisferios ipsi y contralateral para cada una de las 6 rebanadas coronales.
- Calcular el volumen infarto como un porcentaje del cerebro total:
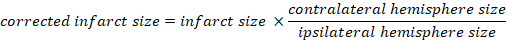
- Calcular edema cerebral usando el método Kaplan:
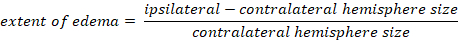
-
Determinar la extensión de la rotura de la barrera hematoencefálica (BBB)
NOTA: Evalúe la rotura del BBB 24 h después de la lesión cerebral inducida por láser de la siguiente manera:- Administrar 2% Evans Blue mezclado con 4 ml/kg de solución salina por vía intravenosa a ratas a través de la vena de cola canulada y permitir que la solución circule durante 1 h.
- Eutanasia las ratas exponiéndolas al 20% de oxígeno y al 80% de CO2 (a través de la inspiración) 24 h después del último SEN, como se describió anteriormente13.
- Cosecha el tinte localizado intravascularmente de la siguiente manera:
- Abra los pechos de las ratas con pincettes quirúrgicas y tijeras quirúrgicas.
- Perfunde a los animales con solución salina enfriada al 0,9% a través del ventrículo izquierdo utilizando 110 mmHg hasta obtener un líquido de perfusión incoloro de la aurícula derecha.
- Cosecha los cerebros y córtales rostrocaudally en rodajas de 2 mm.
- Separe las rebanadas cerebrales izquierdas de las porciones derechas para evaluar los hemisferios lesionados y no lesionados por separado.
- Pesar, homogeneizar con mortero y pestillo, y luego incubar los tejidos cerebrales en 50% ácido tricloroacético durante 24 h.
- Centrifugar las rebanadas cerebrales homogeneizadas a 10.000 g durante 20 min.
- Mezclar 1 ml del sobrenadante del cerebro centrifugado con 1,5 ml de etanol al 96% de etanol a 1:3 y evaluar la rotura de la barrera hematoencefálica utilizando un detector de fluorescencia a 620 nm de longitud de onda de excitación (10 nm de ancho de banda) y 680 nm de longitud de onda de emisión (10 nm de ancho de banda).
NOTA: Ambos grupos de ratas se someten al mismo protocolo para determinar la avería de BBB.
Resultados
No se registraron muertes ni SAH ni en el control ni en los grupos experimentales(Tabla 1). El grupo MCAO tenía una tasa del 20% tanto de mortalidad como de SAH.
Los cambios relativos de la temperatura corporal en las ratas de ambos grupos también fueron similares, a pesar de una diferencia en la variabilidad de ambos grupos (Tabla 1).
Hubo un SEN significativamente peor tanto en los modelos láser (16 x 1,1) como en el MCAO (20 x...
Discusión
Es justo suponer que la técnica láser es mínimamente invasiva, dado que no se produjeron muertes o SAH en el grupo láser. La causa principal de la muerte y la SAH es el daño a los vasos sanguíneos que conduce a una elevación de la presión intracraneal (ICP), como se muestra en las técnicas originales de MCAO10. La ausencia de muerte y SAH en el grupo láser es probable debido a los efectos específicos de los láseres: no tienen impacto directo en los vasos sanguíneos y pueden inducir la...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría dar las gracias al Departamento de Anestesiología del Centro Médico de la Universidad de Soroka y al personal de laboratorio de la Universidad Ben-Gurion del Negev por su ayuda en la realización de este experimento.
Materiales
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride | SIGMA - ALDRICH | 298-96-4 | |
| 50% trichloroacetic acid | SIGMA - ALDRICH | 76-03-9 | |
| Brain & Tissue Matrices | SIGMA - ALDRICH | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 1.83604E+11 | |
| Centrifuge Sigma 2-16P | SIGMA - ALDRICH | Sigma 2-16P | |
| Compact Analytical Balances | SIGMA - ALDRICH | HR-AZ/HR-A | |
| Digital Weighing Scale | SIGMA - ALDRICH | Rs 4,000 | |
| Dissecting scissors | SIGMA - ALDRICH | Z265969 | |
| Eppendorf pipette | SIGMA - ALDRICH | Z683884 | |
| Eppendorf Tube | SIGMA - ALDRICH | EP0030119460 | |
| Ethanol 96 % | ROMICAL | Flammable Liquid | |
| Evans Blue 2% | SIGMA - ALDRICH | 314-13-6 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | model Infinite 200 PRO multimode reader | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Infusion Cuff | ABN | IC-500 | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 | |
| Multiset | TEVA MEDICAL | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Optical scanner | Canon | Cano Scan 4200F | |
| Petri dishes | SIGMA - ALDRICH | P5606 | |
| Scalpel blades 11 | SIGMA - ALDRICH | S2771 | |
| Sharplan 3000 Nd:YAG (neodymium-doped yttrium aluminum garnet) laser machine | Laser Industries Ltd | ||
| Stereotaxic head holder | KOPF | 900LS | |
| Sterile Syringe 2 ml | Braun | 4606027V | |
| Syringe-needle 27 G | Braun | 305620 |
Referencias
- World Health Organization. Global health estimates: deaths by cause, age, sex and country, 2000-2012. World Health Organization. 9, (2014).
- Meadows, K. L. Experimental models of focal and multifocal cerebral ischemia: a review. Reviews in the Neurosciences. 29, 661-674 (2018).
- Durukan, A., Strbian, D., Tatlisumak, T. Rodent models of ischemic stroke: a useful tool for stroke drug development. Current Pharmaceutical Designs. 14, 359-370 (2008).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Li, F., Omae, T., Fisher, M. Spontaneous hyperthermia and its mechanism in the intraluminal suture middle cerebral artery occlusion model of rats. Stroke. 30, 2464-2470 (1999).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Zhao, Q., Memezawa, H., Smith, M. L., Siesjo, B. K. Hyperthermia complicates middle cerebral artery occlusion induced by an intraluminal filament. Brain Research. 649, 253-259 (1994).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Experimental and Translational Stroke Medicine. 1, 8 (2009).
- Choi, B. I., et al. Neurobehavioural deficits correlate with the cerebral infarction volume of stroke animals: a comparative study on ischaemia-reperfusion and photothrombosis models. Environmental Toxicology and Pharmacology. 33, 60-69 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedure Online. 21, 9 (2019).
- Bleilevens, C., et al. Effect of anesthesia and cerebral blood flow on neuronal injury in a rat middle cerebral artery occlusion (MCAO) model. Experimental Brain Research. 224, 155-164 (2013).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. (147), e58875 (2019).
- Boyko, M., et al. Morphological and neuro-behavioral parallels in the rat model of stroke. Behavioural Brain Research. 223, 17-23 (2011).
Erratum
Formal Correction: Erratum: Laser-Induced Brain Injury in the Motor Cortex of Rats
Posted by JoVE Editors on 2/07/2022. Citeable Link.
An erratum was issued for: Laser-Induced Brain Injury in the Motor Cortex of Rats. The Authors section was updated.
One of the author names was updated from:
Dmitri Frank
to
Dmitry Frank
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados