このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ラットの運動皮質におけるレーザー誘発脳損傷
* これらの著者は同等に貢献しました
Erratum Notice
要約
ここで示すプロトコルは、脳損傷のげっ歯類モデルを作成する技術を示しています。ここで説明する方法は、レーザー照射を使用し、運動皮質を標的とする。
要約
実験的なげっ歯類モデルで脳卒中を誘導するための一般的な技術は、カテーテルを使用して中大脳動脈(MCAO-p)の過渡性(しばしばMCAO-tと呼ばれる)または永久的な(MCAO-pと呼ばれる)閉塞を含む。しかし、この一般的に受け入れられている手法には、いくつかの制限があり、それによってその広範な使用が制限されます。この方法による脳卒中誘導は、虚血領域の局在化および大きさの変動性の高さ、出血の周期的発生、および高い死亡率によって特徴づけられる。また、一時的または永続的な手順のいずれかを正常に完了するには、専門知識が必要であり、多くの場合、約30分間続きます。このプロトコルでは、げっ歯類モデルにおける脳損傷を誘発し、研究するための代替方法として役立つレーザー照射技術が提示される。
対照群およびMCAO群のラットと比較した場合、レーザー誘導による脳損傷は体温、梗塞容積、脳浮腫、頭蓋内出血、および死亡率の変動を減少させた。さらに、レーザーによる傷害の使用は、運動皮質と線条体組織の両方の破壊が観察されるMCAO実験とは異なり、運動皮質でのみ脳組織に損傷を与えた。
この調査結果から、レーザー照射は、運動皮質の脳損傷を誘発するための代替的かつ効果的な技術として役立つ可能性があることを示唆している。このメソッドは、プロシージャを完了する時間を短縮し、専門家のハンドラーを必要としません。
概要
世界的に、脳卒中は第2の主要な死因であり、障害の第3位の原因である。脳卒中はまた、重度の障害につながり、多くの場合、医療スタッフや親戚からの余分なケアを必要とします。したがって、障害に関連する合併症を理解し、より肯定的な結果の可能性を改善する必要があります。
動物モデルの使用は、病気を理解するための最初のステップです。最良の研究成果を得るために、一般的なモデルには、単純な手法、手頃な価格、高い再現性、および最小限の変動性が含まれます。虚血性脳卒中モデルにおける決定因子としては、脳浮腫容積、梗塞サイズ、血液脳関門(BBB)の破壊の程度、および神経学的重症度スコア2を介して一般的に評価される機能障害が含まれる。
げっ歯類モデルで最も広く使用されている脳卒中誘導技術は、中大脳動脈(MCA)を一過性または永久的に閉塞させる3.この技術は、ヒトのものと同様のストロークモデルを生成する:それは、ストローク領域を囲む陰茎を有し、高度に再現性があり、虚血持続時間および再灌流4を調節する。それにもかかわらず、MCAO法には若干の合併症がある。この技術は、多くの場合、追加の結果につながる視覚皮質および一般的な温熱の機能不全を伴う頭蓋内出血およびipsi側性の腎不全への傷害を起こしやすい55、6、7。6,7他の制限には、誘発された脳卒中の高い変動(虚血の可能性のある拡張から、外部頸動脈領域のような意図しない領域に起因する)、MCAの閉塞が不十分、および早期再灌流が含まれる。また、異なる株や大きさのラットは、様々な梗塞容積8を示す。前述のすべての欠点に加えて、MCAOモデルは、カテーテル法のための最小血管サイズの要件の点で技術的に限られているため、深部脳領域で小さな単離されたストロークを誘導することはできません。これにより、代替モデルの必要性がますます重要になります。別の方法、フォトトロンボシスは、MCAO手順に代わる可能性があるが、効率9を改善しない。このテクニックは、光でストロークをターゲットにし、以前のモデルでいくつかの改善を提供します。しかし、光血栓症は、二次的な併発に関連する侵襲的な頭蓋切り出しを必要とする。
ここで示す欠点の観点から、ここで提示されるプロトコルはげっ歯類の脳損傷を誘発するための可能な代替レーザー技術を提供する。レーザー技術の作用機序は、生体組織に与えるレーザーの光熱効果に基づいており、身体組織による光ビームの吸収と熱への変換につながります。レーザー技術を使用する利点は、その安全性と操作の容易さです。レーザーが出血を止めるために熱を生成する能力は医学において非常に重要であり、与えられた満点で異なるビームを増幅する能力は、レーザーが目標点10の邪魔になる健康な組織を破壊することを避けることを保証する。このプロトコルで使用されるレーザービームは、そのエネルギーを放出したり、破壊を引き起こすことなく、骨などの低液体媒体を通過することができます。脳組織などの高い液体培地に到達すると、エネルギーを使って標的組織を破壊します。したがって、この技術は、脳の適切な領域でのみ脳損傷を誘発することができる。
ここで提示された技術は、照射のレベルを調節する能力の膨大な量を示し、最初から意図された脳損傷の選択されたバリエーションを生み出した。皮質と線条体の両方に影響を与える元のMCAOとは異なり、レーザー技術は脳損傷の影響を調節することができ、意図した運動皮質にのみ傷害を誘発した。本明細書において、レーザー誘発性脳損傷プロトコルおよびラットの大脳皮質に対して行われる処置の代表的な結果の概要が提供される。
プロトコル
以下の手順は、欧州共同体の実験動物の使用に関するガイドラインに従って行われました。実験はまた、ネゲブのベングリオン大学で動物ケア委員会によって承認されました.
1. 動物の選択と準備
- この処置のための異常な病理学なしで300から350 gの重量を量る65の雄のスプレイグ・ドーリーのラットを選ぶ。サイズが小さいほど、MCAO の手順に技術的な問題が生じる。
- ケージごとに3匹のラットを割り当て、少なくとも3日間適応させてください。
2. MCAO手続き
- MCAO の 25 匹のラットを選択し、手順 11 に関連する死亡率を10~ 20% に設定します。
- 前述の詳細12で説明したように、標準の手法を使用して MCAO を実行します。
3. レーザー誘発脳損傷実験手順
- レーザー群としてマークされたグループに20匹のラットを割り当て、別の対照群に20匹のラットを割り当てる(シャム操作)。
- レーザー群ラットを、次のようにして50J X10 ポイントでレーザー照射を行う。
- 自発的な換気を可能にする酸素中の2%イオブルランの混合物とラットを麻酔する。引き出し反射の欠如を確認するために鉗子で尾をつまんで十分な麻酔深さを確認してください。
- 直腸温度調節加熱パッドを用いた実験手順を通して、ラットのコア体温を37°Cに維持する。
- 70%のアルコールと0.5%のクロルヘキシジングルコン酸塩で、剃毛で地元の毛髪を除去し、消毒します。消毒ステップをさらに2回繰り返します。
注意:外科的切開の大きさは約3cmであるべきである。切開部の周りに少なくとも2cmの毛を取り除きます。 - 立体性ヘッドホルダーにラットを置き、頭皮を横に反射し、ブレグマとラムダの間の領域を露出させるために3cmの切開を行います。
- 鼻コーンを通して麻酔を維持する。
- ネオジムYAG(Nd-YAG)レーザー(ピーク波長1064 nm)を使用して、50J X 10 ポイントを1sパルス持続時間で、右半球の上の頭蓋骨の露出領域に投与する。
- 装置のレーザー発生部分が露出した領域から2mmの距離にあることを確認し、レーザー光線を生成します。異なるエネルギー/表面の組み合わせを慎重に評価した後、50J X 10 点 を選択した。この組み合わせは効率的であり、第2の10未満の投与後に頭蓋骨の骨破壊を引き起こさない。
注:2 mmは、レーザー光の端子(通す光ケーブルから)と頭蓋骨の間の距離です。焦点レンズを使用する場合、距離は、損傷の所望の領域にビームを焦点を合わせるためにレンズの傾斜の角度を考慮して計算する必要があります。適切なトレーニングと眼の保護を含むレーザー装置を使用する際には、適切な安全性を確保してください。 - 装置からラットを取り除き、3-0シルク外科縫合糸で頭皮を閉じます。
- 麻酔を中止し、ラットをケージに戻して回復します。0.25%ブピバカインを局所投与し、手術直後に術後の痛みを軽減する。
メモ:正しく実行すれば、手順全体は5分未満で完了するはずです。
- 麻酔後の回復中に苦痛の兆候についてラットを観察してください。麻酔から出現する前に、術後鎮痛のために0.01mg / kgの筋肉内ブプレノルフィンを与え、少なくとも48時間12時間ごとに反復用量を続ける。
- 被験者はラットをレーザーに施すことなく同じ条件に制御する。
4. 神経学的重症度スコア(NSS)
- 43点スコア13を用いて、レーザー誘発性脳損傷後の神経学的重症度スコア24時間を評価する。以前に詳述したように、より重度の障害のためにより高いスコアを割り当てる神経学的欠陥、行動障害、ビームバランスタスク、および反射神経のために動物をテストする。
5. 傷害後の操作
- NSS評価後、ラットを20%酸素および80%のCO2(インスピレーションを介して)にさらして安楽死させ、ラットにヘパリン化されたリン酸緩衝生理食塩(PBS、0.9%NaCl)を経線的に浸透させる。
注:機関動物の世話と使用委員会のガイドラインに従って、CO2 が所定のレートで提供されていることを確認してください。このステップはまた、5%イソフルラン麻酔下で行うことができる。 - 脳を収穫し、以前のプロトコル11に記載されているようにさらなる検査の準備をする。
- 頭蓋骨からの分離後の脳全体の視覚検査を通じてくも膜下出血(SAH)を評価する。必要に応じて、顕微鏡や拡大鏡をこの目的に使用してもよい。
6. 脳損傷の評価
-
TTC染色による脳梗塞容積と脳浮腫の決定
注:2,3,5-トリフェニルテトラゾリウムクロリド(TTC)染色は、脳梗塞検出11のための便利な手順です。- 収穫した脳を6つのコロナスライス、それぞれ2mmの厚さに切り離します。
- 0.05%TTCで37°Cで30分間、各脳からスライスのセットをインキュベートします。
- 染色後、1600 X 1600 dpiの解像度で光学式スキャナーでスライスをスキャンします。
- 固定脳スライスの染色されていない領域は梗塞12と定義される。
- 画像処理ソフトウェア(例えば、フリーウェア 画像J)を用いて、6つのコロナスライスのそれぞれについて、非梗塞領域、ipsi-および対角半球を測定する。
- 梗塞の体積を脳全体の割合として計算する:
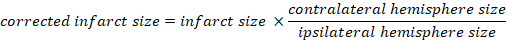
- カプラン法を使用して脳浮腫を計算します。
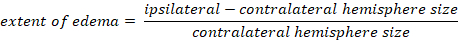
-
血液脳関門(BBB)破損の程度を決定する
注:レーザー誘発脳損傷後のBBB破損24時間後を評価します。- カニューレートされた尾静脈を介してラットに4mL/kg生理食液を静脈内に混合した2%のエバンスブルーを投与し、溶液を1時間循環させる。
- ラットを20%酸素と80%のCO2(インスピレーションを介して)24時間後に曝露して安楽死させる。
- 次のように、血管内局在性染料を収穫する:
- 外科用ピンセットと手術用はさみでラットの胸部を開きます。
- 右心房から無色の灌流液を得るまで110mmHgを用いて左心室を介して0.9%生理食動物を温化して動物を浸透させる。
- 脳を収穫し、2ミリメートルのスライスにロストロショードそれらをスライス。
- 左脳スライスを右部分から分離して、負傷した半球と負傷していない半球を別々に評価します。
- 重さを量り、モルタルと害虫を用いて均質化し、次いで脳組織を50%トリクロロ酢酸で24時間インキュベートする。
- ホモジナイズされた脳スライスを10,000×gで× g20分間遠心分離する。
- 1:3で96%エタノールの1.5mLと遠心脳からの上清の1mLを混合し、620 nm励起波長(10帯域幅)および680 nmの発光波長(10nm帯域幅)で蛍光検出器を使用して血液脳関門破損を評価する。
注: ラットの両方のグループは、BBBの内訳を決定するために同じプロトコルを受けます。
結果
制御または実験群のいずれにも死亡またはSAHが登録されなかった(表1)。MCAOグループは死亡率とSAHの両方の20%の割合を有していた。
両群のラットにおける相対体温変化も同様であったが、両群のばらつきの違いにもかかわらず(表1)。
レーザー(16 ±1.1)とMCAO(20±1.5)モデルの両方で、シャム操作対照群(1±0.3)と比較して有意に悪い...
ディスカッション
レーザー群で死亡またはSAHが発生しなかった場合、レーザー技術は最小限の侵襲性であると考えるのは公正です。死亡の主な原因とSAHは、元のMCAO技術10に示すように、頭蓋内圧(ICP)の上昇につながる血管への損傷である。レーザー群における死およびSAHの欠如は、レーザーの特定の効果による可能性が高い:彼らは血管に直接影響を与えないし、漏出の場合に凝固を誘発する?...
開示事項
著者らは開示するものは何もない。
謝辞
ソロカ大学医療センター麻酔科とネゲブのベングリオン大学の研究室スタッフに、この実験の成果に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride | SIGMA - ALDRICH | 298-96-4 | |
| 50% trichloroacetic acid | SIGMA - ALDRICH | 76-03-9 | |
| Brain & Tissue Matrices | SIGMA - ALDRICH | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 1.83604E+11 | |
| Centrifuge Sigma 2-16P | SIGMA - ALDRICH | Sigma 2-16P | |
| Compact Analytical Balances | SIGMA - ALDRICH | HR-AZ/HR-A | |
| Digital Weighing Scale | SIGMA - ALDRICH | Rs 4,000 | |
| Dissecting scissors | SIGMA - ALDRICH | Z265969 | |
| Eppendorf pipette | SIGMA - ALDRICH | Z683884 | |
| Eppendorf Tube | SIGMA - ALDRICH | EP0030119460 | |
| Ethanol 96 % | ROMICAL | Flammable Liquid | |
| Evans Blue 2% | SIGMA - ALDRICH | 314-13-6 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | model Infinite 200 PRO multimode reader | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Infusion Cuff | ABN | IC-500 | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 | |
| Multiset | TEVA MEDICAL | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Optical scanner | Canon | Cano Scan 4200F | |
| Petri dishes | SIGMA - ALDRICH | P5606 | |
| Scalpel blades 11 | SIGMA - ALDRICH | S2771 | |
| Sharplan 3000 Nd:YAG (neodymium-doped yttrium aluminum garnet) laser machine | Laser Industries Ltd | ||
| Stereotaxic head holder | KOPF | 900LS | |
| Sterile Syringe 2 ml | Braun | 4606027V | |
| Syringe-needle 27 G | Braun | 305620 |
参考文献
- World Health Organization. Global health estimates: deaths by cause, age, sex and country, 2000-2012. World Health Organization. 9, (2014).
- Meadows, K. L. Experimental models of focal and multifocal cerebral ischemia: a review. Reviews in the Neurosciences. 29, 661-674 (2018).
- Durukan, A., Strbian, D., Tatlisumak, T. Rodent models of ischemic stroke: a useful tool for stroke drug development. Current Pharmaceutical Designs. 14, 359-370 (2008).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Li, F., Omae, T., Fisher, M. Spontaneous hyperthermia and its mechanism in the intraluminal suture middle cerebral artery occlusion model of rats. Stroke. 30, 2464-2470 (1999).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Zhao, Q., Memezawa, H., Smith, M. L., Siesjo, B. K. Hyperthermia complicates middle cerebral artery occlusion induced by an intraluminal filament. Brain Research. 649, 253-259 (1994).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Experimental and Translational Stroke Medicine. 1, 8 (2009).
- Choi, B. I., et al. Neurobehavioural deficits correlate with the cerebral infarction volume of stroke animals: a comparative study on ischaemia-reperfusion and photothrombosis models. Environmental Toxicology and Pharmacology. 33, 60-69 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedure Online. 21, 9 (2019).
- Bleilevens, C., et al. Effect of anesthesia and cerebral blood flow on neuronal injury in a rat middle cerebral artery occlusion (MCAO) model. Experimental Brain Research. 224, 155-164 (2013).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. (147), e58875 (2019).
- Boyko, M., et al. Morphological and neuro-behavioral parallels in the rat model of stroke. Behavioural Brain Research. 223, 17-23 (2011).
Erratum
Formal Correction: Erratum: Laser-Induced Brain Injury in the Motor Cortex of Rats
Posted by JoVE Editors on 2/07/2022. Citeable Link.
An erratum was issued for: Laser-Induced Brain Injury in the Motor Cortex of Rats. The Authors section was updated.
One of the author names was updated from:
Dmitri Frank
to
Dmitry Frank
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved