Method Article
牵引力显微镜研究B淋巴细胞激活
摘要
在这里,我们提出了一个协议,用于在B细胞上进行牵引力显微镜实验。我们描述了软聚丙烯酰胺凝胶的制备及其功能化,以及显微镜下的数据采集和数据分析摘要。
摘要
牵引力显微镜 (TFM) 能够测量基板上的电池产生的力。该技术从在弹性基板上拉的细胞产生的实验观测的位移场推断出牵引力测量。在这里,我们调整了TFM,以研究B细胞在B细胞受体抗原接合激活时所施加的力场的空间和时间结构。凝胶刚度、珠密度和蛋白质功能化必须进行优化,以研究与细胞表面受体相互作用的相对较小的细胞(±6 μm),并特别响应配体。
引言
B细胞是免疫系统的抗体产生细胞。为了激活自适应免疫反应,他们首先通过称为B细胞受体(BCR)1的特定受体获得原生形式(即非处理)。此过程发生在淋巴结 B 细胞区。即使某些抗原可以通过淋巴液到达B细胞,大多数抗原,特别是高分子量(>70 kDa,这是淋巴导管的极限大小)确实以原生形式呈现在抗原呈现细胞(APC)的表面,通常是亚囊鼻窦巨噬细胞或卵泡树突细胞,通过卵磷或Fc受体(非特异性)。与该细胞的接触导致免疫突触的形成,其中BCR对与APP相关的抗原施加力。抗原与 BCR 的绑定启动 BCR 信号,从而激活产生力的机制。这些力量对于扩增BCR信号可能很重要,但对B细胞提取和内化抗原也是必不可少的。
最近的研究表明,BCR确实是机械敏感2。例如,更硬的基板会发出增强的 BCR 信令 3。此外,在免疫突触产生的力拉单个BCR,以探寻其亲和力抗原,从而确保亲和力歧视4。因此,研究B细胞对抗原表现的机械反应,并解剖这种反应,从涉及的受体类型(IgG/IgM)5,粘附分子(内黄体体)或药理学和转基因细胞(即,BCR信号或细胞骨架动力学下游的蛋白质的沉默)6。
观察细胞对生理刚性基质基底的反应的简单方法是牵引力显微镜 (TFM)。TFM包括观察在弹性基板上拉的细胞产生的位移场。最初,凝胶的变形是通过相对比显微镜7的弹性体本身的皱纹观察到的,但插入荧光微珠作为基准标记可以更好的分辨率,并从此成为标准8。这种方法已被用于研究粘附细胞、组织,甚至嵌入凝胶中的器官所施加的牵引力。TFM 的几个变体已经开发出9种,包括,结合超分辨率显微镜(即STED 10 或SRF11),修改凝胶的折射率,允许TIRF显微镜12,用纳米打印图案13取代珠子,并使用纳米单子代替平面14。有关这些变化的完整审查,请参阅科林-约克等人第15条。
此处介绍的协议描述了测量 B 细胞在抗原涂层基材上施加力的过程。这些力应用于配体(抗原),以便聚类它们,然后从抗原呈现基质中提取它们。我们调整了标准TFM协议,以模拟生理抗原呈现基板的刚度、尺寸和B细胞的相关涂层。该协议允许同时研究多个细胞,并可与荧光显微镜技术和化学处理结合使用。然而,它的目的并不旨在探测单分子力测量,其中光学钳子16,分子张力探针17,18,生物膜力探针19,和原子力显微镜20是比较合适的技术。与其他单细胞力测量方法(例如,微管21或微孔板 22)相比,TFM 允许重建一个分辨率为 ±300 nm 的突触施加的力的完整图。这可用于识别表面施加的力中的时态模式,并且由于凝胶与共和成像兼容,因此将它们与特定蛋白质(例如,细胞骨架和信号蛋白)的招募关联。
虽然 3D TFM 是可能的,但它与我们使用的刚度和设置不兼容。3D 中的变形可以通过其他更复杂的设置实现,例如突起力显微镜(AFM 扫描镀细胞的可变形膜)23、24和弹性振振器干扰显微镜(ERISM,一种凝胶作为光的振振腔,并突出显示基板的变形,精度为几纳米)25。虽然这些技术是非常有希望的,他们还没有被用于B细胞。其他类型的TFM,如纳米极14,可以用来拥有更可重复的基材。然而,由于细胞相互交插,因此这种几何体不能适应软细胞,这使分析变得复杂。这种方法确实在T细胞中被用来观察细胞在柱子26周围建造结构的能力。
尽管 TFM 简单明了,但它使用聚丙烯酰胺凝胶允许同时观察许多细胞,并且可以在配备长凳和荧光显微镜的任何实验室中轻松、廉价地实施(尽管我们建议使用共聚/旋转盘)。
为了模仿APC的生理刚性,我们使用刚度为+500 Pa27 的聚丙烯酰胺凝胶,并激活抗原使凝胶功能化。在该协议中,我们使用母鸡蛋糖酶(HEL)对聚丙烯酰胺凝胶的表面进行功能化。这允许通过接触抗原结合位点测量刺激 BCR 产生的力。使用这种抗原和从MD4小鼠的 HEL 特异性B细胞确保相对均匀的力生成响应抗原结扎28。然而,其他分子(如B6小鼠的抗IgM)可以嫁接到凝胶上,但在这些情况下产生的力可能更异质化,强度更低。由于 B 细胞是小细胞(直径 ±6 μm),因此珠的数量已优化为最大,但仍可跟踪。对于在基材上施加 +kPa 力的大型细胞,可以使用相对稀疏的珠子或执行简单的粒子图像测速 (PIV) 来重建变形场,获得令人满意的结果。然而,对于小细胞,如B淋巴细胞,施加的压力小至+50Pa,需要使用单粒子跟踪(粒子跟踪测速仪,PTV)来实现所需的精度,当重建变形场。为了可靠地单独跟踪珠子,目标镜头的放大倍率需要至少60倍,其数值孔径约为1.3倍。因此,凝胶必须相对薄(<50 μm),否则珠子不可见,因为它们高于目标的工作距离。
主要方案由三部分组成:凝胶制备、凝胶功能化和成像;另外两个部分是可选的,专用于荧光细胞的抗原提取定量和成像。
研究方案
1. 凝胶制备
- 凝胶支持的硅化
- 使用紫外线灯激活盖玻片或玻璃底 Petri 盘(将用作凝胶支持),使用 UV 灯 2 分钟(在暴露于紫外线灯之前等待 30 秒以避免暴露于残留臭氧)。
- 使用 200 μL 氨基三氧硅烷 (APTMS) 将盖玻片/玻璃底盘硅化 5 分钟。这将准备对凝胶共价结合的支持。
- 用超纯水彻底清洗盖玻片/玻璃底盘。
- 使用真空吸气将盖玻片/玻璃底盘干燥。
- 准备用于压平凝胶的 18mm 盖玻片
- 要准备盖玻片,请先将它们放入陶瓷盖玻片支架中。然后将盖玻片架放入小烧杯(50 mL)中,将硅化试剂(储存在4°C,可重复使用)倒入盖玻片上,确保完全盖住它们。
- 用铝箔盖住烧杯,在室温下孵育3分钟。在等待时,用超纯水填充大烧杯(500 mL)。在硅化试剂中孵育3分钟后,将带盖玻片的盖玻片转移到水杯中。
- 用超纯水彻底冲洗盖玻片,干燥干净,并放在纸巾上。为获得最佳效果,请立即进入下一节。
- 凝胶聚合
- 对于 0.5 kPa 的凝胶,将 75 μL 的 40% 丙烯酰胺与 30 μL 的 2% 双丙烯酰胺(交联剂)和 895 μL 的磷酸盐缓冲盐水 (PBS) 混合。此预混料可储存长达一个月,温度为 4 °C。
- 至 167 μL 的 0.5 kPa 凝胶预混,在沐浴声波器中加入 1% (1.67 μL) 的珠子、涡流和声波 5 分钟(标准台式超声波清洁剂,功率为 50±100 W,频率为 40 kHz)。使用铝箔防止混合物受到光线的利用。
注:在添加启动器 (TEMED) 之前,预混料不会聚合。 - 要催化聚合,加入 1% (1.67 μL) 的 10% w/v 硫酸铵 (APS)。
- 要开始聚合,加入0.1%(0.2μL)N、N、N=,N+-四甲苯二胺(TEMED)。与移液器混合。添加 APS 和 TEMED 后,凝胶会快速聚合,以便快速进行凝胶铸造。
- 凝胶铸造
- 将 9 μL 凝胶混合物滴到每个盖玻片/玻璃底盘上(掉落在中心,图 1A)
- 放置硅化/疏水性盖玻片并压平凝胶(图1B)。使用钳子,按盖玻片,确保凝胶扩散到盖玻片的整个区域(图1C),直到它开始泄漏。
- 将盖玻片/玻璃底盘倒置到一个大的培养皿中,然后轻拍长凳上,迫使珠子朝凝胶表面移动(图 1D)。
- 用铝箔盖住,在室温下在潮湿室中聚合1小时(即,在盘子上方放一个湿纸巾以防止蒸发)。
- 1 小时后,将 PBS 添加到样品中,以便于释放盖玻片。小心地,用针头去除盖玻片(具有不同的薄片的涂层应允许从凝胶上轻松剥离盖 玻片,图 1E)。
- 将凝胶留在 PBS 中。
注:凝胶现在可以在4°C的PBS中储存5~7天,但建议在48小时内使用。
2. 凝胶功能化
- 在 10 mM HEPES 缓冲液中,以 0.5 mg/mL 的六烷酸盐 (Sulfo SANPAH) 溶液在 0.5 mg/mL 中准备磺胺六烷基 6-(4'-azido-2'-硝基苯丙胺)六烷酸酯(Sulfo SANPAH) 溶液。这可以在4°C用铝箔覆盖长达一个星期。
- 从凝胶中吸出 PBS。
- 在室温下将150μL的S SULfo SANPAH加入凝胶(图1F)。
- 将凝胶暴露在紫外线处理中 2 分钟,以对 Sulfo SANPAH 的场地进行照片激活,并使其粘在凝胶表面。
- 用 PBS 洗涤三次(图 1G)。
- 重复步骤 2.2~2.5。
- 将 250 μL 的 HEL (100 μg/mL) 添加到每个凝胶中,并在 4 °C 的潮湿室中孵育过夜,同时用铝箔覆盖(图 1H)。
- 去除 HEL 抗原,用 PBS 洗涤三次。
注:HEL既作为抗原,又作为粘附分子。它可以被与受体结合的其他分子(例如,抗小鼠IgM,牛血清白蛋白,椭圆形蛋白)或与集成素配体混合(例如,ICAM1与LFA1结合)所取代。如果需要,可以使用 HEL 的荧光版本进行抗原提取(通过用蛋白质标签套件染色分子获得,请参见步骤 4)。请注意,散装的给定浓度可能不会产生与玻璃上相同的表面浓度:如果需要直接比较,需要用二次染色来量化。
3. 细胞加载和成像
- 成像前,从凝胶中去除PBS,加入500μL的B细胞介质(RPMI 1640,10%的胎儿小腿血清,1%青霉素-链霉素,2%丙酮酸钠,50uM墨脱醇和1X非必需氨基酸),并让他们平衡到RT。
- 细胞制备
- 根据负选择协议从脾脏中纯化原 B 细胞( 参见材料表)。典型的最终B细胞产量约为1×107 细胞。在B细胞培养基中将这种浓缩到3 x 106 细胞/mL(RPMI-1640,辅以10%的胎儿小牛血清、1%青霉素-链霉素、0.1%的甲酸酯醇和2%的丙酮酸钠)。
- 根据需要在 4 °C 下存储 6 小时以下的细胞。
- 在图像采集前,将细胞保持37°C30分钟。
- 成像
- 使用带热和(可能)CO 2 控制的共合显微镜 。
注:无论是否使用共合或旋转盘显微镜,使用允许像素大小 <200 nm 的客观/针孔在分析阶段舒适地跟踪珠子(例如,60x、NA 1.3)非常重要。此外,还可以使用荧光显微镜,但它提供较低的信噪比,并可能导致单个珠子跟踪更加困难。 - 两个主要层的珠子将出现在凝胶的底部和顶部。聚焦凝胶平面。
注:一个漂亮的凝胶会出现作为星空,珠子大致均匀地分布在同一平面上。 - 以 5 秒的帧速率编程采集 30 分钟(这可适应实验的需求,例如,获取其他颜色、获取 z 堆栈等)
- 从凝胶中吸出介质,在凝胶上留下约 200 μL 的介质。将凝胶放在显微镜上,在凝胶上找到珠子的表面层和一个不错的均匀区域。
- 加入80μL的细胞(避免接触凝胶以保持对焦)。
- 确保焦点仍然正确,并且可以看到细胞在该区域(在透光下)下降。在细胞到达凝胶之前启动采集。
- 如果意外接触凝胶、振动或焦点漂移,请调整焦点。
注:收集放松凝胶的图像至关重要,这可能是在凝胶上细胞到达之前拍摄的任何图像。
- 使用带热和(可能)CO 2 控制的共合显微镜 。
4. 荧光 HEL 提取实验
- 通过结合荧光染料(颜色不同于珠子,如Alexa 555)来准备荧光 HEL, 参见材料表。
- 在步骤 2.7 中,用荧光 HEL 替换传统的 HEL。
- 获取照明设置低或帧速率低的图像(例如,每分钟 2 帧),以避免照片漂白。
- 为了量化 HEL 提取,根据公式计算每个帧 I(t)的单元格区域上集成的强度,并按照帧 0 的强度I (0)校正和规范化:
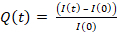
注:与荧光团结合的抗原不可见(可能是由于凝胶表面的荧光团淬火),但它在凝胶上的存在可以通过抗 HEL 和荧光二级抗体进行验证。可以验证,荧光磷确实是荧光时,分离时,剥离它与盖玻片涂有抗H能,并揭示它与二次荧光抗体(在盖玻片)6。提取的抗原信号非常暗淡,有时被珠子泄漏遮盖。如果只对抗原提取感兴趣,建议在没有珠子的情况下准备凝胶(跳过步骤1.3.2和1.4.3)。
5. 荧光成像
- 通过从转基因小鼠的 sple 中纯化 B 细胞来获得荧光 B 细胞,就像对野生类型(例如,从 Lifeact-GFP 或 Myosin II GFP 小鼠)一样。
- 对于成像荧光细胞,使用(如果可能的话)旋转盘显微镜与水浸长距离40x~100倍目标。
- 保持曝光持续时间和帧速率低,以避免漂白。
注:Z 中的点传播功能因凝胶的存在而高度退化,因此我们建议使用水浸目标。带浸水目标的直立显微镜受到发射路径中(球形)细胞(和细胞核)存在引起的强球形畸变。
6. 分析
注:数据分析通常通过首先校正整个堆栈的漂移,在每个帧中查找珠子,跟踪其移动参照系(在没有细胞的情况下拍摄),插值位移场和反转问题,以获得使用 Fourier 变换29的应力。为此,我们建议使用 ImageJ 宏和 MATLAB 程序的组合,可从在线存储库30 下载。
- 在 ImageJ 中打开影片,作为图像堆栈
- 运行宏"Crop_and_save.ijm"
- 使用"矩形"工具选择感兴趣区域 (ROI),并使用"t"键将它们添加到 ROI 列表中。
- 裁剪单元格时,请确保包含至少 5~10 像素的不可移动磁珠区域。从分析中排除过于接近边界或其他单元格的单元格。完成后,单击"确定"。
- 宏建议单元格的掩码:如果这是令人满意的,请单击"确定"。如果不满意,请单击"不正常",然后使用任何选择工具手动选择封闭区域(例如"手绘"或"Oval"),然后单击"继续"。
- 打开 MATLAB 并运行"TFM_v1.m"。
- 输入所需的参数:特别是检查图像属性(像素大小、采集时间间隔)和凝胶属性(年轻模量 E、泊松比)。
- 默认情况下,引用图像设置为第一个。如果需要,将它设置为另一个帧,或将它设置为"0"以加载外部文件。
- 将软件的输出定位在同一目录中,与原始文件相同(有关说明,请参阅User_notice.pdf文件)。这包括珠子的初步轨迹("FILENAME.fig"),一个随着时间变化而产生的能量图("FILENAME_energy.fig"),一个在细胞上集成的几种数量表(能量、面积、时刻等)"FILENAME_finaltable.mat",一个包含位移和力场、珠子电影、位移场、应力和能量(可与任何 avi 读取器一起打开)的结构。
注:在输入参数中,"窗口大小"是插位窗口,因此应力和置换字段的最终分辨率。这设置为几个(默认情况下为 4 个)像素。不建议减少这一点,因为通过插值没有珠子的区域来人为地增加分辨率。
结果
考虑到细胞的大小,通过相关技术(如粒子图像测速)提取珠子位移图的算法一般不是很精确。然而,根据所需的分辨率,一个人可以很容易地获得定性的结果,使用免费的斐济/ImageJ插件31,32。虽然这种方法足以比较刺激和非刺激条件,为了进行彻底的分析,我们建议使用我们的软件可从在线存储库30下载,该存储库分别跟踪珠子,并在给定时间点提供位移场图,作为单个珠位移33的插值。此时,可以进行几种量化。例如(假设位移仅由与凝胶表面相切应力引起),软件还提供导致该特定位移图的每个点的压力。这是一种"反转问题":某个点的位移取决于应用于其他点的所有力的总和。"反转算法"考虑基板的物理参数:其刚度(年轻模数)和泊松比。直接算法通常非常准确,但计算成本高昂。基于 Fourier 变换的算法(像我们的算法一样)在 Fourier 空间中基本上执行去卷积,效率更高,但容易出现一些错误(主要由于插值步骤)。这些算法通常需要调整一个参数,以防止小局部(和潜在的神器)位移在计算应力场时变得过于相关(Tikhonov正则化参数8,29;对话框窗口中的"正则化"变量;在这里,我们通常设置为等于 5 x 10-19。对于更高级的解释和分析,如时空相关性、局部运动、荧光通道相关性,我们建议与该领域的专家合作。有关计算方法的回顾,请参阅施瓦茨等人9。
如上所述,正确的珠子图像看起来像一个"星空",一个均匀和随机分布的亮点(图2A)。当珠子数量过低(图2B)或图像对焦不足时,数据和分析不可靠(图2C)。一旦B细胞稳定到凝胶表面,细胞下方的珠子开始移动,由于细胞对凝胶施加的牵引力。应丢弃珠子无法跟踪的框架。
作为检查,可以眼睛观察珠子的运动,比较"参考框架",通常是细胞与基板第一次接触之前的运动。从单个粒子跟踪(例如,跟踪,斐济 34)中获得近似结果,如图 3A所示。分析提供了参考图像("FILENAME.fig")中珠子的分割作为控件。
使用我们提议的软件,可以获取位移(图3B)和应力场(每个像素的局部应力矢量和从位移场的反转获得的每个时间点, 图3C)。在细胞区域上集成的位移和力场的扇板素提供细胞在基板上施加的总工作(图4A)。此计算需要协议步骤 6.2 中引入的单元格的掩码。
要比较两个生物条件(如激活 HEL 与非激活基板 BSA,或野生类型与淘汰),计算平均曲线(图 4B)或更综合地计算能量达到高原的最后时间点(20 分钟)的平均值(图4C) 是很有用的。当力的空间信息相关时,可以比较每个条件的单个时间点(图 4D)。有关更深入的分析,请参阅库马里等人 6。
图 5A显示了荧光抗原提取时间推移的示例:突触时荧光信号的逐行出现,指示抗原从凝胶分离。图 5B所示,15个单元的平均提取曲线及其置信区间(均值的标准误差)。
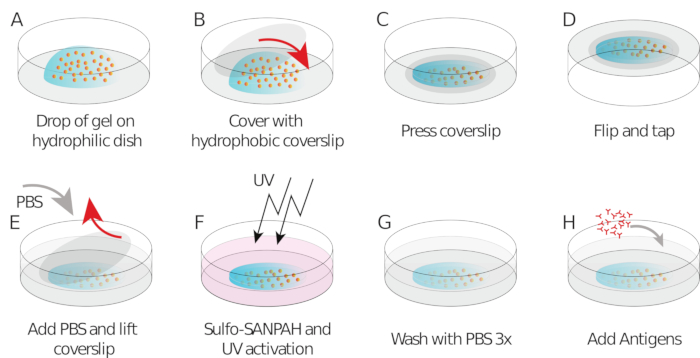
图1:凝胶制备及其功能化的示意图。协议中介绍了步骤。请单击此处查看此图的较大版本。

图2:三个不同品质的珠子图像示例。 (A) 具有正确信噪比和正确密度的珠子图像示例。(B) 珠子数量不足和焦平面数不足的图像示例.请单击此处查看此图的较大版本。
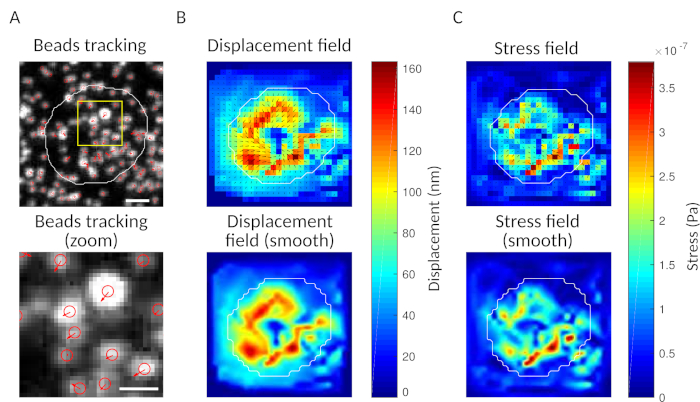
图3:处理图像以提取力场。( A )珠子图像示例(白色单元格轮廓,从传输图像中提取),时间 t = 5 分钟(红色叠加)和相对于时间 t = 0 分钟(比例杆 5 μm)的珠子跟踪。(B) 插值位移场(表示为矢量颤动和幅度图,箭头与位移 [nm]成正比;参见右侧的色条);底部:更平滑的量级图像(通过双立方函数的插值获得)。(C) 面板 B 中位移场的应力场(表示为矢量颤动和幅度图;箭头与剪切应力成正比 [Pa];参见右侧的色条);底部:更平滑的量级图像(通过双立方函数的插值获得)。请单击此处查看此图的较大版本。
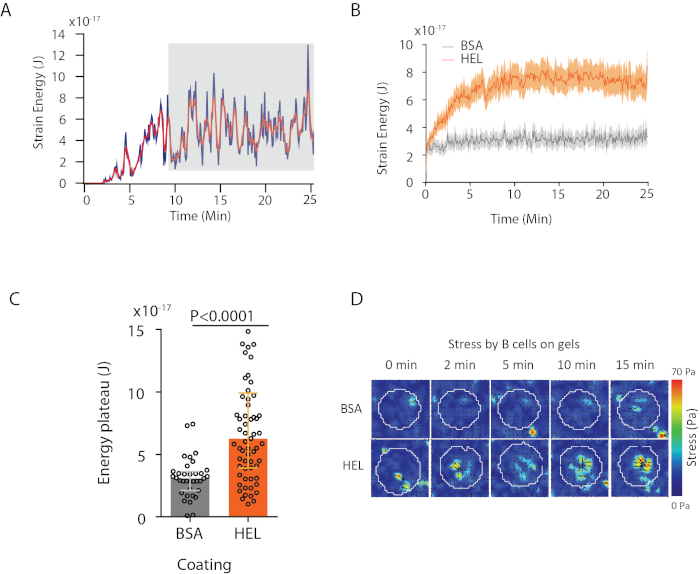
图4:可以从力和位移场中提取的信息示例。( A) 单个细胞能量在时间上演化的例子:一个高原相位(以灰色突出显示)大约10分钟后出现。 (B) 比较在 HEL(激活)涂层凝胶上镀制的 65 个细胞和 35 个 BSA(非激活)涂层凝胶上 35 个细胞(显示中位 ± 四分位数范围)的相对水平和相对高原水平的比较,使用曼-惠特尼测试进行统计意义。(D) HEL 和控制 BSA 条件的应力的延时彩色图;显示幅度和颤动图。这些图像改编自库马里等人6。请单击此处查看此图的较大版本。
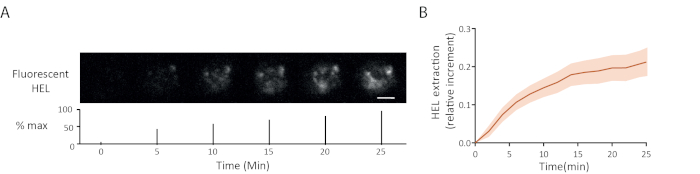
图5:荧光抗原实验示例. (A) 荧光 HEL 提取的时间推移(下图:最大值的百分比,比例杆 = 3μm)。(B) 随着时间的推移,抗原聚集(平均±SEM,n = 15)。这些图像改编自库马里等人6。请单击此处查看此图的较大版本。
讨论
此处描述的 TFM 方法允许系统地研究 B 细胞的有源机械能力。在B细胞的上下文中,这与提取和内化抗原的能力有关。与其他TFM方法相比,此处提出的协议简单且相当可重复:通过玻璃微球的缩进和使用赫兹模型测量的刚性在400至600帕之间。 类似的协议不仅成功地用于B细胞35, 而且也成功地用于T细胞36。与纳米云拉(也用于T淋巴细胞37)相比,它提供了一个平坦的均匀表面,因此结果更容易解释,因为凝胶的相互作用主要约束到与表面切线。
我们描述的协议允许访问B细胞在抗原呈现基质上施加的力的时空动力学。在空间层面上,这提供了力的定位信息,并结合荧光显微镜,使实验者能够将局部力与特定分子的存在(即细胞骨架或BCR信号级联的成分)的存在关联。在时间层面,可以集成数量(如总能量或总应力),以提供每个时间点一个值并降低噪声。这允许观察牵引力在时间(生长和高原)的演变和脉动模式的存在。
分析的关键实验方面如下所述。(i) 细胞密度:为了进行正确的分析,细胞应充分分离。如果细胞周围有一个自身大小的空区域,我们认为它是可分析的。(二) 传输图像:建议在实验期间至少收集细胞的传输图像,以用作分析中的掩码。(iii) 图像中的珠数:我们建议仅分析突触中的珠数在 30 到 200(即 1~8 个珠子/μm2)的图像。较低的密度不允许进行适当的地图位移重建。高珠密度使单个颗粒跟踪不可靠。(四) 在实验期间,珠子的数量应保持不变;但是,由于成像条件下的变异性很小(特别是在彼此过于接近的珠子中),可能会发生波动。必须纠正焦点漂移,并丢弃有问题的帧。(v) 凝胶质量:裂纹过重、珠子分布变化或过厚的凝胶应丢弃。(vi) 根据细胞类型,在反复暴露后,后期时间点(>300帧)的细胞可能会遭受光毒性影响。建议在没有单元格的掩码上运行程序,作为与数据进行比较的"基线"。这仅根据实验条件提供噪声级别的大小。
用于测量经典粘附中牵引力的凝胶允许对在焦点粘附时发生的过程(行为源流动和信号分子的招募)进行调查,即施加力的点38,39。但是,突触的力不会通过焦点粘附应用。B细胞免疫突触中力生成时空模式直到最近才使用这种方法进行定量研究。使用TFM,我们首次观察到,力模式在B细胞免疫突触,在我们最近的研究6,打开令人鼓舞的观点,在研究淋巴细胞。
值得注意的是,此方法使用在凝胶上细胞到达之前拍摄的图像作为力计算的参考图像。通常的TFM协议建议在实验结束时使用尝试素分离细胞后拍摄参考图像;这允许实验者寻找一个富含细胞的区域。虽然这在这里也是可能的,但 trypsin 在从抗原涂层凝胶分离 B 细胞时效率相当低,需要等待很长时间才能分离,并且凝胶修饰和运动的风险更高(使整个数据集无法开发)。
此处介绍的方法是灵活的,可用于研究免疫突触中其他信号的作用,因为它允许将其他蛋白质移植到凝胶表面(例如,集成糖体和免疫球蛋白已经过测试),甚至荧光抗原(见第 4 节)。此外,实验者仍然能够获得细胞进行药物治疗和局部扰动。最后,该方法还与成像固定细胞兼容。对于这些观察,建议在盖玻片上制作凝胶,弄脏细胞,将盖玻片粘在幻灯片上,然后添加安装介质和另一个盖玻片。然后,将用顶部的凝胶进行观察,以避免图像通过凝胶退化。
可能的陷阱是凝胶在聚合和涂层中的变异性。聚合问题主要是由于启动者/催化剂的质量。此外,凝胶可以膨胀,特别是在组装后未使用。这个问题似乎没有显著影响凝胶的机械性能,但它可以使珠层无法达到的目标,有效地使凝胶无用的。当出现此问题时,我们建议为每种情况准备额外的凝胶。涂层也可能存在某种变异性,新稀释的 Sulfo SANPAH 至关重要。
最后,我们描述了一种简单、廉价和可重复的方法,用于测量B细胞在由BR配体激活时在免疫突触中施加的力。它可以适应研究对其他配体和其他类型的淋巴细胞(记忆B细胞,T细胞等)使用适当的受体配体的反应。
披露声明
作者没有什么可透露的。
致谢
作者感谢M.Bolger-Munro的批判性阅读,并感谢尼康成像Center@CNRS研究所和PICT-IBISA,居里研究所,巴黎,法国-生物成像国家研究基础设施的成员,在图像采集和居里动物设施方面的支持。PP 得到 CNRS 的支持。AK 和 JP 得到了巴黎笛卡尔博士奖学金和学术博士火项目贝当古的支持。该项目由赠款资助PP(ANR-10-JCJC-1504-Immuphy)和 AMLD(ANR-PoLyBex-12-BSV3-0014-001,ERC-Strapacemi-GA 243103)。
材料
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethoxysilane (APTMS) | Sigma-Aldrich | 281778 | Store aliquoted, protected from humidity |
| 40% Acrylamide Solution | Biorad | 1610140 | |
| Alexa555 microscale protein labeling kit | Molecular Probes | A30007 | |
| Ammonium Persulfate (APS) | Sigma-Aldrich | A3678 | |
| B cell Isolation Kit, Mouse | Miltenyi Biotec | 130-090-862 | |
| B-mercaptoethanol | Gibco | 31350-010 | |
| 2% Bis Solution | Biorad | 161-0142 | |
| Bovine Serum Albumin (BSA) | Euromedex | 04-100-812-C | |
| Coverslip 18mm | VWR | 631-1580 | |
| Fetal calf serum | PAA | A15-151 | Decomplemented (40min @56°C) |
| Fluorodishes FD35 | World Precision Instruments, Inc | FD35100 | |
| Fluosphere: carboxylate-modified, 0.2um, dark red | Molecular Probes | F8807 | |
| Hen Egg Lysozyme | Sigma-Aldrich | L6876 | Stocked in aliquote 100mg/ml |
| MEM Non-Essential Amino Acids Solution (100X) | Thermofisher/Gibco | 11140035 | |
| N,N,N',N'-tetrametiletilendiammine (TEMED) | Euromedex | 50406-B | |
| PBS (Phosfate Buffer Saline) | Gibco | 10010-015 | |
| Penicillin–streptomycin | Gibco | 15140-010 | |
| RMPI 1640 – Glutamax I | Thermofisher | 61870-010 | |
| Sigmacote | Sigma-Aldrich | SL2 | |
| Sodium pyruvate | Gibco | 11360-039 | |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate (Sulfo-SANPAH) | Thermo Scientific | 22589 |
参考文献
- Yuseff, M. -I., Pierobon, P., Reversat, A., Lennon-Duménil, A. -M. How B cells capture, process and present antigens: a crucial role for cell polarity. Nature Reviews. Immunology. 13 (7), 475-486 (2013).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. The Journal of Cell Biology. 216 (1), 217-230 (2017).
- Shaheen, S., Wan, Z., et al. Substrate stiffness governs the initiation of B cell activation by the concerted signaling of PKCβ and focal adhesion kinase. eLife. 6, (2017).
- Natkanski, E., et al. B cells use mechanical energy to discriminate antigen affinities. Science. 340 (6140), 1587-1590 (2013).
- Wan, Z., Chen, X., et al. The activation of IgM- or isotype-switched IgG- and IgE-BCR exhibits distinct mechanical force sensitivity and threshold. eLife. 4, (2015).
- Kumari, A., Pineau, J., et al. Actomyosin-driven force patterning controls endocytosis at the immune synapse. Nature Communications. 10 (1), 2870(2019).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophysical Journal. 94 (1), 207-220 (2008).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochimica et Biophysica Acta. 1853 (11), Pt B 3095-3104 (2015).
- Colin-York, H., Shrestha, D., et al. Super-Resolved Traction Force Microscopy (STFM). Nano Letters. 16 (4), 2633-2638 (2016).
- Stubb, A., Laine, R. F., Guzmán, C., Henriques, R., Jacquemet, G., Ivaska, J. Fluctuation-Based Super-Resolution Traction Force Microscopy. BioRxiv. , (2019).
- Gutierrez, E., Tkachenko, E., et al. High refractive index silicone gels for simultaneous total internal reflection fluorescence and traction force microscopy of adherent cells. Plos One. 6 (9), 23807(2011).
- Bergert, M., Lendenmann, T., et al. Confocal reference free traction force microscopy. Nature Communications. 7, 12814(2016).
- Schoen, I., Hu, W., Klotzsch, E., Vogel, V. Probing cellular traction forces by micropillar arrays: contribution of substrate warping to pillar deflection. Nano Letters. 10 (5), 1823-1830 (2010).
- Colin-York, H., Fritzsche, M. The future of traction force microscopy. Current Opinion in Biomedical Engineering. 5, 1-5 (2018).
- Feng, Y., et al. Mechanosensing drives acuity of αβ T-cell recognition. Proceedings of the National Academy of Sciences of the United States of America. 114 (39), 8204-8213 (2017).
- Spillane, K. M., Tolar, P. DNA-Based Probes for Measuring Mechanical Forces in Cell-Cell Contacts: Application to B Cell Antigen Extraction from Immune Synapses. Methods in Molecular Biology. 1707, 69-80 (2018).
- Stabley, D. R., Jurchenko, C., Marshall, S. S., Salaita, K. S. Visualizing mechanical tension across membrane receptors with a fluorescent sensor. Nature Methods. 9 (1), 64-67 (2011).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397 (6714), 50-53 (1999).
- Hinterdorfer, P., Dufrêne, Y. F. Detection and localization of single molecular recognition events using atomic force microscopy. Nature Methods. 3 (5), 347-355 (2006).
- Sawicka, A., Babataheri, A., et al. Micropipette force probe to quantify single-cell force generation: application to T-cell activation. Molecular Biology of the Cell. 28 (23), 3229-3239 (2017).
- Desprat, N., Guiroy, A., Asnacios, A. Microplates-based rheometer for a single living cell. Review of Scientific Instruments. 77 (5), 055111(2006).
- Labernadie, A., Bouissou, A., et al. Protrusion force microscopy reveals oscillatory force generation and mechanosensing activity of human macrophage podosomes. Nature Communications. 5, 5343(2014).
- Bouissou, A., Proag, A., et al. Protrusion force microscopy: A method to quantify forces developed by cell protrusions. Journal of Visualized Experiments. (136), 57636(2018).
- Kronenberg, N. M., Liehm, P., et al. Long-term imaging of cellular forces with high precision by elastic resonator interference stress microscopy. Nature Cell Biology. 19 (7), 864-872 (2017).
- Basu, R., Whitlock, B. M., et al. Cytotoxic T cells use mechanical force to potentiate target cell killing. Cell. 165 (1), 100-110 (2016).
- Bufi, N., Saitakis, M., et al. Human Primary Immune Cells Exhibit Distinct Mechanical Properties that Are Modified by Inflammation. Biophysical Journal. 108 (9), 2181-2190 (2015).
- Goodnow, C. C., Crosbie, J., et al. Altered immunoglobulin expression and functional silencing of self-reactive B lymphocytes in transgenic mice. Nature. 334 (6184), 676-682 (1988).
- Butler, J. P., Tolić-Nørrelykke, I. M., Fabry, B., Fredberg, J. J. Traction fields, moments, and strain energy that cells exert on their surroundings. American Journal of Physiology. Cell Physiology. 282 (3), 595-605 (2002).
- MBPPlab/TFM_v1: Software for Time dependent Traction Force Microscopy. , Available from: https://github.com/MBPPlab/TFM_v1 (2019).
- Tseng, Q., Duchemin-Pelletier, E., et al. Spatial organization of the extracellular matrix regulates cell-cell junction positioning. Proceedings of the National Academy of Sciences of the United States of America. 109 (5), 1506-1511 (2012).
- ImageJ plugins by Qingzong TSENG. , Available from: https://sites.google.com/site/qingzongtseng/ (2019).
- Plotnikov, S. V., Sabass, B., Schwarz, U. S., Waterman, C. M. High-resolution traction force microscopy. Methods in Cell Biology. 123, 367-394 (2014).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Wang, J., Lin, F., et al. Profiling the origin, dynamics, and function of traction force in B cell activation. Science Signaling. 11 (542), (2018).
- Hui, K. L., Balagopalan, L., Samelson, L. E., Upadhyaya, A. Cytoskeletal forces during signaling activation in Jurkat T-cells. Molecular Biology of the Cell. 26 (4), 685-695 (2015).
- Bashour, K. T., Gondarenko, A., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences of the United States of America. 111 (6), 2241-2246 (2014).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. The Journal of Cell Biology. 183 (6), 999-1005 (2008).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. Journal of Physics. Condensed Matter. 22 (19), 194104(2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。