Method Article
B 림프구 활성화를 연구하는 견인력 현미경 검사법
요약
여기서 우리는 B 세포에 견인력 현미경 실험을 수행하는 데 사용되는 프로토콜을 제시한다. 우리는 연약한 폴리 아크릴아미드 젤의 준비와 그 기능성, 현미경에서의 데이터 수집 및 데이터 분석의 요약을 설명합니다.
초록
견인력 현미경 검사법(TFM)은 기판에 세포에 의해 생성된 힘의 측정을 가능하게 한다. 이 기술은 탄성 기판을 당기는 세포에 의해 생성된 실험적으로 관찰된 변위 필드에서 견인력 측정을 추론합니다. 여기서, 우리는 B 세포 수용체의 항원 참여에 의해 활성화될 때 B 세포에 의해 가해지는 힘 필드의 공간 및 측두구조를 조사하기 위해 TFM을 조정하였다. 겔 강성, 비드 밀도 및 단백질 기능화는 세포 표면 수용체를 위한 리간드에 특별히 반응하는 상대적으로 작은 세포(~ 6 μm)의 연구에 최적화되어야 합니다.
서문
B 세포는 면역 계통의 항체 생성 세포입니다. 적응성 면역 반응을 활성화하기 위해, 그들은 먼저 B 세포 수용체 (BCR)1에게불린 특정 수용체를 통해 네이티브 양식 (즉, 비 처리)에서 항원을 취득한다. 이 과정은 림프절 B 세포 영역에서 발생합니다. 일부 항원림프액을 통해 B 세포에 도달할 수 있더라도, 대부분의 항원, 특히 높은 분자량(림프도관의 한계 크기인 70 kDa)은 실제로 항원 제시 세포(APC)의 표면에 그들의 모국형태로 제시되고, 일반적으로 캡슐 성 대식세포 또는 모낭 세포(fctin) 또는 말낭 세포(fcs) 특이적 세포를 통해 서술하였다. 이 세포와의 접촉은 BCR이 APC 관련 항원에서 힘을 발휘하는 면역 시냅스의 형성으로 이어집니다. BCR에 항원의 결합은 BCR 신호를 개시, 이는 힘 생성 메커니즘을 활성화 할 수 있습니다. 이러한 힘은 BCR 신호를 증폭하는 데 중요할 수 있지만 B 세포가 항원을 추출한 다음 내재화하는 데도 필수적입니다.
최근 연구에 따르면 BCR은 실제로메카노감2입니다. 예를 들어, 딱딱한 기판은 향상된 BCR 신호3을유도합니다. 더욱이, 면역 시냅스에서 생성된 힘은 단일 BcR에서 항원에 대한 친화성을 조사하고 이를 통해 친화력 차별4를보장한다. 따라서 항원 프리젠 테이션에 B 세포의 기계적 반응을 조사하고 이 반응을 연루 된 수용체 유형 (IgG/IgM)5,접착 분자 (인테그린 리간드) 또는 약리학적 및 유전자 변형 세포 (즉, BCR 신호 사이토 의 역학적 또는6)하류의 단백질 하류의 질질에 대해 이 반응을 해부하는 것은 흥미롭습니다.
생리적 강성의 기판에 대한 세포의 반응을 관찰하는 간단한 방법은, 동시에 기판에 가해지는 연구력은 견인력 현미경검사법(TFM)이다. TFM은 탄성 기판을 당기는 세포에 의해 생성된 변위 필드를 관찰하는 것으로 구성된다. 원래 겔의 변형은 위상 대비 현미경검사법 7에의해 흉골 자체의 주름을 통해 관찰되었지만, 형광 마이크로비드를 수탁마커로 삽입하여 더 나은 분해능을 허용하고 이후 표준8이되었다. 이 방법은 부착 세포, 조직, 심지어 젤에 내장 된 오르가노이드에 의해 가해지는 견인력을 조사하는 데 사용되었습니다. TFM의 여러 변형은TIRF 현미경검사법(12)을허용하기 위해 젤의 굴절지수 변형, 나노 인쇄패턴(13)에의해 구슬을 대체하고, 평평한표면(14)대신 나노필라를 사용하는 등, 과해상도 현미경검사(즉, STED10 또는 SRRF11)와결합하여 9개개발되었다. 이러한 변형에 대한 전체 검토는 콜린 요크 외15를참조하십시오.
여기에 제시된 프로토콜은 항원 코팅 기판에 B 세포에 의해 가해지는 힘을 측정하는 절차를 설명합니다. 이들 힘은 리간드(antigen)에 적용되어 이를 클러스터링하고 그 후 항원 제시 기판으로부터 추출한다. 우리는 생리항원 제시 기질의 강성, B 세포에 대한 크기 및 관련 코팅의 강성을 모방하기 위해 표준 TFM 프로토콜을 조정했습니다. 이 프로토콜은 동시에 여러 세포의 연구를 허용하고 형광 현미경 기술 및 화학 적 치료와 함께 사용할 수 있습니다. 그러나, 광학핀셋(16),분자 장력프로브(17,18),생체멤브레인프로브(19)및 원자력현미경(20)이 더 적합한 기술인 단일 분자 힘 측정을 조사하는 것을 목표로 하지 않는다. TFM은 다른 단일 세포력 측정 방법(예를 들어, 마이크로피펫 21 또는마이크로플레이트(22)과비교하여 ~300nm의 해상도로 시냅스에서 가해지는 힘의 완전한 맵을 재구성할 수 있게 한다. 이것은 표면에 가해지는 힘에 있는 주걱 측두패턴을 확인하고, 젤이 공초점 화상 진찰과 호환되기 때문에, 특정 단백질의 모집과 그(예를 들어, 사이토스켈레톤 및 신호 단백질)의 모집과 상관관계를 관련시키는 것이 유용하다.
3D TFM은 가능하지만 사용된 강성 및 설정과 호환되지 않습니다. 3D의 변형은 돌출력 현미경검사(AFM스캐닝 세포가 도금되는 변형형 멤브레인)과 같은 다른 보다 복잡한 설정에 의해 달성가능하며,23,24 및 탄성 공진기 간섭 응력 현미경검사(ERISM, 젤은 빛을 위한 공명 캐비티 역할을하고, 나노계 의정확도로 기체의 변형을 강조하는 젤). 이 기술은 아주 유망하더라도, 그(것)들은 아직 B 세포에서 채택되지 않았습니다. 나노 기둥(14)과같은 다른 유형의 TFM은 더 재현 가능한 기판을 갖는 데 사용될 수 있습니다. 그러나, 이 형상은 세포가 분석을 복잡하게 하는 기둥을 관통하기 때문에 연약한 세포에 적응되지 않습니다. 이 접근법은 실제로기둥(26)을중심으로 구조물을 구축하는 세포의 능력을 관찰하기 위해 T 세포에서 사용되었습니다.
단순함에도 불구하고, 폴리 아크릴아미드 젤을 사용하는 TFM은 많은 세포의 동시 관찰을 허용하고 벤치와 에피플루오렌스 현미경이 장착 된 모든 실험실에서 쉽고 저렴하게 구현 될 수 있습니다 (우리는 공초점 / 회전 디스크를 권장하지만).
APC의 생리적 강성을 모방하기 위해 ~ 500 Pa27의 강성을 가진 폴리 아크릴아미드 젤을 사용하고 항원 활성화로 젤을 기능화했습니다. 이 프로토콜에서, 우리는 암탉 계란 리소지메 (HEL)와 폴리 아크릴 아미드 젤의 표면을 기능화. 이를 통해 항원 결합 부위의 교전을 통해 BCR의 자극에 의해 생성된 힘을 측정할 수 있다. MD4 마우스로부터 이러한 항원 및 HEL 특이적 B 세포의 사용은 항원결찰(28)에반응하여 상대적으로 균일한 힘 생성을 보장한다. 그러나, 다른 분자(예: B6 마우스에 대한 안티-IgM)는 겔상에 이식될 수 있지만, 이러한 경우에 생성된 힘은 더 이질적이고 덜 강렬할 수 있다. B 셀은 작은 세포 (직경 ~6 μm) 때문에 구슬의 수는 최대하지만 여전히 추적 할 수 있도록 최적화되었습니다. 기판에 ~kPa 힘을 발휘하는 큰 세포의 경우, 상대적으로 희소한 구슬을 사용하거나 변형 필드를 재구성하기 위해 간단한 입자 이미지 속도 측정(PIV)을 수행하여 만족스러운 결과를 얻을 수 있다. 그러나, ~50Pa만큼 작은 응력을 발휘하는 B 림프구와 같은 작은 세포의 경우, 변형 필드를 재구성할 때 원하는 정확도를 달성하기 위해 단일 입자 추적(입자 추적 속도, PTV)의 사용이 요구된다. 구슬을 개별적으로 안정적으로 추적하려면 객관적인 렌즈의 배율은 최소 60배 이상이어야 하며 수치 조리개는 약 1.3이어야 합니다. 따라서, 젤은 상대적으로 얇은 (&50 μm) 여야 하며, 그렇지 않으면 비드가 목표의 작업 거리 이상으로 보이지 않는다.
주요 프로토콜은 젤 제제, 젤 기능화 및 이미징의 세 가지 섹션으로 구성됩니다. 2개의 추가 단면도는 선택사항이고 형광 세포의 항원 추출 정량화 및 화상 진찰에 전념합니다.
프로토콜
1. 젤 준비
- 젤 지지의 실라화
- 2 분 동안 UV 램프 (잔류 오존에 노출되지 않도록 UV 램프에 노출하기 전에 30 초 기다립니다)와 커버 슬립 또는 유리 바닥 페트리 접시 (젤 지지체로 사용됩니다)를 활성화합니다.
- 200 μL 아미노프로필트리메톡실레인(APTMS)을 5분 동안 사용하여 커버슬립/유리 바닥 접시를 실란화합니다. 이것은 젤의 공유 결합에 대한 지원을 준비할 것입니다.
- 커버슬립/유리 바닥 접시를 초순수물로 철저히 씻으십시오.
- 진공 포부를 사용하여 커버슬립/유리 바닥 접시를 말리십시오.
- 젤을 평평하게 하는 데 사용되는 18mm 커버슬립 준비
- 커버립을 준비하려면 먼저 세라믹 커버슬립 홀더에 넣습니다. 그런 다음 커버슬립 홀더를 작은 비커(50mL)에 넣고 실리콘화 시약(4°C에 저장됨, 재사용 가능)을 커버립 위에 부어 완전히 덮어야 합니다.
- 비커를 알루미늄 호일로 덮고 실온에서 3분 동안 배양합니다. 기다리는 동안, 초순수물로 큰 비커(500mL)를 채웁니다. 실리콘 시약에서 3 분 동안 인큐베이션을 한 후 커버슬립 홀더를 커버립으로 물 비커로 옮기습니다.
- 커버립을 초순수물로 철저히 헹구고 잘 말리고 종이 물티슈를 보관하십시오. 최상의 결과를 얻으려면 즉시 다음 섹션으로 이동합니다.
- 젤 중합화
- 0.5 kPa의 젤의 경우, 40% 아크릴아미드의 75 μL과 30 μL의 2% 비사크라이알라미드(크로스링커) 및 인산완충식식(PBS)의 895 μL을 혼합한다. 이 프리믹스는 4°C에서 최대 1개월 동안 보관할 수 있다.
- 0.5 kPa 젤 프리믹스의 167 μL에, 1%(1.67 μL)를 욕조 초음파처리기(50-100W및 주파수 40kHz의 전력을 갖춘 표준 벤치 초음파 청소기)에 5분 동안 구슬, 소용돌이 및 초음파 처리합니다. 알루미늄 호일을 사용하여 빛으로부터 믹스를 보호하십시오.
참고: 프리믹스는 이시화기(TEMED)가 추가될 때까지 중합되지 않습니다. - 중합화를 촉매하려면 10%의 1%(1.67 μL)를 10%w/v 암모늄 감산(APS)을 추가합니다.
- 중합을 시작하려면 0.1% (0.2 μL) N,N,N,N,N,N,N',N′-테트라메틸레틸렌디아민(TEMED)을 추가합니다. 파이펫과 섞으세요. APS와 TEMED가 추가되면 겔은 빠르게 중합되므로 젤 주조로 빠르게 진행됩니다.
- 젤 주조
- 각 커버슬립/유리 바닥 접시에 젤 믹스의 파이프 9 μL(중앙에 드롭, 도 1A)
- 사멸/소수성 커버슬립을 놓고 젤을 평평하게한다(도 1B). 집게를 사용하여 커버슬립을 눌러 젤이 누출되기 시작할 때까지 커버슬립(도1C)의전체 영역에 걸쳐 젤이 퍼지도록 합니다.
- 커버슬립/유리 바닥 접시를 큰 페트리 접시에 넣고 벤치에 두드려 구슬이 젤 표면으로 향하도록 강요합니다(그림1D).
- 알루미늄 호일로 덮고 습한 챔버에서 실온에서 중합하기 위해 1 h를 둡니다 (즉, 증발을 방지하기 위해 접시 위에 젖은 조직을 놓습니다).
- 1시간 후, 커버슬립 방출을 용이하게 하기 위해 샘플에 PBS를 추가합니다. 조심스럽게, 바늘을 사용하여 커버 슬립을 제거 (다른 실레인 코팅은 젤에서 커버 슬립의 쉽게 벗겨 수 있도록해야한다, 도 1E).
- 젤을 PBS에 둡니다.
참고: 젤은 이제 5-7일 동안 4°C에서 PBS에 저장할 수 있지만 48시간 이내에 사용하는 것이 좋습니다.
2. 젤 기능화
- 설포스치니미딜 6-(4'-아지도-2'-니트로페닐아미노)헥사노아테(Sulfo SANPAH) 용액을 10m HEPES 버퍼에서 0.5 mg/mL로 준비한다. 이것은 최대 1 주일 동안 알루미늄 호일로 덮인 4 °C에서 저장할 수 있습니다.
- 젤에서 PBS를 흡인.
- 실온(도1F)에서젤에 설포 SANPAH의 150 μL을 첨가합니다.
- 젤을 UV 치료에 2분 동안 노출시켜 Sulfo SANPAH 부위를 광활성화시키고 젤 표면에 달라붙게 한다.
- PBS로 세 번 세척하십시오(그림1G).
- 2.2-2.5 단계를 반복합니다.
- 각 젤에 250 μL(100 μg/mL)을 추가하고 알루미늄 호일(도1H)으로덮여 있는 동안 밤새 4°C의 습한 챔버에서 하룻밤 동안 배양합니다.
- HEL 항원을 제거하고 PBS로 세 번 세척하십시오.
참고: HEL은 항원및 접착 분자로서 모두 작용합니다. 그것은 수용체에 결합하는 다른 분자로 대체 될 수있다 (예를 들어, 안티 마우스 IgM, 소혈송 알부민, Ovalbumin) 또는 integrin 리간드로 혼합 (예를 들어, LFA1 결합 ICAM1). 필요한 경우, 항원 추출은 HEL의 형광 버전으로 관찰될 수 있다(단백질 라벨링 키트로 분자를 염색함으로써 얻어져, 4단계를 참조하십시오). 대량으로 주어진 농도는 유리와 동일한 표면 농도를 산출하지 않을 수 있습니다: 직접 비교가 필요한 경우 이차 염색으로 정량화될 필요가 있습니다.
3. 셀 로딩 및 이미징
- 이미징하기 전에 젤에서 PBS를 제거하고 B 세포 매체의 500 μL을 추가합니다 (RPMI 1640, 10% 변형된 태아 송아지 혈청, 1% 페니실린-연쇄절제술신, 2% 나트륨 피루바테, 50uM 메르카포에타놀 및 1X 비필수 아미노산)을 추가하여 RT에 평형을 허용합니다.
- 세포 준비
- 음의 선택 프로토콜에 따라 비장에서 1 차 B 세포를 정화합니다(재료 표참조). 일반적인 최종 B 세포 수율은 약 1 x 107 세포입니다. 이를 B 세포 배지에 3 x 106 세포/mL로 농축합니다(RPMI-1640은 태아 종아리 혈청 10%, 페니실린-연쇄 절제술, 0.1% 메르카포에탄올 및 2% 나트륨 피루바테)로 보충한다.
- 4°C에서 최대 6시간 동안 필요에 따라 셀을 저장합니다.
- 이미지를 수집하기 전에 30분 동안 셀을 37°C로 유지하십시오.
- 이미징
- 열 및 (아마도) CO2 제어와 공초점 현미경을 사용합니다.
참고: 공초점 또는 회전 디스크 현미경이 사용되는지 여부에 관계없이 픽셀 크기 및 200 nm가 분석 단계에서 구슬을 편안하게 추적 할 수있는 목표 /핀홀을 사용하는 것이 중요합니다 (예 : 60x, NA 1.3). 에피플루오렌스 현미경 검사법은 또한 사용될 수 있습니다, 그러나 그것은 소음 비율에 더 낮은 신호를 제공하고 개별 비드 추적을 어렵게 만들 수 있습니다. - 구슬의 두 가지 주요 층은 젤의 바닥과 상단에 나타납니다. 젤 평면에 집중하십시오.
참고 : 좋은 젤은 별이 빛나는 하늘로 나타납니다, 구슬은 약 균일하게 같은 평면에 배포와 함께. - 5s의 프레임 속도로 30 분 동안 획득 을 프로그래밍 (이것은 실험의 요구에 적응 할 수 있습니다, 예를 들어, 다른 색상을 취득, z 스택을 취득, 등)
- 젤에서 미디어를 흡인하여 약 200 μL의 젤을 남깁니다. 현미경에 젤을 배치하고 구슬의 표면 층과 젤에 좋은 짝수 영역을 찾을 수 있습니다.
- 세포의 80 μL을 추가 (초점을 유지하기 위해 젤을 만지지 마십시오).
- 초점이 여전히 정확하고 세포가 해당 영역(전달된 빛 아래)에서 내림차순으로 보이는 것을 볼 수 있는지 확인합니다. 세포가 젤에 도달하기 전에 인수를 시작합니다.
- 젤, 진동 또는 초점 드리프트와 우발적으로 접촉하는 경우 초점을 조정합니다.
참고 : 편안한 젤의 이미지를 수집하는 것이 중요하며 이것은 젤에 세포가 도착하기 전에 촬영 한 모든 이미지가 될 수 있습니다.
- 열 및 (아마도) CO2 제어와 공초점 현미경을 사용합니다.
4. 형광 HEL 추출 실험
- 형광염염료(Alexa 555와 같은 구슬과 다른 색)를 결합하여 형광 헬을 준비하여 재료의 표를참조하십시오.
- 2.7 단계에서, 종래의 HEL을 형광 헬로 교체한다.
- 사진 표백을 피하기 위해 조명 설정이 낮거나 프레임 속도가 낮은 이미지를 획득합니다(예: 분당 2프레임).
- HEL 추출을 정량화하기 위해, 수식에 따라 프레임 0의 강도 I(0)에의해 수정및 정규화된 각 프레임 I(t)에 대한 셀 영역에 통합된 강도를 계산합니다.
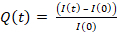
참고: 형광소로 공주된 항원(겔 표면에서 형광로소의 담금질로 인해)은 보이지 않지만, 젤상에 그 존재는 항헬및 형광이차 항체로 확인할 수 있다. 형광소가 실제로 형광성임을 확인할 수 있으며, 반대로 HEL로 코팅된 커버슬립으로 젤에서 분리하여 이차 형광 항체(coverslipon)6으로드러나고 있다. 추출된 항원의 신호는 매우 어둡고 때로는 구슬의 누출로 가려집니다. 항원 추출에만 관심이 있는 경우, 구슬 없이 젤을 준비하는 것이 좋습니다(1.3.2 단계 및 1.4.3단계를 건너뛰는 것이 좋습니다).
5. 형광 화상 진찰
- 야생 형(예를 들어 Lifeact-GFP 또는 Myosin II GFP 마우스로부터)을 위해 수행된 유전자 변형 마우스의 비장으로부터 B 세포를 정화하여 형광 B 세포를 얻습니다.
- 이미징 형광 세포의 경우, 물 침지 장거리 40x-100x 목표를 가진 회전 디스크 현미경을 사용하십시오.
- 표백을 피하기 위해 노출 지속 시간과 프레임 속도를 낮게 유지합니다.
참고: Z의 포인트 스프레드 기능은 젤의 존재에 의해 매우 저하되므로 물 침수 목표를 사용하는 것이 좋습니다. 수분 담그기 목표와 직립 현미경 검사법은 배출 경로에 (구형) 세포 (및 세포 핵)의 존재에 의해 유도 된 강한 구형 수차를 앓고.
6. 분석
참고: 데이터 분석은 일반적으로 드리프트를 위한 전체 스택을 수정하고, 각 프레임에서 구슬을 찾고, 기준 프레임(세포가 없는 경우 촬영)에 대하여 그들의 움직임을 추적하고, 변위 필드를 보간하고, Fourier transform29를사용하여 스트레스를 얻기 위해 문제를 반전시킴으로써 수행됩니다. 이를 위해 온라인 리포지토리30에서다운로드할 수 있는 ImageJ 매크로 및 MATLAB 프로그램의 조합을 사용하는 것이 좋습니다.
- 이미지 스택으로 ImageJ에서 영화 열기
- 매크로 "Crop_and_save.ijm" 실행
- "사각형" 도구를 사용하여 관심 영역(ROI)을 선택하고 't' 키를 사용하여 ROI 목록에 추가합니다.
- 셀을 자르는 경우 최소 5-10픽셀의 비드 영역을 포함해야 합니다. 경계에 너무 가까운 셀이나 다른 셀에 대한 셀을 분석에서 제외합니다. 완료되면 'OK'를 클릭합니다.
- 매크로는 셀의 마스크를 제안합니다: 이것이 "OK"를 클릭하면. 만족스럽지 않은 경우 "안 확인 안"을 클릭한 다음 선택 도구(예: "Freehand" 또는 "Oval")가 있는 닫힌 지역을 수동으로 선택하고 "계속"을 클릭합니다.
- MATLAB을 열고 "TFM_v1.m"실행합니다.
- 필요한 매개 변수 입력: 특히 이미지 특성(픽셀 크기, 획득 시간 간격) 및 겔 속성(영 계수 E, 푸아송 비율)을 확인합니다.
- 참조 이미지는 기본적으로 첫 번째 이미지로 설정됩니다. 필요한 경우 다른 프레임으로 설정하거나 외부 파일을 로드하려면 "0"으로 설정합니다.
- 원본 파일과 동일한 디렉터리에서 소프트웨어의 출력을 찾습니다(설명의 경우 User_notice.pdf 파일 참조). 여기에는 비드("FILENAME.fig"), 시간이 지남에 따라 수축 에너지의 플롯("FILENAME_energy.fig"), 셀(에너지, 지역, 모멘트 등) "FILENAME_finaltable.mat", 변위 및 포스 필드를 포함하는 구조, 비드의 영화, 변위 필드, 스트레스 및 에너지(모든 판독기와 함께 열 수 있음)의 예비 트랙이 포함됩니다.
참고: 입력 매개 변수에서 "창 크기"는 변위가 보간되는 창이므로 응력 및 변위 필드의 최종 해상도입니다. 이 픽셀은 기본적으로 4픽셀로 설정됩니다. 구슬이 없는 지역을 보간하여 인위적으로 해상도를 증가시키는 것은 바람직하지 않습니다.
결과
세포의 크기를 감안할 때, 상관 관계 기술 (예 : 입자 이미지 속도 측정)을 통해 구슬의 변위 맵을 추출하는 알고리즘은 일반적으로 매우 정확하지 않습니다. 그러나 필요한 해상도의 정도에 따라 무료 피지 /ImageJ 플러그인31,32를사용하여 질적 결과를 쉽게 얻을 수 있습니다. 이 방법은 자극과 비 자극 조건을 비교하기에 충분하지만, 철저한 분석을 위해 우리는 개별적으로 구슬을 추적하고 개별 비지 변위(33)의보간으로 주어진 시점에서 변위 필드지도를 제공하는 온라인 저장소30에서다운로드 할 수있는 소프트웨어를 사용하는 것이 좋습니다 철저한 분석을 위해. 이 시점에서 몇 가지 정량화가 가능합니다. 예를 들어(변위가 젤 표면에 대한 응력 접선에 의해서만 발생한다고 가정하여) 소프트웨어는 또한 특정 변위 맵을 일으키는 각 지점에서 응력도 제공한다. 이것은 "반전 문제"의 유형입니다 : 특정 지점에서 변위는 다른 지점에 적용되는 모든 힘의 합계에 따라 달라집니다. "반전 알고리즘"은 기판의 물리적 매개 변수를 고려합니다: 강성(Young modulus) 및 푸아송 비율. 직접 알고리즘은 일반적으로 매우 정확하지만 계산 비용이 많이 듭니다. Fourier 변환을 기반으로 하는 알고리즘은 우리처럼 Fourier 공간에서 본질적으로 감소를 수행하며 보다 효율적이지만 일부 오류(주로 보간 단계로 인한)가 발생하기 쉽습니다. 이러한 알고리즘은 일반적으로 작은 로컬(및 잠재적으로 관절상) 변위를 방지하는 매개변수의 튜닝이 스트레스 필드의 계산에 너무 관련성이 되도록 해야 합니다(Tikhonov 정규화 매개변수8,29; 대화 창에서 "정규화" 변수; 여기서는 일반적으로 5 x 10-19와동일하게 설정됩니다.). spatio-측두성 상관 관계, 지역 이동, 형광 채널과의 상관 관계와 같은 보다 진보된 해석 및 분석을 위해 해당 분야의 전문가와 협력하는 것이 좋습니다. 계산 방법에 대한 검토는 슈바르츠 외9를참조하십시오.
위에서 언급했듯이 올바른 비드 이미지는 밝은 반점의 균일하고 무작위 분포인 "별이 빛나는 하늘"처럼보입니다(그림 2A). 데이터 및 분석은 구슬의 수가 너무 낮거나(도2B)또는 이미지가 초점이 부족할 때 신뢰할 수 없습니다(그림2C). B 세포가 젤 표면에 정착되면, 세포 아래의 구슬은 젤의 세포에 의해 가해지는 견인력으로 인해 움직이기 시작합니다. 구슬을 추적할 수 없는 프레임을 폐기해야 합니다.
검사로서, "기준 프레임"을 비교하는 구슬의 움직임을 눈으로 관찰할 수 있으며, 전형적으로 기판과 세포의 첫 번째 접촉 앞에 있는 것이가능하다. 대략적인 결과는 도 3A에서수행된 단일 입자 추적(예를 들어, 트랙메이트, 피지 34)에서얻을 수 있다. 분석은 참조 이미지("FILENAME.fig")에서 구슬의 분할을 컨트롤로 제공합니다.
우리가 제안하는 소프트웨어를 사용하면 변위(도 3B)및 응력 필드 (변위 필드, 도 3C로부터의 반전에 의해 얻어진 각 픽셀 및 각 시간 지점에서 로컬 응력의 벡터)를 얻을 수 있습니다. 셀의 영역에 통합된 변위 및 포스 필드의 스칼라 제품은 기판상에 셀에 의해 가해지는 총 작업을제공한다(도 4A). 이 계산은 프로토콜의 6.2 단계에서 도입된 셀의 마스크가 필요합니다.
두 가지 생물학적 조건(HEL 활성화 대 비활성화 기질 BSA, 또는 야생형 대 녹아웃)을 비교하기 위해, 에너지가 고원에 도달하는 마지막 시간 포인트(20분)에 걸쳐 평균 값을 계산하는 것이 유용하다(도 4C). 힘의 공간 정보가 관련성이 있을 때 각조건(도 4D)의단일 시간점을 비교할 수 있다. 더 깊은 분석을 위해 Kumari 외6을 참조하십시오.
형광 항원 추출 시간 경과의 예는 도 5A에도시된다 : 시냅스에서 형광 신호의 점진적 출현은 젤에서 항원 분리를 나타냈다. 15개 셀을 넘는 신뢰 구간(평균오차 기준)을 가진 평균 추출 곡선은 도 5B에도시된다.
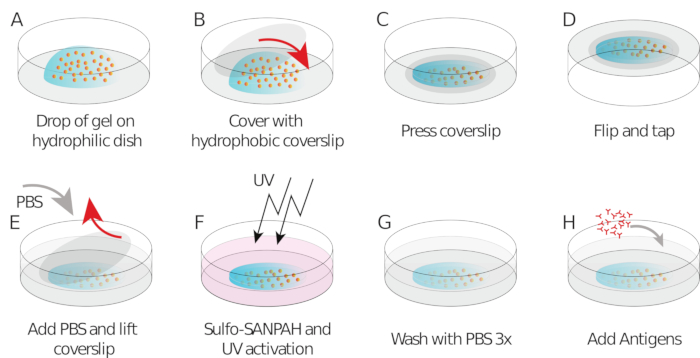
도 1: 젤의 제제 및 기능화를 나타내는 회로도. 단계는 프로토콜에 설명되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: 서로 다른 특성의 비드 이미지의 세 가지 예. (A)올바른 신호대 노이즈 비 및 올바른 밀도를 가진 비드 이미지의 예. (B)비드의 수가 너무 부족한 이미지의 예와(C)초점 평면에서. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
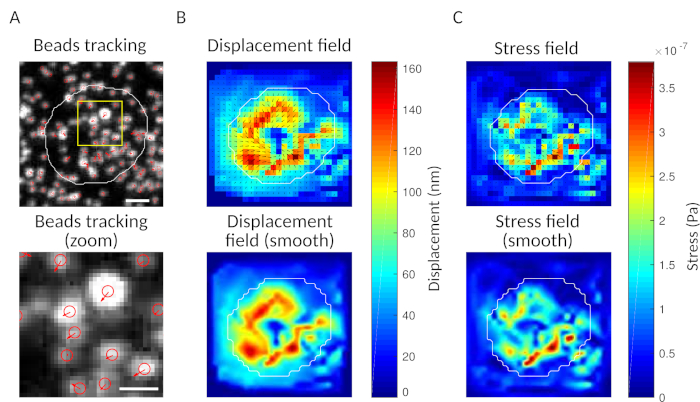
도 3: 힘 필드를 추출하는 이미지의 처리. (A)구슬의 이미지(백신의 윤곽선, 전송 이미지에서 추출), 비드 트래킹 시간 t = 5분(적색 오버레이) 및 변위(화살표)의 예는 t=0분(스케일 바 5 μm)에 상대한다. (B)보간 변위 필드 (벡터 떨림 및 크기맵으로 표현, 화살표는 변위 [nm]에 비례; 오른쪽에있는 색상 막대를 참조하십시오); 아래쪽: 크기의 부드러운 이미지(이중 입방 함수를 가진 보간에 의해 얻어짐). (C)패널 B의 변위 필드에서 응력 필드(벡터 떨림 및 크기 맵으로 표현됨; 화살표는 전단 응력 [Pa]에 비례하며, 오른쪽의 색상 막대를 참조하십시오); 아래쪽: 크기의 부드러운 이미지(이중 입방 함수를 가진 보간에 의해 얻어짐). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
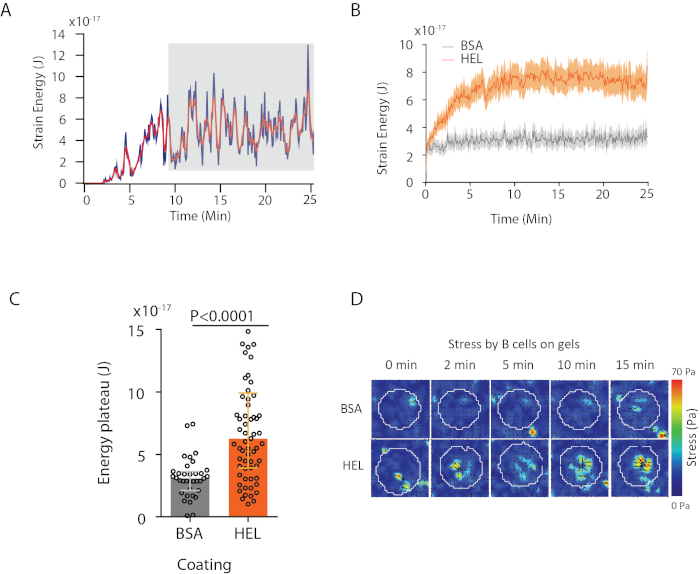
도 4: 힘 및 변위 필드에서 추출할 수 있는 정보의 예. (A)단일 셀에 대한 시간에 에너지의 진화의 예: 고원상(회색으로 강조표시)은 약 10분 후에 나타난다.(B)평균 에너지 곡선및(C)상대 고원 레벨의 HEL(활성화) 코팅젤 및 35세포에 코팅된 겔 및 35세포(비활성화) 코팅겔(중앙± 간수량 범위, Mann-Whitney 시험은 통계적 유의성을 위해 사용되었다). (D)HEL 및 제어 BSA 조건에 대한 스트레스의 시간 경과 색상지도; 크기와 떨림 플롯이 모두 표시됩니다. 이러한 이미지는 쿠마리 등에서적응되었습니다. 6. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
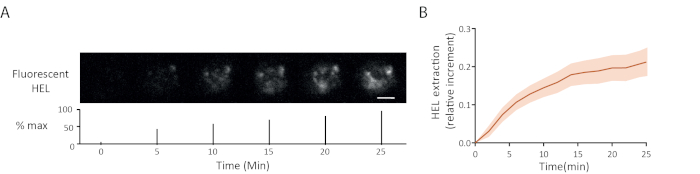
도 5: 형광 항원을 가진 실험의 예. (A)형광 HEL의 추출의 시간 경과 (아래: 최대의 백분율, 스케일 바 = 3μm). (B)시간이 지남에 따라 항원 수집 (평균 ± SEM, n = 15). 이러한 이미지는 쿠마리 등에서적응되었습니다. 6. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기서 설명된 TFM 방법은 B 세포의 활성 기계적 능력에 대한 체계적인 연구를 가능하게 한다. B 세포의 맥락에서, 이것은 항원 추출 및 내산화 능력과 관련이 있다. 다른 TFM 방법에 비해, 여기에 제시된 프로토콜은 간단하고 오히려 재현할 수 있습니다: 유리 마이크로스피어의 들여쓰기및 Hertz 모델을 사용하여 측정된 강성은 400~600 Pa. 유사한 프로토콜이 B세포(35)뿐만 아니라 T세포(36)에도성공적으로 사용되었다. 나노필라오스(T림프구(37)에비해 평평한 균일한 표면을 제공하므로 겔의 상호작용이 주로 표면에 접선으로 제한됨에 따라 해석이 용이하다.
우리가 설명한 프로토콜은 항원 제시 기판에 B 세포에 의해 가해지는 힘의 현면역학에 접근을 제공합니다. 공간 수준에서 이것은 힘의 국소화에 대한 정보를 제공하고, 형광 현미경 검사법과 함께, 실험자가 특정 분자의 존재와 지역 세력의 상관 관계를 가능하게한다 (즉, 세포 골격 또는 BCR 신호 캐스케이드의 구성 요소). 시간 적 수준에서, 수량(예: 총 에너지 또는 총 응력)을 통합하여 시간당 하나의 값을 제공하고 소음을 줄일 수 있습니다. 이를 통해 제시간에 견인력의 진화(성장 및 고원)와 맥동 패턴의 존재를 관찰할 수 있습니다.
분석에 대한 중요한 실험 적 측면은 다음과 같이 설명됩니다. (i) 세포 밀도: 올바른 분석을 수행하려면 세포가 충분히 분리되어야 합니다. 셀이 주변에 자체 크기의 빈 영역이 있는 경우 셀을 분석할 수 있다고 고려합니다. (ii) 전송 영상: 실험 중에 세포의 적어도 전송 영상을 수집하여 분석에서 마스크로 사용하는 것이 좋습니다. (iii) 이미지의 구슬 수: 시냅스의 구슬 수가 30에서 200(즉, 1-8 구슬/μm²) 사이인 이미지만 분석하는 것이 좋습니다. 밀도가 낮을 때 적절한 맵 변위 재구성이 허용되지 않습니다. 비드 밀도가 높음으로 단일 파티클 추적이 불안정해집니다. (iv) 실험 중에 구슬 의 수는 일정해야 한다; 그러나, 변동은 화상 진찰 조건 (특히 서로 너무 가까운 구슬에서) 화상 진찰 조건에서 작은 가변성 때문에 생길 수 있습니다. 포커스 드리프트가 발생하면 수정해야 하며 문제가 있는 프레임을 폐기해야 합니다. (v) 젤 품질: 너무 많은 균열을 가진 젤, 구슬 분포또는 너무 두꺼운 젤의 가변성은 버려야 합니다. (vi) 세포 유형에 따라, 반복 된 노출 후, 늦은 시간 지점에서 세포 (>300 프레임) 광독성 효과를 겪을 수 있습니다. 데이터와 비교할 "기준선"으로 세포가 없는 마스크에서 프로그램을 실행하는 것이 좋습니다. 이것은 실험 조건으로 인한 노이즈 레벨의 크기를 제공합니다.
고전적인 접착력에서 견인력을 측정하는 데 사용되는 젤은 초점 접착(액틴 흐름 및 신호 분자 모집)에서 발생하는 공정의 조사를 가능하게 합니다(힘이38,39로적용되는 지점). 그러나 시냅스의 힘은 초점 접착을 통해 적용되지 않습니다. B 세포 면역 시냅스에서의 힘 발생의 현면 패턴은 최근까지 이 방법을 사용하여 정량적으로 조사되지 않았다. TFM을 사용하여, 우리는 우리의 최근 연구6에서제시된 바와 같이, B 세포 면역 시냅스에서 힘 패터닝을 처음으로 관찰, 림프구의 연구에 격려 관점을 열어.
특히, 이 방법은 겔상에 셀이 도착하기 전에 촬영한 이미지를 힘 계산에 대한 기준 이미지로 채용한다. 일반적인 TFM 프로토콜은 트립신으로 세포를 분리 한 후 실험의 끝에 참조 이미지를 취하는 것이 좋습니다. 이를 통해 실험자는 세포가 풍부한 영역을 찾을 수 있습니다. 이것은 여기에서도 가능하지만 트립신은 항원 코팅 젤에서 B 세포를 분리하는 데 다소 비효율적이며, 분리를 위해 오래 기다려야하며 겔 변형 및 움직임의 위험 (전체 데이터를 악용 할 수 없게 함)이 더 높습니다.
여기에 제시된 방법은 유연하고 다른 단백질을 젤 표면에 접목할 수 있으므로 면역 시냅스에서 다른 신호의 효과를 연구하도록 적용할 수 있습니다(예를 들어, 인테그린 리간드 및 면역글로불린이 테스트되었습니다)과 형광 항원(섹션 4 참조). 더욱이, 세포는 약물 치료 및 국부적 혼란을 위한 실험자가 접근할 수 있습니다. 마지막으로, 이 방법은 이미징 고정 셀과도 호환됩니다. 이러한 관찰을 위해, 커버 슬립에 젤을 만드는 것이 좋습니다, 세포를 얼룩, 슬라이드에 커버 슬립을 접착제 와 마운팅 미디어와 다른 커버 슬립을 추가. 관찰은 젤을 통해 이미지의 저하를 피하기 위해 상단에 젤로 수행됩니다.
가능한 함정은 중합 및 코팅내젤의 가변성이다. 중합 문제는 주로 이시화기/촉매의 품질 에 기인한다. 또한, 겔은 특히 조립 직후 사용하지 않을 경우 팽창할 수 있습니다. 이 문제는 겔의 기계적 특성에 극적으로 영향을 미치지 않는 것처럼 보이지만 비드 층을 목표에 도달할 수 없게 하여 젤을 효과적으로 쓸모없게 만들 수 있습니다. 이 문제가 나타날 때 각 조건에 대해 추가 젤을 준비하는 것이 좋습니다. 코팅에는 일정한 가변성이 있을 수 있으며, 신선하게 희석된 Sulfo SANPAH를 갖는 것이 중요합니다.
결론적으로, 우리는 BCR 리간드에 의해 활성화될 때 면역학적 시냅스에서 B 세포에 의해 가해지는 힘을 측정하는 간단하고 저렴하며 재현 가능한 방법을 설명했습니다. 적절한 수용체 리간드를 사용하여 다른 리간드 및 다른 종류의 림프구(메모리 B 세포, T 세포 등)에 대한 반응을 연구하도록 조정할 수 있다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 중요한 독서에 대한 M. 볼거 - 먼로감사와 이미지 수집 및 퀴리 동물 시설에 대한 지원을 위해, 프랑스 - 바이오 이미징 국가 연구 인프라의 회원, 파리, Institut Curie, 파리, 니콘 이미징 Center@CNRS - 인스티투트 큐리와 PICT-IBiSA를 인정합니다. PP는 CNRS에 의해 지원되었다. AK와 JP는 파리 데카르트 박사 펠로우십과 에콜 닥터탈 파이어-프로그램 베텐쿠르의 지원을 받았습니다. 이 프로젝트는 PP (ANR-10-JCJC-1504-Immuphy)와 AMLD (ANR-PoLyBex-12-BSV3-0014-001, ERC-Strapacemi-GA 243103)에 대한 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethoxysilane (APTMS) | Sigma-Aldrich | 281778 | Store aliquoted, protected from humidity |
| 40% Acrylamide Solution | Biorad | 1610140 | |
| Alexa555 microscale protein labeling kit | Molecular Probes | A30007 | |
| Ammonium Persulfate (APS) | Sigma-Aldrich | A3678 | |
| B cell Isolation Kit, Mouse | Miltenyi Biotec | 130-090-862 | |
| B-mercaptoethanol | Gibco | 31350-010 | |
| 2% Bis Solution | Biorad | 161-0142 | |
| Bovine Serum Albumin (BSA) | Euromedex | 04-100-812-C | |
| Coverslip 18mm | VWR | 631-1580 | |
| Fetal calf serum | PAA | A15-151 | Decomplemented (40min @56°C) |
| Fluorodishes FD35 | World Precision Instruments, Inc | FD35100 | |
| Fluosphere: carboxylate-modified, 0.2um, dark red | Molecular Probes | F8807 | |
| Hen Egg Lysozyme | Sigma-Aldrich | L6876 | Stocked in aliquote 100mg/ml |
| MEM Non-Essential Amino Acids Solution (100X) | Thermofisher/Gibco | 11140035 | |
| N,N,N',N'-tetrametiletilendiammine (TEMED) | Euromedex | 50406-B | |
| PBS (Phosfate Buffer Saline) | Gibco | 10010-015 | |
| Penicillin–streptomycin | Gibco | 15140-010 | |
| RMPI 1640 – Glutamax I | Thermofisher | 61870-010 | |
| Sigmacote | Sigma-Aldrich | SL2 | |
| Sodium pyruvate | Gibco | 11360-039 | |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate (Sulfo-SANPAH) | Thermo Scientific | 22589 |
참고문헌
- Yuseff, M. -I., Pierobon, P., Reversat, A., Lennon-Duménil, A. -M. How B cells capture, process and present antigens: a crucial role for cell polarity. Nature Reviews. Immunology. 13 (7), 475-486 (2013).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. The Journal of Cell Biology. 216 (1), 217-230 (2017).
- Shaheen, S., Wan, Z., et al. Substrate stiffness governs the initiation of B cell activation by the concerted signaling of PKCβ and focal adhesion kinase. eLife. 6, (2017).
- Natkanski, E., et al. B cells use mechanical energy to discriminate antigen affinities. Science. 340 (6140), 1587-1590 (2013).
- Wan, Z., Chen, X., et al. The activation of IgM- or isotype-switched IgG- and IgE-BCR exhibits distinct mechanical force sensitivity and threshold. eLife. 4, (2015).
- Kumari, A., Pineau, J., et al. Actomyosin-driven force patterning controls endocytosis at the immune synapse. Nature Communications. 10 (1), 2870(2019).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophysical Journal. 94 (1), 207-220 (2008).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochimica et Biophysica Acta. 1853 (11), Pt B 3095-3104 (2015).
- Colin-York, H., Shrestha, D., et al. Super-Resolved Traction Force Microscopy (STFM). Nano Letters. 16 (4), 2633-2638 (2016).
- Stubb, A., Laine, R. F., Guzmán, C., Henriques, R., Jacquemet, G., Ivaska, J. Fluctuation-Based Super-Resolution Traction Force Microscopy. BioRxiv. , (2019).
- Gutierrez, E., Tkachenko, E., et al. High refractive index silicone gels for simultaneous total internal reflection fluorescence and traction force microscopy of adherent cells. Plos One. 6 (9), 23807(2011).
- Bergert, M., Lendenmann, T., et al. Confocal reference free traction force microscopy. Nature Communications. 7, 12814(2016).
- Schoen, I., Hu, W., Klotzsch, E., Vogel, V. Probing cellular traction forces by micropillar arrays: contribution of substrate warping to pillar deflection. Nano Letters. 10 (5), 1823-1830 (2010).
- Colin-York, H., Fritzsche, M. The future of traction force microscopy. Current Opinion in Biomedical Engineering. 5, 1-5 (2018).
- Feng, Y., et al. Mechanosensing drives acuity of αβ T-cell recognition. Proceedings of the National Academy of Sciences of the United States of America. 114 (39), 8204-8213 (2017).
- Spillane, K. M., Tolar, P. DNA-Based Probes for Measuring Mechanical Forces in Cell-Cell Contacts: Application to B Cell Antigen Extraction from Immune Synapses. Methods in Molecular Biology. 1707, 69-80 (2018).
- Stabley, D. R., Jurchenko, C., Marshall, S. S., Salaita, K. S. Visualizing mechanical tension across membrane receptors with a fluorescent sensor. Nature Methods. 9 (1), 64-67 (2011).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397 (6714), 50-53 (1999).
- Hinterdorfer, P., Dufrêne, Y. F. Detection and localization of single molecular recognition events using atomic force microscopy. Nature Methods. 3 (5), 347-355 (2006).
- Sawicka, A., Babataheri, A., et al. Micropipette force probe to quantify single-cell force generation: application to T-cell activation. Molecular Biology of the Cell. 28 (23), 3229-3239 (2017).
- Desprat, N., Guiroy, A., Asnacios, A. Microplates-based rheometer for a single living cell. Review of Scientific Instruments. 77 (5), 055111(2006).
- Labernadie, A., Bouissou, A., et al. Protrusion force microscopy reveals oscillatory force generation and mechanosensing activity of human macrophage podosomes. Nature Communications. 5, 5343(2014).
- Bouissou, A., Proag, A., et al. Protrusion force microscopy: A method to quantify forces developed by cell protrusions. Journal of Visualized Experiments. (136), 57636(2018).
- Kronenberg, N. M., Liehm, P., et al. Long-term imaging of cellular forces with high precision by elastic resonator interference stress microscopy. Nature Cell Biology. 19 (7), 864-872 (2017).
- Basu, R., Whitlock, B. M., et al. Cytotoxic T cells use mechanical force to potentiate target cell killing. Cell. 165 (1), 100-110 (2016).
- Bufi, N., Saitakis, M., et al. Human Primary Immune Cells Exhibit Distinct Mechanical Properties that Are Modified by Inflammation. Biophysical Journal. 108 (9), 2181-2190 (2015).
- Goodnow, C. C., Crosbie, J., et al. Altered immunoglobulin expression and functional silencing of self-reactive B lymphocytes in transgenic mice. Nature. 334 (6184), 676-682 (1988).
- Butler, J. P., Tolić-Nørrelykke, I. M., Fabry, B., Fredberg, J. J. Traction fields, moments, and strain energy that cells exert on their surroundings. American Journal of Physiology. Cell Physiology. 282 (3), 595-605 (2002).
- MBPPlab/TFM_v1: Software for Time dependent Traction Force Microscopy. , Available from: https://github.com/MBPPlab/TFM_v1 (2019).
- Tseng, Q., Duchemin-Pelletier, E., et al. Spatial organization of the extracellular matrix regulates cell-cell junction positioning. Proceedings of the National Academy of Sciences of the United States of America. 109 (5), 1506-1511 (2012).
- ImageJ plugins by Qingzong TSENG. , Available from: https://sites.google.com/site/qingzongtseng/ (2019).
- Plotnikov, S. V., Sabass, B., Schwarz, U. S., Waterman, C. M. High-resolution traction force microscopy. Methods in Cell Biology. 123, 367-394 (2014).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Wang, J., Lin, F., et al. Profiling the origin, dynamics, and function of traction force in B cell activation. Science Signaling. 11 (542), (2018).
- Hui, K. L., Balagopalan, L., Samelson, L. E., Upadhyaya, A. Cytoskeletal forces during signaling activation in Jurkat T-cells. Molecular Biology of the Cell. 26 (4), 685-695 (2015).
- Bashour, K. T., Gondarenko, A., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences of the United States of America. 111 (6), 2241-2246 (2014).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. The Journal of Cell Biology. 183 (6), 999-1005 (2008).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. Journal of Physics. Condensed Matter. 22 (19), 194104(2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유