Method Article
Microscopia de Força de Tração para Estudar ativação de linfócitos B
Neste Artigo
Resumo
Aqui apresentamos um protocolo usado para realizar experimentos de microscopia de força de tração em células B. Descrevemos a preparação de géis de poliacrilamida macio e sua funcionalização, bem como aquisição de dados no microscópio e um resumo da análise de dados.
Resumo
A microscopia de força de tração (TFM) permite a medição de forças produzidas por uma célula em um substrato. Esta técnica infere as medidas de força de tração de um campo de deslocamento experimentalmente observado produzido por uma célula puxando um substrato elástico. Aqui, adaptamos a TFM para investigar a estrutura espacial e temporal do campo de força exercida por células B quando ativada pelo engajamento de antígeno do receptor de células B. A rigidez do gel, a densidade das contas e a funcionalização da proteína devem ser otimizadas para o estudo de células relativamente pequenas (~ 6 μm) que interagem e respondem especificamente aos ligantes para receptores de superfície celular.
Introdução
As células B são as células produtoras de anticorpos do sistema imunológico. Para ativar a resposta imune adaptativa, eles primeiro adquirem o antígeno de forma nativa (ou seja, não processado) através de um receptor específico chamado receptor de células B (BCR)1. Esse processo ocorre na zona de célula b do linfonodo. Mesmo que alguns antígenos possam alcançar a célula B através de fluidos linfáticos, a maioria dos antígenos, especialmente com alto peso molecular (>70 kDa, que é o tamanho limite para conduítes linfáticos) são de fato apresentados em sua forma nativa na superfície de uma célula presente de antígeno (APC), tipicamente um macrófago sinugo subcapsular ou célula dendrítica folicular, através de receptores de lectina ou Fc (não específico). O contato com esta célula leva à formação de uma sinapse imunológica onde o BCR exerce força sobre os antígenos associados ao APC. A vinculação de um antígeno ao BCR inicia a sinalização BCR, que pode ativar mecanismos geradores de força. Essas forças podem ser importantes para amplificar a sinalização bcr, mas também são essenciais para as células B extrairem e, em seguida, internalizarem o antígeno.
Estudos recentes mostraram que o BCR é de fato mecanosensível2. Por exemplo, substratos mais rígidos provocam uma sinalização BCR aprimorada3. Além disso, a força gerada na sinapse imunológica puxa os BCRs únicos para sondar sua afinidade com o antígeno e, assim, garantir a discriminação de afinidade4. Por isso, é interessante investigar a resposta mecânica das células B à apresentação de antígenos e dissecar essa resposta em termos de tipo de receptores implicados (IgG/IgM)5, moléculas de adesão (ligantes integrin) ou em células farmacológicas e geneticamente modificadas (ou seja, silenciamento de uma proteína a jusante da sinalização BCR ou da dinâmica do citoesqueleto)6.
Um método simples para observar a resposta de uma célula a um substrato de rigidez fisiológica e, ao mesmo tempo, as forças de estudo exercidas sobre o substrato é a Microscopia de Força de Tração (TFM). TFM consiste em observar o campo de deslocamento produzido pela célula puxando um substrato elástico. Originalmente, a deformação do gel foi observada através de rugas do próprio elastômero por microscopia de contraste de fase7,mas a inserção de microesferas de fluorescência como marcadores fiduciários permitiu uma melhor resolução e desde então tornou-se o padrão8. Este método tem sido usado para investigar a força de tração exercida por células aderentes, tecidos e até organoides embutidos em géis. Várias variações de TFM foram desenvolvidas9 incluindo, combinação com microscopia de superresolução (ou seja, STED10 ou SRRF11), modificação do índice refrativo do gel para permitir microscopia TIRF12,substituição de contas por padrões nano-impressos13, e utilização de nanopilares em vez de superfície plana14. Para uma revisão completa dessas variações, consulte Colin-York et al.15.
O protocolo aqui apresentado descreve um procedimento para medir forças exercidas por células B em um substrato revestido de antígeno. Essas forças são aplicadas nos ligantes (antígenos) a fim de agrupar-los e, posteriormente, extraí-los do substrato que apresenta antígeno. Adaptamos o protocolo TFM padrão para imitar a rigidez dos substratos fisiológicos que apresentam antígenos, o tamanho e o revestimento relevante para as células B. Este protocolo permite o estudo de várias células simultaneamente e pode ser usado em conjunto com técnicas de microscopia de fluorescência e tratamentos químicos. No entanto, não visa sondar medidas de força de molécula única, para as quais pinças ópticas16, sondas de tensão molecular17,18, sondas de força biomembrana19, e microscopia de força atômica20 são técnicas mais adequadas. Em comparação com outros métodos de medição de força celular única (por exemplo, micropipettos21 ou microplacas22) o TFM permite a reconstrução de um mapa completo das forças exercidas na sinapse com uma resolução de ~300 nm. Isso é útil para identificar padrões espátulais-temporais nas forças exercidas na superfície e, como o gel é compatível com imagens confocal, para correlacioná-los com o recrutamento de proteínas específicas (por exemplo, citoesqueleto e proteínas de sinalização).
Embora o 3D TFM seja possível, ele não é compatível com a rigidez e a configuração que usamos. As deformações em 3D são alcançáveis por outras configurações mais complexas, como microscopia de força de saliência (AFM escaneando uma membrana deformável onde as células são emplacar)23,24 e microscopia de estresse de interferência de ressonador elástico (ERISM, um gel agindo como cavidade ressonante para luz e destacando deformações do substrato com precisão de alguns nanômetros)25. Embora essas técnicas sejam muito promissoras, elas ainda não foram empregadas em células B. Outros tipos de TFM, como em nanopillars14,poderiam ser usados para ter substratos mais reprodutíveis. No entanto, essa geometria não é adaptada às células macias à medida que a célula interpenetra os pilares, o que complica a análise. Essa abordagem tem sido de fato usada em células T para observar a capacidade da célula de construir estruturas ao redor dos pilares26.
Apesar de sua simplicidade, o uso de géis de poliacrilamida permite a observação simultânea de muitas células e pode ser implementado de forma fácil e barata em qualquer laboratório equipado com um banco e um microscópio de epifluorescência (embora recomendamos disco confocal/giratório).
Para imitar a rigidez fisiológica de um APC, utilizamos géis de poliacrilamida com uma rigidez de ~500 Pa27 e funcionalizamos o gel com antígenos ativados. Neste protocolo, funcionalizamos a superfície do gel de poliacrilamida com lise de ovo de galinha (HEL). Isso permite a medição de forças geradas pela estimulação do BCR através do engajamento do local de ligação de antígeno. O uso deste antígeno e das células B específicas do HEL de camundongos MD4 garante uma geração de força relativamente uniforme em resposta à ligadura de antígeno28. No entanto, outras moléculas (como o anti-IgM para camundongos B6) podem ser enxertadas no gel, mas as forças geradas nesses casos podem ser mais heterogêneas e menos intensas. Como as células B são pequenas células (diâmetro ~6 μm), o número de contas foi otimizado para ser máximo, mas ainda rastreável. Para células grandes que exercem ~kPa forças em seus substratos, pode-se alcançar resultados satisfatórios usando contas relativamente esparsas ou realizando simples velocimetria de imagem de partículas (PIV) para reconstruir o campo de deformação. No entanto, para pequenas células como linfócitos B que exercem estresse tão pequeno quanto ~50 Pa, é necessário o uso de rastreamento de partículas únicas (velocimetria de rastreamento de partículas, PTV) para alcançar a precisão desejada ao reconstruir o campo de deformação. Para rastrear de forma confiável as contas individualmente, a ampliação da lente objetiva precisa ser de pelo menos 60x e sua abertura numérica em torno de 1,3. Assim, os géis devem ser relativamente finos (<50 μm), caso contrário as contas não são visíveis, pois estão acima da distância de trabalho do objetivo.
O protocolo principal consiste em três seções: preparação de gel, funcionalização em gel e imagem; mais duas seções são opcionais e são dedicadas à quantificação de extração de antígeno e imagem de células fluorescentes.
Protocolo
1. Preparação do gel
- Silanização do suporte de gel
- Ative a tampa ou a placa de Petri de fundo de vidro (que será usada como suporte de gel) com uma lâmpada UV por 2 minutos (espere 30 s antes da exposição à lâmpada UV para evitar a exposição ao ozônio residual).
- Silanize o prato de cobertura/fundo de vidro usando 200 μL aminopropyltrimethoxysilane (APTMS) por 5 min. Isso preparará o suporte para a ligação covalente do gel.
- Lave bem o prato de tampa/fundo de vidro com água ultra-pura.
- Seque a tampa/prato de fundo de vidro usando aspiração de vácuo.
- Preparação do deslizamento de cobertura de 18mm usado para achatar o gel
- Para preparar as tampas, primeiro coloque-as em um suporte de deslizamento de cerâmica. Em seguida, coloque o suporte de deslizamento de tampa em um pequeno béquer (50 mL) e despeje reagente siliconador (armazenado a 4 °C, reutilizável) sobre as tampas, certificando-se de cobri-los completamente.
- Cubra o béquer com papel alumínio e incubar por 3 minutos em temperatura ambiente. Enquanto espera, encha um grande béquer (500 mL) com água ultra-pura. Após 3 minutos de incubação no reagente de silício, transfira o suporte de deslizamento de tampas com tampas para o béquer de água.
- Enxágue bem as tampas com água ultra-pura, seque-as bem e mantenha os lenços umedecidos de papel. Para obter melhores resultados, prossiga imediatamente para a próxima seção.
- Polimerização de gel
- Para géis de 0,5 kPa, misture 75 μL de 40% de acrilamida com 30 μL de 2% de bisacrilamida (crosslinker) e 895 μL de salina tamponada com fosfato (PBS). Esta pré-caixa pode ser armazenada por até um mês a 4 °C.
- A 167 μL de 0,5 kPa gel premix, adicione 1% (1,67 μL) de contas, vórtice e sonicato por 5 min em um sonicator de banho (limpador ultrassônico de banco padrão com potência de 50-100 W e frequência de 40 kHz). Mantenha a mistura protegida da luz usando papel alumínio.
NOTA: A pré-mistura não polimeriza até que o iniciador (TEMED) seja adicionado. - Para catalisar a polimerização, adicione 1% (1,67 μL) de 10% w/v persulânfito de amônio (APS).
- Para iniciar a polimerização, adicione 0,1% (0,2 μL) N,N,N′,N'-Tetramethylenediamina (TEMED). Misture com uma pipeta. Uma vez que APS e TEMED foram adicionados, o gel polimeriza rapidamente para fundição de gel.
- Fundição em gel
- Pipet 9 μL de mistura de gel em cada prato de cobertura/fundo de vidro (gota no centro, Figura 1A)
- Coloque o deslizamento silanizado/hidrofóbico e achate o gel(Figura 1B). Usando fórceps, pressione a mancha de cobertura para garantir que o gel se espalhe por toda a área do deslizamento de cobertura(Figura 1C)até que comece a vazar.
- Inverta a placa de tampa/fundo de vidro em uma grande placa de Petri e bata-a no banco para forçar as contas indo em direção à superfície do gel(Figura 1D).
- Cubra com papel alumínio e deixe por 1h para polimerizar à temperatura ambiente em uma câmara úmida (ou seja, coloque um tecido molhado acima do prato para evitar a evaporação).
- Depois de 1h, adicione PBS à amostra para facilitar a liberação do deslizamento de cobertura. Remova cuidadosamente a mancha de cobertura usando uma agulha (o revestimento com diferentes silanes deve permitir a remoção fácil do deslizamento do clipe do gel, Figura 1E).
- Deixe o gel na PBS.
NOTA: Os géis agora podem ser armazenados em PBS a 4 °C por 5-7 dias, mas recomenda-se usá-los dentro de 48 h.
2. Funcionalização do gel
- Prepare a solução sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoato (Sulfo SANPAH) a 0,5 mg/mL em 10 mM HEPES tampão. Isso pode ser armazenado a 4 °C coberto com papel alumínio por até uma semana.
- Aspire o PBS de géis.
- Adicione 150 μL de Sulfo SANPAH ao gel à temperatura ambiente(Figura 1F).
- Exponha o gel ao tratamento UV por 2 minutos para fotoativar os locais de Sulfo SANPAH e fazê-lo grudar na superfície do gel.
- Lave com PBS trêsvezes (Figura 1G).
- Repetir as etapas 2.2-2.5.
- Adicione 250 μL de HEL (100 μg/mL) a cada gel e incuba durante a noite em uma câmara úmida a 4 °C durante a noite, mantendo-se coberta com papelalumínio (Figura 1H).
- Remova o antígeno HEL e lave com PBS três vezes.
NOTA: HEL age tanto como um antígeno quanto como uma molécula de adesão. Pode ser substituído por outras moléculas que se ligam ao receptor (por exemplo, um IgM anti-rato, Bovine Serum Albumin, Ovalbumin) ou misturado com ligantes de integrin (por exemplo, ligação ICAM1 ao LFA1). Se necessário, a extração de antígeno pode ser observada com uma versão fluorescente do HEL (obtida pela coloração da molécula com um kit de rotulagem de proteínas, ver passo 4). Observe que uma dada concentração a granel pode não produzir a mesma concentração superficial no gel como no vidro: isso precisa ser quantificado com coloração secundária se for necessária comparação direta.
3. Carregamento de células e imagem
- Antes da imagem, remova o PBS dos géis e adicione 500 μL de mídia celular B (RPMI 1640, 10% soro de bezerro fetal decomplementado, 1% penicilina-estreptomicina, 2% Piruvato de Sódio, 50uM Mercaptoetanol e 1X Aminoácidos Não Essenciais) e deixe-os equilibrar para RT.
- Preparação celular
- Purificar células B primárias do baço de acordo com um protocolo de seleção negativo (ver Tabela de Materiais). O rendimento típico da célula B final é em torno de 1 x 107 células. Concentre isso em 3 x 106 células/mL em meio de célula B (RPMI-1640 suplementado com soro de bezerro fetal de 10%, 1% penicilina-estreptomicina, 0,1% mercaptoetanol e 2% piruvato de sódio).
- Armazene as células conforme necessário por até 6h a 4 °C.
- Mantenha as células a 37 °C por 30 minutos antes da aquisição da imagem.
- Imaging
- Use um microscópio confocal com controle térmico e (possivelmente) CO2.
NOTA: Independentemente de um microscópio confocal ou de disco giratório ser usado, é importante usar um orifício objetivo/pinhole que permita que um tamanho de pixel <200 nm rastreie confortavelmente as contas na fase de análise (por exemplo, 60x, NA 1.3). A microscopia de epifluorescência também pode ser usada, porém fornece menor relação sinal/ruído e pode dificultar o rastreamento individual de contas. - Duas camadas principais de contas aparecerão na parte inferior e na parte superior do gel. Concentre-se no plano de gel.
NOTA: Um bom gel aparecerá como um céu estrelado, com contas aproximadamente uniformemente distribuídas no mesmo plano. - Programe a aquisição por 30 min com uma taxa de quadros de 5 s (isso é adaptável às necessidades do experimento, por exemplo, adquirir outras cores, adquirir pilha z, etc.)
- Aspire a mídia do gel, deixando cerca de 200 μL de mídia no gel. Posicione o gel no microscópio e encontre a camada superficial de contas e uma boa área uniforme no gel.
- Adicione 80 μL de células (evite tocar no gel para manter o foco).
- Certifique-se de que o foco ainda está correto e que as células podem ser vistas descendo na área (sob luz transmitida). Lance a aquisição antes que as células cheguem ao gel.
- Em caso de contato acidental com gel, vibrações ou drift de foco, ajuste o foco.
NOTA: É crucial coletar uma imagem do gel relaxado e esta pode ser qualquer imagem tirada antes da chegada das células no gel.
- Use um microscópio confocal com controle térmico e (possivelmente) CO2.
4. Experimento de extração de HEL fluorescente
- Prepare o HEL fluorescente ligando um corante fluorescente (de uma cor diferente das contas como alexa 555), consulte a Tabela de Materiais.
- Na etapa 2.7, substitua o HEL convencional pelo HEL fluorescente.
- Adquira imagens com configurações de iluminação baixa ou baixa taxa de quadros (por exemplo, 2 quadros por minuto) para evitar o branqueamento de fotos.
- Para quantificar a extração de HEL, calcule a intensidade integrada sobre a área celular para cada quadro I(t) corrigido e normalizado pela intensidade I(0) do quadro 0 de acordo com a fórmula:
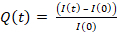
NOTA: O antígeno conjugado com um fluoróforo não é visível (provavelmente devido à extinção do fluorohore na superfície do gel), mas sua presença no gel pode ser verificada com um anti-HEL e um anticorpo secundário fluorescente. Pode-se verificar que o fluoróforo é de fato fluorescente quando destacado, retirando-o do gel com um deslizamento revestido com anti-HEL e revelando-o com um anticorpo fluorescente secundário (no deslizamento de tampa)6. O sinal do antígeno extraído é muito escuro e às vezes é mascarado pelo vazamento das contas. Se alguém estiver interessado apenas na extração de antígeno, recomenda-se preparar o gel sem contas (passos 1.3.2 e 1.4.3).
5. Imagem de fluorescência
- Obtenha células B fluorescentes purificando células B dos baços de camundongos geneticamente modificados como feito para o tipo selvagem (por exemplo, de lifeact-GFP ou myosin II GFP ratos).
- Para imagens de células fluorescentes, use (se possível) um microscópio de disco giratório com um objetivo de imersão de água de longa distância 40x-100x.
- Mantenha a duração da exposição e a taxa de quadros baixas para evitar branqueamento.
NOTA: A função de spread de ponto em Z é altamente degradada pela presença do gel, por isso sugerimos o uso de um objetivo de imersão em água. A microscopia viva vertical com objetivos de mergulho de água sofre de fortes aberrações esféricas induzidas pela presença da célula (esférica) (e núcleo celular) no caminho das emissões.
6. Análise
NOTA: A análise de dados é realizada em geral corrigindo primeiro toda a pilha para deriva, encontrando as contas em cada quadro, rastreando seus movimentos em relação a um quadro de referência (tomado na ausência de células), interpolando o campo de deslocamento e invertendo o problema para obter o estresse usando fourier transformar29. Para isso, sugerimos o uso de uma combinação de programas ImageJ Macro e MATLAB para download de um repositório online30.
- Abra o filme em ImageJ como pilha de imagens
- Execute o macro "Crop_and_save.ijm"
- Selecione as regiões de interesse (ROI) com a ferramenta "Retângulo" e adicione-as à lista de ROI usando a tecla 't'.
- Ao cortar a célula, certifique-se de incluir uma região de pelo menos 5 a 10 pixels de contas imóveis. Exclua células que estão muito próximas dos limites ou de outras células da análise. Quando terminar clique em 'OK'.
- A macro propõe uma máscara da célula: se isso for satisfatório clique em "OK". Se não for satisfatório, clique em "Não está ok" e selecione manualmente uma região fechada com qualquer ferramenta de seleção (por exemplo, "Freehand" ou "Oval") e clique em "Continuar".
- Abra o MATLAB e execute "TFM_v1.m".
- Insira os parâmetros necessários: em especial verifique as propriedades da imagem (tamanho do pixel, intervalo de tempo de aquisição) e as propriedades do gel (Young modulus E, Razão Poisson).
- A imagem de referência é definida como a primeira por padrão. Configure-o para outro quadro, se necessário ou defina-o como "0" para carregar um arquivo externo.
- Localize as saídas do software no mesmo diretório do arquivo original (para obter uma descrição, consulte o arquivo User_notice.pdf). Isso inclui uma faixa preliminar das contas ("FILENAME.fig"), um enredo da energia contítil ao longo do tempo ("FILENAME_energy.fig"), uma tabela de várias quantidades integradas sobre a célula (energia, área, momentos, etc) "FILENAME_finaltable.mat", estrutura contendo o campo de deslocamento e força, filmes do campo de deslocamento, estresse e energia (que podem ser abertos com qualquer leitor de avi).
NOTA: Nos parâmetros de entrada, o "tamanho da janela" é a janela sobre a qual o deslocamento é interpolado, daí a resolução final do campo de estresse e deslocamento. Isso é definido para alguns (por padrão quatro) pixels. Não é aconselhável reduzir isso, pois aumentaria artificialmente a resolução interpolando regiões onde não há contas.
Resultados
Dado o tamanho das células, algoritmos que extraem o mapa de deslocamento das contas através de técnicas correlativas (como a velocimetria de imagem de partículas) não são, em geral, muito precisos. No entanto, dependendo do grau de resolução necessário, pode-se facilmente obter resultados qualitativos usando um plugin Fiji/ImageJ gratuito31,32. Embora essa abordagem seja suficiente para comparar condições estimulantes versus não estimulantes, para uma análise minuciosa recomendamos o uso de nosso software para download de um repositório on-line30, que rastreia as contas individualmente e fornece o mapa de campo de deslocamento em um determinado ponto de tempo como a interpolação dos deslocamentos individuais de contas33. Várias quantificações são possíveis neste momento. Por exemplo (assumindo que o deslocamento é causado apenas por estresse tangencial à superfície do gel) o software também fornece o estresse em cada ponto causando esse mapa de deslocamento específico. Trata-se de um tipo de "problema de inversão": o deslocamento em um determinado ponto depende da soma de todas as forças aplicadas em todos os outros pontos. O "algoritmo de inversão" leva em conta os parâmetros físicos do substrato: sua rigidez (módulo jovem) e razão poisson. Algoritmos diretos são tipicamente muito precisos, mas computacionalmente caros. Algoritmos baseados na transformação fourier, como o nosso, realizam essencialmente uma desconvolução no espaço Fourier e são mais eficientes, mas propensos a alguns erros (principalmente devido à etapa de interpolação). Esses algoritmos geralmente requerem a sintonia de um parâmetro que impede que pequenos deslocamentos locais (e potencialmente artefatosuais) se tornem muito relevantes na computação do campo de estresse (parâmetro de regularização Tikhonov8,29; Variável de "regularização" na janela de diálogo; aqui normalmente definimos igual a 5 x 10-19). Para uma interpretação e análise mais avançadas, como correlações espátulais-temporais, movimentos locais, correlações com canais fluorescentes, recomendamos colaborar com especialistas da área. Para uma revisão sobre métodos computacionais, consulte Schwarz et al.9.
Como mencionado acima, as imagens corretas de contas parecem um "céu estrelado", uma distribuição uniforme e aleatória de pontos brilhantes(Figura 2A). Dados e análises não são confiáveis quando o número de contas é muito baixo(Figura 2B) ou a imagem está fora de foco(Figura 2C). Uma vez que as células B se estabeleceram na superfície do gel, as contas sob as células começam a se mover devido à força de tração exercida pela célula no gel. Os quadros para os quais as contas não são rastreáveis devem ser descartados.
Como verificação, é possível observar olho o movimento das contas comparando o "quadro de referência", tipicamente aquele que precede o primeiro contato da célula com o substrato. Resultados aproximados podem ser obtidos a partir do rastreamento de partículas únicas (por exemplo, Trackmate, Fiji 34) como feito na Figura 3A. A análise fornece uma segmentação das contas na imagem de referência ("FILENAME.fig") como um controle.
Com o software que propomos, pode-se obter o deslocamento (Figura 3B) e o campo de estresse (o vetor do estresse local em cada pixel e cada ponto de tempo obtido pela inversão do campo de deslocamento, Figura 3C). Produto escalar dos campos de deslocamento e força integrados na área da célula fornece trabalho total exercido pela célula no substrato (Figura 4A). Este cálculo requer a máscara da célula introduzida na etapa 6.2 do protocolo.
Para comparar duas condições biológicas (como ativar HEL versus substrato não ativado BSA, ou tipo selvagem versus knock-out) é útil calcular a curva média (Figura 4B) ou, ainda mais sinteticamente, um valor médio sobre os pontos do último tempo (20 min) onde a energia atinge um platô(Figura 4C). Quando as informações espaciais das forças são relevantes é possível comparar pontos de tempo únicos de cada condição(Figura 4D). Consulte Kumari et al.6 para análise mais profunda.
Um exemplo de lapso de tempo de extração de antígeno fluorescência é mostrado na Figura 5A: o aparecimento progressivo de sinais de fluorescência na sinapse indicada descolamento de antígeno do gel. A curva média de extração com seu intervalo de confiança (erro padrão da média) sobre 15 células é mostrada na Figura 5B.
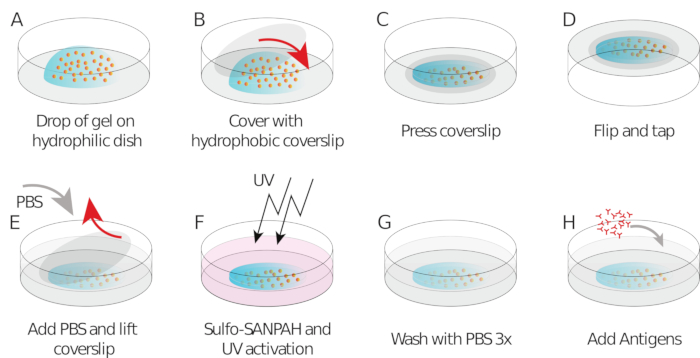
Figura 1: Demonstração esquemática da preparação do gel e sua funcionalização. As etapas estão descritas no protocolo. Clique aqui para ver uma versão maior desta figura.

Figura 2: Três exemplos de imagens de contas de diferentes qualidades. (A) Exemplo de imagem de contas com a razão de sinal correto para ruído e a densidade correta. (B) Exemplos de imagens com um número muito insuficiente de contas e (C) fora do plano de foco. Clique aqui para ver uma versão maior desta figura.
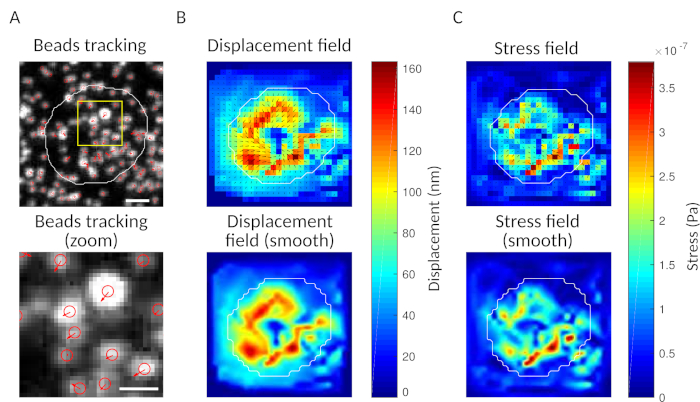
Figura 3: Processamento das imagens para extrair o campo de força. (A) Exemplo de uma imagem das contas (contorno da célula em branco, extraído da imagem de transmissão), rastreamento de contas no momento t = 5 min (sobreposição vermelha) e deslocamento (setas) relativo ao tempo t = 0 min (barra de escala 5 μm). (B) Campo de deslocamento interpolado (representado como trêmuto vetorial e mapa de magnitude, as setas são proporcionais ao deslocamento [nm]; ver a barra de cor à direita); inferior: uma imagem mais suave da magnitude (obtida pela interpolação com uma função bicubica). (C) Campo de estresse do campo de deslocamento no painel B (representado como trêm salvorto vetorial e mapa de magnitude; setas são proporcionais ao estresse da cisalhamento [Pa]; ver a barra de cor à direita); inferior: uma imagem mais suave da magnitude (obtida pela interpolação com uma função bicubica). Clique aqui para ver uma versão maior desta figura.
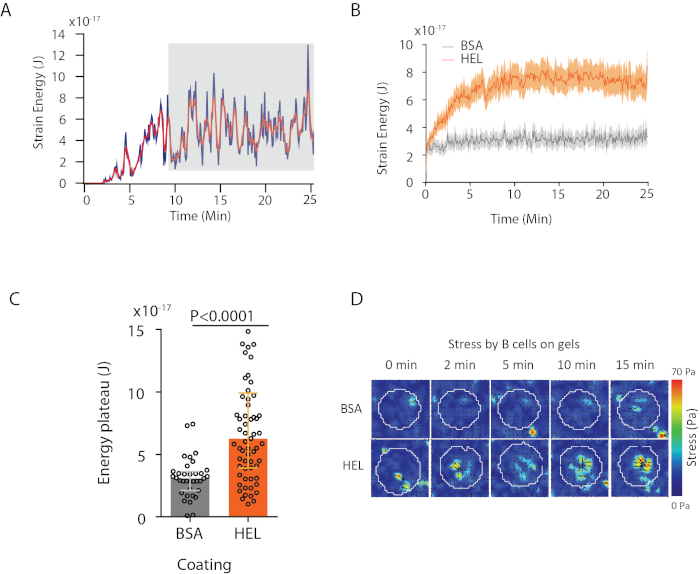
Figura 4: Exemplo de informações que podem ser extraídas de campos de força e deslocamento. (A) Exemplo de evolução da energia no tempo para uma única célula: uma fase de planalto (destacada em cinza) aparece após cerca de 10 minutos. (B) Comparação das curvas médias de energia e (C) dos níveis relativos do planalto para 65 células banhadas em gel revestido hel (ativação) e 35 células em gel revestido BSA (não ativação) (intervalos medianos ± interquartil são mostrados, o teste mann-whitney foi usado para significância estatística). (D) Mapas de cores de lapso de tempo de estresse para HEL e controlar a condição BSA; tanto as parcelas de magnitude quanto de quiver são mostradas. Estas imagens foram adaptadas de Kumari et al.6. Clique aqui para ver uma versão maior desta figura.
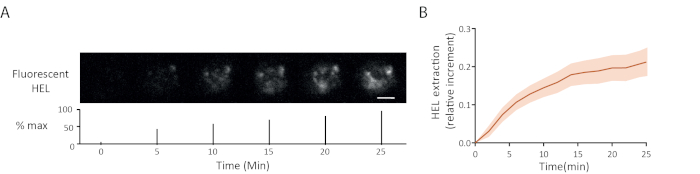
Figura 5: Exemplo de experimentos com antígeno fluorescente. (A) Lapso de tempo da extração de HEL fluorescente (abaixo: percentual da barra de escala máxima = 3μm). (B) Recolhimento de antígeno ao longo do tempo (Média ± SEM, n = 15). Estas imagens foram adaptadas de Kumari et al.6. Clique aqui para ver uma versão maior desta figura.
Discussão
O método TFM descrito aqui permite o estudo sistemático das capacidades mecânicas ativas das células B. No contexto das células B, isso está relacionado à capacidade de extrair e internalizar o antígeno. Em comparação com outros métodos TFM, o protocolo aqui apresentado é simples e bastante reprodutível: a rigidez, medida pelo recuo de uma microesfera de vidro e usando o modelo Hertz, está entre 400 e 600 Pa. Protocolos semelhantes têm sido usados com sucesso não só para células B35, mas também para células T36. Em comparação com os nanopillares (também usados para linfócitos T37) fornece uma superfície homogênea plana, portanto os resultados são mais fáceis de interpretar, pois a interação do gel é principalmente restrita a ser tangencial à superfície.
O protocolo descrito dá acesso à dinâmica espacial das forças exercidas pelas células B em substratos que apresentam antígenos. No nível espacial, isso fornece informações da localização de forças, e em combinação com a microscopia de fluorescência, permite ao experimentador correlacionar forças locais com a presença de moléculas específicas (ou seja, componentes do citoesqueleto ou cascata de sinalização BCR). No nível temporal, é possível integrar quantidades (como energia total ou estresse total) para fornecer um valor por ponto de tempo e reduzir o ruído. Isso permite observação da evolução da força de tração no tempo (crescimento e planalto) e da presença de padrões pulsantes.
Aspectos experimentais críticos para a análise são descritos como a seguir. (i) Densidade celular: para realizar uma análise correta, as células devem ser suficientemente separadas. Consideramos que uma célula pode ser analisada se tiver uma região vazia de seu próprio tamanho ao seu redor. (ii) Imagem de transmissão: é aconselhável coletar pelo menos uma imagem de transmissão das células durante o experimento para ser usada como máscara na análise. (iii) Número de contas na imagem: sugerimos analisar apenas imagens onde o número de contas na sinapse está entre 30 e 200 (ou seja, 1-8 contas/μm²). Densidades mais baixas não permitem a reconstrução adequada do deslocamento do mapa. Altas densidades de contas tornam o rastreamento de partículas únicas não confiável. (iv) O número de contas deve ser constante durante o experimento; no entanto, flutuações podem ocorrer devido à pequena variabilidade nas condições de imagem (especialmente em contas que estão muito próximas umas das outras). O foco de deriva, se ocorrer, deve ser corrigido e quadros problemáticos devem ser descartados. v A qualidade do gel: géis com muitas rachaduras, variabilidade na distribuição de contas ou géis muito grossos devem ser descartados. (vi) Dependendo do tipo celular, após exposições repetidas, as células em pontos de atraso (>300 quadros) podem sofrer efeitos fototóxicos. É aconselhável executar o programa em uma máscara desprovida de células como uma "linha de base" a ser comparada com os dados. Isso fornece uma magnitude do nível de ruído apenas devido às condições experimentais.
Os géis utilizados para medir a força de tração na adesão clássica permitem a investigação de processos que ocorrem na adesão focal (fluxos de actina e recrutamento de moléculas de sinalização)— os pontos onde as forças são aplicadas38,39. No entanto, as forças na sinapse não são aplicadas através de aderências focais. O padrão esposotemporal de geração de força na sinapse imunológica das células B não foi investigado quantitativamente usando este método até recentemente. Utilizando tfm, observamos pela primeira vez, a padronização da força na sinapse imunológica das células B, como apresentado em nosso estudo recente6, abrindo perspectivas encorajadoras no estudo dos linfócitos.
Notavelmente, este método emprega uma imagem tirada antes da chegada das células no gel como uma imagem de referência para a computação de força. Protocolos TFM usuais sugerem tirar a imagem de referência no final do experimento, depois de separar as células com trippsina; isso permite que o experimentador procure uma região rica em células. Embora isso seja possível aqui também, a trippsina é bastante ineficiente em desprender células B do gel revestido de antígeno, é preciso esperar muito tempo para o desprendimento e o risco de modificação de gel e movimentos (que tornam todo o conjunto de dados inexploitável) é maior.
O método aqui apresentado é flexível e pode ser aplicado para estudar o efeito de outros sinais na sinapse imunológica, pois permite enxertar outras proteínas na superfície do gel (por exemplo, ligantes integrin e imunoglobulinas foram testadas) e até mesmo antígenos fluorescentes (ver seção 4). Além disso, as células permanecem acessíveis ao experimentador para tratamento de drogas e perturbações locais. Finalmente, o método também é compatível com células fixas de imagem. Para essas observações, recomenda-se fazer o gel em uma mancha de cobertura, manchar as células, colar o deslizamento em um slide e só então adicionar mídia de montagem e outra mancha de cobertura. A observação será então feita com o gel em cima para evitar a degradação da imagem através do gel.
As possíveis armadilhas são a variabilidade em gel na polimerização e revestimento. Os problemas de polimerização se devem principalmente à qualidade do iniciador/catalisador. Além disso, o gel pode inflar, especialmente se não for usado logo após a montagem. Este problema não parece afetar drasticamente as propriedades mecânicas do gel, mas pode tornar a camada de contas inalcançável para o objetivo, tornando efetivamente o gel inútil. Recomendamos preparar géis extras para cada condição quando este problema aparecer. Pode haver também uma certa variabilidade no revestimento, e é crucial ter sulfo SANPAH recém-diluído.
Em conclusão, descrevemos um método simples, barato e reprodutível para medir as forças exercidas pelas células B na sinapse imunológica quando ativado pelo ligante BCR. Pode ser adaptado para estudar a reação a outros ligantes e outros tipos de linfócitos (células B de memória, células T, etc.) com o uso do ligante receptor adequado.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores agradecem a M. Bolger-Munro pela leitura crítica e reconhecem a Nikon Imaging Center@CNRS-InstitutCurie e PICT-IBiSA, Institut Curie, Paris, membro da infraestrutura nacional de pesquisa France-BioImaging, pelo apoio na aquisição de imagens e no Curie Animal Facility. O PP foi apoiado pelo CNRS. AK e JP foram apoiados pela bolsa de doutorado paris descartes e ecole doctorale FIRE - Programa Bettencourt. Este projeto foi financiado por subvenções para PP (ANR-10-JCJC-1504-Immuphy) e AMLD (ANR-PoLyBex-12-BSV3-0014-001, ERC-Strapacemi-GA 243103).
Materiais
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethoxysilane (APTMS) | Sigma-Aldrich | 281778 | Store aliquoted, protected from humidity |
| 40% Acrylamide Solution | Biorad | 1610140 | |
| Alexa555 microscale protein labeling kit | Molecular Probes | A30007 | |
| Ammonium Persulfate (APS) | Sigma-Aldrich | A3678 | |
| B cell Isolation Kit, Mouse | Miltenyi Biotec | 130-090-862 | |
| B-mercaptoethanol | Gibco | 31350-010 | |
| 2% Bis Solution | Biorad | 161-0142 | |
| Bovine Serum Albumin (BSA) | Euromedex | 04-100-812-C | |
| Coverslip 18mm | VWR | 631-1580 | |
| Fetal calf serum | PAA | A15-151 | Decomplemented (40min @56°C) |
| Fluorodishes FD35 | World Precision Instruments, Inc | FD35100 | |
| Fluosphere: carboxylate-modified, 0.2um, dark red | Molecular Probes | F8807 | |
| Hen Egg Lysozyme | Sigma-Aldrich | L6876 | Stocked in aliquote 100mg/ml |
| MEM Non-Essential Amino Acids Solution (100X) | Thermofisher/Gibco | 11140035 | |
| N,N,N',N'-tetrametiletilendiammine (TEMED) | Euromedex | 50406-B | |
| PBS (Phosfate Buffer Saline) | Gibco | 10010-015 | |
| Penicillin–streptomycin | Gibco | 15140-010 | |
| RMPI 1640 – Glutamax I | Thermofisher | 61870-010 | |
| Sigmacote | Sigma-Aldrich | SL2 | |
| Sodium pyruvate | Gibco | 11360-039 | |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate (Sulfo-SANPAH) | Thermo Scientific | 22589 |
Referências
- Yuseff, M. -. I., Pierobon, P., Reversat, A., Lennon-Duménil, A. -. M. How B cells capture, process and present antigens: a crucial role for cell polarity. Nature Reviews. Immunology. 13 (7), 475-486 (2013).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. The Journal of Cell Biology. 216 (1), 217-230 (2017).
- Shaheen, S., Wan, Z., et al. Substrate stiffness governs the initiation of B cell activation by the concerted signaling of PKCβ and focal adhesion kinase. eLife. 6, (2017).
- Natkanski, E., et al. B cells use mechanical energy to discriminate antigen affinities. Science. 340 (6140), 1587-1590 (2013).
- Wan, Z., Chen, X., et al. The activation of IgM- or isotype-switched IgG- and IgE-BCR exhibits distinct mechanical force sensitivity and threshold. eLife. 4, (2015).
- Kumari, A., Pineau, J., et al. Actomyosin-driven force patterning controls endocytosis at the immune synapse. Nature Communications. 10 (1), 2870 (2019).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophysical Journal. 94 (1), 207-220 (2008).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochimica et Biophysica Acta. 1853 (11), 3095-3104 (2015).
- Colin-York, H., Shrestha, D., et al. Super-Resolved Traction Force Microscopy (STFM). Nano Letters. 16 (4), 2633-2638 (2016).
- Stubb, A., Laine, R. F., Guzmán, C., Henriques, R., Jacquemet, G., Ivaska, J. Fluctuation-Based Super-Resolution Traction Force Microscopy. BioRxiv. , (2019).
- Gutierrez, E., Tkachenko, E., et al. High refractive index silicone gels for simultaneous total internal reflection fluorescence and traction force microscopy of adherent cells. Plos One. 6 (9), 23807 (2011).
- Bergert, M., Lendenmann, T., et al. Confocal reference free traction force microscopy. Nature Communications. 7, 12814 (2016).
- Schoen, I., Hu, W., Klotzsch, E., Vogel, V. Probing cellular traction forces by micropillar arrays: contribution of substrate warping to pillar deflection. Nano Letters. 10 (5), 1823-1830 (2010).
- Colin-York, H., Fritzsche, M. The future of traction force microscopy. Current Opinion in Biomedical Engineering. 5, 1-5 (2018).
- Feng, Y., et al. Mechanosensing drives acuity of αβ T-cell recognition. Proceedings of the National Academy of Sciences of the United States of America. 114 (39), 8204-8213 (2017).
- Spillane, K. M., Tolar, P. DNA-Based Probes for Measuring Mechanical Forces in Cell-Cell Contacts: Application to B Cell Antigen Extraction from Immune Synapses. Methods in Molecular Biology. 1707, 69-80 (2018).
- Stabley, D. R., Jurchenko, C., Marshall, S. S., Salaita, K. S. Visualizing mechanical tension across membrane receptors with a fluorescent sensor. Nature Methods. 9 (1), 64-67 (2011).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397 (6714), 50-53 (1999).
- Hinterdorfer, P., Dufrêne, Y. F. Detection and localization of single molecular recognition events using atomic force microscopy. Nature Methods. 3 (5), 347-355 (2006).
- Sawicka, A., Babataheri, A., et al. Micropipette force probe to quantify single-cell force generation: application to T-cell activation. Molecular Biology of the Cell. 28 (23), 3229-3239 (2017).
- Desprat, N., Guiroy, A., Asnacios, A. Microplates-based rheometer for a single living cell. Review of Scientific Instruments. 77 (5), 055111 (2006).
- Labernadie, A., Bouissou, A., et al. Protrusion force microscopy reveals oscillatory force generation and mechanosensing activity of human macrophage podosomes. Nature Communications. 5, 5343 (2014).
- Bouissou, A., Proag, A., et al. Protrusion force microscopy: A method to quantify forces developed by cell protrusions. Journal of Visualized Experiments. (136), 57636 (2018).
- Kronenberg, N. M., Liehm, P., et al. Long-term imaging of cellular forces with high precision by elastic resonator interference stress microscopy. Nature Cell Biology. 19 (7), 864-872 (2017).
- Basu, R., Whitlock, B. M., et al. Cytotoxic T cells use mechanical force to potentiate target cell killing. Cell. 165 (1), 100-110 (2016).
- Bufi, N., Saitakis, M., et al. Human Primary Immune Cells Exhibit Distinct Mechanical Properties that Are Modified by Inflammation. Biophysical Journal. 108 (9), 2181-2190 (2015).
- Goodnow, C. C., Crosbie, J., et al. Altered immunoglobulin expression and functional silencing of self-reactive B lymphocytes in transgenic mice. Nature. 334 (6184), 676-682 (1988).
- Butler, J. P., Tolić-Nørrelykke, I. M., Fabry, B., Fredberg, J. J. Traction fields, moments, and strain energy that cells exert on their surroundings. American Journal of Physiology. Cell Physiology. 282 (3), 595-605 (2002).
- . MBPPlab/TFM_v1: Software for Time dependent Traction Force Microscopy Available from: https://github.com/MBPPlab/TFM_v1 (2019)
- Tseng, Q., Duchemin-Pelletier, E., et al. Spatial organization of the extracellular matrix regulates cell-cell junction positioning. Proceedings of the National Academy of Sciences of the United States of America. 109 (5), 1506-1511 (2012).
- . ImageJ plugins by Qingzong TSENG Available from: https://sites.google.com/site/qingzongtseng/ (2019)
- Plotnikov, S. V., Sabass, B., Schwarz, U. S., Waterman, C. M. High-resolution traction force microscopy. Methods in Cell Biology. 123, 367-394 (2014).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Wang, J., Lin, F., et al. Profiling the origin, dynamics, and function of traction force in B cell activation. Science Signaling. 11 (542), (2018).
- Hui, K. L., Balagopalan, L., Samelson, L. E., Upadhyaya, A. Cytoskeletal forces during signaling activation in Jurkat T-cells. Molecular Biology of the Cell. 26 (4), 685-695 (2015).
- Bashour, K. T., Gondarenko, A., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences of the United States of America. 111 (6), 2241-2246 (2014).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. The Journal of Cell Biology. 183 (6), 999-1005 (2008).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. Journal of Physics. Condensed Matter. 22 (19), 194104 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados