Method Article
Микроскопия силы тяги для изучения активации лимфоцитов B
В этой статье
Резюме
Здесь мы представляем протокол, используемый для выполнения экспериментов по микроскопии силы тяги на В-клетках. Мы описываем подготовку мягких полиакриламидных гелей и их функционализацию, а также сбор данных под микроскопом и резюме анализа данных.
Аннотация
Силовая микроскопия тяги (TFM) позволяет измерять силы, производимые клеткой на субстрате. Этот метод позволяет сделать вывод о измерениях силы тяги из экспериментально наблюдаемого поля смещения, производимого клеткой, потянувшей за эластичный субстрат. Здесь мы адаптировали TFM для исследования пространственной и временной структуры силового поля, оказываемого клетками группы В при активации антигенным взаимодействием рецептора В-клеток. Плотность геля, плотность бисера и функционализация белка должны быть оптимизированы для изучения относительно небольших клеток ( й 6 мкм), которые взаимодействуют с, и реагировать конкретно на лиганды для рецепторов поверхности клеток.
Введение
В-клетки являются антителами, производящими клетки иммунной системы. Чтобы активировать адаптивный иммунный ответ, они сначала приобретают антиген в родной форме (т.е. необработав) через специфический рецептор под названием B-клеточный рецептор (BCR)1. Этот процесс происходит в зоне клеток лимфатического узла В. Даже если некоторые антигены могут достичь В-клетки через лимфатические жидкости, большинство антигенов, особенно с высоким молекулярным весом (Nogt;70 kDa, который является предельным размером для лимфатических трубопроводов) действительно представлены в их родной форме на поверхности антигена, представляя клетки (APC), как правило, подкапсулярный синус макрофаг или фолликулярной дендритической клетки, через лектин или fc. Контакт с этой клеткой приводит к образованию иммунного синапса, при котором BCR оказывает силу на связанные с БТР антигены. Связывание антигена с BCR инициирует сигнализацию BCR, которая может активировать механизмы, генерирующие силу. Эти силы могут иметь важное значение для усиления BCR сигнализации, но также имеют важное значение для В-клеток для извлечения, а затем интернализировать антиген.
Недавние исследования показали, что BCR действительно mechanosensitive2. Например, более жесткие субстраты вызывают повышенную BCR сигнализацию3. Кроме того, сила, генерируемая при иммунном синапсе, тянет на одиночные BCRs, чтобы исследовать его близость к антигену и тем самым обеспечить сродстводискриминации 4. Поэтому интересно исследовать механическую реакцию В-клеток на презентацию антигена и вскрыть этот ответ с точкизрениятипа рецепторов, замешанных (IgG/IgM) 5 , молекул адгезии (интегрин лиганды) или в фармакологических и генетически модифицированных клетках (т.е. замалчивание белка ниже по течению от BCR сигнализации или цитоскелетнойдинамики) 6.
Простым методом наблюдения реакции клетки на субстрат физиологической жесткости и, в то же время, изучение сил, оказываемых на субстрат, является микроскопия силы тяги (TFM). TFM состоит из наблюдения за полем перемещения, производимым клеткой, потянув за эластичный субстрат. Первоначально деформация геля наблюдалась через морщины самого елатомера фазово-контрастноймикроскопией 7, но вставка микроволокной флуоресценции в качестве фидуциальных маркеров позволила лучшее разрешение и с тех пор стала стандартной8. Этот метод был использован для исследования силы тяги, оказываемой приверженцами клеток, тканей и даже органоидов, встроенных в гели. Несколько вариаций TFM былиразработаны 9 в том числе, сочетание с микроскопией суперрезолюции (т.е. STED10 или SRRF11), модификация рефракционного индекса геля, чтобы позволить TIRFмикроскопии 12, заменив бисер нано-печатныхмоделей 13, и с помощью нанопилларов вместоплоской поверхности 14. Полный обзор этих вариаций можно получить см. Колин-йорк и др.15.
В представленном здесь протоколе описывается процедура измерения сил, оказываемых клетками группы В на антигенный субстрат. Эти силы применяются на лигандах (антигене) для их кластеризации, а затем извлечения из антигеносующих субстратов. Мы адаптировали стандартный протокол TFM, чтобы имитировать жесткость физиологических антиген-представляя субстратов, размер и соответствующее покрытие для В-клеток. Этот протокол позволяет изучать несколько клеток одновременно и может быть использован в сочетании с методами флуоресценции микроскопии и химической обработки. Тем не менее, он не направлен на зондирование одной молекулы измерения силы, длякоторых оптические пинцеты 16,молекулярное напряжение зондов 17,18, биомембрана силызондов 19, и атомной микроскопиисилы 20 являются более подходящими методами. По сравнению с другими методами измерения силы одной клетки(например, микропипюты 21 или микроплэты 22) TFM позволяет работать над полной картой сил, оказываемых на синапсе с разрешением 300 нм. Это полезно для выявления пространственно-временных закономерностей в силах, оказываемых на поверхность, и, поскольку гель совместим с конфокальные изображения, соотносить их с набором конкретных белков (например, цитоскелета и сигнальных белков).
Хотя 3D TFM возможен, он не совместим с жесткостью и настройкой, которую мы использовали. Деформации в 3D достижимы другими, более сложнымиустановками,такими как микроскопия силы выступа (AFM, сканирующая деформируемую мембрану, гдеклетки побканы) 23,24 и эластичная микроскопия напряжения интерференциона ресонатора (ERISM, гель, выступающий в качестве резонирует полость для света иподчеркивая деформации субстрата с точностью в несколько нанометров) 25. Хотя эти методы являются весьма перспективными, они еще не были использованы в В-клеток. Другие типы TFM, такие как нанопиллары14, могут быть использованы, чтобы иметь более воспроизводимые субстраты. Однако эта геометрия не приспособлена к мягким клеткам, так как клетка интерпенетатит столбы, что усложняет анализ. Этот подход действительно был использован в Т-клеток для наблюдения за способностью клетки строить структуры вокруг столбов26.
Несмотря на свою простоту, TFM с использованием полиакриламинидных гелей позволяет одновременное наблюдение многих клеток и может быть легко и недорого реализованы в любой лаборатории оснащены скамейке и эпифлуоресценции микроскопа (хотя мы рекомендуем confocal / спиннинг диска).
Чтобы имитировать физиологическую жесткость БТР, мы использовали полиакриламидные гели с жесткостью 500 па27 и функционализировали гель с активировав антигенами. В этом протоколе мы функционализировали поверхность полиакриламинидного геля с лизозимом куриного яйца (HEL). Это позволяет измерять силы, генерируемые стимуляцией БЦР путем вовлечения антигенного связывающего участка. Использование этого антигена и HEL-специфических В-клеток от мышей MD4 обеспечивает относительно равномерное силовое поколение в ответ на антигенную перевязку28. Тем не менее, другие молекулы (такие как анти-IgM для мышей B6) могут быть привиты на гель, но силы, генерируемые в этих случаях может быть более неоднородным и менее интенсивным. Поскольку В-клетки являются небольшими клетками (диаметр 6 мкм), количество бусин было оптимизировано, чтобы быть максимальным, но все еще отслеживается. Для крупных клеток, которые оказывают силы кПа на их субстраты, можно достичь удовлетворительных результатов с помощью относительно редких бусин или выполнения простых частиц изображения велоциметрии (PIV) для реконструкции поля деформации. Тем не менее, для небольших клеток, таких как B лимфоцитов, которые оказывают стресс размером до 50 Па, использование одной частицы отслеживания требуется (частицы отслеживания велоциметрии, PTV) для достижения желаемой точности при реконструкции поля деформации. Для того, чтобы надежно отслеживать бисер индивидуально, увеличение объектива должно быть не менее 60x и его численная диафрагма около 1,3. Таким образом, гели должны быть относительно тонкими (lt;50 мкм), в противном случае шарики не видны, поскольку они находятся выше рабочего расстояния цели.
Основной протокол состоит из трех разделов: гелевая подготовка, функционализация геля и визуализация; еще два раздела являются необязательными и предназначены для количественной оценки и визуализации флуоресцентных клеток.
протокол
1. Гелевая подготовка
- Силанизация поддержки геля
- Активируйте крышку или стеклянное дно чашки Петри (которая будет использоваться в качестве геля поддержки) с УФ-лампой в течение 2 мин (подождите 30 с перед воздействием УФ-лампы, чтобы избежать воздействия остаточного озона).
- Силанизировать крышки / стекло дно блюдо с использованием 200 йл аминопропилтриметоксиоксана (APTMS) в течение 5 мин. Это подготовит поддержку ковалентной привязки геля.
- Тщательно промыть крышку / стекло дно блюдо с ультра-чистой водой.
- Высушите крышку/стеклянное дно блюдо с помощью вакуумного аспирации.
- Подготовка 18-мм крышки используется для выравнивания геля
- Чтобы подготовить крышки, сначала положите их в керамический держатель крышки. Затем положите держатель крышки в небольшой стакан (50 мл) и залить силиконовым реагентом (хранится при 4 градусов по Цельсию, многоразовые) над крышками, будучи уверенным, чтобы полностью покрыть их.
- Обложка стакан с алюминиевой фольгой и инкубировать в течение 3 мин при комнатной температуре. Во время ожидания заполните большой стакан (500 мл) ультра-чистой водой. После 3 минут инкубации в силиконизации реагента, передача держатель крышки с крышками в стакан воды.
- Тщательно промыть крышки ультра-чистой водой, хорошо высушить их и держать на бумажных салфетках. Для получения наилучших результатов немедленно перейти к следующему разделу.
- Полимеризация геля
- Для гелей 0,5 кПа смешайте 75 МКЛ из 40% акриламида с 30 МКЛ 2% бисакриламинида (кросслинкера) и 895 МКЛ фосфатно-буферного солевого раствора (PBS). Этот премикс может храниться до одного месяца при 4 градусах Цельсия.
- К 167 МКЛ 0,5 кПа гель премикс, добавить 1% (1,67 МЛ) бисера, вихря и sonicate в течение 5 мин в ванне sonicator (стандартная скамейка ультразвуковой очиститель с мощностью 50-100 Вт и частота 40 кГц). Держите смесь защищенной от света с помощью алюминиевой фольги.
ПРИМЕЧАНИЕ: Премикс не полимеризируется до тех пор, пока не будет добавлен инициатор (TEMED). - Чтобы катализировать полимеризацию, добавьте 1% (1,67 л) 10% w/v цинульфата аммония (APS).
- Чтобы инициировать полимеризацию, добавьте 0,1% (0,2 МЛ) N, N, НС, Нэ-Тетратиэтиленедиамин (TEMED). Смешайте с пипеткой. После того, как APS и TEMED были добавлены, гель быстро полимеризуется, так что быстро переходите к литью геля.
- Гель литья
- Pipet 9 йл гель смеси на каждом coverslip / стекло нижней блюдо (капля в центре, рисунок 1A)
- Поместите силанизированные / гидрофобные крышки и сгладить гель(рисунок 1B). Используя типсы, нажмите на крышку, чтобы обеспечить распространение геля по всей области крышки(рисунок 1C), пока он не начнет просачиваться.
- Инвертировать крышку / стекло нижней блюдо в большой чашки Петри и нажмите его на скамейке, чтобы заставить бисер собирается к поверхности геля (Рисунок 1D).
- Накрыть алюминиевой фольгой и оставить на 1 ч полимеризировать при комнатной температуре во влажной камере (т.е. поставить мокрую ткань над блюдом, чтобы предотвратить испарение).
- После 1 ч, добавить PBS в образец для облегчения релиз coverslip. Аккуратно снимите крышку с помощью иглы (покрытие с различными силанами должно позволить легко отслаиваться от крышки из геля, рисунок 1E).
- Оставьте гель в PBS.
ПРИМЕЧАНИЕ: Гели теперь могут храниться в PBS при 4 градусов по Цельсию в течение 5-7 дней, но рекомендуется использовать их в течение 48 ч.
2. Функционализация геля
- Приготовьте раствор сульфосучинимидил 6-(4'-azido-2'-nitrophenylamino)hexanoate (Sulfo SANPAH) при 0,5 мг/мл в буфере HEPES 10 мМ. Это может храниться при 4 градусах Цельсия, покрытых алюминиевой фольгой в течение одной недели.
- Аспирировать PBS из гелей.
- Добавьте 150 мкл Сульфо САНПАХ в гель при комнатной температуре(рисунок 1F).
- Выставить гель для УФ-обработки в течение 2 минут, чтобы фотоактивировать сайты Сульфо SANPAH и сделать его придерживаться поверхности геля.
- Вымойте с PBS три раза( Рисунок 1G).
- Повторите шаги 2.2-2.5.
- Добавьте 250 мкл HEL (100 мкг/мл) к каждому гелю и инкубировать на ночь во влажной камере при 4 градусах Цельсия на ночь, сохраняя при этом покрытые алюминиевой фольгой (Рисунок 1H).
- Удалить антиген HEL и мыть с PBS три раза.
ПРИМЕЧАНИЕ: HEL действует как антиген, так и как молекула адгезии. Его можно заменить другими молекулами, которые связываются с рецептором (например, антимоша igM, Bovine Serum Albumin, Ovalbumin) или смешиваются с лигандами интегрина (например, ICAM1 связывание с LFA1). При необходимости экстракция антигена может наблюдаться с помощью флуоресцентной версии HEL (полученной путем окрашивания молекулы набором для маркировки белка, см. шаг 4). Обратите внимание, что та или иная концентрация навалом может не дать той же концентрации поверхности на геле, что и на стекле: это необходимо количественно определить с помощью вторичного окрашивания, если требуется прямое сравнение.
3. Загрузка клеток и визуализация
- Перед визуализацией удалите PBS из гелей и добавьте 500 МКЛ В-клеточных медиа (RPMI 1640, 10% декомплементированных фетальных икроножных сывороток, 1% пенициллин-стрептомицин, 2% пируват натрия, 50uM Меркаптоэтанол и 1X несущественных аминокислот) и дайте им уравночные кислоты.
- Подготовка клеток
- Очистка первичных В-клеток от селезенки в соответствии с протоколом отрицательного отбора (см. таблицу материалов). Типичный окончательный выход клеток B составляет около 1 х 107 клеток. Сосредоточьте это до 3 х 106 клеток/мл в среде В-клеток (RPMI-1640 дополнен 10% сыворотки теленка плода, 1% пенициллин-стрептомицин, 0,1% меркаптоэтанола и 2% пирувата натрия).
- Храните ячейки по мере необходимости до 6 ч при 4 градусах Цельсия.
- Держите ячейки на уровне 37 градусов по Цельсию в течение 30 минут до получения изображения.
- Изображений
- Используйте конфокальный микроскоп с тепловым и (возможно) CO2 управления.
ПРИМЕЧАНИЕ: Независимо от того, используется конфокальный или вращающийся диск микроскоп, важно использовать объектив / пинхол, который позволяет размеру пикселя Lt;200 nm комфортно отслеживать бисер в фазе анализа (например, 60x, NA 1.3). Эпифлюоресценция микроскопии также могут быть использованы, однако она обеспечивает более низкий сигнал к шуму соотношение и может сделать отдельные шарик отслеживания сложнее. - Два основных слоя бисера появятся на дне и в верхней части геля. Сосредоточьтесь на геле плоскости.
ПРИМЕЧАНИЕ: Хороший гель появится как звездное небо, с бисером примерно равномерно распределены на той же плоскости. - Запрограммируйте приобретение на 30 мин с частотой кадров 5 с (это адаптируется к потребностям эксперимента, например, приобретает другие цвета, приобретает стек z и т.д.)
- Аспирировать средства массовой информации из геля, оставляя около 200 мл средств массовой информации на гель. Распоимите гель на микроскопе и найдите поверхностный слой бисера и хорошую овеную область на геле.
- Добавьте 80 МКЛ клеток (избегайте прикосновения к гелю для поддержания фокусировки).
- Убедитесь, что фокус по-прежнему корректен и что клетки можно увидеть спускаясь в области (под передаваемым светом). Запустите приобретение до того, как клетки достигнут геля.
- В случае случайного контакта с гелем, вибрации, или фокус дрейфа, настроить фокус.
ПРИМЕЧАНИЕ: Очень важно собрать изображение расслабленной гель, и это может быть любое изображение, принятое до прибытия клеток на гель.
- Используйте конфокальный микроскоп с тепловым и (возможно) CO2 управления.
4. Флуоресцентный эксперимент по извлечению HEL
- Подготовка флуоресцентных HEL путем связывания флуоресцентный краситель (цвета отличается от бисера один, таких как Alexa 555), см. Таблицу материалов.
- В шаге 2.7 замените обычный HEL на флуоресцентный HEL.
- Приобретайте изображения с низкими настройками освещения или низкой частотой кадров (например, 2 кадра в минуту), чтобы избежать отбеливания фотографий.
- Для количественной оценки извлечения HEL вычислите интенсивность, интегрированную в область ячейки для каждого кадра I (t), исправленного и нормализованного по интенсивности I (0) кадра 0 в соответствии с формулой:
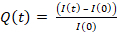
ПРИМЕЧАНИЕ: Антиген, конъюгированный флюорофором, не виден (вероятно, из-за закалки флюорофора на поверхности геля), но его присутствие на геле может быть проверено анти-HEL и флуоресцентными вторичными антителами. Это может быть проверено, что флуорофор действительно флуоресцентные, когда отделены, лишая его от геля с coverslip покрыты анти-HEL и выявление его со вторичным флуоресцентным антителом (на крышке)6. Сигнал извлеченного антигена очень тусклый и иногда маскируется утечкой бисера. Если кто-то заинтересован только в экстракции антигена, рекомендуется готовить гель без бисера (пропустить шаги 1.3.2 и 1.4.3).
5. Флуоресценция изображений
- Получить флуоресцентные В-клетки путем очистки В-клеток от селезенки генетически модифицированных мышей, как это делается для дикого типа (например, от Lifeact-GFP или Myosin II GFP мышей).
- Для визуализации флуоресцентных клеток используйте (если это возможно) вращающийся дисковый микроскоп с целью погружения в воду на большие расстояния 40x-100x.
- Держите продолжительность экспозиции и частоту кадров низкой, чтобы избежать отбеливания.
ПРИМЕЧАНИЕ: Функция равномерного распространения в Кью сильно деградировала из-за присутствия геля, поэтому мы предлагаем использовать цель погружения в воду. Прямая микроскопия с целями погружения воды страдает от сильных сферических аберраций, вызванных наличием (сферической) клетки (и ядра клетки) на пути выбросов.
6. Анализ
ПРИМЕЧАНИЕ: Анализ данных в целом выполняется путем первой коррекции всего стека для дрейфа, нахождения бисера в каждом кадре, отслеживания их движений по отношению к эталонной рамке (принято в отсутствие ячеек), интерполяции поля перемещения и инвертирования проблемы для получения стресса с помощью Фурьетрансформировать 29. С этой целью мы предлагаем использовать комбинацию программ ImageJ Macro и MATLAB, загружаемых из онлайн-хранилища30.
- Откройте фильм в ImageJ как стопку изображений
- Вы запустите макрос "Crop_and_save.ijm"
- Выберите области интересов (ROI) с помощью инструмента "Rectangle" и добавьте их в список рентабельности инвестиций с помощью ключа 't'.
- При обрезке ячейки, не забудьте включить область, по крайней мере 5-10 пикселей неподвижных бусин. Исключите из анализа ячейки, которые находятся слишком близко к границам или к другим ячейкам. Когда закончите нажмите на кнопку "ОК".
- Макрос предлагает маску ячейки: если это удовлетворительно, нажмите на кнопку "Хорошо". Если это неудовлетворительно, нажмите на кнопку "Не в порядке", а затем вручную выберите закрытый регион с любым инструментом выбора (например, "Freehand" или "Oval") и нажмите на кнопку "Продолжить".
- Откройте MATLAB и запустите "TFM_v1.m".
- Вввемите необходимые параметры: в частности, проверьте свойства изображения (размер пикселя, интервал времени приобретения) и свойства геля (коэффициент Young modulus E, Poisson).
- Справочное изображение будет первым по умолчанию. Установите его на другой кадр, если это необходимо или установите его на "0" для загрузки внешнего файла.
- Найдите выводы программного обеспечения в том же каталоге, что и исходный файл (для описания см. User_notice.pdf файл). Это включает в себя предварительный трек бисера ("FILENAME.fig"), сюжет контрактной энергии с течением времени ("FILENAME_energy.fig"), таблицу из нескольких количеств, интегрированных над клеткой (энергия, область, моменты и т.д.) "FILENAME_finaltable.mat", структура, содержащая смещение и силовое поле, фильмы о бисере, поле перемещения, стресс и энергию (которые могут быть открыты с любым avi читателя).
ПРИМЕЧАНИЕ: В входных параметрах "размер окна" является окном, над которым интерполируется перемещение, следовательно, окончательным разрешением поля напряжения и перемещения. Это установлено на несколько (по умолчанию четыре) пикселей. Не рекомендуется уменьшать это, поскольку это искусственно увеличит разрешение путем интерполяции регионов, где нет бисера.
Результаты
Учитывая размер клеток, алгоритмы, которые извлекают карту смещения бисера с помощью коррелятивных методов (таких как велоциметрия изображения частиц), в целом не очень точны. Однако в зависимости от степени требуемого разрешения, можно легко получить качественные результаты с помощью бесплатного плагина Fiji/ImageJ31,32. Хотя этот подход достаточен для сравнения стимулирующих и нестимулирующего условий, для тщательного анализа мы рекомендуем использовать наше программное обеспечение,загружаемое из онлайн-хранилища 30,которое отслеживает бисер индивидуально и предоставляет карту поля перемещения в данный момент времени в качестве интерполяции отдельных перемещенийшарика 33. На данный момент возможно несколько количественных данных. Например (предполагая, что перемещение вызвано только стрессом, касательным для поверхности геля) программное обеспечение также обеспечивает стресс в каждой точке, вызывая, что конкретные карты перемещения. Это своего рода "проблема инверсии": перемещение в определенный момент зависит от суммы всех сил, применяемых во всех других точках. "Алгоритм инверсии" учитывает физические параметры субстрата: его жесткость (молодой модуль) и соотношение Пуассона. Прямые алгоритмы, как правило, очень точны, но вычислительно дороги. Алгоритмы, основанные на преобразовании Фурье, как и наша, выполняют по существу деконволюцию в пространстве Фурье и являются более эффективными, но склонными к некоторым ошибкам (главным образом из-за шага интерполяции). Эти алгоритмы, как правило, требуют настройки параметра, который предотвращает небольшие локальные (и потенциально артефактные) перемещения, чтобы стать слишком актуальными при вычислении поля напряжения (параметрготизации Тихонова 8,29; переменная "Екоманизация" в окне диалога; здесь мы обычно устанавливаем равные 5 х 10-19). Для более продвинутой интерпретации и анализа, таких как пространственно-временные корреляции, локальные движения, корреляции с флуоресцентными каналами, мы рекомендуем сотрудничать с экспертами в этой области. Для обзора вычислительных методовсм.
Как уже упоминалось выше, правильные изображения бисера выглядят как "звездное небо", равномерное и случайное распределение ярких пятен(рисунок 2A). Данные и анализ не являются надежными, когда количество бусинок слишком низко(рисунок 2B)или изображение находится вне фокуса(рисунок 2C). После того, как В-клетки поселились на поверхности геля, шарики под клетками начинают двигаться из-за силы тяги, оказываемой клеткой на гель. Кадры, для которых шарики не отслеживаются, должны быть отброшены.
В качестве проверки можно наблюдать на глазу движение бисера, сравнивая «справочную рамку», обычно предшествующую первому контакту клетки с субстратом. Приблизительные результаты можно получить из одного отслеживания частиц (например, Trackmate, Фиджи 34), как это делается на рисунке 3A. Анализ обеспечивает сегментацию бусин в справочном изображении («FILENAME.fig») в качестве управления.
С программным обеспечением мы предлагаем, можно получить смещения (Рисунок 3B) и стресс поле (вектор локального стресса на каждом пикселе, и каждый момент времени, полученные инверсии из поля перемещения, рисунок 3C). Scalar продукт смещения и силовых полей, интегрированных на площади клетки обеспечивает общую работу, оказываемую ячейкой на подложку (рисунок 4A). Для этого вычисления требуется маска ячейки, введенная в шаге 6.2 протокола.
Для сравнения двух биологических условий (как активация HEL по сравнению с неактивной субстрат BSA, или дикий тип по сравнению с нокаутом) полезно вычислитьсреднюю кривую (рисунок 4B) или, что еще более синтетически, среднее значение за последний раз точек (20 мин), где энергия достигает плато (Рисунок 4C). Когда пространственная информация сил актуальна, можно сравнить отдельные точки времени каждого состояния(рисунок 4D). Для более глубокого анализа обратитесь к Kumari et al.6.
Пример флуоресценции антигена извлечения промежуток времени показан на рисунке 5A: прогрессивный вид сигналов флуоресценции при синапсе указал антигенный отслоение от геля. Средняя кривая извлечения с интервалом доверия (стандартная погрешность среднего) более 15 ячеек показана на рисунке 5B.
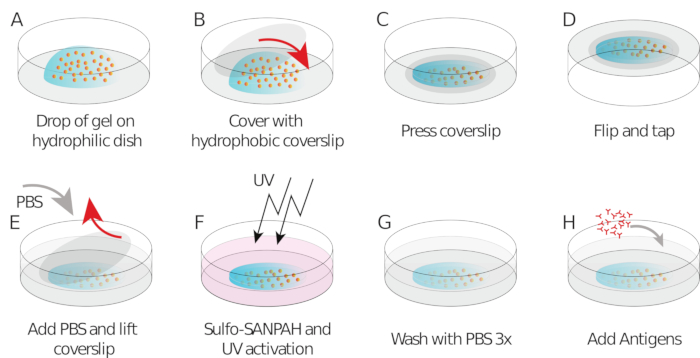
Рисунок 1: Схема, показывающая подготовку геля и его функционализацию. Шаги описаны в протоколе. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Три примера бисерных изображений различных качеств. (A) Пример изображения шарика с правильным соотношением сигнала к шуму и правильной плотностью. (B)Примеры изображений с слишком недостаточным количеством бисера и(C) из фокуса плоскости. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
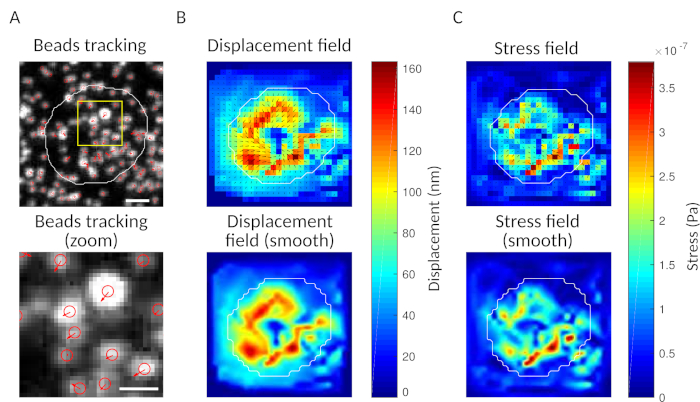
Рисунок 3: Обработка изображений для извлечения силового поля. (A) Пример изображения бисера (очертания клетки в белом, извлеченные из изображения передачи), отслеживание бисера во время т 5 мин (красная накладка) и смещения (стрелки) по отношению к времени т 0 мин (шкала бар 5 мкм). (B)Интерполированное поле перемещения (представленное как векторная колчан и карта величины, стрелки пропорциональны смещению (нм); см. цветовую планку справа); внизу: более гладкое изображение величины (полученное интерполяцией с бикубической функцией). (C)Стрессовое поле из поля смещения в панели B (представлено как векторная колчан и карта величины; стрелки пропорциональны стрессу стрижки (Pa); см. цветовую планку справа); внизу: более гладкое изображение величины (полученное интерполяцией с бикубической функцией). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
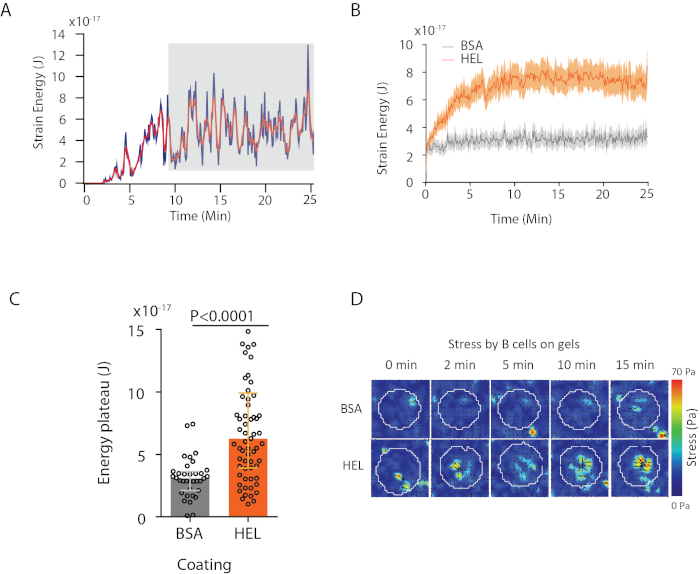
Рисунок 4: Пример информации, которая может быть извлечена из силовых и водоизмещений. ( Пример эволюции энергии во времени для одной ячейки: фаза плато (выделенная серым цветом) появляется примерно через 10 минут. (B) Сравнение средних кривых энергии и (C) относительных уровней плато для 65 клеток, покрытых HEL (активация) покрытием гель и 35 клеток на BSA (не активации) покрытием гель (средний ± межквартильные диапазоны показаны, Манн-Уитни тест был использован для статистической значимости). (D)Карты цветов замедленного действия стресса для HEL и управления состоянием BSA; показаны как масштабы, так и колчаны. Эти изображения были адаптированы из Кумари и др.6. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
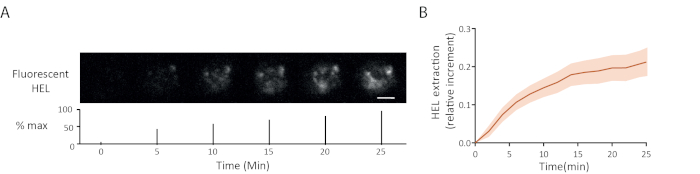
Рисунок 5: Пример экспериментов с флуоресцентным антигеном.(A)Промежуток времени экстракции флуоресцентного HEL (см. процент от максимума, планка масштаба 3 м). (B) Сбор антигенов с течением времени (средняя ± SEM, n No 15). Эти изображения были адаптированы из Кумари и др.6. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Описанный здесь метод TFM позволяет систематически изучать активные механические возможности В-клеток. В контексте В-клеток это связано со способностью извлекать и интернализировать антиген. По сравнению с другими методами TFM, представленный здесь протокол прост и довольно воспроизводим: жесткость, измеряемая отступом стеклянной микросферы и использованием модели Hertz, составляет от 400 до 600 па. Подобные протоколы успешно используются не только дляВ-клеток 35, но и дляТ-клеток 36. По сравнению с нанопиллярами (также используемымидля Т-лимфоцитов 37)он обеспечивает плоскую однородную поверхность, поэтому результаты легче интерпретировать, так как взаимодействие геля в основном ограничено, чтобы быть касательным к поверхности.
Протокол, который мы описали, дает доступ к spatiotemporal динамике сил, оказываемых клетками В на антиген-представляя субстраты. На пространственном уровне это дает информацию о локализации сил, а в сочетании с флуоресцентной микроскопией позволяет экспериментатору соотносить локальные силы с наличием конкретных молекул (т.е. компонентов цитоскелета или каскада сигнализации BCR). На временном уровне можно интегрировать количество (например, общую энергию или общий стресс), чтобы обеспечить одно значение за точку времени и уменьшить шум. Это позволяет вовремя заслеировать эволюцию силы тяги (рост и плато) и наличие пульсирующих узоров.
Критические экспериментальные аспекты анализа описаны следующим образом. i) Плотность клеток: для проведения правильного анализа клетки должны быть достаточно разделены. Мы считаем, что клетка является анализируемой, если вокруг нее имеется пустая область собственного размера. ii) Трансмиссионные изображения: рекомендуется собрать по крайней мере трансмиссионные изображения клеток во время эксперимента, которые будут использоваться в качестве маски в анализе. iii) Количество бусин на изображении: мы предлагаем анализировать только изображения, где количество бусинок в синапсе составляет от 30 до 200 (т.е. 1-8 бусин/мк2). Более низкая плотность не позволяет обеспечить адекватную реконструкцию перемещения карт. Высокая плотность бисера делает отслеживание отдельных частиц ненадежным. iv) количество бусин должно быть постоянным во время эксперимента; однако колебания могут возникать из-за небольшой изменчивости условий визуализации (особенно в бисере, которые находятся слишком близко друг к другу). Фокус дрейф, если происходит, должны быть исправлены и проблемные кадры должны быть отброшены. v) качество геля: следует отказаться от гелей со слишком большим количеством трещин, изменчивости в распределении бисера или слишком толстых гелей. vi) В зависимости от типа клетки, после повторных воздействий, клетки в поздних точках времени (nogt;300 кадров) могут страдать от фототоксических эффектов. Целесообразно запустить программу на маске, лишенной клеток, в качестве «базовой линии», которую можно сравнить с данными. Это обеспечивает величину уровня шума исключительно из-за экспериментальных условий.
Гели, используемые для измерения силы тяги в классической адгезии позволяют для исследования процессов, которые происходят на фокусной адгезии (актин потоков и набора сигнальных молекул) - точки, гдесилы применяются 38,39. Тем не менее, силы в синапсе не применяются через фокусные спайки. Spatiotemporal картина генерации силы на B-клеток иммунной синапзы не было количественно исследовано с помощью этого метода до недавнего времени. Используя TFM, мы наблюдали в первый раз, сила шаблонирования на В-клеток иммунной синапзы, как это представлено в нашем недавнемисследовании 6, открывая обнадеживающие перспективы в изучении лимфоцитов.
Примечательно, что этот метод использует изображение, взятое до прибытия ячеек на гель в качестве эталонного изображения для силовых вычислений. Обычные протоколы TFM предлагают сделать эталонное изображение в конце эксперимента, после отсоединения ячеек трипсином; это позволяет экспериментатору искать область, богатую клетками. Хотя это возможно и здесь, трипсин является довольно неэффективным при отсоединения В-клеток от антигенного гель, нужно долго ждать отслоения и риск модификации геля и движений (которые делают весь набор данных неэксплуатируемым) выше.
Представленный здесь метод является гибким и может быть применен для изучения влияния других сигналов на иммунную синапсис, поскольку он позволяет прививать другие белки на поверхность геля (например, были протестированы интегрин лиганды и иммуноглобулины) и даже флуоресцентный антиген (см. раздел 4). Кроме того, клетки остаются доступными для экспериментатора для лечения наркомании и местных возмущений. Наконец, метод также совместим с изображениями фиксированных ячеек. Для этих наблюдений рекомендуется сделать гель на крышке, испачкать клетки, приклеить крышку на слайде и только потом добавить монтажные средства и еще одну крышку. Наблюдение будет сделано с гелем на вершине, чтобы избежать деградации изображения через гель.
Возможными подводными камнями являются изменчивость геля в полимеризации и покрытии. Проблемы полимеризации в основном связаны с качеством инициатора/катализатора. Кроме того, гель может надуваться, особенно если не используется сразу после сборки. Эта проблема, кажется, не резко влияет на механические свойства геля, но это может сделать слой шарика недоступным для цели, фактически делая гель бесполезным. Мы рекомендуем готовить дополнительные гели для каждого состояния, когда эта проблема появляется. Там может быть также определенная изменчивость в покрытии, и очень важно иметь свежеотбавленный Сульфо SANPAH.
В заключение мы описали простой, дешевый и воспроизводимый метод измерения сил, оказываемых клетками группы В при иммунологическом синапсе при активации bcR лигандом. Он может быть адаптирован для изучения реакции на другие лиганды и другие виды лимфоцитов (клетки памяти В, Т-клетки и т.д.) с использованием правильного рецептора лиганда.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Авторы благодарят М. Болджер-Манро за критическое чтение и признают Nikon Imaging Center@CNRS-InstitutCurie и PICT-IBiSA, Институт Кюри, Париж, член Франции-BioImaging национальной исследовательской инфраструктуры, за поддержку в приобретении изображений и Кюри животных фонда. PP была поддержана CNRS. АК и JP были поддержаны Париж Декарт PhD стипендий и Ecole Doctorale FIRE-Программа Беттанкур. Этот проект финансировался за счет грантов PP (ANR-10-JCJC-1504-Immuphy) и AMLD (ANR-PoLyBex-12-BSV3-0014-001, ERC-Strapacemi-GA 243103).
Материалы
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethoxysilane (APTMS) | Sigma-Aldrich | 281778 | Store aliquoted, protected from humidity |
| 40% Acrylamide Solution | Biorad | 1610140 | |
| Alexa555 microscale protein labeling kit | Molecular Probes | A30007 | |
| Ammonium Persulfate (APS) | Sigma-Aldrich | A3678 | |
| B cell Isolation Kit, Mouse | Miltenyi Biotec | 130-090-862 | |
| B-mercaptoethanol | Gibco | 31350-010 | |
| 2% Bis Solution | Biorad | 161-0142 | |
| Bovine Serum Albumin (BSA) | Euromedex | 04-100-812-C | |
| Coverslip 18mm | VWR | 631-1580 | |
| Fetal calf serum | PAA | A15-151 | Decomplemented (40min @56°C) |
| Fluorodishes FD35 | World Precision Instruments, Inc | FD35100 | |
| Fluosphere: carboxylate-modified, 0.2um, dark red | Molecular Probes | F8807 | |
| Hen Egg Lysozyme | Sigma-Aldrich | L6876 | Stocked in aliquote 100mg/ml |
| MEM Non-Essential Amino Acids Solution (100X) | Thermofisher/Gibco | 11140035 | |
| N,N,N',N'-tetrametiletilendiammine (TEMED) | Euromedex | 50406-B | |
| PBS (Phosfate Buffer Saline) | Gibco | 10010-015 | |
| Penicillin–streptomycin | Gibco | 15140-010 | |
| RMPI 1640 – Glutamax I | Thermofisher | 61870-010 | |
| Sigmacote | Sigma-Aldrich | SL2 | |
| Sodium pyruvate | Gibco | 11360-039 | |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate (Sulfo-SANPAH) | Thermo Scientific | 22589 |
Ссылки
- Yuseff, M. -I., Pierobon, P., Reversat, A., Lennon-Duménil, A. -M. How B cells capture, process and present antigens: a crucial role for cell polarity. Nature Reviews. Immunology. 13 (7), 475-486 (2013).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. The Journal of Cell Biology. 216 (1), 217-230 (2017).
- Shaheen, S., Wan, Z., et al. Substrate stiffness governs the initiation of B cell activation by the concerted signaling of PKCβ and focal adhesion kinase. eLife. 6, (2017).
- Natkanski, E., et al. B cells use mechanical energy to discriminate antigen affinities. Science. 340 (6140), 1587-1590 (2013).
- Wan, Z., Chen, X., et al. The activation of IgM- or isotype-switched IgG- and IgE-BCR exhibits distinct mechanical force sensitivity and threshold. eLife. 4, (2015).
- Kumari, A., Pineau, J., et al. Actomyosin-driven force patterning controls endocytosis at the immune synapse. Nature Communications. 10 (1), 2870(2019).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophysical Journal. 94 (1), 207-220 (2008).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochimica et Biophysica Acta. 1853 (11), Pt B 3095-3104 (2015).
- Colin-York, H., Shrestha, D., et al. Super-Resolved Traction Force Microscopy (STFM). Nano Letters. 16 (4), 2633-2638 (2016).
- Stubb, A., Laine, R. F., Guzmán, C., Henriques, R., Jacquemet, G., Ivaska, J. Fluctuation-Based Super-Resolution Traction Force Microscopy. BioRxiv. , (2019).
- Gutierrez, E., Tkachenko, E., et al. High refractive index silicone gels for simultaneous total internal reflection fluorescence and traction force microscopy of adherent cells. Plos One. 6 (9), 23807(2011).
- Bergert, M., Lendenmann, T., et al. Confocal reference free traction force microscopy. Nature Communications. 7, 12814(2016).
- Schoen, I., Hu, W., Klotzsch, E., Vogel, V. Probing cellular traction forces by micropillar arrays: contribution of substrate warping to pillar deflection. Nano Letters. 10 (5), 1823-1830 (2010).
- Colin-York, H., Fritzsche, M. The future of traction force microscopy. Current Opinion in Biomedical Engineering. 5, 1-5 (2018).
- Feng, Y., et al. Mechanosensing drives acuity of αβ T-cell recognition. Proceedings of the National Academy of Sciences of the United States of America. 114 (39), 8204-8213 (2017).
- Spillane, K. M., Tolar, P. DNA-Based Probes for Measuring Mechanical Forces in Cell-Cell Contacts: Application to B Cell Antigen Extraction from Immune Synapses. Methods in Molecular Biology. 1707, 69-80 (2018).
- Stabley, D. R., Jurchenko, C., Marshall, S. S., Salaita, K. S. Visualizing mechanical tension across membrane receptors with a fluorescent sensor. Nature Methods. 9 (1), 64-67 (2011).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397 (6714), 50-53 (1999).
- Hinterdorfer, P., Dufrêne, Y. F. Detection and localization of single molecular recognition events using atomic force microscopy. Nature Methods. 3 (5), 347-355 (2006).
- Sawicka, A., Babataheri, A., et al. Micropipette force probe to quantify single-cell force generation: application to T-cell activation. Molecular Biology of the Cell. 28 (23), 3229-3239 (2017).
- Desprat, N., Guiroy, A., Asnacios, A. Microplates-based rheometer for a single living cell. Review of Scientific Instruments. 77 (5), 055111(2006).
- Labernadie, A., Bouissou, A., et al. Protrusion force microscopy reveals oscillatory force generation and mechanosensing activity of human macrophage podosomes. Nature Communications. 5, 5343(2014).
- Bouissou, A., Proag, A., et al. Protrusion force microscopy: A method to quantify forces developed by cell protrusions. Journal of Visualized Experiments. (136), 57636(2018).
- Kronenberg, N. M., Liehm, P., et al. Long-term imaging of cellular forces with high precision by elastic resonator interference stress microscopy. Nature Cell Biology. 19 (7), 864-872 (2017).
- Basu, R., Whitlock, B. M., et al. Cytotoxic T cells use mechanical force to potentiate target cell killing. Cell. 165 (1), 100-110 (2016).
- Bufi, N., Saitakis, M., et al. Human Primary Immune Cells Exhibit Distinct Mechanical Properties that Are Modified by Inflammation. Biophysical Journal. 108 (9), 2181-2190 (2015).
- Goodnow, C. C., Crosbie, J., et al. Altered immunoglobulin expression and functional silencing of self-reactive B lymphocytes in transgenic mice. Nature. 334 (6184), 676-682 (1988).
- Butler, J. P., Tolić-Nørrelykke, I. M., Fabry, B., Fredberg, J. J. Traction fields, moments, and strain energy that cells exert on their surroundings. American Journal of Physiology. Cell Physiology. 282 (3), 595-605 (2002).
- MBPPlab/TFM_v1: Software for Time dependent Traction Force Microscopy. , Available from: https://github.com/MBPPlab/TFM_v1 (2019).
- Tseng, Q., Duchemin-Pelletier, E., et al. Spatial organization of the extracellular matrix regulates cell-cell junction positioning. Proceedings of the National Academy of Sciences of the United States of America. 109 (5), 1506-1511 (2012).
- ImageJ plugins by Qingzong TSENG. , Available from: https://sites.google.com/site/qingzongtseng/ (2019).
- Plotnikov, S. V., Sabass, B., Schwarz, U. S., Waterman, C. M. High-resolution traction force microscopy. Methods in Cell Biology. 123, 367-394 (2014).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Wang, J., Lin, F., et al. Profiling the origin, dynamics, and function of traction force in B cell activation. Science Signaling. 11 (542), (2018).
- Hui, K. L., Balagopalan, L., Samelson, L. E., Upadhyaya, A. Cytoskeletal forces during signaling activation in Jurkat T-cells. Molecular Biology of the Cell. 26 (4), 685-695 (2015).
- Bashour, K. T., Gondarenko, A., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences of the United States of America. 111 (6), 2241-2246 (2014).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. The Journal of Cell Biology. 183 (6), 999-1005 (2008).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. Journal of Physics. Condensed Matter. 22 (19), 194104(2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены