Method Article
Microscopie de force de traction pour étudier l’activation de lymphocyte de B
Dans cet article
Résumé
Ici, nous présentons un protocole utilisé pour effectuer des expériences de microscopie de force de traction sur les cellules B. Nous décrivons la préparation de gels polyacrylamides mous et leur fonctionnalisation, ainsi que l’acquisition de données au microscope et un résumé de l’analyse des données.
Résumé
La microscopie de force de traction (TFM) permet de mesurer les forces produites par une cellule sur un substrat. Cette technique infère des mesures de force de traction à partir d’un champ de déplacement observé expérimentalement produit par une cellule tirant sur un substrat élastique. Ici, nous avons adapté TFM pour étudier la structure spatiale et temporelle du champ de force exercé par les cellules B lorsqu’il est activé par l’engagement antigène du récepteur des cellules B. La rigidité du gel, la densité des perles et la fonctionnalisation des protéines doivent être optimisées pour l’étude de cellules relativement petites (~ 6 μm) qui interagissent avec les ligands et réagissent spécifiquement aux ligands pour les récepteurs de surface cellulaire.
Introduction
Les cellules B sont les cellules productrices d’anticorps du système immunitaire. Pour activer la réponse immunitaire adaptative, ils acquièrent d’abord l’antigène sous une forme indigène (c.-à-d. non traitée) par l’intermédiaire d’un récepteur spécifique appelé récepteur des cellules B (BCR)1. Ce processus se produit dans la zone cellulaire du ganglion lymphatique B. Même si certains antigènes peuvent atteindre la cellule B par des fluides lymphatiques, la plupart des antigènes, en particulier avec un poids moléculaire élevé (>70 kDa, qui est la taille limite pour les conduits lymphatiques) sont en effet présentés sous leur forme indigène à la surface d’une cellule de présentation d’antigène (APC), typiquement un macrophage de sinus subcapsulaire ou une cellule dendritique folliculaire, par des récepteurs de lectine ou de Fc (non spécifiques). Le contact avec cette cellule conduit à la formation d’une synapse immunitaire où le BCR exerce une force sur les antigènes associés à l’APC. La liaison d’un antigène au BCR initie la signalisation BCR, qui peut activer des mécanismes générateurs de force. Ces forces pourraient être importantes pour amplifier la signalisation BCR, mais sont également essentielles pour que les cellules B extraient puis intériorisent l’antigène.
Des études récentes ont montré que le BCR est en effet mécanosensible2. Par exemple, des substrats plus rigides provoquent une signalisation BCRaméliorée 3. En outre, la force générée à la synapse immunitaire tire sur les BCR simples pour sonder son affinité à l’antigène et ainsi assurer la discrimination d’affinité4. Il est donc intéressant d’étudier la réponse mécanique des cellules B à la présentation de l’antigène et de disséquer cette réponse en termes de type de récepteurs impliqués (IgG/IgM)5,molécules d’adhérence (ligands d’intégrine) ou dans les cellules pharmacologiques et génétiquement modifiées (c.-à-d. le silence d’une protéine en aval de la signalisation BCR ou de la dynamique du cytosquelette)6.
Une méthode simple pour observer la réponse d’une cellule à un substrat de rigidité physiologique et, en même temps, les forces d’étude exercées sur le substrat est microscopie de force de traction (TFM). TFM consiste à observer le champ de déplacement produit par la cellule tirant sur un substrat élastique. À l’origine, la déformation du gel a été observée par les rides de l’élastomère lui-même par microscopie à contraste phase7, mais l’insertion de microbilles de fluorescence comme marqueurs fiduciaux a permis une meilleure résolution et est depuis devenu la norme8. Cette méthode a été utilisée pour étudier la force de traction exercée par les cellules adhérentes, les tissus et même les organoïdes incorporés dans les gels. Plusieurs variantes de TFM ont étédéveloppées 9 comprenant, la combinaison avec la microscopie de superrésolution (c.-à-d., STED10 ou SRRF11),la modification de l’index réfractif du gel pour permettre la microscopie de TIRF12,remplaçant des perles par des modèles nano-imprimés13,et utilisant des nanopillars au lieu de la surface plate14. Pour un examen complet de ces variations, voir Colin-York et coll.15.
Le protocole présenté ici décrit une procédure visant à mesurer les forces exercées par les cellules B sur un substrat recouvert d’antigènes. Ces forces sont appliquées sur les ligands (antigène) afin de les regrouper et de les extraire par la suite du substrat présentant des antigènes. Nous avons adapté le protocole TFM standard pour imiter la rigidité des substrats physiologiques présentant des antigènes, la taille et le revêtement pertinent pour les cellules B. Ce protocole permet l’étude simultanée de plusieurs cellules et peut être utilisé conjointement avec des techniques de microscopie par fluorescence et des traitements chimiques. Cependant, il ne vise pas à sonder les mesures de force d’une molécule unique, pour lesquelles les pinces optiques16, les sondes de tensionmoléculaire 17,18, les sondes de force biomembrane19, et la microscopie de forceatomique 20 sont des techniques plus appropriées. Par rapport à d’autres méthodes de mesure de la force cellulaire unique (p. ex., micropipettes21 ou microplaques22)TFM permet la reconstruction d’une carte complète des forces exercées à la synapse avec une résolution d’environ 300 nm. Ceci est utile pour identifier les modèles spatio-temporels dans les forces exercées à la surface et, comme le gel est compatible avec l’imagerie confocale, pour les corréler avec le recrutement de protéines spécifiques (par exemple, le cytosquelette et les protéines de signalisation).
Bien que la TFM 3D soit possible, elle n’est pas compatible avec la rigidité et la configuration que nous avons utilisée. Les déformations en 3D sont réalisables par d’autres configurations plus complexes telles que la microscopie par force de saillie (AFM scannant une membrane déformable où les cellules sont plaquées)23,24 et la microscopie de stress de résonateur élastique (ERISM, gel agissant comme cavité résonnante pour la lumière et mettant en évidence les déformations du substrat avec précision de quelques nanomètres)25. Bien que ces techniques soient très prometteuses, elles n’ont pas encore été utilisées dans les cellules B. D’autres types de TFM, comme sur les nanopillars14,pourraient être utilisés pour avoir des substrats plus reproductibles. Cependant, cette géométrie n’est pas adaptée aux cellules molles car la cellule interpénère les piliers, ce qui complique l’analyse. Cette approche a en effet été utilisée dans les cellules T pour observer la capacité de la cellule à construire des structures autour des piliers26.
Malgré sa simplicité, le TFM utilisant des gels polyacrylamides permet l’observation simultanée de nombreuses cellules et peut être facilement et à peu de frais mis en œuvre dans n’importe quel laboratoire équipé d’un banc et d’un microscope à épifluorescence (bien que nous recommandons le disque confocal/filature).
Pour imiter la rigidité physiologique d’un APC, nous avons utilisé des gels polyacrylamides avec une rigidité de ~500 Pa27 et fonctionnalisé le gel avec des antigènes activants. Dans ce protocole, nous avons fonctionnalisé la surface du gel de polyacrylamide avec le lysozyme d’oeuf de poule (HEL). Cela permet de mesurer les forces générées par la stimulation du BCR par l’engagement du site de liaison antigène. L’utilisation de cet antigène et des cellules B spécifiques à HEL des souris MD4 assure une génération de force relativement uniforme en réponse à la ligature antigène28. Cependant, d’autres molécules (comme l’anti-IgM pour les souris B6) peuvent être greffées sur le gel, mais les forces générées dans ces cas pourraient être plus hétérogènes et moins intenses. Étant donné que les cellules B sont de petites cellules (diamètre ~6 μm), le nombre de perles a été optimisé pour être maximal mais toujours à suivre. Pour les grandes cellules qui exercent des forces ~kPa sur leurs substrats, on peut obtenir des résultats satisfaisants en utilisant des perles relativement clairsemées ou en effectuant une velocimétrie simple d’image de particule (PIV) pour reconstruire le champ de déformation. Cependant, pour les petites cellules telles que les lymphocytes B qui exercent un stress aussi petit que ~50 Pa, l’utilisation d’un seul suivi des particules est nécessaire (velocimétrie de suivi des particules, PTV) pour atteindre la précision souhaitée lors de la reconstruction du champ de déformation. Afin de suivre de manière fiable les perles individuellement, le grossissement de la lentille objective doit être d’au moins 60x et son ouverture numérique autour de 1,3. Ainsi, les gels doivent être relativement minces (<50 μm), sinon les perles ne sont pas visibles car elles sont au-dessus de la distance de travail de l’objectif.
Le protocole principal se compose de trois sections : préparation de gel, fonctionnalisation du gel et imagerie; deux autres sections sont facultatives et sont dédiées à la quantification de l’extraction des antigènes et à l’imagerie des cellules fluorescentes.
Protocole
1. Préparation de gel
- Silanisation du support gel
- Activez le coverslip ou la boîte de Petri à fond de verre (qui sera utilisée comme support gel) avec une lampe UV pendant 2 min (attendez 30 s avant l’exposition à la lampe UV pour éviter l’exposition à l’ozone résiduel).
- Silanize le coverslip/plat en verre-fond utilisant 200 μL aminopropyltrimethoxysilane (APTMS) pendant 5 min. Ceci préparera le support pour la liaison covalente du gel.
- Laver soigneusement le couvercle/plat à fond de verre avec de l’eau ultra-pure.
- Séchez le couvercle/plat à fond de verre à l’aide de l’aspiration sous vide.
- Préparation du coverslip de 18mm utilisé pour aplatir le gel
- Pour préparer les coverslips, mettez-les d’abord dans un support de coverslip en céramique. Ensuite, mettez le support de coverslip dans un petit bécher (50 mL) et versez le reagent siliconizing (stocké à 4 °C, réutilisable) sur les coverslips, en étant sûr de les couvrir complètement.
- Couvrir le bécher de papier d’aluminium et incuber pendant 3 min à température ambiante. En attendant, remplissez un grand bécher (500 mL) d’eau ultra-pure. Après 3 minutes d’incubation dans le réaccente siliconizing, transférez le support de coverslip avec des coverslips au bécher de l’eau.
- Rincez soigneusement les coverslips à l’eau ultra-pure, séchez-les bien et gardez-les sur des lingettes en papier. Pour obtenir de meilleurs résultats, passez immédiatement à la section suivante.
- Polymérisation du gel
- Pour les gels de 0,5 kPa, mélanger 75 μL d’acrylamide à 40 % avec 30 μL de bisacrylamide (crosslinker) à 2 % et 895 μL de solution saline tamponnée de phosphate (PBS). Ce prémétème peut être stocké jusqu’à un mois à 4 °C.
- À 167 μL de préméx de gel de 0,5 kPa, ajouter 1 % (1,67 μL) de perles, vortex et sonicate pendant 5 min dans un sonicateur de bain (nettoyeur ultrasonique standard de banc avec puissance de 50-100 W et fréquence 40 kHz). Protégez le mélange de la lumière à l’aide de papier d’aluminium.
REMARQUE : Le préméx ne polymérise pas tant que l’initiateur (TEMED) n’est pas ajouté. - Pour catalyser la polymérisation, ajouter 1 % (1,67 μL) de 10 % de persulfate d’ammonium w/v (APS).
- Pour initier la polymérisation, ajouter 0,1% (0,2 μL) N,N,N′,N′-Tetramethylethylenediamine (TEMED). Mélanger avec une pipette. Une fois aps et TEMED ont été ajoutés, le gel polymérise rapidement ainsi procéder rapidement à la coulée de gel.
- Moulage de gel
- Pipet 9 μL de mélange de gel sur chaque coverslip/plat de fond de verre (goutte au centre, figure 1A)
- Placez le coverslip silanized/hydrophobe et aplatissez le gel(figure 1B). À l’aide de forceps, appuyez sur le coverslip pour vous assurer que le gel se propage sur toute la zone du coverslip(figure 1C)jusqu’à ce qu’il commence à s’échapper.
- Inversez le couvercle/plat à fond de verre dans une grande boîte de Pétri et appuyez-le sur le banc pour forcer les perles qui se dirigent vers la surface du gel (figure 1D).
- Couvrir de papier d’aluminium et laisser polymériser à température ambiante dans une chambre humide (c.-à-d. mettre un tissu humide au-dessus du plat pour éviter l’évaporation).
- Après 1 h, ajouter pbs à l’échantillon pour faciliter la libération coverslip. Soigneusement, retirez le coverslip à l’aide d’une aiguille (le revêtement avec différentes silanes devrait permettre un peeling facile hors du coverslip du gel, Figure 1E).
- Laissez le gel dans PBS.
REMARQUE : Les gels peuvent maintenant être stockés en PBS à 4 °C pendant 5 à 7 jours, mais il est recommandé de les utiliser dans les 48 h.
2. Fonctionnalisation du gel
- Préparer sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate (Sulfo SANPAH) solution à 0,5 mg/mL dans 10 mM HEPES tampon. Ceci peut être stocké à 4 °C recouvert de papier d’aluminium pendant une semaine.
- Aspirer le PBS à partir de gels.
- Ajouter 150 μL de Sulfo SANPAH au gel à température ambiante (Figure 1F).
- Exposez le gel au traitement UV pendant 2 min pour photoactiver les sites de Sulfo SANPAH et le faire coller à la surface du gel.
- Laver avec PBS trois fois (Figure 1G).
- Répétez les étapes 2.2-2.5.
- Ajouter 250 μL de HEL (100 μg/mL) à chaque gel et incuber toute la nuit dans une chambre humide à 4 °C pendant la nuit tout en restant recouvert de papier d’aluminium (figure 1H).
- Retirer l’antigène HEL et laver avec du PBS trois fois.
REMARQUE : HEL agit à la fois comme antigène et comme molécule d’adhérence. Il peut être remplacé par d’autres molécules qui se lient au récepteur (p. ex., un IgM anti-souris, un sérum bovin albumine, ovalbumine) ou mélangés à des ligands d’intégrine (p. ex., liaison ICAM1 à LFA1). Si nécessaire, l’extraction d’antigène peut être observée avec une version fluorescente du HEL (obtenue en souinant la molécule avec un kit d’étiquetage protéique, voir l’étape 4). Notez qu’une concentration donnée en vrac pourrait ne pas produire la même concentration de surface sur le gel que sur le verre : celle-ci doit être quantifiée avec une coloration secondaire si une comparaison directe est nécessaire.
3. Chargement cellulaire et imagerie
- Avant l’imagerie, retirer le PBS des gels et ajouter 500 μL de médias cellulaires B (RPMI 1640, sérum fœtal de veau 10% décomplé, 1% pénicilline-streptomycine, 2% Pyruvate de sodium, 50uM Mercaptoéthanol et 1X acides aminés non essentiels) et laissez-les s’équilibrer à RT.
- Préparation cellulaire
- Purifier les cellules B primaires de la rate selon un protocole de sélection négatif (voir tableau des matériaux). Le rendement final typique de cellules B est d’environ 1 x 107 cellules. Concentrez-le à 3 x 106 cellules/mL dans le milieu de cellule B (RPMI-1640 complété avec 10% sérum foetal de veau, 1% pénicilline-streptomycine, 0.1% mercaptoethanol et 2% pyruvate de sodium).
- Conserver les cellules au besoin jusqu’à 6 h à 4 °C.
- Gardez les cellules à 37 °C pendant 30 minutes avant l’acquisition de l’image.
- Imagerie
- Utilisez un microscope confocal avec commande thermique et (éventuellement) de CO2.
REMARQUE : Qu’un microscope confocal ou à disque filature soit utilisé, il est important d’utiliser un objectif/sténopé qui permet à une taille de pixel et à 200 nm de suivre confortablement les perles dans la phase d’analyse (p. ex., 60x, NA 1.3). La microscopie d’épifluorescence peut également être employée, cependant elle fournit le rapport inférieur de signal au bruit et peut rendre le suivi individuel de perle plus dur. - Deux couches principales de perles apparaîtront sur le fond et le dessus du gel. Concentrez-vous sur le plan gel.
REMARQUE: Un beau gel apparaîtra comme un ciel étoilé, avec des perles réparties approximativement uniformément sur le même plan. - Programmez l’acquisition pendant 30 min avec un taux d’image de 5 s (ceci est adaptable aux besoins de l’expérience, par exemple, acquérir d’autres couleurs, acquérir z stack, etc.)
- Aspirez les médias du gel, laissant environ 200 μL de médias sur le gel. Placez le gel sur le microscope et trouvez la couche superficielle de perles et une belle zone uniforme sur le gel.
- Ajouter 80 μL de cellules (éviter de toucher le gel pour maintenir la concentration).
- Assurez-vous que l’accent est toujours correct et que les cellules peuvent être vues descendant dans la zone (sous la lumière transmise). Lancez l’acquisition avant que les cellules n’atteignent le gel.
- En cas de contact accidentel avec du gel, des vibrations ou une dérive de mise au point, ajustez la mise au point.
REMARQUE: Il est crucial de recueillir une image du gel détendu et cela peut être n’importe quelle image prise avant l’arrivée des cellules sur le gel.
- Utilisez un microscope confocal avec commande thermique et (éventuellement) de CO2.
4. Expérience d’extraction fluorescente de HEL
- Préparez hel fluorescent en liant un colorant fluorescent (d’une couleur différente des perles un tel que Alexa 555), voir la table des matériaux.
- À l’étape 2.7, remplacez hel conventionnel par le HEL fluorescent.
- Obtenez des images avec de faibles paramètres d’éclairage ou un faible taux d’image (p. ex., 2 images par minute) pour éviter le blanchiment des photos.
- Pour quantifier l’extraction hel, calculer l’intensité intégrée sur la zone cellulaire pour chaque cadre I (t) corrigé et normalisé par l’intensité I (0 )du cadre 0 selon la formule :
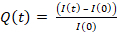
REMARQUE : L’antigène conjugué à un fluorophore n’est pas visible (probablement en raison de l’assaisons du fluorophore à la surface du gel), mais sa présence sur le gel peut être vérifiée avec un anti-HEL et un anticorps secondaire fluorescent. On peut vérifier que le fluorophore est en effet fluorescent lorsqu’il est détaché en le dépouillant du gel avec un coverslip recouvert d’anti-HEL et en le révélant avec un anticorps fluorescent secondaire (sur le coverslip)6. Le signal de l’antigène extrait est très faible et est parfois masqué par une fuite des perles. Si l’on ne s’intéresse qu’à l’extraction des antigènes, il est recommandé de préparer le gel sans perles (sauter les étapes 1.3.2 et 1.4.3).
5. Imagerie par fluorescence
- Obtenir des cellules B fluorescentes en purifiant la cellule B de la rate des souris génétiquement modifiées comme c’est le cas pour le type sauvage (p. ex., chez les souris Lifeact-GFP ou Myosin II GFP).
- Pour l’imagerie des cellules fluorescentes, utilisez (si possible) un microscope à disque filature avec un objectif d’immersion d’eau à longue distance 40x-100x.
- Maintenez la durée d’exposition et le taux d’image bas pour éviter le blanchiment.
REMARQUE : La fonction de propagation de points en Z est fortement dégradée par la présence du gel, c’est pourquoi nous suggérons d’utiliser un objectif d’immersion dans l’eau. La microscopie verticale à l’aide d’objectifs de trempage de l’eau souffre de fortes aberrations sphériques induites par la présence de la cellule (sphérique) (et du noyau cellulaire) dans le chemin d’émission.
6. Analyse
REMARQUE : L’analyse des données est en général effectuée en corrigeant d’abord toute la pile pour la dérive, en trouvant les perles dans chaque cadre, en suivant leurs mouvements par rapport à un cadre de référence (prise en l’absence de cellules), en interpolant le champ de déplacement et en inversant le problème pour obtenir le stress à l’aide de Fourier transform29. À cette fin, nous vous suggérons d’utiliser une combinaison de programmes ImageJ Macro et MATLAB téléchargeables à partir d’un référentielen ligne 30.
- Ouvrez le film dans ImageJ comme pile d’images
- Exécuter la macro « Crop_and_save.ijm »
- Sélectionnez les régions d’intérêt (ROI) avec l’outil « Rectangle » et ajoutez-les à la liste de retour sur investissement à l’aide de la clé « t ».
- Lors de la culture de la cellule, assurez-vous d’inclure une région d’au moins 5-10 pixels de perles immobiles. Exclure les cellules trop proches des limites ou d’autres cellules de l’analyse. Une fois terminé cliquez sur 'OK'.
- La macro propose un masque de la cellule: si c’est satisfaisant cliquez sur « OK ». S’il n’est pas satisfaisant, cliquez sur « Pas ok », puis sélectionnez manuellement une région fermée avec n’importe quel outil de sélection (par exemple « Main levée » ou « Ovale ») et cliquez sur « Continuer ».
- Ouvrez MATLAB et exécutez « TFM_v1.m ».
- Entrez les paramètres requis : vérifiez en particulier les propriétés de l’image (taille des pixels, intervalle de temps d’acquisition) et les propriétés gel (Young modulus E, Poisson ratio).
- L’image de référence est définie comme la première par défaut. Réglez-le sur un autre cadre si nécessaire ou réglez-le à « 0 » pour charger un fichier externe.
- Localiser les sorties du logiciel dans le même répertoire que le fichier d’origine (pour une description voir le fichier User_notice.pdf fichier). Il s’agit notamment d’une piste préliminaire des perles (« FILENAME.fig »), une parcelle de l’énergie contractile au fil du temps (« FILENAME_energy.fig »), une table de plusieurs quantités intégrées sur la cellule (énergie, zone, moments, etc) « FILENAME_finaltable.mat », une structure contenant le champ de déplacement et de force, des films de la perle, champ de déplacement, le stress et l’énergie (qui peut être ouvert avec n’importe quel lecteur avi).
REMARQUE : Dans les paramètres d’entrée, la « taille de fenêtre » est la fenêtre sur laquelle le déplacement est interpolé, d’où la résolution finale du champ de stress et de déplacement. Ceci est réglé sur quelques (par défaut quatre) pixels. Il n’est pas conseillé de réduire cela car il augmenterait artificiellement la résolution en interpolant les régions où il n’y a pas de perles.
Résultats
Compte tenu de la taille des cellules, les algorithmes qui extraient la carte de déplacement des perles au moyen de techniques corrélatives (telles que la velocimétrie de l’image des particules) ne sont généralement pas très précis. Toutefois, selon le degré de résolution requis, on peut facilement obtenir des résultats qualitatifs à l’aide d’un plugin gratuit Fiji/ImageJ31,32. Bien que cette approche soit suffisante pour comparer les conditions stimulantes par rapport aux conditions non stimulantes, pour une analyse approfondie, nous vous recommandons d’utiliser notre logiciel téléchargeable à partir d’unréférentiel en ligne 30, qui suit les perles individuellement et fournit la carte de terrain de déplacement à un moment donné que l’interpolation des déplacements de perlesindividuelles 33. Plusieurs quantifications sont possibles à ce stade. Par exemple (en supposant que le déplacement est causé uniquement par le stress tangentiel à la surface du gel), le logiciel fournit également le stress à chaque point causant cette carte de déplacement spécifique. Il s’agit d’un type de « problème d’inversion » : le déplacement à un certain moment dépend de la somme de toutes les forces appliquées sur tous les autres points. L’algorithme d’inversion prend en compte les paramètres physiques du substrat : sa rigidité (Young modulus) et le rapport Poisson. Les algorithmes directs sont généralement très précis mais coûteux sur le plan informatique. Les algorithmes basés sur Fourier transforment, comme le nôtre, effectuent essentiellement une déconvolution dans l’espace Fourier et sont plus efficaces mais sujets à certaines erreurs (principalement en raison de l’étape d’interpolation). Ces algorithmes nécessitent généralement l’accordage d’un paramètre qui empêche les petits déplacements locaux (et potentiellement artifactual) de devenir trop pertinents dans le calcul du champ de stress (paramètres de régularisation Tikhonov8,29; variable de « régularisation » dans la fenêtre de dialogue; ici, nous avons généralement mis égal à 5 x 10-19). Pour une interprétation et une analyse plus avancées, telles que les corrélations spatio-temporelles, les mouvements locaux, les corrélations avec les canaux fluorescents, nous recommandons de collaborer avec des experts dans le domaine. Pour un examen des méthodes de calcul, voir Schwarz et coll.9.
Comme mentionné ci-dessus, les images de perles correctes ressemblent à un « ciel étoilé », une distribution uniforme et aléatoire des taches lumineuses (figure 2A). Les données et l’analyse ne sont pas fiables lorsque le nombre de perles est trop faible(figure 2B)ou que l’image est hors de discussion (figure 2C). Une fois que les cellules B se sont installées sur la surface du gel, les perles sous les cellules commencent à se déplacer en raison de la force de traction exercée par la cellule sur le gel. Les cadres pour lesquels les perles ne sont pas lisibles doivent être jetés.
En tant que contrôle, il est possible d’observer à l’œil le mouvement des perles comparant le « cadre de référence », généralement celui précédant le premier contact de la cellule avec le substrat. Des résultats approximatifs peuvent être obtenus à partir du suivi des particules simples (p. ex., Trackmate, Fiji 34)tel qu’il est fait dans la figure 3A. L’analyse fournit une segmentation des perles dans l’image de référence (« FILENAME.fig ») comme un contrôle.
Avec le logiciel que nous proposons, on peut obtenir le déplacement (Figure 3B) et le champ de stress (le vecteur du stress local à chaque pixel et chaque point de temps obtenu par inversion du champ de déplacement, figure 3C). Le produit scalaire des champs de déplacement et de force intégrés sur la zone de la cellule fournit un travail total exercé par la cellule sur le substrat (Figure 4A). Ce calcul nécessite le masque de la cellule introduit à l’étape 6.2 du protocole.
Pour comparer deux conditions biologiques (comme l’activation du HEL par rapport au substrat non activant BSA, ou type sauvage par rapport à knock-out), il est utile de calculer la courbe moyenne (figure 4B) ou, plus synthétiquement encore, une valeur moyenne au cours des derniers points de temps (20 min) où l’énergie atteint un plateau (figure 4C). Lorsque l’information spatiale des forces est pertinente, il est possible de comparer les points de temps unique de chaque condition (Figure 4D). Reportez-vous à Kumari et coll.6 pour une analyse plus approfondie.
Un exemple de laps de temps d’extraction d’antigène de fluorescence est montré dans la figure 5A: l’aspect progressif des signaux de fluorescence à la synapse a indiqué le détachement d’antigène du gel. La courbe d’extraction moyenne avec son intervalle de confiance (erreur standard de la moyenne) sur 15 cellules est indiquée dans la figure 5B.
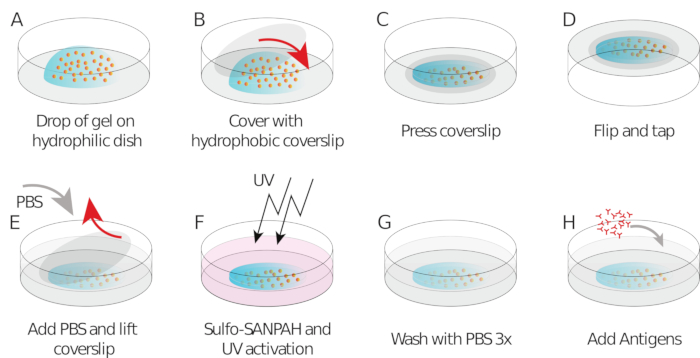
Figure 1 : Représentation schématique de la préparation du gel et de sa fonctionnalisation. Les étapes sont décrites dans le protocole. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2 : Trois exemples d’images perlées de différentes qualités. (A) Exemple d’image de perle avec le bon rapport signal/bruit et la densité correcte. (B) Exemples d’images avec un nombre trop insuffisant de perles et (C) hors plan de mise au point. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
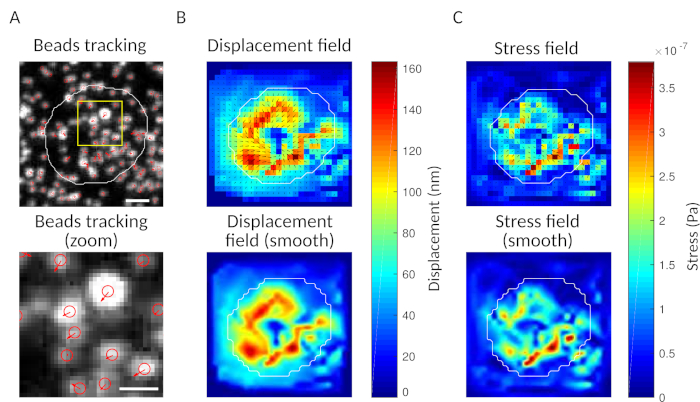
Figure 3 : Traitement des images pour extraire le champ de force. ( A )Exempled’image des perles (contour de la cellule en blanc, extrait de l’image de transmission), suivi des perles au moment t = 5 min (superposition rouge) et déplacement (flèches) par rapport au temps t = 0 min (barre d’échelle 5 μm). (B) Champ de déplacement interpolé (représenté comme carquois vectoriel et carte de magnitude, les flèches sont proportionnelles au déplacement [nm]; voir la barre de couleur à droite); en bas : une image plus lisse de l’ampleur (obtenue par interpolation avec une fonction bicubique). (C) Champ de stress du champ de déplacement dans le panneau B (représenté comme carquois vectoriel et carte de magnitude; les flèches sont proportionnelles au stress de cisaillement [Pa]; voir la barre de couleur sur la droite); en bas : une image plus lisse de l’ampleur (obtenue par interpolation avec une fonction bicubique). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
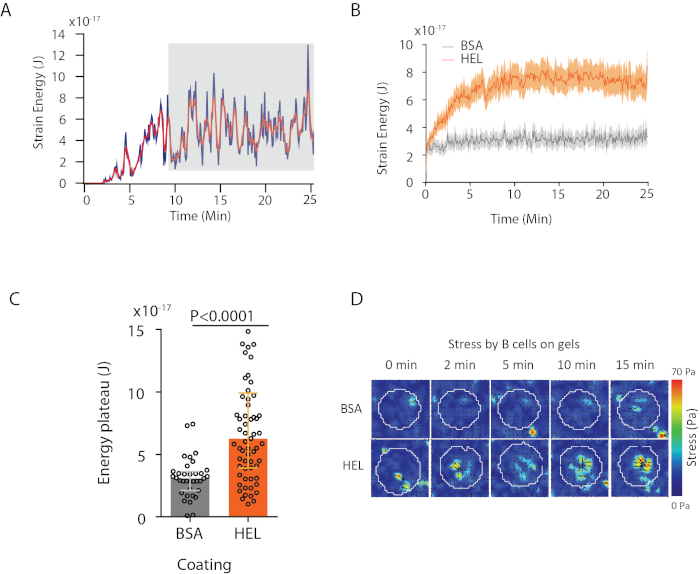
Figure 4 : Exemple d’information qui peut être extraite des champs de force et de déplacement. (A) Exemple d’évolution de l’énergie à temps pour une seule cellule : une phase de plateau (mise en évidence en gris) apparaît après environ 10 minutes. (B) Comparaison des courbes énergétiques moyennes et (C) des niveaux de plateau relatif pour 65 cellules plaquées sur HEL (activation) gel enduit et 35 cellules sur BSA (non activant) gel enduit (médiane ± gammes interquartiles sont montrés, Mann-Whitney test a été utilisé pour la signification statistique). (D) Cartes couleur time-lapse du stress pour HEL et contrôler l’état BSA; les parcelles de magnitude et de carquois sont montrées. Ces images ont été adaptées de Kumari et coll.6. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
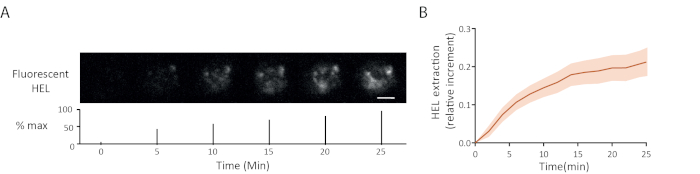
Figure 5 : Exemple d’expériences avec l’antigène fluorescent. (A) Laps de temps de l’extraction de HEL fluorescent (ci-dessous : pourcentage du maximum, barre d’échelle = 3μm). (B) Rassemblement d’antigènes au fil du temps (± SEM, n = 15). Ces images ont été adaptées de Kumari et coll.6. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
La méthode TFM décrite ici permet l’étude systématique des capacités mécaniques actives des cellules B. Dans le contexte des cellules B, ceci est lié à la capacité d’extraire et d’internaliser l’antigène. Comparé à d’autres méthodes de TFM, le protocole présenté ici est simple et plutôt reproductible : la rigidité, mesurée par l’indentation d’une microsphère en verre et utilisant le modèle Hertz, se situe entre 400 et 600 Pa. Des protocoles similaires ont été utilisés avec succès non seulement pour les cellules B35 mais aussi pour les cellules T36. Par rapport aux nanopillars (également utilisés pour les lymphocytes T37),il fournit une surface homogène plate, d’où les résultats sont plus faciles à interpréter que l’interaction du gel sont principalement contraints d’être tangentielle à la surface.
Le protocole que nous avons décrit donne accès à la dynamique spatiotemporale des forces exercées par les cellules B sur les substrats présentant des antigènes. Sur le plan spatial, cela fournit des informations sur la localisation des forces, et en combinaison avec la microscopie de fluorescence, permet à l’expérimentateur de corréler les forces locales avec la présence de molécules spécifiques (c’est-à-dire des composants du cytosquelette ou de la cascade de signalisation BCR). Au niveau temporel, il est possible d’intégrer des quantités (comme l’énergie totale ou le stress total) pour fournir une valeur par point de temps et réduire le bruit. Cela permet d’observer l’évolution de la force de traction dans le temps (croissance et plateau) et la présence de motifs pulsatiles.
Les aspects expérimentaux critiques de l’analyse sont décrits comme suit. (i) Densité cellulaire : pour effectuer une analyse correcte, les cellules doivent être suffisamment séparées. Nous considérons qu’une cellule est analyzable si elle a une région vide de sa propre taille autour d’elle. (ii) Image de transmission : il est conseillé de recueillir au moins une image de transmission des cellules pendant l’expérience pour être utilisée comme masque dans l’analyse. iii Nombre de perles dans l’image : nous suggérons d’analyser uniquement les images où le nombre de perles dans la synapse se situe entre 30 et 200 (soit 1 à 8 perles/μm²). Les densités inférieures ne permettent pas une reconstruction adéquate du déplacement des cartes. Les densités élevées de perles rendent le suivi des particules unique peu fiable. iv) Le nombre de perles doit être constant pendant l’expérience; cependant, des fluctuations peuvent se produire en raison de la faible variabilité des conditions d’imagerie (en particulier dans les perles qui sont trop proches les unes des autres). La dérive de mise au point, si elle se produit, doit être corrigée et les cadres problématiques doivent être jetés. v) Qualité du gel : les gels avec trop de fissures, la variabilité de la distribution des perles ou les gels trop épais doivent être jetés. (vi) Selon le type de cellule, après des expositions répétées, les cellules à des moments tardifs (>300 images) peuvent subir des effets phototoxiques. Il est conseillé d’exécuter le programme sur un masque dépourvu de cellules comme une « ligne de base » à comparer avec les données. Cela fournit une magnitude du niveau de bruit uniquement en raison des conditions expérimentales.
Les gels utilisés pour mesurer la force de traction dans l’adhérence classique permettent d’examiner les processus qui se produisent à l’adhérence focale (flux d’actine et recrutement de molécules de signalisation) — les points où les forces sontappliquées 38,39. Cependant, les forces à la synapse ne sont pas appliquées par des adhérences focales. Le modèle spatiotemporal de génération de force à la synapse immunisée de cellules de B n’a pas été quantitativement étudié utilisant cette méthode jusqu’à récemment. En utilisant TFM, nous avons observé pour la première fois, le modelage de force à la synapse immunisée de cellules B, tel que présenté dans notre étuderécente 6,ouvrant des perspectives encourageantes dans l’étude des lymphocytes.
Cette méthode utilise notamment une image prise avant l’arrivée des cellules sur le gel comme image de référence pour le calcul de la force. Les protocoles TFM habituels suggèrent de prendre l’image de référence à la fin de l’expérience, après avoir détaché les cellules avec de la trypsine; cela permet à l’expérimentateur de rechercher une région riche en cellules. Bien que cela soit possible ici aussi, trypsine est plutôt inefficace pour détacher les cellules B du gel enduit d’antigène, il faut attendre longtemps pour le détachement et le risque de modification du gel et les mouvements (qui rendent l’ensemble des données inexploitables) est plus élevé.
La méthode présentée ici est flexible et peut être appliquée pour étudier l’effet d’autres signaux à la synapse immunitaire car elle permet de greffer d’autres protéines sur la surface du gel (par exemple, les ligands d’intégrine et les immunoglobulines ont été testés) et même l’antigène fluorescent (voir la section 4). En outre, les cellules restent accessibles à l’expérimentateur pour le traitement de la drogue et les perturbations locales. Enfin, la méthode est également compatible avec l’imagerie des cellules fixes. Pour ces observations, il est recommandé de faire le gel sur un coverslip, tacher les cellules, coller le coverslip sur une diapositive et seulement ensuite ajouter des supports de montage et un autre coverslip. L’observation se fera ensuite avec le gel sur le dessus pour éviter la dégradation de l’image à travers le gel.
Les pièges possibles sont la variabilité du gel dans la polymérisation et le revêtement. Les problèmes de polymérisation sont principalement dus à la qualité de l’initiateur/catalyseur. En outre, le gel peut gonfler, surtout s’il n’est pas utilisé juste après l’assemblage. Ce problème ne semble pas affecter considérablement les propriétés mécaniques du gel, mais il peut rendre la couche de perles inaccessible pour l’objectif, rendant effectivement le gel inutile. Nous vous recommandons de préparer des gels supplémentaires pour chaque condition lorsque ce problème apparaît. Il peut également y avoir une certaine variabilité dans le revêtement, et il est crucial d’avoir sulfo SANPAH fraîchement dilué.
En conclusion, nous avons décrit une méthode simple, bon marché et reproductible pour mesurer les forces exercées par les cellules B à la synapse immunologique lorsqu’elles sont activées par bcr ligand. Il peut être adapté pour étudier la réaction à d’autres ligands et autres types de lymphocytes (cellules B de mémoire, lymphocytes T, etc.) avec l’utilisation du ligand récepteur approprié.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient M. Bolger-Munro pour leur lecture critique et reconnaissent le Nikon Imaging Center@CNRS-InstitutCurie et PICT-IBiSA, Institut Curie, Paris, membre de l’infrastructure nationale de recherche France-BioImaging, pour leur soutien à l’acquisition d’images et à l’Installation animale Curie. PP a été soutenu par le CNRS. AK et JP ont été soutenus par paris Descartes PhD fellowship et Ecole Doctorale FIRE—Programme Bettencourt. Ce projet a été financé par des subventions à PP (ANR-10-JCJC-1504-Immuphy) et AMLD (ANR-PoLyBex-12-BSV3-0014-001, ERC-Strapacemi-GA 243103).
matériels
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethoxysilane (APTMS) | Sigma-Aldrich | 281778 | Store aliquoted, protected from humidity |
| 40% Acrylamide Solution | Biorad | 1610140 | |
| Alexa555 microscale protein labeling kit | Molecular Probes | A30007 | |
| Ammonium Persulfate (APS) | Sigma-Aldrich | A3678 | |
| B cell Isolation Kit, Mouse | Miltenyi Biotec | 130-090-862 | |
| B-mercaptoethanol | Gibco | 31350-010 | |
| 2% Bis Solution | Biorad | 161-0142 | |
| Bovine Serum Albumin (BSA) | Euromedex | 04-100-812-C | |
| Coverslip 18mm | VWR | 631-1580 | |
| Fetal calf serum | PAA | A15-151 | Decomplemented (40min @56°C) |
| Fluorodishes FD35 | World Precision Instruments, Inc | FD35100 | |
| Fluosphere: carboxylate-modified, 0.2um, dark red | Molecular Probes | F8807 | |
| Hen Egg Lysozyme | Sigma-Aldrich | L6876 | Stocked in aliquote 100mg/ml |
| MEM Non-Essential Amino Acids Solution (100X) | Thermofisher/Gibco | 11140035 | |
| N,N,N',N'-tetrametiletilendiammine (TEMED) | Euromedex | 50406-B | |
| PBS (Phosfate Buffer Saline) | Gibco | 10010-015 | |
| Penicillin–streptomycin | Gibco | 15140-010 | |
| RMPI 1640 – Glutamax I | Thermofisher | 61870-010 | |
| Sigmacote | Sigma-Aldrich | SL2 | |
| Sodium pyruvate | Gibco | 11360-039 | |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate (Sulfo-SANPAH) | Thermo Scientific | 22589 |
Références
- Yuseff, M. -I., Pierobon, P., Reversat, A., Lennon-Duménil, A. -M. How B cells capture, process and present antigens: a crucial role for cell polarity. Nature Reviews. Immunology. 13 (7), 475-486 (2013).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. The Journal of Cell Biology. 216 (1), 217-230 (2017).
- Shaheen, S., Wan, Z., et al. Substrate stiffness governs the initiation of B cell activation by the concerted signaling of PKCβ and focal adhesion kinase. eLife. 6, (2017).
- Natkanski, E., et al. B cells use mechanical energy to discriminate antigen affinities. Science. 340 (6140), 1587-1590 (2013).
- Wan, Z., Chen, X., et al. The activation of IgM- or isotype-switched IgG- and IgE-BCR exhibits distinct mechanical force sensitivity and threshold. eLife. 4, (2015).
- Kumari, A., Pineau, J., et al. Actomyosin-driven force patterning controls endocytosis at the immune synapse. Nature Communications. 10 (1), 2870(2019).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophysical Journal. 94 (1), 207-220 (2008).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochimica et Biophysica Acta. 1853 (11), Pt B 3095-3104 (2015).
- Colin-York, H., Shrestha, D., et al. Super-Resolved Traction Force Microscopy (STFM). Nano Letters. 16 (4), 2633-2638 (2016).
- Stubb, A., Laine, R. F., Guzmán, C., Henriques, R., Jacquemet, G., Ivaska, J. Fluctuation-Based Super-Resolution Traction Force Microscopy. BioRxiv. , (2019).
- Gutierrez, E., Tkachenko, E., et al. High refractive index silicone gels for simultaneous total internal reflection fluorescence and traction force microscopy of adherent cells. Plos One. 6 (9), 23807(2011).
- Bergert, M., Lendenmann, T., et al. Confocal reference free traction force microscopy. Nature Communications. 7, 12814(2016).
- Schoen, I., Hu, W., Klotzsch, E., Vogel, V. Probing cellular traction forces by micropillar arrays: contribution of substrate warping to pillar deflection. Nano Letters. 10 (5), 1823-1830 (2010).
- Colin-York, H., Fritzsche, M. The future of traction force microscopy. Current Opinion in Biomedical Engineering. 5, 1-5 (2018).
- Feng, Y., et al. Mechanosensing drives acuity of αβ T-cell recognition. Proceedings of the National Academy of Sciences of the United States of America. 114 (39), 8204-8213 (2017).
- Spillane, K. M., Tolar, P. DNA-Based Probes for Measuring Mechanical Forces in Cell-Cell Contacts: Application to B Cell Antigen Extraction from Immune Synapses. Methods in Molecular Biology. 1707, 69-80 (2018).
- Stabley, D. R., Jurchenko, C., Marshall, S. S., Salaita, K. S. Visualizing mechanical tension across membrane receptors with a fluorescent sensor. Nature Methods. 9 (1), 64-67 (2011).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397 (6714), 50-53 (1999).
- Hinterdorfer, P., Dufrêne, Y. F. Detection and localization of single molecular recognition events using atomic force microscopy. Nature Methods. 3 (5), 347-355 (2006).
- Sawicka, A., Babataheri, A., et al. Micropipette force probe to quantify single-cell force generation: application to T-cell activation. Molecular Biology of the Cell. 28 (23), 3229-3239 (2017).
- Desprat, N., Guiroy, A., Asnacios, A. Microplates-based rheometer for a single living cell. Review of Scientific Instruments. 77 (5), 055111(2006).
- Labernadie, A., Bouissou, A., et al. Protrusion force microscopy reveals oscillatory force generation and mechanosensing activity of human macrophage podosomes. Nature Communications. 5, 5343(2014).
- Bouissou, A., Proag, A., et al. Protrusion force microscopy: A method to quantify forces developed by cell protrusions. Journal of Visualized Experiments. (136), 57636(2018).
- Kronenberg, N. M., Liehm, P., et al. Long-term imaging of cellular forces with high precision by elastic resonator interference stress microscopy. Nature Cell Biology. 19 (7), 864-872 (2017).
- Basu, R., Whitlock, B. M., et al. Cytotoxic T cells use mechanical force to potentiate target cell killing. Cell. 165 (1), 100-110 (2016).
- Bufi, N., Saitakis, M., et al. Human Primary Immune Cells Exhibit Distinct Mechanical Properties that Are Modified by Inflammation. Biophysical Journal. 108 (9), 2181-2190 (2015).
- Goodnow, C. C., Crosbie, J., et al. Altered immunoglobulin expression and functional silencing of self-reactive B lymphocytes in transgenic mice. Nature. 334 (6184), 676-682 (1988).
- Butler, J. P., Tolić-Nørrelykke, I. M., Fabry, B., Fredberg, J. J. Traction fields, moments, and strain energy that cells exert on their surroundings. American Journal of Physiology. Cell Physiology. 282 (3), 595-605 (2002).
- MBPPlab/TFM_v1: Software for Time dependent Traction Force Microscopy. , Available from: https://github.com/MBPPlab/TFM_v1 (2019).
- Tseng, Q., Duchemin-Pelletier, E., et al. Spatial organization of the extracellular matrix regulates cell-cell junction positioning. Proceedings of the National Academy of Sciences of the United States of America. 109 (5), 1506-1511 (2012).
- ImageJ plugins by Qingzong TSENG. , Available from: https://sites.google.com/site/qingzongtseng/ (2019).
- Plotnikov, S. V., Sabass, B., Schwarz, U. S., Waterman, C. M. High-resolution traction force microscopy. Methods in Cell Biology. 123, 367-394 (2014).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Wang, J., Lin, F., et al. Profiling the origin, dynamics, and function of traction force in B cell activation. Science Signaling. 11 (542), (2018).
- Hui, K. L., Balagopalan, L., Samelson, L. E., Upadhyaya, A. Cytoskeletal forces during signaling activation in Jurkat T-cells. Molecular Biology of the Cell. 26 (4), 685-695 (2015).
- Bashour, K. T., Gondarenko, A., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences of the United States of America. 111 (6), 2241-2246 (2014).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. The Journal of Cell Biology. 183 (6), 999-1005 (2008).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. Journal of Physics. Condensed Matter. 22 (19), 194104(2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon