Method Article
Microscopía de fuerza de tracción para estudiar la activación de linfocitos B
En este artículo
Resumen
Aquí presentamos un protocolo utilizado para realizar experimentos de microscopía de fuerza de tracción en células B. Describimos la preparación de geles blandos de poliacrilamida y su funcionalización, así como la adquisición de datos en el microscopio y un resumen del análisis de datos.
Resumen
La microscopía de fuerza de tracción (TFM) permite la medición de las fuerzas producidas por una célula sobre un sustrato. Esta técnica deduce mediciones de fuerza de tracción de un campo de desplazamiento observado experimentalmente producido por una célula tirando de un sustrato elástico. Aquí, adaptamos el MFT para investigar la estructura espacial y temporal del campo de fuerza ejercido por las células B cuando se activa por el compromiso de antígeno del receptor de células B. La rigidez del gel, la densidad de las cuentas y la funcionalización de las proteínas deben optimizarse para el estudio de células relativamente pequeñas (6 m) que interactúan con, y responden específicamente a los ligandos para los receptores de superficie celular.
Introducción
Las células B son las células productoras de anticuerpos del sistema inmunitario. Para activar la respuesta inmune adaptativa, primero adquieren el antígeno en forma nativa (es decir, no procesado) a través de un receptor específico llamado receptor de células B (BCR)1. Este proceso se produce en la zona celular del ganglio linfático B. Incluso si algunos antígenos pueden llegar a la célula B a través de fluidos linfáticos, la mayoría de los antígenos, especialmente con alto peso molecular (>70 kDa, que es el tamaño límite para los conductos linfáticos) se presentan en su forma nativa en la superficie de una célula que presenta antígeno (APC), típicamente un macrófago del seno subcapsular o células dendríticas foliculares, a través de lecina o receptores Fc (no específicos). El contacto con esta célula conduce a la formación de una sinapsis inmune donde el BCR ejerce fuerza sobre los antígenos asociados a APC. La unión de un antígeno al BCR inicia la señalización BCR, que puede activar mecanismos de generación de fuerza. Estas fuerzas podrían ser importantes para amplificar la señalización BCR, pero también son esenciales para que las células B extraigan y luego internalicen el antígeno.
Estudios recientes han demostrado que el BCR es de hecho mecanosensible2. Por ejemplo, los sustratos más rígidos provocan una señalización BCR mejorada3. Además, la fuerza generada en la sinapsis inmune tira de BCR único para sondear su afinidad con el antígeno y así asegurar la discriminación de afinidad4. Por lo tanto, es interesante investigar la respuesta mecánica de las células B a la presentación del antígeno y diseccionar esta respuesta en términos de tipo de receptores implicados (IgG/IgM)5, moléculas de adhesión (ligandos de integrina) o en células modificadas farmacológica y genéticamente (es decir, silenciamiento de una proteína aguas abajo de la señalización BCR o dinámica de citoesqueleto)6.
Un método simple para observar la respuesta de una célula a un sustrato de rigidez fisiológica y, al mismo tiempo, las fuerzas de estudio ejercidas sobre el sustrato es microscopía de fuerza de tracción (TFM). TFM consiste en observar el campo de desplazamiento producido por la célula tirando de un sustrato elástico. Originalmente la deformación del gel se observó a través de arrugas del propio elastómero por microscopía de contraste de fase7,pero la inserción de microperlas de fluorescencia como marcadores fiduciarios permitió una mejor resolución y desde entonces se ha convertido en el estándar8. Este método se ha utilizado para investigar la fuerza de tracción ejercida por las células adherentes, tejidos, e incluso organoides incrustados en geles. Se han desarrollado varias variaciones de MFT9 incluyendo, combinación con microscopía de superresolución (es decir, STED10 o SRRF11), modificación del índice de refracción del gel para permitir la microscopía TIRF12,sustitución de perlas por patrones nanoimpresos13, y el uso de nanopillares en lugar de superficie plana14. Para una revisión completa de estas variaciones, véase Colin-York et al.15.
El protocolo presentado aquí describe un procedimiento para medir las fuerzas ejercidas por las células B sobre un sustrato recubierto de antígeno. Estas fuerzas se aplican en los ligandos (antígeno) con el fin de agruparlos y posteriormente extraerlos del sustrato que presenta el antígeno. Hemos adaptado el protocolo TFM estándar para imitar la rigidez de los sustratos fisiológicos que presentan antígenos, el tamaño y el recubrimiento relevante para las células B. Este protocolo permite el estudio de varias células simultáneamente y se puede utilizar junto con técnicas de microscopía de fluorescencia y tratamientos químicos. Sin embargo, no tiene como objetivo sondear mediciones de fuerza de molécula única, para las cuales las pinzas ópticas16,las sondas de tensión molecular17,18, sondas de fuerza de biomembrana19, y la microscopía de fuerza atómica20 son técnicas más adecuadas. En comparación con otros métodos de medición de fuerza de célula única (por ejemplo, micropipetas21 o microplacas22)TFM permite la reconstrucción de un mapa completo de las fuerzas ejercidas en la sinapsis con una resolución de 300 nm. Esto es útil para identificar patrones espacio-temporales en las fuerzas ejercidas sobre la superficie y, como el gel es compatible con imágenes confocales, para correlacionarlos con el reclutamiento de proteínas específicas (por ejemplo, citoesqueleto y proteínas de señalización).
Aunque 3D TFM es posible, no es compatible con la rigidez y la configuración que utilizamos. Las deformaciones en 3D son alcanzables por otras configuraciones más complejas como la microscopía de fuerza de protuberancia (AFM escaneando una membrana deformable donde las células están chapadas)23,24 y la microscopía de tensión de interferencia del resonador elástico (ERISM, un gel que actúa como cavidad resonante para la luz y resalta de las deformaciones del sustrato con precisión de unos pocos nanómetros)25. Aunque estas técnicas son muy prometedoras, todavía no se han empleado en células B. Otros tipos de MFT, como en los nanopillares14,podrían utilizarse para tener sustratos más reproducibles. Sin embargo, esta geometría no se adapta a las celdas blandas, ya que la célula interpenetra los pilares, lo que complica el análisis. Este enfoque se ha utilizado en células T para observar la capacidad de la célula para construir estructuras alrededor de los pilares26.
A pesar de su simplicidad, TFM utilizando geles de poliacrilamida permite la observación simultánea de muchas células y se puede implementar fácil y económicamente en cualquier laboratorio equipado con un banco y un microscopio de epifluorescencia (aunque recomendamos disco confocal / giratorio).
Para imitar la rigidez fisiológica de un APC, utilizamos geles de poliacrilamida con una rigidez de 500 Pa27 y funcionalizamos el gel con antígenos activadores. En este protocolo, funcionalizamos la superficie del gel de poliacrilamida con lysozyme de huevo de gallina (HEL). Esto permite la medición de las fuerzas generadas por la estimulación del BCR a través de la participación del sitio de unión del antígeno. El uso de este antígeno y las células B específicas de HEL de ratones MD4 asegura una generación de fuerza relativamente uniforme en respuesta a la ligadura de antígenos28. Sin embargo, otras moléculas (como anti-IgM para ratones B6) se pueden injertar en el gel, pero las fuerzas generadas en estos casos podrían ser más heterogéneas y menos intensas. Debido a que las células B son celdas pequeñas (diámetro 6 m), el número de cuentas se ha optimizado para ser máximo pero todavía rastreable. Para las células grandes que ejercen fuerzas de kPa sobre sus sustratos, se pueden lograr resultados satisfactorios utilizando perlas relativamente dispersas o realizando velocimetría de imagen de partícula simple (PIV) para reconstruir el campo de deformación. Sin embargo, para células pequeñas como linfocitos B que ejercen estrés tan pequeño como 50 Pa, se requiere el uso de seguimiento de partículas únicas (velocimetría de seguimiento de partículas, PTV) para lograr la precisión deseada al reconstruir el campo de deformación. Con el fin de realizar un seguimiento fiable de las perlas individualmente, la ampliación de la lente objetivo debe ser al menos 60x y su apertura numérica alrededor de 1.3. Por lo tanto, los geles deben ser relativamente delgados (<50 m), de lo contrario las perlas no son visibles ya que están por encima de la distancia de trabajo del objetivo.
El protocolo principal consta de tres secciones: preparación de gel, funcionalización del gel e imágenes; dos secciones más son opcionales y están dedicadas a la cuantificación de la extracción de antígenos y la imagen de las células fluorescentes.
Protocolo
1. Preparación de gel
- Silanización del soporte gel
- Activar el cubreobjetos o la placa Petri de fondo de vidrio (que se utilizará como soporte de gel) con una lámpara UV durante 2 minutos (espere 30 s antes de la exposición a la lámpara UV para evitar la exposición al ozono residual).
- Silanice el cubreobjetos/plato de fondo de vidrio usando aminopropiltrimethoxysilane (APTMS) de 200 l durante 5 min. Esto preparará el soporte para la unión covalente del gel.
- Lave bien el plato de fondo de cristal/tapa con agua ultrapura.
- Seque el cubreobjetos/plato de fondo de cristal utilizando aspiración al vacío.
- Preparación del cubreobjetos de 18 mm utilizado para aplanar el gel
- Para preparar los cubreobjetos, primero colóquelos en un soporte de cubierta de cerámica. A continuación, coloque el soporte de cubreobjetos en un vaso de precipitados pequeño (50 ml) y vierta el reactivo de silicona (almacenado a 4 oC, reutilizable) sobre los cubreobjetos, asegurándose de cubrirlos por completo.
- Cubra el vaso de precipitados con papel de aluminio e incubar durante 3 minutos a temperatura ambiente. Mientras espera, llene un vaso grande (500 ml) con agua ultrapura. Después de 3 minutos de incubación en reactivo de silicio, transfiera el soporte de cubreobjetos con cubreobjetos al vaso de agua.
- Enjuague bien los cubreobjetos con agua ultrapura, séquelos bien y manténgalos en toallitas de papel. Para obtener los mejores resultados, proceda inmediatamente a la siguiente sección.
- Polimerización de gel
- Para geles de 0,5 kPa, mezcle 75 l de acrilamida al 40% con 30 ml de bisacrilamida al 2% (reticulante) y 895 l de solución salina tamponada con fosfato (PBS). Esta premezcla se puede almacenar hasta un mes a 4 oC.
- A 167 l de premezcla de gel de 0,5 kPa, agregue un 1% (1,67 l) de perlas, vórtice y sonicado durante 5 minutos en un sonicador de baño (limpiador ultrasónico de banco estándar con potencia de 50-100 W y frecuencia de 40 kHz). Mantenga la mezcla protegida de la luz con papel de aluminio.
NOTA: La premezcla no se polimeriza hasta que se añade el iniciador (TEMED). - Para catalizar la polimerización, añada un 1% (1,67 l) de 10% de persulfato de amonio con v (APS).
- Para iniciar la polimerización, añada 0,1% (0,2 l) N,N,N,N-Tetrametiletilendiamina (TEMED). Mezclar con una pipeta. Una vez que se han añadido APS y TEMED, el gel se polimeriza rápidamente, por lo que procede rápidamente a la fundición en gel.
- Fundición de gel
- Pipet 9 l de mezcla de gel en cada plato de tapa labial/fondo de vidrio (gota en el centro, Figura 1A)
- Coloque el cubreobjetos silanizado/hidrofóbico y aplane el gel (Figura 1B). Con fórceps, presione el cubreobjetos para asegurarse de que el gel se extiende por toda el área del cubreobjetos (Figura 1C) hasta que comience a salir a gotear.
- Invierta el plato de fondo de vidrio/cubierta en una gran plato de Petri y tóquelo en el banco para forzar las perlas que van hacia la superficie del gel (Figura 1D).
- Cubrir con papel de aluminio y dejar durante 1 h para polimerizar a temperatura ambiente en una cámara húmeda (es decir, poner un tejido húmedo por encima del plato para evitar la evaporación).
- Después de 1 h, agregue PBS a la muestra para facilitar la liberación de cubreobjetos. Con cuidado, retire el cubreobjetos con una aguja (el recubrimiento con diferentes sillanes debe permitir un fácil desprende del cubreobjetos del gel, Figura 1E).
- Deje el gel en PBS.
NOTA: Los geles ahora se pueden almacenar en PBS a 4 oC durante 5-7 días, pero se recomienda usarlos dentro de 48 h.
2. Funcionalización del gel
- Preparar la solución de sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate (Sulfo SANPAH) a 0,5 mg/ml en tampón HEPES de 10 mM. Esto se puede almacenar a 4 oC cubierto con papel de aluminio durante un máximo de una semana.
- Aspirar el PBS de geles.
- Añadir 150 l de Sulfo SANPAH al gel a temperatura ambiente (Figura 1F).
- Exponer el gel al tratamiento UV durante 2 minutos para fotoactivar los sitios de Sulfo SANPAH y hacer que se pegue a la superficie del gel.
- Lavar con PBS tres veces(Figura 1G).
- Repita los pasos 2.2–2.5.
- Añadir 250 l de HEL (100 g/ml) a cada gel e incubar durante la noche en una cámara húmeda a 4 oC durante la noche, manteniéndose cubierto con papel de aluminio (Figura 1H).
- Retire el antígeno HEL y lávelo con PBS tres veces.
NOTA: HEL actúa como antígeno y como molécula de adhesión. Puede ser reemplazado por otras moléculas que se unen al receptor (por ejemplo, un IgM antiratón, albúmina sérica bovina, Ovalbumin) o mezclada con ligandos de integrina (por ejemplo, ICAM1 unión a LFA1). Si es necesario, la extracción de antígenos se puede observar con una versión fluorescente del HEL (obtenida manchando la molécula con un kit de etiquetado de proteínas, ver paso 4). Tenga en cuenta que una concentración determinada a granel podría no producir la misma concentración superficial en el gel que en el vidrio: esto debe cuantificarse con tinción secundaria si se requiere una comparación directa.
3. Carga celular e imágenes
- Antes de la toma de imágenes, retire el PBS de los geles y agregue 500 l de medios celulares B (RPMI 1640, 10% de suero de ternero fetal descompletado, 1% penicilina-estreptomicina, 2% Piruvato de Sodio, 50uM Mercaptoetanol y 1X Aminoácidos No Esenciales) y déjelos equilibrar a RT.
- Preparación celular
- Purifique las células B primarias del bazo según un protocolo de selección negativo (consulte Tabla de materiales). El rendimiento típico de la célula B final es de alrededor de 1 x 107 celdas. Concentrar esto en 3 x 106 células/ml en medio celular B (RPMI-1640 complementado con 10% de suero de ternera fetal, 1% penicilina-estreptomicina, 0.1% mercaptoetanol y 2% piruvato sódico).
- Almacene las celdas según sea necesario hasta 6 h a 4 oC.
- Mantenga las celdas a 37 oC durante 30 minutos antes de la adquisición de la imagen.
- Imagen
- Utilice un microscopio confocal con control térmico y (posiblemente) co2.
NOTA: Independientemente de si se utiliza un microscopio confocal o de disco giratorio, es importante utilizar un objetivo/agujero que permita un tamaño de píxel <200 nm para realizar un seguimiento cómodo de las perlas en la fase de análisis (por ejemplo, 60x, NA 1.3). La microscopía de epifluorescencia también se puede utilizar, sin embargo, proporciona una menor relación señal-ruido y puede hacer que el seguimiento individual del cordón sea más difícil. - Dos capas principales de cuentas aparecerán en la parte inferior y la parte superior del gel. Concéntrate en el plano de gel.
NOTA: Un buen gel aparecerá como un cielo estrellado, con cuentas aproximadamente distribuidas uniformemente en el mismo plano. - Programar la adquisición durante 30 min con una velocidad de fotogramas de 5 s (esto es adaptable a las necesidades del experimento, por ejemplo, adquirir otros colores, adquirir la pila z, etc.)
- Aspirar los medios del gel, dejando alrededor de 200 l de medios en el gel. Coloque el gel en el microscopio y encontrar la capa superficial de las cuentas y un área agradable y uniforme en el gel.
- Añadir 80 l de las células (evitar tocar el gel para mantener el enfoque).
- Asegúrese de que el foco sea todavía correcto y de que las células se puedan ver descendiendo en el área (bajo la luz transmitida). Inicie la adquisición antes de que las células lleguen al gel.
- En caso de contacto accidental con gel, vibraciones o deriva de enfoque, ajuste el enfoque.
NOTA: Es crucial recoger una imagen del gel relajado y esta puede ser cualquier imagen tomada antes de la llegada de las células en el gel.
- Utilice un microscopio confocal con control térmico y (posiblemente) co2.
4. Experimento de extracción de HEL fluorescente
- Preparar HEL fluorescente mediante la unión de un tinte fluorescente (de un color diferente de las cuentas uno como Alexa 555), ver la tabla de materiales.
- En el paso 2.7, sustituya el HEL convencional por el HEL fluorescente.
- Adquiera imágenes con ajustes de iluminación bajos o baja velocidad de fotogramas (por ejemplo, 2 fotogramas por minuto) para evitar el blanqueo fotográfico.
- Para cuantificar la extracción HEL, calcule la intensidad integrada sobre el área de celda para cada fotograma I(t) corregido y normalizado por la intensidad I(0) del fotograma 0 según la fórmula:
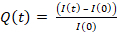
NOTA: El antígeno conjugado con un fluoróforo no es visible (probablemente debido al enfriamiento del fluoróforo en la superficie del gel), pero su presencia en el gel se puede verificar con un anti-HEL y un anticuerpo secundario fluorescente. Se puede verificar que el fluoróforo es de hecho fluorescente cuando se desprende despojándolo del gel con un cubrelip recubierto con anti-HEL y revelando con un anticuerpo fluorescente secundario (en el cubreobjetos)6. La señal del antígeno extraído es muy tenue y a veces se enmascara por la fuga de las cuentas. Si uno está interesado sólo en la extracción de antígenos, se recomienda preparar el gel sin cuentas (saltar los pasos 1.3.2 y 1.4.3).
5. Imágenes de fluorescencia
- Obtener células B fluorescentes mediante la purificación de células B de los bazos de ratones modificados genéticamente como se hace para el tipo salvaje (por ejemplo, de Lifeact-GFP o Myosin II GFP ratones).
- Para las células fluorescentes por imágenes, utilice (si es posible) un microscopio de disco giratorio con un objetivo de larga distancia de 40x–100x de inmersión en agua.
- Mantenga la duración de la exposición y la velocidad de fotogramas bajas para evitar el blanqueo.
NOTA: La función de propagación de puntos en Z está muy degradada por la presencia del gel, por lo tanto, sugerimos utilizar un objetivo de inmersión en agua. La microscopía vertical viva con objetivos de inmersión en agua sufre de fuertes aberraciones esféricas inducidas por la presencia de la célula (esférica) (y del núcleo celular) en la ruta de emisión.
6. Análisis
NOTA: El análisis de datos se realiza en general corrigiendo primero toda la pila para la deriva, encontrando las perlas en cada fotograma, rastreando sus movimientos con respecto a un marco de referencia (tomado en ausencia de celdas), interpolando el campo de desplazamiento e invirtiendo el problema para obtener la tensión usando fourier transform29. Para ello, sugerimos utilizar una combinación de programas ImageJ Macro y MATLAB descargables desde un repositorio en línea30.
- Abra la película en ImageJ como pila de imágenes
- Ejecute la macro "Crop_and_save.ijm"
- Seleccione las regiones de interés (ROI) con la herramienta "Rectangle" y agréguelas a la lista de ROI utilizando la tecla 't'.
- Al recortar la celda, asegúrese de incluir una región de al menos 5-10 píxeles de cuentas inmóviles. Excluya del análisis las celdas que están demasiado cerca de los límites o de otras celdas. Cuando haya terminado, haga clic en "Aceptar".
- La macro propone una máscara de la celda: si esto es satisfactorio, haga clic en "Aceptar". Si no es satisfactorio, haga clic en "No está bien" y luego seleccione manualmente una región cerrada con cualquier herramienta de selección (por ejemplo, "Freehand" u "Oval") y haga clic en "Continuar".
- Abra MATLAB y ejecute "TFM_v1.m".
- Introduzca los parámetros necesarios: en particular, compruebe las propiedades de la imagen (tamaño de píxel, intervalo de tiempo de adquisición) y las propiedades del gel (módulo joven E, relación Poisson).
- La imagen de referencia está configurada como la primera de forma predeterminada. Establézcalo en otro fotograma si es necesario o establézcalo en "0" para cargar un archivo externo.
- Localice las salidas del software en el mismo directorio que el archivo original (para obtener una descripción consulte el archivo User_notice.pdf). Esto incluye una pista preliminar de las cuentas ("FILENAME.fig"), una gráfica de la energía contráctil a lo largo del tiempo ("FILENAME_energy.fig"), una tabla de varias cantidades integradas sobre la celda (energía, área, momentos, etc.) "FILENAME_finaltable.mat", una estructura que contiene el campo de desplazamiento y fuerza, películas del cordón, campo de desplazamiento, estrés y energía (que se puede abrir con cualquier lector avi).
NOTA: En los parámetros de entrada, el "Tamaño de ventana" es la ventana sobre la que se interpola el desplazamiento, de ahí la resolución final del campo de tensión y desplazamiento. Esto se establece en unos pocos (de forma predeterminada cuatro) píxeles. No es aconsejable reducir esto, ya que aumentaría artificialmente la resolución interpolando regiones donde no hay cuentas.
Resultados
Dado el tamaño de las celdas, los algoritmos que extraen el mapa de desplazamiento de las cuentas a través de técnicas correlativas (como la velocimetría de imagen de partícula) en general no son muy precisos. Sin embargo, dependiendo del grado de resolución requerido, uno puede obtener fácilmente resultados cualitativos utilizando un plugin gratuito Fiji / ImageJ31,32. Si bien este enfoque es suficiente para comparar las condiciones estimulantes frente a las no estimulantes, para un análisis exhaustivo recomendamos utilizar nuestro software descargable desde un repositorio en línea30,que rastrea las perlas individualmente y proporciona el mapa de campo de desplazamiento en un punto de tiempo dado como la interpolación de los desplazamientos individuales del cordón33. Varias cuantificaciones son posibles en este punto. Por ejemplo (suponiendo que el desplazamiento es causado sólo por la tensión tangencial a la superficie del gel) el software también proporciona la tensión en cada punto causando ese mapa de desplazamiento específico. Este es un tipo de "problema de inversión": el desplazamiento en un punto determinado depende de la suma de todas las fuerzas aplicadas en todos los otros puntos. El "algoritmo de inversión" tiene en cuenta los parámetros físicos del sustrato: su rigidez (módulo joven) y relación Poisson. Los algoritmos directos suelen ser muy precisos pero computacionalmente caros. Los algoritmos basados en la transformación de Fourier, como el nuestro, realizan esencialmente una desconvolución en el espacio de Fourier y son más eficientes pero propensos a algunos errores (principalmente debido al paso de interpolación). Estos algoritmos generalmente requieren la afinación de un parámetro que impide que los pequeños desplazamientos locales (y potencialmente artifactuales) se vuelvan demasiado relevantes en el cálculo del campo de tensión (parámetro de regularización de Tikhonov8,29; "Regularización" en la ventana de diálogo; aquí normalmente establecemos igual a 5 x 10-19). Para una interpretación y un análisis más avanzados, como correlaciones espacio-temporales, movimientos locales, correlaciones con canales fluorescentes, recomendamos colaborar con expertos en la materia. Para una revisión sobre los métodos computacionales, véase Schwarz et al.9.
Como se mencionó anteriormente, las imágenes correctas de las cuentas parecen un "cielo estrellado", una distribución uniforme y aleatoria de los puntos brillantes (Figura 2A). Los datos y el análisis no son fiables cuando el número de cuentas es demasiado bajo (Figura 2B) o la imagen está fuera de foco (Figura 2C). Una vez que las células B se han asentado en la superficie del gel, las cuentas debajo de las células comienzan a moverse debido a la fuerza de tracción ejercida por la célula en el gel. Los marcos para los que las perlas no son rastreables deben descartarse.
Como comprobación, es posible observar a simple vista el movimiento de las perlas comparando el "marco de referencia", típicamente el que precede al primer contacto de la célula con el sustrato. Los resultados aproximados se pueden obtener a partir del seguimiento de partículas individuales (por ejemplo, Trackmate, Fiji 34) como se hace en la Figura 3A. El análisis proporciona una segmentación de los cordones de la imagen de referencia ("FILENAME.fig") como control.
Con el software que proponemos, se puede obtener el desplazamiento (Figura 3B) y el campo de tensión (el vector de la tensión local en cada píxel y cada punto de tiempo obtenido por inversión desde el campo de desplazamiento, Figura 3C). El producto escalar de los campos de desplazamiento y fuerza integrados en el área de la célula proporciona el trabajo total ejercido por la célula sobre el sustrato (Figura 4A). Este cálculo requiere la máscara de la célula introducida en el paso 6.2 del protocolo.
Para comparar dos condiciones biológicas (como activación de HEL frente a sustrato no activadoR BSA, o tipo salvaje frente a knock-out) es útil calcular la curva media (Figura 4B) o, aún más sintéticamente, un valor promedio sobre los últimos puntos de tiempo (20 min) donde la energía alcanza una meseta (Figura 4C). Cuando la información espacial de las fuerzas es relevante, es posible comparar puntos de tiempo únicos de cada condición (Figura 4D). Consulte Kumari et al.6 para un análisis más profundo.
Un ejemplo de lapso de tiempo de extracción de antígeno de fluorescencia se muestra en la Figura 5A:la aparición progresiva de señales de fluorescencia en la sinapsis indicada de desprendimiento de antígeno del gel. La curva de extracción media con su intervalo de confianza (error estándar de la media) sobre 15 celdas se muestra en la Figura 5B.
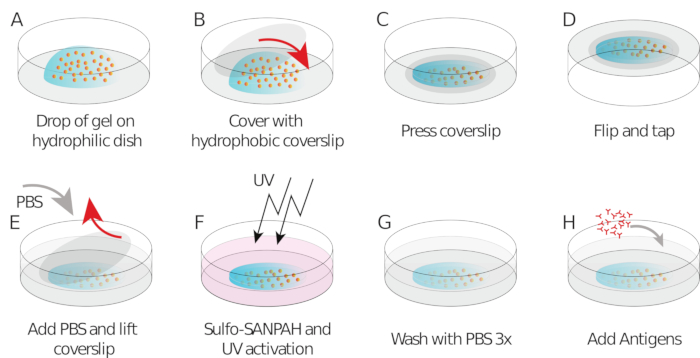
Figura 1: Muestra esquemática de la preparación del gel y su funcionalización. Los pasos se describen en el protocolo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Tres ejemplos de imágenes de cuentas de diferentes calidades. (A) Ejemplo de imagen de cordón con la relación señal-ruido correcta y la densidad correcta. (B) Ejemplos de imágenes con un número demasiado insuficiente de cuentas y (C) fuera de foco plano. Haga clic aquí para ver una versión más grande de esta figura.
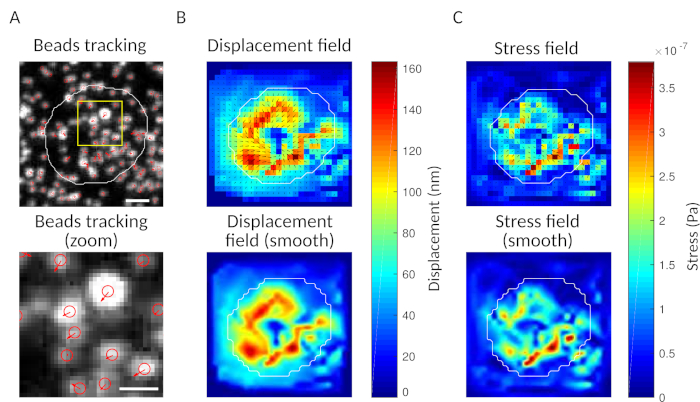
Figura 3: Procesamiento de las imágenes para extraer el campo de fuerza. (A) Ejemplo de una imagen de las cuentas (esquema de la celda en blanco, extraído de la imagen de transmisión), seguimiento de cuentas en el tiempo t a 5 min (superposición roja) y desplazamiento (flechas) en relación con el tiempo t a 0 min (barra de escala de 5 m). (B) Campo de desplazamiento interpolado (representado como temblor vectorial y mapa de magnitud, las flechas son proporcionales al desplazamiento [nm]; ver la barra de color a la derecha); inferior: una imagen más suave de la magnitud (obtenida por interpolación con una función bicúbica). (C) Campo de tensión del campo de desplazamiento en el panel B (representado como temblor vectorial y mapa de magnitud; las flechas son proporcionales a la tensión de cizallamiento [Pa]; véase la barra de color de la derecha); inferior: una imagen más suave de la magnitud (obtenida por interpolación con una función bicúbica). Haga clic aquí para ver una versión más grande de esta figura.
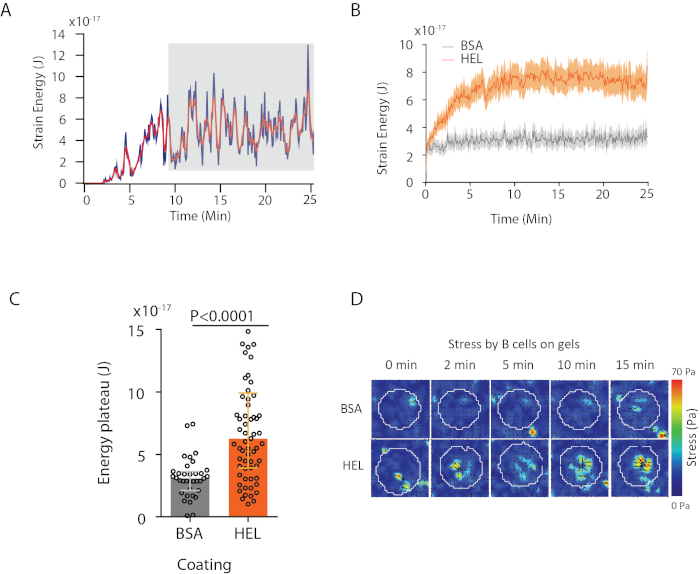
Figura 4: Ejemplo de información que se puede extraer de los campos de fuerza y desplazamiento. (A) Ejemplo de evolución de la energía en el tiempo para una sola celda: una fase de meseta (resaltada en gris) aparece después de unos 10 minutos. (B) Comparación de las curvas de energía medias y (C) de los niveles relativos de meseta para 65 células chapadas en gel recubierto HEL (activador) y 35 células en gel recubierto BSA (no activador) (se muestran rangos intercuartiles de ± medianas, se utilizó la prueba Mann-Whitney para significación estadística). (D) Mapas de color de lapso de tiempo de tensión para HEL y condición de control BSA; se muestran las gráficas de magnitud y temblor. Estas imágenes han sido adaptadas de Kumari et al.6. Haga clic aquí para ver una versión más grande de esta figura.
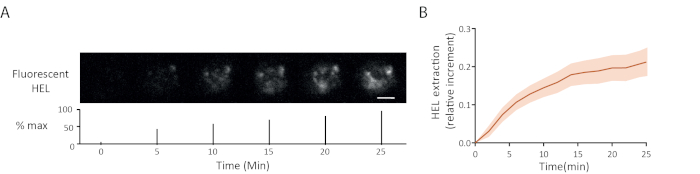
Figura 5: Ejemplo de experimentos con antígeno fluorescente (A) Lapso de tiempo de la extracción de HEL fluorescente (abajo: porcentaje del máximo, barra de escala a 3 m). (B) Recolección de antígenos a lo largo del tiempo (media ± SEM, n a 15). Estas imágenes han sido adaptadas de Kumari et al.6. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El método TFM descrito aquí permite el estudio sistemático de las capacidades mecánicas activas de las células B. En el contexto de las células B, Esto está relacionado con la capacidad de extraer e internalizar el antígeno. En comparación con otros métodos TFM, el protocolo presentado aquí es simple y bastante reproducible: la rigidez, medida por la sangría de una microesfera de vidrio y el uso del modelo Hertz, está entre 400 y 600 Pa. Protocolos similares se han utilizado con éxito no sólo para las células B35 sino también para las células T36. En comparación con los nanopillares (también utilizados para linfocitos T37) proporciona una superficie homogénea plana, por lo tanto los resultados son más fáciles de interpretar ya que la interacción del gel se restringe principalmente para ser tangencial a la superficie.
El protocolo que describimos da acceso a la dinámica espaciotemporal de las fuerzas ejercidas por las células B sobre sustratos que presentan antígenos. A nivel espacial, esto proporciona información sobre la localización de fuerzas, y en combinación con la microscopía de fluorescencia, permite al experimentador correlacionar las fuerzas locales con la presencia de moléculas específicas (es decir, componentes de la cascada de señalización de citoesqueleto o BCR). A nivel temporal, es posible integrar cantidades (como energía total o estrés total) para proporcionar un valor por punto de tiempo y reducir el ruido. Esto permite observar la evolución de la fuerza de tracción en el tiempo (crecimiento y meseta) y la presencia de patrones pulsatiles.
Los aspectos experimentales críticos para el análisis se describen como a continuación. (i) Densidad celular: para realizar un análisis correcto, las células deben estar suficientemente separadas. Consideramos que una celda es analizable si tiene una región vacía de su propio tamaño a su alrededor. (ii) Imagen de transmisión: es aconsejable recoger al menos una imagen de transmisión de las células durante el experimento que se utilizará como máscara en el análisis. (iii) Número de cuentas en la imagen: sugerimos analizar sólo las imágenes en las que el número de cuentas en la sinapsis está entre 30 y 200 (es decir, 1-8 perlas/m2). Las densidades más bajas no permiten una reconstrucción adecuada del desplazamiento del mapa. Las altas densidades de perlas hacen que el seguimiento de partículas individuales no sea confiable. (iv) El número de cuentas debe ser constante durante el experimento; sin embargo, las fluctuaciones pueden ocurrir debido a una pequeña variabilidad en las condiciones de imagen (especialmente en cuentas que están demasiado cerca unas de otras). La deriva de enfoque, si se produce, debe corregirse y se deben descartar las tramas problemáticas. (v) Calidad del gel: se deben desechar los geles con demasiadas grietas, la variabilidad en la distribución de las cuentas o los geles que son demasiado gruesos. (vi) Dependiendo del tipo de célula, después de exposiciones repetidas, las células en puntos de tiempo tardíos (>300 fotogramas) pueden sufrir efectos fototóxicos. Es aconsejable ejecutar el programa en una máscara desprovista de celdas como una "línea de base" que se compara con los datos. Esto proporciona una magnitud del nivel de ruido sólo debido a las condiciones experimentales.
Los geles utilizados para medir la fuerza de tracción en la adhesión clásica permiten la investigación de los procesos que se producen en la adhesión focal (flujos de actina y reclutamiento de moléculas de señalización), los puntos donde se aplican fuerzas38,39. Sin embargo, las fuerzas en la sinapsis no se aplican a través de adherencias focales. El patrón espaciotemporal de generación de fuerza en la sinapsis inmune de las células B no se ha investigado cuantitativamente utilizando este método hasta hace poco. Usando TFM, observamos por primera vez, patrón de fuerza en la sinapsis inmune de las células B, como se presenta en nuestro estudio reciente6,abriendo perspectivas alentadoras en el estudio de linfocitos.
En particular, este método emplea una imagen tomada antes de la llegada de las celdas en el gel como una imagen de referencia para el cálculo de fuerza. Los protocolos TFM habituales sugieren tomar la imagen de referencia al final del experimento, después de separar las células con tripina; esto permite al experimentador buscar una región rica en células. Aunque esto también es posible aquí, la tripina es bastante ineficiente en la separación de células B del gel recubierto de antígeno, uno necesita esperar mucho tiempo para el desprendimiento y el riesgo de modificación y movimientos de gel (que hacen que todo el conjunto de datos no explote) es mayor.
El método que se presenta aquí es flexible y se puede aplicar para estudiar el efecto de otras señales en la sinapsis inmune, ya que permite injertar otras proteínas en la superficie del gel (por ejemplo, se han probado ligandos de integrina e inmunoglobulinas) e incluso antígeno fluorescente (ver sección 4). Además, las células siguen siendo accesibles para el experimentador para el tratamiento de fármacos y perturbaciones locales. Por último, el método también es compatible con las células fijas de imágenes. Para estas observaciones, se recomienda hacer el gel en un cubreobjetos, manchar las células, pegar el cubreobjetos en una diapositiva y sólo entonces añadir medios de montaje y otro cubreobjetos. La observación se realizará con el gel en la parte superior para evitar la degradación de la imagen a través del gel.
Los posibles escollos son la variabilidad en el gel en la polimerización y el recubrimiento. Los problemas de polimerización se deben principalmente a la calidad del iniciador/catalizador. Además, el gel puede inflarse, especialmente si no se usa justo después del montaje. Este problema no parece afectar dramáticamente las propiedades mecánicas del gel, pero puede hacer que la capa del cordón sea inalcanzable para el objetivo, haciendo que el gel sea inútil. Recomendamos preparar geles adicionales para cada afección cuando aparezca este problema. También puede haber una cierta variabilidad en el recubrimiento, y es crucial tener Sulfo SANPAH recién diluido.
En conclusión, hemos descrito un método simple, barato y reproducible para medir las fuerzas ejercidas por las células B en la sinapsis inmunológica cuando se activa por el ligando BCR. Se puede adaptar para estudiar la reacción a otros ligandos y otros tipos de linfocitos (células de memoria B, células T, etc.) con el uso del ligando receptor adecuado.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a M. Bolger-Munro la lectura crítica y reconocen a Nikon Imaging Center@CNRS-InstitutCurie y PICT-IBiSA, Institut Curie, París, miembro de la infraestructura nacional de investigación France-BioImaging, por su apoyo en la adquisición de imágenes y en el Curie Animal Facility. PP fue apoyado por el CNRS. AK y JP contaron con el apoyo de la beca de doctorado Paris Descartes y el programa Ecole Doctorale FIRE—Programme Bettencourt. Este proyecto fue financiado por subvenciones a PP (ANR-10-JCJC-1504-Immuphy) y AMLD (ANR-PoLyBex-12-BSV3-0014-001, ERC-Strapacemimi-GA 243103).
Materiales
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethoxysilane (APTMS) | Sigma-Aldrich | 281778 | Store aliquoted, protected from humidity |
| 40% Acrylamide Solution | Biorad | 1610140 | |
| Alexa555 microscale protein labeling kit | Molecular Probes | A30007 | |
| Ammonium Persulfate (APS) | Sigma-Aldrich | A3678 | |
| B cell Isolation Kit, Mouse | Miltenyi Biotec | 130-090-862 | |
| B-mercaptoethanol | Gibco | 31350-010 | |
| 2% Bis Solution | Biorad | 161-0142 | |
| Bovine Serum Albumin (BSA) | Euromedex | 04-100-812-C | |
| Coverslip 18mm | VWR | 631-1580 | |
| Fetal calf serum | PAA | A15-151 | Decomplemented (40min @56°C) |
| Fluorodishes FD35 | World Precision Instruments, Inc | FD35100 | |
| Fluosphere: carboxylate-modified, 0.2um, dark red | Molecular Probes | F8807 | |
| Hen Egg Lysozyme | Sigma-Aldrich | L6876 | Stocked in aliquote 100mg/ml |
| MEM Non-Essential Amino Acids Solution (100X) | Thermofisher/Gibco | 11140035 | |
| N,N,N',N'-tetrametiletilendiammine (TEMED) | Euromedex | 50406-B | |
| PBS (Phosfate Buffer Saline) | Gibco | 10010-015 | |
| Penicillin–streptomycin | Gibco | 15140-010 | |
| RMPI 1640 – Glutamax I | Thermofisher | 61870-010 | |
| Sigmacote | Sigma-Aldrich | SL2 | |
| Sodium pyruvate | Gibco | 11360-039 | |
| sulfosuccinimidyl 6-(4'-azido-2'-nitrophenylamino)hexanoate (Sulfo-SANPAH) | Thermo Scientific | 22589 |
Referencias
- Yuseff, M. -I., Pierobon, P., Reversat, A., Lennon-Duménil, A. -M. How B cells capture, process and present antigens: a crucial role for cell polarity. Nature Reviews. Immunology. 13 (7), 475-486 (2013).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. The Journal of Cell Biology. 216 (1), 217-230 (2017).
- Shaheen, S., Wan, Z., et al. Substrate stiffness governs the initiation of B cell activation by the concerted signaling of PKCβ and focal adhesion kinase. eLife. 6, (2017).
- Natkanski, E., et al. B cells use mechanical energy to discriminate antigen affinities. Science. 340 (6140), 1587-1590 (2013).
- Wan, Z., Chen, X., et al. The activation of IgM- or isotype-switched IgG- and IgE-BCR exhibits distinct mechanical force sensitivity and threshold. eLife. 4, (2015).
- Kumari, A., Pineau, J., et al. Actomyosin-driven force patterning controls endocytosis at the immune synapse. Nature Communications. 10 (1), 2870(2019).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophysical Journal. 94 (1), 207-220 (2008).
- Schwarz, U. S., Soiné, J. R. D. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochimica et Biophysica Acta. 1853 (11), Pt B 3095-3104 (2015).
- Colin-York, H., Shrestha, D., et al. Super-Resolved Traction Force Microscopy (STFM). Nano Letters. 16 (4), 2633-2638 (2016).
- Stubb, A., Laine, R. F., Guzmán, C., Henriques, R., Jacquemet, G., Ivaska, J. Fluctuation-Based Super-Resolution Traction Force Microscopy. BioRxiv. , (2019).
- Gutierrez, E., Tkachenko, E., et al. High refractive index silicone gels for simultaneous total internal reflection fluorescence and traction force microscopy of adherent cells. Plos One. 6 (9), 23807(2011).
- Bergert, M., Lendenmann, T., et al. Confocal reference free traction force microscopy. Nature Communications. 7, 12814(2016).
- Schoen, I., Hu, W., Klotzsch, E., Vogel, V. Probing cellular traction forces by micropillar arrays: contribution of substrate warping to pillar deflection. Nano Letters. 10 (5), 1823-1830 (2010).
- Colin-York, H., Fritzsche, M. The future of traction force microscopy. Current Opinion in Biomedical Engineering. 5, 1-5 (2018).
- Feng, Y., et al. Mechanosensing drives acuity of αβ T-cell recognition. Proceedings of the National Academy of Sciences of the United States of America. 114 (39), 8204-8213 (2017).
- Spillane, K. M., Tolar, P. DNA-Based Probes for Measuring Mechanical Forces in Cell-Cell Contacts: Application to B Cell Antigen Extraction from Immune Synapses. Methods in Molecular Biology. 1707, 69-80 (2018).
- Stabley, D. R., Jurchenko, C., Marshall, S. S., Salaita, K. S. Visualizing mechanical tension across membrane receptors with a fluorescent sensor. Nature Methods. 9 (1), 64-67 (2011).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397 (6714), 50-53 (1999).
- Hinterdorfer, P., Dufrêne, Y. F. Detection and localization of single molecular recognition events using atomic force microscopy. Nature Methods. 3 (5), 347-355 (2006).
- Sawicka, A., Babataheri, A., et al. Micropipette force probe to quantify single-cell force generation: application to T-cell activation. Molecular Biology of the Cell. 28 (23), 3229-3239 (2017).
- Desprat, N., Guiroy, A., Asnacios, A. Microplates-based rheometer for a single living cell. Review of Scientific Instruments. 77 (5), 055111(2006).
- Labernadie, A., Bouissou, A., et al. Protrusion force microscopy reveals oscillatory force generation and mechanosensing activity of human macrophage podosomes. Nature Communications. 5, 5343(2014).
- Bouissou, A., Proag, A., et al. Protrusion force microscopy: A method to quantify forces developed by cell protrusions. Journal of Visualized Experiments. (136), 57636(2018).
- Kronenberg, N. M., Liehm, P., et al. Long-term imaging of cellular forces with high precision by elastic resonator interference stress microscopy. Nature Cell Biology. 19 (7), 864-872 (2017).
- Basu, R., Whitlock, B. M., et al. Cytotoxic T cells use mechanical force to potentiate target cell killing. Cell. 165 (1), 100-110 (2016).
- Bufi, N., Saitakis, M., et al. Human Primary Immune Cells Exhibit Distinct Mechanical Properties that Are Modified by Inflammation. Biophysical Journal. 108 (9), 2181-2190 (2015).
- Goodnow, C. C., Crosbie, J., et al. Altered immunoglobulin expression and functional silencing of self-reactive B lymphocytes in transgenic mice. Nature. 334 (6184), 676-682 (1988).
- Butler, J. P., Tolić-Nørrelykke, I. M., Fabry, B., Fredberg, J. J. Traction fields, moments, and strain energy that cells exert on their surroundings. American Journal of Physiology. Cell Physiology. 282 (3), 595-605 (2002).
- MBPPlab/TFM_v1: Software for Time dependent Traction Force Microscopy. , Available from: https://github.com/MBPPlab/TFM_v1 (2019).
- Tseng, Q., Duchemin-Pelletier, E., et al. Spatial organization of the extracellular matrix regulates cell-cell junction positioning. Proceedings of the National Academy of Sciences of the United States of America. 109 (5), 1506-1511 (2012).
- ImageJ plugins by Qingzong TSENG. , Available from: https://sites.google.com/site/qingzongtseng/ (2019).
- Plotnikov, S. V., Sabass, B., Schwarz, U. S., Waterman, C. M. High-resolution traction force microscopy. Methods in Cell Biology. 123, 367-394 (2014).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Wang, J., Lin, F., et al. Profiling the origin, dynamics, and function of traction force in B cell activation. Science Signaling. 11 (542), (2018).
- Hui, K. L., Balagopalan, L., Samelson, L. E., Upadhyaya, A. Cytoskeletal forces during signaling activation in Jurkat T-cells. Molecular Biology of the Cell. 26 (4), 685-695 (2015).
- Bashour, K. T., Gondarenko, A., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences of the United States of America. 111 (6), 2241-2246 (2014).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. The Journal of Cell Biology. 183 (6), 999-1005 (2008).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. Journal of Physics. Condensed Matter. 22 (19), 194104(2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados