Method Article
长期,无血清培养有机小鼠视网膜外植与完整的视网膜色素上皮
摘要
该协议描述了小鼠 神经视网膜的细胞图外植,与视网膜色素上皮(RPE)一起在R16定义的介质中培养,不含血清和抗生素。与 体内 实验相比,这种方法性能相对简单、成本更低、耗时,可适应多种实验应用。
摘要
在眼科研究中,神经神经内膜的 体外 模型非常需要。在这里,我们提出了一个详细的协议,为细胞图培养小鼠 神经视网膜与完整的视网膜色素上皮(RPE)。根据研究问题,视网膜可以从野生类型的动物或疾病模型中分离出来,例如研究糖尿病视网膜病变或遗传性视网膜退化。产后早期2-9动物的眼睛在无菌条件下被诱导。它们部分被消化在蛋白酶K中,以便将胆汁从RPE中分离。在立体镜下,角膜形成一个小切口,形成两个边缘,从其中胆汁和硬骨可以轻轻地从 RPE 和神经精子剥离。然后,将镜头拆下,眼杯切成四点,使其具有四楔形,类似于三叶草叶。组织最终被转移到一个挂滴到细胞培养插入持有聚碳酸酯培养膜。然后,这些培养物在R16介质中保持,没有血清或抗生素,在完全定义的条件下,每隔一天发生一次中等变化。
所述程序使小膜能够隔离,并维持其正常的生理和组织背景,至少持续2周的培养期。这些功能使有机视网膜外植培养成为具有高预测价值的优秀模型,用于研究视网膜发育、疾病机制和电生理学,同时实现药理学筛查。
引言
在眼科研究中,有多种模型可用于研究视网膜,包括原发性视网膜细胞培养、视网膜衍生细胞系、视网膜器官,以及体内动物模型1、2、3、4、5。然而,这些模型中的每一个都有缺点。例如,细胞在孤立中生长,而网膜是一个复杂的网络,具有多种细胞对细胞的相互作用。因此,与整个组织中观察到的行为相比,孤立细胞培养的行为可能是人为的。这个问题可以部分地用体外分化视网膜器官来补救,可用于研究发育和基础生物学6。然而,从今天起,视网膜器官的生成仍然是耗时的,劳动密集型的,并遭受可重复性问题,需要大量的进一步发展工作之前,器官可用于转化视网膜研究。最后,对活体动物的研究,虽然可以说是最接近眼科研究要求的模型,但与强烈的伦理问题有关。细胞培养系统的效率与体内动物模型的真实情况之间的一个很好的折衷方案是有机视网膜外植培养。这种文化也减少了动物的痛苦,因为没有进行体内干预。
已经描述了几种方法来培育来自不同物种5,7,8的视网膜外植。我们的协议描述了一种隔离小鼠神经神经质及其视网膜色素上皮(RPE)的技术。这项技术也将适合大鼠视网膜培养9。神经神经质培养及其 RPE 对于成功至关重要。RPE对视网膜具有基本功能:输送养分、离子、水、吸收光线和防止光氧化,将全跨视网膜重新异构成11-cis-视网膜,这对视循环、棚光感受膜的幻象形成以及视网膜结构完整性的基本因素分泌至关重要。维护 RPE 可成功开发光感受器的外部和内部部分,使光网膜在较长时间内保持活力。下文描述的程序至少保存了两个星期12的直肠组织和生理特征。此外,在无血清、无抗生素的介质中培养有机视网膜外植可避免存在未知物质,并能够直接解释结果12。
有机视网膜外植培养对于提高我们对视网膜发育和退化的知识至关重要。我们在这里表明,它们也是药理学筛查的有用工具,它们可以用来模拟各种视网膜疾病,包括糖尿病视网膜病变。
研究方案
符合德国动物保护法第4条的动物议定书由图宾根大学动物保护委员会(埃因里希通·费尔·蒂尔舒茨、蒂雷兹特利琴·迪恩斯特和拉蒂尔昆德)审查和批准:注册号AK02/19M)。在这项研究中,视网膜是从野生型(WT)和rd1小鼠中获得的,后者是遗传性视网膜变性15的一个特征良好的模型。老鼠被安置在标准的白色循环照明下,可以自由获得食物和水,并且无论性别如何使用。
1. 清单
- 为确保无菌条件,避免污染,使用 70% 乙醇清洁和消毒层气流罩。一定要让乙醇完全蒸发,防止视网膜培养物的陶醉。
- 使用前自动切割工具(如剪刀、钳子和眼科显微镜刮勺)。
- 在无菌条件下,提前在层流罩下准备以下介质:Basal R16 介质 (BM) (可存储在 4 °C 4 周)、BM 与 20% 胎儿小腿血清 (FCS) (同一天使用),BM 与 0 .12% 蛋白酶 K (44 mAnson U/mg) 溶液 (当天使用) 和完整的 R16 介质与补充剂 (CM) 如 Romijn16所描述 (可存储在 4 °C 3 周) (见表 S1, S2,和S3)。
- 在 37 °C 预热蛋白酶 K 溶液以激活它,并在第 2.5 步中使用它。
2. 准备
- 在产后日(P)5通过斩首牺牲 rd1/WT动物。对于超过P11的动物,根据当地动物保护条例,使用二氧化碳 和/或宫颈错位。
- 根据动物的年龄,在诱导之前,如果需要,使用钳子打开眼睑,非常小心地分离眼睑,而无需触摸或划伤下面的眼睛。
- 使用弯曲的钳子在立体镜下快速诱导眼睛。
- 在室温下将眼睛在 BM 中孵育 5 分钟 (RT)。
- 在预热的BM中孵化眼睛,在37°C下用0.12%的蛋白酶K孵育15分钟。
- 在层压气流罩内执行以下步骤,以确保无菌条件。要灭活蛋白酶 K,将眼睛转移到含有 20% FCS 的 BM,并在 RT 孵育 5 分钟。
- 在 RT 的培养皿中,在立体镜下解剖眼睛,无菌地在 RT 中含有新鲜的 BM。时间越长,解剖视网膜就越难,眼睛变得很软。
- 用钳子,从视神经保持眼睛。使用细剪刀,在角膜上做一个小切口,创建2个边缘,从角膜,胆汁和硬皮可以轻轻地去皮使用2对细钳(图1 步骤A–C)。或者,使用窄口径的管子将第一个切口切入角膜,然后将其中一把剪刀刀片插入开口。
- 用细钳抓住镜头。将第二对钳子垂直于第一对,以便第一个钳子在第二个磁盘的 2 个刀柄之间。拉从眼杯中提取镜头。如果静脉和胆体仍然附着在视网膜上,小心地将其移除(图1 步骤D)。
注意:步骤 2.7.1 和 2.7.2 需要练习,并确保谨慎不要损坏网膜。 - 将垂直于边缘的网状网状物切成四点,形成四叶三叶草形状(图1 步骤E–F)。
- 使用 1 mL 尖端广泛切割底座的移液器,将网状膜放在悬挂的介质中,并将其转移到放置在 6 井培养板中的培养皿滤芯插入物中。RPE 层应面向膜(图 1 步骤 G)。
- 使用移液器,小心地从插入物中去除多余的介质。
- 从井的两侧,每口井添加1毫升CM,在37°C的无菌孵化器中孵化,二氧化碳2为5%。不要将小膜浸入介质中,因为这会减少氧合并导致组织退化。去种植物应保持在液体和空气之间的界面,只覆盖由水表面张力产生的薄薄的液体薄膜。
- 在前 48 小时内保持视网膜外植不受干扰,以便于去除程序后恢复。
- 每隔两天更换一次介质(48 小时)。从每口井中丢弃 700 μL 的介质,并在井中加入 900 μL 的新鲜 CM。这样,蒸发失去的介质量被恢复,视网膜外植保留了前48小时产生的一些神经保护因子。
- 将去除的介质与培养物一起在单独和封闭的微中流管中孵化,以控制和评估可能的污染(即介质颜色的变化)。
注:视网膜外植可以在培养中保存至少2周12。
3. 栽培后
注:外植可用于不同的实验应用(西斑、组织学、全坐骑、基因分析、电生理学)。根据应用,有机视网膜外植物可以捕捉冷冻、解冻或准备冷冻。下面的步骤描述了神学准备。
- 用4%的副甲醛(PFA)进行45分钟的固定,然后进行渐进的蔗糖低温保护(10分钟10%蔗糖,20分钟20%,室温(RT)或夜间(开)在4°C时2小时30%。将这些缓冲器直接添加到井中。
- 切开视网膜外植物周围的膜。
- 将膜和视网膜组织嵌入介质中,用于冷冻组织。
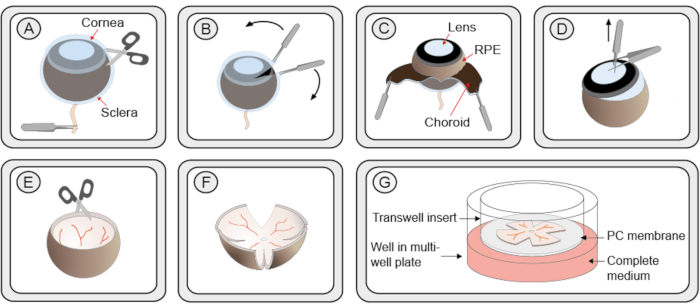
图1:器官视网膜外植培养物的编制分步程序。(A) 小鼠眼睛被诱导并转移到蛋白酶K溶液中,以便将硬盘和胆汁从视网膜和RPE中分离出来。引入了囊泡/巧克力层的一个小切口。(B) 两个钳子用于剥去硬皮/胆汁层。(C) 在剥皮过程中可以看到黑色巧克力层。下划线的深色视网膜色素上皮 (RPE) 仍然附着在眼球上。硬骨和胆汁与视神经一起被切除。(D) 镜头和钳子用钳子提取。 剩余的胆小的身体被移除。(E) 网状网膜保持碗状形状。(F) 为了平整在盘子中培养的网状网膜,用剪刀在网状物周围等距离内进行4次切割,使其形成三叶草状的形状。使用切割的 1 mL 移液器尖端,将网膜培养物转移到插入 6 井板中的膜培养物中。网状网膜仍然保留一些碗形。然而,在去除视网膜周围的多余的液体后,它将展开到平面结构。(G) 在培养膜设置中,网状膜培养物位于多孔聚碳酸酯 (PC) 膜上,位于完整的 R16 介质溶液之上。为了确保生存能力,该培养必须保持在一个潮湿的无菌孵化器中,温度为37°C,二氧化碳为5%,并且每48小时更换一次介质。
结果
遵循协议后,解剖和培养的视网膜除外植物保留其正常的组织结构,具有不同的层,从RPE到结节细胞层(GCL),如图2所示。外层核层(ONL)和内部核层(INL)的大小在2-3周内基本保持稳定,如果培养期延长到4周及以后,细胞流失缓慢,这些层逐渐变薄。相比之下,在GCL中,由于视神经的轴切除术,通常在培养的头4天内观察到明显的变薄。之后,GCL中剩余的细胞群(大部分为置换的阿马格林细胞)将继续存活3-4周17、18、19。
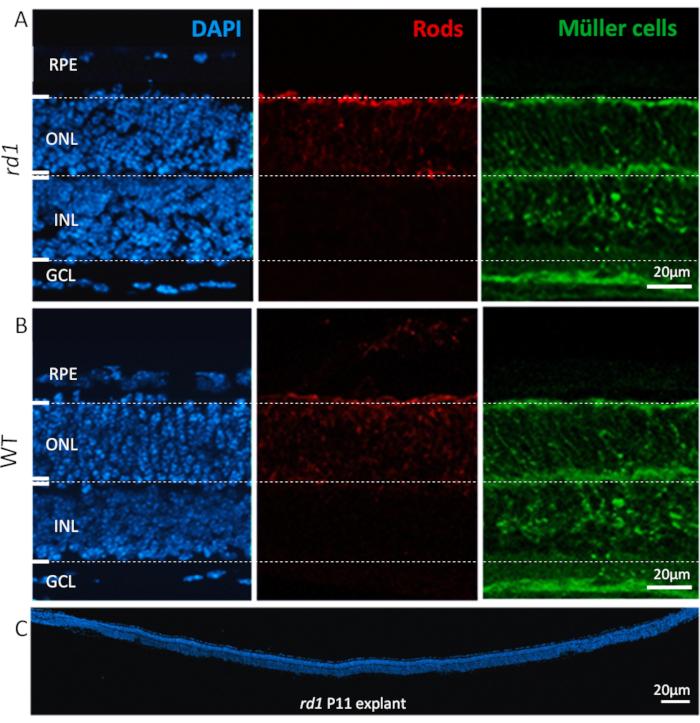
图2:视网膜外植培养中发现的细胞类型。P11的视网膜外植培养来自rd1突变体(A)和WT动物(B),显示核染色与DAPI(左,蓝色),棒光感受器(中,红色)和穆勒细胞(右,绿色)。核染色突出了视网膜的所有主要细胞层,如视网膜色素上皮(RPE)、外核层(ONL)、内核层(INL)和结膜细胞层(GCL)。核层中的特定细胞类型,如棒状细胞和穆勒细胞,分别用α逮捕素26和谷氨酰胺合成酶27抗体免疫。(C) 显示整个 rd1小鼠视网膜的全长部分,DAPI 染色突出了视网膜的一致性、集成和发展性。这些视网膜被培养了6天。程序描述:从rd1或WT动物中提取的雷蒂娜和RPE在P5被隔离,并按照协议所述进行培养,直到P11每48小时发生一次中等变化。文化在P11时用4%的PFA固定,并进行了冷冻剖析。请单击此处查看此图的较大版本
无血清介质和持续的 体外 环境使能够完全控制实验条件。在这里,我们为本协议的具体应用提供两个示例。
第一个例子说明了使用视网膜外植进行药物测试或筛选的可能性。有机视网膜外植培养物是从野生类型 (WT) 和rd1小鼠模型中准备的。后者是视网膜变性15的一个特点良好的模型。在rd1小鼠网膜中,ONL 退化是由棒光感受器6、20中异常高的 cGMP 水平触发的。过量的cGMP导致循环核苷酸门离子通道(CNGCs)和cGMP依赖蛋白激酶(PKG)的活性增加,导致细胞死亡21。用结构类似于cGMP(环核苷酸#3的31小鼠视网膜的处理:针对 PKG 和 CNGC 的 CN003 进行了测试。在 P5 去除后,遵循图 3A中描述的治疗模式。在P11中,外植培养物固定在4%PFA,并准备进行冷冻切除(图3A)。为了评估从治疗,非治疗(NT)和WT标本组织学部分的细胞死亡,进行了终端脱氧核苷酸转移酶dUTP尼克结束标签(TUNEL)检测22。TUNEL标记细胞的分析显示,在未经处理的标本的UNL中,死亡细胞的比例很高,而CN003在浓度为50μM23(图3B)时保护了第1个小鼠光感受器。
糖尿病的常见并发症是糖尿病视网膜病变,一种致盲疾病,很难在动物模型5中忠实地繁殖。第二个例子突出了使用有机视网膜外植培养物来描述视网膜细胞在模拟2型糖尿病(T2DM)24的条件下的生存能力。在这里,我们使用20mM的糖化抑制剂2-脱氧葡萄糖(2-DG)25,并管理它到培养介质24小时从P10到P11。我们表明,将WT视网膜外植受制于这种体外模拟糖尿病疾病会导致视网膜(图3C)广泛的神经元细胞死亡。然后,这种范式可以反过来用于研究退行机制或在糖尿病背景下测试视网膜保护治疗。
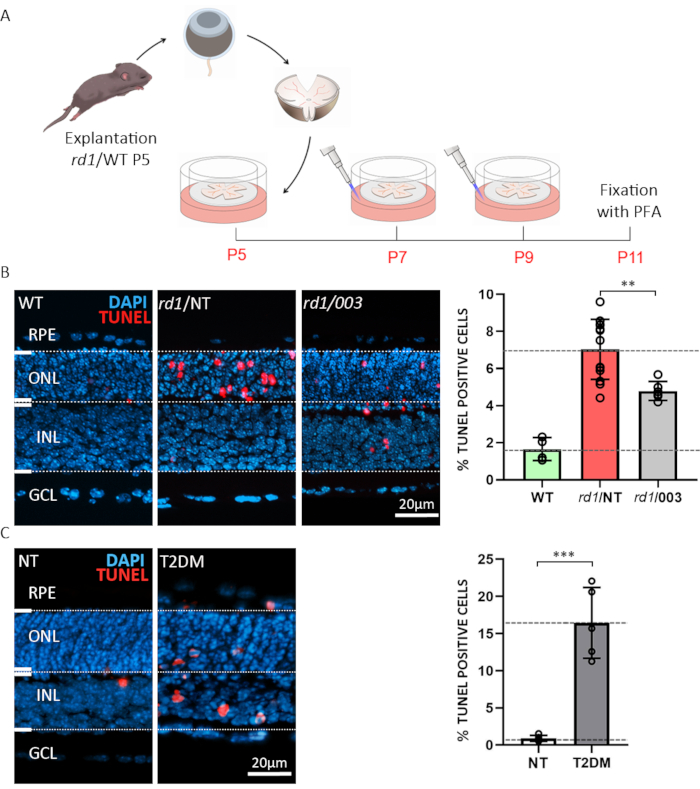
图3:两个应用有机视网膜外植培养物的例子。 (A) 程序描述: 来自rd1或WT动物的视网膜和RPE在产后日(P)5被隔离,并如上所述进行培养,每48小时发生一次中等变化。在 P7 和 P9 中,废中等被丢弃,在板中加入浓度为 50μM 的含有活性化合物的新鲜 CM。文化在P11时用4%的PFA固定,并进行了冷冻剖析。(B) 对rd1小网膜进行复合测试。部分来自WT,治疗(003)和非处理(NT)有机视网膜外植培养物。图恩尔检测(红色)被用作细胞死亡的标记。核染色与DAPI(蓝色)。条图中显示的定量说明了WT、rd1 NT 和rd1 003 条件下死亡细胞的百分比。用化合物003治疗显著减少rd1光感受器细胞死亡。(C) 使用 2 脱氧葡萄糖 (2-DG) 治疗方式模拟 WT 视网膜上的 2 型糖尿病 (T2DM)。在NT和T2DM标本上进行了TUNTL检测。量化表明细胞死亡显著增加。请单击此处查看此图的较大版本
表S1。 请单击此处下载表
表 S2。 请单击此处下载表
表 S3。 请单击此处下载表
讨论
所提交的协议描述了小鼠网状体的有机去除培养物,在定义的R16介质中具有完整的RPE,不含血清和抗生素。该协议最初开发于20世纪80年代末7,28,从那时起,它一直在不断完善6,11,12。值得注意的应用包括研究遗传性视网膜退化的机制和视网膜保护药物的鉴定23,29,30。
要想进行成功的实验,需要考虑一些重要的考虑因素。这里有一些重要的故障排除点,以帮助提高文化的质量。首先,视网膜文化可能表现出过度折叠和/或玫瑰花环形成31。这可以通过在去除过程中用钳子触摸直膜引起。此外,必须从除法植物中完全去除胆体,因为这样可以增加培养过程中的视网膜折叠。其次,在将小雷管转移到井板的悬垂滴中,如果网状网膜朝下面朝下,将其放在悬挂在移液器尖端的掉落处,并非常轻轻地将介质推入和推出尖端(无需分离悬垂滴)以翻转网状体。最后,如果 RPE 仍然附着在囊泡上,并且从网状网膜上分离,则很可能是由于硬盘消化不足造成的。在与来自老动物或非啮齿动物(如猪)的眼睛一起工作时,这个问题可能特别重要,并且可以通过增加蛋白酶K浓度来解决。
进行有机视网膜外植培养是一个复杂的过程,需要充分的培训和经验。缺乏培训可能导致视网膜外植质量的变异。出于这些原因,必须监测和验证可行性和可重复性,例如,用 TUNEL 检测来描述细胞死亡率。使用无抗生素介质使视网膜外植物容易受到细菌和真菌的污染。为了尽量减少这种风险,我们建议在真正无菌的条件下特别小心工作。 体外视网膜培养的另一个限制是与 体内 视网膜(例如,胆囊和视网膜供血、氧气和葡萄糖水平、眼内压力、体外组成)相比,物理化学环境的差异。一个连续的灌注系统,也许嵌入到一个专门的生物反应器32可以使这个模型更接近 体内 的条件。此外,视网膜解剖期间视神经的轴切除术会导致结节细胞死亡,从而诱发应激反应8。因此,建议在受特定操作或治疗之前,让去种植物 在体外 至少2天适应栽培条件。
上述方法通常在不成熟的视网膜组织上进行,在体外7、33中存活4周。然而,该程序是针对各种应用量身定制的,包括成人直膜的培养。虽然不同已发布的方法描述的成人视网膜的隔离没有其RPE34,35, 孵化与木瓜蛋白溶液长达1小时在37 °C之前解剖允许RPE保持连接到视网膜,即使来自成人小鼠36.
无血清介质和化学定义的体外环境为完全定义和可重复的实验条件提供了操作。因此,有机视网膜外植培养是眼科和神经科学领域的宝贵工具,曾用于研究视网膜疾病37、视网膜发育38、39、视网膜干细胞治疗40、基因改造41和药理筛选。作为药物测试的一个具体例子,在这里我们使用视网膜外植培养物来测试cGMP模拟(CN003),已知可以减少遗传视网膜疾病动物模型中的光感受细胞死亡23(图3B)。该技术的另一个可能应用在图3C中描述,它说明了如何利用组织环境的精确控制来模拟糖尿病状况24。由于在整个培养期组织结构的保存,有机视网膜外植培养也适合电生理学研究。使用补丁夹记录42和多电极阵列(MEA)记录33,43对视网膜外植物的神经元功能进行了研究。后者允许同时记录神经元人群的电活动,并利用它来描述培养条件下的光接受器和结节细胞功能。从更广的角度看,有机外植培养系统也可以应用于临床前研究,其中外植培养用于测试体温过低44的疗效。
有机体外植培养技术相对简单,与 体内 实验相比,成本更低,耗时更短,避免了与活体动物研究相关的伦理问题。对实验条件的精确控制以及RPE和组织复杂性的保存,使该方法成为提高我们对视网膜生理学和病理生理学知识的宝贵工具,并能够进行大量实验应用。
披露声明
作者没有什么可透露的。
致谢
这项研究工作得到了欧盟的资助。H2020-MSCA-765441),德国研究理事会(DFG;PA1751/8-1,10-1)和中国奖学金委员会。
材料
| Name | Company | Catalog Number | Comments |
| Biotin | Sigma | B4639 | |
| (+/-)-α-LipoicAcid (=Thiotic acid) | Sigma | T1395 | |
| BSA | Sigma | B4639 | |
| CDP-Choline-Na | Sigma | 30290 | |
| Corticosterone | Sigma | C2505 | |
| CuSO4 × 5H2O | Sigma | C8027 | |
| DL-Tocopherol | Sigma | T1539 | |
| Ethanolamine | Sigma | E0135 | |
| FCS | Sigma | F7524 | |
| Filtropur BT100, 1L, 0.2µm | SARSTEDT | 83.3942.101 | for Basal Medium |
| Forceps | F.S.T | 15003-08 | |
| Glutamine | Sigma | G8540 | |
| Glutathione | Sigma | G6013 | |
| Insulin | Sigma | I6634 | |
| L-CysteineHCl | Sigma | C7477 | |
| Linoleic Acid | Sigma | L1012 | |
| Linolenic Acid | Sigma | L2376 | |
| MnCl2 x 4H2O | Sigma | M5005 | |
| Na-pyruvate | Sigma | P3662 | |
| NaSeO3 x 5H2O | Sigma | S5261 | |
| Ophthalmic microscope scaping spoon | F.S.T. | 10360-13 | |
| Progesteron | Sigma | P8783 | |
| Proteinase K | MP Biomedicals | 21935025 | 44 mAnson U/mg |
| R16 | Gibco | 07491252A | |
| Retinol | Sigma | R7632 | |
| Retinyl acetate | Sigma | R7882 | |
| Scissors | F.S.T | 15004-08 | |
| Sterile filter 0.22µm | MILLEX GP | SLGP033RS | for supplements |
| T3 | Sigma | T6397 | |
| Tocopherylacetate | Sigma | T1157 | |
| Transferrin | Sigma | T1283 | |
| Transwell permeable supports | Corning | 3412 | |
| Vitamin B1 | Sigma | T1270 | |
| Vitamin B12 | Sigma | V6629 | |
| Vitamin C | Sigma | A4034 |
参考文献
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
- Llonch, S., Carido, M., Ader, M. Organoid technology for retinal repair. Developmental Biology. 433 (2), 132-143 (2018).
- Mencl, S., Trifunović, D., Zrenner, E., Paquet-Durand, F. PKG-dependent cell death in 661W cone photoreceptor-like cell cultures (experimental study). Advances in Experimental Medicine and Biology. 1074, 511-517 (2018).
- Sanges, D., Comitato, A., Tammaro, R., Marigo, V. Apoptosis in retinal degeneration involves cross-talk between apoptosis-inducing factor (AIF) and caspase-12 and is blocked by calpain inhibitors. Proceedings of the National Academy of Sciences of the United States of America. 103 (46), 17366-17371 (2006).
- Schnichels, S., et al. Retina in a dish: cell cultures, retinal explants and animal models for common diseases of the retina. Progress in Retinal and Eye Research. , 100880 (2020).
- Paquet-Durand, F., Hauck, S. M., van Veen, T., Ueffing, M., Ekström, P. PKG activity causes photoreceptor cell death in two retinitis pigmentosa models. Journal of Neurochemistry. 108 (3), 796-810 (2009).
- Caffe, A. R., Visser, H., Jansen, H. G., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical and Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Arango-Gonzalez, B., et al. In vivo and in vitro development of S- and M-cones in rat retina. Investigative Ophthalmology and Visual Science. 51 (10), 5320-5327 (2010).
- Strauss, O. The retinal pigment epithelium in visual function. Physiological Reviews. 85 (3), 845-881 (2005).
- Söderpalm, A., Szél, A., Caffé, A. R., van Veen, T. Selective development of one cone photoreceptor type in retinal organ culture. Investigative Ophthalmology and Visual Science. 35 (11), 3910-3921 (1994).
- Caffe, A. R., et al. Mouse retina explants after long-term culture in serum free medium. Journal of Chemical Neuroanatomy. 22 (4), 263-273 (2001).
- Caffe, A. R., Soderpalm, A. K., Holmqvist, I., van Veen, T. A combination of CNTF and BDNF rescues rd photoreceptors but changes rod differentiation in the presence of RPE in retinal explants. Investigative Ophthalmology and Visual Science. 42 (1), 275-282 (2001).
- Ogilvie, J. M., Speck, J. D., Lett, J. M., Fleming, T. T. A reliable method for organ culture of neonatal mouse retina with long-term survival. Journal of Neuroscience Methods. 87 (1), 57-65 (1999).
- Keeler, C. E. The inheritance of a retinal abnormality in white mice. Proceedings of the National Academy of Sciences of the United States of America. 10 (7), 329-333 (1924).
- Romijn, H. J. Development and advantages of serum-free, chemically defined nutrient media for culturing of nerve tissue. Biology of the Cell. 63 (3), 263-268 (1988).
- Caffe, A. R., et al. Mouse retina explants after long-term culture in serum free medium. Journal of Chemical Neuroanatomy. 22 (4), 263-273 (2001).
- Alarautalahti, V., et al. Viability of Mouse Retinal Explant Cultures Assessed by Preservation of Functionality and Morphology. Investigative Ophthalmology and Visual Science. 60 (6), 1914-1927 (2019).
- Caffe, A. R., Visser, H., Jansen, H. G., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Farber, D. B., Lolley, R. N. Cyclic guanosine monophosphate: elevation in degenerating photoreceptor cells of the C3H mouse retina. Science. 186 (4162), 449-451 (1974).
- Arango-Gonzalez, B., et al. Identification of a common non-apoptotic cell death mechanism in hereditary retinal degeneration. PloS One. 9 (11), 112142 (2014).
- Loo, D. T. In situ detection of apoptosis by the TUNEL assay: an overview of techniques. Methods in Molecular Biology. 682, 3-13 (2011).
- Vighi, E., et al. Combination of cGMP analogue and drug delivery system provides functional protection in hereditary retinal degeneration. Proceedings of the National Academy of Sciences of the United States of America. 115 (13), 2997-3006 (2018).
- Valdés, J., et al. Organotypic retinal explant cultures as in vitro alternative for diabetic retinopathy studies. Altex. 33 (4), 459-464 (2016).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: from diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), (2019).
- Slepak, V. Z., Hurley, J. B. Mechanism of light-induced translocation of arrestin and transducin in photoreceptors: interaction-restricted diffusion. IUBMB Life. 60 (1), 2-9 (2008).
- Paquet-Durand, F., et al. A retinal model of cerebral malaria. Scientific Reports. 9 (1), 3470 (2019).
- Romijn, H. J., de Jong, B. M., Ruijter, J. M. A procedure for culturing rat neocortex explants in a serum-free nutrient medium. Journal of Neuroscience Methods. 23 (1), 75-83 (1988).
- Azadi, S., et al. CNTF+BDNF treatment and neuroprotective pathways in the rd1 mouse retina. Brain Research. 1129 (1), 116-129 (2007).
- Kaur, J., et al. Calpain and PARP activation during photoreceptor cell death in P23H and S334ter rhodopsin mutant rats. PloS One. 6 (7), 22181 (2011).
- Samardzija, M., et al. A mouse model for studying cone photoreceptor pathologies. Investigative Ophthalmology and Visual Science. 55 (8), 5304-5313 (2014).
- Achberger, K., et al. Merging organoid and organ-on-a-chip technology to generate complex multi-layer tissue models in a human retina-on-a-chip platform. eLife. 8, (2019).
- Alarautalahti, V., et al. Viability of Mouse Retinal Explant Cultures Assessed by Preservation of Functionality and Morphology. Investigative Ophthalmology and Visual Science. 60 (6), 1914-1927 (2019).
- Ferrer-Martín, R. M., et al. Microglial cells in organotypic cultures of developing and adult mouse retina and their relationship with cell death. Experimental Eye Research. 121, 42-57 (2014).
- Müller, B. Organotypic culture of adult mouse retina. Methods in Molecular Biology. 1940, 181-191 (2019).
- Heller, J. P., Kwok, J. C., Vecino, E., Martin, K. R., Fawcett, J. W. A method for the isolation and culture of adult rat Retinal Pigment Epithelial (RPE) cells to study retinal diseases. Frontiers in Cellular Neuroscience. 9, 449 (2015).
- Sahaboglu, A., et al. Retinitis pigmentosa: rapid neurodegeneration is governed by slow cell death mechanisms. Cell Death & Disease. 4 (2), 488 (2013).
- Arai, E., et al. Ablation of Kcnj10 expression in retinal explants revealed pivotal roles for Kcnj10 in the proliferation and development of Müller glia. Molecular Vision. 21, 148-159 (2015).
- Demas, J., Eglen, S. J., Wong, R. O. Developmental loss of synchronous spontaneous activity in the mouse retina is independent of visual experience. Journal of Neuroscience. 23 (7), 2851-2860 (2003).
- Johnson, T. V., Martin, K. R. Development and characterization of an adult retinal explant organotypic tissue culture system as an in vitro intraocular stem cell transplantation model. Investigative Ophthalmology and Visual Science. 49 (8), 3503-3512 (2008).
- Hatakeyama, J., Kageyama, R. Retrovirus-mediated gene transfer to retinal explants. Methods. 28 (4), 387-395 (2002).
- Moritoh, S., Tanaka, K. F., Jouhou, H., Ikenaka, K., Koizumi, A. organotypic tissue culture of adult rodent retina followed by particle-mediated acute gene transfer in vitro. PloS One. 5 (9), 12917 (2010).
- Reinhard, K., et al. Step-by-step instructions for retina recordings with perforated multi electrode arrays. PloS One. 9 (8), 106148 (2014).
- Klemm, P., et al. Hypothermia protects retinal ganglion cells against hypoxia-induced cell death in a retina organ culture model. Clinical and Experimental Ophthalmology. 47 (8), 1043-1054 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。