Method Article
Sağlam Retina Pigment Epitel ile Organotipik Fare Retina Eksplantlarının Uzun Süreli, Serumsuz Ekimi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Protokol, fare nöroretinasınınorganotipik eksplantlarını açıklar Retina pigment epiteliyle (RPE) birlikte yetiştirilen, R16 tanımlı ortamda, serum ve antibiyotik içermez. Bu yöntemin in vivo deneylere kıyasla gerçekleştirilmesi nispeten basit, daha az pahalı ve zaman alıcıdır ve çok sayıda deneysel uygulamaya uyarlanabilir.
Özet
Oftalmik araştırmalarda, nöroretina in vitro modellere güçlü bir ihtiyaç vardır. Burada, sağlam retina pigment epitel (RPE) ile fare nöroretina organotipik kültürü için ayrıntılı bir protokol sunuyoruz. Araştırma sorusuna bağlı olarak, retinalar vahşi tip hayvanlardan veya hastalık modellerinden izole edilebilir, örneğin diyabetik retinopati veya kalıtsal retina dejenerasyonu çalışmak için. Doğum sonrası erken gün 2-9 hayvanın gözleri aseptik koşullar altında enükle edilir. Koroidin RPE'den ayrılabilmesi için proteinaz K'de kısmen sindirilirler. Stereoskop altında, korneada küçük bir kesi yapılır ve koroid ve skleranın RPE ve nöroretina'dan nazikçe soyulabileceği iki kenar oluşturur. Lens daha sonra çıkarılır ve göz kapağı yonca yaprağına benzeyen dört kamalı bir şekil vermek için dört noktada kesilir. Doku sonunda bir hücre kültürüne asılı bir damla içinde aktarılır polikarbonat kült membran tutan. Kültürler daha sonra serum veya antibiyotik olmadan, tamamen tanımlanmış koşullar altında, her iki günde bir orta değişiklikle R16 ortamında sürdürülür.
Açıklanan prosedür retinanın izolasyonunu ve en az 2 haftalık kültleme süreleri için normal fizyolojik ve histotipik bağlamının korunmasını sağlar. Bu özellikler organotipik retina eksplant kültürlerini, retina gelişimi, hastalık mekanizmaları ve elektrofizyoloji çalışmaları için yüksek tahmin değerine sahip mükemmel bir model haline getirirken, farmakolojik taramayı da mümkün kılar.
Giriş
Oftalmik araştırmalarda, birincil retina hücre kültürleri, retina türevli hücre hatları, retina organoidleri ve in vivo hayvan modelleri1, 2 ,3,4,5dahil olmak üzere retinayı incelemek için çeşitli modeller mevcuttur. Ancak, bu modellerin her biri dezavantajlardan muzdariptir. Örneğin, retina çok sayıda hücreden hücreye etkileşime sahip karmaşık bir ağ iken hücreler izole bir şekilde büyür. Bu nedenle, izole hücre kültürlerinin davranışının tüm dokuda gözlemlenene kıyasla yapay olması muhtemeldir. Bu sorun kısmen in vitro farklılaştırılmış retina organoidleri kullanılarak düzeltilebilir, bu da gelişimi ve temel biyolojiyi incelemek için kullanılabilir6. Ancak, bugün itibariyle, retinal organoid üretimi hala zaman alıcı, emek yoğundur ve tekrarlanabilirlik sorunlarından muzdariptir ve organoidlerin çevirisel retina araştırmaları için kullanılabilmesi için önemli ölçüde daha fazla geliştirme çalışması gerektirmektedir. Son olarak, canlı hayvanlar üzerinde yapılan çalışmalar, tartışmasız oftalmik araştırmanın gereksinimlerine en yakın model olsa da, güçlü etik kaygılarla ilişkilidir. Hücre kültürü sistemlerinin verimliliği ile in vivo hayvan modellerinin gerçek hayattaki durumu arasında iyi bir uzlaşma organotipik retina eksplant kültürleridir. Bu tür kültürler, in vivo müdahale yapılmadığı için hayvan acılarını da azaltır.
Farklı türlerden retina eksplantlarını kültleme için çeşitli yöntemler tanımlanmıştır5,7,8. Protokolümüz, fare nöroretinasının retina pigment epiteliyle (RPE) izolasyonu için bir teknik tanımlamaktadır. Bu teknik sıçan retina kültürleri için de uygun olacaktır9. Nöroretina kültürü RPE ile birlikte başarı için büyük önem taşımaktadır. RPE retina için temel işlevleri yerine getirir: besinlerin, iyonların, suyun taşınması, ışığın emilimi ve fotooksidasyona karşı koruma, tüm trans retinaların görme döngüsü için çok önemli olan 11-cis-retinal içine yeniden izomerizasyonu, dökülen fotoreceptör zarlarının fagositozu ve retinanın yapısal bütünlüğü için temel faktörlerin salgılanması10. RPE'nin korunması, fotoreceptör dış ve iç segmentlerinin başarılı bir şekilde gelişmesine izin verir, retinayı daha uzun süre yaşayabilir tutar11. Aşağıda açıklanan prosedür retinanın histotipik ve fizyolojik özelliklerini en az iki hafta korur12. Ayrıca, organotipik retina eksplantlarının serumsuz, antibiyotik içermeyen ortamda kült haline edilmesi bilinmeyen maddelerin varlığını önler ve sonuçların basit bir şekilde yorumlanmasını sağlar12.
Organotipik retina eksplant kültürleri retina gelişimi ve dejenerasyon hakkındaki bilgimizi geliştirmek için gerekli olmuştur7,13,14. Burada farmakolojik tarama için de yararlı bir araç olduklarını ve diyabetik retinopati de dahil olmak üzere çeşitli retina hastalıklarını modellemek için kullanılabileceğini gösteriyoruz.
Protokol
Alman hayvanları koruma yasasının §4'üne uygun hayvan protokolleri Tübingen Üniversitesi hayvanları koruma komitesi tarafından gözden geçirildi ve onaylandı (Einrichtung für Tierschutz, Tierärztlichen Dienst und Labortierkunde; Kayıt No AK02/19M). Bu çalışmada, retinalar vahşi tip (WT) ve rd1 farelerden elde edildi, ikincisi kalıtsal retina dejenerasyonu için iyi karakterize edilmiş birmodeldir 15. Fareler standart beyaz döngüsel aydınlatma altında barındırıldı, yiyecek ve suya ücretsiz erişime sahipti ve cinsiyetten bağımsız olarak kullanıldı.
1. Kontrol listesi
- Steril koşulları sağlamak ve kirlenmeleri önlemek için laminer hava akış davlumbazını % 70 etanol ile temizleyin ve dezenfekte edin. Retina kültürlerinin zehirlenmesini önlemek için etanol'ün tamamen buharlaşmasına izin verdiğinden emin olun.
- Kullanmadan önce otoklav aletleri (örneğin makas, hardal ve oftalmik mikroskop kazıma kaşığı).
- Aşağıdaki ortamı steril koşullar altında laminer akışlı bir davlumbaz altında önceden hazırlayın: Bazal R16 ortamı (BM) (4 hafta boyunca 4 °C'de saklanabilir), %20 fetal baldır serumu (FCS) ile BM (aynı gün kullanım), 0,0 ile BM % 12 proteinaz K (44 mAnson U/mg) çözeltisi (aynı gün kullanımı) ve Romijn 16 tarafından açıklandığı gibi takviyeli (CM) kompleR16 ortamı (3 hafta boyunca 4 °C'de saklanabilir) (bkz. Tablolar S1, S2 ve S3).
- Proteinaz K çözeltisini etkinleştirmek için 37 °C'de önceden ısıtın ve 2.5.
2. Hazırlık
- Doğum sonrası gün (P) 5'te rd1/WT hayvanlarını kafa kesme ile kurban edin. P11'den büyük hayvanlar için, yerel hayvan koruma yönetmeliklerine göre CO2 ve/veya servikal çıkık kullanın.
- Hayvanın yaşına bağlı olarak, enükleasyondan önce, gerekirse, göz kapaklarını uzun uçlar kullanarak açın ve aşağıdaki göze dokunmadan veya kaşımadan göz kapaklarını çok dikkatli bir şekilde ayırın.
- Kavisli asalar kullanarak stereoskop altında gözleri hızla enüklee edin.
- Gözleri BM'de oda sıcaklığında (RT) 5 dakika kuluçkaya yatırın.
- Gözleri önceden ısıtılmış BM'de 15 dakika boyunca 37 °C'de% 0.12 proteinaz K ile kuluçkaya yatırın.
- Steril koşulları sağlamak için laminer hava akış başlığı içinde aşağıdaki adımları uygulayın. Proteinaz K'yi inaktive etmek için gözleri% 20 FCS içeren BM'ye aktarın ve RT'de 5 dakika kuluçkaya yatır.
- Rt'de taze BM içeren bir Petri kabında gözleri bir stereoskop altında, aseptik olarak parçalara ayırma. Bu süre ne kadar uzun olursa, retinayı parçalamak o kadar zorlaşır, gözler çok yumuşak hale gelir.
- Asalarla, gözü optik sinirden tutun. İnce makas kullanarak korneada küçük bir kesi yaparak kornea, koroid ve skleranın 2 çift ince tokmakla hafifçe soyulabileceği yerden 2 kenar oluşturun(Şekil 1 adım A–C). Alternatif olarak, korneaya ilk kesiyi yapmak için dar bir kanonül kullanın ve ardından makas bıçaklarından birini açıklığa yerleştirin.
- Lensi ince kanatlarla kavrayın. İlk atalara dik olarak ikinci bir çift tokmak yerleştirin, böylece ilk toslar ikincisinin 2 sapı arasındadır. Lensi göz kabından çıkarmak için çekin. Vitreus ve siliary vücut hala retinaya bağlıysa, dikkatlice çıkarın(Şekil 1 adım D).
NOT: Adım 2.7.1 ve 2.7.2 pratik gerekir ve retinaya zarar vermemek için dikkatli olun. - Retinayı kenarlarına dik olarak dört noktada kesin ve dört yapraklı yonca şekli oluşturun(Şekil 1 adım E-F).
- 1 mL ucun geniş kesim tabanına sahip bir pipet kullanarak, retinayı asılı bir orta damlada tutun ve 6 kuyulu bir kültür plakasına yerleştirilmiş bir kültür yemeği filtresine aktarın. RPE tabakası zara bakmalıdır(Şekil 1 adım G).
- Bir pipet kullanarak, fazla ortamı kesici uçtan dikkatlice çıkarın.
- Kuyunun yanlarından, kuyu başına 1 mL CM ekleyin ve% 5 CO2ile 37 ° C'de steril bir inkübatörde kuluçkaya yatırın. Retinayı ortama batırmayın, çünkü bu oksijenlenmeyi azaltır ve doku dejenerasyonuna neden olur. Explant, sadece suyun yüzey gerilimi tarafından oluşturulan ince bir sıvı filmi ile kaplanmış sıvı ve hava arasındaki arayüzde kalmalıdır.
- Eksplantasyon işleminden sonra iyileşmeyi kolaylaştırmak için retinayı ilk 48 saat boyunca bozulmadan bırakın.
- Ortamı her iki günde bir değiştirin (48 saat). Her kuyudan 700 μL orta atın ve kuyuya 900 μL taze CM ekleyin. Bu sayede buharlaşma ile kaybedilen ortam miktarı geri kazanılır ve retina eksplantı önceki 48 saat içinde üretilen nöroprotektif faktörlerin bir kısmını tutar.
- Olası kontaminasyonu (yani ortamın renginin değişmesini) kontrol etmek ve değerlendirmek için çıkarılan ortamı kültürlerle birlikte ayrı ve kapalı bir mikrosantrifüj tüpünde kuluçkaya yatırın.
NOT: Retina eksplantları kültürde en az 2 hafta tutulabilir12.
3. Kültlemeden sonra
NOT: Explants farklı deneysel uygulamalar (batı lekesi, histoloji, tüm binekler, genetik analiz, elektrofizyoloji) için kullanılabilir. Uygulamaya bağlı olarak, organotipik retina eksplantları dondurulabilir, yutabilir veya kriyoseksiyon için hazırlanabilir. Aşağıdaki adımlar histolojik hazırlığı açıklar.
- %4 paraformaldehit (PFA) ile 45 dakikalık bir fiksasyon gerçekleştirin, ardından kademeli sakkaroz kriyoproteksiyon (10 dakika için%10 sakkaroz, 20 dakika için %20 ve oda sıcaklığında (RT) 2 saat veya 4 °C'de geceleme (AÇIK) için %30). Bu arabellekleri doğrudan kuyuya ekleyin.
- Retina eksplantlarının etrafındaki zarı kesin.
- Donmuş doku için hem zarı hem de retina dokusunu ortama gömün.
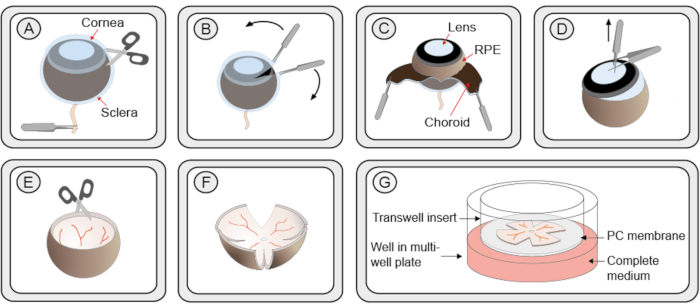
Şekil 1: Organotipik retina eksplant kültürlerinin hazırlanması için adım adım prosedür. (A) Fare gözleri, sklera ve koroidlerin retina ve RPE'den ayrılmasını sağlamak için enükle edilir ve proteinaz K çözeltisine aktarılır. Sklera/koroid tabakasında küçük bir kesik sunulmuştur. (B) Sklera/koroid tabakasını soymak için iki adet tokmak kullanılır. (C) Siyah koroid tabakası peeling sırasında görülebilir. Altı çizili koyu retina pigment epitel (RPE) göz küresine bağlı kalır. Sklera ve koloid optik sinir ile birlikte çıkarılır. (D) Lens ve vitreus, emişlerle çıkarılır. Kalan siliary vücut çıkarılır. (E) Retina kase benzeri bir şekil korur. (F) Bir tabakta kültleme için retinayı düzleştirmek için, retinanın etrafında eşit mesafede 4 kesik bir makasla yapılır ve yonca benzeri bir şekil verilir. Retina kültürü, kesilmiş 1 mL pipet ucu kullanılarak 6 kuyulu bir plakada bir membran kültürü kesici ucuna aktarılır. Retina hala kase şeklinin bir kısmını koruyor. Bununla birlikte, retinayı çevreleyen fazla sıvının çıkarılmasından sonra, düzlemsal bir yapıya açılacaktır. (G) Kültür zarı kurulumunda retina kültürü, tam bir R16 ortamı çözeltisinin üzerine gözenekli bir polikarbonat (PC) membran üzerinde dinlenir. Canlılığı sağlamak için, kültür% 5 CO2ile 37 ° C'de nemlendirilmiş steril bir inkübatörde tutulmalıdır ve ortam her 48 saat içinde değiştirilmelidir.
Sonuçlar
Protokolü takip ettikten sonra, parçalanmış ve kültürlü retina eksplantları, Şekil 2'degösterildiği gibi, RPE'den ganglion hücre tabakasına (GCL) kadar farklı katmanlarla normal doku mimarilerini korur. Dış nükleer tabaka (ONL) ve iç nükleer tabaka (INL) boyutu çoğunlukla 2-3 hafta boyunca sabit kaldı, yavaş ilerleyen hücre kaybı ve kültleme süresi 4 hafta ve ötesine uzarsa bu katmanların kademeli olarak inceltilmesi giderek daha belirgin hale geldi. GCL'de, aksine, optik sinirin akstatomisi nedeniyle, genellikle kültlemenin ilk 4 günü içinde belirgin bir inceltme görülür. Daha sonra, GCL'de kalan hücre popülasyonu (çoğunlukla yerinden edilmiş amakrin hücreleri) 3-4 hafta daha yaşayabilir olmaya devamedecektir 17,18,19.
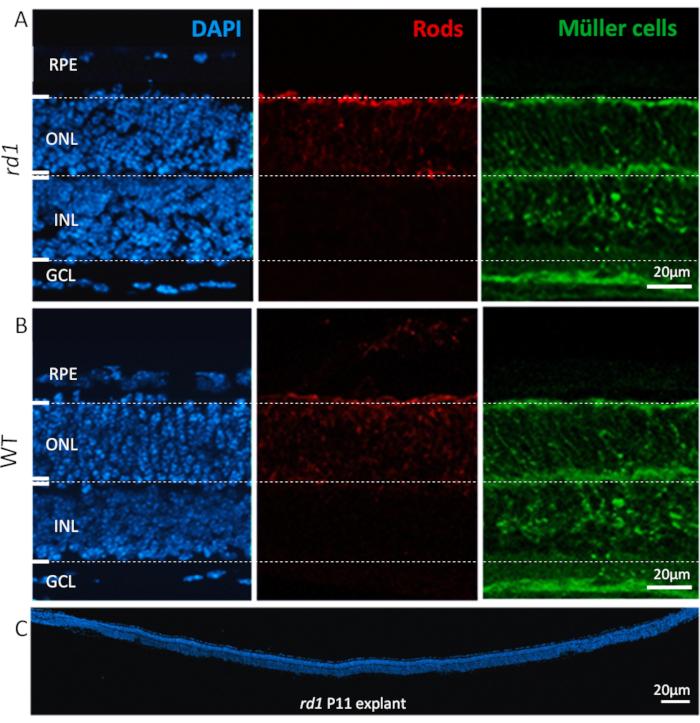
Şekil 2: Retina eksplant kültüründe bulunan hücre tipleri. P11'deki retina explant kültürü rd1 mutant (A) ve WT hayvanlarından(B) türetilmiştir ve DAPI (sol, mavi), çubuk fotoreceptörler (orta, kırmızı) ve Müller hücreleri (sağ, yeşil) ile nükleer lekeleme gösterir. Nükleer boyama retinanın retina pigment epitel (RPE), dış nükleer tabaka (ONL), iç nükleer tabaka (INL) ve ganglion hücre tabakası (GCL) gibi tüm ana hücresel katmanlarını vurgular. Nükleer katmanlardaki çubuklar ve Müller hücreler gibi spesifik hücre tipleri, sırasıyla alfa arrestin26 ve glutamin sintetaz27 antikorları ile immün olarak etiketlenir. (C) Tüm rd1 fare retinasının tam uzunlukta bölümünü gösterir, DAPI boyama retinanın tutarlılığını, entegrasyonunu ve gelişimini vurgular. Bu retinalar 6 gün boyunca kültürlendi. Prosedür açıklaması: Rd1 veya WT hayvanlarından elde edilen Retina ve RPE, P5'te izole edildi ve protokolde açıklandığı gibi, her 48 saat orta değişiklikle P11'e kadar kültürlendi. Kültürler P11'de %4 PFA ile sabitlendi ve kriyoseksiyon yapıldı. Bu şeklin daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın
Serumsuz ortam ve sürekli in vitro ortam, deneysel koşullar üzerinde tam kontrole sahip olmayı sağlar. Burada, bu protokolün belirli uygulamaları için iki örnek sunuyoruz.
İlk örnek, retina eksplantlarını ilaç testi veya tarama amacıyla kullanma olasılığını göstermektedir. Organotipik retina eksplant kültürleri vahşi tip (WT) ve rd1 fare modellerinden hazırlanmıştır. İkincisi retina dejenerasyonu için iyi karakterize edilmiş bir modeldir15. Rd1 fare retinasında, ONL dejenerasyonu, çubuk fotoreceptörlerde anormal derecede yüksek cGMP seviyeleri tarafından tetiklenir6,20. Aşırı cGMP, döngüsel nükleotid kapılı iyon kanallarının (CNGC' ler) ve cGMP'ye bağımlı protein kinazının (PKG) aktivitesinin artmasına neden olarak hücre ölümüne yol21. rd1 fare retinalarının cGMP'ye yapısal bir analog ile tedavisi (döngüsel nükleotid #3; Hem PKG hem de CNGC'yi hedefleyen CN003 test edildi. P5'te eksplantasyondan sonra Şekil 3A'da açıklanan tedavi paradigması takip edildi. Explant kültürleri P11'de % 4 PFA ile sabitlendi ve kriyoseksiyon için hazırlandı (Şekil 3A). Tedavi edilen, tedavi edilmeyen (NT) ve WT örneklerinden histolojik bölümlerin hücre ölümünü değerlendirmek için terminal deoksinükleotidil transferaz dUTP nick ucu etiketlemesi (TUNEL)22 yapıldı. TUNEL etiketli hücrelerin analizi, rd1 işlenmemiş örneklerin ONL'sinde yüksek oranda ölmekte olan hücreler gösterirken, CN003 50 μM23 konsantrasyonda uygulandığında rd1 fare fotoseptörlerini korudu (Şekil 3B).
Diyabetin sık görülen bir komplikasyonu diyabetik retinopatidir, hayvan modellerinde sadakatle üremesi zor olan kör edici bir hastalıktır5. İkinci örnek, tip-2 diabetes mellitus (T2DM)24'eöykünen koşullar altında retina hücre canlılığını karakterize etmek için organotipik retina eksplant kültürlerinin kullanımını vurgulamaktadır. Burada glikoliz inhibitörü 2-deoksi-glikoz (2-DG)25'in 20 mM'liğini kullandık ve P10'dan P11'e kadar 24 saat boyunca kültür ortamına uyguladık. WT retina eksplantlarının bu tür in vitro simüle diyabetik durumlara maruz tutulmasının retinanın kapsamlı nöronal hücre ölümüne yol açtığını gösteriyoruz(Şekil 3C). Bu paradigma daha sonra, örneğin dejeneratif mekanizmaları incelemek veya diyabet bağlamında retinoprotektif tedavileri test etmek için kullanılabilir.
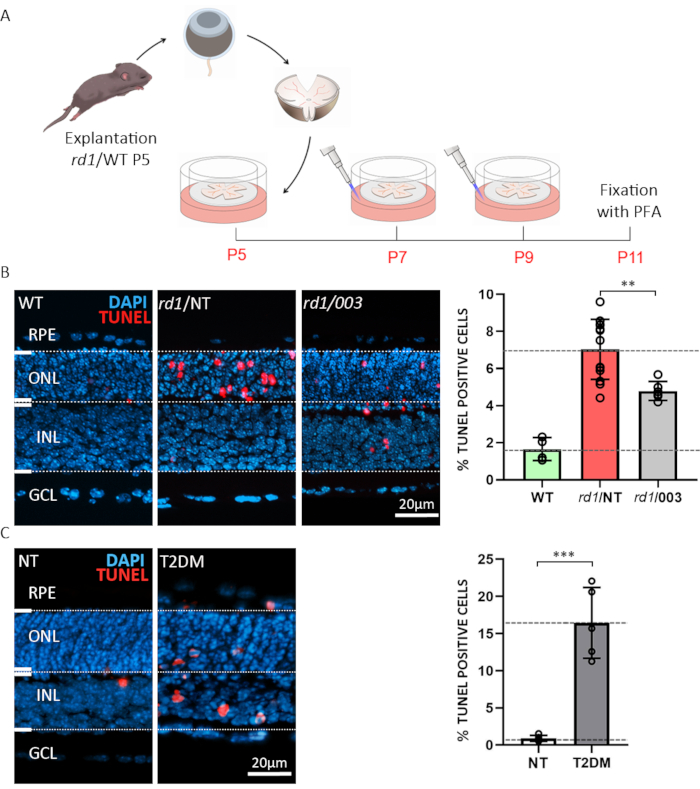
Şekil 3: Organotipik retina eksplant kültürlerinin uygulamaları için iki örnek. (A) Prosedür açıklaması: Rd1 veya WT hayvanlarından elde edilen retina ve RPE, doğum sonrası gün (P) 5'te izole edildi ve yukarıda açıklandığı gibi, her 48 saat orta değişiklikle kültürlendi. P7 ve P9'da, harcanan ortam atıldı ve plakaya 50 μM konsantrasyonda aktif bileşik içeren taze CM eklendi. Kültürler P11'de %4 PFA ile sabitlendi ve kriyoseksiyon yapıldı. (B) Rd1 retina üzerinde bileşik test. Bölümler WT, tedavi (003) ve tedavi edilmeyen (NT) organotipik retina eksplant kültürlerinden elde edildi. TUNEL tahlili (kırmızı) hücre ölümü için bir işaretleyici olarak kullanılmıştır. DAPI (mavi) ile nükleer boyama. Çubuk grafikte gösterilen niceleme, WT, rd1 NT ve rd1 003 koşulunda ölen hücrelerin yüzdelerini gösterir. Bileşik 003 ile tedavi önemli ölçüde azaltılmış rd1 fotoreceptör hücre ölümü. (C) 2-deoksi-glikoz (2-DG) tedavisi kullanılarak WT retinada tip-2 diabetes mellitus (T2DM) simülasyon. TUNEL tahlili NT ve T2DM örneklerinde yapıldı. Niceleme, hücre ölümünde oldukça önemli bir artış olduğunu gösteriyor. Bu şeklin daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın
Tablo S1. Tabloyu indirmek için lütfen tıklayınız
Tablo S2. Tabloyu indirmek için lütfen tıklayınız
Tablo S3. Tabloyu indirmek için lütfen tıklayınız
Tartışmalar
Sunulan protokol, tanımlanmış R16 ortamında, serum ve antibiyotik içermeyen, bozulmamış RPE ile fare retinasının organotipik eksplant kültürlerini açıklar. Bu protokol başlangıçta 1980'lerin sonundan başlayarak7,28 ve o zamandan beri sürekli olarakrafineedilmiştir 6,11,12. Önemli uygulamalar kalıtsal retina dejenerasyonu mekanizmalarına yönelik çalışmaları ve retinoprotektif ilaçların tanımlanmasınıiçerir 23,29,30.
Başarılı bir deney için bazı önemli hususların dikkate alınması gerekir. Kültürlerin kalitesini artırmaya yardımcı olacak bazı önemli sorun giderme noktaları aşağıda bulabilirsiniz. İlk olarak, retina kültürleri aşırı katlama ve / veya rozet oluşumu gösterebilir31. Bu, eksplantasyon işlemi sırasında retinaya bir yaban arısı ile dokunmaktan kaynaklanabilir. Ayrıca, siliary vücut, kültür sırasında retina katlamayı artırabileceğinden, eksplanttan tamamen çıkarılmalıdır. İkincisi, retinanın asılı bir damlada kuyu plakasına aktarılması sırasında, retina zarın yanlış tarafına bakılırsa, pipet ucundan sarkan damlada tutun ve retinayı çevirmek için ortamı ucun içine ve dışına (asılı damlayı ayırmadan) çok nazikçe itin. Son olarak, RPE skleraya bağlı kalırsa ve retinadan ayrılırsa, büyük olasılıkla skleranın yetersiz bir prediyajından kaynaklanır. Bu sorun özellikle yaşlı hayvanlardan veya kemirgen olmayan türlerden (örneğin domuzlar) gözlerle çalışırken önemli olabilir ve proteinaz K konsantrasyonu artırılarak çözülebilir.
Organotipik retina eksplant kültürlerinin yürütülmesi, yeterli eğitim ve deneyim gerektiren karmaşık bir prosedürdür. Eğitim eksikliği retina eksplantlarının kalitesinde değişkenliğe yol açabilir. Bu nedenlerden dolayı, canlılık ve tekrarlanabilirliği izlemek ve doğrulamak önemlidir, örneğin TUNEL test ile hücre ölüm oranını karakterize etmek. Antibiyotik içermeyen bir ortamın kullanılması, retina eksplantlarını bakteri ve mantarların kirlenmesine karşı savunmasız hale getirir. Bu riski en aza indirmek için, gerçekten aseptik koşullar altında çalışmaya özellikle özen göstermenizi öneririz. İn vitro retina kültleşmesinin bir diğer sınırlaması, in vivo retina ile karşılaştırıldığında fizyofimik ortamdaki farklılıklardır (örneğin, koroidal ve retinal kan akışı, oksijen ve glikoz seviyeleri, göz içi basıncı, vitreus bileşimi). Sürekli bir perfüzyon sistemi, belki de özel bir biyoreaktör32'ye gömülü bu modeli in vivo durumuna yaklaştırır. Ayrıca, retina diseksiyonu sırasında optik sinirin akstotomisi ganglion hücre ölümüne yol açacaktır, bu da stres yanıtlarına neden olabilir8. Bu nedenle, eksplantın belirli bir manipülasyona veya tedaviye tabi tutulmadan önce en az 2 gün boyunca kültleme koşullarına uyum sağlaması tavsiye edilir.
Açıklanan yöntem genellikle 4 hafta boyunca iyi hayatta kalabilen olgunlaşmamış retina dokuları üzerinde gerçekleştirilir in vitro7,33. Bununla birlikte, prosedür yetişkin retinanın kült haline alınması da dahil olmak üzere çeşitli uygulamalara göre uyarlanabilir. Yayınlanan farklı yaklaşımlar yetişkin retinasının RPE34,35olmadan izolasyonunu açıklasa da, diseksiyondan önce 37 ° C'de 1 saate kadar papain çözeltisi ile inkübasyon, RPE'nin yetişkin bir fareden türetildiğinde bile retinaya bağlı kalmasını sağlar36.
Serumsuz ortam ve kimyasal olarak tanımlanmış in vitro ortam, deneysel koşulların tamamen tanımlanmış ve tekrarlanabilir bir manipülasyonu sağlar. Bu nedenle, organotipik retina eksplant kültürleri oftalmoloji ve sinirbilim alanında değerli araçlardır ve retina hastalıkları37, retina gelişimi 38 ,39, retina kök hücre tedavisi40,genetik modifikasyonlar41ve farmakolojik tarama için kullanılmıştır. İlaç testlerinin özel bir örneği olarak, burada kalıtsal retina hastalığı için hayvan modellerinde fotoreceptör hücre ölümünü azalttığı bilinen bir cGMP analogu (CN003) test etmek için retina explant kültürlerini kullandık23 (Şekil 3B). Tekniğin bir başka olası uygulaması Şekil 3C'de açıklanmıştır Doku ortamının hassas kontrolünün diyabetik koşulları taklit etmek için nasıl kullanılabileceğini göstermektedir24. Doku mimarisinin tüm kültleme dönemi boyunca korunması nedeniyle organotipik retina eksplant kültürleri elektrofizyolojik çalışmalar için de uygundur. Retina eksplantları üzerindeki nöronal işlevsellik, yama kelepçesi kaydı42 ve çoklu elektrot dizisi (MEA) kaydı33,43kullanılarak incelenmiştir. İkincisi, nöronal popülasyonların elektriksel aktivitesinin aynı anda kaydedilmesine izin verir ve kültür koşullarında fotoreceptör ve ganglion hücre işlevselliğini karakterize etmek için yararlanılmıştır. Daha geniş bir perspektifte, organotipik eksplant kültür sistemleri, hipotermi44'ünterapötik etkinliğini test etmek için eksplant kültürlerinin kullanıldığı klinik öncesi araştırmalarda da uygulanabilir.
Organotipik eksplant kültleme tekniğinin gerçekleştirilmesi nispeten basittir ve ilgili in vivo deneylerle karşılaştırıldığında, daha az pahalı ve zaman alıcıdır ve canlı hayvan çalışmaları ile ilgili etik kaygılardan kaçınır. Deneysel koşullar üzerindeki hassas kontrol ve RPE ve doku karmaşıklığının korunması, yöntemi retina fizyolojisi ve patofizyolojisi hakkındaki bilgimizi geliştirmek ve çok sayıda deneysel uygulamaya olanak sağlamak için değerli bir araç haline getirmektedir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu araştırma çalışması Avrupa Birliği'nden mali destek aldı (transMed; H2020-MSCA-765441), Alman araştırma konseyi (DFG; PA1751/8-1, 10-1) ve Çin burs konseyi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Biotin | Sigma | B4639 | |
| (+/-)-α-LipoicAcid (=Thiotic acid) | Sigma | T1395 | |
| BSA | Sigma | B4639 | |
| CDP-Choline-Na | Sigma | 30290 | |
| Corticosterone | Sigma | C2505 | |
| CuSO4 × 5H2O | Sigma | C8027 | |
| DL-Tocopherol | Sigma | T1539 | |
| Ethanolamine | Sigma | E0135 | |
| FCS | Sigma | F7524 | |
| Filtropur BT100, 1L, 0.2µm | SARSTEDT | 83.3942.101 | for Basal Medium |
| Forceps | F.S.T | 15003-08 | |
| Glutamine | Sigma | G8540 | |
| Glutathione | Sigma | G6013 | |
| Insulin | Sigma | I6634 | |
| L-CysteineHCl | Sigma | C7477 | |
| Linoleic Acid | Sigma | L1012 | |
| Linolenic Acid | Sigma | L2376 | |
| MnCl2 x 4H2O | Sigma | M5005 | |
| Na-pyruvate | Sigma | P3662 | |
| NaSeO3 x 5H2O | Sigma | S5261 | |
| Ophthalmic microscope scaping spoon | F.S.T. | 10360-13 | |
| Progesteron | Sigma | P8783 | |
| Proteinase K | MP Biomedicals | 21935025 | 44 mAnson U/mg |
| R16 | Gibco | 07491252A | |
| Retinol | Sigma | R7632 | |
| Retinyl acetate | Sigma | R7882 | |
| Scissors | F.S.T | 15004-08 | |
| Sterile filter 0.22µm | MILLEX GP | SLGP033RS | for supplements |
| T3 | Sigma | T6397 | |
| Tocopherylacetate | Sigma | T1157 | |
| Transferrin | Sigma | T1283 | |
| Transwell permeable supports | Corning | 3412 | |
| Vitamin B1 | Sigma | T1270 | |
| Vitamin B12 | Sigma | V6629 | |
| Vitamin C | Sigma | A4034 |
Referanslar
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
- Llonch, S., Carido, M., Ader, M. Organoid technology for retinal repair. Developmental Biology. 433 (2), 132-143 (2018).
- Mencl, S., Trifunović, D., Zrenner, E., Paquet-Durand, F. PKG-dependent cell death in 661W cone photoreceptor-like cell cultures (experimental study). Advances in Experimental Medicine and Biology. 1074, 511-517 (2018).
- Sanges, D., Comitato, A., Tammaro, R., Marigo, V. Apoptosis in retinal degeneration involves cross-talk between apoptosis-inducing factor (AIF) and caspase-12 and is blocked by calpain inhibitors. Proceedings of the National Academy of Sciences of the United States of America. 103 (46), 17366-17371 (2006).
- Schnichels, S., et al. Retina in a dish: cell cultures, retinal explants and animal models for common diseases of the retina. Progress in Retinal and Eye Research. , 100880 (2020).
- Paquet-Durand, F., Hauck, S. M., van Veen, T., Ueffing, M., Ekström, P. PKG activity causes photoreceptor cell death in two retinitis pigmentosa models. Journal of Neurochemistry. 108 (3), 796-810 (2009).
- Caffe, A. R., Visser, H., Jansen, H. G., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical and Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Arango-Gonzalez, B., et al. In vivo and in vitro development of S- and M-cones in rat retina. Investigative Ophthalmology and Visual Science. 51 (10), 5320-5327 (2010).
- Strauss, O. The retinal pigment epithelium in visual function. Physiological Reviews. 85 (3), 845-881 (2005).
- Söderpalm, A., Szél, A., Caffé, A. R., van Veen, T. Selective development of one cone photoreceptor type in retinal organ culture. Investigative Ophthalmology and Visual Science. 35 (11), 3910-3921 (1994).
- Caffe, A. R., et al. Mouse retina explants after long-term culture in serum free medium. Journal of Chemical Neuroanatomy. 22 (4), 263-273 (2001).
- Caffe, A. R., Soderpalm, A. K., Holmqvist, I., van Veen, T. A combination of CNTF and BDNF rescues rd photoreceptors but changes rod differentiation in the presence of RPE in retinal explants. Investigative Ophthalmology and Visual Science. 42 (1), 275-282 (2001).
- Ogilvie, J. M., Speck, J. D., Lett, J. M., Fleming, T. T. A reliable method for organ culture of neonatal mouse retina with long-term survival. Journal of Neuroscience Methods. 87 (1), 57-65 (1999).
- Keeler, C. E. The inheritance of a retinal abnormality in white mice. Proceedings of the National Academy of Sciences of the United States of America. 10 (7), 329-333 (1924).
- Romijn, H. J. Development and advantages of serum-free, chemically defined nutrient media for culturing of nerve tissue. Biology of the Cell. 63 (3), 263-268 (1988).
- Caffe, A. R., et al. Mouse retina explants after long-term culture in serum free medium. Journal of Chemical Neuroanatomy. 22 (4), 263-273 (2001).
- Alarautalahti, V., et al. Viability of Mouse Retinal Explant Cultures Assessed by Preservation of Functionality and Morphology. Investigative Ophthalmology and Visual Science. 60 (6), 1914-1927 (2019).
- Caffe, A. R., Visser, H., Jansen, H. G., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Farber, D. B., Lolley, R. N. Cyclic guanosine monophosphate: elevation in degenerating photoreceptor cells of the C3H mouse retina. Science. 186 (4162), 449-451 (1974).
- Arango-Gonzalez, B., et al. Identification of a common non-apoptotic cell death mechanism in hereditary retinal degeneration. PloS One. 9 (11), 112142 (2014).
- Loo, D. T. In situ detection of apoptosis by the TUNEL assay: an overview of techniques. Methods in Molecular Biology. 682, 3-13 (2011).
- Vighi, E., et al. Combination of cGMP analogue and drug delivery system provides functional protection in hereditary retinal degeneration. Proceedings of the National Academy of Sciences of the United States of America. 115 (13), 2997-3006 (2018).
- Valdés, J., et al. Organotypic retinal explant cultures as in vitro alternative for diabetic retinopathy studies. Altex. 33 (4), 459-464 (2016).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: from diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), (2019).
- Slepak, V. Z., Hurley, J. B. Mechanism of light-induced translocation of arrestin and transducin in photoreceptors: interaction-restricted diffusion. IUBMB Life. 60 (1), 2-9 (2008).
- Paquet-Durand, F., et al. A retinal model of cerebral malaria. Scientific Reports. 9 (1), 3470 (2019).
- Romijn, H. J., de Jong, B. M., Ruijter, J. M. A procedure for culturing rat neocortex explants in a serum-free nutrient medium. Journal of Neuroscience Methods. 23 (1), 75-83 (1988).
- Azadi, S., et al. CNTF+BDNF treatment and neuroprotective pathways in the rd1 mouse retina. Brain Research. 1129 (1), 116-129 (2007).
- Kaur, J., et al. Calpain and PARP activation during photoreceptor cell death in P23H and S334ter rhodopsin mutant rats. PloS One. 6 (7), 22181 (2011).
- Samardzija, M., et al. A mouse model for studying cone photoreceptor pathologies. Investigative Ophthalmology and Visual Science. 55 (8), 5304-5313 (2014).
- Achberger, K., et al. Merging organoid and organ-on-a-chip technology to generate complex multi-layer tissue models in a human retina-on-a-chip platform. eLife. 8, (2019).
- Alarautalahti, V., et al. Viability of Mouse Retinal Explant Cultures Assessed by Preservation of Functionality and Morphology. Investigative Ophthalmology and Visual Science. 60 (6), 1914-1927 (2019).
- Ferrer-Martín, R. M., et al. Microglial cells in organotypic cultures of developing and adult mouse retina and their relationship with cell death. Experimental Eye Research. 121, 42-57 (2014).
- Müller, B. Organotypic culture of adult mouse retina. Methods in Molecular Biology. 1940, 181-191 (2019).
- Heller, J. P., Kwok, J. C., Vecino, E., Martin, K. R., Fawcett, J. W. A method for the isolation and culture of adult rat Retinal Pigment Epithelial (RPE) cells to study retinal diseases. Frontiers in Cellular Neuroscience. 9, 449 (2015).
- Sahaboglu, A., et al. Retinitis pigmentosa: rapid neurodegeneration is governed by slow cell death mechanisms. Cell Death & Disease. 4 (2), 488 (2013).
- Arai, E., et al. Ablation of Kcnj10 expression in retinal explants revealed pivotal roles for Kcnj10 in the proliferation and development of Müller glia. Molecular Vision. 21, 148-159 (2015).
- Demas, J., Eglen, S. J., Wong, R. O. Developmental loss of synchronous spontaneous activity in the mouse retina is independent of visual experience. Journal of Neuroscience. 23 (7), 2851-2860 (2003).
- Johnson, T. V., Martin, K. R. Development and characterization of an adult retinal explant organotypic tissue culture system as an in vitro intraocular stem cell transplantation model. Investigative Ophthalmology and Visual Science. 49 (8), 3503-3512 (2008).
- Hatakeyama, J., Kageyama, R. Retrovirus-mediated gene transfer to retinal explants. Methods. 28 (4), 387-395 (2002).
- Moritoh, S., Tanaka, K. F., Jouhou, H., Ikenaka, K., Koizumi, A. organotypic tissue culture of adult rodent retina followed by particle-mediated acute gene transfer in vitro. PloS One. 5 (9), 12917 (2010).
- Reinhard, K., et al. Step-by-step instructions for retina recordings with perforated multi electrode arrays. PloS One. 9 (8), 106148 (2014).
- Klemm, P., et al. Hypothermia protects retinal ganglion cells against hypoxia-induced cell death in a retina organ culture model. Clinical and Experimental Ophthalmology. 47 (8), 1043-1054 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır