Method Article
無条件網膜色素上皮を用いた、オルガマウス網膜の長期無血清栽培
要約
プロトコルは、マウス 神経網膜のorganotypic型外植体を記述し、その網膜色素上皮(RPE)と共に栽培され、R16で、血清および抗生物質を含まない。この方法は、 インビボ 実験と比較すると比較的簡単に実行でき、安価で時間がかかり、多数の実験アプリケーションに適応することができます。
要約
眼科研究では、神経レチンの インビトロ モデルが強く必要とされています。ここでは、網膜色素上皮(RPE)を用いたマウス 神経網膜のオルガノイド培養のための詳細なプロトコルを提示する。研究の質問に応じて、網膜は、例えば糖尿病性網膜症または遺伝性網膜変性を研究するために、野生型動物または疾患モデルから分離することができる。出生後2~9日の目は無菌状態で摘出される。これらは、RPEからの脈絡膜の剥離を可能にするためにプロテナーゼKで部分的に消化される。ステレオスコープの下で、小さな切開が角膜で作られ、そこから脈絡膜と皮膜をRPEと神経切開から穏やかに剥がすことができる2つの縁を作ります。その後、レンズを取り外し、目のコップを4点にカットしてクローバーの葉に似た4つのくさび状の形状を与えます。組織は最終的に、ポリカーボネート培養膜を保持する細胞培養インサートに吊り下げ液中に移される。培養物は、血清または抗生物質を含まないR16培地で、完全に定義された条件下で、2日ごとに培地変化を伴って維持される。
記載された手順は、少なくとも2週間の培養期間のための、その正常な生理学的およびヒストタイヒスの文脈の分離および保存を可能にする。これらの特徴は、動物性の排泄物培養物を、高い予測値を持つ優れたモデルにし、疾患の発生、および電気生理学の研究を行うとともに、薬理学的スクリーニングを可能にする。
概要
眼科研究では、原発性レチナル細胞培養、レチナ由来細胞株、レチナルオルガノイド、生体内動物モデル1、2、3、4、5など、さまざまなモデルがレチナを研究できる。ただし、これらのモデルは、それぞれ欠点に苦しんでいます。例えば、細胞は孤立して成長し、retinaは多数の細胞間相互作用を持つ複雑なネットワークです。したがって、単離された細胞培養物の挙動は、組織全体で観察されたものと比較して人工的である可能性が高い。この問題は、開発と基礎生物学6を研究するために使用することができるin vitro分化されたレチナルオルガノイドを使用して部分的に改善することができます。しかし、現在のところ、レチナルオルガノイドの生成は依然として時間がかかり、労働集約的であり、再現性の問題に苦しんでおり、オルガノイドを翻訳のretinal研究に使用するには、実質的なさらなる開発作業が必要です。最後に、生きている動物に関する研究は、間違いなく眼科研究の要件に最も近いモデルであるが、強い倫理的懸念に関連している。細胞培養系の効率と生体内動物モデルの現実の状況との間の良い妥協点は、妄分性の植物培養である。このような培養はまた、生体内介入が行われないため動物の苦しみを軽減する。
異種5、7、8から植物の植物を培養するためのいくつかの方法が説明されている。我々のプロトコルは、マウス神経網膜を網膜色素上皮(RPE)と共に単離するための技術を記述する。この技術はラットのレチナル培養9にも適している。そのRPEと一緒に神経レティナの培養は、成功のために重要です.RPEは、栄養分の輸送、イオン、水、光酸化に対する光と保護の吸収、視覚サイクルに不可欠な11-シス-レチナルへの全トランスレチナルの再異性化、脱皮光受容体膜のファゴサイトーシス、およびreina1の構造完全性に不可欠な因子の分泌という、レチナに不可欠な機能を果たします。RPEを維持することで、感光体の外側および内側のセグメントの開発が成功し、より長い時間のために生存可能なレチナを維持する11.以下に説明する手順は、少なくとも2週間12の間、その経時および、その残りの部分の特徴を維持する。また、無血清の無抗生物質性の培地での組織性の筋性外植体の培養は、未知の物質の存在を回避し、結果12の簡単な解釈を可能にする。
アウガロツのレティナル外植文化は、7、13、14のレチンの発達と変性に関する知識を向上させるために不可欠です。ここでは、薬理学的スクリーニングにも有用なツールであり、糖尿病性網膜症を含む様々な網膜疾患をモデル化するために使用できることを示しています。
プロトコル
動物保護のドイツの法律の§4に準拠した動物プロトコルは、動物保護に関するテュービンゲン大学委員会によって審査され、承認されました (アインリヒトゥン・フュル・ティアシュッツ, ティエルツリヒェン・ディエンスト・ウント・Labortierkunde;登録なしAK02/19M)。本研究では、野生型(WT)およびrd1マウスからレティナが得られ、後者は遺伝性のレチン性変性15に対して十分に特徴付けられるモデルである。マウスは標準的な白色の環状照明の下に収容され、食料と水への自由なアクセスを持ち、性別に関係なく使用された。
1. チェックリスト
- 滅菌状態を確保し、汚染を避けるために、70%エタノールで薄層空気流フードをきれいに、消毒します。必ず、エタノールを完全に蒸発させ、レチン培養物の中毒を防ぎます。
- 使用前のオートクレーブツール(例えば、はさみ、鉗子、眼科顕微鏡の掻き取りスプーン)
- 積層流れフードの下で事前に次の培地を準備し、無菌条件下で:基底R16培地(BM)(4°Cで4週間保存可能)、BM20%胎児子牛血清(FCS)(同日使用)、BM 0. 12%プロテイナーゼK(44 mAnson U/mg)溶液(同じ日の使用)および完全なR16培地(同じ日の使用)とサプリメント(CM)が記載されているようにRomijn16(3週間4°Cで保存することができます)(表S1、表S1、サプリメントを使用して S2、およびS3)。
- プロテナーゼK溶液を37°Cで予熱して活性化し、ステップ2.5で使用します。
2. 準備
- 出生後の日(P)5で切断によって rd1/WT動物を犠牲にする。P11より古い動物の場合は、地域の動物保護規則に従ってCO2 および/または子宮頸部脱臼を使用してください。
- 動物の年齢に応じて、必要に応じて、核分裂の前に、鉗子を使用して眼瞼を開き、下の目に触れたり引っ掻いたりすることなく、非常に慎重に眼瞼を分離する。
- 曲面鉗子を使用して、ステレオスコープの下で目を素早く核状にする。
- 目をBMで室温(RT)で5分間インキュベートします。
- 予熱されたBMで目をインキュベートし、0.12%のプロテイナーゼKを37°Cで15分間インキュベートします。
- 滅菌状態を確実にするために、ラミナーエアフローフードの内部で次の手順を実行します。プロテナーゼKを不活性化するには、20%FCSを含むBMに目を移し、RTで5分間インキュベートする。
- RTで新鮮なBMを含むペトリ皿の中で、無菌のステレオスコープの下で目を解剖します。この時間が長いほど、眼を解剖するのが難しくなり、目は非常に柔らかくなります。
- 鉗子で、視神経から目を保持します。細かいはさみを使用して角膜に小さな切開を行い、角膜、脈絡膜、強膜を2組の細かい鉗子で緩やかに剥がすことができる2つの縁から作ります(図1 ステップA-C)。あるいは、狭軌カニューレを使用して角膜に最初の切開を行い、その後、はさみブレードの1つを開口部に挿入します。
- 細かい鉗子でレンズをつかみます。最初の鉗子が2番目の鉗子の間にあるように最初の鉗子に垂直に第2の鉗子のペアを置く。引っ張ってアイカップからレンズを抽出します。もし、生膜と毛様体が引き続き残っている場合は、慎重に取り除いてください(図1 ステップD)。
注:手順2.7.1と2.7.2は練習をする必要があり、必ず、レティナを損傷しないように注意してください。 - 4 つの点で、そのエッジに垂直なレティナをカットし、四つ葉のクローバー形状を作成します(図 1 ステップ E–F)。
- 1 mL先端の広く切断されたベースのピペットを使用して、レチナを培地の吊り下げドロップに保持し、6ウェル培養プレートに入れた培養皿フィルターインサートに移します。RPE層は膜に向き合う必要があります(図1 ステップG)。
- ピペットを使用して、慎重に挿入から余分な媒体を除去します。
- ウェルの側面から、ウェルあたりCMの1 mLを加え、5%CO2で37°Cの無菌インキュベーターでインキュベートする。これは酸素を減らし、組織の変性を引き起こすので、媒体にレティナを沈めないでください。外植は、水の表面張力によって作られた液体の薄膜によってのみ覆われた液体と空気の間の界面に留まるべきである。
- 排泄手順後の回復を容易にするために、最初の48時間は、レチン性外植を邪魔しないでください。
- 2日ごとに培地を変更します(48時間)。各ウェルから700 μLの培地を捨て、900 μLの新鮮なCMをウェルに加えます。このようにして、蒸発によって失われた培地の量が回収され、残りの外植は、前の48時間で産生される神経保護因子の一部を維持する。
- 除去された培地を分離した閉じたマイクロ遠心分離チューブに培養液と共にインキュベートし、汚染の可能性を評価(すなわち、培地の色の変化)を制御および評価する。
注:レティナルの外植は、少なくとも2週間12のために文化に保つことができます。
3. 培養後
注:エクスプラントは、異なる実験アプリケーション(ウェスタンブロット、神学、全体のマウント、遺伝子解析、電気生理学)に使用することができます。アプリケーションに応じて、オルガノミカルな外植物は、凍結、凍結、または凍結切断のために調製スナップすることができます。以下の手順は、組織学的準備について説明します。
- 4%パラホルムアルデヒド(PFA)で45分間の固定を行い、続いて徐々にショ糖凍結保護(10分間10%スクロース、20分間20%、室温(RT)または4°Cで2時間(ON)で30%を行います。これらのバッファーをウェルに直接追加します。
- 植物の外植の周りの膜を切る。
- 凍結組織用の培地に膜とレチン組織の両方を埋め込みます。
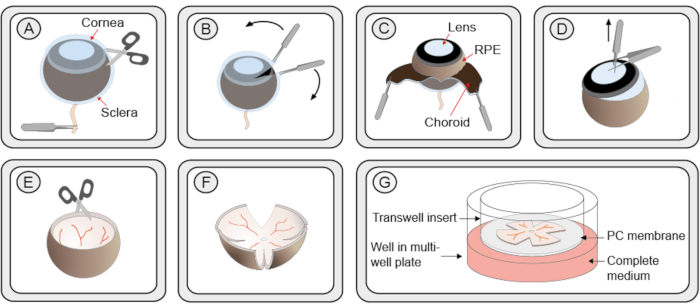
図1:組織性のレチン系外植培養物の調製のためのステップバイステップの手順(A)マウスの目は、ヌクレオチドKの溶液に移され、クリテラと脈絡膜を、レチナとRPEから分離することを可能にする。・クリンラ/コロイド層に小さな切り傷が導入される。(B)強膜/脈絡膜層の剥離には2つの鉗子が使用される。(C)黒い脈絡膜層は剥離の間に見ることができる。下線暗い網膜色素上皮(RPE)は眼球に付着したままである。その後、眼神経と共に、鎖骨と脈絡膜が除去される。(D) レンズとガラス膜は鉗子で抽出される。 残りの毛様体は除去される。(E)レティナはボウル状を保持する。(F)皿で培養するためにレティナを平らにするために、4カットは、そのクローバーのような形状を与え、はさみで作られ、retinaの周りに等しい距離に作られています。このレチナ培養液は、切り取られた1mLピペットチップを用いて、6ウェルプレート内の膜培養インサートに移される。レティナはまだボウルの形の一部を保持しています。しかし、余分な液体を取り巻くレティナを取り除くと、平面構造に展開します。(G)培養膜のセットアップにおいて、レチナ培養は完全なR16培地の溶液の上に多孔質ポリカーボネート(PC)膜上に置かれている。生存率を確保するために、培養物は37°Cの加湿された無菌インキュベーターに5%CO2で保管する必要があり、培地は48時間ごとに交換する必要があります。
結果
プロトコルに従った後、解剖および培養されたレチン状の外植体は、RPEから神経節細胞層(GCL)まで、異なる層を有する正常組織アーキテクチャを保存する。外核層(ONL)と内核層(INL)の大きさは2~3週間ほとんど安定しており、培養期間が4週間以上延長されると、細胞損失が徐々に進行し、徐々に薄くなっていった。GCLでは、対照的に、視神経の奇抜さのために、通常、培養の最初の4日以内に顕著な間引きが観察される。その後、GCLの残りの細胞集団(主に変位したアマクリン細胞)は、さらに3-4週間17、18、19のために生存可能であり続ける。
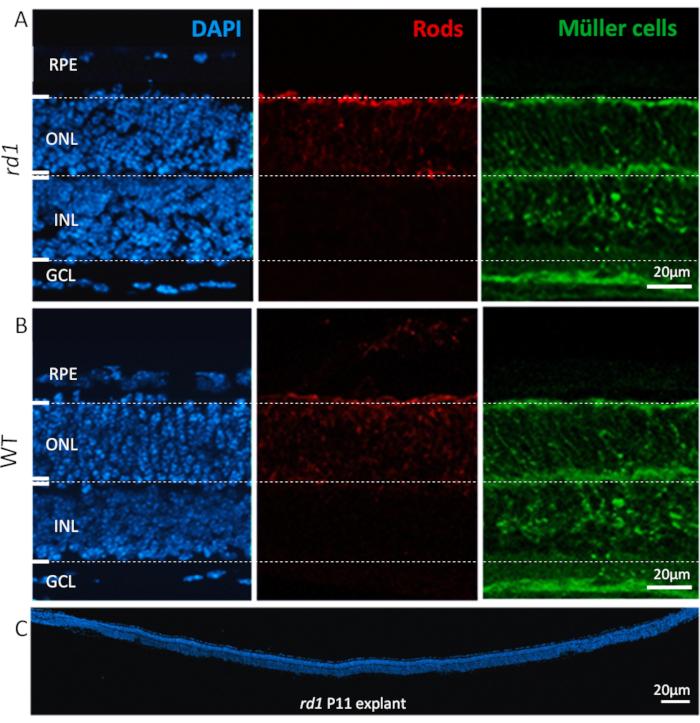
図2:レチン性外植培養で見られる細胞型rd1変異体(A)およびWT動物(B)に由来するP11のレチナル外植培養(B)は、DAPI(左、青)、ロッド感光体(中央、赤)およびミュラー細胞(右、緑)を用いた核染色を示す。核染色は、網膜色素上皮(RPE)、外核層(ONL)、内核層(INL)、神経節細胞層(GCL)など、網膜の主要な細胞層をすべて強調している。核層中の特定の細胞タイプは、棒およびミュラー細胞など、それぞれαアレスタ26およびグルタミン合成酵素27抗体で免疫標識される。(C) rd1 マウスの全部分を示し 、DAPI 染色で、retina の一貫性、統合、および開発を強調します。これらのレチンは6日間培養した。手順説明:rd1またはWT動物由来のレティナおよびRPEをP5で単離し、プロトコルに記載されているように培養し、P11までは48時間毎に培地変化を行う。培養物はP11で4%PFAで固定し、凍結切断した。この図の大きなバージョンを表示するには、ここをクリックしてください
無血清培地および持続型 インビトロ 環境は、実験条件を完全に制御することを可能にする。ここでは、このプロトコルの特定のアプリケーションの例を2つ提供します。
最初の例は、薬物検査またはスクリーニング目的でレチン性外植を使用する可能性を示す。野生型のレチンス外植培養物を野生型(WT)およびrd1マウスモデルから調製した。後者は、15のレチン性変性のためのよく特徴付けられるモデルである。rd1マウスのretinaでは、ONL変性は、ロッド感光体6,20におけるcGMPの異常に高いレベルによって引き起こされる。過剰なcGMPは、環状ヌクレオチドゲートイオンチャネル(CNGCs)およびcGMP依存性プロテインキナーゼ(PKG)の活性の増加を引き起こし、細胞死21を招く。cGMPに対する構造類似体を用いてrd1マウスのレチナの治療(環状ヌクレオチド#3;CN003)はPKGとCNGCの両方を対象とし、試験を行った。P5での排泄後、図3Aに記載の治療パラダイムを追った。外植培養物はP11で4%PFAで固定され、凍結切断のために調製された(図3A)。処理された非治療(NT)、およびWT検体からの組織学的切片の細胞死を評価するために、末端デオキシヌクレオチジルトランスファーーゼdUTPニックエンドラベリング(TUNEL)アッセイ22を行った。TUNEL標識細胞の分析は、rd1未処理の標本のONL中の死細胞の割合が高いことを示し、CN003は50μM23の濃度で適用された場合のrd1マウス感光体を保護した(図3B)。
糖尿病の合併症が頻繁に起こるのは糖尿病性網膜症であり、動物モデル5では忠実に再現することが困難な盲検疾患である。2番目の例は、2型糖尿病(T2DM)24をエミュレートする条件下でのレチン細胞生存率を特徴付けるために、組織語性のレチン性外植培養物の使用を強調している。ここで、2-デオキシグルコース(2-DG)25の解糖抑制剤20mMを用い、P10からP11まで24時間培養培地に投与した。我々は、このようなインビトロでシミュレートされた糖尿病状態にWTレチンの外植物を施すことを示す(図3C)。このパラダイムは、例えば、変性メカニズムを研究したり、糖尿病の文脈でレチノ保護治療をテストするために使用することができます。
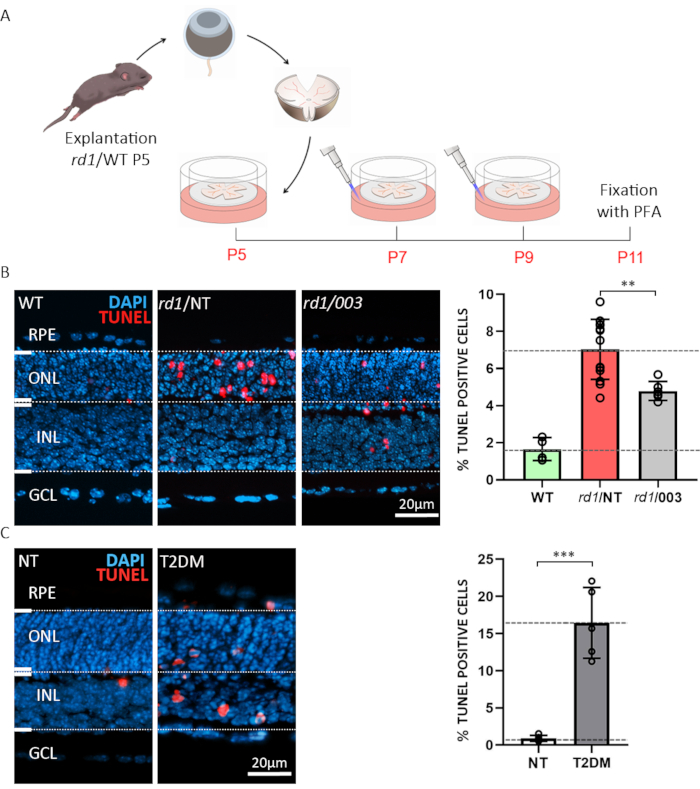
図3:organotypicretinal外植物培養物の適用のための2つの例。(A)手順の説明:rd1またはWT動物由来のレチナおよびRPEを出生後(P)5で単離し、上記のように培養し、48時間ごとに培地変化を伴う。P7およびP9では、使用済み培地を廃棄し、50μMの濃度で活性化合物を含む新鮮なCMをプレートに添加した。培養物はP11で4%PFAで固定し、凍結切断した。(B) rd1の retina での複合テスト。切片はWTから得られ、(003)、非処理(NT)の外植培養物を非治療した。TUNELアッセイ(赤)を細胞死のマーカーとして使用した。DAPI(青)での核染色。棒グラフに示す定量は、WT、rd1 NT、およびrd1 003条件における死細胞の割合を示す。化合物003による治療は、rd1感光体細胞死を有意に減少させた。(C) 2-デオキシグルコース(2-DG)治療を用いたWTレチナにおける2型糖尿病(T2DM)のシミュレーションNTおよびT2DM検体に対してTUNELアッセイを行った。定量化は、細胞死の著しい増加を示す。この図の大きなバージョンを表示するには、ここをクリックしてください
表 S1. テーブルをダウンロードするには、ここをクリックしてください
ディスカッション
提示されるプロトコルは、血清および抗生物質を含まない定義されたR16培地におけるインタクトRPEを有するマウスレティナのorganotypic外植培養を記述する。このプロトコルは、もともと1980年代後半7、28に始まって開発され、それ以来、6、11、12を継続的に改良されています。顕著な応用は遺伝性のレチン性変性のメカニズムおよび、23、29、30のレティノ保護薬の同定に関する研究を含む。
実験を成功させるには、いくつかの重要な考慮事項を考慮する必要があります。ここでは、文化の質を高めるために重要なトラブルシューティングポイントをいくつか紹介します。第1に、このレチンカルカルチャは、過度の折り畳みやロゼット形成31を示し得る。これは、排泄手順中に鉗子でレチナに触れることによって引き起こされる可能性があります。さらに、毛様体は、培養中のレチナルフォールディングを増加させることができるので、外植から完全に除去されなければならない。第二に、吊り下げドロップで網膜をウェルプレートに移す際に、網膜が膜を間違った側に向けた場合は、ピペット先端から垂れ下がったドロップに保管し、先端の中と外にメディアを非常に穏やかに押し出して網膜を反転させます。最後に、RPEがスクレラに付着したまま網膜から剥離する場合、それは、最も可能性の低い、スクレラの前消化不良によって引き起こされる。この問題は、古い動物や非げっ歯類の種(例えば、ブタ)からの目で作業する場合に特に重要であり、タンパク質分解物K濃度を高めることによって解決され得る。
組織語性のレティナル外植培養を行うことは、十分な訓練と経験を必要とする複雑な手順です。トレーニングの欠如は、植物の外植の質の変動につながることができます。これらの理由から、TUNELアッセイによる細胞死率などを特徴付け、生存率と再現性を監視および検証することが重要です。抗生物質を含まない培地を使用すると、細菌や真菌による汚染に対して、排泄物が脆弱になります。このリスクを最小限に抑えるために、真無菌状態での作業には、特に注意を払うことをお勧めします。 インビトロの再培養のもう一つの制限は、 生体内 のレチナ(例えば、脈絡膜および陰部血源の供給、酸素およびグルコースレベル、眼内圧、膜子膜の組成)と比較した場合の生理化学的環境の違いである。連続的な灌流システムは、おそらく専用のバイオリアクター32に埋め込まれた、このモデルを in vivo 状態に近づけることができる。さらに、眼神経の奇抜性は、神経節細胞死を引き起こし、ストレス応答を誘導する可能性がある8.したがって、外植物は、特定の操作または治療を受ける前に、少なくとも2日間 の培養 条件に適応するために残すことを推奨する。
記載された方法は、通常、インビトロ7、33で4週間生存する可能性のある未熟なレチン組織に対して行われる。しかし、この手順は、成人のレティナの培養を含む様々な用途に合わせて調整可能である。異なる公表されたアプローチは、そのRPE34、35を伴う成人のレチナの分離を記述するが、解剖前に37°Cで最大1時間のパパイン溶液を用いたインキュベーションは、RPEが成人マウス36から誘導された場合でも、レチナに付着したままにすることを可能にする。
無血清培地および化学的に定義されたin vitro環境は、実験条件の完全に定義された再現可能な操作を提供します。そのため、外発性組織は眼科・神経科学の分野で有用なツールであり、眼科や神経科学の分野において有用なツールであり、37、レティナ発育38、39、レチン幹細胞療法40、遺伝子組換え41、および薬理学的スクリーニングの研究に用いられてきた。薬物検査の具体例として、ここでは、遺伝性の疾患に対する動物モデルにおける感光体細胞死を低減することが知られているcGMP類似体(CN003)を試験するために、レチナル外植培養物を用いた(図3B)。この技術のもう一つの可能な応用は図3Cに記載されており、これは、組織環境の正確な制御を利用して糖尿病状態24をエミュレートする方法を示している。培養期間全体にわたって組織アーキテクチャを保存するため、組織性の筋外植物培養は電気生理学的研究にも適しています。レチン状外植体の神経機能は、パッチクランプ記録42および多電極アレイ(MEA)記録33,43を用いて調べられている。後者は、同時に神経集団の電気活動の記録を可能にし、培養条件での光受容体および神経節細胞の機能を特徴付けるために利用されている。より広い視野では、組織語外植培養システムは、低体温症44の治療効果を試験するために外植培養物を使用した前臨床研究にも適用することができる。
organotypicexの培養技術は比較的簡単に行い、それに対応する in vivo 実験と比較すると、より安価で時間がかかり、生きた動物研究に関連する倫理的な懸念を回避します。実験条件の正確な制御とRPEと組織の複雑さの保存は、この方法を網膜生理学と病理生理学に関する知識を向上させ、数多くの実験アプリケーションを可能にする貴重なツールとなっています。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、欧州連合(EU)から財政的支援を受けました (トランスMed;H2020-MSCA-765441、ドイツ研究評議会(DFG;PA1751/8-1、10-1)と中国奨学金評議会。
資料
| Name | Company | Catalog Number | Comments |
| Biotin | Sigma | B4639 | |
| (+/-)-α-LipoicAcid (=Thiotic acid) | Sigma | T1395 | |
| BSA | Sigma | B4639 | |
| CDP-Choline-Na | Sigma | 30290 | |
| Corticosterone | Sigma | C2505 | |
| CuSO4 × 5H2O | Sigma | C8027 | |
| DL-Tocopherol | Sigma | T1539 | |
| Ethanolamine | Sigma | E0135 | |
| FCS | Sigma | F7524 | |
| Filtropur BT100, 1L, 0.2µm | SARSTEDT | 83.3942.101 | for Basal Medium |
| Forceps | F.S.T | 15003-08 | |
| Glutamine | Sigma | G8540 | |
| Glutathione | Sigma | G6013 | |
| Insulin | Sigma | I6634 | |
| L-CysteineHCl | Sigma | C7477 | |
| Linoleic Acid | Sigma | L1012 | |
| Linolenic Acid | Sigma | L2376 | |
| MnCl2 x 4H2O | Sigma | M5005 | |
| Na-pyruvate | Sigma | P3662 | |
| NaSeO3 x 5H2O | Sigma | S5261 | |
| Ophthalmic microscope scaping spoon | F.S.T. | 10360-13 | |
| Progesteron | Sigma | P8783 | |
| Proteinase K | MP Biomedicals | 21935025 | 44 mAnson U/mg |
| R16 | Gibco | 07491252A | |
| Retinol | Sigma | R7632 | |
| Retinyl acetate | Sigma | R7882 | |
| Scissors | F.S.T | 15004-08 | |
| Sterile filter 0.22µm | MILLEX GP | SLGP033RS | for supplements |
| T3 | Sigma | T6397 | |
| Tocopherylacetate | Sigma | T1157 | |
| Transferrin | Sigma | T1283 | |
| Transwell permeable supports | Corning | 3412 | |
| Vitamin B1 | Sigma | T1270 | |
| Vitamin B12 | Sigma | V6629 | |
| Vitamin C | Sigma | A4034 |
参考文献
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
- Llonch, S., Carido, M., Ader, M. Organoid technology for retinal repair. Developmental Biology. 433 (2), 132-143 (2018).
- Mencl, S., Trifunović, D., Zrenner, E., Paquet-Durand, F. PKG-dependent cell death in 661W cone photoreceptor-like cell cultures (experimental study). Advances in Experimental Medicine and Biology. 1074, 511-517 (2018).
- Sanges, D., Comitato, A., Tammaro, R., Marigo, V. Apoptosis in retinal degeneration involves cross-talk between apoptosis-inducing factor (AIF) and caspase-12 and is blocked by calpain inhibitors. Proceedings of the National Academy of Sciences of the United States of America. 103 (46), 17366-17371 (2006).
- Schnichels, S., et al. Retina in a dish: cell cultures, retinal explants and animal models for common diseases of the retina. Progress in Retinal and Eye Research. , 100880 (2020).
- Paquet-Durand, F., Hauck, S. M., van Veen, T., Ueffing, M., Ekström, P. PKG activity causes photoreceptor cell death in two retinitis pigmentosa models. Journal of Neurochemistry. 108 (3), 796-810 (2009).
- Caffe, A. R., Visser, H., Jansen, H. G., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical and Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Arango-Gonzalez, B., et al. In vivo and in vitro development of S- and M-cones in rat retina. Investigative Ophthalmology and Visual Science. 51 (10), 5320-5327 (2010).
- Strauss, O. The retinal pigment epithelium in visual function. Physiological Reviews. 85 (3), 845-881 (2005).
- Söderpalm, A., Szél, A., Caffé, A. R., van Veen, T. Selective development of one cone photoreceptor type in retinal organ culture. Investigative Ophthalmology and Visual Science. 35 (11), 3910-3921 (1994).
- Caffe, A. R., et al. Mouse retina explants after long-term culture in serum free medium. Journal of Chemical Neuroanatomy. 22 (4), 263-273 (2001).
- Caffe, A. R., Soderpalm, A. K., Holmqvist, I., van Veen, T. A combination of CNTF and BDNF rescues rd photoreceptors but changes rod differentiation in the presence of RPE in retinal explants. Investigative Ophthalmology and Visual Science. 42 (1), 275-282 (2001).
- Ogilvie, J. M., Speck, J. D., Lett, J. M., Fleming, T. T. A reliable method for organ culture of neonatal mouse retina with long-term survival. Journal of Neuroscience Methods. 87 (1), 57-65 (1999).
- Keeler, C. E. The inheritance of a retinal abnormality in white mice. Proceedings of the National Academy of Sciences of the United States of America. 10 (7), 329-333 (1924).
- Romijn, H. J. Development and advantages of serum-free, chemically defined nutrient media for culturing of nerve tissue. Biology of the Cell. 63 (3), 263-268 (1988).
- Caffe, A. R., et al. Mouse retina explants after long-term culture in serum free medium. Journal of Chemical Neuroanatomy. 22 (4), 263-273 (2001).
- Alarautalahti, V., et al. Viability of Mouse Retinal Explant Cultures Assessed by Preservation of Functionality and Morphology. Investigative Ophthalmology and Visual Science. 60 (6), 1914-1927 (2019).
- Caffe, A. R., Visser, H., Jansen, H. G., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Farber, D. B., Lolley, R. N. Cyclic guanosine monophosphate: elevation in degenerating photoreceptor cells of the C3H mouse retina. Science. 186 (4162), 449-451 (1974).
- Arango-Gonzalez, B., et al. Identification of a common non-apoptotic cell death mechanism in hereditary retinal degeneration. PloS One. 9 (11), 112142 (2014).
- Loo, D. T. In situ detection of apoptosis by the TUNEL assay: an overview of techniques. Methods in Molecular Biology. 682, 3-13 (2011).
- Vighi, E., et al. Combination of cGMP analogue and drug delivery system provides functional protection in hereditary retinal degeneration. Proceedings of the National Academy of Sciences of the United States of America. 115 (13), 2997-3006 (2018).
- Valdés, J., et al. Organotypic retinal explant cultures as in vitro alternative for diabetic retinopathy studies. Altex. 33 (4), 459-464 (2016).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: from diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), (2019).
- Slepak, V. Z., Hurley, J. B. Mechanism of light-induced translocation of arrestin and transducin in photoreceptors: interaction-restricted diffusion. IUBMB Life. 60 (1), 2-9 (2008).
- Paquet-Durand, F., et al. A retinal model of cerebral malaria. Scientific Reports. 9 (1), 3470 (2019).
- Romijn, H. J., de Jong, B. M., Ruijter, J. M. A procedure for culturing rat neocortex explants in a serum-free nutrient medium. Journal of Neuroscience Methods. 23 (1), 75-83 (1988).
- Azadi, S., et al. CNTF+BDNF treatment and neuroprotective pathways in the rd1 mouse retina. Brain Research. 1129 (1), 116-129 (2007).
- Kaur, J., et al. Calpain and PARP activation during photoreceptor cell death in P23H and S334ter rhodopsin mutant rats. PloS One. 6 (7), 22181 (2011).
- Samardzija, M., et al. A mouse model for studying cone photoreceptor pathologies. Investigative Ophthalmology and Visual Science. 55 (8), 5304-5313 (2014).
- Achberger, K., et al. Merging organoid and organ-on-a-chip technology to generate complex multi-layer tissue models in a human retina-on-a-chip platform. eLife. 8, (2019).
- Alarautalahti, V., et al. Viability of Mouse Retinal Explant Cultures Assessed by Preservation of Functionality and Morphology. Investigative Ophthalmology and Visual Science. 60 (6), 1914-1927 (2019).
- Ferrer-Martín, R. M., et al. Microglial cells in organotypic cultures of developing and adult mouse retina and their relationship with cell death. Experimental Eye Research. 121, 42-57 (2014).
- Müller, B. Organotypic culture of adult mouse retina. Methods in Molecular Biology. 1940, 181-191 (2019).
- Heller, J. P., Kwok, J. C., Vecino, E., Martin, K. R., Fawcett, J. W. A method for the isolation and culture of adult rat Retinal Pigment Epithelial (RPE) cells to study retinal diseases. Frontiers in Cellular Neuroscience. 9, 449 (2015).
- Sahaboglu, A., et al. Retinitis pigmentosa: rapid neurodegeneration is governed by slow cell death mechanisms. Cell Death & Disease. 4 (2), 488 (2013).
- Arai, E., et al. Ablation of Kcnj10 expression in retinal explants revealed pivotal roles for Kcnj10 in the proliferation and development of Müller glia. Molecular Vision. 21, 148-159 (2015).
- Demas, J., Eglen, S. J., Wong, R. O. Developmental loss of synchronous spontaneous activity in the mouse retina is independent of visual experience. Journal of Neuroscience. 23 (7), 2851-2860 (2003).
- Johnson, T. V., Martin, K. R. Development and characterization of an adult retinal explant organotypic tissue culture system as an in vitro intraocular stem cell transplantation model. Investigative Ophthalmology and Visual Science. 49 (8), 3503-3512 (2008).
- Hatakeyama, J., Kageyama, R. Retrovirus-mediated gene transfer to retinal explants. Methods. 28 (4), 387-395 (2002).
- Moritoh, S., Tanaka, K. F., Jouhou, H., Ikenaka, K., Koizumi, A. organotypic tissue culture of adult rodent retina followed by particle-mediated acute gene transfer in vitro. PloS One. 5 (9), 12917 (2010).
- Reinhard, K., et al. Step-by-step instructions for retina recordings with perforated multi electrode arrays. PloS One. 9 (8), 106148 (2014).
- Klemm, P., et al. Hypothermia protects retinal ganglion cells against hypoxia-induced cell death in a retina organ culture model. Clinical and Experimental Ophthalmology. 47 (8), 1043-1054 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved