Method Article
Langfristige, serumfreie Kultivierung organotypischer Maus-Retina-Explanten mit intaktem retinalen Pigmentepithel
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das Protokoll beschreibt organotypische Explanten der Maus NeuroRetina, kultiviert zusammen mit seinem retinalen Pigment epithel (RPE), in R16 definierten Medium, frei von Serum und Antibiotika. Diese Methode ist relativ einfach durchzuführen, im Vergleich zu In-vivo-Experimenten kostengünstiger und zeitaufwändigund und kann an zahlreiche experimentelle Anwendungen angepasst werden.
Zusammenfassung
In der ophthalmologischen Forschung besteht ein starker Bedarf an In-vitro-Modellen der Neuroretina. Hier stellen wir ein detailliertes Protokoll zur organotypischen Kultivierung der Mausneuro-Retina mit intaktem retinalen Pigmentepithel (RPE) vor. Je nach Forschungsfrage können Netzhaut von Wildtieren oder von Krankheitsmodellen isoliert werden, um beispielsweise diabetische Retinopathie oder erbliche Netzhautdegeneration zu untersuchen. Die Augen vom frühen postnatalen Tag 2 bis 9 Tiere werden unter aseptischen Bedingungen enukleiert. Sie werden teilweise in Proteinase K verdaut, um eine Ablösung der Aderhaut vom RPE zu ermöglichen. Unter dem Stereoskop wird ein kleiner Schnitt in der Hornhaut gemacht, wo zwei Kanten entstehen, von denen die Aderhaut und Sklera sanft von der RPE und Neuroretina abgeschält werden können. Die Linse wird dann entfernt, und die Augenmuschel wird in vier Punkte geschnitten, um ihr eine vierkeilige Form zu geben, die einem Kleeblatt ähnelt. Das Gewebe wird schließlich in einem hängenden Tropfen in einen Zellkultureinsatz mit einer Polycarbonat-Kultivierungsmembran übertragen. Die Kulturen werden dann in R16 medium, ohne Serum oder Antibiotika, unter vollständig definierten Bedingungen, mit einer mittleren Veränderung jeden zweiten Tag gepflegt.
Das beschriebene Verfahren ermöglicht die Isolierung der Netzhaut und die Erhaltung ihres normalen physiologischen und histotypischen Kontextes für Kultivierungsperioden von mindestens 2 Wochen. Diese Eigenschaften machen organotypische Netzhautexplantationskulturen zu einem ausgezeichneten Modell mit hohem Vorhersagewert für Studien zur Netzhautentwicklung, Zustände und Elektrophysiologie und ermöglichen gleichzeitig ein pharmakologisches Screening.
Einleitung
In der ophthalmologischen Forschung stehen eine Vielzahl von Modellen zur Verfügung, um die Netzhaut zu untersuchen, einschließlich primärer Netzhautzellkulturen, retina-abgeleiteter Zelllinien, retinaler Organoide und in vivo Tiermodelle1,2,3,4,5. Jedes dieser Modelle leidet jedoch unter Nachteilen. Zum Beispiel wachsen Zellen isoliert, während die Netzhaut ein komplexes Netzwerk mit einer Vielzahl von Zell-zu-Zell-Interaktionen ist. Daher ist das Verhalten isolierter Zellkulturen wahrscheinlich künstlich im Vergleich zu dem, das in einem ganzen Gewebe beobachtet wird. Dieses Problem kann zum Teil mit in vitro differenzierten Retina-Organoiden behoben werden, die verwendet werden können, um Entwicklung und grundlegende Biologie zu studieren6. Dennoch ist die Retinal-Organoid-Generation bis heute zeitaufwändig, arbeitsintensiv und leidet unter Reproduzierbarkeitsproblemen, die umfangreiche Weiterentwicklungsarbeit erfordern, bevor Organoide für die translationale Netzhautforschung verwendet werden können. Schließlich sind Studien an lebenden Tieren, obwohl das Modell, das den Anforderungen der ophthalmologischen Forschung am nächsten kommt, mit starken ethischen Bedenken verbunden. Ein guter Kompromiss zwischen der Effizienz von Zellkultursystemen und der realen Situation von in vivo Tiermodellen sind organotypische Netzhautexplantationskulturen. Solche Kulturen reduzieren auch das Leiden der Tiere, da keine In-vivo-Interventionen durchgeführt werden.
Es wurden mehrere Methoden zur Kultivierung von Retinalen Expflanzen verschiedener Arten5,7,8beschrieben. Unser Protokoll beschreibt eine Technik zur Isolierung der Mausneuroretina zusammen mit ihrem retinalen Pigmentepithel (RPE). Diese Technik wird auch für Ratte Netzhautkulturen9geeignet sein. Die Kultur der Neuroretina zusammen mit ihrem RPE ist von großer Bedeutung für den Erfolg. Das RPE erfüllt wesentliche Funktionen für die Netzhaut: Transport von Nährstoffen, Ionen, Wasser, Absorption von Licht und Schutz vor Photooxidation, Re-Isomerisierung von All-Trans-Retinal in 11-cis-retinal, was für den visuellen Zyklus entscheidend ist, Phagozytose von Schuppen photorezeptormembranen, und Sekretion von wesentlichen Faktoren für die strukturelle Integrität der Netzhaut10. Die Aufrechterhaltung des RPE ermöglicht eine erfolgreiche Entwicklung von Photorezeptor-Außen- und Innensegmenten, wodurch die Netzhaut länger lebensfähig bleibt11. Das unten beschriebene Verfahren bewahrt die histotypischen und physiologischen Eigenschaften der Netzhaut für mindestens zwei Wochen12. Darüber hinaus vermeidet die Kultivierung der organotypischen Netzhautexplantationen in serumfreiem, antibiotikafreiem Medium das Vorhandensein unbekannter Substanzen und ermöglicht eine einfache Interpretation der Ergebnisse12.
Organotypische Netzhautexplantationskulturen waren wesentlich für die Verbesserung unseres Wissens über Netzhautentwicklung und Degeneration7,13,14. Wir zeigen hier, dass sie auch ein nützliches Werkzeug für pharmakologisches Screening sind und dass sie eingesetzt werden können, um eine Vielzahl von Netzhauterkrankungen zu modellieren, einschließlich diabetischer Retinopathie.
Protokoll
Tierprotokolle, die dem Tierschutzgesetz nr. 4 entsprechen, wurden vom Tübinger Tierschutzausschuss überprüft undgenehmigt. Registrierungs-Nr. AK02/19M). In dieser Studie wurden Netzhaut von Wildtyp-Mäusen (WT) und Rd1-Mäusen gewonnen, wobei letztere ein gut charakterisiertes Modell für die erbliche Netzhautdegeneration15waren. Mäuse wurden unter weißer zyklischer Standardbeleuchtung untergebracht, hatten freien Zugang zu Nahrung und Wasser und wurden unabhängig vom Geschlecht verwendet.
1. Checkliste
- Um sterile Bedingungen zu gewährleisten und Verunreinigungen zu vermeiden, reinigen und desinfizieren Sie die laminare Luftstromhaube mit 70% Ethanol. Achten Sie darauf, das Ethanol vollständig verdampfen zu lassen, um eine Vergiftung der Netzhautkulturen zu verhindern.
- Autoklavwerkzeuge (z. B. Schere, Zange und ophthalmologischer Mikroskop-Schrumpflöffel) vor dem Gebrauch.
- Bereiten Sie folgende Medien im Voraus unter einer laminaren Stromhaube unter sterilen Bedingungen vor: Basal R16 medium (BM) (kann 4 Wochen bei 4 °C gelagert werden), BM mit 20% fetalem Kalbsserum (FCS) (am selben Tag), BM mit 0 .12% Proteinase K (44 mAnson U/mg) Lösung (Am selben Tag) und komplettes R16-Medium mit Ergänzungen (CM) wie von Romijn16 beschrieben (kann bei 4 °C für 3 Wochen gelagert werden) (siehe Tabellen S1, S2 und S3).
- Die Proteinase-K-Lösung bei 37 °C vorheizen, um sie zu aktivieren und in Schritt 2.5 zu verwenden.
2. Vorbereitung
- Opfern rd1/WT Tier am postnatalen Tag (P) 5 durch Enthauptung. Für Tiere, die älter als P11 sind, verwenden Sie CO2 und/oder Zervixdislokation gemäß den örtlichen Tierschutzbestimmungen.
- Je nach Alter des Tieres, vor der Enukleation, bei Bedarf, öffnen Sie die Augenlider mit Zangen und sehr sorgfältig trennen Sie die Augenlider, ohne das Auge unten zu berühren oder zu kratzen.
- Die Augen unter einem Stereoskop mit gekrümmten Zangen schnell enukleieren.
- Inkubieren Sie die Augen in BM für 5 min bei Raumtemperatur (RT).
- Inkubieren Sie die Augen in vorgewärmtem BM, mit 0,12% Proteinase K bei 37 °C für 15 min.
- Führen Sie die folgenden Schritte in einer laminaren Luftstromhaube aus, um sterile Bedingungen zu gewährleisten. Um Proteinase K zu inaktivieren, übertragen Sie die Augen auf BM, die 20% FCS enthalten, und inkubieren Sie für 5 min bei RT.
- Sezieren Sie die Augen unter einem Stereoskop, aseptisch, in einer Petrischale mit frischem BM bei RT. Initiieren Sie die Sezierung so schnell wie möglich nach der Enukleation. Je länger diese Zeit ist, desto schwieriger ist es, die Netzhaut zu sezieren, die Augen werden sehr weich.
- Halten Sie mit Einer Zange das Auge vom Sehnerv. Mit einer feinen Schere, machen Sie einen kleinen Schnitt in der Hornhaut, wo 2 Kanten, von wo die Hornhaut, die Aderundin und die Sklera sanft geschält werden können mit 2 Paar feinen Zangen(Abbildung 1 Schritte A-C). Alternativ können Sie eine Schmalspurkanüle verwenden, um einen ersten Schnitt in die Hornhaut zu machen, und dann eine der Scherenklingen in die Öffnung einsetzen.
- Greifen Sie die Linse mit feiner Zange. Platzieren Sie ein zweites Zangenpaar senkrecht zu den ersten, so dass sich die ersten Zangen zwischen den beiden Schaften des zweiten befinden. Ziehen Sie, um die Linse aus der Augenschale zu extrahieren. Wenn der Glaskörper und der Ziliarkörper noch an der Netzhaut befestigt sind, entfernen Sie sie sorgfältig(Abbildung 1 Schritt D).
HINWEIS: Die Schritte 2.7.1 und 2.7.2 müssen geübt werden und achten Sie darauf, dass die Netzhaut nicht beschädigt wird. - Schneiden Sie die Netzhaut senkrecht zu ihren Rändern in vier Punkte, wodurch eine vierblättrige Kleeform entsteht(Abbildung 1 Schritte E–F).
- Mit einer Pipette mit breit geschnittener Basis einer 1 ml Spitze die Netzhaut in einem hängenden Tropfen des Mediums halten und in einen Kulturschalenfiltereinsatz übertragen, der in eine 6-Well-Kulturplatte gelegt wird. Die RPE-Schicht sollte der Membran gegenüberstehen(Abbildung 1 Schritt G).
- Entfernen Sie mit einer Pipette vorsichtig das überschüssige Medium aus dem Einsatz.
- Von den Seiten des Brunnens 1 ml CM pro Brunnen hinzufügen und in einem sterilen Inkubator bei 37 °C mit 5%CO2brüten. Tauchen Sie die Netzhaut nicht in das Medium, da dies die Sauerstoffversorgung reduziert und Gewebedegeneration verursacht. Die Explantation sollte an der Schnittstelle zwischen Flüssigkeit und Luft bleiben, nur durch einen dünnen Flüssigkeitsfilm bedeckt, der durch die Oberflächenspannung von Wasser erzeugt wird.
- Lassen Sie die Netzhautexplantation für die ersten 48 h ungestört, um die Genesung nach dem Explantationsverfahren zu erleichtern.
- Ändern Sie das Medium jeden zweiten Tag (48 h). Entsorgen Sie 700 l Medium aus jedem Brunnen und fügen Sie 900 l frischen CM in den Brunnen. Auf diese Weise wird die Menge des durch Verdunstung verlorenen Mediums wiederhergestellt und die Netzhautexplantation behält einige der neuroprotektive Faktoren, die in den vorherigen 48 h produziert wurden.
- Inkubieren Sie das entfernte Medium in einem separaten und geschlossenen Mikrozentrifugenrohr zusammen mit den Kulturen, um mögliche Verunreinigungen zu kontrollieren und zu bewerten (d. h. Farbänderung des Mediums).
HINWEIS: Netzhaut-Expflanzen können in Kultur für mindestens 2 Wochen gehalten werden12.
3. Nach der Kultivierung
HINWEIS: Explanten können für verschiedene experimentelle Anwendungen (Westlicher Fleck, Histologie, ganze Reittiere, genetische Analyse, Elektrophysiologie) verwendet werden. Je nach Anwendung können organotypische Netzhautexpflanzen eingefroren, lysiert oder für die Kryosektion vorbereitet werden. Die folgenden Schritte beschreiben die histologische Vorbereitung.
- Führen Sie eine 45-min-Fixierung mit 4% Paraformaldehyd (PFA), gefolgt von allmählichem Saccharose-Kryoschutz (10% Saccharose für 10 min, 20% für 20 min und 30% für 2 h bei Raumtemperatur (RT) oder über Nacht (ON) bei 4 °C). Fügen Sie diese Puffer direkt in den Brunnen.
- Schneiden Sie die Membran um die retinalen Explanten.
- Einbetten sowohl der Membran als auch des Netzhautgewebes in das Medium für gefrorenes Gewebe.
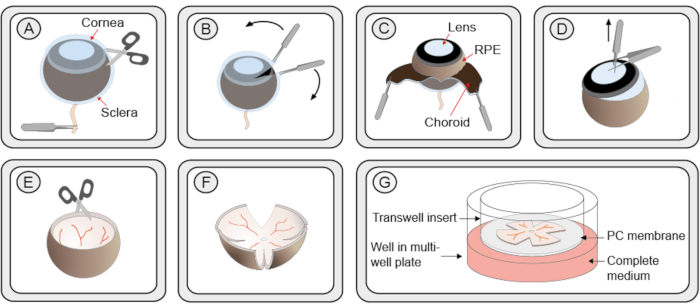
Abbildung 1:Schritt-für-Schritt-Verfahren zur Herstellung organotypischer netzretinaler Explantationskulturen. (A) Mausaugen werden enukleiert und auf eine Lösung der Proteinase K übertragen, um die Trennung von Sklera und Aderhaut von der Netzhaut und RPE zu ermöglichen. Ein kleiner Schnitt in der Sklera/Choroidschicht wird eingeführt. (B) Zwei Zangen werden verwendet, um die Sklera/Choroidschicht zu schälen. (C) Die schwarze Aderhautschicht ist während des Peelings zu sehen. Das unterlegende dunkle retinale Pigmentepithel (RPE) bleibt am Augapfel befestigt. Die Sklera und Die Aderhaut werden zusammen mit dem Sehnerv entfernt. (D) Die Linse und der Glaskörper werden mit Zangen extrahiert. Der verbleibende Ziliarkörper wird entfernt. (E) Die Netzhaut behält eine schüsselartige Form. (F) Um die Netzhaut für die Kultivierung in einer Schale abzuflachen, werden 4 Schnitte in gleichem Abstand um die Netzhaut mit einer Schere gemacht, was ihr eine kleeähnliche Form verleiht. Die Netzhautkultur wird mit hilfe einer geschnittenen 1 ml Pipettenspitze auf einen Membrankultureinsatz in einer 6-Well-Platte übertragen. Die Netzhaut behält noch einen Teil der Schalenform. Bei Entfernung der überschüssigen Flüssigkeit, die die Netzhaut umgibt, entfaltet sie sich jedoch zu einer planaren Struktur. (G) Im Kulturmembranaufbau ruht die Netzhautkultur auf einer porösen Polycarbonatmembran (PC) auf einer Lösung des kompletten R16-Mediums. Um die Lebensfähigkeit zu gewährleisten, muss die Kultur in einem befeuchteten sterilen Inkubator bei 37 °C mit 5%CO2gehalten werden, und das Medium sollte alle 48 h ausgetauscht werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Nach dem Befolgen des Protokolls bewahren sezierte und kultivierte Netzhautexplanten ihre normale Gewebearchitektur mit unterschiedlichen Schichten, vom RPE bis zur Ganglienzellschicht (GCL), wie in Abbildung 2dargestellt. Die Größe der äußeren Kernschicht (ONL) und der inneren Kernschicht (INL) blieb 2-3 Wochen lang weitgehend stabil, wobei ein langsam fortschreitender Zellverlust und eine allmähliche Ausdünnung dieser Schichten immer deutlicher werden, wenn die Kultivierungszeit auf 4 Wochen und darüber hinaus verlängert wird. Im GCL hingegen wird aufgrund der Axotomie des Sehnervs in der Regel innerhalb der ersten 4 Tage der Kultivierung eine deutliche Ausdünnung beobachtet. Danach wird die verbleibende Zellpopulation in der GCL (meist verdrängte Amacrine-Zellen) für weitere 3-4-Wochen17,18,19lebensfähig bleiben.
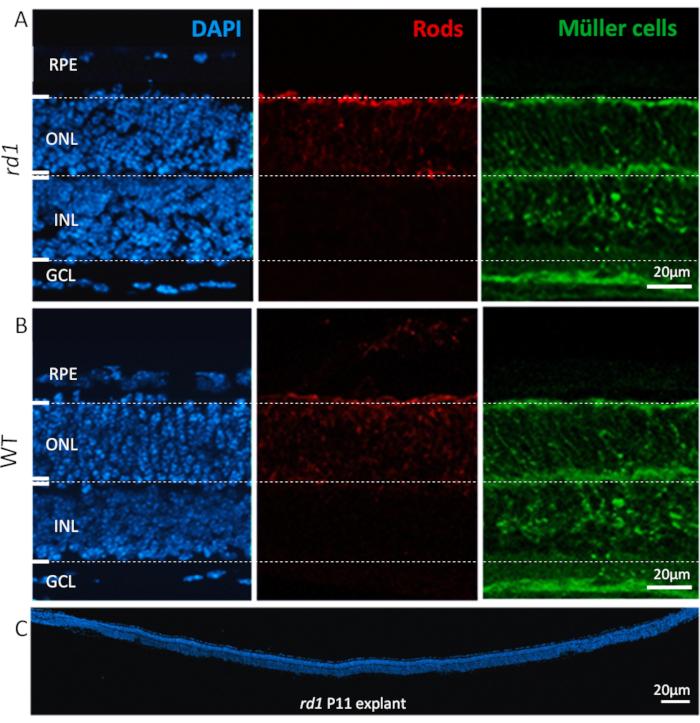
Abbildung 2:Zelltypen, die in derretinalen Explantationskultur gefunden werden. Netzhautexplantationskultur bei P11 abgeleitet von rd1 Mutant (A) und WT-Tieren (B) zeigt nukleare Färbung mit DAPI (links, blau), Stab-Photorezeptoren (Mitte, rot) und Müller-Zellen (rechts, grün). Die Kernfärbung hebt alle wichtigen zellulären Schichten der Netzhaut hervor, wie z. B. retinalepigmentepithel (RPE), äußere Kernschicht (ONL), innere Kernschicht (INL) und Ganglienzellschicht (GCL). Spezifische Zelltypen in den Kernschichten, wie Z.B. Stäbe und Müller-Zellen, sind immunlabeliert mit Alpha-Arrestin26 bzw. Glutamin-Synthetase-27-Antikörpern. (C) Zeigt den gesamten Abschnitt einer ganzen rd1-Maus-Retina mit DAPI-Färbung an, die die Konsistenz, Integration und Entwicklung der Netzhaut hervorhebt. Diese Netzhaut wurde für 6 Tage kultiviert. Verfahrensbeschreibung: Retina und RPE, abgeleitet von rd1 oder WT-Tieren, wurden bei P5 isoliert und, wie im Protokoll beschrieben, bis P11 mit einer mittleren Veränderung alle 48 h kultiviert. Kulturen wurden mit 4% PFA bei P11 fixiert und kryosectioniert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen
Serumfreies Medium und die nachhaltige In-vitro-Umgebung ermöglichen die volle Kontrolle über die experimentellen Bedingungen. Hier stellen wir zwei Beispiele für spezifische Anwendungen dieses Protokolls bereit.
Das erste Beispiel veranschaulicht die Möglichkeit, Netzhautexplantationen für Arzneimitteltests oder Screening-Zwecke zu verwenden. Organotypische Netzhautexplantationskulturen wurden aus Wildtyp-(WT) und rd1-Mausmodellen hergestellt. Letzteres ist ein gut charakterisiertes Modell für die Netzhautdegeneration15. In der rd1 MausNetzhaut wird die ONL-Degeneration durch ungewöhnlich hohe cGMP-Werte in Stabphotorezeptoren6,20ausgelöst. Übermäßige cGMP verursacht erhöhte Aktivität von zyklischen Nukleotid-Gated-Ionen-Kanälen (CNGCs) und cGMP-abhängiger Proteinkinase (PKG), was zum Zelltod21führt. Die Behandlung von rd1-Mausnetzhaut mit einem strukturellen Analog zu cGMP (zyklisches Nukleotid #3; CN003), das sowohl auf PKG als auch auf CNGC abzielt, wurde getestet. Nach der Explantation bei P5 wurde das in Abbildung 3A beschriebene Behandlungsparadigma befolgt. Die Explantkulturen wurden mit 4% PFA bei P11 fixiert und für die Kryosektion vorbereitet (Abbildung 3A). Zur Beurteilung des Zelltodes von histologischen Abschnitten aus behandelten, nicht behandelten (NT) und WT-Proben wurde ein terminaler Desoxynukleotidyltransferase dUTP nick end labeling (TUNEL) Assay22 durchgeführt. Die Analyse von TUNEL-markierten Zellen zeigte einen hohen Anteil sterbender Zellen im ONL der rd1 unbehandelten Proben, während CN003-geschützte rd1-Mausphotorezeptoren bei einer Konzentration von 50 m23 (Abbildung 3B) aufgetragen wurden.
Eine häufige Komplikation von Diabetes ist die diabetische Retinopathie, eine blendende Krankheit, die in Tiermodellen nur schwer originalgetreu zu reproduzieren ist5. Das zweite Beispiel zeigt die Verwendung von organotypischen retinalen Explant-Kulturen zur Charakterisierung der Lebensfähigkeit der Netzhautzellen unter Bedingungen, die Typ-2-Diabetes mellitus (T2DM)24emulieren. Hier haben wir 20 mM des Glykolyseinhibitors 2-Deoxy-Glucose (2-DG)25 verwendet und 24 h von P10 bis P11 an das Kulturmedium verabreicht. Wir zeigen, dass die Unterwerung von WT-Retina-Explantationen solchen in vitro simulierten diabetischen Erkrankungen zu einem umfangreichen neuronalen Zelltod der Netzhaut führt (Abbildung 3C). Dieses Paradigma wiederum kann dann zum Beispiel verwendet werden, um degenerative Mechanismen zu studieren oder retinoprotektive Behandlungen in einem Diabetes-Kontext zu testen.
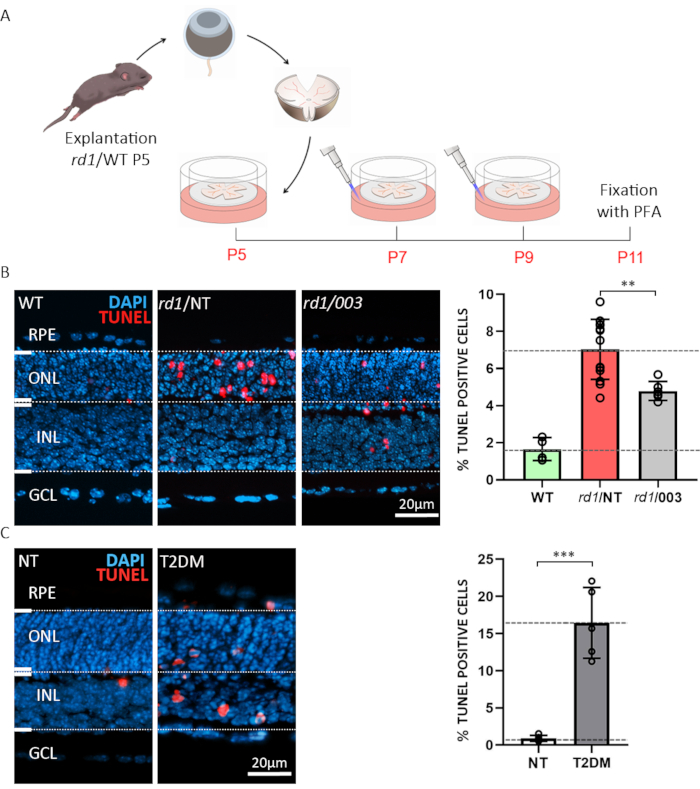
Abbildung 3: Zwei Beispiele für Anwendungen organotypischer netzretinaler Explantationskulturen. (A) Verfahrensbeschreibung: Retina und RPE abgeleitet von rd1 oder WT-Tieren wurden am postnatalen Tag (P) 5 isoliert und wie oben beschrieben kultiviert, mit einer mittleren Veränderung alle 48 h. Bei P7 und P9 wurde das verbrauchte Medium verworfen und frischecm mit Wirkstoff in einer Konzentration von 50 m auf die Platte gesetzt. Kulturen wurden mit 4% PFA bei P11 fixiert und kryosectioniert. (B) Compound-Tests an der netzretina rd1. Abschnitte wurden aus WT, behandelt (003) und nicht behandelten (NT) organotypischen retinalen Explantationskulturen gewonnen. TUNEL Assay (rot) wurde als Marker für den Zelltod verwendet. Nukleare Färbung mit DAPI (blau). Die im Balkendiagramm dargestellte Quantifizierung veranschaulicht die Prozentsätze sterbender Zellen in WT, rd1 NT und rd1 003 Zustand. Die Behandlung mit Verbindung 003 reduzierte den Tod von rd1 Photorezeptorzellen signifikant. (C) Simulation von Typ-2-Diabetes mellitus (T2DM) auf der WT-Retina mit 2-Deoxy-Glucose (2-DG) Behandlung. DER TUNEL-Assay wurde an NT- und T2DM-Proben durchgeführt. Die Quantifizierung deutet auf einen sehr signifikanten Anstieg des Zelltodes hin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen
Tabelle S1. Bitte klicken Sie hier, um die Tabelle herunterzuladen
Tabelle S2. Bitte klicken Sie hier, um die Tabelle herunterzuladen
Tabelle S3. Bitte klicken Sie hier, um die Tabelle herunterzuladen
Diskussion
Das vorgestellte Protokoll beschreibt organotypische Explantienkulturen der Mausnetzhaut mit intaktem RPE in definiertem R16-Medium, frei von Serum und Antibiotika. Dieses Protokoll wurde ursprünglich in den späten 1980er Jahrenentwickelt 7,28 und seitdem wurde es kontinuierlich verfeinert6,11,12. Bemerkenswerte Anwendungen sind Studien über die Mechanismen der erblichen Netzhautdegeneration und die Identifizierung von retinoprotektive Medikamente23,29,30.
Für ein erfolgreiches Experiment müssen einige wichtige Überlegungen berücksichtigt werden. Hier sind einige wichtige Fehlerbehebungspunkte, um die Qualität der Kulturen zu verbessern. Erstens können die Netzhautkulturen übermäßige Faltung und/oder Rosettenbildungzeigen 31. Dies kann durch Berühren der Netzhaut mit einer Zange während des Explantationsvorgangs verursacht werden. Darüber hinaus muss der Ziliarkörper vollständig aus der Explantation entfernt werden, da dies die Netzhautfaltung während der Kultur erhöhen kann. Zweitens, während der Übertragung der Netzhaut auf die Brunnenplatte in einem hängenden Tropfen, wenn die Netzhaut der Membran die falsche Seite nach unten zeigt, halten Sie es in den Tropfen hängen an der Pipette Spitze und sehr sanft drücken Sie das Medium in und aus der Spitze (ohne den hängenden Tropfen zu lösen), um die Netzhaut umzudrehen. Schließlich, wenn das RPE an der Sklera befestigt bleibt und sich von der Netzhaut löst, wird es höchstwahrscheinlich durch eine unzureichende Präverdauung der Sklera verursacht. Dieses Problem kann besonders wichtig sein, wenn es mit Augen älterer Tiere oder Nicht-Nagetierarten (z. B. Schweine) arbeitet und durch Erhöhung der Proteinase-K-Konzentration gelöst werden kann.
Die Durchführung organotypischer Netzhautexplantationskulturen ist ein komplexes Verfahren, das eine angemessene Ausbildung und Erfahrung erfordert. Mangelndes Training kann zu Einer Variabilität der Qualität der Netzhautexplantationen führen. Aus diesen Gründen ist es wichtig, die Lebensfähigkeit und Reproduzierbarkeit zu überwachen und zu überprüfen, indem beispielsweise die Rate des Zelltodes mit dem TUNEL-Assay charakterisiert wird. Der Einsatz eines antibiotikafreien Mediums macht die Netzhautexplantationen anfällig für eine Kontamination durch Bakterien und Pilze. Um dieses Risiko zu minimieren, empfehlen wir, besonders darauf zu achten, unter wirklich aseptischen Bedingungen zu arbeiten. Eine weitere Einschränkung der in vitro retinalen Kultivierung sind Unterschiede in der physiochemischen Umgebung im Vergleich zur in vivo Netzhaut (z. B. Aderhaut- und Netzhautblutversorgung, Sauerstoff- und Glukosespiegel, Augeninnendruck, Zusammensetzung des Glaskörpers). Ein kontinuierliches Perfusionssystem, das vielleicht in einen speziellen Bioreaktor32 eingebettet ist, könnte dieses Modell näher an den In-vivo-Zustand bringen. Darüber hinaus führt die Axotomie des Sehnervs während der Netzhautsektion zum Tod von Ganglienzellen, die Stressreaktionen induzieren können8. Daher ist es empfehlenswert, dass das Explant mindestens 2 Tage in vitro an Kultivierungsbedingungen angepasst werden muss, bevor es einer spezifischen Manipulation oder Behandlung unterzogen wird.
Die beschriebene Methode wird in der Regel auf unreife Netzhautgewebe durchgeführt, die gut überleben können für 4 Wochen in vitro7,33. Das Verfahren ist jedoch auf eine Vielzahl von Anwendungen zugeschnitten, einschließlich der Kultivierung der adulten Netzhaut. Obwohl verschiedene veröffentlichte Ansätze die Isolierung der adulten Netzhaut ohne ihre RPE34,35beschreiben, ermöglicht die Inkubation mit Papainlösung für bis zu 1 h bei 37 °C vor der Zerlegung, dass das RPE an der Netzhaut befestigt bleibt, selbst wenn es von einer erwachsenen Maus abgeleitet ist36.
Das serumfreie Medium und die chemisch definierte In-vitro-Umgebung sorgen für eine vollständig definierte und reproduzierbare Manipulation der Versuchsbedingungen. Daher sind organotypische netzhaut-Explantationskulturen wertvolle Werkzeuge auf dem Gebiet der Ophthalmologie und Neurowissenschaften und wurden für die Untersuchung von Netzhauterkrankungen37, Netzhautentwicklung38,39, Netzhautstammzelltherapie40, genetische Modifikationen41und pharmakologisches Screening verwendet. Als spezifisches Beispiel für Arzneimitteltests haben wir hier retinale Explantationskulturen verwendet, um ein cGMP-Analogon (CN003) zu testen, bekannt, um den Tod von Photorezeptorzellen in Tiermodellen für vererbte Netzhauterkrankungen zu reduzieren23 (Abbildung 3B). Eine weitere mögliche Anwendung der Technik wird in Abbildung 3Cbeschrieben, die zeigt, wie die präzise Kontrolle der Gewebeumgebung genutzt werden kann, um diabetische Bedingungen zu emulieren24. Aufgrund der Erhaltung der Gewebearchitektur über die gesamte Kultivierungsperiode eignen sich organotypische Netzhautexplantationskulturen auch für elektrophysiologische Studien. Neuronale Funktionalität auf retinalen Explants wurden mit Patch-Clamp-Aufnahme42 und Multi-Elektroden-Array (MEA) Aufzeichnung33,43untersucht. Letzteres ermöglicht die gleichzeitige Erfassung der elektrischen Aktivität neuronaler Populationen und wurde genutzt, um die Funktionalität von Photorezeptor- und Ganglienzellen unter Kulturbedingungen zu charakterisieren. In einer breiteren Perspektive können die organotypischen Explantenkultursysteme auch in der präklinischen Forschung angewendet werden, wo Explantienkulturen verwendet wurden, um die therapeutische Wirksamkeit der Hypothermie zu testen44.
Die organotypische Explant-Kultivierungstechnik ist relativ einfach durchzuführen und im Vergleich zu entsprechenden In-vivo-Experimenten kostengünstiger und zeitaufwändiger und vermeidet die ethischen Bedenken im Zusammenhang mit Studien lebender Tiere. Die präzise Kontrolle der experimentellen Bedingungen und die Erhaltung der RPE- und Gewebekomplexität machen die Methode zu einem wertvollen Werkzeug, um unser Wissen über Netzhautphysiologie und Pathophysiologie zu verbessern und zahlreiche experimentelle Anwendungen zu ermöglichen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Forschungsarbeiten wurden von der Europäischen Union finanziell unterstützt (transMed; H2020-MSCA-765441), der Deutsche Forschungsrat (DFG; PA1751/8-1, 10-1) und dem China-Stipendienrat.
Materialien
| Name | Company | Catalog Number | Comments |
| Biotin | Sigma | B4639 | |
| (+/-)-α-LipoicAcid (=Thiotic acid) | Sigma | T1395 | |
| BSA | Sigma | B4639 | |
| CDP-Choline-Na | Sigma | 30290 | |
| Corticosterone | Sigma | C2505 | |
| CuSO4 × 5H2O | Sigma | C8027 | |
| DL-Tocopherol | Sigma | T1539 | |
| Ethanolamine | Sigma | E0135 | |
| FCS | Sigma | F7524 | |
| Filtropur BT100, 1L, 0.2µm | SARSTEDT | 83.3942.101 | for Basal Medium |
| Forceps | F.S.T | 15003-08 | |
| Glutamine | Sigma | G8540 | |
| Glutathione | Sigma | G6013 | |
| Insulin | Sigma | I6634 | |
| L-CysteineHCl | Sigma | C7477 | |
| Linoleic Acid | Sigma | L1012 | |
| Linolenic Acid | Sigma | L2376 | |
| MnCl2 x 4H2O | Sigma | M5005 | |
| Na-pyruvate | Sigma | P3662 | |
| NaSeO3 x 5H2O | Sigma | S5261 | |
| Ophthalmic microscope scaping spoon | F.S.T. | 10360-13 | |
| Progesteron | Sigma | P8783 | |
| Proteinase K | MP Biomedicals | 21935025 | 44 mAnson U/mg |
| R16 | Gibco | 07491252A | |
| Retinol | Sigma | R7632 | |
| Retinyl acetate | Sigma | R7882 | |
| Scissors | F.S.T | 15004-08 | |
| Sterile filter 0.22µm | MILLEX GP | SLGP033RS | for supplements |
| T3 | Sigma | T6397 | |
| Tocopherylacetate | Sigma | T1157 | |
| Transferrin | Sigma | T1283 | |
| Transwell permeable supports | Corning | 3412 | |
| Vitamin B1 | Sigma | T1270 | |
| Vitamin B12 | Sigma | V6629 | |
| Vitamin C | Sigma | A4034 |
Referenzen
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
- Llonch, S., Carido, M., Ader, M. Organoid technology for retinal repair. Developmental Biology. 433 (2), 132-143 (2018).
- Mencl, S., Trifunović, D., Zrenner, E., Paquet-Durand, F. PKG-dependent cell death in 661W cone photoreceptor-like cell cultures (experimental study). Advances in Experimental Medicine and Biology. 1074, 511-517 (2018).
- Sanges, D., Comitato, A., Tammaro, R., Marigo, V. Apoptosis in retinal degeneration involves cross-talk between apoptosis-inducing factor (AIF) and caspase-12 and is blocked by calpain inhibitors. Proceedings of the National Academy of Sciences of the United States of America. 103 (46), 17366-17371 (2006).
- Schnichels, S., et al. Retina in a dish: cell cultures, retinal explants and animal models for common diseases of the retina. Progress in Retinal and Eye Research. , 100880 (2020).
- Paquet-Durand, F., Hauck, S. M., van Veen, T., Ueffing, M., Ekström, P. PKG activity causes photoreceptor cell death in two retinitis pigmentosa models. Journal of Neurochemistry. 108 (3), 796-810 (2009).
- Caffe, A. R., Visser, H., Jansen, H. G., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical and Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Arango-Gonzalez, B., et al. In vivo and in vitro development of S- and M-cones in rat retina. Investigative Ophthalmology and Visual Science. 51 (10), 5320-5327 (2010).
- Strauss, O. The retinal pigment epithelium in visual function. Physiological Reviews. 85 (3), 845-881 (2005).
- Söderpalm, A., Szél, A., Caffé, A. R., van Veen, T. Selective development of one cone photoreceptor type in retinal organ culture. Investigative Ophthalmology and Visual Science. 35 (11), 3910-3921 (1994).
- Caffe, A. R., et al. Mouse retina explants after long-term culture in serum free medium. Journal of Chemical Neuroanatomy. 22 (4), 263-273 (2001).
- Caffe, A. R., Soderpalm, A. K., Holmqvist, I., van Veen, T. A combination of CNTF and BDNF rescues rd photoreceptors but changes rod differentiation in the presence of RPE in retinal explants. Investigative Ophthalmology and Visual Science. 42 (1), 275-282 (2001).
- Ogilvie, J. M., Speck, J. D., Lett, J. M., Fleming, T. T. A reliable method for organ culture of neonatal mouse retina with long-term survival. Journal of Neuroscience Methods. 87 (1), 57-65 (1999).
- Keeler, C. E. The inheritance of a retinal abnormality in white mice. Proceedings of the National Academy of Sciences of the United States of America. 10 (7), 329-333 (1924).
- Romijn, H. J. Development and advantages of serum-free, chemically defined nutrient media for culturing of nerve tissue. Biology of the Cell. 63 (3), 263-268 (1988).
- Caffe, A. R., et al. Mouse retina explants after long-term culture in serum free medium. Journal of Chemical Neuroanatomy. 22 (4), 263-273 (2001).
- Alarautalahti, V., et al. Viability of Mouse Retinal Explant Cultures Assessed by Preservation of Functionality and Morphology. Investigative Ophthalmology and Visual Science. 60 (6), 1914-1927 (2019).
- Caffe, A. R., Visser, H., Jansen, H. G., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Farber, D. B., Lolley, R. N. Cyclic guanosine monophosphate: elevation in degenerating photoreceptor cells of the C3H mouse retina. Science. 186 (4162), 449-451 (1974).
- Arango-Gonzalez, B., et al. Identification of a common non-apoptotic cell death mechanism in hereditary retinal degeneration. PloS One. 9 (11), 112142 (2014).
- Loo, D. T. In situ detection of apoptosis by the TUNEL assay: an overview of techniques. Methods in Molecular Biology. 682, 3-13 (2011).
- Vighi, E., et al. Combination of cGMP analogue and drug delivery system provides functional protection in hereditary retinal degeneration. Proceedings of the National Academy of Sciences of the United States of America. 115 (13), 2997-3006 (2018).
- Valdés, J., et al. Organotypic retinal explant cultures as in vitro alternative for diabetic retinopathy studies. Altex. 33 (4), 459-464 (2016).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: from diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), (2019).
- Slepak, V. Z., Hurley, J. B. Mechanism of light-induced translocation of arrestin and transducin in photoreceptors: interaction-restricted diffusion. IUBMB Life. 60 (1), 2-9 (2008).
- Paquet-Durand, F., et al. A retinal model of cerebral malaria. Scientific Reports. 9 (1), 3470 (2019).
- Romijn, H. J., de Jong, B. M., Ruijter, J. M. A procedure for culturing rat neocortex explants in a serum-free nutrient medium. Journal of Neuroscience Methods. 23 (1), 75-83 (1988).
- Azadi, S., et al. CNTF+BDNF treatment and neuroprotective pathways in the rd1 mouse retina. Brain Research. 1129 (1), 116-129 (2007).
- Kaur, J., et al. Calpain and PARP activation during photoreceptor cell death in P23H and S334ter rhodopsin mutant rats. PloS One. 6 (7), 22181 (2011).
- Samardzija, M., et al. A mouse model for studying cone photoreceptor pathologies. Investigative Ophthalmology and Visual Science. 55 (8), 5304-5313 (2014).
- Achberger, K., et al. Merging organoid and organ-on-a-chip technology to generate complex multi-layer tissue models in a human retina-on-a-chip platform. eLife. 8, (2019).
- Alarautalahti, V., et al. Viability of Mouse Retinal Explant Cultures Assessed by Preservation of Functionality and Morphology. Investigative Ophthalmology and Visual Science. 60 (6), 1914-1927 (2019).
- Ferrer-Martín, R. M., et al. Microglial cells in organotypic cultures of developing and adult mouse retina and their relationship with cell death. Experimental Eye Research. 121, 42-57 (2014).
- Müller, B. Organotypic culture of adult mouse retina. Methods in Molecular Biology. 1940, 181-191 (2019).
- Heller, J. P., Kwok, J. C., Vecino, E., Martin, K. R., Fawcett, J. W. A method for the isolation and culture of adult rat Retinal Pigment Epithelial (RPE) cells to study retinal diseases. Frontiers in Cellular Neuroscience. 9, 449 (2015).
- Sahaboglu, A., et al. Retinitis pigmentosa: rapid neurodegeneration is governed by slow cell death mechanisms. Cell Death & Disease. 4 (2), 488 (2013).
- Arai, E., et al. Ablation of Kcnj10 expression in retinal explants revealed pivotal roles for Kcnj10 in the proliferation and development of Müller glia. Molecular Vision. 21, 148-159 (2015).
- Demas, J., Eglen, S. J., Wong, R. O. Developmental loss of synchronous spontaneous activity in the mouse retina is independent of visual experience. Journal of Neuroscience. 23 (7), 2851-2860 (2003).
- Johnson, T. V., Martin, K. R. Development and characterization of an adult retinal explant organotypic tissue culture system as an in vitro intraocular stem cell transplantation model. Investigative Ophthalmology and Visual Science. 49 (8), 3503-3512 (2008).
- Hatakeyama, J., Kageyama, R. Retrovirus-mediated gene transfer to retinal explants. Methods. 28 (4), 387-395 (2002).
- Moritoh, S., Tanaka, K. F., Jouhou, H., Ikenaka, K., Koizumi, A. organotypic tissue culture of adult rodent retina followed by particle-mediated acute gene transfer in vitro. PloS One. 5 (9), 12917 (2010).
- Reinhard, K., et al. Step-by-step instructions for retina recordings with perforated multi electrode arrays. PloS One. 9 (8), 106148 (2014).
- Klemm, P., et al. Hypothermia protects retinal ganglion cells against hypoxia-induced cell death in a retina organ culture model. Clinical and Experimental Ophthalmology. 47 (8), 1043-1054 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten