Method Article
Culture à long terme et sans sérum d’explants organotypiques de la rétine de souris avec un épithélium pigmentaire rétinien intact
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le protocole décrit des explants organotypiques de la neurorétinede souris, cultivés avec son épithélium pigmentaire rétinien (RPE), en milieu défini R16, exempt de sérum et d’antibiotiques. Cette méthode est relativement simple à réaliser, moins coûteuse et prend beaucoup de temps par rapport aux expériences in vivo, et peut être adaptée à de nombreuses applications expérimentales.
Résumé
Dans la recherche ophtalmique, il existe un fort besoin de modèles in vitro de la neurorétine. Ici, nous présentons un protocole détaillé pour la culture organotypique de larétine neurode souris avec l’épithélium rétinien intact de colorant (RPE). Selon la question de recherche, les rétines peuvent être isolées à partir d’animaux de type sauvage ou de modèles de maladies, pour étudier, par exemple, la rétinopathie diabétique ou la dégénérescence rétinienne héréditaire. Les yeux des animaux du début de la période postnatale 2 à 9 sont énucléés dans des conditions aseptiques. Ils sont partiellement digérés dans la protéinase K pour permettre un détachement de la choroïde du RPE. Sous le stéréoscope, une petite incision est faite dans la cornée créant deux bords d’où la choroïde et la sclérotique peuvent être doucement décollées de la RPE et de la neurorétine. La lentille est ensuite retirée et l’œillet est coupé en quatre points pour lui donner une forme à quatre calées ressemblant à une feuille de trèfle. Le tissu est finalement transféré dans une goutte suspendue dans un insert de culture cellulaire tenant une membrane de culture de polycarbonate. Les cultures sont ensuite maintenues en milieu R16, sans sérum ni antibiotiques, dans des conditions entièrement définies, avec un changement de milieu tous les deux jours.
Le procédé décrit permet l’isolement de la rétine et la conservation de son contexte physiologique et histotypique normal pour des périodes de culture d’au moins 2 semaines. Ces caractéristiques font des cultures d’explant rétiniennes organotypiques un excellent modèle avec la valeur prédictive élevée, pour des études dans le développement rétinien, les mécanismes de la maladie, et l’électrophysiologie, tout en permettant également le criblage pharmacologique.
Introduction
Dans la recherche ophtalmique, une variété de modèles sont disponibles pour étudier la rétine, y compris les cultures cellulaires rétiniennes primaires, les lignées cellulaires dérivées de la rétine, les organoïdes rétiniens et les modèles animaux in vivo 1,2,3,4,5. Cependant, chacun de ces modèles souffre d’inconvénients. Par exemple, les cellules se développent isolément tandis que la rétine est un réseau complexe avec une multitude d’interactions de cellule à cellule. Ainsi, le comportement des cultures cellulaires isolées est susceptible d’être artificiel par rapport à celui observé dans un tissu entier. Ce problème peut en partie être résolu à l’aide d’organoïdes rétiniennes différenciés in vitro, qui peuvent être utilisés pour étudier le développement et la biologie fondamentale6. Pourtant, à ce jour, la génération d’organoïdes rétiniennes prend encore beaucoup de temps, exige beaucoup de travail et souffre de problèmes de reproductibilité, nécessitant des travaux de développement supplémentaires substantiels avant que les organoïdes puissent être utilisés pour la recherche translationnelle sur la rétine. Enfin, les études sur les animaux vivants, bien qu’on peut soutenir que le modèle se rapproche le plus des exigences de la recherche ophtalmique, sont associées à de fortes préoccupations éthiques. Un bon compromis entre l’efficacité des systèmes de culture cellulaire et la situation réelle des modèles animaux in vivo sont les cultures explantes rétiniennes organotypiques. De telles cultures réduisent également la souffrance animale puisqu’aucune intervention in vivo n’est effectuée.
Plusieurs procédés ont été décrits pour la culture d’explants rétiniennes de différentes espèces5,7,8. Notre protocole décrit une technique pour l’isolement du neuroretina de souris ainsi que son épithélium rétinien de colorant (RPE). Cette technique conviendra également aux cultures rétiniennes de rat9. La culture de la neurorétine avec son RPE est d’une importance majeure pour le succès. Le RPE remplit des fonctions essentielles pour la rétine : transport des nutriments, des ions, de l’eau, absorption de la lumière et protection contre la photooxydation, ré-isomérisation de tout-trans-rétinien en 11-cis-rétinienne, ce qui est crucial pour le cycle visuel, phagocytose des membranes photoréceptrices excrétées, et sécrétion de facteurs essentiels pour l’intégrité structurelle de la rétine10. Le maintien du RPE permet un développement réussi des segments externes et internes du photorécepteur, gardant la rétine viable plus longtemps11. La procédure décrite ci-dessous préserve les caractéristiques histotypiques et physiologiques de la rétine pendant au moins deux semaines12. De plus, la culture des explants rétiniennes organotypiques en milieu sans sérum et sans antibiotiques évite la présence de substances inconnues et permet une interprétation simple des résultats12.
Les cultures d’explantation rétiniennes organotypiques ont été essentielles pour améliorer nos connaissances sur le développement rétinien et la dégénérescence7,13,14. Nous montrons ici qu’ils sont également un outil utile pour le dépistage pharmacologique et qu’ils peuvent être utilisés pour modéliser une variété de maladies de la rétine, y compris la rétinopathie diabétique.
Protocole
Les protocoles animaux conformes au §4 de la loi allemande sur la protection animale ont été examinés et approuvés par le comité de l’Université de Tübingen sur la protection animale (Einrichtung für Tierschutz, Tierärztlichen Dienst und Labortierkunde; Numéro d’enregistrement AK02/19M). Dans cette étude, les rétines ont été obtenues à partir de souris de type sauvage (WT) et rd1, cette dernière étant un modèle bien caractérisé pour la dégénérescence rétinienne héréditaire15. Les souris étaient logées sous un éclairage cyclique blanc standard, avaient un accès gratuit à la nourriture et à l’eau et étaient utilisées indépendamment du sexe.
1. Liste de contrôle
- Pour assurer des conditions stériles et éviter les contaminations, nettoyez et désinfectez la hotte à flux d’air laminaire avec de l’éthanol à 70%. Assurez-vous de laisser l’éthanol s’évaporer complètement, pour éviter l’intoxication des cultures rétiniennes.
- Outils d’autoclave (p. ex. ciseaux, pinces et cuillère de grattage de microscope ophtalmique) avant utilisation.
- Préparer à l’avance les milieux suivants sous une hotte à flux laminaire, dans des conditions stériles : milieu basal R16 (BM) (peut être conservé à 4 °C pendant 4 semaines), BM avec 20 % de sérum de veau fœtal (FCS) (utilisation le jour même), BM avec solution de 0,12 % de protéinase K (44 mAnson U/mg) (utilisation le jour même) et milieu R16 complet avec suppléments (CM) tel que décrit par Romijn16 (peut être conservé à 4 °C pendant 3 semaines) (voir tableaux S1, S2 et S3).
- Préchauffer la solution de protéinase K à 37°C pour l’activer et l’utiliser à l’étape 2.5.
2. Préparation
- Sacrifier rd1/WT animal au jour postnatal (P) 5 par décapitation. Pour les animaux âgés de plus de P11, utilisez le CO2 et/ou la luxation cervicale, conformément aux règlements locaux de protection des animaux.
- Selon l’âge de l’animal, avant l’énucléation, si nécessaire, ouvrez les couvercles oculaires à l’aide d’une pince et séparez très soigneusement les paupières, sans toucher ni gratter l’œil ci-dessous.
- Enucleate rapidement les yeux sous un stéréoscope utilisant la pince courbe.
- Incuber les yeux dans bm pendant 5 min à température ambiante (droite).
- Incuber les yeux dans du BM préchauffé, avec 0,12 % de protéinase K à 37 °C pendant 15 min.
- Effectuez les étapes suivantes à l’intérieur d’une hotte à flux d’air laminaire pour assurer des conditions stériles. Pour inactiver la protéinase K, transférer les yeux à la nomenclature contenant 20% FCS et incuber pendant 5 minutes à droite.
- Disséquer les yeux sous un stéréoscope, aseptiquement, dans une boîte de Petri contenant de la nomenclature fraîche à TA. Lancer la dissection dès que possible après l’énucléation. Plus ce temps est long, plus il est difficile de disséquer la rétine, les yeux devenant très doux.
- Avec une pince, tenez l’œil du nerf optique. À l’aide de ciseaux fins, faites une petite incision dans la cornée en créant 2 bords d’où la cornée, la choroïde et la sclérotique peuvent être doucement pelées à l’aide de 2 paires de pinces fines(Figure 1 étapes A-C). Vous pouvez également utiliser une canule à voie étroite pour faire une première incision dans la cornée, puis insérer l’une des lames de ciseaux dans l’ouverture.
- Saisissez l’objectif avec une pince fine. Placez une deuxième paire de pinces perpendiculairement aux premières afin que les premières pinces se trouvent entre les 2 tiges de la seconde. Tirez pour extraire la lentille de la coupe des yeux. Si le vitré et le corps ciliaire sont toujours attachés à la rétine, retirez-les soigneusement(figure 1 étape D).
NOTA : Les étapes 2.7.1 et 2.7.2 doivent être pratiquées et faire preuve de prudence pour ne pas endommager la rétine. - Couper la rétine perpendiculairement à ses bords en quatre points, créant une forme de trèfle à quatre feuilles(Figure 1 étapes E-F).
- À l’aide d’une pipette à base largement coupée d’une pointe de 1 mL, maintenez la rétine dans une goutte suspendue de milieu et transférez-la dans un insert de filtre à plat de culture placé dans une plaque de culture à 6 puits. La couche RPE doit faire face à la membrane(figure 1 étape G).
- À l’aide d’une pipette, retirez soigneusement l’excès de milieu de l’insert.
- Sur les côtés du puits, ajouter 1 mL de CM par puits et incuber dans un incubateur stérile à 37 °C avec 5% deCO2. Ne pas submerger la rétine dans le milieu car cela réduirait l’oxygénation et provoquerait une dégénérescence des tissus. L’explant doit rester à l’interface entre le liquide et l’air, recouvert uniquement d’un mince film de liquide créé par la tension superficielle de l’eau.
- Laissez l’explant rétinien intact pendant les 48 premières h pour faciliter le rétablissement après le procédé d’explantation.
- Changer le support tous les deux jours (48 h). Jeter 700 μL de milieu de chaque puits et ajouter 900 μL de CM frais au puits. De cette façon, la quantité de milieu perdu par évaporation est récupérée et l’explant rétinien conserve certains des facteurs neuroprotecteurs produits dans les 48 h précédentes.
- Incuber le milieu éliminé dans un tube de microcentrifugation séparé et fermé avec les cultures pour contrôler et évaluer la contamination possible (c.-à-d. changement de couleur du milieu).
REMARQUE: Les explants rétiniennes peuvent être conservés en culture pendant au moins 2 semaines12.
3. Après la culture
REMARQUE: Les explants peuvent être utilisés pour différentes applications expérimentales (western blot, histologie, montures entières, analyse génétique, électrophysiologie). Selon l’application, les explants rétiniennes organotypiques peuvent être congelés, lysés ou préparés pour la cryosection. Les étapes ci-dessous décrivent la préparation histologique.
- Effectuer une fixation de 45 minutes avec du paraformaldéhyde à 4 % (PFA), suivie d’une cryoprotection progressive du saccharose (10 % de saccharose pendant 10 min, 20 % pendant 20 min et 30 % pendant 2 h à température ambiante (RT) ou pendant la nuit (ON) à 4 °C). Ajoutez ces mémoires tampons directement dans le puits.
- Couper la membrane autour des explants rétiniennes.
- Incorporer à la fois la membrane et le tissu rétinien dans le milieu pour le tissu congelé.
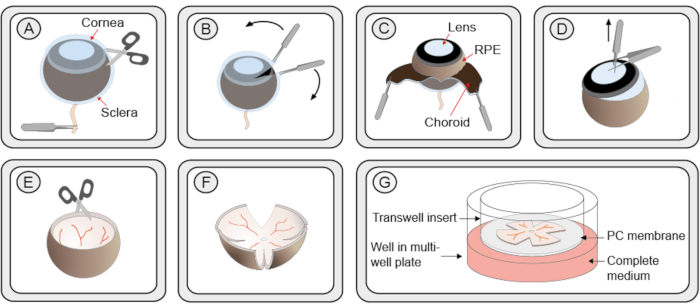
Figure 1: Procédure étape par étape pour la préparation de cultures d’explantation rétiniennes organotypiques. (A) Les yeux de souris sont énucléés et transférés dans une solution de protéinase K pour permettre la séparation de la sclérotique et de la choroïde de la rétine et de la RPE. Une petite coupe dans la couche sclérotique/choroïde est introduite. (B) Deux pinces sont utilisées pour peler la couche sclérotique/choroïde. (C) La couche choroïde noire peut être vue pendant le peeling. L’épithélium rétinien foncé de soulignement (RPE) reste attaché au globe oculaire. La sclérotique et la choroïde sont enlevées avec le nerf optique. (D) La lentille et le vitré sont extraits avec des pinces. Le corps ciliaire restant est enlevé. (E) La rétine conserve une forme en forme de bol. (F) Pour aplatir la rétine pour la culture dans un plat, 4 coupes à égale distance autour de la rétine sont faites avec un ciseau, lui donnant une forme de trèfle. La culture de la rétine est transférée dans un insert de culture membranaire dans une plaque à 6 puits à l’utilisation d’une pointe de pipette coupée de 1 mL. La rétine conserve encore une partie de la forme du bol. Cependant, lors de l’élimination de l’excès de liquide entourant la rétine, il se déploiera sur une structure plane. (G) Dans la configuration de la membrane de culture, la culture de la rétine repose sur une membrane poreuse en polycarbonate (PC) au-dessus d’une solution de milieu R16 complet. Pour assurer la viabilité, la culture doit être conservée dans un incubateur stérile humidifié à 37 °C avec 5 % deCO2,et le milieu doit être remplacé toutes les 48 h. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Résultats
Après avoir suivi le protocole, les explants rétiniennes disséqués et cultivés préservent leur architecture tissulaire normale, avec des couches distinctes, du RPE à la couche de cellules ganglionnaires (GCL), comme le montre la figure 2. La taille de la couche nucléaire externe (ONL) et de la couche nucléaire interne (INL) est demeurée la plupart du temps stable pendant 2-3 semaines, avec une perte de cellules progressant lentement et un amincissement progressif de ces couches devenant de plus en plus évident si la période de culture est prolongée à 4 semaines et au-delà. Dans le GCL, en revanche, en raison de l’axotomy du nerf optique, on observe habituellement un amincissement marqué dans les 4 premiers jours de la culture. Par la suite, la population cellulaire restante dans le GCL (cellules amacrine principalement déplacées) continuera d’être viable pendant encore 3-4 semaines17,18,19.
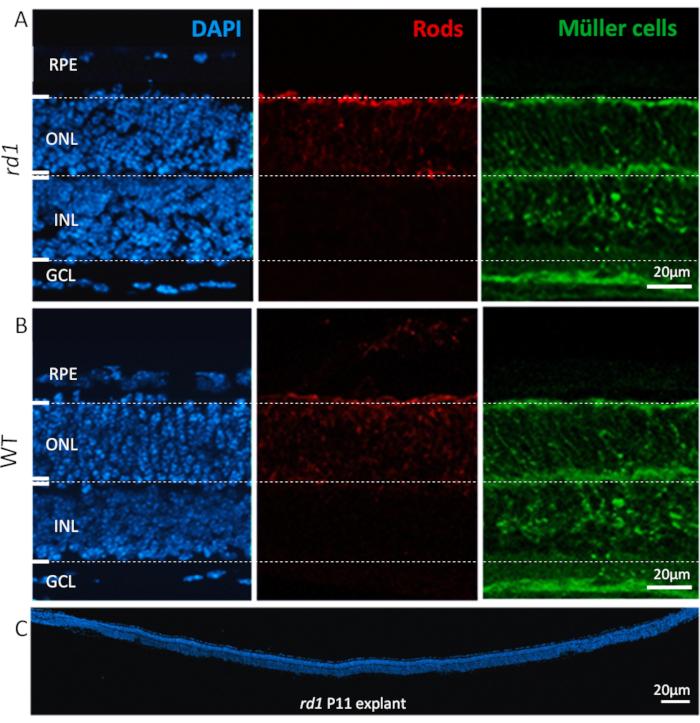
Figure 2: Types de cellules trouvées dans la culture explantaire rétinienne. Culture explantaire rétinienne à P11 dérivée d’animaux mutants rd1 (A)et WT(B)montrant une coloration nucléaire avec DAPI (gauche, bleu), photorécepteurs de tige (centre, rouge) et cellules de Müller (droite, vert). La souillure nucléaire accentue toutes les couches cellulaires principales de la rétine telles que, épithélium rétinien de colorant (RPE), couche nucléaire externe (ONL), couche nucléaire intérieure (INL), et couche de cellules de ganglion (GCL). Des types cellulaires spécifiques dans les couches nucléaires, tels que les bâtonnets et les cellules de Müller, sont immunomarqués avec des anticorps alpha arrestin26 et glutamine synthétase27, respectivement. (C) Montre la section pleine longueur d’une rétine de sourisrd1 entière, avec la coloration DAPI mettant en évidence la cohérence, l’intégration, et le développement de la rétine. Ces rétines ont été cultivées pendant 6 jours. Description de procédure : La rétine et le RPE dérivés d’animaux rd1 ou WT ont été isolés à P5 et cultivés comme décrit dans le protocole, jusqu’à P11 avec un changement moyen toutes les 48 h. Des cultures ont été fixées avec 4% PFA à P11 et cryosectioned. Veuillez cliquer ici pour voir une version agrandie de cette figure
Le milieu sans sérum et l’environnement in vitro soutenu permettent d’avoir un contrôle total sur les conditions expérimentales. Ici, nous fournissons deux exemples d’applications spécifiques de ce protocole.
Le premier exemple illustre la possibilité d’utiliser des explants rétiniennes à des fins de dépistage ou de dépistage des drogues. Des cultures rétiniennes organotypiques d’explant ont été préparées à partir de modèles murins de type sauvage (WT) et rd1. Ce dernier est un modèle bien caractérisé pour la dégénérescence rétinienne15. Dans la rétine de souris rd1, la dégénérescence ONL est déclenchée par des niveaux anormalement élevés de GMPc dans les photorécepteurs de tige6,20. Les GMPc excessives provoquent une activité accrue des canaux ioniques dépendants des nucléotides cycliques (CNGCs) et des protéines kinases dépendantes des GMPc (PKG), entraînant la mort cellulaire21. Le traitement des rétines de souris rd1 avec un analogue structurel à cGMP (nucléotide cyclique #3; CN003), qui cible à la fois PKG et CNGC, a été testé. Après explantation à P5, le paradigme de traitement décrit sur la figure 3A a été suivi. Des cultures d’explant ont été fixées avec 4% de PFA à P11 et préparées pour cryosection(figure 3A). Pour évaluer la mort cellulaire des sections histologiques des spécimens traités, non-traités (NT), et de POIDS, une analyseterminale de l’extrémité de nick de la transférase d’oxynucleotidyl dUTP (TUNEL) a été exécutée. L’analyse des cellules étiquetées tunel a montré un pourcentage élevé de cellules mourantes dans l’ONL des échantillons rd1 non traités, tandis que CN003 protégeait les photorécepteurs de souris rd1 lorsqu’ils sont appliqués à une concentration de 50 μM23 (Figure 3B).
Une complication fréquente du diabète est la rétinopathie diabétique, une maladie aveuglante difficile à reproduire fidèlement chez les modèles animaux5. Le deuxième exemple met en évidence l’utilisation de cultures d’explants rétiniennes organotypiques pour caractériser la viabilité des cellules rétiniennes dans des conditions émulant le diabète sucré de type 2 (DT2)24. Ici, nous avons employé 20 mM de l’inhibiteur de glycolyse 2-deoxy-glucose (2-DG)25 et l’avons administré au milieu de culture pendant 24 h de P10 à P11. Nous montrons que la mise en cause d’explants rétiniennes WT à de telles affections diabétiques simulées in vitro entraîne une mort cellulaire neuronale étendue de la rétine(figure 3C). Ce paradigme peut ensuite être utilisé, par exemple, pour étudier les mécanismes dégénératifs ou pour tester des traitements rétinoprotecteurs dans un contexte de diabète.
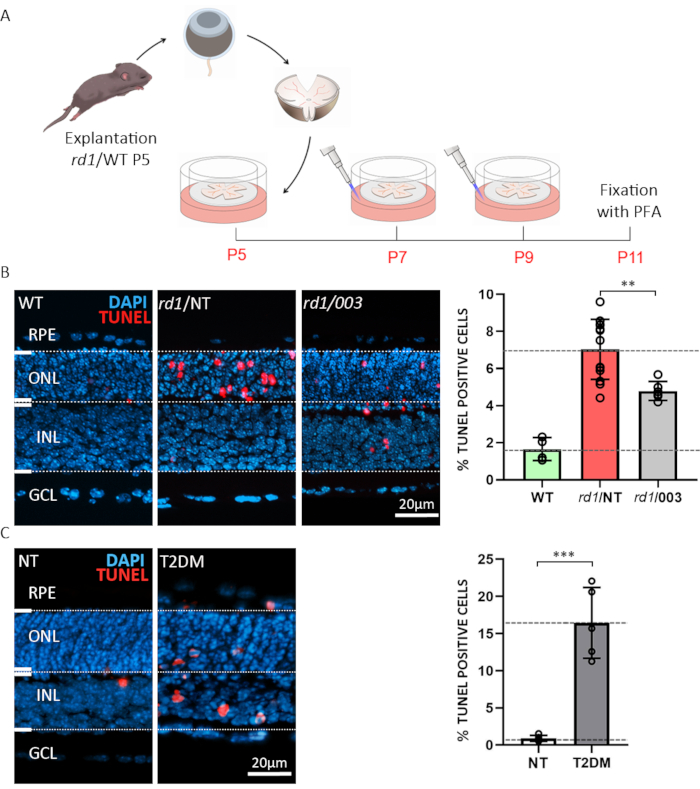
Figure 3: Deux exemples d’applications de cultures explantes rétiniennes organotypiques. (A) Description de la procédure : La rétine et le RPE dérivés d’animaux rd1 ou WT ont été isolés au jour postnatal (P) 5 et cultivés comme décrit ci-dessus, avec un changement de milieu toutes les 48 h. À P7 et P9, le milieu usé a été jeté et du CM frais contenant un composé actif à une concentration de 50 μM a été ajouté à la plaque. Des cultures ont été fixées avec 4% PFA à P11 et cryosectioned. (B) Essais composés sur la rétine rd1. Des sections ont été obtenues à partir de WT, traitées (003), et non-traitées (NT) cultures rétiniennes rétiniennes d’explant. Le test TUNEL (rouge) a été utilisé comme marqueur de la mort cellulaire. Coloration nucléaire avec DAPI (bleu). La quantification présentée dans le diagramme à barres illustre les pourcentages de cellules mourantes dans WT, rd1 NT et rd1 003 condition. Le traitement avec le composé 003 a réduit de manière significative la mort cellulaire du photorécepteur rd1. (C) Simulation de diabète sucré de type 2 (DT2) sur la rétine WT à l’aide du traitement par 2 désoxy-glucose (2-DG). L’analyse tunel a été exécutée sur des spécimens de NT et de T2DM. La quantification indique une augmentation très significative de la mort cellulaire. Veuillez cliquer ici pour voir une version agrandie de cette figure
Tableau S1. Veuillez cliquer ici pour télécharger le tableau
Tableau S2. Veuillez cliquer ici pour télécharger le tableau
Tableau S3. Veuillez cliquer ici pour télécharger le tableau
Discussion
Le protocole présenté décrit les cultures organotypiques d’explant de la rétine de souris avec RPE intact dans le milieu R16 défini, exempt de sérum et d’antibiotiques. Ce protocole a été développé à l’origine à partir de la fin des années 19807,28 et depuis lors, il a été continuellement affiné6,11,12. Parmi les applications notables, on peut citer les études sur les mécanismes de la dégénérescence rétinienne héréditaire et l’identification des médicaments rétinoprotecteurs23,29,30.
Pour une expérience réussie, certaines considérations importantes doivent être prises en compte. Voici quelques points de dépannage importants pour aider à améliorer la qualité des cultures. Tout d’abord, les cultures rétiniennes peuvent présenter un pliage excessif et/ou une formation de rosettes31. Cela peut être causé en touchant la rétine avec une pince pendant la procédure d’explantation. De plus, le corps ciliaire doit être complètement retiré de l’explant, car cela peut augmenter le repliement rétinien pendant la culture. Deuxièmement, lors du transfert de la rétine à la plaque de puits dans une goutte suspendue, si la rétine fait face à la membrane du mauvais côté vers le bas, gardez-la dans la goutte suspendue à la pointe de la pipette et poussez très doucement le milieu dans et hors de la pointe (sans détacher la goutte suspendue) pour retourner la rétine. Enfin, si le RPE reste attaché à la sclérotique et se détache de la rétine, il est très probablement causé par une prédigestion insuffisante de la sclérotique. Ce problème pourrait être particulièrement important lorsque vous travaillez avec des yeux d’animaux plus âgés ou d’espèces non rongeurs (p. ex. porcs) et peut être résolu en augmentant la concentration de protéinase K.
La conduite des cultures rétiniennes organotypiques d’explant est une procédure complexe qui exige la formation et l’expérience adéquates. Le manque de formation peut entraîner une variabilité de la qualité des explants rétiniennes. Pour ces raisons, il est important de surveiller et de vérifier la viabilité et la reproductibilité, en caractérisant, par exemple, le taux de mort cellulaire avec le test TUNEL. L’utilisation d’un milieu sans antibiotiques rend les explants rétiniens vulnérables à la contamination par des bactéries et des champignons. Pour minimiser ce risque, nous recommandons que des précautions particulières soient prises pour travailler dans des conditions vraiment aseptiques. Une autre limitation de la culture rétinienne in vitro sont les différences dans l’environnement physiochimique par rapport à la rétine in vivo (par exemple, l’approvisionnement en sang choroïde et rétinien, les niveaux d’oxygène et de glucose, la pression intraoculaire, la composition du vitré). Un système de perfusion continue, peut-être intégré dans un bioréacteur dédié32 pourrait rapprocher ce modèle de la condition in vivo. En outre, l’axotomy du nerf optique au cours de la dissection rétinienne conduira à la mort cellulaire ganglionnaire, qui peut induire des réponses de stress8. Par conséquent, il est recommandé de laisser l’explant s’adapter aux conditions de culture pendant au moins 2 jours in vitro avant d’être soumis à une manipulation ou à un traitement spécifique.
La méthode décrite est généralement réalisée sur des tissus rétiniennes immatures, qui peuvent bien survivre pendant 4 semaines in vitro7,33. Cependant, la procédure est adaptable à une variété d’applications, y compris la culture de la rétine adulte. Bien que différentes approches publiées décrivent l’isolement de la rétine adulte sans son RPE34,35,l’incubation avec une solution de papaïne jusqu’à 1 h à 37 °C avant la dissection permet au RPE de rester attaché à la rétine même lorsqu’il est dérivé d’une souris adulte36.
Le milieu sans sérum et l’environnement in vitro chimiquement défini permettent une manipulation entièrement définie et reproductible des conditions expérimentales. Par conséquent, les cultures d’explantations rétiniennes organotypiques sont des outils précieux dans le domaine de l’ophtalmologie et des neurosciences, et ont été utilisées pour l’étude des maladies de la rétine37,le développement de la rétine38,39,la thérapie par cellules souches rétiniennes40,les modifications génétiques41et le dépistage pharmacologique. À titre d’exemple spécifique de test de médicaments, nous avons utilisé ici des cultures explantes rétiniennes pour tester un analogue des BPF (CN003), connu pour réduire la mort cellulaire des photorécepteurs chez des modèles animaux pour la maladie rétinienne héréditaire23 (Figure 3B). Une autre application possible de la technique est décrite à la figure 3C,qui illustre comment le contrôle précis de l’environnement tissulaire peut être exploité pour émuler les affections diabétiques24. En raison de la conservation de l’architecture de tissu au cours de toute la période de culture, les cultures rétiniennes organotypiques d’explant conviennent également aux études électrophysiologiques. La fonctionnalité neuronale sur les explants rétiniennes a été étudiée à l’aide de l’enregistrementpatch-clamp 42 et de l’enregistrement multi-électrodes (MEA)33,43. Ce dernier permet d’enregistrer l’activité électrique des populations neuronales en même temps et a été exploité pour caractériser la fonctionnalité des cellules photorécepteurs et ganglionnaires dans des conditions de culture. Dans une perspective plus large, les systèmes organotypiques de culture d’explants peuvent également être appliqués dans la recherche préclinique, où des cultures d’explants ont été utilisées pour tester l’efficacité thérapeutique de l’hypothermie44.
La technique de culture d’explants organotypiques est relativement simple à réaliser et, comparée aux expériences in vivo correspondantes, est moins coûteuse et prend moins de temps, et évite les préoccupations éthiques liées aux études sur les animaux vivants. Le contrôle précis des conditions expérimentales et la préservation du RPE et de la complexité tissulaire font de la méthode un outil précieux pour améliorer nos connaissances sur la physiologie et la physiopathologie rétiniennes et permettre de nombreuses applications expérimentales.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ces travaux de recherche ont reçu le soutien financier de l’Union européenne (transMed; H2020-MSCA-765441), le conseil allemand de la recherche (DFG; PA1751/8-1, 10-1) et le Conseil des bourses d’études de la Chine.
matériels
| Name | Company | Catalog Number | Comments |
| Biotin | Sigma | B4639 | |
| (+/-)-α-LipoicAcid (=Thiotic acid) | Sigma | T1395 | |
| BSA | Sigma | B4639 | |
| CDP-Choline-Na | Sigma | 30290 | |
| Corticosterone | Sigma | C2505 | |
| CuSO4 × 5H2O | Sigma | C8027 | |
| DL-Tocopherol | Sigma | T1539 | |
| Ethanolamine | Sigma | E0135 | |
| FCS | Sigma | F7524 | |
| Filtropur BT100, 1L, 0.2µm | SARSTEDT | 83.3942.101 | for Basal Medium |
| Forceps | F.S.T | 15003-08 | |
| Glutamine | Sigma | G8540 | |
| Glutathione | Sigma | G6013 | |
| Insulin | Sigma | I6634 | |
| L-CysteineHCl | Sigma | C7477 | |
| Linoleic Acid | Sigma | L1012 | |
| Linolenic Acid | Sigma | L2376 | |
| MnCl2 x 4H2O | Sigma | M5005 | |
| Na-pyruvate | Sigma | P3662 | |
| NaSeO3 x 5H2O | Sigma | S5261 | |
| Ophthalmic microscope scaping spoon | F.S.T. | 10360-13 | |
| Progesteron | Sigma | P8783 | |
| Proteinase K | MP Biomedicals | 21935025 | 44 mAnson U/mg |
| R16 | Gibco | 07491252A | |
| Retinol | Sigma | R7632 | |
| Retinyl acetate | Sigma | R7882 | |
| Scissors | F.S.T | 15004-08 | |
| Sterile filter 0.22µm | MILLEX GP | SLGP033RS | for supplements |
| T3 | Sigma | T6397 | |
| Tocopherylacetate | Sigma | T1157 | |
| Transferrin | Sigma | T1283 | |
| Transwell permeable supports | Corning | 3412 | |
| Vitamin B1 | Sigma | T1270 | |
| Vitamin B12 | Sigma | V6629 | |
| Vitamin C | Sigma | A4034 |
Références
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
- Llonch, S., Carido, M., Ader, M. Organoid technology for retinal repair. Developmental Biology. 433 (2), 132-143 (2018).
- Mencl, S., Trifunović, D., Zrenner, E., Paquet-Durand, F. PKG-dependent cell death in 661W cone photoreceptor-like cell cultures (experimental study). Advances in Experimental Medicine and Biology. 1074, 511-517 (2018).
- Sanges, D., Comitato, A., Tammaro, R., Marigo, V. Apoptosis in retinal degeneration involves cross-talk between apoptosis-inducing factor (AIF) and caspase-12 and is blocked by calpain inhibitors. Proceedings of the National Academy of Sciences of the United States of America. 103 (46), 17366-17371 (2006).
- Schnichels, S., et al. Retina in a dish: cell cultures, retinal explants and animal models for common diseases of the retina. Progress in Retinal and Eye Research. , 100880 (2020).
- Paquet-Durand, F., Hauck, S. M., van Veen, T., Ueffing, M., Ekström, P. PKG activity causes photoreceptor cell death in two retinitis pigmentosa models. Journal of Neurochemistry. 108 (3), 796-810 (2009).
- Caffe, A. R., Visser, H., Jansen, H. G., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical and Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Arango-Gonzalez, B., et al. In vivo and in vitro development of S- and M-cones in rat retina. Investigative Ophthalmology and Visual Science. 51 (10), 5320-5327 (2010).
- Strauss, O. The retinal pigment epithelium in visual function. Physiological Reviews. 85 (3), 845-881 (2005).
- Söderpalm, A., Szél, A., Caffé, A. R., van Veen, T. Selective development of one cone photoreceptor type in retinal organ culture. Investigative Ophthalmology and Visual Science. 35 (11), 3910-3921 (1994).
- Caffe, A. R., et al. Mouse retina explants after long-term culture in serum free medium. Journal of Chemical Neuroanatomy. 22 (4), 263-273 (2001).
- Caffe, A. R., Soderpalm, A. K., Holmqvist, I., van Veen, T. A combination of CNTF and BDNF rescues rd photoreceptors but changes rod differentiation in the presence of RPE in retinal explants. Investigative Ophthalmology and Visual Science. 42 (1), 275-282 (2001).
- Ogilvie, J. M., Speck, J. D., Lett, J. M., Fleming, T. T. A reliable method for organ culture of neonatal mouse retina with long-term survival. Journal of Neuroscience Methods. 87 (1), 57-65 (1999).
- Keeler, C. E. The inheritance of a retinal abnormality in white mice. Proceedings of the National Academy of Sciences of the United States of America. 10 (7), 329-333 (1924).
- Romijn, H. J. Development and advantages of serum-free, chemically defined nutrient media for culturing of nerve tissue. Biology of the Cell. 63 (3), 263-268 (1988).
- Caffe, A. R., et al. Mouse retina explants after long-term culture in serum free medium. Journal of Chemical Neuroanatomy. 22 (4), 263-273 (2001).
- Alarautalahti, V., et al. Viability of Mouse Retinal Explant Cultures Assessed by Preservation of Functionality and Morphology. Investigative Ophthalmology and Visual Science. 60 (6), 1914-1927 (2019).
- Caffe, A. R., Visser, H., Jansen, H. G., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Farber, D. B., Lolley, R. N. Cyclic guanosine monophosphate: elevation in degenerating photoreceptor cells of the C3H mouse retina. Science. 186 (4162), 449-451 (1974).
- Arango-Gonzalez, B., et al. Identification of a common non-apoptotic cell death mechanism in hereditary retinal degeneration. PloS One. 9 (11), 112142 (2014).
- Loo, D. T. In situ detection of apoptosis by the TUNEL assay: an overview of techniques. Methods in Molecular Biology. 682, 3-13 (2011).
- Vighi, E., et al. Combination of cGMP analogue and drug delivery system provides functional protection in hereditary retinal degeneration. Proceedings of the National Academy of Sciences of the United States of America. 115 (13), 2997-3006 (2018).
- Valdés, J., et al. Organotypic retinal explant cultures as in vitro alternative for diabetic retinopathy studies. Altex. 33 (4), 459-464 (2016).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: from diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), (2019).
- Slepak, V. Z., Hurley, J. B. Mechanism of light-induced translocation of arrestin and transducin in photoreceptors: interaction-restricted diffusion. IUBMB Life. 60 (1), 2-9 (2008).
- Paquet-Durand, F., et al. A retinal model of cerebral malaria. Scientific Reports. 9 (1), 3470 (2019).
- Romijn, H. J., de Jong, B. M., Ruijter, J. M. A procedure for culturing rat neocortex explants in a serum-free nutrient medium. Journal of Neuroscience Methods. 23 (1), 75-83 (1988).
- Azadi, S., et al. CNTF+BDNF treatment and neuroprotective pathways in the rd1 mouse retina. Brain Research. 1129 (1), 116-129 (2007).
- Kaur, J., et al. Calpain and PARP activation during photoreceptor cell death in P23H and S334ter rhodopsin mutant rats. PloS One. 6 (7), 22181 (2011).
- Samardzija, M., et al. A mouse model for studying cone photoreceptor pathologies. Investigative Ophthalmology and Visual Science. 55 (8), 5304-5313 (2014).
- Achberger, K., et al. Merging organoid and organ-on-a-chip technology to generate complex multi-layer tissue models in a human retina-on-a-chip platform. eLife. 8, (2019).
- Alarautalahti, V., et al. Viability of Mouse Retinal Explant Cultures Assessed by Preservation of Functionality and Morphology. Investigative Ophthalmology and Visual Science. 60 (6), 1914-1927 (2019).
- Ferrer-Martín, R. M., et al. Microglial cells in organotypic cultures of developing and adult mouse retina and their relationship with cell death. Experimental Eye Research. 121, 42-57 (2014).
- Müller, B. Organotypic culture of adult mouse retina. Methods in Molecular Biology. 1940, 181-191 (2019).
- Heller, J. P., Kwok, J. C., Vecino, E., Martin, K. R., Fawcett, J. W. A method for the isolation and culture of adult rat Retinal Pigment Epithelial (RPE) cells to study retinal diseases. Frontiers in Cellular Neuroscience. 9, 449 (2015).
- Sahaboglu, A., et al. Retinitis pigmentosa: rapid neurodegeneration is governed by slow cell death mechanisms. Cell Death & Disease. 4 (2), 488 (2013).
- Arai, E., et al. Ablation of Kcnj10 expression in retinal explants revealed pivotal roles for Kcnj10 in the proliferation and development of Müller glia. Molecular Vision. 21, 148-159 (2015).
- Demas, J., Eglen, S. J., Wong, R. O. Developmental loss of synchronous spontaneous activity in the mouse retina is independent of visual experience. Journal of Neuroscience. 23 (7), 2851-2860 (2003).
- Johnson, T. V., Martin, K. R. Development and characterization of an adult retinal explant organotypic tissue culture system as an in vitro intraocular stem cell transplantation model. Investigative Ophthalmology and Visual Science. 49 (8), 3503-3512 (2008).
- Hatakeyama, J., Kageyama, R. Retrovirus-mediated gene transfer to retinal explants. Methods. 28 (4), 387-395 (2002).
- Moritoh, S., Tanaka, K. F., Jouhou, H., Ikenaka, K., Koizumi, A. organotypic tissue culture of adult rodent retina followed by particle-mediated acute gene transfer in vitro. PloS One. 5 (9), 12917 (2010).
- Reinhard, K., et al. Step-by-step instructions for retina recordings with perforated multi electrode arrays. PloS One. 9 (8), 106148 (2014).
- Klemm, P., et al. Hypothermia protects retinal ganglion cells against hypoxia-induced cell death in a retina organ culture model. Clinical and Experimental Ophthalmology. 47 (8), 1043-1054 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon