Method Article
통가 경사진 마우스 망막의 장기, 세럼 없는 재배는 그대로 망막 색소 상피와 함께 익스처스
요약
프로토콜은 혈청과 항생제가 없는 R16 정의 배지에서 망막 색소 상피 (RPE)와 함께 재배 된 마우스 신경망막의조직화 각질을 설명합니다. 이 방법은 생체 내 실험과 비교할 때 비교적 간단하고, 비용이 적게 들고, 시간이 많이 소요되며, 수많은 실험 응용 프로그램에 적응할 수 있다.
초록
안과 연구에서는 신경 망막의 체외 모델에 대한 강력한 필요성이 있습니다. 여기에서, 우리는 그대로 망막 안료 상피 (RPE)와 마우스 신경망막의 조직화 에 대한 상세한 프로토콜을 제시한다. 연구 질문에 따라 망막은 야생 형 동물이나 질병 모델에서 분리 되어 당뇨병 성 망막 병증 또는 유전 망막 변성을 연구할 수 있습니다. 이른 산후 날부터 눈은 2-9 동물이 무균 조건에서 방출됩니다. 그들은 부분적으로 단백질 제 K에서 소화되어 RPE에서 코로이드를 분리할 수 있습니다. 입체 스코프에서, 작은 절개는 코로이드와 clera 부드럽게 RPE와 신경 망막에서 벗겨질 수있는 곳에서 두 개의 가장자리를 만드는 각막에서 만들어집니다. 그런 다음 렌즈를 제거하고 안구가 4점으로 절단되어 클로버 잎과 유사한 4쐐기 모양을 제공합니다. 조직은 마침내 폴리카보네이트 배양 막을 들고 있는 세포 배양 삽입체로 매달려 있는 낙하로 옮겨집니다. 배양은 완전히 정의된 조건하에서 혈청 이나 항생제없이 R16 배지에서 유지되며, 매 2 일마다 중간 변화가 있습니다.
설명된 절차는 망막의 격리 및 적어도 2 주의 배양 기간에 대한 그것의 일반적인 생리학 및 조직적인 맥락의 보존을 가능하게 합니다. 이러한 특징은 organotypic 망막 박종 배양을 망막 발달, 질병 메커니즘 및 전기 생리학에 대한 연구를 위한 높은 예측 가치를 가진 우수한 모델로 만드는 동시에 약리학적 스크리닝을 가능하게 합니다.
서문
안과 연구에서, 1차 망막 세포 배양, 망막 유래 세포주, 망막 오르가노이드, 생체내 동물 모델1,2,3,4,5를포함한 다양한 모델이 망막을 연구할 수 있다. 그러나 이러한 각 모델은 단점으로 고통받습니다. 예를 들면, 망막은 세포 대 세포 상호 작용의 다수와 복잡한 네트워크 인 동안 세포는 격리에서 증가합니다. 따라서, 고립된 세포 배양의 행동은 전체 조직에서 관찰된 것과 비교하여 인공적일 가능성이 높다. 이 문제는 부분적으로 시험관 내 분화 된 망막 오르가노이드를 사용하여 해결할 수 있으며, 이는 발달 및 기초 생물학6을연구하는 데 사용할 수 있습니다. 그러나, 오늘 현재, 망막 오르가노이드 생성은 여전히 시간이 많이 소요되고, 노동 집약적이며, 재현성 문제로 고통받고 있으며, 오르가노이드가 번역 망막 연구에 사용되기 전에 실질적인 추가 개발 작업이 필요합니다. 마지막으로, 살아있는 동물에 대한 연구는 틀림없이 안과 연구의 요구 사항에 가장 가까운 모델이지만, 강한 윤리적 관심사와 관련이 있습니다. 세포 배양 시스템의 효율성과 생체 내 동물 모델의 실제 상황 사이의 좋은 타협은 조직적인 망막 박종 배양이다. 이러한 문화권은 생체 내정간섭이 수행되지 않으므로 동물의 고통을 감소시다.
여러 가지 방법으로 는 상이한종으로부터망막 각종을 배양하기 위해 기술되었다5,7,8. 우리의 프로토콜은 망막 안료 상피 (RPE)와 함께 마우스 신경 망막의 격리를위한 기술을 설명합니다. 이 기술은 또한 쥐 망막 배양에 적합 할 것이다9. 그것의 RPE와 함께 신경 망막의 문화는 성공을 위한 중요한 중요성입니다. RPE는 망막에 필수적인 기능을 수행합니다 : 영양분, 이온, 물, 광산화에 대한 빛의 흡수 및 광산화에 대한 보호, 모든 트랜스 망막의 재 isomerization 11-cis-망막으로 의 전환, 이는 시각적 주기에 매우 중요합니다, 광수용체 막의 phagocytosis, 및 구조적 인 요소의 비밀10구조적 무결성을 위한 필수 요소의 백티나 1. RPE를 유지하면 광수용체 외부 및 내부 세그먼트를 성공적으로 개발하여 망막을 장기간11동안사용할 수 있게 합니다. 아래에 설명된 절차는 적어도 2 주 동안 망막의 조직및 생리적 특성을보존12. 더욱이, 세럼이 없고 항생제 없는 배지에서 조직적인 망막 이주를 배양하면 알 수 없는 물질의 존재를 피하고결과(12)를간단하게 해석할 수 있다.
Organotypic 망막 소멸 문화는 망막 발달 및 변성7,13,14에대한 지식을 향상시키는 데 필수적이었습니다. 우리는 그(것)들이 또한 약리학 검열을 위한 유용한 공구이고 당뇨병 망막증을 포함하여 망막 질병의 각종 모형을 위해 이용될 수 있다는 것을 여기에서 보여줍니다.
프로토콜
동물 보호의 독일 법의 §4를 준수하는 동물 프로토콜은 동물 보호에 대한 튀빙겐 대학위원회에 의해 검토및 승인되었다(아인리히퉁 퓌르 Tierschutz, Tierärztlichen Dienst und Labortierkunde; 등록 번호 AK02/19M). 본 연구에서, 망막은 야생형(WT) 및 rd1 마우스로부터 수득되었으며, 후자는 유전망변성(15)에대한 잘 특징적인 모델이다. 마우스는 표준 백색 순환 조명 아래에 보관되었고, 음식과 물에 자유롭게 접근할 수 있었으며, 성별에 관계없이 사용되었습니다.
1. 체크리스트
- 멸균 상태를 보장하고 오염을 방지하기 위해 70 %의 에탄올로 라미나르 공기 흐름 후드를 청소하고 소독하십시오. 망막 문화의 중독을 방지하기 위해 에탄올이 완전히 증발하도록하십시오.
- 자동 클랩 도구 (예 : 가위, 집게 및 안과 현미경 스크래핑 숟가락)을 사용하기 전에.
- 멸균 조건하에서 라미나르-플로우 후드 하에서 다음 매체를 사전에 준비: 기저 R16 배지(BM) (4주 동안 4°C에 보관할 수 있음), BM20% 태아 종아리 혈청(FCS) (동일 사용), BM(0).12% 단백질Ae K (44 mAnson U/mg) 용액 (당일 사용) 및 전체 R16 단백질 (CM) 로미진에 의해 설명 된 (3 주 동안 4 °C에 저장할 수 있습니다) (표 S1 참조, S2, 및 S3).
- 37°C에서 단백질Ae K 용액을 예열하여 활성화하고 2.5 단계에서 사용하십시오.
2. 준비
- 산후 날(P) 5에서 rd1/WT동물을 희생하여 참수합니다. P11 보다 오래된 동물의 경우 현지 동물 보호 규정에 따라 CO2 및/또는 자궁 경부 탈구를 사용합니다.
- 동물의 나이에 따라, enucleation 전에, 필요한 경우, 집게를 사용하여 눈 뚜껑을 열고 매우 신중하게 아래 눈을 긁거나 긁히지 않고, 눈 뚜껑을 분리.
- 구부러진 집게를 사용하여 입체 범위 아래에서 눈을 빠르게 방출합니다.
- 실온(RT)에서 5분 동안 BM의 눈을 배양합니다.
- 예열된 BM에서 눈을 배양하고, 15분 동안 37°C에서 0.12%의 단백질아제 K를 섭취한다.
- 멸균 상태를 보장하기 위해 라미나르 공기 흐름 후드 내부의 다음 단계를 수행합니다. 단백질을 비활성화하려면 눈을 20% FCS를 함유한 BM으로 옮기고 RT에서 5분 동안 배양합니다.
- RT에서 신선한 BM이 함유된 페트리 접시에서 입체스코프 아래 눈을 해부합니다. 시간이 길수록 망막을 해부하기가 더 어려워지고 눈이 매우 부드러워집니다.
- 집게로 시신경에서 눈을 잡으시면 눈을 잡으라. 미세 한 가위를 사용 하 여 각막에 작은 절개를 만들어 2 가장자리에서 각막, choroid 및 clera 부드럽게 좋은 집게의 2 쌍을 사용 하 여 껍질을 벗길 수 있습니다(그림 1 단계 A-C). 또는 좁은 게이지 캐뉼라를 사용하여 각막에 첫 번째 절개를 한 다음 가위 블레이드 중 하나를 개구부에 삽입합니다.
- 미세 한 집게로 렌즈를 잡습니다. 첫 번째 집게가 두 번째 집게사이에 있도록 두 번째 집게를 첫 번째 집게에 수직으로 놓습니다. 당기면 안경에서 렌즈를 추출합니다. 유리체와 섬모 체가 여전히 망막에 부착되어 있는 경우 조심스럽게 제거하십시오(그림1단계 D).
참고: 2.7.1 단계 및 2.7.2 단계는 연습이 필요하며 망막을 손상시키지 않도록주의하십시오. - 망막을 가장자리에 수직으로 4점으로 자르고 4잎 클로버모양(그림 1단계 E-F)을 만듭니다.
- 1mL 팁의 광범위하게 절단된 베이스가 있는 파이펫을 사용하여 망막을 중간 방울에 넣고 6웰 배양판에 배치된 배양 접시 필터 인서트로 옮직다. RPE 층은 멤브레인(도1 단계 G)에 직면해야 합니다.
- 파이펫을 사용하여 삽입에서 초과 매체를 조심스럽게 제거합니다.
- 우물의 측면에서, 잘 당 CM의 1 mL을 추가하고 5 % CO2와37 °C에서 멸균 인큐베이터에 인큐베이션. 이 산소를 감소시키고 조직 퇴화를 일으킬 것이기 때문에 매체에 망막을 침수하지 마십시오. 이 박람회는 액체와 공기 사이의 인터페이스에 남아 있어야 하며, 물의 표면 장력에 의해 생성된 액체의 박막으로만 덮여 있어야 합니다.
- 농장 절차 후 회복을 용이하게하기 위해 처음 48 시간 동안 방해받지 않고 망막 을 둡니다.
- 매 2일(48시간)마다 배지를 변경합니다. 각 우물에서 700 μL의 매체를 버리고 900 μL의 신선한 CML을 우물에 추가합니다. 이러한 방식으로, 증발에 의해 손실된 배지의 양이 회수되고 망막 절제는 이전 48h에서 생성된 신경 보호 요인의 일부를 유지한다.
- 제거된 배지를 분리및 폐쇄된 미세원심분리기 튜브에 배양하여 가능한 오염(즉, 매체의 색상 변화)을 제어하고 평가합니다.
참고 : 망막 이절은 적어도 2 주12동안 문화권에 보관 할 수 있습니다.
3. 배양 후
참고 : 각출은 다른 실험 응용 (서양 얼룩, 히스토로지, 전체 마운트, 유전 분석, 전기 생리학)에 사용할 수 있습니다. 응용 프로그램에 따라, organotypic 망막 이출은 동결, lysed, 또는 극저온 절제에 대한 준비 스냅 할 수 있습니다. 아래 단계는 조직학적 준비를 설명합니다.
- 4% 파라포름알데히드(PFA)로 45분 고정을 수행하고, 점진적인 자당 극저온 보호(10분 동안 10%, 실온(RT) 또는 4°C에서 2시간 동안 20분 동안 20%, 30%로 뒤를 이었다. 이러한 버퍼를 우물에 직접 추가합니다.
- 망막 이출 주위의 멤브레인을 잘라냅니다.
- 동결 된 조직을 위한 매체에 막 및 망막 조직을 둘 다 포함.
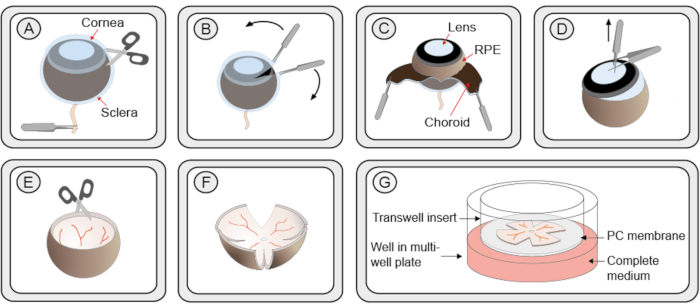
그림 1: organotypic 망막 각성 문화의 준비를위한 단계별 절차. (A)마우스 눈은 망막 및 RPE로부터 의 클레라와 코로이드를 분리할 수 있도록 단백질제 K의 용액으로 에클레아화되고 전달된다. sclera/choroid 층의 작은 컷이 도입됩니다. (B)두 개의 집게는 경쇄/코로이드 층을 껍질을 벗기는 데 사용됩니다. (C)검은 색 코로이드 층은 박리 중에 볼 수 있습니다. 밑줄이 어두운 망막 색소 상피 (RPE)는 안구에 부착 된 상태로 유지됩니다. 조각과 코로이드는 시신경과 함께 제거됩니다. (D)렌즈와 유리체는 집게로 추출됩니다. 남은 섬모 본체가 제거됩니다. (E)망막은 그릇 모양과 같은 모양을 유지합니다. (F)접시에서 배양하기 위한 망막을 평평하게 하기 위해 망막 주위의 동일한 거리에서 4컷을 가위로 만들어 클로버 모양의 모양을 만듭니다. 망막 배양은 절단 된 1 mL 파이펫 팁을 사용하여 6 웰 플레이트에 멤브레인 배양 삽입으로 전달됩니다. 망막은 여전히 그릇 모양의 일부를 유지합니다. 그러나 망막을 둘러싼 과잉 액체를 제거하면 평면 구조로 전개됩니다. (G)배양막 설정에서 망막 배양은 완전한 R16 배지의 용액 위에 다공성 폴리카보네이트(PC) 멤브레인위에 놓여 있다. 생존가능성을 보장하기 위해 배양은 37°C에서 37°C의 가습멸 인큐베이터에 보관해야하며,배지는 48h마다 교체되어야 합니다.
결과
프로토콜을 따른 후, 해부 및 배양망 각질은 도 2에도시된 바와 같이 RPE에서 신경절 세포 층(GCL)에 이르는 뚜렷한 층으로 정상적인 조직 아키텍처를 보존한다. 외부 핵층(ONL) 및 내부 핵층(INL) 크기는 2-3주 동안 대부분 안정적으로 유지되었으며, 이러한 층의 세포 손실과 점진적인 숱이 4주 이상으로 연장될 경우 점점 더 명백해지고 있습니다. 반면 GCL에서는 시신경의 축축술로 인해, 현저한 숱이 일반적으로 배양의 첫 4일 이내에 관찰된다. 그 후, GCL에 남아 있는 세포 인구(주로 변위된 막골 세포)는 또 다른 3-4주17,18,19에대해 계속 실행 가능해질 것이다.
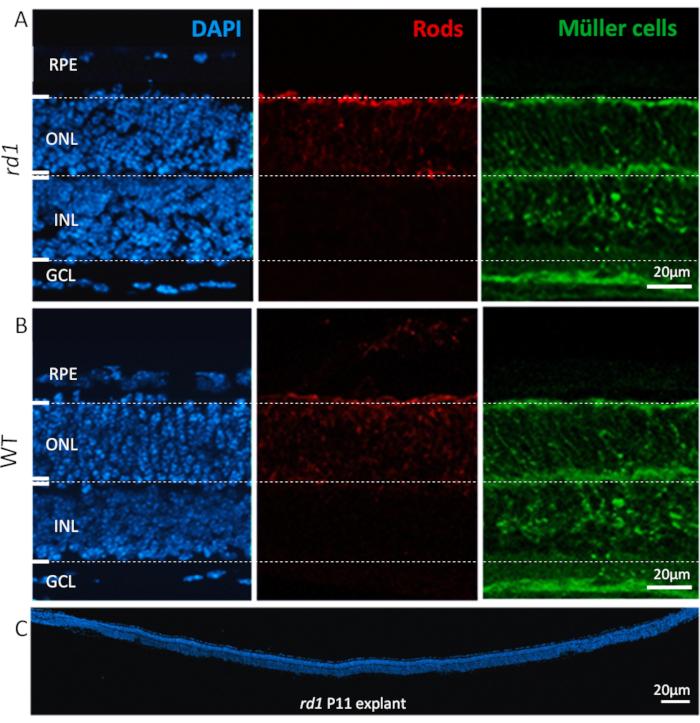
그림 2: 망막 식해 배양에서 발견되는 세포 유형. Rd1 돌연변이(A)및 WT동물(B)에서유래된 P11에서의 망막 박멸 배양은 DAPI(왼쪽, 파란색), 막대 광수용체(중앙, 빨간색) 및 뮐러 세포(오른쪽, 녹색)로 핵 염색을 보여 주는 것이다. 핵 염색은 망막 안료 상피(RPE), 외부 핵층(ONL), 내부 핵층(INL), 및 신경절 세포 층(GCL)과 같은 망막의 모든 주요 세포 층을 강조합니다. 막대 및 뮐러 세포와 같은 핵 층의 특정 세포 유형은 알파알테인(26)과 글루타민 신디라제27 항체로 각각 면역 라벨을 부착한다. (C) DAPI 염색이 망막의 일관성, 통합 및 개발을 강조하여 전체rd1 마우스 망막의 전체 길이 섹션을 표시합니다. 이 망막은 6 일 동안 배양되었습니다. 절차 설명: rd1 또는 WT 동물에서 유래된 망막 및 RPE는 P5에서 분리되고 프로토콜에 설명된 대로 배양되었으며, P11까지 48h마다 중간 변화가 있을 때까지. 배양은 P11에서 4% PFA로 고정되었고 냉동 절제되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
혈청이 없는 매체와 지속적인 체외 환경은 실험 조건을 완전히 제어할 수 있게 합니다. 여기서는 이 프로토콜의 특정 응용 프로그램에 대한 두 가지 예제를 제공합니다.
첫 번째 예는 약물 검사 또는 스크리닝 목적으로 망막 경전을 사용할 가능성을 보여줍니다. Organotypic 망막 각성 배양은 야생 형 (WT) 및 rd1 마우스 모델에서 제조되었다. 후자는 망막변성(15)에대한 잘 특징적인 모델이다. rd1 마우스 망막에서 ONL 변성은 로드 광수용체6,20에서비정상적으로 높은 수준의 cGMP에 의해 유발된다. 과도한 cGMP는세포사멸(21)으로이어지는 순환 뉴클레오티드 게이트 이온 채널(CNGCs) 및 cGMP 의존성 단백질 키나아제(PKG)의 증가된 활성을 일으킨다. cGMP에 구조적 유사체를 가진 rd1 마우스 망막의 처리(경추 뉴클레오티드 #3; PKG와 CNGC를 모두 대상으로 하는 CN003)이 테스트되었습니다. P5에서 방사 후, 도 3A에 기재된 치료 패러다임이 뒤따랐다. 소비 배양은 P11에서 4 % PFA로 고정되어 냉동 절제(그림 3A)에대비했습니다. 치료, 비처리(NT) 및 WT 표본으로부터 조직학적 부분의 세포 사멸을 평가하기 위해, 말단 탈옥핵분디딜 전달제 dUTP 닉 엔드 라벨링(TUNEL)분석(TUNEL) 분석(TUNEL) 분석(22)이 수행되었다. TUNEL 표지 된 세포의 분석은 RD1 처리되지 않은 표본의 ONL에서 죽어가는 세포의 높은 비율을 보였으며, CN003은 50 μM23 (도 3B)의농도로 적용 할 때 rd1 마우스 광수용체를 보호했다.
당뇨병의 빈번한 합병증은 동물 모델에서 충실하게 재현하기 어려운 당뇨병 성 망막증, 눈먼 질병5. 두 번째 예는 타입-2 당뇨병 멜리투스(T2DM)24를에뮬레이트하는 조건 하에서 망막 세포 생존가능성을 특성화하기 위해 organotypic 망막 박멸 배양의 사용을 강조한다. 여기서, 우리는 글리코리시스 억제제 2-deoxy-glucose (2-DG) (2-DG)(2-DG)의 20 mM을 사용하고 P10에서 P11까지 24 시간 동안 배양 배지에 투여하였다. 우리는 이러한 체외 시뮬레이션 당뇨병 조건에 WT 망막 이식을 복종망증(도 3C)의광범위한 신경 세포 죽음에 이르게 것을 보여줍니다. 이 패러다임차례로 그 때, 예를 들면, 퇴행성 기계장치를 공부하거나 당뇨병 맥락에서 망토 보호 처리를 시험하기 위하여 그 때 이용될 수 있습니다.
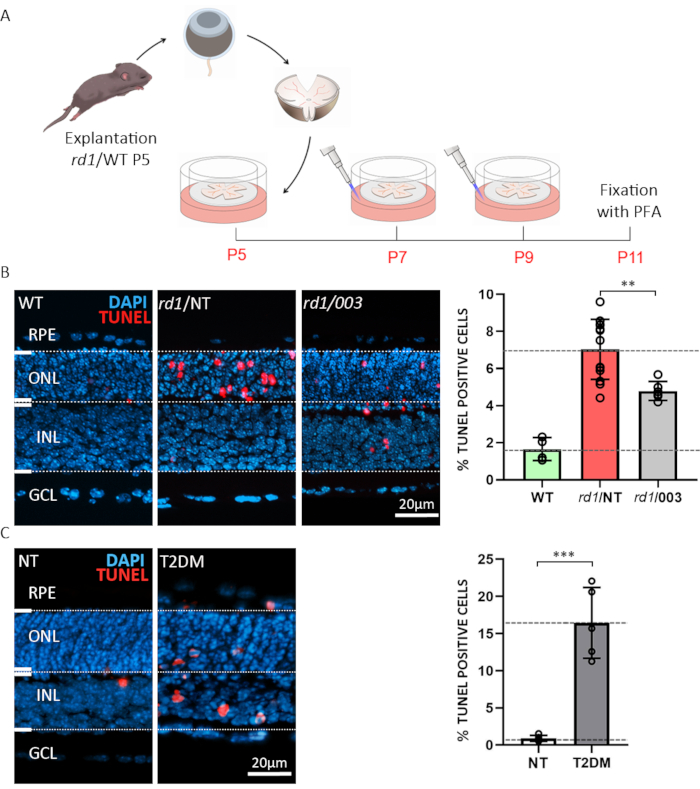
그림 3: organotypic 망막 절제 문화의 응용 에 대한 두 가지 예. (A)절차 설명 : rd1 또는 WT 동물에서 파생 된 망막 과 RPE는 산후 날 (P) 5에서 분리되고 위에서 설명 한 바와 같이 배양되었으며, 매 48 h마다 중간 변화가 있었다. P7 및 P9에서, 소비된 배지는 버려지고 50 μM의 농도에서 활성 화합물을 함유하는 신선한 CM이 플레이트에 첨가되었다. 배양은 P11에서 4% PFA로 고정되었고 냉동 절제되었습니다. (B) rd1 망막에 대한 화합물 테스트. 단면도는 WT로부터, 처리(003) 및 비처리(NT) organotypic 망막 각성 배양으로부터 수득하였다. TUNEL 분석(red)은 세포 사멸을 위한 마커로서 사용되었다. DAPI (파란색)와 핵 염색. 막대 그래프에 표시된 정량화는 WT, rd1 NT 및 rd1 003 조건에서 죽어가는 세포의 백분율을 보여줍니다. 화합물 003을 가진 처리는 rd1 광수용체 세포 사멸을 현저하게 감소시켰습니다. (C)2-deoxy-포도당 (2-DG) 처리를 사용하여 WT 망막에 타입-2 당뇨병 mellitus (T2DM)의 시뮬레이션. TUNEL 분석은 NT 및 T2DM 표본에서 수행되었다. 정량화는 세포 사멸의 매우 유의한 증가를 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 S1. 테이블을 다운로드하려면 여기를 클릭하십시오.
표 S2. 테이블을 다운로드하려면 여기를 클릭하십시오.
표 S3. 테이블을 다운로드하려면 여기를 클릭하십시오.
토론
제시된 프로토콜은 혈청과 항생제가 없는 정의된 R16 배지에서 그대로 RPE를 가진 마우스 망막의 organotypic explant 문화를 설명합니다. 이 프로토콜은 원래 1980 년대 후반7,28에서 시작하여 개발되었으며 그 이후로 지속적으로6,11,12를정제했습니다. 주목할 만한 응용 분야는 유전망변성의 메커니즘에 대한 연구와 망막 보호약의식별(23,29,30)을포함한다.
성공적인 실험을 위해서는 몇 가지 중요한 고려 사항을 고려해야 합니다. 다음은 문화의 질을 향상시키는 데 도움이 되는 몇 가지 중요한 문제 해결 포인트입니다. 첫째, 망막 배양은 과도한 접이식 및/또는 로제트형성(31)을나타낼 수 있다. 이것은 농장 절차 도중 집게로 망막을 만져서 발생할 수 있습니다. 더욱이, 섬모 몸은 배양 중에 망막 접기를 증가시킬 수 있기 때문에, 절제에서 완전히 제거되어야합니다. 둘째, 망막이 매달려 있는 우물판으로 옮기는 동안 망막이 잘못된 면을 마주하면 파이펫 끝에서 매달려 있는 드롭에 보관하고 매우 부드럽게 (매달려 있는 방울을 분리하지 않고) 중간을 끝안팎으로 밀어 망막을 뒤집습니다. 마지막으로, RPE가 망막에서 슬라우라에 부착된 상태로 남아 있다면, 그것은 대부분 슬라메라의 불충분 한 소화불량에 의해 발생. 이 문제는 오래된 동물 또는 비 설치류 종 (예를 들어, 돼지)에서 눈으로 작업 할 때 특히 중요 할 수 있으며 단백질 AE K 농도를 증가시켜 해결할 수 있습니다.
조직망막 식배 는 적절한 훈련과 경험이 필요한 복잡한 절차입니다. 훈련의 부족은 망막 흥분의 질에 있는 가변성으로 이끌어 낼 수 있습니다. 이러한 이유로, 예를 들어 TUNEL 분석과 세포 사멸의 비율을 특징으로 하는 생존력과 재현성을 모니터링하고 확인하는 것이 중요합니다. 항생제없는 배지의 사용은 망막 이질박테리아와 곰팡이에 의한 오염에 취약하게 만듭니다. 이 위험을 최소화하기 위해, 우리는 특별한 주의가 진정으로 무균 조건에서 작동하도록 하는 것이 좋습니다. 체외 망막 배양의 또 다른 제한은 생체 내 망막 (예를 들어, choroidal 및 망막 혈액 공급, 산소 및 포도당 수준, 안구 압력, 유리체의 조성)에 비해 생리화학 적 환경의 차이입니다. 지속적인 관류 시스템, 아마도 전용 생물 반응기에 내장32 생체 내 상태에 가까운이 모델을 만들 수 있습니다. 더욱이, 망막 해부 중 시신경의 축축약은 신경절 세포 사멸로 이어질 것이며, 이는 스트레스 반응을 유도할 수 있다8. 따라서, 특정 조작 또는 치료를 받기 전에 시험관내에서 적어도 2일 동안 배양 조건에 적응하기 위해 자궁을 남겨두는 것이 좋습니다.
상기 기술된 방법은 일반적으로 시험관 내4주 동안 잘 살아남을 수 있는 미숙한 망막 조직에서7,33이다. 그러나, 절차는 성인 망막의 배양을 포함하여 다양한 응용 프로그램에 맞게 조정할 수 있습니다. 상이한 개시된 접근법은 RPE34,35없이성인 망막의 분리를 설명하지만, 해부 전에 37°C에서 최대 1h의 파아플 용액을 가진 배큐어는 RPE가 성인마우스(36)로부터파생된 경우에도 망막에 부착된 상태를 유지할 수 있게 한다.
혈청이 없는 매체와 화학적으로 정의된 체외 환경은 실험 조건의 완전히 정의되고 재현 가능한 조작을 제공합니다. 따라서, organotypic 망막 절제 배양은 안과 및 신경과학 분야에서 귀중한 도구이며, 망막 발달38,39,망막 줄기 세포 치료40,유전자 변형41및 약리학적 스크리닝을 연구하는 데 사용되어 왔다. 약물 검사의 특정 예로, 여기에서 는 상속된 망막질환(23)에 대한 동물 모델에서 광수용체 세포 사멸을 감소시키는 것으로 알려진 cGMP 유사체(CN003)를 테스트하기 위해 망막 박멸 배양을 사용하였다. 기술의 또 다른 가능한 적용은 조직 환경의 정확한 제어가 당뇨조건(24)을에뮬레이트하기 위해 어떻게 악용될 수 있는지를 보여주는 도 3C에기재된다. 전체 배양 기간 동안 조직 아키텍처의 보존으로 인해, 조직망막 각성 배양도 전기 생리학 연구에 적합합니다. 망막 이식에 대한 신경 기능은 패치 클램프레코딩(42) 및 다중 전극 어레이(MEA)레코딩(33,43)을사용하여 조사되었다. 후자는 동시에 신경 인구의 전기 활성의 기록을 허용하고 배양 조건에서 광수용체 및 신경절 세포 기능을 특성화하기 위해 악용되었습니다. 더 넓은 관점에서, organotypic explant 배양 시스템은 또한 저체온증의 치료 효능을 시험하기 위하여 해소 배양을 이용한 전 임상 연구에서 적용될 수있다(44).
organotypic 절제 기술은 수행하기가 비교적 간단하며 생체 내 실험에 대응하는 것과 비교할 때 비용이 저렴하고 시간이 많이 소요되며 살아있는 동물 연구와 관련된 윤리적 우려를 피합니다. 실험 조건과 RPE 및 조직 복잡성의 보존에 대한 정밀한 제어는 이 방법을 망막 생리학 및 병리학에 대한 지식을 개선하고 수많은 실험 응용 프로그램을 가능하게 하는 귀중한 도구입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구 작업은 유럽 연합(트랜스Med)에서재정 지원을 받았다; H2020-MSCA-765441), 독일 연구 위원회 (DFG; PA1751/8-1, 10-1) 및 중국 장학금 협의회.
자료
| Name | Company | Catalog Number | Comments |
| Biotin | Sigma | B4639 | |
| (+/-)-α-LipoicAcid (=Thiotic acid) | Sigma | T1395 | |
| BSA | Sigma | B4639 | |
| CDP-Choline-Na | Sigma | 30290 | |
| Corticosterone | Sigma | C2505 | |
| CuSO4 × 5H2O | Sigma | C8027 | |
| DL-Tocopherol | Sigma | T1539 | |
| Ethanolamine | Sigma | E0135 | |
| FCS | Sigma | F7524 | |
| Filtropur BT100, 1L, 0.2µm | SARSTEDT | 83.3942.101 | for Basal Medium |
| Forceps | F.S.T | 15003-08 | |
| Glutamine | Sigma | G8540 | |
| Glutathione | Sigma | G6013 | |
| Insulin | Sigma | I6634 | |
| L-CysteineHCl | Sigma | C7477 | |
| Linoleic Acid | Sigma | L1012 | |
| Linolenic Acid | Sigma | L2376 | |
| MnCl2 x 4H2O | Sigma | M5005 | |
| Na-pyruvate | Sigma | P3662 | |
| NaSeO3 x 5H2O | Sigma | S5261 | |
| Ophthalmic microscope scaping spoon | F.S.T. | 10360-13 | |
| Progesteron | Sigma | P8783 | |
| Proteinase K | MP Biomedicals | 21935025 | 44 mAnson U/mg |
| R16 | Gibco | 07491252A | |
| Retinol | Sigma | R7632 | |
| Retinyl acetate | Sigma | R7882 | |
| Scissors | F.S.T | 15004-08 | |
| Sterile filter 0.22µm | MILLEX GP | SLGP033RS | for supplements |
| T3 | Sigma | T6397 | |
| Tocopherylacetate | Sigma | T1157 | |
| Transferrin | Sigma | T1283 | |
| Transwell permeable supports | Corning | 3412 | |
| Vitamin B1 | Sigma | T1270 | |
| Vitamin B12 | Sigma | V6629 | |
| Vitamin C | Sigma | A4034 |
참고문헌
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
- Llonch, S., Carido, M., Ader, M. Organoid technology for retinal repair. Developmental Biology. 433 (2), 132-143 (2018).
- Mencl, S., Trifunović, D., Zrenner, E., Paquet-Durand, F. PKG-dependent cell death in 661W cone photoreceptor-like cell cultures (experimental study). Advances in Experimental Medicine and Biology. 1074, 511-517 (2018).
- Sanges, D., Comitato, A., Tammaro, R., Marigo, V. Apoptosis in retinal degeneration involves cross-talk between apoptosis-inducing factor (AIF) and caspase-12 and is blocked by calpain inhibitors. Proceedings of the National Academy of Sciences of the United States of America. 103 (46), 17366-17371 (2006).
- Schnichels, S., et al. Retina in a dish: cell cultures, retinal explants and animal models for common diseases of the retina. Progress in Retinal and Eye Research. , 100880 (2020).
- Paquet-Durand, F., Hauck, S. M., van Veen, T., Ueffing, M., Ekström, P. PKG activity causes photoreceptor cell death in two retinitis pigmentosa models. Journal of Neurochemistry. 108 (3), 796-810 (2009).
- Caffe, A. R., Visser, H., Jansen, H. G., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical and Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Arango-Gonzalez, B., et al. In vivo and in vitro development of S- and M-cones in rat retina. Investigative Ophthalmology and Visual Science. 51 (10), 5320-5327 (2010).
- Strauss, O. The retinal pigment epithelium in visual function. Physiological Reviews. 85 (3), 845-881 (2005).
- Söderpalm, A., Szél, A., Caffé, A. R., van Veen, T. Selective development of one cone photoreceptor type in retinal organ culture. Investigative Ophthalmology and Visual Science. 35 (11), 3910-3921 (1994).
- Caffe, A. R., et al. Mouse retina explants after long-term culture in serum free medium. Journal of Chemical Neuroanatomy. 22 (4), 263-273 (2001).
- Caffe, A. R., Soderpalm, A. K., Holmqvist, I., van Veen, T. A combination of CNTF and BDNF rescues rd photoreceptors but changes rod differentiation in the presence of RPE in retinal explants. Investigative Ophthalmology and Visual Science. 42 (1), 275-282 (2001).
- Ogilvie, J. M., Speck, J. D., Lett, J. M., Fleming, T. T. A reliable method for organ culture of neonatal mouse retina with long-term survival. Journal of Neuroscience Methods. 87 (1), 57-65 (1999).
- Keeler, C. E. The inheritance of a retinal abnormality in white mice. Proceedings of the National Academy of Sciences of the United States of America. 10 (7), 329-333 (1924).
- Romijn, H. J. Development and advantages of serum-free, chemically defined nutrient media for culturing of nerve tissue. Biology of the Cell. 63 (3), 263-268 (1988).
- Caffe, A. R., et al. Mouse retina explants after long-term culture in serum free medium. Journal of Chemical Neuroanatomy. 22 (4), 263-273 (2001).
- Alarautalahti, V., et al. Viability of Mouse Retinal Explant Cultures Assessed by Preservation of Functionality and Morphology. Investigative Ophthalmology and Visual Science. 60 (6), 1914-1927 (2019).
- Caffe, A. R., Visser, H., Jansen, H. G., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Farber, D. B., Lolley, R. N. Cyclic guanosine monophosphate: elevation in degenerating photoreceptor cells of the C3H mouse retina. Science. 186 (4162), 449-451 (1974).
- Arango-Gonzalez, B., et al. Identification of a common non-apoptotic cell death mechanism in hereditary retinal degeneration. PloS One. 9 (11), 112142 (2014).
- Loo, D. T. In situ detection of apoptosis by the TUNEL assay: an overview of techniques. Methods in Molecular Biology. 682, 3-13 (2011).
- Vighi, E., et al. Combination of cGMP analogue and drug delivery system provides functional protection in hereditary retinal degeneration. Proceedings of the National Academy of Sciences of the United States of America. 115 (13), 2997-3006 (2018).
- Valdés, J., et al. Organotypic retinal explant cultures as in vitro alternative for diabetic retinopathy studies. Altex. 33 (4), 459-464 (2016).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: from diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), (2019).
- Slepak, V. Z., Hurley, J. B. Mechanism of light-induced translocation of arrestin and transducin in photoreceptors: interaction-restricted diffusion. IUBMB Life. 60 (1), 2-9 (2008).
- Paquet-Durand, F., et al. A retinal model of cerebral malaria. Scientific Reports. 9 (1), 3470 (2019).
- Romijn, H. J., de Jong, B. M., Ruijter, J. M. A procedure for culturing rat neocortex explants in a serum-free nutrient medium. Journal of Neuroscience Methods. 23 (1), 75-83 (1988).
- Azadi, S., et al. CNTF+BDNF treatment and neuroprotective pathways in the rd1 mouse retina. Brain Research. 1129 (1), 116-129 (2007).
- Kaur, J., et al. Calpain and PARP activation during photoreceptor cell death in P23H and S334ter rhodopsin mutant rats. PloS One. 6 (7), 22181 (2011).
- Samardzija, M., et al. A mouse model for studying cone photoreceptor pathologies. Investigative Ophthalmology and Visual Science. 55 (8), 5304-5313 (2014).
- Achberger, K., et al. Merging organoid and organ-on-a-chip technology to generate complex multi-layer tissue models in a human retina-on-a-chip platform. eLife. 8, (2019).
- Alarautalahti, V., et al. Viability of Mouse Retinal Explant Cultures Assessed by Preservation of Functionality and Morphology. Investigative Ophthalmology and Visual Science. 60 (6), 1914-1927 (2019).
- Ferrer-Martín, R. M., et al. Microglial cells in organotypic cultures of developing and adult mouse retina and their relationship with cell death. Experimental Eye Research. 121, 42-57 (2014).
- Müller, B. Organotypic culture of adult mouse retina. Methods in Molecular Biology. 1940, 181-191 (2019).
- Heller, J. P., Kwok, J. C., Vecino, E., Martin, K. R., Fawcett, J. W. A method for the isolation and culture of adult rat Retinal Pigment Epithelial (RPE) cells to study retinal diseases. Frontiers in Cellular Neuroscience. 9, 449 (2015).
- Sahaboglu, A., et al. Retinitis pigmentosa: rapid neurodegeneration is governed by slow cell death mechanisms. Cell Death & Disease. 4 (2), 488 (2013).
- Arai, E., et al. Ablation of Kcnj10 expression in retinal explants revealed pivotal roles for Kcnj10 in the proliferation and development of Müller glia. Molecular Vision. 21, 148-159 (2015).
- Demas, J., Eglen, S. J., Wong, R. O. Developmental loss of synchronous spontaneous activity in the mouse retina is independent of visual experience. Journal of Neuroscience. 23 (7), 2851-2860 (2003).
- Johnson, T. V., Martin, K. R. Development and characterization of an adult retinal explant organotypic tissue culture system as an in vitro intraocular stem cell transplantation model. Investigative Ophthalmology and Visual Science. 49 (8), 3503-3512 (2008).
- Hatakeyama, J., Kageyama, R. Retrovirus-mediated gene transfer to retinal explants. Methods. 28 (4), 387-395 (2002).
- Moritoh, S., Tanaka, K. F., Jouhou, H., Ikenaka, K., Koizumi, A. organotypic tissue culture of adult rodent retina followed by particle-mediated acute gene transfer in vitro. PloS One. 5 (9), 12917 (2010).
- Reinhard, K., et al. Step-by-step instructions for retina recordings with perforated multi electrode arrays. PloS One. 9 (8), 106148 (2014).
- Klemm, P., et al. Hypothermia protects retinal ganglion cells against hypoxia-induced cell death in a retina organ culture model. Clinical and Experimental Ophthalmology. 47 (8), 1043-1054 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유