Method Article
A largo plazo, Cultivo Sin Suero De Explantes Organotípicos De La Retina De Ratón Con Epitelio Pigmento Retiniano Intacto
* Estos autores han contribuido por igual
En este artículo
Resumen
El protocolo describe explantes organotípicos de ratón neuroretina,cultivados junto con su epitelio pigmentario retiniano (EPR), en medio definido R16, libre de suero y antibióticos. Este método es relativamente simple de realizar, menos costoso y lento en comparación con los experimentos in vivo, y se puede adaptar a numerosas aplicaciones experimentales.
Resumen
En la investigación oftálmica, hay una fuerte necesidad de modelos in vitro de la neuroretina. Aquí, presentamos un protocolo detallado para el cultivo organotípico de laretina neuradel ratón con el epitelio retiniano intacto del pigmento (RPE). Dependiendo de la pregunta de la investigación, las retinas se pueden aislar de animales de tipo salvaje o de modelos de enfermedades, para estudiar, por ejemplo, la retinopatía diabética o la degeneración hereditaria de la retina. Los ojos de los primeros animales del día postnatal 2-9 son enucleados en condiciones asépticas. Se digieren parcialmente en la proteinasa K para permitir una separación de la coroides del RPE. Debajo del estereoscopio, se hace una pequeña incisión en la córnea creando dos bordes desde donde la coroides y la esclerótica se pueden despegar suavemente del RPE y la neuroretina. La lente se retira, y el ocular se corta en cuatro puntos para darle una forma de cuatro cuñas que se asemeja a una hoja de trébol. El tejido finalmente se transfiere en una gota colgante en un inserto de cultivo celular que sostiene una membrana de cultivo de policarbonato. Los cultivos se mantienen entonces en medio R16, sin suero ni antibióticos, en condiciones totalmente definidas, con un cambio de medio cada dos días.
El procedimiento descrito permite el aislamiento de la retina y la preservación de su contexto fisiológico e histotípico normal para períodos de cultivo de al menos 2 semanas. Estas características hacen culturas retinianas organotypic del explant un modelo excelente con el alto valor profético, para los estudios en el desarrollo retiniano, los mecanismos de la enfermedad, y la electrofisiología, mientras que también permiten la investigación farmacológica.
Introducción
En la investigación oftálmica, una variedad de modelos están disponibles para estudiar la retina, incluyendo cultivos celulares primarios de la retina, líneas celulares derivadas de la retina, organoides de la retina, y modelos animales in vivo 1,2,3,4,5. Sin embargo, cada uno de estos modelos sufre de inconvenientes. Por ejemplo, las células crecen aisladamente mientras que la retina es una red compleja con una multitud de interacciones célula a célula. Por lo tanto, es probable que el comportamiento de los cultivos celulares aislados sea artificial en comparación con el observado en todo un tejido. Este problema puede remediarse en parte utilizando organoides de retina diferenciados in vitro, que pueden utilizarse para estudiar el desarrollo y la biología básica6. Sin embargo, a partir de hoy, la generación de organoides de retina todavía consume mucho tiempo, requiere mucho trabajo y sufre de problemas de reproducibilidad, lo que requiere un trabajo de desarrollo adicional sustancial antes de que los organoides se puedan usar para la investigación retiniana traslacional. Por último, los estudios en animales vivos, si bien podría decirse que es el modelo que más se acerca a los requisitos de la investigación oftálmica, están asociados con fuertes preocupaciones éticas. Un buen compromiso entre la eficacia de los sistemas de cultivo celular y la situación de la vida real de los modelos animales in vivo son los cultivos de explantes retinianos organotípicos. Tales culturas también reducen el sufrimiento animal puesto que no se realizan intervenciones in vivo.
Se han descrito varios métodos para el cultivo de explantes de retina de diferentes especies5,7,8. Nuestro protocolo describe una técnica para el aislamiento del neuroretina del ratón junto con su epitelio retiniano del pigmento (RPE). Esta técnica también será adecuada para cultivos de retina de rata9. La cultura del neuroretina junto con su RPE es de importancia importante para el éxito. El EPR realiza funciones esenciales para la retina: transporte de nutrientes, iones, agua, absorción de luz y protección contra la fotooxidación, re-isomerización de todo-trans-retinal en 11-cis-retinal, que es crucial para el ciclo visual, fagocitosis de membranas fotorreceptoras desprendimiento, y secreción de factores esenciales para la integridad estructural de la retina10. El mantenimiento del RPE permite un desarrollo exitoso de los segmentos externos e internos del fotorreceptor, manteniendo la retina viable durante más tiempo11. El procedimiento descrito a continuación preserva las características histotípicas y fisiológicas de la retina durante al menos dos semanas12. Además, el cultivo de los explantes retinianos organotípicos en medio sérico y libre de antibióticos evita la presencia de sustancias desconocidas y permite una interpretación directa de los resultados12.
Los cultivos organotípicos de explantes retinianos han sido esenciales para mejorar nuestro conocimiento sobre el desarrollo y la degeneraciónde la retina 7,13,14. Mostramos aquí que son también una herramienta útil para la investigación farmacológica y que pueden ser empleados para modelar una variedad de enfermedades retinianas, incluyendo retinopatía diabética.
Protocolo
Los protocolos de animales que cumplen con el §4 de la ley alemana de protección animal fueron revisados y aprobados por el comité de protección animal de la Universidad de Tubinga(Einrichtung für Tierschutz, Tierärztlichen Dienst und Labortierkunde; Inscripción No. AK02/19M). En este estudio, las retinas se obtuvieron de ratones de tipo salvaje (WT) y rd1, siendo este último un modelo bien caracterizado para la degeneración hereditaria de la retina15. Los ratones fueron alojados bajo iluminación cíclica blanca estándar, tenían acceso libre a alimentos y agua, y fueron utilizados independientemente del género.
1. Lista de verificación
- Para garantizar condiciones estériles y evitar contaminaciones, limpie y desinfecte la campana de flujo de aire laminar con etanol al 70%. Asegúrese de dejar que el etanol se evapore por completo, para prevenir la intoxicación de los cultivos de retina.
- Herramientas de autoclave (por ejemplo, tijeras, fórceps y cuchara de raspado de microscopio oftálmico) antes de su uso.
- Prepare los siguientes medios con anticipación bajo una campana de flujo laminar, en condiciones estériles: Medio basal R16 (BM) (puede almacenarse a 4 °C durante 4 semanas), BM con suero de ternero fetal al 20% (FCS) (uso en el mismo día), BM con solución de proteinasa K al 0,12% (44 mAnson U/mg) (uso en el mismo día) y medio R16 completo con suplementos (CM) según lo descrito por Romijn16 (se puede almacenar a 4 °C durante 3 semanas) (ver Tablas S1, S2 y S3).
- Precaliente la solución de proteinasa K a 37 °C para activarla y utilícese en el paso 2.5.
2. Preparación
- Sacrificio rd1/WTanimal en el día postnatal (P) 5 por decapitación. Para los animales mayores de P11, use CO2 y/o luxación cervical, según las regulaciones locales de protección animal.
- Dependiendo de la edad del animal, antes de la enucleación, si es necesario, abra los párpados con espérceps y separe con mucho cuidado los párpados, sin tocar ni rascar el ojo por debajo.
- Enuclee rápidamente los ojos debajo de un estereoscopio usando fórceps curvos.
- Incubar los ojos en BM durante 5 min a temperatura ambiente (RT).
- Incubar los ojos en BM precalentado, con proteinasa K al 0,12% a 37 °C durante 15 min.
- Realice los siguientes pasos dentro de una campana de flujo de aire laminar para garantizar condiciones estériles. Para inactivar la proteinasa K, transferir los ojos a BM que contiene 20% FCS e incubar durante 5 min en RT.
- Diseccione los ojos bajo un estereoscopio, asépticamente, en una placa de Petri que contenga BM fresco en RT. Inicie la disección tan pronto como sea posible después de la enucleación. Cuanto más largo es este tiempo, más difícil es diseccionar la retina, los ojos se vuelven muy suaves.
- Con las fuerzas, mantenga el ojo del nervio óptico. Usando tijeras finas, haga una pequeña incisión en la córnea creando 2 bordes desde donde la córnea, la coroides y la esclerótica se pueden pelar suavemente usando 2 pares de fórceps finos(Figura 1 pasos A-C). Alternativamente, use una cánula de vía estrecha para hacer una primera incisión en la córnea y luego inserte una de las cuchillas de tijera en la abertura.
- Agarre la lente con pórceps finos. Coloque un segundo par de fórceps perpendicularmente a los primeros para que los primeros fórceps estén entre las 2 cañas del segundo. Tire para extraer la lente de la copa del ojo. Si el cuerpo vítreo y el ciliar todavía están unidos a la retina, retírelos cuidadosamente (Figura 1 paso D).
NOTA: Los pasos 2.7.1 y 2.7.2 necesitan práctica y asegúrese de precaución para no dañar la retina. - Corte la retina perpendicular a sus bordes en cuatro puntos, creando una forma de trébol de cuatro hojas(Figura 1 pasos E-F).
- Usando una pipeta con una base ampliamente cortada de una punta de 1 mL, sostenga la retina en una gota colgante de medio y transfiérala a un inserto de filtro de plato de cultivo colocado en un plato de cultivo de 6 pozos. La capa RPE debe estar frente a la membrana(Figura 1 paso G).
- Con una pipeta, retire cuidadosamente el exceso de medio del inserto.
- Desde los lados del pozo, añadir 1 mL de CM por pozo e incubar en una incubadora estéril a 37 °C con un 5% deCO2. No sumerja la retina en el medio, ya que esto reducirá la oxigenación y causará degeneración del tejido. El explant debe permanecer en la interfaz entre el líquido y el aire, cubierto sólo por una fina película de líquido creado por la tensión superficial del agua.
- Deje el explanto retiniano intacto durante las primeras 48 h para facilitar la recuperación después del procedimiento de explantación.
- Cambiar el medio cada dos días (48 h). Deseche 700 μL de medio de cada pozo y agregue 900 μL de CM fresco al pozo. De esta forma, se recupera la cantidad de medio perdido por evaporación y el explante retiniano mantiene algunos de los factores neuroprotectores producidos en las 48 h anteriores.
- Incubar el medio eliminado en un tubo de microcentrífuga separado y cerrado junto con los cultivos para controlar y evaluar la posible contaminación (es decir, el cambio de color del medio).
NOTA: Los explantes de retina se pueden mantener en cultivo durante al menos 2 semanas12.
3. Después de cultivar
NOTA: Los explantes se pueden utilizar para diferentes aplicaciones experimentales (western blot, histología, monturas enteras, análisis genético, electrofisiología). Dependiendo de la aplicación, los explantes organotípicos de la retina pueden congelarse, lisearse o prepararse para la criosección. Los pasos a continuación describen la preparación histológica.
- Realizar una fijación de 45 min con paraformacionaldehído al 4% (APA), seguida de crioprotección gradual de sacarosa (10% de sacarosa durante 10 min, 20% durante 20 min y 30% durante 2 h a temperatura ambiente (RT) o durante la noche (ON) a 4 °C). Agregue estos búferes directamente en el pozo.
- Corte la membrana alrededor de los explantes de la retina.
- Incruste tanto la membrana como el tejido retiniano en el medio para el tejido congelado.
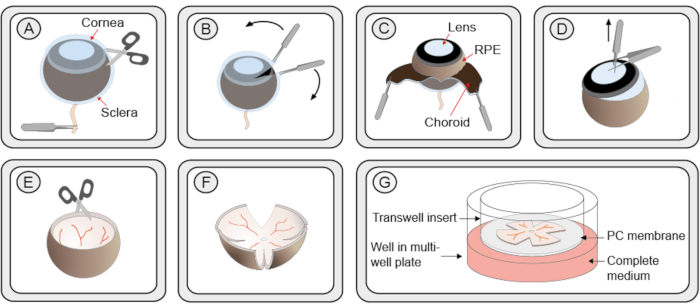
Figura 1: Procedimiento paso a paso para la preparación de cultivos organotípicos de explantes de retina. (A)Los ojos de ratón se enuclean y se transfieren a una solución de proteinasa K para permitir la separación de la esclerótica y la coroides de la retina y el RPE. Se introduce un pequeño corte en la capa esclerótica/coroides. (B) Dos fórceps se utilizan para pelar la esclerótica / capa coroides. (C) La capa coroides negra se puede ver durante el peeling. El epitelio retiniano oscuro (RPE) de subrayado permanece atado al globo ocular. La esclerótica y la coroides se eliminan junto con el nervio óptico. (D) La lente y el vítreo se extraen con fórceps. Se extirpa el cuerpo ciliar restante. (E) La retina conserva una forma de cuenco. (F)Para aplanar la retina para cultivar en un plato, se hacen 4 cortes a igual distancia alrededor de la retina con una tijera, dándole una forma similar a un trébol. El cultivo de retina se transfiere a un inserto de cultivo de membrana en una placa de 6 pozos con el uso de una punta de pipeta cortada de 1 mL. La retina todavía conserva parte de la forma del tazón de fuente. Sin embargo, tras la eliminación del exceso de líquido que rodea la retina, se desplegará a una estructura plana. (G)En la configuración de la membrana de cultivo, el cultivo de retina está descansando sobre una membrana de policarbonato poroso (PC) sobre una solución de medio R16 completo. Para garantizar la viabilidad, el cultivo debe mantenerse en una incubadora estéril humidificada a 37 °C con un 5% de CO2,y el medio debe reemplazarse cada 48 h. Haga clic aquí para ver una versión más grande de esta figura
Resultados
Después de seguir el protocolo, los explantes de retina disecados y cultivados conservan su arquitectura tisular normal, con capas distintas, desde el RPE hasta la capa de células ganglionares (GCL), como se muestra en la Figura 2. El tamaño de la capa nuclear externa (ONL) y de la capa nuclear interna (INL) se mantuvo mayormente estable durante 2-3 semanas, con una pérdida celular de progresión lenta y un adelgazamiento gradual de estas capas cada vez más evidentes si el período de cultivo se prolonga a 4 semanas y más allá. En el GCL, en cambio, debido a el axotomy del nervio óptico, una reducción marcada se observa generalmente dentro de los primeros 4 días de cultivar. Posteriormente, la población celular restante en el GCL (en su mayoría células amacrinas desplazadas) seguirá siendo viable durante otras 3-4 semanas17,18,19.
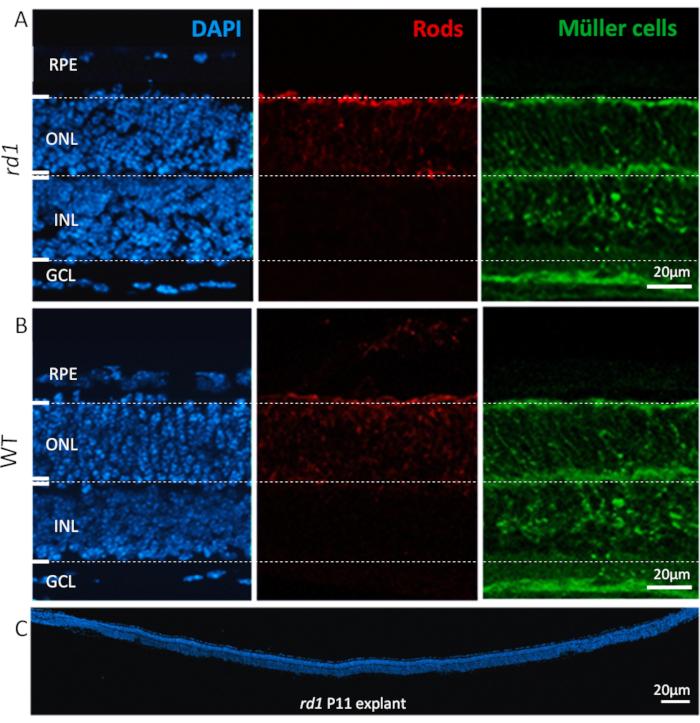
Figura 2 :Tipos de células que se encuentran en el cultivo de explantes de retina. Cultivo de explantes de retina en P11 derivado de animales rd1 mutantes(A)y WT(B)que muestran tinción nuclear con DAPI (izquierda, azul), fotorreceptores de varilla (centro, rojo) y células de Müller (derecha, verde). La coloración nuclear destaca todas las capas celulares principales de la retina tales como, epitelio retiniano del pigmento (RPE), capa nuclear externa (ONL), capa nuclear interna (INL), y capa de la célula del ganglio (GCL). Los tipos específicos de células en las capas nucleares, como las varillas y las células de Müller, se inmunomarcan con alfa arrestina26 y glutamina sintetasa27 anticuerpos, respectivamente. (C)Muestra una sección de longitud completa de toda una retina de ratón rd1, con tinción DAPI destacando la consistencia, integración y desarrollo de la retina. Estas retinas fueron cultivadas por 6 días. Descripción del procedimiento: La retina y el RPE derivados de animales rd1 o WT fueron aislados en P5 y cultivados según lo descrito en el protocolo, hasta P11 con un cambio medio cada 48 h. Las culturas fueron fijadas con el 4% PFA en P11 y cryosectioned. Haga clic aquí para ver una versión más grande de esta figura
El medio libre de suero y el ambiente in vitro sostenido permiten tener un control total sobre las condiciones experimentales. Aquí, proporcionamos dos ejemplos para aplicaciones específicas de este protocolo.
El primer ejemplo ilustra la posibilidad de utilizar explantes de retina para pruebas de drogas o con fines de detección. Las culturas retinianas organotípicas del explant fueron preparadas del salvaje-tipo (PESO) y de los modelos del ratón rd1. Este último es un modelo bien caracterizado para la degeneraciónretiniana 15. En la retina del ratón rd1, la degeneración de ONL es provocada por niveles anormalmente altos de cGMP en los fotorreceptores de varilla6,20. El exceso de cGMP causa una mayor actividad de los canales iónicos bloqueados por nucleótidos cíclicos (CNGCs) y la proteína quinasa dependiente de cGMP (PKG), lo que lleva a la muerte celular21. El tratamiento de las retinas de ratón rd1 con un análogo estructural a cGMP (nucleótido cíclico #3; CN003), que se dirige tanto a PKG como a CNGC, se probó. Después de la explantación en P5, se siguió el paradigma de tratamiento descrito en la Figura 3A. Los cultivos de explantes se fijaron con PFA al 4% en P11 y se prepararon para la criosección(Figura 3A). Para determinar la muerte celular de secciones histológicas de especímenes tratados, no tratados (NT), y del PESO, un análisis terminal22 del extremo de la mella del dUTP de la transferasa del deoxynucleotidyl (TUNEL) fue realizado. El análisis de las células etiquetadas con TUNEL mostró un alto porcentaje de células moribundas en la ONL de las muestras rd1 no tratadas, mientras que cn003 protegió los fotorreceptores de ratón rd1 cuando se aplicaron a una concentración de 50 μM23 (Figura 3B).
Una complicación frecuente de la diabetes es la retinopatía diabética, una enfermedad cegadora difícil de reproducir fielmente en modelos animales5. El segundo ejemplo destaca el uso de cultivos organotípicos de explantes retinianos para caracterizar la viabilidad de las células de la retina en condiciones que emulan la diabetes mellitus tipo 2 (DM2)24. Aquí, utilizamos 20 milímetros del inhibidor de la glucólisis 2-deoxy-glucose (2-DG)25 y lo administramos al medio de cultivo para 24 h de P10 a P11. Mostramos que someter los explantes de retina WT a tales condiciones diabéticas simuladas in vitro conduce a una extensa muerte celular neuronal de la retina(Figura 3C). Este paradigma a su vez puede ser utilizado, por ejemplo, para estudiar mecanismos degenerativos o para probar tratamientos retinoprotectores en un contexto de diabetes.
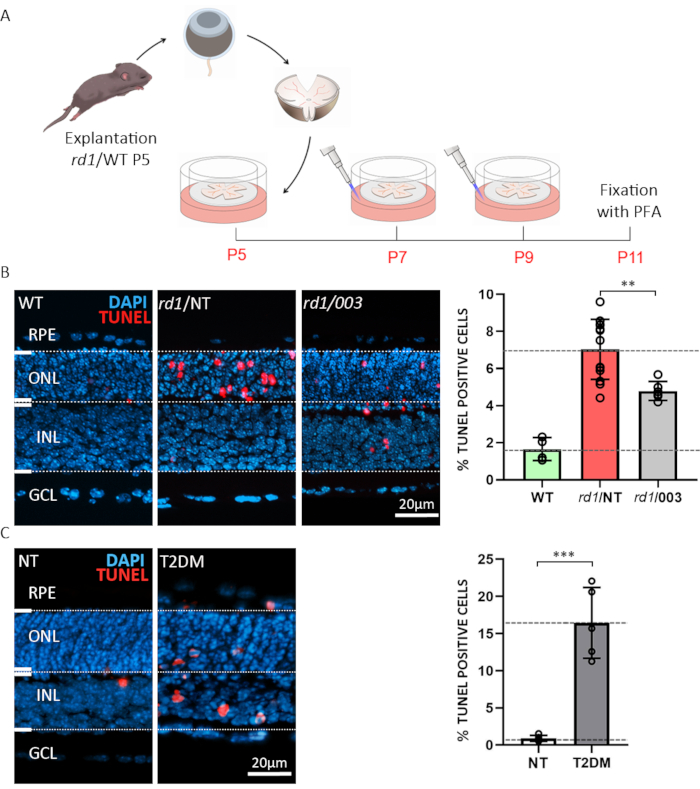
Figura 3:Dos ejemplos para aplicaciones de cultivos organotípicos de explantes de retina. (A)Descripción del procedimiento: Retina y RPE derivados de animales rd1 o WT se aislaron en el día postnatal (P) 5 y se cultivaron como se describió anteriormente, con un cambio de medio cada 48 h. En P7 y P9, el medio gastado fue desechado y el cm fresco que contenía el compuesto activo en una concentración de 50 μM fue añadido a la placa. Las culturas fueron fijadas con el 4% PFA en P11 y cryosectioned. (B)Pruebas compuestas en retina rd1. Las secciones fueron obtenidas del PESO, de las culturas retinianas organotípicas no tratadas (003), y no-tratadas (NT) del explant. El análisis de TUNEL (rojo) fue utilizado como marcador para la muerte celular. Tinción nuclear con DAPI (azul). La cuantificación mostrada en el gráfico de barras ilustra los porcentajes de células moribundas en wt, rd1 NT, y rd1 003 condición. El tratamiento con el compuesto 003 redujo perceptiblemente muerte celular del fotorreceptor rd1. (C)Simulación de diabetes mellitus tipo 2 (DM2) en retina WT utilizando el tratamiento con 2-desoxi-glucosa (2-DG). El análisis de TUNEL fue realizado en especímenes del NT y de T2DM. La cuantificación indica un aumento altamente significativo en la muerte celular. Haga clic aquí para ver una versión más grande de esta figura
Tabla S1. Haga clic aquí para descargar la tabla
Tabla S2. Haga clic aquí para descargar la tabla
Tabla S3. Haga clic aquí para descargar la tabla
Discusión
El protocolo presentado describe cultivos de explantes organotípicos de retina de ratón con RPE intacto en medio R16 definido, libre de suero y antibióticos. Este protocolo fue desarrollado originalmente a partir de finales de la década de 19807,28 y desde entonces se ha refinado continuamente6,11,12. Las aplicaciones notables incluyen estudios sobre los mecanismos de la degeneración hereditaria de la retina y la identificación de fármacos retinoprotectores23,29,30.
Para que un experimento tenga éxito, se deben tener en cuenta algunas consideraciones importantes. Estos son algunos puntos importantes de solución de problemas para ayudar a mejorar la calidad de las referencias culturales. En primer lugar, los cultivos retinianos pueden mostrar un plegamiento excesivo y/o formación de rosetas31. Esto puede ser causado por tocar la retina con un pórceps durante el procedimiento de explantación. Por otra parte, el cuerpo ciliar debe ser completamente eliminado del explant, ya que esto puede aumentar el plegamiento de la retina durante el cultivo. En segundo lugar, durante la transferencia de la retina a la placa del pozo en una gota colgante, si la retina se enfrenta a la membrana del lado equivocado hacia abajo, manténgala en la gota que cuelga de la punta de la pipeta y empuje muy suavemente el medio dentro y fuera de la punta (sin separar la gota colgante) para voltear la retina. Finalmente, si el RPE permanece atado a la esclerótica y se separa de la retina, lo más probable es que sea causado por una predigestión insuficiente de la esclerótica. Este problema podría ser especialmente importante cuando se trabaja con ojos de animales mayores o especies no roedoras (por ejemplo, cerdos) y puede resolverse aumentando la concentración de proteína K.
La realización de cultivos de explantes retinianos organotípicos es un procedimiento complejo que requiere entrenamiento y experiencia adecuados. La falta de entrenamiento puede conducir a la variabilidad en la calidad de los explantes de retina. Por estas razones, es importante monitorear y verificar la viabilidad y reproducibilidad, caracterizando, por ejemplo, la tasa de muerte celular con el ensayo TUNEL. El uso de un medio libre de antibióticos hace que los explantes de retina sean vulnerables a la contaminación por bacterias y hongos. Para minimizar este riesgo, recomendamos que se preste especial atención al trabajo en condiciones verdaderamente asépticas. Otra limitación del cultivo in vitro de la retina son las diferencias en el entorno fisioquímico en comparación con la retina in vivo (por ejemplo, el suministro de sangre coroides y retiniana, los niveles de oxígeno y glucosa, la presión intraocular, la composición del vítreo). Un sistema de perfusión continua, tal vez integrado en un biorreactor dedicado32 podría hacer que este modelo se acerque más a la condición in vivo. Además, la axotomía del nervio óptico durante la disección retiniana conducirá a la muerte de las células ganglionares, que puede inducir respuestas deestrés 8. Por lo tanto, es recomendable que el explant se deje adaptarse a las condiciones de cultivo durante al menos 2 días in vitro antes de que se someta a una manipulación o tratamiento específico.
El método descrito se realiza generalmente en tejidos retinianos inmaduros, que pueden sobrevivir bien durante 4 semanas in vitro7,33. Sin embargo, el procedimiento es adaptable a una variedad de aplicaciones, incluyendo el cultivo de la retina adulta. Aunque diferentes enfoques publicados describen el aislamiento de la retina adulta sin su RPE34,35,la incubación con solución de papaína durante un período de hasta 1 h a 37 °C antes de la disección permite que el RPE permanezca unido a la retina incluso cuando se deriva de un ratón adulto36.
El medio libre de suero y el ambiente in vitro químicamente definido proporcionan una manipulación totalmente definida y reproducible de las condiciones experimentales. Por lo tanto, los cultivos organotípicos de explantes de retina son herramientas valiosas en el campo de la oftalmología y la neurociencia, y se han utilizado para el estudio de enfermedades de la retina37,desarrollo de la retina38,39,terapia con células madre de retina40,modificaciones genéticas41y cribado farmacológico. Como ejemplo específico de pruebas de fármacos, aquí se utilizaron cultivos de explantes de retina para probar un análogo de cGMP (CN003), conocido por reducir la muerte celular de los fotorreceptores en modelos animales para la enfermedad hereditariade la retina 23 (Figura 3B). Otra posible aplicación de la técnica se describe en la Figura 3C,que ilustra cómo el control preciso del entorno tisular puede ser explotado para emular las condiciones diabéticas24. Debido a la preservación de la arquitectura del tejido durante todo el período de cultivo, los cultivos de explantes retinianos organotípicos también son adecuados para estudios electrofisiológicos. La funcionalidad neuronal en explantes de retina se han investigado utilizando la grabación de parches de abrazadera42 y la grabación de múltiples electrodos (MEA)33,43. Este último permite el registro de la actividad eléctrica de las poblaciones neuronales al mismo tiempo y ha sido explotado para caracterizar la funcionalidad de las células fotorreceptoras y ganglionares en condiciones de cultivo. En una perspectiva más amplia, los sistemas de cultivo de explantes organotípicos también se pueden aplicar en la investigación preclínica, donde se utilizaron cultivos de explantes para probar la eficacia terapéutica de la hipotermia44.
La técnica de cultivo organotípico de explantes es relativamente simple de realizar y, en comparación con los experimentos in vivo correspondientes, es menos costosa y consume mucho tiempo, y evita las preocupaciones éticas relacionadas con los estudios con animales vivos. El control preciso sobre las condiciones experimentales y la preservación de la RPE y la complejidad tisular hacen del método una herramienta valiosa para mejorar nuestro conocimiento sobre la fisiología de la retina y la fisiopatología y permitir numerosas aplicaciones experimentales.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo de investigación recibió apoyo financiero de la Unión Europea (transMed; H2020-MSCA-765441), el consejo de investigación alemán (DFG; PA1751/8-1, 10-1) y el Consejo de Becas de China.
Materiales
| Name | Company | Catalog Number | Comments |
| Biotin | Sigma | B4639 | |
| (+/-)-α-LipoicAcid (=Thiotic acid) | Sigma | T1395 | |
| BSA | Sigma | B4639 | |
| CDP-Choline-Na | Sigma | 30290 | |
| Corticosterone | Sigma | C2505 | |
| CuSO4 × 5H2O | Sigma | C8027 | |
| DL-Tocopherol | Sigma | T1539 | |
| Ethanolamine | Sigma | E0135 | |
| FCS | Sigma | F7524 | |
| Filtropur BT100, 1L, 0.2µm | SARSTEDT | 83.3942.101 | for Basal Medium |
| Forceps | F.S.T | 15003-08 | |
| Glutamine | Sigma | G8540 | |
| Glutathione | Sigma | G6013 | |
| Insulin | Sigma | I6634 | |
| L-CysteineHCl | Sigma | C7477 | |
| Linoleic Acid | Sigma | L1012 | |
| Linolenic Acid | Sigma | L2376 | |
| MnCl2 x 4H2O | Sigma | M5005 | |
| Na-pyruvate | Sigma | P3662 | |
| NaSeO3 x 5H2O | Sigma | S5261 | |
| Ophthalmic microscope scaping spoon | F.S.T. | 10360-13 | |
| Progesteron | Sigma | P8783 | |
| Proteinase K | MP Biomedicals | 21935025 | 44 mAnson U/mg |
| R16 | Gibco | 07491252A | |
| Retinol | Sigma | R7632 | |
| Retinyl acetate | Sigma | R7882 | |
| Scissors | F.S.T | 15004-08 | |
| Sterile filter 0.22µm | MILLEX GP | SLGP033RS | for supplements |
| T3 | Sigma | T6397 | |
| Tocopherylacetate | Sigma | T1157 | |
| Transferrin | Sigma | T1283 | |
| Transwell permeable supports | Corning | 3412 | |
| Vitamin B1 | Sigma | T1270 | |
| Vitamin B12 | Sigma | V6629 | |
| Vitamin C | Sigma | A4034 |
Referencias
- Fletcher, E. L., et al. Animal models of retinal disease. Progress in Molecular Biology and Translational Science. 100, 211-286 (2011).
- Llonch, S., Carido, M., Ader, M. Organoid technology for retinal repair. Developmental Biology. 433 (2), 132-143 (2018).
- Mencl, S., Trifunović, D., Zrenner, E., Paquet-Durand, F. PKG-dependent cell death in 661W cone photoreceptor-like cell cultures (experimental study). Advances in Experimental Medicine and Biology. 1074, 511-517 (2018).
- Sanges, D., Comitato, A., Tammaro, R., Marigo, V. Apoptosis in retinal degeneration involves cross-talk between apoptosis-inducing factor (AIF) and caspase-12 and is blocked by calpain inhibitors. Proceedings of the National Academy of Sciences of the United States of America. 103 (46), 17366-17371 (2006).
- Schnichels, S., et al. Retina in a dish: cell cultures, retinal explants and animal models for common diseases of the retina. Progress in Retinal and Eye Research. , 100880 (2020).
- Paquet-Durand, F., Hauck, S. M., van Veen, T., Ueffing, M., Ekström, P. PKG activity causes photoreceptor cell death in two retinitis pigmentosa models. Journal of Neurochemistry. 108 (3), 796-810 (2009).
- Caffe, A. R., Visser, H., Jansen, H. G., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Murali, A., Ramlogan-Steel, C. A., Andrzejewski, S., Steel, J. C., Layton, C. J. Retinal explant culture: A platform to investigate human neuro-retina. Clinical and Experimental Ophthalmology. 47 (2), 274-285 (2019).
- Arango-Gonzalez, B., et al. In vivo and in vitro development of S- and M-cones in rat retina. Investigative Ophthalmology and Visual Science. 51 (10), 5320-5327 (2010).
- Strauss, O. The retinal pigment epithelium in visual function. Physiological Reviews. 85 (3), 845-881 (2005).
- Söderpalm, A., Szél, A., Caffé, A. R., van Veen, T. Selective development of one cone photoreceptor type in retinal organ culture. Investigative Ophthalmology and Visual Science. 35 (11), 3910-3921 (1994).
- Caffe, A. R., et al. Mouse retina explants after long-term culture in serum free medium. Journal of Chemical Neuroanatomy. 22 (4), 263-273 (2001).
- Caffe, A. R., Soderpalm, A. K., Holmqvist, I., van Veen, T. A combination of CNTF and BDNF rescues rd photoreceptors but changes rod differentiation in the presence of RPE in retinal explants. Investigative Ophthalmology and Visual Science. 42 (1), 275-282 (2001).
- Ogilvie, J. M., Speck, J. D., Lett, J. M., Fleming, T. T. A reliable method for organ culture of neonatal mouse retina with long-term survival. Journal of Neuroscience Methods. 87 (1), 57-65 (1999).
- Keeler, C. E. The inheritance of a retinal abnormality in white mice. Proceedings of the National Academy of Sciences of the United States of America. 10 (7), 329-333 (1924).
- Romijn, H. J. Development and advantages of serum-free, chemically defined nutrient media for culturing of nerve tissue. Biology of the Cell. 63 (3), 263-268 (1988).
- Caffe, A. R., et al. Mouse retina explants after long-term culture in serum free medium. Journal of Chemical Neuroanatomy. 22 (4), 263-273 (2001).
- Alarautalahti, V., et al. Viability of Mouse Retinal Explant Cultures Assessed by Preservation of Functionality and Morphology. Investigative Ophthalmology and Visual Science. 60 (6), 1914-1927 (2019).
- Caffe, A. R., Visser, H., Jansen, H. G., Sanyal, S. Histotypic differentiation of neonatal mouse retina in organ culture. Current Eye Research. 8 (10), 1083-1092 (1989).
- Farber, D. B., Lolley, R. N. Cyclic guanosine monophosphate: elevation in degenerating photoreceptor cells of the C3H mouse retina. Science. 186 (4162), 449-451 (1974).
- Arango-Gonzalez, B., et al. Identification of a common non-apoptotic cell death mechanism in hereditary retinal degeneration. PloS One. 9 (11), 112142 (2014).
- Loo, D. T. In situ detection of apoptosis by the TUNEL assay: an overview of techniques. Methods in Molecular Biology. 682, 3-13 (2011).
- Vighi, E., et al. Combination of cGMP analogue and drug delivery system provides functional protection in hereditary retinal degeneration. Proceedings of the National Academy of Sciences of the United States of America. 115 (13), 2997-3006 (2018).
- Valdés, J., et al. Organotypic retinal explant cultures as in vitro alternative for diabetic retinopathy studies. Altex. 33 (4), 459-464 (2016).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: from diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), (2019).
- Slepak, V. Z., Hurley, J. B. Mechanism of light-induced translocation of arrestin and transducin in photoreceptors: interaction-restricted diffusion. IUBMB Life. 60 (1), 2-9 (2008).
- Paquet-Durand, F., et al. A retinal model of cerebral malaria. Scientific Reports. 9 (1), 3470 (2019).
- Romijn, H. J., de Jong, B. M., Ruijter, J. M. A procedure for culturing rat neocortex explants in a serum-free nutrient medium. Journal of Neuroscience Methods. 23 (1), 75-83 (1988).
- Azadi, S., et al. CNTF+BDNF treatment and neuroprotective pathways in the rd1 mouse retina. Brain Research. 1129 (1), 116-129 (2007).
- Kaur, J., et al. Calpain and PARP activation during photoreceptor cell death in P23H and S334ter rhodopsin mutant rats. PloS One. 6 (7), 22181 (2011).
- Samardzija, M., et al. A mouse model for studying cone photoreceptor pathologies. Investigative Ophthalmology and Visual Science. 55 (8), 5304-5313 (2014).
- Achberger, K., et al. Merging organoid and organ-on-a-chip technology to generate complex multi-layer tissue models in a human retina-on-a-chip platform. eLife. 8, (2019).
- Alarautalahti, V., et al. Viability of Mouse Retinal Explant Cultures Assessed by Preservation of Functionality and Morphology. Investigative Ophthalmology and Visual Science. 60 (6), 1914-1927 (2019).
- Ferrer-Martín, R. M., et al. Microglial cells in organotypic cultures of developing and adult mouse retina and their relationship with cell death. Experimental Eye Research. 121, 42-57 (2014).
- Müller, B. Organotypic culture of adult mouse retina. Methods in Molecular Biology. 1940, 181-191 (2019).
- Heller, J. P., Kwok, J. C., Vecino, E., Martin, K. R., Fawcett, J. W. A method for the isolation and culture of adult rat Retinal Pigment Epithelial (RPE) cells to study retinal diseases. Frontiers in Cellular Neuroscience. 9, 449 (2015).
- Sahaboglu, A., et al. Retinitis pigmentosa: rapid neurodegeneration is governed by slow cell death mechanisms. Cell Death & Disease. 4 (2), 488 (2013).
- Arai, E., et al. Ablation of Kcnj10 expression in retinal explants revealed pivotal roles for Kcnj10 in the proliferation and development of Müller glia. Molecular Vision. 21, 148-159 (2015).
- Demas, J., Eglen, S. J., Wong, R. O. Developmental loss of synchronous spontaneous activity in the mouse retina is independent of visual experience. Journal of Neuroscience. 23 (7), 2851-2860 (2003).
- Johnson, T. V., Martin, K. R. Development and characterization of an adult retinal explant organotypic tissue culture system as an in vitro intraocular stem cell transplantation model. Investigative Ophthalmology and Visual Science. 49 (8), 3503-3512 (2008).
- Hatakeyama, J., Kageyama, R. Retrovirus-mediated gene transfer to retinal explants. Methods. 28 (4), 387-395 (2002).
- Moritoh, S., Tanaka, K. F., Jouhou, H., Ikenaka, K., Koizumi, A. organotypic tissue culture of adult rodent retina followed by particle-mediated acute gene transfer in vitro. PloS One. 5 (9), 12917 (2010).
- Reinhard, K., et al. Step-by-step instructions for retina recordings with perforated multi electrode arrays. PloS One. 9 (8), 106148 (2014).
- Klemm, P., et al. Hypothermia protects retinal ganglion cells against hypoxia-induced cell death in a retina organ culture model. Clinical and Experimental Ophthalmology. 47 (8), 1043-1054 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados