需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
睡眠美人转座转染人视网膜色素上皮细胞氧化应激的诱导与分析
摘要
我们提出了一种开发和使用氧化应激模型的方案,方法是用H2O2处理视网膜色素上皮细胞,分析细胞形态,活力,密度,谷胱甘肽和UCP-2水平。它是研究转座子转染细胞分泌的蛋白质治疗神经视网膜变性的抗氧化作用的有用模型。
摘要
氧化应激在几种退行性疾病中起着关键作用,包括年龄相关性黄斑变性(AMD),这是一种影响全球约3000万患者的病理。它导致视网膜色素上皮 (RPE) 合成的神经保护因子减少,例如色素上皮衍生因子 (PEDF) 和粒细胞-巨噬细胞集落刺激因子 (GM-CSF),随后 RPE 细胞丢失,最终导致光感受器和视网膜神经节细胞 (RGC) 死亡。我们假设通过转染的RPE细胞过表达PEDF和GM-CSF的视网膜下移植来重建神经保护性和神经源性视网膜环境,有可能通过减轻氧化应激的影响,抑制炎症和支持细胞存活来预防视网膜变性。使用 睡美人 转座子系统(SB100X),人RPE细胞已经转染了 PEDF 和 GM-CSF 基因,并使用qPCR,蛋白质印迹,ELISA和免疫荧光显示出稳定的基因整合,长期基因表达和蛋白质分泌。为了确认转染的RPE细胞分泌的 PEDF 和 GM-CSF 的功能和效力,我们开发了一种体外测定法来量化培养物中H2O2诱导的氧化应激对RPE细胞的减少。通过分析细胞形态、密度、谷胱甘肽的细胞内水平 、UCP2 基因表达和细胞活力来评估细胞保护。与未处理的对照相比,转染的RPE细胞过度表达PEDF和/或GM-CSF以及未转染但用PEDF和/或GM-CSF(市售或从转染细胞中纯化)预处理的细胞显示出显着的抗氧化细胞保护。目前的H2O2模型是一种简单有效的方法来评估可能有效治疗AMD或类似神经退行性疾病的因子的抗氧化作用。
引言
这里描述的模型为评估生物制药剂减少细胞氧化应激的效率提供了一种有用的方法。我们利用该模型研究了PEDF和GM-CSF对H2O2介导的氧化应激对视网膜色素上皮细胞的保护作用,这些细胞暴露于高水平的O2和可见光,以及光感受器外段膜的吞噬作用,产生显着水平的活性氧(ROS)1, 2.它们被认为是缺血性年龄相关性黄斑变性(aAMD)发病机制的主要贡献者3,4,5,6,7,8。此外,RPE合成的神经保护因子减少,特别是色素上皮衍生因子(PEDF),胰岛素样生长因子(IGF)和粒细胞巨噬细胞集落刺激因子(GM-CSF)导致RPE细胞的功能障碍和丢失,其次是光感受器和视网膜神经节细胞(RGC)死亡3,4,5.AMD是一种复杂的疾病,由代谢,功能,遗传和环境因素之间的相互作用引起4。缺乏对aAMD的治疗是工业化国家60岁以上患者失明的主要原因9,10。通过视网膜下移植过表达PEDF和GM-CSF的转基因RPE细胞重建神经保护性和神经源性视网膜环境,有可能通过减轻氧化应激的影响,抑制炎症和支持细胞存活来预防视网膜变性11,12,13,14,15,16.尽管有几种方法将基因递送到细胞,但我们选择了非病毒性过度活跃的睡美人转座子系统将PEDF和GM-CSF基因递送到RPE细胞,因为它的安全性,基因整合到宿主细胞的基因组中,以及它倾向于将递送的基因整合到非转录活性位点中,正如我们之前所展示的那样17, 18,19.
细胞氧化应激可以通过几种氧化剂在体外培养的细胞中诱导,包括过氧化氢(H2O 2),4-氢炔诺(HNE),过氧化氢叔丁酯(tBH),高氧张力和可见光(全光谱或紫外线照射)20,21。高氧张力和光需要特殊的设备和条件,这限制了向其他系统的可转移性。H 2 O2、HNE和 tBH 等试剂可诱导重叠的氧化应激分子和细胞变化。我们选择H2O2来测试PEDF和GM-CSF的抗氧化活性,因为它方便且具有生物学相关性,因为它是由RPE细胞在光感受器外段吞噬作用22期间作为活性氧中间体产生的,并且存在于体内的眼组织中23。由于谷胱甘肽的氧化可能是眼睛中H2O2产生部分原因,因此我们在研究中分析了GSH / 谷胱甘肽的水平,这与H2O2诱导的氧化应激和细胞的再生能力有关21,22。谷胱甘肽水平的分析特别相关,因为它参与眼睛的抗氧化保护机制24。暴露于H2O2经常被用作模型来检查RPE细胞1,25,26,27,28,29,30的氧化应激敏感性和抗氧化活性,此外,它显示出与光诱导的氧化应激损伤的相似性,氧化应激损伤是氧化应激21的"生理"来源。
为了评估神经保护因子的功能和有效性,我们开发了一种体外模型,该模型允许分析以量化由基因修饰以过度表达PEDF和GM-CSF的细胞表达的生长因子的抗氧化作用。在这里,我们表明,与PEDF和GM-CSF基因转染的RPE细胞比未转染的对照细胞更能抵抗H2O2的有害影响,如细胞形态学,密度,活力,谷胱甘肽的细胞内水平和UCP2基因的表达所证明的那样,UCP2基因编码线粒体解偶联蛋白2,已被证明可以减少活性氧(ROS)31。
Access restricted. Please log in or start a trial to view this content.
研究方案
收集和使用人眼的程序由州伦理研究委员会批准(编号:2016-01726)。
1. 细胞分离和培养条件
- 人 ARPE-19 细胞系
- 在Dulbecco的改良鹰培养基/营养混合物F-12火腿(DMEM / Ham's F-12)中培养5 x 105 个ARPE-19细胞,这是一种人RPE细胞系,在37°C下在T75烧瓶中加入10%胎牛血清(FBS),80 U / mL青霉素,80μg/ mL链霉素B(完整培养基)在5%CO2 和95%空气的加湿气氛中(其他细胞密度见表1)。
- 每周更换三次介质。
- 一旦细胞生长到约90%汇合(定性评估),吸出培养基并用无菌的1x PBS洗涤细胞。
- 用5%胰蛋白酶-2%EDTA溶液在37°C下孵育细胞7-10分钟(体积见 表1)。直观地监视分离。
- 通过添加含有10%FBS的完整培养基来停止胰蛋白酶消化(体积见表1)。
- 转染细胞(见方案的步骤2),以1:10的比例(每周一次)亚培养细胞,或接种在96孔板中,详见下文(参见方案的步骤3.3和3.4)。
| 中等容量(毫升) | ||||||
| 面积(平方厘米) | ARPE-19细胞(细胞/孔)的接种密度 | 应用 | 用于细胞培养 | 停用胰蛋白酶 | 胰蛋白酶体积 (mL) | |
| 烧瓶 T75 | 75 | 5,00,000 | ARPE-19细胞生长 | 10 | 7 | 3 |
| 6 孔板 | 9.6 | 1,00,000 | 转染ARPE-19细胞的接种 | 3 | 1 | 0.5 |
| 24 孔板 | 2 | 50,000 | 转染hRPE细胞的接种 | 1 | 0.8 | 0.2 |
| 96 孔板 | 0.32 | 5,000用于转染细胞的氧化应激实验(图1) | 氧化应激实验 | 0.2 | ||
| 3,000用于非转染细胞加蛋白质的氧化应激实验(图1) | ||||||
表1:细胞培养体积。推荐用于培养ARPE-19和原代人RPE细胞的细胞培养板和烧瓶的培养基体积。
- 原代人 RPE 细胞
- 分离出Thumann等人17所描述的原代人RPE细胞,并在补充有20%FBS的完整培养基中培养细胞。
- 每周更换两次培养基。一旦细胞达到汇合(目视监测),将FBS降低到1%以避免过度生长。
- 转染细胞(参见方案的步骤2),或在96孔板中接种,详见下文(参见方案的步骤3.3和3.4)。
注:此处提供的数据是从四名人类供体的眼睛获得的RPE细胞培养物中收集的。 表2 详细介绍了狮子会视力礼物眼库(明尼苏达州圣保罗)捐赠者的人口统计数据。根据《赫尔辛基宣言》获得知情同意后,眼睛在死后12.7±5.7小时(平均±SD)进行眼科检查。
| 不 | 年龄 | 性 | 死亡到保存(小时) | 死亡至孤立 | 培养 | 培养 | 图形中的符号 | |
| (天) | 转染前(天) | 转染后(天) | ||||||
| 2 | 80 | M | 20.7 | 8 | 140 | 36 |  | |
| 3 | 86 | F | 12.8 | 8 | 85 | 45 |  | |
| 4 | 86 | F | 8.5 | 5 | 26 | 133 |  | |
| 8 | 83 | F | 8.9 | 6 | 18 | 27 |  | |
| 意味 着 | 83.8 | 12.7 | 6.8 | 67.3 | 60.3 | |||
| 标清 | 2.9 | 5.7 | 1.5 | 57.0 | 49.1 |
表2:视网膜色素上皮细胞的人类供体人口统计。
2. ARPE-19和原代人RPE细胞的电穿孔
- 胰蛋白酶消化ARPE-19细胞或原代人RPE细胞,如方案的步骤1.1.3-1.1.5中所述。
- 使用市售转染试剂盒进行电穿孔(见 材料表)。
- 对于ARPE-19细胞的转染,请参阅Johnen等人32,对于原代hRPE,请参阅Thumann等人17。简而言之,将1 x 105 ARPE-19细胞或5 x 104原代hRPE细胞重悬于11μLR缓冲液中,并加入2μL含有0.03μgpSB100X转座酶33和0.47μgpT2-CMV-PEDF -His或pT2-CMV-GMCSF -其转座子的质粒混合物(转座酶比例:转座子1:16)。对于PEDF和GM-CSF双转染细胞,使用1:16:16的比例(0.03μgp SB100X,0.47μgpT2-CMV-PEDF-His和0.47μgpT2-CMV-GMCSF-His)。使用以下电穿孔参数:ARPE-19电池的两个脉冲为1,350 V,持续20 ms(脉冲宽度);原代电池的两个1,100 V脉冲持续20 ms。
- 种子1 x 105 转染ARPE-19或5 x10 4 转染原代hRPE细胞分别在6孔和24孔板中,在补充10%FBS的培养基中,不含抗生素或抗真菌剂。在转染后 3 天,加入青霉素 (80 U/mL)、链霉素 (80 μg/mL) 和两性霉素 B (2.5 μg/mL),首次置换培养基。
- 通过每周显微镜监测细胞来确定细胞生长。通过RT-PCR分析基因表达以及ELISA和WB的蛋白质分泌来监测转染效率(方法在 补充材料中解释)。
注意:一旦细胞达到汇合,即分别在转染后约7天和4周对ARPE-19细胞和原代hRPE细胞进行转染后,可以首次评估转染效率。 - 96孔板中的种子细胞如下所述(参见方案的步骤3.5)。
3. 氧化应激诱导(H2O2 治疗)和神经保护(PEDF和/或GM-CSF治疗)
- 转染ARPE-19细胞的条件培养基的制备
- 使用转染有PEDF,GM-CSF或两者基因的ARPE-19细胞(参见方案的步骤2);按照方案的步骤1.1所述培养细胞28天。
- 在转染后28天,胰蛋白酶消化细胞(参见方案的步骤1.1.3-1.1.5),使用Neubauer室34,35和种子5×105个细胞在T75烧瓶中完全培养基中,如方案步骤1.1.1所述。当细胞培养物汇合度约为80%时(约1周后;定性验证)交换培养基。24小时后收集培养基。
- 将培养基储存在-20°C直至使用。
注:重组PEDF和GM-CSF在条件培养基中的足够浓度由WB验证,并由ELISA定量,如 补充材料中所述。
- 从转染ARPE-19细胞的调节培养基中纯化PEDF和GM-CSF
- 将步骤3.1.2中收集的培养基在4°C下以10,000×g离心15分钟。
- 根据制造商的协议使用Ni-NTA超级流(见 材料表)来纯化Hi-NTA标记的蛋白质,如下所述。
- 将30μLNi-NTA混合物移液到1.5mL管中,以2,600×g离心30s并丢弃流出物。用200μL1x孵育缓冲液洗涤沉淀两次。
- 以2,600 x g 离心30 s,丢弃流出物。加入40μL4x孵育缓冲液并重悬。
- 加入900μL离心条件培养基,并在室温下以70rpm(轨道振荡器)孵育1小时。
- 用175μL1x孵育缓冲液洗涤沉淀两次。以2,600 x g 离心30 s,丢弃流出物。
- 为了洗脱His标记的PEDF和GM-CSF蛋白,加入20μL洗脱缓冲液,并在室温下以70rpm(轨道振荡器)孵育20分钟。 保持含有重组PEDF或GM-CSF的上清液。
- 根据制造商的说明,使用市售的BCA蛋白测定试剂盒(见 材料表)定量总蛋白。
- 将蛋白质溶液储存在-20°C直至使用。
注意:孵育缓冲液(4x)含有200 mM NaH2PO 4,1.2 M NaCl和40 mM咪唑;洗脱缓冲液含有50 mM NaH2PO 4,300 mM NaCl和250 mM咪唑。
- 用调节培养基加H 2 O 2处理未转染的ARPE-19 /原代hRPE细胞(图1A)
- 在96孔板中每孔接种3,000个未转染的ARPE-19(来自方案的步骤1.1.6)或原代hRPE(来自方案的步骤1.2.3)细胞,并在来自转染ARPE-19细胞的200μL调节培养基中培养。
- 将细胞在37°C下在5%CO2 和95%空气的加湿气氛中培养10天。每天更换调理培养基。将细胞暴露于350μM H2O2 中24小时。
- 通过定量谷胱甘肽水平(见方案的步骤4.1),显微镜检查(见方案的步骤4.2)和细胞毒性测定(见方案的步骤4.2),评估氧化应激损伤并确定PEDF和GM-CSF的抗氧化作用。
注意:实验的持续时间为 12 天。透明平底微孔板用于评估发光和细胞形态。为了同时进行细胞毒性和谷胱甘肽测定,必须在同一天用细胞接种两个板。
- 用PEDF和GM-CSF生长因子加H 2 O2处理未转染的ARPE-19 /原代hRPE细胞(图1B)
- 将3,000个未转染的ARPE-19(来自方案的步骤1.1.6)或原代hRPE(来自方案的步骤1.2.3)细胞每孔(96孔板,具有透明平底)接种在含有500ng / mL重组PEDF和/或50ng / mL重组GM-CSF的完整培养基中,从转染ARPE-19细胞培养基中纯化或市售。在37°C下在5%CO2 和95%空气的加湿气氛中培养细胞48小时。每天更新培养基,包括PEDF和GM-CSF生长因子。
注意:将新鲜的生长因子加入培养基中。 - 用生长因子处理细胞48小时后,除去培养基并加入含有350μM H2O2 加500 ng / mL PEDF和/或50 ng / mL GM-CSF的完整培养基。
- 通过定量谷胱甘肽水平(见方案的步骤4.1),显微镜检查(见方案的步骤4.2)和细胞毒性测定(见方案的步骤4.2),评估氧化应激损伤并确定PEDF和GM-CSF的抗氧化作用。
注意:实验的持续时间为 3 天。
- 将3,000个未转染的ARPE-19(来自方案的步骤1.1.6)或原代hRPE(来自方案的步骤1.2.3)细胞每孔(96孔板,具有透明平底)接种在含有500ng / mL重组PEDF和/或50ng / mL重组GM-CSF的完整培养基中,从转染ARPE-19细胞培养基中纯化或市售。在37°C下在5%CO2 和95%空气的加湿气氛中培养细胞48小时。每天更新培养基,包括PEDF和GM-CSF生长因子。
- 用H 2 O 2处理转染的ARPE-19/原代hRPE细胞(图1C)
- 通过WB和ELISA验证转染细胞的充分基因表达和蛋白质分泌,如 补充材料中所述。
- 从含有转染细胞的孔中取出培养基(参见方案的步骤2)。
- 胰蛋白酶消化细胞如方案的步骤1.1.3-1.1.5中所述。使用Neubauer室34,35对细胞进行计数。
- 将5,000转染细胞/孔接种在96孔板中,加入200μL完整培养基中。在37°C下在5%CO 2和95%空气的加湿气氛中培养细胞24 小时。24小时后,将细胞暴露于350μM H2O2 中24小时。
- 通过定量谷胱甘肽水平(见方案的步骤4.1),显微镜检查(见方案的步骤4.2),细胞毒性测定(见方案的步骤4.2)和确定 UCP2 基因表达(见方案的步骤4.3),评估氧化应激损伤并确定PEDF和GM-CSF的抗氧化作用。
注意:实验的持续时间为 2 天。
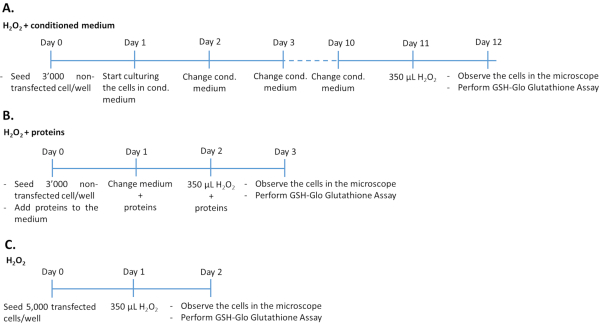
图1:三种不同实验方法中H2O2测定的时间表。将用条件培养基/重组蛋白处理的3,000个未转染细胞或5,000个转染细胞接种在96孔板中,用于H2O2处理。为了确定条件培养基的效果,将细胞在100%培养基中连续培养10天,每天更换培养基。为了确定重组生长因子的作用,通过每天添加适量的生长因子连续3天来培养细胞。请注意,与转染细胞相比,未转染的细胞接种在每孔3,000个细胞,以避免在更长的培养持续时间内过度生长。请点击此处查看此图的放大版本。
4. 氧化应激水平和抗氧化能力分析
- 谷胱甘肽测定
- 按照制造商的说明,使用市售试剂盒(见 材料表)测量谷胱甘肽(GSH)水平。简而言之,制备和适当体积的1x试剂混合物(100μL试剂/孔):荧光素-NT底物和谷胱甘肽S-转移酶在反应缓冲液中以1:100稀释。
注意:96孔板需要10 mL的1x试剂混合物,这是通过将100μL荧光素-NT底物和100μL谷胱甘肽S-转移酶加入10mL反应缓冲液来制备的。使用前立即准备1x试剂混合物。不要储存准备好的试剂混合物以备将来使用。 - 通过将一瓶复原缓冲液转移到冻干的荧光素检测试剂中来制备荧光素检测试剂。
- 使用谷胱甘肽(GSH)标准溶液(5mM)准备标准曲线。用dH2O以1:100稀释5mM GSH溶液(将10μL5mM GSH溶液加入990μLdH2O)。在500μL的dH 2 O中进行7次连续1:1稀释,将每种稀释的标准品的10μL转移到一式两份的适当孔中。
注意:谷胱甘肽的最终浓度范围为0.039μM至5μM。 - 准备空白(1x试剂混合物)并将10μL(重复)转移到适当的孔中。
- 从培养箱中取出H2O2处理的细胞。
注意:通过明场显微镜(40x)记录H2O2处理细胞的形态。
当细胞被氧化时,它们看起来更圆润,扩散更少。 - 小心地吸出培养基。向每个孔中加入100μL制备的1x试剂混合物。将细胞与试剂在轨道振荡器上以500rpm混合15秒。
- 将板在室温下孵育30分钟。向每个孔中加入100μL复构的荧光素检测试剂。
- 在轨道振荡器上以500 rpm的速度将溶液混合15秒。将板在室温下孵育15分钟。
- 使用预安装程序ADP-Glo的读板器确定发光。
注:将板放入不带盖子的读板器内。- 单击 "更改布局", 然后在 "基本参数"中选择以下设置:Costar 96孔板;顶级光学;定位延迟:0.1;测量开始时间:0.0;测量间隔时间:1.0;规范化结果的时间:0.0;增益由设备自动调节。定义空白、标准品和样品。单击 开始测量。
- 将数据导出为 Excel 文件。通过标准曲线的插值计算每个样品中GSH的浓度。
- 按照制造商的说明,使用市售试剂盒(见 材料表)测量谷胱甘肽(GSH)水平。简而言之,制备和适当体积的1x试剂混合物(100μL试剂/孔):荧光素-NT底物和谷胱甘肽S-转移酶在反应缓冲液中以1:100稀释。
- 细胞毒性测定和显微分析
- 从细胞中吸出培养基,并向每个孔中加入100μL含有1%FBS的完整培养基。将细胞返回培养箱。
注意:使用1%的FBS,因为较高百分比的FBS会干扰发光的测量,因此在这种情况下使用1%的FBS。 - 按照制造商的说明,使用市售的细胞毒性测定试剂盒(见 材料表)测量细胞活力。简而言之,制备试剂混合物,将测定缓冲液加入冻干底物中。通过将33μL洋地黄素加入5mL测定缓冲液(用于一个96孔板)来制备裂解试剂。通过上下移液充分混合,以确保均匀性。
注意:为获得最佳效果,请使用新鲜制备的试剂混合物。试剂混合物可以在4°C下储存长达7天,并且可以在-70°C下以一次性等分试样储存长达4个月。 必须避免冷冻和解冻。裂解试剂可以在4°C下储存长达7天。 - 用未经处理的ARPE-19细胞制备标准曲线。
- 按照方案的步骤1.1.3-1.1.5所述对细胞进行胰蛋白酶消化,并使用Neubauer室34,35对细胞进行计数。在室温下以120g离心细胞10分钟,吸出上清液并将细胞沉淀重悬于含有1%FBS的DMEM / Ham的F12培养基中至终浓度为1 x 105个细胞/ mL。
- 在含有1%FBS的200μL培养基中制备7个连续1:1稀释液。将每种标准品的100μL转移到适当的孔中(重复)。向所有孔中加入50μL试剂混合物。
- 将细胞与试剂在轨道振荡器上以500rpm混合15秒。在室温下孵育板15分钟,使用读板器测量发光,如方案的步骤4.1.9中所述。加入50μL裂解试剂并孵育15分钟。使用读板器测量发光,如协议的步骤4.1.9中所述。
- 计算活细胞的百分比:(100 - %死细胞)和死细胞的百分比=[第一次发光测量((样品中的死细胞))/第二次发光测量(所有细胞在地黄素处理后死亡)] x 100。
- 从细胞中吸出培养基,并向每个孔中加入100μL含有1%FBS的完整培养基。将细胞返回培养箱。
- 通过RT-qPCR进行UCP2表达分析
- 如上所述对转染的细胞进行胰蛋白酶消化(方案的步骤1.1.3-1.1.5)。
- 使用Neubauer室34,35对细胞进行计数。
- 在96孔板中播种5,000转染的ARPE-19细胞/孔。
- 培养24小时后,用350μM H2O2 处理细胞24小时。
- 按照制造商的说明,使用商业试剂盒从少量细胞中分离RNA总RNA(见 材料表)。
- 执行实时定量荧光定量 PCR (RT-qPCR),如 补充材料中所述。简而言之,使用含有优化的M-MLV逆转录酶的市售混合物通过反转录产生cDNA(见 材料表)。
- 对于qPCR,采用即用型反应混合物,其中包含除引物(参见补充材料表S1)和DNA模板之外的所有组分(包括SYBR Green)。使用以下热循环条件:在95°C下初始变性10分钟,在95°C下变性40次,15秒,在60°C下退火30秒,在72°C下伸长32秒。
- 使用2^(-ΔΔCT)方法进行分析36。
- 用于pAkt的SDS-PAGE和WB分析的细胞裂解物的制备(Ser473)
- 种子3×105 GM-CSF转染的ARPE-19细胞/孔在6孔板中(转染后≥21天),以确定GM-CSF是否通过激活Akt生存途径15保护RPE细胞免受H2O2的损害。
- 培养24小时后,将细胞暴露于350μM H2O2 中24小时。
- 将1 mL RIPA缓冲液与10μL蛋白酶磷酸酶抑制剂混合物,10μL0.5 M EDTA和25μL8M尿素混合(体积用于一个孔)。
- 小心地吸出培养基并用1x PBS洗涤细胞。
- 将整个体积的RIPA缓冲液混合物加入细胞中。
- 上下移液。
- 将裂解物收集在1.5 mL管中。
- 在4°C下以20,000×g离心30分钟。
- 将上清液转移到新的1.5 mL管中。
- 通过WB测定15μL未稀释的细胞裂解物中pAkt的水平,如 补充材料中所述。
Access restricted. Please log in or start a trial to view this content.
结果
诱导人视网膜色素上皮细胞中的氧化应激
ARPE-19和原代hRPE细胞用不同浓度的H2O2处理24小时,并定量抗氧化剂谷胱甘肽的细胞内水平(图2A,B)。H2O2在50μM和100μM不影响谷胱甘肽的产生,而在350μM时,ARPE-19和原代hRPE细胞中的谷胱甘肽显着降低。细胞毒性分析表明,350μM是H2O2...
Access restricted. Please log in or start a trial to view this content.
讨论
这里提出的方案提供了一种分析转染细胞产生的PEDF和GM-CSF的抗氧化和保护功能的方法,可以应用于任何假定有益基因转染的细胞。在以通过移植转基因细胞将蛋白质递送到组织的基因治疗策略中,获得有关蛋白质表达水平,表达寿命以及表达蛋白质在疾病模型中的有效性的信息至关重要。在我们的实验室中,这里提出的方案可用于确定PEDF和GM-CSF对氧化应激的有效性,氧化应激已被假设为aAMD
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
作者要感谢Gregg Sealy和Alain Conti的出色技术援助,以及柏林Max-Delbrück中心的Zsuzsanna Izsvák教授慷慨地提供了pSB100X和pT2-CAGGS-Venus质粒。这项工作得到了瑞士国家科学基金会和欧盟委员会在第七个框架方案的范围内的支持。Z.I由欧洲研究委员会ERC Advanced资助[ERC-2011-ADG 294742]。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 24-well plates | Corning | 353047 | |
| 6-well plates | Greiner | 7657160 | |
| 96-well culture plate white with clear flat bottom | Costar | 3610 | Allows to check the cells before measuring the luminescence (GSH-Glo Assay) |
| 96-well plates | Corning | 353072 | |
| Acrylamid 40% | Biorad | 161-0144 | |
| Amphotericin B | AMIMED | 4-05F00-H | |
| Antibody anti-GMCSF | ThermoFisher Scientific | PA5-24184 | |
| Antibody anti-mouse IgG/IgA/IgM | Agilent | P0260 | |
| Antibody anti-PEDF | Santa Cruz Biotechnology Inc | sc-390172 | |
| Antibody anti-penta-His | Qiagen | 34660 | |
| Antibody anti-phospho-Akt | Cell Signaling Technology | 9271 | |
| Antibody anti-rabbit IgG H&L-HRP | Abcam | ab6721 | |
| Antibody donkey anti-rabbit Alexa Fluor 594 | ThermoFisher Scientific | A11034 | |
| Antibody goat anti-mouse Alexa 488 | ThermoFisher Scientific | A-11029 | |
| ARPE-19 cell line | ATCC | CRL-2302 | |
| BSA | Sigma-Aldrich | A9418-500G | |
| chamber culture glass slides | Corning | 354118 | |
| CytoTox-Glo Cytotoxicity Assay | Promega | G9291 | |
| DAPI | Sigma-Aldrich | D9542-5MG | |
| DMEM/Ham`s F12 | Sigma-Aldrich | D8062 | |
| Duo Set ELISA kit | R&D Systems | DY215-05 | |
| EDTA | ThermoFisher Scientific | 78440 | |
| ELISAquant kit | BioProducts MD | PED613-10-Human | |
| Eyes (human) | Lions Gift of Sight Eye Bank (Saint Paul, MN) | ||
| FBS | Brunschwig | P40-37500 | |
| Fluoromount Aqueous Mounting Medium | Sigma-Aldrich | F4680-25ML | |
| FLUOstar Omega plate reader | BMG Labtech | ||
| GraphPad Prism software (version 8.0) | GraphPad Software, Inc. | ||
| GSH-Glo Glutathione Assay | Promega | V6912 | |
| hydrogen peroxide (H2O2) | Merck | 107209 | |
| ImageJ software (image processing program) | W.S. Rasband, NIH, Bethesda, MD, USA; https://imagej.nih.gov/ij/; 1997–2014 | ||
| Imidazol | Axonlab | A1378.0010 | |
| Leica DMI4000B microscope | Leica Microsystems | ||
| LightCycler 480 Instrument II | Roche Molecular Systems | ||
| LightCycler 480 SW1.5.1 software | Roche Molecular Systems | ||
| NaCl | Sigma-Aldrich | 71376-1000 | |
| NaH2PO4 | Axonlab | 3468.1000 | |
| Neon Transfection System | ThermoFisher Scientific | MPK5000 | |
| Neon Transfection System 10 µL Kit | ThermoFisher Scientific | MPK1096 | |
| Neubauer chamber | Marienfeld-superior | 640010 | |
| Ni-NTA superflow | Qiagen | 30410 | |
| Nitrocellulose | VWR | 732-3197 | |
| Omega Lum G Gel Imaging System | Aplegen Life Science | ||
| PBS 1X | Sigma-Aldrich | D8537 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P0781-100 | |
| PerfeCTa SYBR Green FastMix | Quantabio | 95072-012 | |
| PFA | Sigma-Aldrich | 158127-100G | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23227 | |
| Primers | Invitrogen | See Table 1 in Supplementary Materials | |
| pSB100X (250 ng/µL) | Mátés et al., 2009. Provide by Prof. Zsuzsanna Izsvak | ||
| pT2-CMV-GMCSF-His plasmid DNA (250 ng/µL) | Constructed using the existing pT2-CMV-PEDF-EGFP plasmid reported in Johnen, S. et al. (2012) IOVS, 53 (8), 4787-4796. | ||
| pT2-CMV-PEDF-His plasmid DNA (250 ng/µL) | Constructed using the existing pT2-CMV-PEDF-EGFP plasmid reported in Johnen, S. et al. (2012) IOVS, 53 (8), 4787-4796. | ||
| QIAamp DNA Mini Kit | QIAGEN | 51304 | |
| recombinant hGM-CSF | Peprotech | 100-11 | |
| recombinant hPEDF | BioProductsMD | 004-096 | |
| ReliaPrep RNA Cell Miniprep System | Promega | Z6011 | |
| RIPA buffer | ThermoFisher Scientific | 89901 | |
| RNase-free DNase Set | QIAGEN | 79254 | |
| RNeasy Mini Kit | QIAGEN | 74204 | |
| SDS | Applichem | A2572 | |
| Semi-dry transfer system for WB | Bio-Rad | ||
| SuperMix qScript | Quantabio | 95048-025 | |
| Tris-buffered saline (TBS) | ThermoFisher Scientific | 15504020 | |
| Triton X-100 | AppliChem | A4975 | |
| Trypsin/EDTA | Sigma-Aldrich | T4174 | |
| Tween | AppliChem | A1390 | |
| Urea | ThermoFisher Scientific | 29700 | |
| WesternBright ECL HRP substrate | Advansta | K-12045-D50 | |
| Whatman nitrocellulose membrane | Chemie Brunschwig | MNSC04530301 |
参考文献
- Zareba, M., Raciti, M. W., Henry, M. M., Sarna, T., Burke, J. M. Oxidative stress in ARPE-19 cultures: Do melanosomes confer cytoprotection. Free Radical Biology and Medicine. 40 (1), 87-100 (2006).
- Gong, X., Draper, C. S., Allison, G. S., Marisiddaiah, R., Rubin, L. P. Effects of the macular carotenoid lutein in human retinal pigment epithelial cells. Antioxidants. 6 (4), (2017).
- Sacconi, R., Corbelli, E., Querques, L., Bandello, F., Querques, G. A Review of current and future management of geographic atrophy. Ophthalmology and Therapy. 6, 69-77 (2017).
- Al-Zamil, W. M., Yassin, S. A. Recent developments in age-related macular degeneration: a review. Clinical Interventions in Aging. 12, 1313-1330 (2017).
- Kumar-Singh, R. The role of complement membrane attack complex in dry and wet AMD - From hypothesis to clinical trials. Experimental Eye Research. 184, 266-277 (2019).
- Ung, L., Pattamatta, U., Carnt, N., Wilkinson-Berka, J. L., Liew, G., White, A. J. R. Oxidative stress and reactive oxygen species. Clinical Science. 131, 2865-2883 (2017).
- Beatty, S., Koh, H. H., Phil, M., Henson, D., Boulton, M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Survey of Ophthalmology. 45 (2), 115-134 (2000).
- Alhasani, R. H., et al. Gypenosides protect retinal pigment epithelium cells from oxidative stress. Food and Chemical Toxicology. 112, 76-85 (2018).
- National Institute of Health. , Available from: https://nei.nih.gov/learn-about-eye-health/resources-for-health-educators/eye-health-data-and-statistics/age-related-macular-degeneration-amd-data-and-statistics (2020).
- Mitchell, P., Liew, G., Gopinath, B., Wong, T. Y. Age-related macular degeneration. The Lancet. 392, 1147-1159 (2018).
- He, Y., Leung, K. W., Ren, Y., Jinzhi, P., Jian, G., Tombran-Tink, J. PEDF improves mitochondrial function in RPE cells during oxidative stress. Investigative Ophthalmology & Visual Science. 55, 6742-6755 (2014).
- Cao, S., Walker, G. B., Wang, X., Cui, J. Z., Matsubara, J. A. Altered cytokine profiles of human retinal pigment epithelium: Oxidant injury and replicative senescence. Molecular Vision. 19, 718-728 (2013).
- Farnoodian, M., Sorenson, C. M., Sheibani, N. PEDF expression affects the oxidative and inflammatory state of choroidal endothelial cells. Amercian Journal of Physiology and Cell Physiology. 314 (4), 456-472 (2018).
- Polato, F., Becerra, S. P. Retinal Degenerative Diseases: Mechanisms and Experimental Therapies. Retinal Degenerative Diseases. , Springer. 699-706 (2016).
- Schallenberg, M., Charalambous, P., Thanos, S. GM-CSF regulates the ERK1/2 pathways and protects injured retinal ganglion cells from induced death. Experimental Eye Research. 89, 665-677 (2009).
- Schallenberg, M., Charalambous, P., Thanos, S. GM-CSF protects rat photoreceptors from death by activating the SRC-dependent signalling and elevating anti-apoptotic factors and neurotrophins. Graefes Archives for Clinical and Experimental Ophthalmology. 250, 699-712 (2012).
- Thumann, G., et al. Engineering of PEDF-expressing primary pigment epithelial cells by the SB transposon system delivered by pFAR4 plasmids. Molecular Therapy - Nucleic Acids. 6, 302-314 (2017).
- Garcia-Garcia, L., et al. Long-term PEDF release in rat iris and retinal epithelial cells after Sleeping Beauty transposon-mediated gene delivery. Molecular Therapy - Nucleic Acids. 9, 1-11 (2017).
- Johnen, S., et al. Antiangiogenic and neurogenic activities of Sleeping Beauty-mediated PEDF-transfected RPE cells in vitro and in vivo. BioMed Research International. 2015, (2015).
- Weigel, A. L., Handa, J. T., Hjelmeland, M. L. Microarray analysis of H2O2-, HNE-, or tBH-treated ARPE-19 cells. Free Radical Biology & Medicine. 33 (10), 1419-1432 (2002).
- Allen, R. G., Tresini, M. Oxidative stress and gene regulation. Free Radical Biology and Medicine. 28 (3), 463-499 (2000).
- Tate, D. J., Miceli, M. V., Newsome, D. A. Phagocytosis and H2O2 induce catalase and metallothionein gene expression in human retinal pigment epithelial cells. Investigative Ophthalmology and Visual Science. 36 (7), 1271-1279 (1995).
- Halliwell, B., Clement, M. V., Long, L. H. Hydrogen peroxide in the human body. FEBS Letters. 486 (1), 10-13 (2000).
- Giblin, F. J., McCready, J. P., Kodama, T., Reddy, V. N. A direct correlation between the levels of ascorbic acid and H2O2 in aqueous humor. Experimental Eye Research. 38, 87-93 (1984).
- Geiger, R. C., Waters, C. M., Kamp, D. W., Glucksberg, M. R. KGF prevents oxygen-mediated damage in ARPE-19 cells. Investigative Ophthalmology and Visual Science. 46, 3435-3442 (2005).
- Campochiaro, P. A., et al. Lentiviral vector gene transfer of endostatin/angiostatin for macular degeneration (GEM) study. Human Gene Therapy. 28, 99-111 (2017).
- Chen, X. -D., Su, M. -Y., Chen, T. -T., Hong, H. -Y., Han, A. -D., Li, W. -S. Oxidative stress affects retinal pigment epithelial cell survival through epidermal growth factor receptor/AKT signaling pathway. International Journal of Ophthalmology. 10 (4), 507-514 (2017).
- Tu, G., et al. Allicin attenuates H2O2 - induced cytotoxicity in retinal pigmented epithelial cells by regulating the levels of reactive oxygen species. Molecular Medicine Reports. 13, 2320-2326 (2016).
- Hao, Y., Liu, J., Wang, Z., Yu, L., Wang, J. Piceatannol protects human retinal pigment epithelial cells against hydrogen peroxide induced oxidative stress and apoptosis through modulating. Nutrients. 11, 1-13 (2019).
- Ballinger, S. W., Van Houten, B., Conklin, C. A., Jin, G. F., Godley, B. F. Hydrogen peroxide causes significant mitochondrial DNA damage in human RPE cells. Experimental Eye Research. 68 (6), 765-772 (1999).
- Ma, S., et al. Transgenic overexpression of uncoupling protein 2 attenuates salt-induced vascular dysfunction by inhibition of oxidative stress. American Journal of Hypertension. 27 (3), 345-354 (2014).
- Johnen, S., et al. Sleeping Beauty transposon-mediated transfection of retinal and iris pigment epithelial cells. Investigative Ophthalmology and Visual Science. 53 (8), 4787-4796 (2012).
- Mátés, L., et al. Molecular evolution of a novel hyperactive Sleeping Beauty transposase enables robust stable gene transfer in vertebrates. Nature Genetics. 41 (6), 753-761 (2009).
- Marienfeld Technical information Neubauer-improved. , Available from: https://www.marienfeld-superior.com/information-about-our-counting-chambers.html (2020).
- Electron Microscopy Sciences. Neubauer Haemocytometry. , Available from: https://www.emsdiasum.com/microscopy/technical/datasheet/68052-14.aspx (2020).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2^(-ΔΔCT) method. Methods. 25 (4), San Diego, California. 402-408 (2001).
- Bascuas, T., et al. Non-virally transfected primary human pigment epithelium cells overexpressing the oxidative stress reduction factors PEDF and GM-CSF to treat retinal neurodegeneration neurodegenerationl. Human Gene Therapy. 30 (11), (2019).
- Zhuge, C. C., et al. Fullerenol protects retinal pigment epithelial cells from oxidative stress-induced premature senescence via activating SIRT1. Investigative Ophthalmology & Visual Science. 55 (7), 4628-4638 (2014).
- Kaczara, P., Sarna, T., Burke, M. Dynamics of H2O2 Availability to ARPE-19 cultures in models of oxidative stress. Free Radical Biology and Medicine. 48 (8), 1068-1070 (2010).
- Gorrini, C., Harris, I. S., Mak, T. W. Modulation of oxidative stress as an anticancer strategy. Nature Reviews Drug Discovery. 12, 931-947 (2013).
- Wang, X., et al. PEDF protects human retinal pigment epithelial cells against oxidative stress via upregulation of UCP2 expression. Molecular Medicine Reports. 19 (1), 59-74 (2019).
- Donadelli, M., Dando, I., Fiorini, C., Palmieri, M. UCP2, a mitochondrial protein regulated at multiple levels. Cellular and Molecular Life Sciences. 71, 1171-1190 (2014).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。