A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אינדוקציה וניתוח של עקה חמצונית ב היפהפייה הנרדמת טרנספוסון-transposon-transfected תאי אפיתל פיגמנט רשתית אנושית
In This Article
Summary
אנו מציגים פרוטוקול לפיתוח ושימוש במודל סטרס חמצוני על ידי טיפול בתאי אפיתל פיגמנט רשתית עם H2O2, ניתוח מורפולוגיה של תאים, כדאיות, צפיפות, גלוטתיון, ורמת UCP-2. זהו מודל שימושי לחקור את ההשפעה נוגדת החמצון של חלבונים המופרשים על ידי תאים transposon-transfected לטיפול ניוון neuroretinal.
Abstract
סטרס חמצוני ממלא תפקיד קריטי במספר מחלות ניווניות, כולל ניוון מקולרי הקשור לגיל (AMD), פתולוגיה המשפיעה על כ -30 מיליון חולים ברחבי העולם. זה מוביל לירידה אפיתל פיגמנט רשתית (RPE)-מסונתז גורמים neuroprotective, למשל, גורם פיגמנט נגזר אפיתל (PEDF) ו granulocyte-מקרופאג מושבה מגרה גורם (GM-CSF), ואחריו אובדן של תאי RPE, ובסופו של דבר פוטורצפטור ותא גנגליון רשתית (RGC) מוות. אנו משערים כי שחזור של סביבת הרשתית neuroprotective ו neurogenic על ידי השתלה תת-רינטלית של תאי RPE transfected overexpressing PEDF ו- GM-CSF יש פוטנציאל למנוע ניוון רשתית על ידי הקלה על ההשפעות של עקה חמצונית, עיכוב דלקת, ותמיכה בהישרדות התא. באמצעות מערכת טרנספוסון היפהפייה הנרדמת (SB100X) תאי RPE אנושיים הועברו עם הגנים PEDF ו- GM-CSF והראו שילוב גנים יציב, ביטוי גנים לטווח ארוך והפרשת חלבונים באמצעות qPCR, כתם מערבי, ELISA ואימונופלואורסצנטיות. כדי לאשר את הפונקציונליות ואת העוצמה של PEDF ו- GM-CSF המופרשים על ידי תאי RPE שהודבקו, פיתחנו מבחנה כדי לכמת את ההפחתה של H2O2- סטרס חמצוני המושרה על תאי RPE בתרבית. הגנה על התא הוערכת על ידי ניתוח מורפולוגיה של תאים, צפיפות, רמה תאית של גלוטתיון, ביטוי גן UCP2, ואת הכדאיות התא. שניהם, תאי RPE שהודבקו ב-PEDF ו/או GM-CSF ותאים שאינם מועברים אך מטופלים מראש עם PEDF ו/או GM-CSF (זמין או מטוהר באופן מסחרי מתאים שהודבקו) הראו הגנה משמעותית על תאים נוגדי חמצון בהשוואה לבקרות שאינן מטופלות. מודל H2O2הנוכחי הוא גישה פשוטה ויעילה להערכת ההשפעה נוגדת החמצון של גורמים שעשויים להיות יעילים לטיפול ב- AMD או במחלות ניווניות דומות.
Introduction
המודל המתואר כאן, מציע גישה שימושית כדי להעריך את היעילות של סוכניםbiopharmaceutical להפחתת עקה חמצונית בתאים. השתמשנו במודל כדי לחקור את ההשפעות המגנות של PEDF ו- GM-CSF על H2O2- מתח חמצוני מתווך על תאי אפיתל פיגמנט רשתית, אשר נחשפים לרמות גבוהות של O2, ואור גלוי, ואת phagocytosis של קרומי המגזר החיצוני photoreceptor, יצירת רמות משמעותיות של מינים חמצן תגובתי (ROS)1, 2. הם נחשבים לתורם מרכזי לפתוגנזה של ניוון מקולרי הקשור לגיל כלי דם (aAMD)3,4,5,6,7,8. חוץ מזה, יש ירידה בגורמים neuroprotective מסונתז RPE, במיוחד את הפיגמנט נגזר אפיתל גורם (PEDF), גורמי גדילה דמויי אינסולין (IGFs), ו granulocyte מקרופאג-מושבה מגרה גורם (GM-CSF) המוביל לתפקוד לקוי ואובדן של תאי RPE, ואחריו פוטורצפטור ותא גנגליון רשתית (RGC) מוות3,4,5 . AMD היא מחלה מורכבת הנובעת מהאינטראקציה בין גורמים מטבוליים, פונקציונליים, גנטיים וסביבתיים4. היעדר טיפולים עבור AAMD הוא הגורם העיקרי לעיוורון בחולים מעל גיל 60 במדינות מתועשות9,10. לחזרת הסביבה הנוירו-הגנתית והנוירוגנית ברשתית על ידי השתלה תת-רינטלית של תאי RPE מהונדסים גנטית המדחיקים יתר על המידה PEDF ו- GM-CSF יש פוטנציאל למנוע ניוון רשתית על ידי הקלה על ההשפעות של סטרס חמצוני, עיכוב דלקת ותמיכה בהישרדות תאים11,12,13,14,15,16 . למרות שיש מספר מתודולוגיות להעברת גנים לתאים, בחרנו במערכת הטרנספוסון ההיפראקטיבית של היפהפייה הנרדמת הלא ויראלית כדי להעביר את הגנים PEDF ו- GM-CSF לתאי RPE בגלל פרופיל הבטיחות שלה, שילוב הגנים בגנום של התאים המארחים, ונטייתו לשלב את הגנים המועברים באתרים פעילים שאינם תמלול כפי שהראינו בעבר17, 18,19.
סטרס חמצוני תאי יכול להיגרם בתאים בתרבית במבחנה על ידי מספר גורמים חמצוניים, כולל מי חמצן (H2O2), 4-הידרוינונאל (HNE), טרבוטיל הידופרוקסיד (tBH), מתחי חמצן גבוהים ואור גלוי (ספקטרום מלא או הקרנת UV)20,21. מתחי חמצן גבוהים ואור דורשים ציוד ותנאים מיוחדים, המגבילים את יכולת ההעברה למערכות אחרות. סוכנים כגון H2O2, HNE, ו- tBH גורמים לשינויים מולקולריים ותאיים חופפים של עקה חמצונית. בחרנו H2O2 כדי לבדוק את הפעילות נוגדת החמצון של PEDF ו- GM-CSF כי זה נוח ורלוונטי ביולוגית שכן הוא מיוצר על ידי תאי RPE כמו ביניים חמצן תגובתי במהלך פוטורצפטור קטע חוץ phagocytosis22 והוא נמצא ברקמות עינית vivo23. מאז חמצון גלוטתיון עשוי להיות אחראי חלקית על הייצור של H2O2 בעין, ניתחנו את רמות GSH / גלוטתיון במחקרים שלנו, אשר קשורים H2O2- סטרס חמצוני המושרה ואת היכולת ההתחדשותית של תאים21,22. הניתוח של רמות גלוטתיון רלוונטי במיוחד שכן הוא משתתף במנגנוני ההגנה נוגדי חמצון בעין24. חשיפהל- H 2 O2 משמשת לעתים קרובות כמודל לבחינת רגישות מתח חמצוני ופעילות נוגדת חמצון של תאי RPE1,25,26,27,28,29,30, ובנוסף, הוא מראה דמיון לנזק ללחץ חמצוני שנגרם לאור, מקור "פיזיולוגי" של סטרס חמצוני21.
כדי להעריך את הפונקציונליות ואת האפקטיביות של גורמים neuroprotective, פיתחנו מודל במבחנה המאפשר לניתוח לכמת את ההשפעה נוגד חמצונית של גורמי גדילה לידי ביטוי על ידי תאים מהונדסים גנטית כדי להגזים PEDF ו- GM-CSF. כאן, אנו מראים כי תאי RPE שהודבקו בגנים עבור PEDF ו- GM-CSF עמידים יותר להשפעות המזיקות של H2O2 מאשר תאי בקרה שאינם מודבקים, כפי שמעידים מורפולוגיה של תאים, צפיפות, כדאיות, רמה תאית של גלוטתיון, וביטוי של גן UCP2, אשר מקודדים לחלבון המיטוכונדריאלי 2 שהוכח כמפחית מינים חמצן תגובתי (ROS)31.
Access restricted. Please log in or start a trial to view this content.
Protocol
נהלי איסוף ושימוש בעיניים אנושיות אושרו על ידי הוועדה האתית הקטורונלית למחקר (מס' 2016-01726).
1. בידוד תאים ותנאי תרבות
- קו תאים ARPE-19 אנושי
- תרבות 5 x 105 תאי ARPE-19, קו תאי RPE אנושי, בתערובת בינונית/תזונתית של Dulbecco F-12 חזיר (F-12 של DMEM / Ham) בתוספת סרום בקר עוברי 10% (FBS), 80 פניצילין U / mL, 80 מיקרוגרם / mL סטרפטומיצין, ו 2.5 מיקרוגרם / מ"ל amphotericin B (בינוני מלא) ב 37 °C (5 °F) באטמוספירה לחה של 5% CO2 ו 95% אוויר בבקבוק T75 (עבור צפיפות תאים אחרים לראות טבלה 1).
- שנה את המדיום שלוש פעמים בשבוע.
- לאחר שהתאים גדלים לכ -90% מפגש (מוערך באיכות), שואפים למדיום ולשטוף את התאים עם PBS סטרילי 1x.
- לדגור על התאים עם פתרון EDTA EDTA 5% טריפסין-2% למשך 7-10 דקות ב 37 °C (עבור אמצעי אחסון ראה טבלה 1). נטר ניתוק באופן חזותי.
- הפסק טריפסיניזציה על-ידי הוספת מדיום מלא המכיל 10% FBS (עבור אמצעי אחסון ראה טבלה 1).
- בצע שינוי התאים (ראה שלב 2. של הפרוטוקול), לטפח את התאים ביחס של 1:10 (פעם בשבוע), או לזרוע בלוח 96-well המפורט להלן (ראה שלבים 3.3 ו- 3.4 של הפרוטוקול).
| בינוני (מ"ל) | ||||||
| שטח (ס"מ רבוע) | צפיפות זריעה עבור תאי ARPE-19 (תאים/באר) | יישום | עבור תרבית תאים | כדי לעצור טריפסין | נפח טריפסין (mL) | |
| בקבוקון T75 | 75 | 5,00,000 | צמיחת תאי ARPE-19 | 10 | 7 | 3 |
| 6 צלחת באר | 9.6 | 1,00,000 | זריעה של תאי ARPE-19 שהודבקו | 3 | 1 | 0.5 |
| 24 צלחת ובכן | 2 | 50,000 | זריעה של תאי hRPE שהודבקו | 1 | 0.8 | 0.2 |
| 96 צלחת באר | 0.32 | 5,000 לניסויי עקה חמצונית עם תאים שהודבקו (איור 1) | ניסויי עקה חמצונית | 0.2 | ||
| 3,000 לניסויי עקה חמצונית עם תאים שאינם מודבקים בתוספת חלבונים (איור 1) | ||||||
טבלה 1: כרכים של תרביות תאים. אמצעי אחסון מדיה מומלצים עבור לוחות תרבית תאים ובקבוקונים עבור התרבות של ARPE-19 ותאי RPE אנושיים ראשוניים.
- תאי RPE אנושיים ראשוניים
- לבודד תאי RPE אנושיים ראשוניים כפי שתואר על ידי Thumann et al.17, ותאי תרבות במדיום מלא בתוספת 20% FBS.
- שנה את המדיום פעמיים בשבוע. ברגע שהתאים מגיעים למפגש (מנוטר חזותית), הפחיתו את FBS ל-1% כדי להימנע מצפיפות יתר.
- בצע את התאים (ראה שלב 2 של הפרוטוקול), או זרע בלוח 96-well כמפורט להלן (ראה שלבים 3.3 ו- 3.4 של הפרוטוקול).
הערה: נתונים שהוצגו כאן נאספו מתרבות תאי RPE שהתקבלו מעיניהם של ארבעה תורמים אנושיים. טבלה 2 מפרטת את הדמוגרפיה של התורמים מבנק עין מתנת האריות (סנט פול, MN). העיניים היו enleed 12.7 ± 5.7 שעות (ממוצע ± SD) לאחר קבלת הסכמה מדעת בהתאם להצהרת הלסינקי.
| לא | גיל | מין | מוות לשימור (שעות) | מוות לבידוד | טיפוח | טיפוח | סימן בגרף | |
| (ימים) | לפני טרנספקט (ימים) | לאחר טרנספקט (ימים) | ||||||
| 2 | 80 | M | 20.7 | 8 | 140 | 36 |  | |
| 3 | 86 | F | 12.8 | 8 | 85 | 45 |  | |
| 4 | 86 | F | 8.5 | 5 | 26 | 133 |  | |
| 8 | 83 | F | 8.9 | 6 | 18 | 27 |  | |
| התכוון | 83.8 | 12.7 | 6.8 | 67.3 | 60.3 | |||
| SD | 2.9 | 5.7 | 1.5 | 57.0 | 49.1 |
טבלה 2: דמוגרפיה של תורמים אנושיים לתאי אפיתל פיגמנט רשתית.
2. אלקטרופורציה של ARPE-19 ותאי RPE אנושיים ראשוניים
- Trypsinize ARPE-19 תאים או תאי RPE אנושיים ראשוניים כמתואר בשלבים 1.1.3-1.1.5 של הפרוטוקול.
- בצע אלקטרופורציה עם ערכת transfection זמין מסחרית (ראה טבלה של חומרים).
- עבור transfection של ARPE-19 תאים מתייחס יוחנן ואח'32 ועל hRPE ראשי לתאומן ואח'17. בקצרה, resuspend 1 x 105 תאי ARPE-19 או 5 x 104 תאי hRPE ראשיים ב 11 μL של חוצץ R ולהוסיף 2 μL של תערובת plasmid המכיל 0.03 מיקרוגרם pSB100X transposase33 ו 0.47 μg pT2-CMV-PEDF- שלו או pT2-CMV-GMCSF-טרנספוסון שלו (טרנספוסאז יחס:transposon 1:16). עבור תאי PEDF ו- GM-CSF כפולים, השתמש ביחס של 1:16:16 (0.03 מיקרוגרם pSB100X, 0.47 מיקרוגרם pT2-CMV-PEDF-His, ו- 0.47 מיקרוגרם pT2-CMV-GMCSF-שלו). השתמש בפרמטרים הבאים electroporation: שתי פעימות של 1,350 V עבור 20 ms (רוחב דופק) עבור תאי ARPE-19; שני פולסים של 1,100 V עבור 20 אלפיות השנייה לתאים ראשוניים.
- זרע 1 x 105 ARPE-19 או 5 x 104 תאי hRPE ראשוניים שהודבקו בצלחות 6-well ו-24-well, בהתאמה, ב-10% FBS ללא אנטיביוטיקה או תרופות אנטי-מיקוטיות. הוסף פניצילין (80 U/mL), סטרפטומיצין (80 מיקרוגרם /מ"ל) ואמפוטריצין B (2.5 מיקרוגרם/מ"ל) עם החילוף הבינוני הראשון 3 ימים לאחר טרנספקטו.
- לקבוע את צמיחת התא על ידי ניטור מיקרוסקופי שבועי של התאים. יעילות טרנספקטיון מנוטרת על ידי ניתוח ביטוי גנים על ידי RT-PCR, והפרשת חלבונים על ידי ELISA ו- WB (שיטות המוסברות בחומר משלים).
הערה: יעילות טרנספקטו ניתן להעריך בפעם הראשונה ברגע התאים להגיע למפגש, כלומר, ב ~ 7 ימים ו 4 שבועות לאחר transfection עבור תאי ARPE-19 ותאי hRPE ראשיים, בהתאמה. - תאי זרעים בלוח של 96 באר ומפורט להלן (ראה שלב 3.5 של הפרוטוקול).
3. אינדוקציה של סטרס חמצוני (טיפול H2O2) והגנה עצבית (PEDF ו/או טיפול GM-CSF)
- הכנת מדיום מותנה של תאי ARPE-19 שהודבקו
- השתמש בתאי ARPE-19 שהודבקו בגנים PEDF, GM-CSF, או שניהם (ראה שלב 2 של הפרוטוקול); תאי תרבות במשך 28 ימים כמתואר בשלב 1.1 של הפרוטוקול.
- ב 28 ימים לאחר transfection, תאי טריפסין (ראה שלבים 1.1.3-1.1.5 של הפרוטוקול), לספור תאים באמצעות תא Neubauer34,35, וזרע 5 x 105 תאים בבקבוקי T75 במדיום מלא כמתואר בשלב 1.1.1 של הפרוטוקול. החלף את המדיום כאשר תרבית התא היא כ 80% confluent (כ לאחר שבוע; מאומת איכות). לאסוף את המדיום לאחר 24 שעות.
- יש לאחסן את המדיום ב-20 °C (70 °F) עד לשימוש.
הערה: ריכוז מספיק של PEDF רקומביננטי ו- GM-CSF במדיום המותנה אומת על ידי WB וכימת על ידי ELISA כמתואר בחומר משלים.
- טיהור PEDF ו- GM-CSF מאמצעי מותנה של תאי ARPE-19 שהודבקו
- צנטריפוגות המדיום שנאסף מ שלב 3.1.2 ב 10,000 x g במשך 15 דקות ב 4 °C (70 °F).
- השתמש בזרימת העל של Ni-NTA (ראה טבלת חומרים) בהתאם לפרוטוקולי היצרן כדי לטהר חלבונים מתויגים שלו כמתואר להלן.
- Pipette 30 μL של תערובת Ni-NTA לתוך צינור 1.5 מ"ל צנטריפוגה ב 2,600 x g עבור 30 s ולהשליך את הזרימה דרך. לשטוף את הכדור פעמיים עם 200 μL של חוצץ הדגירה 1x.
- צנטריפוגה ב 2,600 x g עבור 30 s ולהשליך את הזרימה דרך. הוסף 40 μL של 4x חוצץ דגירה ו resuspend.
- הוסף 900 μL של בינוני מותנה צנטריפוגות ודגורה ב 70 סל"ד (שייקר מסלולית) עבור 1 שעה ב RT. צנטריפוגה ב 2,600 x גרם במשך 1 דקות ואת זרימה להשליך דרך.
- לשטוף את הכדור פעמיים עם 175 μL של חוצץ הדגירה 1x. צנטריפוגה ב 2,600 x g עבור 30 s ולהשליך את הזרימה דרך.
- כדי לחמוק מחלבוני PEDF ו-GM-CSF מתויגים שלו, הוסיפו 20 מיקרו-אל של חיץ אלוטיון ודגרה ב-70 סל"ד (שייקר מסלולי) למשך 20 דקות ב-RT. צנטריפוגה ב-2,600 x גרם ל-30 מעלות. שמור על סופר-טבעי המכיל PEDF רקומביננטי או GM-CSF.
- לכמת את סך החלבון באמצעות ערכת החלבון BCA הזמינה מסחרית (ראה טבלת חומרים) בהתאם להוראות היצרן.
- יש לאחסן את תמיסה חלבון ב-20 °C (70 °F) עד לשימוש.
הערה: מאגר הדגירה (4x) מכיל 200 מ"מ NaH2PO4,1.2 M NaCl, ו 40 mM Imidazol; מאגר Elution מכיל 50 מ"מ NaH2PO4,300 מ"מ NaCl, ו 250 mM Imidazol.
- טיפול בתאי ARPE-19/hRPE לא מודבקים עם מדיום מותנה בתוספת H2O2 (איור 1A)
- זרע 3,000 ARPE-19 שאינם מודבקים (מהשלב 1.1.6 של הפרוטוקול) או hRPE ראשי (מהשלב 1.2.3 של הפרוטוקול) תאים לבאר בצלחת ובתרבית של 96 טוב ב- 200 μL של מדיום מותנה מתאי ARPE-19 שהודבקו.
- תרבית התאים במשך 10 ימים ב 37 °C (5 °F) באטמוספירה לחה של 5% CO2 ו 95% אוויר. שנה את המדיום המותנה כל יום. לחשוף את התאים 350 μM H2O2 עבור 24 שעות.
- להעריך נזק סטרס חמצוני ולקבוע את ההשפעה נוגדת החמצון של PEDF ו- GM-CSF על ידי כימות של רמות גלוטתיון (ראה שלב 4.1 של הפרוטוקול), מיקרוסקופיה (ראה שלב 4.2 של הפרוטוקול) ובוחן ציטוטוקסיות (ראה שלב 4.2 של הפרוטוקול).
הערה: משך הניסוי הוא 12 ימים. לוחות מיקרווול שטוחים ברורים משמשים להערכת זוהר כמו גם מורפולוגיה של תאים. כדי לבצע בו זמנית את הציטוקסיות ואת ההבחנה גלוטתיון, שתי צלחות חייבות להיות זרע עם תאים באותו יום.
- טיפול בתאי ARPE-19/hRPE לא מהודבקים עם גורמי גדילה של PEDF ו- GM-CSF בתוספת H2O2 (איור 1B)
- זרע 3,000 ARPE-19 שאינם מודבקים (החל מהשלב 1.1.6 של הפרוטוקול) או hRPE ראשי (מהשלב 1.2.3 של הפרוטוקול) תאים לבאר (לוחות 96-well עם תחתית שטוחה ברורה) ב-200 μL של מדיום תרבית מלא המכיל 500 ננוגרם/מ"ל רקומביננטי PEDF ו/או 50 ng/mL רקומביננטי GM-CSF, מטוהרים מהמדיום של תאי ARPE-19 שהודבקו או זמינים מסחרית. תאי תרבות עבור 48 שעות ב 37 °C (5 °F) באטמוספירה לחה של 5% CO2 ו 95% אוויר. לחדש את המדיום כולל גורמי גדילה PEDF ו- GM-CSF מדי יום.
הערה: הוסף את גורמי הצמיחה טריים למדיום. - לאחר 48 שעות של טיפול בתאים עם גורמי גדילה, להסיר את המדיום ולהוסיף מדיום מלא המכיל 350 μM H2O2 בתוספת 500 ng / mL PEDF ו / או 50 ng / mL GM-CSF.
- להעריך נזק סטרס חמצוני ולקבוע את ההשפעה נוגדת החמצון של PEDF ו- GM-CSF על ידי כימות של רמות גלוטתיון (ראה שלב 4.1 של הפרוטוקול), מיקרוסקופיה (ראה שלב 4.2 של הפרוטוקול) ובוחן ציטוטוקסיות (ראה שלב 4.2 של הפרוטוקול).
הערה: משך הניסוי הוא 3 ימים.
- זרע 3,000 ARPE-19 שאינם מודבקים (החל מהשלב 1.1.6 של הפרוטוקול) או hRPE ראשי (מהשלב 1.2.3 של הפרוטוקול) תאים לבאר (לוחות 96-well עם תחתית שטוחה ברורה) ב-200 μL של מדיום תרבית מלא המכיל 500 ננוגרם/מ"ל רקומביננטי PEDF ו/או 50 ng/mL רקומביננטי GM-CSF, מטוהרים מהמדיום של תאי ARPE-19 שהודבקו או זמינים מסחרית. תאי תרבות עבור 48 שעות ב 37 °C (5 °F) באטמוספירה לחה של 5% CO2 ו 95% אוויר. לחדש את המדיום כולל גורמי גדילה PEDF ו- GM-CSF מדי יום.
- טיפול בתאי ARPE-19/hRPE ראשוניים עם H2O2 (איור 1C)
- אמת ביטוי גנים מספיק והפרשת חלבונים של תאים שהודבקו על ידי WB ו- ELISA כמתואר בחומר המשלים.
- הסר את המדיום מהבארות המכילות את התאים שהודבקו (ראה שלב 2 בפרוטוקול).
- Trypsinize תאים כמתואר בשלבים 1.1.3-1.1.5 של הפרוטוקול. לספור את התאים באמצעות תא Neubauer34,35.
- זרע 5,000 תאים שהודבקו / באר בצלחת 96-well ב 200 μL של מדיום מלא. תאי תרבות עבור 24 שעות ב 37 °C (5 °F) באטמוספירה לחה של 5% CO2 ו 95% אוויר. לאחר 24 שעות, לחשוף את התאים 350 μM H2O2 עבור 24 שעות.
- להעריך נזק סטרס חמצוני ולקבוע את ההשפעה נוגדת החמצון של PEDF ו- GM-CSF על ידי כימות של רמות גלוטתיון (ראה שלב 4.1 של הפרוטוקול), מיקרוסקופיה (ראה שלב 4.2 של הפרוטוקול), בדיקת ציטוטוקסיות (ראה שלב 4.2 של הפרוטוקול) וקביעת ביטוי גנים UCP2 (ראה שלב 4.3 של הפרוטוקול).
הערה: משך הניסוי הוא יומיים.
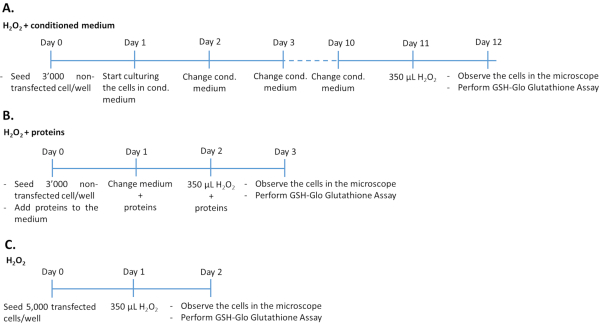
איור 1: לוחות זמנים של בדיקת H2O2 בשלוש הגישות הניסיוניות השונות. 3,000 תאים שאינם נגועים שטופלו בחלבונים בינוניים/רקומביננטיים מותנים או 5,000 תאים שהודבקו נזרעו ב-96 צלחות היטב לטיפול ב-H2O2. כדי לקבוע את ההשפעה של מדיום מותנה, התאים היו בתרבית של 100% בינוני בתרבית במשך 10 ימים רצופים, משתנים מדיום כל יום. כדי לקבוע את ההשפעה של גורמי גדילה רקומביננטיים, תאים היו בתרבית על ידי הוספת הכמות המתאימה של גורמי גדילה בכל יום במשך 3 ימים רצופים. שים לב כי תאים שאינם transfected נזרעו ב 3,000 תאים לבאר כדי למנוע גידול יתר במהלך זמן התרבות הארוך יותר בהשוואה לתאים transfected. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
4. ניתוח של רמת עקה חמצונית ויכולת נוגדת חמצון
- גלוטתיון אסאי
- מדוד את רמות גלוטתיון (GSH) באמצעות הערכה הזמינה מסחרית (ראה טבלת חומרים) בהתאם להוראות היצרן. בקצרה, להכין ונפח מתאים של תערובת ריאגנט 1x (100 μL ריאגנט / טוב): לוציפרין-NT מצע גלוטתיון S-Transferase מדולל 1:100 במאגר התגובה.
הערה: צלחת 96-well דורש 10 מ"ל של 1x תערובת ריאגנט, אשר מוכן על ידי הוספת 100 μL של מצע לוציפרין-NT ו 100 μL של גלוטתיון S-Transferase ל 10 מ"ל של חוצץ תגובה. הכן את תערובת ריאגנט 1x מיד לפני השימוש. אין לאחסן תערובת ריאגנט מוכנה לשימוש עתידי. - הכן את ריאגנט זיהוי לוציפרין על ידי העברת בקבוק אחד של חוצץ שחזור לריגנט זיהוי לוציפרין ליופילי.
- הכן עקומה סטנדרטית באמצעות פתרון סטנדרטי גלוטתיון (GSH) (5 מ"מ). לדלל 5 mM פתרון GSH 1:100 עם dH2O (להוסיף 10 μL של פתרון GSH 5 mM ל 990 μL של dH2O). בצע 7 דילול טורי 1:1 ב 500 μL של dH2O. העבר 10 μL של כל תקן מדולל לבאר מתאימה כפול.
הערה: הריכוז הסופי של גלוטתיון ינוע בין 0.039 מיקרומטר ל 5 מיקרומטר. - הכן את ריק (1x תערובת ריאגנט) ולהעביר 10 μL (כפילויות) לבארות המתאימות.
- הסר את H2O2תאים שטופלו מן האינקובטור.
הערה: תעד את המורפולוגיה של התאים H2O2שטופלו על ידי מיקרוסקופיה Brightfield (40x).
כאשר התאים מחומצנים, הם נראים מעוגלים יותר ופחות מפוזרים. - שאפו בזהירות את המדיום התרבותי. הוסיפו 100 מיקרו-אל של תערובת ריאגנט 1x מוכנה לכל באר. מערבבים את התאים עם ריאגנט עבור 15 s ב 500 סל"ד על שייקר מסלולית.
- לדגור על הצלחת ב RT במשך 30 דקות. הוסף 100 μL של ריאגנט זיהוי לוציפרין מחדש לכל באר.
- מערבבים את התמיסה ל-15 s ב-500 סל"ד בשייקר מסלולי. לדגור על הצלחת במשך 15 דקות ב RT.
- קבע את ההארה באמצעות קורא לוחות באמצעות תוכנית מותקנת מראש ADP-Glo.
הערה: שים את הצלחת בתוך קורא הלוחות ללא המכסה.- לחץ על שינוי פריסה ובחר את ההגדרות הבאות בפרמטרים בסיסיים: צלחת Costar 96-well; אופטיקה עליונה; השהיית מיקום: 0.1; שעת התחלה של מדידה: 0.0; זמן מרווח מדידה: 1.0; זמן לנרמל את התוצאות: 0.0; הרווח מותאם באופן אוטומטי על-ידי ההתקן. הגדר ריקים, תקנים ודוגמאות. לחץ על התחל מדידה.
- יצא את הנתונים כקובץ Excel. חשב את הריכוז של GSH בכל מדגם על ידי אינטרפולציה של העקומה הסטנדרטית.
- מדוד את רמות גלוטתיון (GSH) באמצעות הערכה הזמינה מסחרית (ראה טבלת חומרים) בהתאם להוראות היצרן. בקצרה, להכין ונפח מתאים של תערובת ריאגנט 1x (100 μL ריאגנט / טוב): לוציפרין-NT מצע גלוטתיון S-Transferase מדולל 1:100 במאגר התגובה.
- ציטוקסיה וניתוח מיקרוסקופי
- שאפו את המדיום מהתאים והוסיפו 100 μL של מדיום מלא המכיל 1% FBS לכל באר. תחזיר את התאים לאינקובטור.
הערה: 1% FBS משמש מכיוון שאחוזים גבוהים יותר של FBS יכולים להפריע למדידת הערך, ולכן נעשה שימוש ב- 1% FBS במקרה זה. - מדוד את הכדאיות של התא באמצעות ערכת ה- Assay של ציטוקסיה הזמינה מסחרית (ראה טבלת חומרים) בהתאם להוראות היצרן. בקצרה, להכין את תערובת ריאגנט הוספת חוצץ אסאי למצע ליופילי. הכן את ריאגנט ליסיס על ידי הוספת 33 μL Digitonin למאגר 5 מ"ל אסאי (עבור צלחת אחת 96-well). מערבבים היטב על ידי צנרת למעלה ולמטה כדי להבטיח הומוגניות.
הערה: לקבלת תוצאות מיטביות, יש להשתמש בתערובת ריאגנט טרייה. יש להשתמש בתוך 12 שעות אם מאוחסן ב- RT. תערובת ריאגנט ניתן לאחסן ב 4 °C (7 ימים) וניתן לאחסן אותו ב aliquots לשימוש יחיד עד 4 חודשים ב -70 °C (70 °F). יש להימנע מהקפאה והפשרה. ליסיס ריאגנט ניתן לאחסן ב 4 °C (7 ימים). - הכן עקומה סטנדרטית עם תאי ARPE-19 לא מטופלים.
- Trypsinize התאים כמתואר בשלבים 1.1.3-1.1.5 של הפרוטוקול ולספור את התאים באמצעות תא Neubauer34,35. צנטריפוגות התאים ב 120 גרם במשך 10 דקות ב RT. לשאוף supernatant ול resuspend גלולה התא במדיום F12 של DMEM / Ham המכיל 1% FBS לריכוז סופי של 1 x 105 תאים / מ"ל.
- הכן 7 דילול טורי 1:1 ב 200 μL בינוני המכיל 1% FBS. העבר 100 μL של כל תקן לבארות המתאימות (כפילויות). מוסיפים 50 μL של תערובת ריאגנט לכל בארות.
- מערבבים את התאים עם ריאגנט עבור 15 s ב 500 סל"ד על שייקר מסלולית. לדגור על הצלחת במשך 15 דקות ב RT. למדוד את אור באמצעות קורא הלוחות כמתואר בשלב 4.1.9 של הפרוטוקול. מוסיפים 50 μL של ריאגנט תמוגה ודגרה במשך 15 דקות. מדוד את אור ההשתנות באמצעות קורא הלוחות כמתואר בשלב 4.1.9 של הפרוטוקול.
- חשב את אחוז התאים בני קיימא: (100 - % תאים מתים) ואת אחוז התאים המתים = [מדידת אור 1 ((תאים מתים במדגם))/ מדידת אור שנייה (כל התאים מתים לאחר טיפול דיגיטונין)] x 100.
- שאפו את המדיום מהתאים והוסיפו 100 μL של מדיום מלא המכיל 1% FBS לכל באר. תחזיר את התאים לאינקובטור.
- ניתוח ביטוי UCP2 על-ידי RT-qPCR
- Trypsinize תאים transfected כמתואר לעיל (שלבים 1.1.3-1.1.5 של הפרוטוקול).
- לספור את התאים באמצעות תא Neubauer34,35.
- זרע 5,000 תאי ARPE-19 מודבקים / באר בלוחות 96-well.
- לאחר 24 שעות של תרבית, לטפל בתאים עם 350 μM H2O2 עבור 24 שעות.
- בודד את ה- RNA הכולל באמצעות ערכה מסחרית לבידוד RNA ממספר נמוך של תאים (ראה טבלת חומרים) בהתאם להוראת היצרן.
- בצע PCR כמותי בזמן אמת (RT-qPCR) כמתואר בחומר משלים. בקצרה, ליצור cDNA על ידי retrotranscription באמצעות תערובת זמינה מסחרית המכיל M-MLV הפוך Transcriptase ממוטב (ראה טבלת חומרים).
- עבור qPCR, השתמש בקוקטייל תגובה מוכן לשימוש המכיל את כל הרכיבים (כולל SYBR Green) למעט פריימרים (ראה טבלה S1 של חומר משלים)ותבנית DNA. השתמש בתנאי thermocycling הבאים: denaturation הראשוני ב 95 °C (75 °F) במשך 10 דקות, 40 מחזורים עם denaturation ב 95 °C (75 °F) עבור 15 °C (60 °F) עבור 30 °C ,והארכות ב 72 °C (72 °F) עבור 32 מעלות צלזיוס.
- השתמש בשיטת 2^(-ΔΔCT) לניתוח36.
- הכנת lysate תא עבור SDS-PAGE ו- WB ניתוח של pAkt (Ser473)
- זרע 3 x 105 GM-CSF-transfected ARPE-19 תאים / באר בלוחות 6-בארות (≥21 ימים לאחר transfection) כדי לקבוע אם GM-CSF מגן על תאי RPE מפני נזק על ידי H2O2 באמצעות הפעלת מסלול ההישרדות Akt15.
- לאחר 24 שעות של תאי תרבות נחשפים 350 μM H2O2 עבור 24 שעות.
- לערבב 1 מ"ל של חיץ RIPA עם 10 μL של קוקטייל מעכבי פוספטאז פרוטאז, 10 μL של 0.5 M EDTA, ו 25 μL של 8 M אוריאה (כרכים המשמשים באר אחת).
- שאפו בזהירות בינוני ולשטוף את התאים עם 1x PBS.
- הוסף את כל אמצעי האחסון של תערובת מאגר RIPA לתאים.
- פיפטה למעלה ולמטה.
- לאסוף את lysate בצינורות 1.5 מ"ל.
- צנטריפוגה ב 20,000 x g במשך 30 דקות ב 4 °C (70 °F).
- העבר את supernatant לצינור חדש 1.5 מ"ל.
- לקבוע את רמות pAkt ב 15 μL של lysate תא לא דולל על ידי WB כמתואר בחומר משלים.
Access restricted. Please log in or start a trial to view this content.
תוצאות
אינדוקציה של עקה חמצונית בתאי אפיתל פיגמנט הרשתית האנושית
ARPE-19 ותאי hRPE ראשוניים טופלו בריכוזים משתנים של H2O2 למשך 24 שעות והרמה התארית של גלוטתיון נוגד חמצון כמתה (איור 2A,B). H2O2 ב 50 μM ו 100 μM לא השפיע על ייצור גלוטתיו...
Access restricted. Please log in or start a trial to view this content.
Discussion
הפרוטוקול המוצג כאן מציע גישה לנתח את הפונקציה נוגד חמצונית ומגנה של PEDF ו- GM-CSF המיוצר על ידי תאים transfected, אשר ניתן להחיל על תאים transfected עם כל גן מועיל putative. באסטרטגיות טיפוליות גנטיות שמטרתן להעביר חלבונים לרקמה על ידי השתלת תאים מהונדסים גנטית, חשוב לקבל מידע על רמת ביטוי החלבון, תוחלת החיי?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מבקשים להודות לגרג סילי ואלן קונטי על הסיוע הטכני המצוין ולפרופ' זוזסאנה איזבק ממרכז מקס-דלבריק בברלין על שסיפקו בחביבות את pSB100X ו- pT2-CAGGS -ונוס פלסמידים. עבודה זו נתמכה על ידי הקרן השוויצרית הלאומית למדעים והנציבות האירופית בהקשר של תוכנית המסגרת השביעית. Z.I מומן על ידי מועצת המחקר האירופית, ERC מתקדם [ERC-2011-ADG 294742].
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 24-well plates | Corning | 353047 | |
| 6-well plates | Greiner | 7657160 | |
| 96-well culture plate white with clear flat bottom | Costar | 3610 | Allows to check the cells before measuring the luminescence (GSH-Glo Assay) |
| 96-well plates | Corning | 353072 | |
| Acrylamid 40% | Biorad | 161-0144 | |
| Amphotericin B | AMIMED | 4-05F00-H | |
| Antibody anti-GMCSF | ThermoFisher Scientific | PA5-24184 | |
| Antibody anti-mouse IgG/IgA/IgM | Agilent | P0260 | |
| Antibody anti-PEDF | Santa Cruz Biotechnology Inc | sc-390172 | |
| Antibody anti-penta-His | Qiagen | 34660 | |
| Antibody anti-phospho-Akt | Cell Signaling Technology | 9271 | |
| Antibody anti-rabbit IgG H&L-HRP | Abcam | ab6721 | |
| Antibody donkey anti-rabbit Alexa Fluor 594 | ThermoFisher Scientific | A11034 | |
| Antibody goat anti-mouse Alexa 488 | ThermoFisher Scientific | A-11029 | |
| ARPE-19 cell line | ATCC | CRL-2302 | |
| BSA | Sigma-Aldrich | A9418-500G | |
| chamber culture glass slides | Corning | 354118 | |
| CytoTox-Glo Cytotoxicity Assay | Promega | G9291 | |
| DAPI | Sigma-Aldrich | D9542-5MG | |
| DMEM/Ham`s F12 | Sigma-Aldrich | D8062 | |
| Duo Set ELISA kit | R&D Systems | DY215-05 | |
| EDTA | ThermoFisher Scientific | 78440 | |
| ELISAquant kit | BioProducts MD | PED613-10-Human | |
| Eyes (human) | Lions Gift of Sight Eye Bank (Saint Paul, MN) | ||
| FBS | Brunschwig | P40-37500 | |
| Fluoromount Aqueous Mounting Medium | Sigma-Aldrich | F4680-25ML | |
| FLUOstar Omega plate reader | BMG Labtech | ||
| GraphPad Prism software (version 8.0) | GraphPad Software, Inc. | ||
| GSH-Glo Glutathione Assay | Promega | V6912 | |
| hydrogen peroxide (H2O2) | Merck | 107209 | |
| ImageJ software (image processing program) | W.S. Rasband, NIH, Bethesda, MD, USA; https://imagej.nih.gov/ij/; 1997–2014 | ||
| Imidazol | Axonlab | A1378.0010 | |
| Leica DMI4000B microscope | Leica Microsystems | ||
| LightCycler 480 Instrument II | Roche Molecular Systems | ||
| LightCycler 480 SW1.5.1 software | Roche Molecular Systems | ||
| NaCl | Sigma-Aldrich | 71376-1000 | |
| NaH2PO4 | Axonlab | 3468.1000 | |
| Neon Transfection System | ThermoFisher Scientific | MPK5000 | |
| Neon Transfection System 10 µL Kit | ThermoFisher Scientific | MPK1096 | |
| Neubauer chamber | Marienfeld-superior | 640010 | |
| Ni-NTA superflow | Qiagen | 30410 | |
| Nitrocellulose | VWR | 732-3197 | |
| Omega Lum G Gel Imaging System | Aplegen Life Science | ||
| PBS 1X | Sigma-Aldrich | D8537 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P0781-100 | |
| PerfeCTa SYBR Green FastMix | Quantabio | 95072-012 | |
| PFA | Sigma-Aldrich | 158127-100G | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23227 | |
| Primers | Invitrogen | See Table 1 in Supplementary Materials | |
| pSB100X (250 ng/µL) | Mátés et al., 2009. Provide by Prof. Zsuzsanna Izsvak | ||
| pT2-CMV-GMCSF-His plasmid DNA (250 ng/µL) | Constructed using the existing pT2-CMV-PEDF-EGFP plasmid reported in Johnen, S. et al. (2012) IOVS, 53 (8), 4787-4796. | ||
| pT2-CMV-PEDF-His plasmid DNA (250 ng/µL) | Constructed using the existing pT2-CMV-PEDF-EGFP plasmid reported in Johnen, S. et al. (2012) IOVS, 53 (8), 4787-4796. | ||
| QIAamp DNA Mini Kit | QIAGEN | 51304 | |
| recombinant hGM-CSF | Peprotech | 100-11 | |
| recombinant hPEDF | BioProductsMD | 004-096 | |
| ReliaPrep RNA Cell Miniprep System | Promega | Z6011 | |
| RIPA buffer | ThermoFisher Scientific | 89901 | |
| RNase-free DNase Set | QIAGEN | 79254 | |
| RNeasy Mini Kit | QIAGEN | 74204 | |
| SDS | Applichem | A2572 | |
| Semi-dry transfer system for WB | Bio-Rad | ||
| SuperMix qScript | Quantabio | 95048-025 | |
| Tris-buffered saline (TBS) | ThermoFisher Scientific | 15504020 | |
| Triton X-100 | AppliChem | A4975 | |
| Trypsin/EDTA | Sigma-Aldrich | T4174 | |
| Tween | AppliChem | A1390 | |
| Urea | ThermoFisher Scientific | 29700 | |
| WesternBright ECL HRP substrate | Advansta | K-12045-D50 | |
| Whatman nitrocellulose membrane | Chemie Brunschwig | MNSC04530301 |
References
- Zareba, M., Raciti, M. W., Henry, M. M., Sarna, T., Burke, J. M. Oxidative stress in ARPE-19 cultures: Do melanosomes confer cytoprotection. Free Radical Biology and Medicine. 40 (1), 87-100 (2006).
- Gong, X., Draper, C. S., Allison, G. S., Marisiddaiah, R., Rubin, L. P. Effects of the macular carotenoid lutein in human retinal pigment epithelial cells. Antioxidants. 6 (4), (2017).
- Sacconi, R., Corbelli, E., Querques, L., Bandello, F., Querques, G. A Review of current and future management of geographic atrophy. Ophthalmology and Therapy. 6, 69-77 (2017).
- Al-Zamil, W. M., Yassin, S. A. Recent developments in age-related macular degeneration: a review. Clinical Interventions in Aging. 12, 1313-1330 (2017).
- Kumar-Singh, R. The role of complement membrane attack complex in dry and wet AMD - From hypothesis to clinical trials. Experimental Eye Research. 184, 266-277 (2019).
- Ung, L., Pattamatta, U., Carnt, N., Wilkinson-Berka, J. L., Liew, G., White, A. J. R. Oxidative stress and reactive oxygen species. Clinical Science. 131, 2865-2883 (2017).
- Beatty, S., Koh, H. H., Phil, M., Henson, D., Boulton, M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Survey of Ophthalmology. 45 (2), 115-134 (2000).
- Alhasani, R. H., et al. Gypenosides protect retinal pigment epithelium cells from oxidative stress. Food and Chemical Toxicology. 112, 76-85 (2018).
- National Institute of Health. , Available from: https://nei.nih.gov/learn-about-eye-health/resources-for-health-educators/eye-health-data-and-statistics/age-related-macular-degeneration-amd-data-and-statistics (2020).
- Mitchell, P., Liew, G., Gopinath, B., Wong, T. Y. Age-related macular degeneration. The Lancet. 392, 1147-1159 (2018).
- He, Y., Leung, K. W., Ren, Y., Jinzhi, P., Jian, G., Tombran-Tink, J. PEDF improves mitochondrial function in RPE cells during oxidative stress. Investigative Ophthalmology & Visual Science. 55, 6742-6755 (2014).
- Cao, S., Walker, G. B., Wang, X., Cui, J. Z., Matsubara, J. A. Altered cytokine profiles of human retinal pigment epithelium: Oxidant injury and replicative senescence. Molecular Vision. 19, 718-728 (2013).
- Farnoodian, M., Sorenson, C. M., Sheibani, N. PEDF expression affects the oxidative and inflammatory state of choroidal endothelial cells. Amercian Journal of Physiology and Cell Physiology. 314 (4), 456-472 (2018).
- Polato, F., Becerra, S. P. Retinal Degenerative Diseases: Mechanisms and Experimental Therapies. Retinal Degenerative Diseases. , Springer. 699-706 (2016).
- Schallenberg, M., Charalambous, P., Thanos, S. GM-CSF regulates the ERK1/2 pathways and protects injured retinal ganglion cells from induced death. Experimental Eye Research. 89, 665-677 (2009).
- Schallenberg, M., Charalambous, P., Thanos, S. GM-CSF protects rat photoreceptors from death by activating the SRC-dependent signalling and elevating anti-apoptotic factors and neurotrophins. Graefes Archives for Clinical and Experimental Ophthalmology. 250, 699-712 (2012).
- Thumann, G., et al. Engineering of PEDF-expressing primary pigment epithelial cells by the SB transposon system delivered by pFAR4 plasmids. Molecular Therapy - Nucleic Acids. 6, 302-314 (2017).
- Garcia-Garcia, L., et al. Long-term PEDF release in rat iris and retinal epithelial cells after Sleeping Beauty transposon-mediated gene delivery. Molecular Therapy - Nucleic Acids. 9, 1-11 (2017).
- Johnen, S., et al. Antiangiogenic and neurogenic activities of Sleeping Beauty-mediated PEDF-transfected RPE cells in vitro and in vivo. BioMed Research International. 2015, (2015).
- Weigel, A. L., Handa, J. T., Hjelmeland, M. L. Microarray analysis of H2O2-, HNE-, or tBH-treated ARPE-19 cells. Free Radical Biology & Medicine. 33 (10), 1419-1432 (2002).
- Allen, R. G., Tresini, M. Oxidative stress and gene regulation. Free Radical Biology and Medicine. 28 (3), 463-499 (2000).
- Tate, D. J., Miceli, M. V., Newsome, D. A. Phagocytosis and H2O2 induce catalase and metallothionein gene expression in human retinal pigment epithelial cells. Investigative Ophthalmology and Visual Science. 36 (7), 1271-1279 (1995).
- Halliwell, B., Clement, M. V., Long, L. H. Hydrogen peroxide in the human body. FEBS Letters. 486 (1), 10-13 (2000).
- Giblin, F. J., McCready, J. P., Kodama, T., Reddy, V. N. A direct correlation between the levels of ascorbic acid and H2O2 in aqueous humor. Experimental Eye Research. 38, 87-93 (1984).
- Geiger, R. C., Waters, C. M., Kamp, D. W., Glucksberg, M. R. KGF prevents oxygen-mediated damage in ARPE-19 cells. Investigative Ophthalmology and Visual Science. 46, 3435-3442 (2005).
- Campochiaro, P. A., et al. Lentiviral vector gene transfer of endostatin/angiostatin for macular degeneration (GEM) study. Human Gene Therapy. 28, 99-111 (2017).
- Chen, X. -D., Su, M. -Y., Chen, T. -T., Hong, H. -Y., Han, A. -D., Li, W. -S. Oxidative stress affects retinal pigment epithelial cell survival through epidermal growth factor receptor/AKT signaling pathway. International Journal of Ophthalmology. 10 (4), 507-514 (2017).
- Tu, G., et al. Allicin attenuates H2O2 - induced cytotoxicity in retinal pigmented epithelial cells by regulating the levels of reactive oxygen species. Molecular Medicine Reports. 13, 2320-2326 (2016).
- Hao, Y., Liu, J., Wang, Z., Yu, L., Wang, J. Piceatannol protects human retinal pigment epithelial cells against hydrogen peroxide induced oxidative stress and apoptosis through modulating. Nutrients. 11, 1-13 (2019).
- Ballinger, S. W., Van Houten, B., Conklin, C. A., Jin, G. F., Godley, B. F. Hydrogen peroxide causes significant mitochondrial DNA damage in human RPE cells. Experimental Eye Research. 68 (6), 765-772 (1999).
- Ma, S., et al. Transgenic overexpression of uncoupling protein 2 attenuates salt-induced vascular dysfunction by inhibition of oxidative stress. American Journal of Hypertension. 27 (3), 345-354 (2014).
- Johnen, S., et al. Sleeping Beauty transposon-mediated transfection of retinal and iris pigment epithelial cells. Investigative Ophthalmology and Visual Science. 53 (8), 4787-4796 (2012).
- Mátés, L., et al. Molecular evolution of a novel hyperactive Sleeping Beauty transposase enables robust stable gene transfer in vertebrates. Nature Genetics. 41 (6), 753-761 (2009).
- Marienfeld Technical information Neubauer-improved. , Available from: https://www.marienfeld-superior.com/information-about-our-counting-chambers.html (2020).
- Electron Microscopy Sciences. Neubauer Haemocytometry. , Available from: https://www.emsdiasum.com/microscopy/technical/datasheet/68052-14.aspx (2020).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2^(-ΔΔCT) method. Methods. 25 (4), San Diego, California. 402-408 (2001).
- Bascuas, T., et al. Non-virally transfected primary human pigment epithelium cells overexpressing the oxidative stress reduction factors PEDF and GM-CSF to treat retinal neurodegeneration neurodegenerationl. Human Gene Therapy. 30 (11), (2019).
- Zhuge, C. C., et al. Fullerenol protects retinal pigment epithelial cells from oxidative stress-induced premature senescence via activating SIRT1. Investigative Ophthalmology & Visual Science. 55 (7), 4628-4638 (2014).
- Kaczara, P., Sarna, T., Burke, M. Dynamics of H2O2 Availability to ARPE-19 cultures in models of oxidative stress. Free Radical Biology and Medicine. 48 (8), 1068-1070 (2010).
- Gorrini, C., Harris, I. S., Mak, T. W. Modulation of oxidative stress as an anticancer strategy. Nature Reviews Drug Discovery. 12, 931-947 (2013).
- Wang, X., et al. PEDF protects human retinal pigment epithelial cells against oxidative stress via upregulation of UCP2 expression. Molecular Medicine Reports. 19 (1), 59-74 (2019).
- Donadelli, M., Dando, I., Fiorini, C., Palmieri, M. UCP2, a mitochondrial protein regulated at multiple levels. Cellular and Molecular Life Sciences. 71, 1171-1190 (2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved