Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Uyuyan Güzel Transposon Transposon Transfected İnsan Retina Pigment Epitel Hücrelerinde Oksidatif Stresin İndüksiyonu ve Analizi
Bu Makalede
Özet
Hücre morfolojisi, canlılık, yoğunluk, glutatyon ve UCP-2 seviyesini analiz eden retina pigment epitel hücrelerini H2O2ile tedavi ederek oksidatif stres modelinin geliştirilmesi ve kullanımı için bir protokol sunuyoruz. Transposon transfected hücreler tarafından salgılanan proteinlerin nöroretinal dejenerasyonu tedavi etmek için antioksidan etkisini araştırmak için yararlı bir modeldir.
Özet
Oksidatif stres, dünya çapında ~30 milyon hastayı etkileyen bir patoloji olan yaşa bağlı makula dejenerasyonu (AMD) da dahil olmak üzere çeşitli dejeneratif hastalıklarda kritik bir rol oynamaktadır. Retina pigment epitelinde (RPE)- sentezlenmiş nöroprotektif faktörlerde, örneğin pigment epitel türevi faktör (PEDF) ve granülosit-makrofaj koloni uyarıcı faktöründe (GM-CSF) azalmaya, ardından RPE hücrelerinin kaybına ve sonunda fotoreceptör ve retina ganglion hücre (RGC) ölümüne yol açar. PeDF ve GM-CSF'yi aşırı ifade eden transkreinal RPE hücrelerinin subretinal nakli ile nöroprotektif ve nörojenik retina ortamının yeniden kavrunun, oksidatif stresin etkilerini azaltarak, iltihabı inhibe ederek ve hücre sağkalımını destekleyerek retina dejenerasyonunu önleme potansiyeline sahip olduğunu hipotez ediyoruz. Uyuyan Güzel transposon sistemi (SB100X) insan RPE hücreleri PEDF ve GM-CSF genleri ile transfekte edilmiştir ve qPCR, batı lekesi, ELISA ve immünofluoresans kullanılarak kararlı gen entegrasyonu, uzun süreli gen ekspresyonu ve protein salgılanması gösterilmiştir. Transfected RPE hücreleri tarafından salgılanan PEDF ve GM-CSF'nin işlevselliğini ve gücünü doğrulamak için, kültürdeki RPE hücreleri üzerinde H2O2kaynaklı oksidatif stresin azaltılmasını ölçmek için bir in vitro test geliştirdik. Hücre koruması hücre morfolojisi, yoğunluğu, hücre içi glutatyon düzeyi, UCP2 gen ekspresyonu ve hücre canlılığı analiz ederek değerlendirildi. Her ikisi de, PEDF ve/veya GM-CSF'yi aşırı ifade eden transfected RPE hücreleri ve transknakte olmayan ancak PEDF ve/veya GM-CSF ile önceden tedavi edilen hücreler (ticari olarak mevcut veya transfected hücrelerden arındırılmış) tedavi edilmeyen kontrollere kıyasla önemli antioksidan hücre koruması göstermiştir. Mevcut H2O2-modeli, AMD veya benzeri nörodejeneratif hastalıkları tedavi etmek için etkili olabilecek faktörlerin antioksidan etkisini değerlendirmek için basit ve etkili bir yaklaşımdır.
Giriş
Burada açıklanan model, hücrelerdeki oksidatif stresi azaltmak içinbiyofarmasötik ajanların verimliliğini değerlendirmek için yararlı bir yaklaşım sunar. Modeli, PEDF ve GM-CSF'nin yüksek düzeyde O 2 ve görünür ışığa maruz kalan retina pigment epitel hücreleri üzerindeki H2O2aracılı oksidatif stres üzerindeki koruyucu etkilerini ve fotoreceptör dış segment membranlarının fagositozunu araştırmak için kullandık, önemli düzeyde reaktif oksijen türü (ROS)1, 2. Avasküler yaşa bağlı makula dejenerasyonu (aAMD) 3 , 4 , 5 ,6,7,8patogenezine önemli bir katkıda bulunurlar. Ayrıca, RPE sentezlenmiş nöroprotektif faktörlerde bir azalma vardır, özellikle pigment epitel türevi faktör (PEDF), insülin benzeri büyüme faktörleri (IGF'ler) ve granülosit makrofaj-koloni uyarıcı faktör (GM-CSF) RPE hücrelerinin işlev bozukluğuna ve kaybına yol yorar, ardından fotoreceptör ve retinal ganglion hücre (RGC) ölümü3,4,5 . AMD metabolik, fonksiyonel, genetik ve çevresel faktörler arasındaki etkileşimden kaynaklanan karmaşık bir hastalıktır4. AAMD için tedavi eksikliği, sanayileşmiş ülkelerde 60 yaşından büyük hastalarda körlüğün başlıca nedenidir9,10. PEDF ve GM-CSF'yi aşırı ifade eden genetiği değiştirilmiş RPE hücrelerinin subretinal nakli ile nöroprotektif ve nörojenik retina ortamının yeniden birleşmesi, oksidatif stresin etkilerini azaltarak, iltihabı inhibe ederek ve hücre sağkalımını destekleyerek retina dejenerasyonunu önleme potansiyeline sahiptir11,12,13,14,15,16 . Genleri hücrelere ulaştırmak için çeşitli metodolojiler olsa da, pedf ve GM-CSF genlerini RPE hücrelerine ulaştırmak için viral olmayan hiperaktif Uyuyan Güzel transposon sistemini seçtik, çünkü güvenlik profili, genlerin konak hücrelerin genomuna entegrasyonu ve teslim edilen genleri transkripsiyonel olmayan aktif bölgelere entegre etme eğilimi nedeniyle17. 18,19.
Hücresel oksidatif stres, hidrojen peroksit (H 2O2),4-hidroinonenal (HNE), tertbutilhidroksit (tBH), yüksek oksijen gerginlikleri ve görünür ışık (tam spektrum veya UV ışınlama)20,21dahil olmak üzere çeşitli oksidatif ajanlar tarafından in vitro kültürlenen hücrelerde indüklenebilir. Yüksek oksijen gerilimleri ve ışık, diğer sistemlere aktarilebilirliği sınırlayan özel ekipman ve koşullar gerektirir. H 2 O2,HNE ve tBH gibi ajanlar üst üste binen oksidatif stres moleküler ve hücresel değişikliklere neden olarak. PEDF ve GM-CSF'nin antioksidan aktivitesini test etmek içinH2 O2'yi seçtik, çünkü RPE hücreleri tarafından fotoreceptör dış segment fagositoz22 sırasında reaktif oksijen ara olarak üretildiği ve in vivo23oküler dokularda bulunduğu için uygun ve biyolojik olarak alakalıdır. Glutatyonun oksidasyonu gözdeki H 2 O2üretiminden kısmen sorumlu olabileceğinden, çalışmalarımızda H 2 O2 kaynaklı oksidatif stres ve 21,22hücrelerinin rejeneratifkapasitesi ile bağlantılı GSH / glutatyon seviyelerini analizettik. Glutatyon seviyelerinin analizi özellikle gözdeki anti-oksidatif koruyucu mekanizmalara katıldığı içinönemlidir 24. H 2 O2'yemaruz kalma, RPE hücrelerinin 1 , 25 ,26,27 , 28, 29,30oksidatifstres duyarlılığını ve antioksidan aktivitesini incelemek için bir model olarak sıklıkla kullanılır ve ayrıca, "fizyolojik" bir oksidatif stres kaynağı olan ışık kaynaklı oksidatif stres hasarı ile benzerlikler gösterir21.
Nöroprotektif faktörlerin işlevselliğini ve etkinliğini değerlendirmek için, analizin PEDF ve GM-CSF'yi aşırı ifade etmek için genetiği değiştirilmiş hücreler tarafından ifade edilen büyüme faktörlerinin anti-oksidatif etkisini ölçmesini sağlayan bir in vitro model geliştirdik. Burada, PEDF ve GM-CSF genleri ile transfected RPE hücrelerinin H 2 O2'ninzararlı etkilerine transfected olmayan kontrol hücrelerinden daha dirençli olduğunu gösteriyoruz, hücre morfolojisi, yoğunluğu, canlılığı, hücre içi glutatyon seviyesi ve reaktif oksijen türlerini azalttığı gösterilen mitokondriyal ayrıştırma proteini 2'yi kodlayan UCP2 geninin ekspresyonu ile kanıtlandı (ROS)31.
Protokol
İnsan gözlerinin toplanması ve kullanımına ilişkin prosedürler Kanton Etik Araştırma Komisyonu (no. 2016-01726) tarafından onaylanmıştır.
1. Hücre izolasyonu ve kültür koşulları
- İnsan ARPE-19 hücre hattı
- Kültür 5 x 105 ARPE-19 hücreleri, bir insan RPE hücre hattı, Dulbecco'nun Modifiye Kartal Orta / Besin Karışımı F-12 Jambon (DMEM / Ham'ın F-12) % 10 fetal sığır serumu (FBS), 80 U / mL penisilin ile desteklenmiş, 80 μg/mL streptomisin ve 37 °C'de 2,5 μg/mL amfoterisin B (komple orta) bir T75 şişesinde %5 CO2 ve %95 hava nemli bir atmosferde (diğer hücre yoğunlukları için Bkz. Tablo 1).
- Ortamı haftada üç kez değiştirin.
- Hücreler yaklaşık% 90 izdihama (nitel olarak değerlendirilir) yetiştirildikten sonra, ortamı aspire edin ve hücreleri steril 1x PBS ile yıkayın.
- Hücreleri 37 °C'de 7-10 dakika boyunca %5 Trypsin-%2 EDTA çözeltisi ile kuluçkaya yatırın (birimler için bkz. Tablo 1). Müfrezeyi görsel olarak izleyin.
- %10 FBS içeren tam ortam ekleyerek trypsinization'ı durdurun (birimler için bkz. Tablo 1).
- Hücreleri transfect (bkz. adım 2. protokolü), alt ekili 1:10 oranında (haftada bir kez) veya aşağıda ayrıntılı olarak belirtildiği gibi 96 kuyulu bir tabakta tohum (protokolün 3.3 ve 3.4 adımlarına bakın).
| Orta (mL) | ||||||
| Alan (cm²) | ARPE-19 hücreleri için tohumlama yoğunluğu (hücreler/kuyu) | Uygulama | Hücre kültürü için | Trypsin'i durdurmak için | Tripsin hacmi (mL) | |
| Şişe T75 | 75 | 5,00,000 | ARPE-19 hücre büyümesi | 10 | 7 | 3 |
| 6 Kuyu plakası | 9.6 | 1,00,000 | Transfected ARPE-19 hücrelerinin tohumlama | 3 | 1 | 0.5 |
| 24 Kuyu plakası | 2 | 50,000 | Transfected hRPE hücrelerinin tohumlama | 1 | 0.8 | 0.2 |
| 96 Kuyu plakası | 0.32 | Transfected hücrelerle oksidatif stres deneyleri için 5.000 (Şek. 1) | Oksidatif stres deneyleri | 0.2 | ||
| Transktasyona bulaşmamış hücreler ve proteinlerle oksidatif stres deneyleri için 3.000 (Şek. 1) | ||||||
Tablo 1: Hücre kültürü birimleri. ARPE-19 ve birincil insan RPE hücrelerinin kültürü için hücre kültürü plakaları ve şişeleri için önerilen ortam birimleri.
- Birincil insan RPE hücreleri
- Thumann ve ark.17tarafından tanımlandığı gibi birincil insan RPE hücrelerini ve % 20 FBS ile desteklenmiş komple ortamda kültür hücrelerini izole edin.
- Ortamı haftada iki kez değiştirin. Hücreler konfluense ulaştığında (görsel olarak izlenir), aşırı büyümeyi önlemek için FBS'yi % 1'e düşürün.
- Hücreleri transfect (protokolün 2. adımına bakın) veya aşağıda ayrıntılı olarak açıklanan 96 kuyulu bir plakadaki tohum (protokolün 3.3 ve 3.4. adımlarına bakın).
NOT: Burada sunulan veriler dört insan donörün gözünden elde edilen RPE hücrelerinin kültüründen toplanmıştır. Tablo 2, Lions Gift of Sight Eye Bank'tan (Saint Paul, MN) bağışçıların demografisini detaylandırıyor. Helsinki Bildirgesi uyarınca bilgilendirilmiş onay alındıktan sonra gözler 12.7 ± 5.7 saat (ortalama ± SD) olarak kapsüllendi.
| Hayır | yaş | cinsiyet | koruma için ölüm (saat) | tecrite ölüm | Ekimi | Ekimi | Grafikteki sembol | |
| (gün) | transfection öncesi (gün) | transfection sonrası (gün) | ||||||
| 2 | 80 | M | 20.7 | 8 | 140 | 36 |  | |
| 3 | 86 | F | 12.8 | 8 | 85 | 45 |  | |
| 4 | 86 | F | 8.5 | 5 | 26 | 133 |  | |
| 8 | 83 | F | 8.9 | 6 | 18 | 27 |  | |
| demek | 83.8 | 12.7 | 6.8 | 67.3 | 60.3 | |||
| SD | 2.9 | 5.7 | 1.5 | 57.0 | 49.1 |
Tablo 2: Retina pigment epitel hücreleri için insan donörlerinin demografisi.
2. ARPE-19 ve birincil insan RPE hücrelerinin elektroporasyon
- Protokolün 1.1.3-1.1.5. adımlarında açıklandığı gibi ARPE-19 hücrelerini veya birincil insan RPE hücrelerini deneyin.
- Piyasada bulunan transfeksiyon kiti ile elektroporasyon gerçekleştirin (bkz. Malzeme Tablosu).
- ARPE-19 hücrelerinin transfection için Johnen ve ark.32 ve birincil hRPE için Thumann veark. Kısaca, 11 μL R arabelleğine 1 x10 5 ARPE-19 hücresi veya 5 x10 4 birincil hRPE hücresi yeniden koyun ve 0,03 μg p içeren 2 μL plazmid karışımı ekleyinSB100X transpoosaz33 ve 0.47 μg pT2-CMV-PEDF-His veya pT2-CMV-GMCSF-Transposon (oran transposaz:transposon 1:16). PEDF ve GM-CSF çift transfected hücreler için 1:16:16 (0,03 μg pSB100X, 0,47 μg pT2-CMV-PEDF-His ve 0,47 μg pT2-CMV-GMCSF-His) oranını kullanın. Aşağıdaki elektroporasyon parametrelerini kullanın: ARPE-19 hücreleri için 20 ms (darbe genişliği) için 1.350 V'lık iki darbe; birincil hücreler için 20 ms için 1.100 V'luk iki darbe.
- Tohum 1 x 105 transfected ARPE-19 veya 5 x10 4 transfected primer hRPE hücreleri sırasıyla 6-well ve 24-well plakalarda, antibiyotik veya antimycotics olmadan% 10 FBS ile desteklenmiş orta. Transeksiyondan 3 gün sonra ilk orta değişimle penisilin (80 U/mL), streptomisinin (80 μg/mL) ve amfoterisilin B'yi (2,5 μg/mL) ekleyin.
- Hücrelerin haftalık mikroskobik takibi ile hücre büyümesini belirleyin. Transeksiyon verimliliği, GEN ekspresyonunun RT-PCR tarafından analizi ve ELISA ve WB (Ek Materyaldeaçıklanan yöntemler) tarafından protein salgılanması ile izlenir.
NOT: Transeksiyon verimliliği ilk kez hücreler konfluense ulaştığında, yani ARPE-19 hücreleri ve birincil hRPE hücreleri için transfeksiyon sonrası ~7 gün 4 haftada değerlendirilebilir. - Aşağıda ayrıntılı olarak belirtildiği gibi 96 kuyulu bir tabaktaki tohum hücreleri (protokolün 3,5. adımına bakın).
3. Oksidatif stres indüksiyonu (H2O2 tedavisi) ve nöroproteksyon (PEDF ve/veya GM-CSF tedavisi)
- Transfected ARPE-19 hücrelerinin koşullandırılmış ortamının hazırlanması
- PEDF, GM-CSF veya her ikisi ile enfekte olmuş ARPE-19 hücrelerini kullanın (protokolün 2. adımına bakın); protokolün 1.1.
- Transfection sonrası 28 gün içinde, trypsinize hücreleri (protokolün 1.1.3-1.1.5 numaralı adımlarına bakın), T75 şişelerindeki Neubauer odası34,35ve tohum 5 x10 5 hücrelerini protokolün 1.1.1 adımında açıklandığı gibi tam orta olarak sayar. Hücre kültürü yaklaşık% 80 birleştiğinde ortamı değiştirin (yaklaşık 1 hafta sonra; nitel olarak doğrulanır). Ortamı 24 saat sonra toplayın.
- Ortamı kullanıma kadar -20 °C'de saklayın.
NOT: Rekombinant PEDF ve GM-CSF'nin şartlandırılmış ortamda yeterli konsantrasyonu WB tarafından doğrulandı ve Elisa tarafından Ek Malzeme'deaçıklandığı gibi ölçüldü.
- PEDF ve GM-CSF'nin transfected ARPE-19 hücrelerinin şartlandırılmış ortamından arındırılması
- Toplanan ortamı 3.1.2 adımından 10.000 x g'da 4 °C'de 15 dakika boyunca santrifüj edin.
- Aşağıda açıklandığı gibi, Etiketli proteinleri arındırmak için üreticinin protokollerine göre Ni-NTA süper akışını (bkz. Malzeme Tablosu)kullanın.
- Pipet 30 μL Ni-NTA karışımını 1,5 mL'lik bir tüpe ve santrifüj 30 s için 2.600 x g'da ve akışa atın. Peletin 200 μL 1x kuluçka tamponu ile iki kez yıkayın.
- 30 s için 2.600 x g'da santrifüj ve akış at. 40 μL 4x Kuluçka tamponu ekleyin ve yeniden dirildi.
- 900 μL santrifüjlü şartlandırılmış orta ekleyin ve RT'de 1 saat boyunca 70 rpm'de (orbital çalkalayıcı) kuluçkaya yaslayın.
- Peletin 175 μL 1x kuluçka tamponu ile iki kez yıkayın. 30 s için 2.600 x g'da santrifüj ve akış at.
- Etiketli PEDF ve GM-CSF proteinlerini elüte etmek için 20 μL Elution tamponu ekleyin ve 70 rpm'de (orbital çalkalayıcı) 20 dakika RT. Santrifüj'de 30 s için 2.600 x g'da kuluçkaya yaslayın. Rekombinant PEDF veya GM-CSF içeren süpernatantı saklayın.
- Üreticinin talimatlarına göre piyasada bulunan BCA protein test kitini (bkz. Malzeme Tablosu)kullanarak toplam proteini ölçün.
- Protein çözeltisini kullanıma kadar -20 °C'de saklayın.
NOT: Kuluçka tamponu (4x) 200 mM NaH2PO4, 1.2 M NaCl ve 40 mM Imidazol içerir; Elution tampon içerir 50 mM NaH2PO4, 300 mM NaCl ve 250 mM Imidazol.
- Transktfected olmayan ARPE-19/primer hRPE hücrelerinin şartlı orta artı H2O2 (Şekil 1A) ile tedavisi
- Transfected ARPE-19 hücrelerinden 200 μL şartlandırılmış ortamda 96 kuyu plakası ve kültüründe kuyu başına tohum 3.000 transfected olmayan ARPE-19 (protokolün 1.1.6 adımından) veya birincil hRPE (protokolün 1.2.3 adımından itibaren) hücreleri.
- Hücreleri 37 °C'de 10 gün boyunca %5 CO2 ve %95 hava nemli bir atmosferde kültüre edin. Koşullandırılmış ortamı her gün değiştirin. Hücreleri 24 saat boyunca 350 μM H2O2'ye maruz bırak.
- Oksidatif stres hasarını değerlendirin ve glutatyon seviyelerinin nicelleştirilmesi (protokolün 4.1. adımına bakın), mikroskopi (protokolün 4.2. adımına bakın) ve sitotoksiklik tahlilinin ölçülmesiyle PEDF ve GM-CSF'nin antioksidan etkisini belirleyin (bkz.
NOT: Deneme süresi 12 gündür. Hücre morfolojisini ve lüminesansı değerlendirmek için şeffaf düz alt mikrowell plakaları kullanılır. Sitotoksiklik ve glutatyon testini aynı anda gerçekleştirmek için, aynı gün iki plakanın hücrelerle tohumlanması gerekir.
- PeDF ve GM-CSF büyüme faktörleri artı H2O 2 ( Şekil 1B ) ile transknaze olmayan ARPE-19 / primer hRPE hücrelerinin tedavisi
- Tohum 3.000 transfected olmayan ARPE-19 (protokolün 1.1.6 adımından itibaren) veya birincil hRPE (protokolün 1.2.3 adımından itibaren) kuyu başına hücreler (düz tabanı temiz olan 96 kuyu plakaları) 500 ng/mL rekombinant PEDF ve/veya 50 ng/mL rekombinant GM-CSF içeren 200 μL tam kültür ortamında, transfected ARPE-19 hücrelerinin ortamından arındırılmış veya ticari olarak kullanılabilir. %5 CO2 ve %95 hava nemli bir atmosferde 37 °C'de 48 saat boyunca kültür hücreleri. PEDF ve GM-CSF büyüme faktörleri de dahil olmak üzere ortamı günlük olarak yenileyin.
NOT: Büyüme faktörlerini ortama taze ekleyin. - Hücreleri büyüme faktörleriyle tedavi ettikten 48 saat sonra, ortamı çıkarın ve 350 μM H 2 O2artı500 ng/mL PEDF ve/veya 50 ng/mL GM-CSF içeren komple ortam ekleyin.
- Oksidatif stres hasarını değerlendirin ve glutatyon seviyelerinin nicelleştirilmesi (protokolün 4.1. adımına bakın), mikroskopi (protokolün 4.2. adımına bakın) ve sitotoksiklik tahlilinin ölçülmesiyle PEDF ve GM-CSF'nin antioksidan etkisini belirleyin (bkz.
NOT: Deneme süresi 3 gündür.
- Tohum 3.000 transfected olmayan ARPE-19 (protokolün 1.1.6 adımından itibaren) veya birincil hRPE (protokolün 1.2.3 adımından itibaren) kuyu başına hücreler (düz tabanı temiz olan 96 kuyu plakaları) 500 ng/mL rekombinant PEDF ve/veya 50 ng/mL rekombinant GM-CSF içeren 200 μL tam kültür ortamında, transfected ARPE-19 hücrelerinin ortamından arındırılmış veya ticari olarak kullanılabilir. %5 CO2 ve %95 hava nemli bir atmosferde 37 °C'de 48 saat boyunca kültür hücreleri. PEDF ve GM-CSF büyüme faktörleri de dahil olmak üzere ortamı günlük olarak yenileyin.
- Transfected ARPE-19/primer hRPE hücrelerinin H2O2 (Şekil 1C) ile tedavisi
- Transfected hücrelerin WB ve ELISA tarafından yeterli gen ekspresyonunu ve protein salgısını Ek Materyaldeaçıklandığı gibi doğrulayın.
- Ortamı transfected hücreleri içeren kuyulardan çıkarın (protokolün 2. adımına bakın).
- Protokolün 1.1.3-1.1.5 adımlarında açıklandığı gibi hücreleri trypsinize edin. Neubauer odası34,35kullanarak hücreleri sayın.
- Tohum 5.000 transfected hücre /kuyu 96 kuyu plakasında 200 μL tam orta. %5 CO 2 ve %95 hava nemli bir atmosferde 37 °C'de24 saat boyunca kültür hücreleri. 24 saat sonra, hücreleri 24 saat boyunca 350 μM H2O2'ye maruz bırakın.
- Glutatyon seviyelerinin ölçülmesi (protokolün 4.1. adımına bakın), mikroskopi (protokolün 4.2. adımına bakın), sitotoksiklik tahlilleri (protokolün 4.2. adımına bakın) ve UCP2 gen ekspresyonunun belirlenmesi (bkz. adım 4.3) ile oksidatif stres hasarını değerlendirin ve PEDF ve GM-CSF'nin antioksidan etkisini belirleyin.
NOT: Deneme süresi 2 gündür.
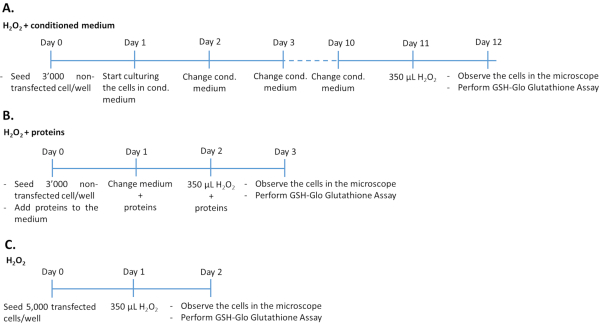
Şekil 1: Üç farklı deneysel yaklaşımda H2O2 tahlilinin zaman çizelgeleri. Şartlandırılmış orta/rekombinant proteinlerle tedavi edilen 3.000 transktuz hücre veya H 2 O2ile tedavi için 96 kuyu plakasında5.000transktasyonlu hücre tohumlanmıştır. Şartlandırılmış ortamın etkisini belirlemek için, hücreler 10 gün üst üste% 100 kültürlü ortamda kültürlendi ve her gün ortayı değiştirdi. Rekombinant büyüme faktörlerinin etkisini belirlemek için, hücreler art arda 3 gün boyunca her gün uygun miktarda büyüme faktörü eklenerek kültürlendi. Transfected olmayan hücrelerin, transfected hücrelere kıyasla daha uzun kültür süresi boyunca aşırı büyümeden kaçınmak için kuyu başına 3.000 hücrede tohumlandığını unutmayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Oksidatif stres seviyesinin ve antioksidan kapasitesinin analizi
- Glutatyon tahlil
- Üreticinin talimatlarına uyarak piyasada bulunan kiti kullanarak Glutatyon (GSH) seviyelerini ölçün (bkz. Malzeme Tablosu). Kısaca, 1x Reaktif karışımının (100 μL reaktif / kuyu) hazırlanması ve uygun hacmi: Luciferin-NT substratı ve Glutatyon S-Transferaz Reaksiyon Tamponunda 1:100 seyreltilir.
NOT: 96 kuyulu bir plaka, 100 μL Luciferin-NT substratı ve 100 μL Glutatyon S-Transferaz ile 10 mL Reaksiyon tamponu eklenerek hazırlanan 10 mL 1x Reaktif karışımı gerektirir. 1x Reaktif karışımını kullanmadan hemen önce hazırlayın. Hazırlanan Reaktif karışımını ileride kullanılmak üzere saklamayın. - Bir şişe Reconstitution tamponu liyofilize Luciferin Algılama Reaktifine aktararak Luciferin Algılama Reaktifini hazırlayın.
- Glutatyon (GSH) standart çözeltisi (5 mM) kullanarak standart bir eğri hazırlayın. 5 mM GSH çözeltisini 1:100 dH2O ile seyreltin (990 μL dH2O'ya 10 μL 5 mM GSH çözeltisi ekleyin). 500 μL dH 2 O'da 7 seri1:1seyreltme gerçekleştirin, her seyreltilmiş standardın 10 μL'sini kopya olarak uygun bir kuyuya aktarın.
NOT: Glutatyonun son konsantrasyonu 0,039 μM ila 5 μM arasında değişecektir. - Boş (1x Reaktif karışımı) hazırlayın ve 10 μL 'yi (kopyaları) uygun kuyulara aktarın.
- H2O2ile işlenmiş hücreleri inkübatörden çıkarın.
NOT: H 2O2ile işlenmiş hücrelerin morfolojisini brightfield mikroskopisi (40x) ile belgele.
Hücreler oksitlendiğinde, daha yuvarlak ve daha az yayılmış görünürler. - Kültür ortamını dikkatlice emiş edin. Her kuyuya 100 μL hazırlanmış 1x Reaktif karışımı ekleyin. Hücreleri yörüngesel bir çalkalayıcıda 500 rpm'de 15 sn reaktifle karıştırın.
- Plakayı RT'de 30 dakika kuluçkaya yatırın. Her kuyuya 100 μL yeniden inşa edilmiş Luciferin Algılama Reaktifi ekleyin.
- 15 sn için çözeltiyi yörüngesel bir çalkalayıcıda 500 rpm'de karıştırın. RT'de plakayı 15 dakika kuluçkaya yatır.
- Önceden yüklenmiş bir program ADP-Glo kullanarak plaka okuyucu kullanarak parlaklığı belirleyin.
NOT: Plakayı kapaksız plaka okuyucunun içine koyun.- Düzeni Değiştir'e tıklayın ve Temel Parametreler:Costar 96 kuyu plakasında aşağıdaki ayarları seçin; üst optik; konumlandırma gecikmesi: 0.1; ölçüm başlangıç saati: 0.0; ölçüm aralığı süresi: 1.0; sonuçları normalleştirme zamanı: 0.0; kazanç cihaz tarafından otomatik olarak ayarlanır. Boşlukları, standartları ve örnekleri tanımlayın. Ölçümü Başlat'a tıklayın.
- Verileri Excel dosyası olarak verin. Standart eğrinin enterpolasyonu ile her örnekteki GSH konsantrasyonunu hesaplayın.
- Üreticinin talimatlarına uyarak piyasada bulunan kiti kullanarak Glutatyon (GSH) seviyelerini ölçün (bkz. Malzeme Tablosu). Kısaca, 1x Reaktif karışımının (100 μL reaktif / kuyu) hazırlanması ve uygun hacmi: Luciferin-NT substratı ve Glutatyon S-Transferaz Reaksiyon Tamponunda 1:100 seyreltilir.
- Sitotoksiklik tahlil ve mikroskobik analiz
- Ortamı hücrelerden emiş edin ve her kuyuya% 1 FBS içeren 100 μL tam ortam ekleyin. Hücreleri inkübatöre döndürün.
NOT: FBS'nin daha yüksek yüzdeleri lüminesansın ölçümünü engelleyebileceğinden% 1 FBS kullanılır, bu nedenle bu durumda% 1 FBS kullanılır. - Üreticinin talimatlarını izleyerek piyasada bulunan sitotoksiklik test kitini (bkz. Malzeme Tablosu)kullanarak hücre canlılığını ölçün. Kısaca, Lyophilized Substrat'a Test tamponu ekleyerek Reaktif karışımını hazırlayın. 5 mL Test tamponu (bir 96 kuyu plakası için) için 33 μL Digitonin ekleyerek Lizis Reaktifini hazırlayın. Homojenliği sağlamak için yukarı ve aşağı pipetleme yaparak iyice karıştırın.
NOT: En iyi sonuçları elde dimi için yeni hazırlanmış Reaktif karışımını kullanın. RT'de saklanırsa 12 saat içinde kullanın. Reaktif karışımı 7 güne kadar 4 °C'de saklanabilir ve -70 °C'de 4 aya kadar tek kullanımlık aliquotlarda saklanabilir. Donma ve çözülme önlenmelidir. Lizis Reaktifi 4 °C'de 7 güne kadar saklanabilir. - Tedavi edilmemiş ARPE-19 hücreleriyle standart bir eğri hazırlayın.
- Protokolün 1.1.3-1.1.5 adımlarında açıklandığı gibi hücreleri trypsinize edin ve neubauer odası34,35kullanarak hücreleri sayın. RT'de 10 dakika boyunca hücreleri 120 g'da santrifüj edin.
- %1 FBS içeren 200 μL ortamda 7 seri 1:1 seyreltme hazırlayın. Her standardın 100 μL'sini uygun kuyulara (kopyalar) aktarın. Tüm kuyulara 50 μL Reaktif karışımı ekleyin.
- Hücreleri yörüngesel bir çalkalayıcıda 500 rpm'de 15 sn reaktifle karıştırın. RT'de plakayı 15 dakika kuluçkaya yatırın. Liziz reaktifinin 50 μL'sini ekleyin ve 15 dakika kuluçkaya yatırın. Protokolün 4.1.9.
- Uygulanabilir hücrelerin yüzdesini hesaplayın: (100 - % ölü hücreler) ve ölü hücrelerin yüzdesi = [1. lüminesans ölçümü ((örnekteki ölü hücreler))/ 2. lüminesans ölçümü (digitonin tedavisinden sonra tüm hücreler ölü)] x 100.
- Ortamı hücrelerden emiş edin ve her kuyuya% 1 FBS içeren 100 μL tam ortam ekleyin. Hücreleri inkübatöre döndürün.
- RT-qPCR tarafından UCP2 ifade analizi
- Yukarıda açıklandığı gibi transkine olmuş hücreleri trypsinize edin (protokolün 1.1.3-1.1.5. adımları).
- Neubauer odası34,35kullanarak hücreleri sayın.
- Tohum 5.000 transfected ARPE-19 hücreleri / kuyu 96 kuyu plakalarında.
- 24 saat kültürden sonra, hücreleri24saat boyunca 350 μM H2 O 2 ile tedavi edin.
- Üreticinin talimatını takiben, RNA'nın düşük sayıda hücreden yalıttığına ilişkin ticari bir kit kullanarak toplam RNA'yı yalıtın (bkz. Malzeme Tablosu).
- Tamamlayıcı Malzeme'de açıklandığı gibi Gerçek Zamanlı nicel PCR (RT-qPCR) gerçekleştirin. Kısaca, optimize edilmiş bir M-MLV Ters Transkriptaz içeren ticari olarak kullanılabilen bir karışım kullanarak retrotranscription ile cDNA oluşturun (bkz. Malzeme Tablosu).
- qPCR için astarlar (bkz. Ek Malzemenin Tablo S1'i) ve DNA şablonu hariç tüm bileşenleri (SYBR Green dahil) içeren kullanımahazır bir reaksiyon kokteyli kullanın. Aşağıdaki termosiklonlama koşullarını kullanın: 10 dakika boyunca 95 °C'de ilk denatürasyon, 15 s için 95 °C'de denatürasyon ile 40 döngü, 30 s için 60 °C'de tavlama ve 32 s için 72 °C'de uzama.
- Analiz için 2^(-ΔΔCT) yöntemini kullanın36.
- pAkt'ın SDS-PAGE ve WB analizi için hücre lysate hazırlanması (Ser473)
- Tohum 3 x 105 GM-CSF-transfected ARPE-19 hücreleri / kuyu 6 kuyulu plakalarda (≥21 gün transfeksiyon sonrası) GM-CSF'nin RPE hücrelerini H 2 O2'ninAkt sağkalım yolunun aktivasyonu yoluyla hasardan koruyup korumadığını belirlemek için 15.
- 24 saat kültür hücresinden sonra 24 saat boyunca 350μMH2 O 2'ye maruz kalır.
- 1 mL RIPA tamponu 10 μL proteaz fosfataz inhibitörü kokteyli, 10 μL 0,5 M EDTA ve 25 μL 8 M üre (bir kuyu için kullanılan hacimler) ile karıştırın.
- Ortamı dikkatlice emiş edin ve hücreleri 1x PBS ile yıkayın.
- RIPA arabellek karışımının tüm birimini hücrelere ekleyin.
- Pipet yukarı ve aşağı.
- Lisatları 1,5 mL tüplerde toplayın.
- 4 °C'de 30 dakika boyunca 20.000 x g'da santrifüj.
- Süpernatant yeni bir 1.5 mL tüpe aktarın.
- Ek Malzeme'deaçıklandığı gibi WB tarafından 15 μL seyreltilmemiş hücre lisatında pAkt seviyelerini belirleyin.
Sonuçlar
İnsan Retina Pigment Epitel hücrelerinde oksidatif stresin indüksiyonu
ARPE-19 ve primer hRPE hücreleri24saat boyunca değişen H 2 O2 konsantrasyonları ile tedavi edildi ve antioksidan glutatyonun hücre içi seviyesi ölçüldü (Şekil 2A,B). H2O2 50 μM ve 100 μM glutatyon üretimini etkilemezken, 350 μM'de ARPE-19 ve primer hRPE hücrelerinde glutatyonda önemli bir a...
Tartışmalar
Burada sunulan protokol, herhangi bir putatif faydalı genle transkârlaşmış hücrelere uygulanabilen transfected hücreler tarafından üretilen PEDF ve GM-CSF'nin anti-oksidatif ve koruyucu işlevini analiz etmek için bir yaklaşım sunmaktadır. Genetiği değiştirilmiş hücreleri naklederek proteinleri dokuya ulaştırma amacına sahip gen terapötik stratejilerinde, protein ekspresyon seviyesi, ifadenin uzun ömürlülüğü ve hastalığın bir modelinde ifade edilen proteinin etkinliği hakkında bilgi edinm...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar mükemmel teknik yardım için Gregg Sealy ve Alain Conti'ye ve Berlin'deki Max-Delbrück Merkezi'nden Prof. Zsuzsanna Izsvák'a pSB100X ve pT2-CAGGS-Venus plazmidlerini nazikça sağladıkları için teşekkür eder. Bu çalışma İsviçre Ulusal Bilimler Vakfı ve Avrupa Komisyonu tarafından Yedinci Çerçeve Programı kapsamında desteklendi. Z.I, Avrupa Araştırma Konseyi, ERC Advanced [ERC-2011-ADG 294742] tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 24-well plates | Corning | 353047 | |
| 6-well plates | Greiner | 7657160 | |
| 96-well culture plate white with clear flat bottom | Costar | 3610 | Allows to check the cells before measuring the luminescence (GSH-Glo Assay) |
| 96-well plates | Corning | 353072 | |
| Acrylamid 40% | Biorad | 161-0144 | |
| Amphotericin B | AMIMED | 4-05F00-H | |
| Antibody anti-GMCSF | ThermoFisher Scientific | PA5-24184 | |
| Antibody anti-mouse IgG/IgA/IgM | Agilent | P0260 | |
| Antibody anti-PEDF | Santa Cruz Biotechnology Inc | sc-390172 | |
| Antibody anti-penta-His | Qiagen | 34660 | |
| Antibody anti-phospho-Akt | Cell Signaling Technology | 9271 | |
| Antibody anti-rabbit IgG H&L-HRP | Abcam | ab6721 | |
| Antibody donkey anti-rabbit Alexa Fluor 594 | ThermoFisher Scientific | A11034 | |
| Antibody goat anti-mouse Alexa 488 | ThermoFisher Scientific | A-11029 | |
| ARPE-19 cell line | ATCC | CRL-2302 | |
| BSA | Sigma-Aldrich | A9418-500G | |
| chamber culture glass slides | Corning | 354118 | |
| CytoTox-Glo Cytotoxicity Assay | Promega | G9291 | |
| DAPI | Sigma-Aldrich | D9542-5MG | |
| DMEM/Ham`s F12 | Sigma-Aldrich | D8062 | |
| Duo Set ELISA kit | R&D Systems | DY215-05 | |
| EDTA | ThermoFisher Scientific | 78440 | |
| ELISAquant kit | BioProducts MD | PED613-10-Human | |
| Eyes (human) | Lions Gift of Sight Eye Bank (Saint Paul, MN) | ||
| FBS | Brunschwig | P40-37500 | |
| Fluoromount Aqueous Mounting Medium | Sigma-Aldrich | F4680-25ML | |
| FLUOstar Omega plate reader | BMG Labtech | ||
| GraphPad Prism software (version 8.0) | GraphPad Software, Inc. | ||
| GSH-Glo Glutathione Assay | Promega | V6912 | |
| hydrogen peroxide (H2O2) | Merck | 107209 | |
| ImageJ software (image processing program) | W.S. Rasband, NIH, Bethesda, MD, USA; https://imagej.nih.gov/ij/; 1997–2014 | ||
| Imidazol | Axonlab | A1378.0010 | |
| Leica DMI4000B microscope | Leica Microsystems | ||
| LightCycler 480 Instrument II | Roche Molecular Systems | ||
| LightCycler 480 SW1.5.1 software | Roche Molecular Systems | ||
| NaCl | Sigma-Aldrich | 71376-1000 | |
| NaH2PO4 | Axonlab | 3468.1000 | |
| Neon Transfection System | ThermoFisher Scientific | MPK5000 | |
| Neon Transfection System 10 µL Kit | ThermoFisher Scientific | MPK1096 | |
| Neubauer chamber | Marienfeld-superior | 640010 | |
| Ni-NTA superflow | Qiagen | 30410 | |
| Nitrocellulose | VWR | 732-3197 | |
| Omega Lum G Gel Imaging System | Aplegen Life Science | ||
| PBS 1X | Sigma-Aldrich | D8537 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P0781-100 | |
| PerfeCTa SYBR Green FastMix | Quantabio | 95072-012 | |
| PFA | Sigma-Aldrich | 158127-100G | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23227 | |
| Primers | Invitrogen | See Table 1 in Supplementary Materials | |
| pSB100X (250 ng/µL) | Mátés et al., 2009. Provide by Prof. Zsuzsanna Izsvak | ||
| pT2-CMV-GMCSF-His plasmid DNA (250 ng/µL) | Constructed using the existing pT2-CMV-PEDF-EGFP plasmid reported in Johnen, S. et al. (2012) IOVS, 53 (8), 4787-4796. | ||
| pT2-CMV-PEDF-His plasmid DNA (250 ng/µL) | Constructed using the existing pT2-CMV-PEDF-EGFP plasmid reported in Johnen, S. et al. (2012) IOVS, 53 (8), 4787-4796. | ||
| QIAamp DNA Mini Kit | QIAGEN | 51304 | |
| recombinant hGM-CSF | Peprotech | 100-11 | |
| recombinant hPEDF | BioProductsMD | 004-096 | |
| ReliaPrep RNA Cell Miniprep System | Promega | Z6011 | |
| RIPA buffer | ThermoFisher Scientific | 89901 | |
| RNase-free DNase Set | QIAGEN | 79254 | |
| RNeasy Mini Kit | QIAGEN | 74204 | |
| SDS | Applichem | A2572 | |
| Semi-dry transfer system for WB | Bio-Rad | ||
| SuperMix qScript | Quantabio | 95048-025 | |
| Tris-buffered saline (TBS) | ThermoFisher Scientific | 15504020 | |
| Triton X-100 | AppliChem | A4975 | |
| Trypsin/EDTA | Sigma-Aldrich | T4174 | |
| Tween | AppliChem | A1390 | |
| Urea | ThermoFisher Scientific | 29700 | |
| WesternBright ECL HRP substrate | Advansta | K-12045-D50 | |
| Whatman nitrocellulose membrane | Chemie Brunschwig | MNSC04530301 |
Referanslar
- Zareba, M., Raciti, M. W., Henry, M. M., Sarna, T., Burke, J. M. Oxidative stress in ARPE-19 cultures: Do melanosomes confer cytoprotection. Free Radical Biology and Medicine. 40 (1), 87-100 (2006).
- Gong, X., Draper, C. S., Allison, G. S., Marisiddaiah, R., Rubin, L. P. Effects of the macular carotenoid lutein in human retinal pigment epithelial cells. Antioxidants. 6 (4), (2017).
- Sacconi, R., Corbelli, E., Querques, L., Bandello, F., Querques, G. A Review of current and future management of geographic atrophy. Ophthalmology and Therapy. 6, 69-77 (2017).
- Al-Zamil, W. M., Yassin, S. A. Recent developments in age-related macular degeneration: a review. Clinical Interventions in Aging. 12, 1313-1330 (2017).
- Kumar-Singh, R. The role of complement membrane attack complex in dry and wet AMD - From hypothesis to clinical trials. Experimental Eye Research. 184, 266-277 (2019).
- Ung, L., Pattamatta, U., Carnt, N., Wilkinson-Berka, J. L., Liew, G., White, A. J. R. Oxidative stress and reactive oxygen species. Clinical Science. 131, 2865-2883 (2017).
- Beatty, S., Koh, H. H., Phil, M., Henson, D., Boulton, M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Survey of Ophthalmology. 45 (2), 115-134 (2000).
- Alhasani, R. H., et al. Gypenosides protect retinal pigment epithelium cells from oxidative stress. Food and Chemical Toxicology. 112, 76-85 (2018).
- . National Institute of Health Available from: https://nei.nih.gov/learn-about-eye-health/resources-for-health-educators/eye-health-data-and-statistics/age-related-macular-degeneration-amd-data-and-statistics (2020)
- Mitchell, P., Liew, G., Gopinath, B., Wong, T. Y. Age-related macular degeneration. The Lancet. 392, 1147-1159 (2018).
- He, Y., Leung, K. W., Ren, Y., Jinzhi, P., Jian, G., Tombran-Tink, J. PEDF improves mitochondrial function in RPE cells during oxidative stress. Investigative Ophthalmology & Visual Science. 55, 6742-6755 (2014).
- Cao, S., Walker, G. B., Wang, X., Cui, J. Z., Matsubara, J. A. Altered cytokine profiles of human retinal pigment epithelium: Oxidant injury and replicative senescence. Molecular Vision. 19, 718-728 (2013).
- Farnoodian, M., Sorenson, C. M., Sheibani, N. PEDF expression affects the oxidative and inflammatory state of choroidal endothelial cells. Amercian Journal of Physiology and Cell Physiology. 314 (4), 456-472 (2018).
- Polato, F., Becerra, S. P. Retinal Degenerative Diseases: Mechanisms and Experimental Therapies. Retinal Degenerative Diseases. , 699-706 (2016).
- Schallenberg, M., Charalambous, P., Thanos, S. GM-CSF regulates the ERK1/2 pathways and protects injured retinal ganglion cells from induced death. Experimental Eye Research. 89, 665-677 (2009).
- Schallenberg, M., Charalambous, P., Thanos, S. GM-CSF protects rat photoreceptors from death by activating the SRC-dependent signalling and elevating anti-apoptotic factors and neurotrophins. Graefes Archives for Clinical and Experimental Ophthalmology. 250, 699-712 (2012).
- Thumann, G., et al. Engineering of PEDF-expressing primary pigment epithelial cells by the SB transposon system delivered by pFAR4 plasmids. Molecular Therapy - Nucleic Acids. 6, 302-314 (2017).
- Garcia-Garcia, L., et al. Long-term PEDF release in rat iris and retinal epithelial cells after Sleeping Beauty transposon-mediated gene delivery. Molecular Therapy - Nucleic Acids. 9, 1-11 (2017).
- Johnen, S., et al. Antiangiogenic and neurogenic activities of Sleeping Beauty-mediated PEDF-transfected RPE cells in vitro and in vivo. BioMed Research International. 2015, (2015).
- Weigel, A. L., Handa, J. T., Hjelmeland, M. L. Microarray analysis of H2O2-, HNE-, or tBH-treated ARPE-19 cells. Free Radical Biology & Medicine. 33 (10), 1419-1432 (2002).
- Allen, R. G., Tresini, M. Oxidative stress and gene regulation. Free Radical Biology and Medicine. 28 (3), 463-499 (2000).
- Tate, D. J., Miceli, M. V., Newsome, D. A. Phagocytosis and H2O2 induce catalase and metallothionein gene expression in human retinal pigment epithelial cells. Investigative Ophthalmology and Visual Science. 36 (7), 1271-1279 (1995).
- Halliwell, B., Clement, M. V., Long, L. H. Hydrogen peroxide in the human body. FEBS Letters. 486 (1), 10-13 (2000).
- Giblin, F. J., McCready, J. P., Kodama, T., Reddy, V. N. A direct correlation between the levels of ascorbic acid and H2O2 in aqueous humor. Experimental Eye Research. 38, 87-93 (1984).
- Geiger, R. C., Waters, C. M., Kamp, D. W., Glucksberg, M. R. KGF prevents oxygen-mediated damage in ARPE-19 cells. Investigative Ophthalmology and Visual Science. 46, 3435-3442 (2005).
- Campochiaro, P. A., et al. Lentiviral vector gene transfer of endostatin/angiostatin for macular degeneration (GEM) study. Human Gene Therapy. 28, 99-111 (2017).
- Chen, X. -. D., Su, M. -. Y., Chen, T. -. T., Hong, H. -. Y., Han, A. -. D., Li, W. -. S. Oxidative stress affects retinal pigment epithelial cell survival through epidermal growth factor receptor/AKT signaling pathway. International Journal of Ophthalmology. 10 (4), 507-514 (2017).
- Tu, G., et al. Allicin attenuates H2O2 - induced cytotoxicity in retinal pigmented epithelial cells by regulating the levels of reactive oxygen species. Molecular Medicine Reports. 13, 2320-2326 (2016).
- Hao, Y., Liu, J., Wang, Z., Yu, L., Wang, J. Piceatannol protects human retinal pigment epithelial cells against hydrogen peroxide induced oxidative stress and apoptosis through modulating. Nutrients. 11, 1-13 (2019).
- Ballinger, S. W., Van Houten, B., Conklin, C. A., Jin, G. F., Godley, B. F. Hydrogen peroxide causes significant mitochondrial DNA damage in human RPE cells. Experimental Eye Research. 68 (6), 765-772 (1999).
- Ma, S., et al. Transgenic overexpression of uncoupling protein 2 attenuates salt-induced vascular dysfunction by inhibition of oxidative stress. American Journal of Hypertension. 27 (3), 345-354 (2014).
- Johnen, S., et al. Sleeping Beauty transposon-mediated transfection of retinal and iris pigment epithelial cells. Investigative Ophthalmology and Visual Science. 53 (8), 4787-4796 (2012).
- Mátés, L., et al. Molecular evolution of a novel hyperactive Sleeping Beauty transposase enables robust stable gene transfer in vertebrates. Nature Genetics. 41 (6), 753-761 (2009).
- . Marienfeld Technical information Neubauer-improved Available from: https://www.marienfeld-superior.com/information-about-our-counting-chambers.html (2020)
- . Electron Microscopy Sciences. Neubauer Haemocytometry Available from: https://www.emsdiasum.com/microscopy/technical/datasheet/68052-14.aspx (2020)
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2^(-ΔΔCT) method. Methods. 25 (4), 402-408 (2001).
- Bascuas, T., et al. Non-virally transfected primary human pigment epithelium cells overexpressing the oxidative stress reduction factors PEDF and GM-CSF to treat retinal neurodegeneration neurodegenerationl. Human Gene Therapy. 30 (11), (2019).
- Zhuge, C. C., et al. Fullerenol protects retinal pigment epithelial cells from oxidative stress-induced premature senescence via activating SIRT1. Investigative Ophthalmology & Visual Science. 55 (7), 4628-4638 (2014).
- Kaczara, P., Sarna, T., Burke, M. Dynamics of H2O2 Availability to ARPE-19 cultures in models of oxidative stress. Free Radical Biology and Medicine. 48 (8), 1068-1070 (2010).
- Gorrini, C., Harris, I. S., Mak, T. W. Modulation of oxidative stress as an anticancer strategy. Nature Reviews Drug Discovery. 12, 931-947 (2013).
- Wang, X., et al. PEDF protects human retinal pigment epithelial cells against oxidative stress via upregulation of UCP2 expression. Molecular Medicine Reports. 19 (1), 59-74 (2019).
- Donadelli, M., Dando, I., Fiorini, C., Palmieri, M. UCP2, a mitochondrial protein regulated at multiple levels. Cellular and Molecular Life Sciences. 71, 1171-1190 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır