Method Article
注射重组狐尾花叶病毒和甘蔗花叶病毒传染性克隆直接农种玉米幼苗
摘要
提出了一种基于 农杆菌的注射(农用注射)方案,用于将狐尾花叶病毒和甘蔗花叶病毒克隆接种到玉米幼苗中。以这种方式接种会导致病毒感染、病毒诱导的标记基因沉默以及 GFP 的病毒过表达。
摘要
基于农杆菌的接种方法广泛用于将病毒载体引入植物组织。本研究详细介绍了在携带病毒载体的农杆菌的分生组织附近注射玉米幼苗的方案。使用用于基因沉默和基因表达的重组狐尾花叶病毒(FoMV)克隆来优化该方法,其用途扩大到包括用于基因表达的重组甘蔗花叶病毒(SCMV)。将感兴趣的基因片段或编码序列插入到修饰的感染性病毒基因组中,该基因组已被克隆到二进制T-DNA质粒载体pCAMBIA1380中。将得到的质粒构建体转化为根瘤藻菌株GV3101。幼年4天的玉米幼苗可以在鞘翅淋巴结附近注射细菌,重悬于MgSO4溶液中。在农杆菌感染期间,携带病毒基因组的T-DNA被转移到玉米细胞中,从而允许转录病毒RNA基因组。随着重组病毒在整个植物中复制和全身扩散,可以在叶子上观察到靶基因沉默引起的病毒症状和表型变化,病灶模拟22(les22)或八氢番茄红素去饱和酶(pds),或者在用紫外光或荧光显微镜照射时可以检测到绿色荧光蛋白(GFP)的表达。为了同时检测病毒并评估插入片段的完整性,从注射植物的叶子中提取RNA,并使用携带插入序列的多克隆位点(MCS)两侧的引物进行RT-PCR。该方案已在几种玉米基因型中得到有效应用,并且可以很容易地扩展到其他病毒载体,从而为在玉米中引入病毒载体提供了一种可访问的工具。
引言
许多植物病毒的传染性克隆已被设计用于病毒诱导的基因沉默(VIGS),基因过表达(VOX),以及最近的病毒基因编辑(VEdGE)1,2,3,4,5,6,7,8,9,10,11.随着新的病毒构建体的开发,还必须考虑用这些修饰的病毒成功感染植物组织的方法。目前在植物中引发病毒感染的方法包括颗粒轰击,体外RNA转录本或DNA克隆的摩擦接种,血管穿刺接种或根瘤菌接种(农业接种)5,12,13,14,15,16,17.这些接种方法中的每一种都有固有的优点和缺点,包括成本,对专用设备的需求以及给定植物病毒系统的可行性。利用浸润或注射含有二元T-DNA构建体的农杆菌菌株以递送重组病毒的方法更可取,因为它们简单且价格低廉。然而,缺乏对玉米(玉米)等单子叶植物的详细农艺接种方法。
1986年发表了最早的关于用于病毒递送的农学接种的报告之一,当时将花椰菜花叶病毒(CaMV)的基因组插入T-DNA构建体中,并且由此产生的携带该结构 的农杆菌 被摩擦接种到萝卜植物上18。此后,还开发了其他农艺方法。例如,在狐尾花叶病毒(FoMV)的情况下, Nicotiana benthamiana 可以用作中间宿主,在叶子中产生病毒颗粒,提供接种源6。使用受感染的边 莲 叶对玉米进行擦拭接种是有效、快速和简单的,但使用中间宿主并不适用于所有玉米感染病毒。例如,甘蔗花叶病毒(SCMV)不能感染 边莲,需要使用替代接种源来获取来自该病毒的载体。1988年,含有玉米条纹病毒(MSV)(一种DNA病毒)的 农杆菌 通过注射(agroinjection)引入玉米幼苗中,证明基于 农杆菌的接种方法对单子叶植物也很有用19。尽管在农业注射方面取得了早期成功,但很少有研究在玉米中利用该技术,这给该方法对RNA病毒和VIGS,VOX和VEdGE载体的适用性留下了悬而未决的问题20,21,22。然而,在单子叶植物物种中广泛使用农业注射是有希望的,因为这种一般方法已用于兰花,水稻和小麦23,24,25,26,27,28。
该方案针对FoMV和 农杆菌 菌株GV3101进行了优化,并且还应用于SCMV载体。FoMV是一种宿主范围广泛的病毒,包括56种单子叶植物和双子叶植物29。FoMV具有6.2千碱基(kb)阳性意义的单链RNA基因组,可编码来自五个开放阅读框(ORFs)的五种不同蛋白质30,31,32,33,34,35。FoMV以前通过将感染性克隆掺入T-DNA质粒骨架上来开发成玉米的VIGS和VOX载体6,36,37。通过在涂层蛋白(CP)的下游添加克隆位点(MCS1 *)来修饰病毒基因组以用于VIGS应用(图1A)36。对于VOX和VEdGE应用,复制CP启动子并添加第二个克隆位点(MCS2)以在ORF 4和CP之间插入感兴趣的序列(图1B)6。包含 MCS1 和 MCS2 且不带插入片段的 FoMV 矢量是 FoMV 空矢量 (FoMV-EV)(图 1)。
SCMV是一种不相关的病毒,已被开发用于玉米中的VOX38。它是Potyviridae家族的成员,其中几个成员已被设计为在Planta39,40,41,42,43,44中表达外来蛋白。SCMV的宿主范围包括玉米,高粱和甘蔗45,46,使其对这些主要作物植物的基因功能研究很有价值36,38。SCMV具有积极的意义,单链RNA基因组长度约为10 kb47,48。为了创建SCMV VOX载体,利用完善的P1 / HCPro连接作为异源序列的插入位点38。该克隆位点之后是编码NIa-Pro蛋白酶切割位点的序列,导致产生独立于SCMV多蛋白的蛋白质(图1C)。
携带这些重组病毒的传染性cDNA的T-DNA质粒已被转化为 农杆菌 菌株GV3101。GV3101是一种诺帕林型菌株,众所周知,它能够将T-DNA转移到单子叶植物,包括玉米26,28,49。此外,以前的农业注射研究也使用了菌株C58或其衍生物GV3101,以及19,20,22,27。
在该方案的开发中使用了三个标记基因:两个用于基因沉默,一个用于基因表达。利用来自玉米基因 病灶模拟 22(les22,GRMZM2G044074)的329碱基对(bp)片段构建沉默载体FoMV-LES22。当 les22 在玉米中被沉默时,沿着叶子的脉管系统出现小而圆形的坏死细胞斑块,这些坏死细胞扩张并聚结成大面积的坏死叶组织50。FoMV-PDS含有来自高粱基因 八氢番茄红素去饱和酶 (pds,LOC110436156,96%序列与玉米 pds,GRMZM2G410515)的313 bp片段,诱导玉米中 pds 的沉默,导致沿着叶子脉管系统的光漂白细胞小条纹随着时间的推移而延长51。绿色荧光蛋白(GFP)的完整编码序列用于证明FoMV(FoMV-GFP)和SCMV(SCMV-GFP)的蛋白表达。叶片中的GFP表达通常在接种后14天(DPI)6中最容易检测到。尽管以前已有研究利用玉米中病毒载体的农用注射,但这些实验仅表明,农用注射可以促进玉米幼苗中感染性克隆的病毒感染,并且不会扩展到为VIGS或VOX应用设计的重组病毒19,20,21,22。这里提出的协议建立在以前的农业注射方法的基础上,特别是Grismley等人19。总体而言,这种农业注射方法与VIGS和VOX载体兼容,不需要专门的设备或替代宿主作为接种源,并且相对于需要生物化学或体外转录的其他常用方法,减少了建立和执行接种所需的总体时间和成本。该协议将促进玉米的功能基因组学研究,应用涉及VIGS,VOX和VEdGE。
研究方案
1. 质粒构建
注意:该方案可应用于其他病毒载体或 农杆菌 菌株,但这可能会影响通过农用注射接种的总体成功率。始终在层流罩中执行细菌接种和电镀步骤。
- FoMV 沉默构造
注:除非另有说明,否则 Luria-Bertani (LB) 介质 (Miller) 用于所有介质。通过将25g颗粒悬浮到1,000mL蒸馏水中并在121°C下高压灭菌15分钟来制备液体LB。 固体LB培养基在高压灭菌前加入1.5%琼脂类似。在LB冷却至〜60°C后加入抗生素,并将溶液倒入95×15mm培养皿中。要使用的抗生素浓度如下:利福平(rif)为25μg/mL,庆大霉素(gent)为50μg/mL,卡那霉素(kan)为50μg/mL。- PCR使用具有PacI限制位点的正向引物和具有XbaI限制位点的反向引物扩增来自待沉默的玉米基因(例如les22或pds)的片段。这将使基因片段能够以反义方向连接到FoMV-pCAMBIA1380二元载体的MCS1*中。
注意:按照 DNA 聚合酶规格,使用高保真 DNA 聚合酶、正向和反向引物(各 10 μM)、质粒 DNA 模板和水设置 PCR。扩增35个循环,使用根据DNA聚合酶和引物熔化温度(Tm)的退火温度,并每千碱基延伸30 s进行扩增。 - 根据试剂盒规格使用 PCR 纯化试剂盒进行 PCR 纯化。
- 用限制性内切酶 XbaI和 PacI消化纯化的PCR产物和FoMV-EV。使用1μg质粒或所有纯化的PCR产物,2μL10x缓冲液,1μL限制性内切酶,并加水制成20μL最终反应体积。根据酶规格孵育。
- 根据制造商的方案将消化的PCR产物和FoMV-EV与T4 DNA连接酶一起Liate。
- 使用热休克方法将连接的质粒转化为DH5α化学感受态 大肠杆菌 细胞。
- 在冰上解冻细胞并向管中加入3μL质粒。在冰上孵育30分钟,然后在42°C下热休克30秒。
- 在冰上放置5分钟,加入200μL超优汤,分解代谢抑制(SOC),让 大肠杆菌 细胞在37°C下在SOC培养基中恢复1小时,以225rpm振荡。
- 在卡那霉素选择性LB培养基上平板并在37°C孵育过夜。
- 通过使用引物 FM-5840F 和 FM-6138R 进行 Sanger 测序检查菌落的准确克隆(补充表 1)。将250 ng质粒DNA提交给将进行Sanger测序的设施。对于该实验,样本被送往爱荷华州立大学DNA核心设施。
- 用所选菌落接种2mL液体LB,并在37°C下孵育过夜,以225rpm振荡。通过碱性裂解质粒DNA制备从过夜培养物中提取质粒DNA52。
- 使用冻融方法将质粒DNA转化为 农杆菌 菌株GV3101细胞。让100μL化学感受态细胞在冰上解冻,加入1-5μL质粒并在冰上孵育30分钟。置于液氮中1分钟,然后在37°C下孵育3分钟。加入1 mL SOC,在28°C下摇动2-3小时,在rif,温和和kan选择性LB培养基上平板,并在28°C下孵育2天。
- 通过集落 PCR 筛查菌落是否存在插入片段。选择单个细菌菌落并将其混合在30μL水中。通过加入12.5μL聚合酶预混液,每个10μM引物1.25μL,FM-5840F和FM-6138R,3μL细菌集落悬浮液和水来建立PCR反应,最终体积为25μL。
- 用正确的 农杆菌集 落接种2-5 mL液体LB(rif,gent,kan)。让它在28°C下生长过夜,以225rpm振荡。
- 将过夜培养物与50%甘油溶液1:1混合。储存在-80°C以长期储存。
- PCR使用具有PacI限制位点的正向引物和具有XbaI限制位点的反向引物扩增来自待沉默的玉米基因(例如les22或pds)的片段。这将使基因片段能够以反义方向连接到FoMV-pCAMBIA1380二元载体的MCS1*中。
- FoMV 表达式构造
- PCR 扩增感兴趣的编码序列,包括起始密码子和停止密码子(例如 GFP),如 1.1.1 中所述,在前向引物上添加 Bsu36I 限制位点,在反向引物上添加 PspOMI 限制位点,以实现在感义方向上定向克隆到 MCS2 中。
- 根据试剂盒的规格使用 PCR 纯化试剂盒进行 PCR 纯化。
- 用限制性内切酶 Bsu36I 和 PspOMI 消化 PCR 产物和 FoMV-EV,如 1.1.3 中所述。
- 根据制造商的方案将消化的PCR产物和FoMV-EV与T4 DNA连接酶一起Liate。
- 使用1.1.5中描述的热休克方法转化为DH5α化学感受态 大肠杆菌 细胞。在卡那霉素选择性LB培养基上平板并在37°C孵育过夜。
- 使用引物5AmuS2和5AmuA2(补充表1)通过Sanger测序检查菌落的准确克隆,如1.1.6中所述。
- 用所选菌落接种2mL液体LB,并在37°C下孵育过夜,以225RPM振荡。通过碱性裂解质粒DNA制备从过夜培养物中提取质粒DNA52。
- 使用1.1.8中所述的冻融方法将质粒DNA转化为 农杆菌 菌株GV3101化学感受态细胞。在 rif、gent 和 kan 选择性 LB 培养基上平板,并在 28 °C 下孵育 2 天。
- 使用引物 5AmuS2 和 5AmuA2 筛选菌落是否存在具有集落 PCR 的插入片段。
- 用正确的 农杆菌菌 落接种2-5 mL液体LB(rif,gent,kan)。在28°C下以225rpm振荡过夜。
- 将过夜培养物与50%甘油溶液1:1混合。储存在-80°C以长期储存。
- SCMV 表达式构造
- PCR 扩增目的基因(例如 GFP),排除 1.1.1 中描述的终止密码子,包括正向引物上的 PspOMI 消化位点和反向引物上的 SbfI 消化位点,以便能够定向克隆到 SCMV-pCAMBIA1380 二元载体中。
注意:插入片段必须与病毒多蛋白一起克隆。 - 根据试剂盒的规格使用 PCR 纯化试剂盒进行 PCR 纯化。
- 用限制性内切酶 PspoMI和 SbfI消化PCR产物和SCMV-EV,如1.1.3中所述。
- 根据制造商的方案将消化的PCR产物和SCMV-EV与T4 DNA连接酶一起Liate。
- 使用1.1.5中描述的热休克方法将产物转化为DH5α化学感受态 大肠杆菌 细胞。在kan选择性LB培养基上平板并在37°C下孵育过夜。
- 使用引物SC-745F和HCProR1通过Sanger测序筛选菌落以获得准确的克隆,如1.1.6所述(补充表1)。
- 用所选菌落接种2mL液体LB,并在37°C下孵育过夜,以225rpm振荡。通过碱性裂解质粒DNA制备从过夜培养物中提取质粒DNA52。
- 使用冻融方法将质粒DNA转化为 农杆菌 菌株GV3101化学感受态细胞,如1.1.8中所述。在 rif、gent 和 kan 选择性 LB 培养基上平板,并在 28 °C 下孵育 2 天。
- 如1.1.9中所述,用引物SC-745F和HCProR1筛选嵌段是否存在嵌段PCR。
- 用正确的 农杆菌集 落接种2-5 mL液体LB(rif,gent,kan)。在28°C下以225rpm振荡过夜。
- 将过夜培养物与50%甘油溶液1:1混合。储存在-80°C以长期储存。
- PCR 扩增目的基因(例如 GFP),排除 1.1.1 中描述的终止密码子,包括正向引物上的 PspOMI 消化位点和反向引物上的 SbfI 消化位点,以便能够定向克隆到 SCMV-pCAMBIA1380 二元载体中。
2. 幼苗准备
- 在注射前4-7天将1-2个玉米种子("金色班塔姆"甜玉米,FR1064,B73等)种植在泥炭基生长培养基中,放置在托盘内的小插入物中。在25°C下16小时,在22°C(约185光合活性辐射(PAR))下8小时的夜晚,或在22-25°C和22-25°C(350-400 PAR)下在16小时下放置8小时的温室中。
注:对 农杆菌的 易感性因玉米基因型而异,影响成功率。此外,某些病毒载体可能与某些玉米基因型不相容。 - 定期浇水,每周施肥一次,用15-5-15液体肥料,百万分之330(PPM)。
3. 农杆菌的制备
- 在注射前一天,用适当的抗生素(rif,gent,kan)制备LB液体培养基,并用携带所需病毒构建体的 农杆菌 菌株接种。建议将20μL甘油储备液加入50mLLB中,这应该产生足够的细菌培养物来接种>100株植物,并且可以根据需要放大或缩小。
注意:为每4-5株制备足够的接种物,以在600nm(OD 600)的光密度为1.0时具有至少1mL的最终量的细菌悬浮液。 - 在28°C下以225rpm振荡24小时。
- 在室温下在4,000× g 下沉淀细菌10分钟。丢弃上清液。
- 通过移液或轻柔涡旋,用1mL去离子(DI)水彻底洗涤沉淀。
- 重复步骤3.3以沉降细菌。
- 通过移液或温和涡旋将沉淀重悬于1mL 10mM MgSO4 溶液中。
- 或者,向溶液中加入200μM乙酰丁酮。虽然常用,乙酰丝金酮仅增强某些 农杆菌 菌株的转化能力。作者尚未发现添加乙酰辛酮会影响该方案的效率(补充表2)。
注意:10 mM MgSO4 溶液可以由1M储备溶液制成,pH值为6.3,在室温下储存。溶液可能不需要pH值调节。
- 或者,向溶液中加入200μM乙酰丁酮。虽然常用,乙酰丝金酮仅增强某些 农杆菌 菌株的转化能力。作者尚未发现添加乙酰辛酮会影响该方案的效率(补充表2)。
- 用分光光度计测量样品的OD 600,并用10mM MgSO4溶液稀释至1.0 OD 600。
注意:这是一个安全的停止点。注射前,细菌悬浮液可在室温下保存长达5小时。
4. 注射
注意:4-7天大的玉米幼苗可用于注射。幼苗生长速度受生长条件、PAR含量(即温室中的PAR高于生长室)和基因型等因素的影响很大,这些因素在温室条件下可能难以控制。当植物高2-3厘米而没有叶子膨胀时,可以注射幼小至4天大,当最下面的圆尖叶扩大时,可以注射至7天。这种接种方法的成功率随着植物在播种后7天以上的年龄而迅速下降。无论幼苗的年龄如何,注射部位都是相同的。
- 戴上安全护目镜,使用连接到1 mL一次性注射器的25G x 5/8"针头将细菌悬浮液注射到鞘翅节点上方2-3mm的幼苗中。
注意:鞘翅节点是冠根最终形成的地方。这是工厂中最低的节点。通常,节点处和下方的颜色将从绿色变为白色。注射位置位于分生组织正上方。在这个阶段解剖一些幼苗可能有助于可视化分生组织的位置,从而形成适当的注射部位。 - 对注射器施加轻柔的压力,直到悬浮液充满鞘翅目或在涡旋中可见,具体取决于植物的生长阶段。这大约是100-200μL悬浮液。
注意:如果难以将悬浮液注入幼苗中,则注射部位可能太低。适度的压力是注入悬浮液所需要的全部。 - 注射所有幼苗,为每个结构更换注射器和针头。
5. 持续的植物护理
- 当它们7-8天大时,将注射的幼苗移植到13 x 13 x 15厘米或更大的花盆中。
- 保持生长条件(16小时光周期和每周一次受精)。
6. 感染确认(表型和 RT-PCR)
- 表型对植物进行 14-21 DPI 评分。沉默对照基因的 病变模仿22 或 八氢番茄红素去饱和酶 可以很容易地在叶子上看到,并且与FoMV症状不同。GFP表达可以通过荧光显微镜成像或其他紫外光成像来检测。
注意:某些构造/病毒载体可能需要更长的时间才能显示症状,或者可能根本不显示任何症状。高光照条件大大增加了由沉默 病变拟态22 和 八氢番茄红素去饱和酶引起的表型。如果植物保持在较低的光照条件下(例如生长室),则病变可能不太明显或不存在,但是不应影响由RT-PCR确定的实际感染率(表1)。 - 为了从分子上确认感染,根据制造商的说明,使用苯酚 - 氯仿提取在14-21 DPI之间和提取总RNA的样品叶6。
- 使用提取的RNA作为模板来生成第一链cDNA。
- 用最多5μg总RNA,1μL随机六聚体引物,1μL寡核苷酸(dT)18 引物,1μLdNTPs,1μL逆转录酶和水设置cDNA反应,最终体积为14.5μL。
- 使用为病毒构建体和cDNA设计的引物作为模板,对每个样品进行PCR以确认病毒感染并确定目标基因或基因片段的完整性,如1.1.1所述,除了将FoMV的周期减少到25个,SCMV的周期减少到30个以避免假阳性。
- 对于FoMV沉默构建体,使用引物FM-5840F和FM-6138R扩增含有玉米基因片段的MCS1*。对于FoMV表达构建体,使用引物5AmuS2和5AmuA2扩增含有插入基因的MCS2。
- 对于SCMV表达构建体,使用引物SC745-F和HCProR1在MCS上扩增,MCS包含插入的基因(补充图3)。
- 对于内源性对照基因,使用引物ZmActS和ZmActA,它们扩增玉米 肌动蛋白 的mRNA片段(GRMZM2G126010)或引物ZmUbiF和ZmUbiR,它们扩增玉米 多泛素 (GRMZM2G409726_T01)的mRNA片段。
- 在含有核酸染色剂的1%琼脂糖凝胶上可视化PCR产物,以确定是否存在病毒和基因或基因片段。
结果
本研究的目的是开发一种简单的方案,用于将用于基因沉默或基因表达的重组病毒直接引入玉米幼苗(图2)。携带插入片段的病毒载体是使用标准分子生物学技术设计和克隆的。用于沉默的基因片段入到 FoMV - EV 的 MCS1* 中,用于表达的编码序列入到 MCS2 的 FoMV - EV 或 MCS 的 SCMV - EV 中。将所得质粒转移到 农杆菌 菌株GV3101中。随后,在种植后一周或更短的时间内注射玉米幼苗。注射后两周,可以从表型和分子上评估植物的病毒感染,基因沉默和基因表达。
玉米植物在泥炭基培养基中生长4-7天。在这个阶段,芽尖分生组织位于鞘翅节点的正上方(图3A)。在鞘翅扩张2-3厘米或播种后7天后,将植物注射到鞘翅节点上方2-3毫米处(图3B-F)。在注射后约12天,植物将开始在叶子上显示沉默表型,通常在血管组织附近观察到,这些病变在视觉上与FoMV病毒镶嵌症状不同(图4)。FoMV的存在和靶基因的沉默都可以在注射的植物中检测到(图5)。GFP表达可以在注射后2周在荧光显微镜下检测到,并且在叶子5-7上最强(图6)。当在荧光成像系统下观察时,FoMV的GFP表达可以可视化为许多小的,点状的荧光区域分布在血管组织附近的叶子上,而SCMV的GFP表达由较大的斑块组成(图6,补充图1)。虽然病毒镶嵌症状在感染FoMV沉默结构的植物上通常可见,但注射了成功表达GFP的GFP表达结构的植物通常没有这些症状。因此,没有明显症状的植物可能仍然对病毒和GFP表达呈阳性。此外,应避免在农业注射过程中刺穿分生组织,因为这可能导致形态缺陷,但由此产生的植物存活并且通常是有症状的(图7)。
虽然该协议最初是使用甜玉米开发的,但使用农业注射可以成功地接种几种玉米自交系的FoMV基因沉默构建体。例如,FR1064和B73通常具有高病毒感染率(表2)。值得注意的是,Mo17是一条已知对FoMV具有遗传抗性的线,其感染效率为0%,正如预期的那样36,53。此外,所使用的构造会影响感染效率(表3)。在FoMV的情况下,FoMV-EV和FoMV-LES22通常具有最高的感染效率,分别为53%和54%。FoMV-PDS的效率略低,为38%,FoMV-GFP最低,为17%。SCMV-GFP的感染效率为8%。这些百分比是几个实验的平均值;单个实验可以具有更高或更低的感染效率。
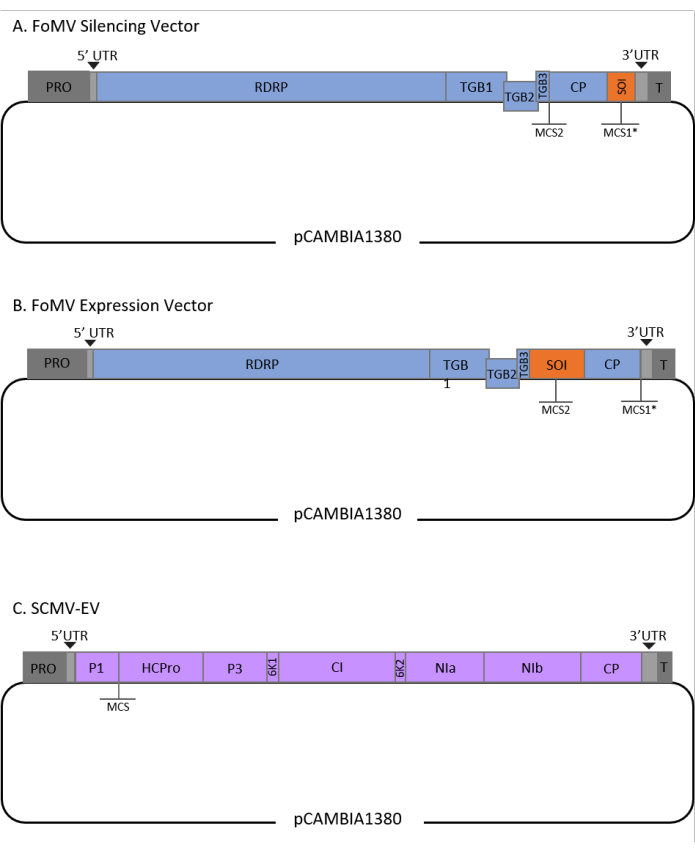
图1:用于玉米农业注射的FoMV和SCMV T-DNA克隆的示意图。 FoMV 载体包含两个多个克隆站点(MCS1* 和 MCS2)。空向量 FoMV-EV 为 7,269 bp,在任一 MCS 中均不包含任何插入片段。(A)使用FoMV载体的基因沉默可以通过将基因片段插入MCS1*(指定为目的序列(SOI))来实现,通常处于反义方向。(B)使用FoMV载体的基因表达可以通过将基因ORFs插入到MCS2中来实现,该方向被指定为SOI。(C)SCMV载体被设计为在P1和HCPro之间具有一个MCS。空向量 SCMV-EV 为 11,015 bp,在 MCS 中不包含任何插入片段。插入MCS中的与SCMV多蛋白一起进入框架的基因ORFs将以蛋白质的形式表达。 请点击此处查看此图的放大版本。
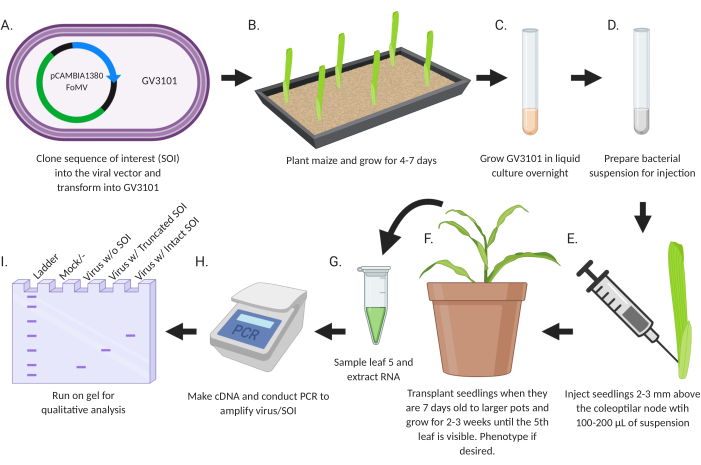
图2:农业注射方案的示意图摘要。(A)将SOI(CDS或基因片段)克隆到病毒载体中并转化为农杆菌菌株GV3101。(B)种植玉米并生长4-7天。(C)在28°C的液体培养物中生长GV3101过夜。(E)向鞘翅淋巴结上方2-3毫米处的幼苗注入100-200μL悬浮液。(F)将7天大的幼苗移植到较大的花盆中,并生长2-3周,直到第5片叶子可见。如果需要,表型。(G)样品叶5和提取RNA。(H)制作cDNA并进行PCR以扩增病毒/ SOI。(I)在凝胶上运行进行定性分析,以确定是否存在病毒以及截断或完整的SOI。这个数字是用 BioRender.com 创建的。请点击此处查看此图的放大版本。

图3:在鞘翅目节点上方接种幼苗的农业注射方法。 (A)4-5天龄的植物。鞘翅完全展开,第一片真叶可能部分可见,但未展开。(B)6-7天陈酿的植物。第一片叶子可能会扩大,但看不到项圈。第二片叶子也将是可见的,并可能在此阶段开始展开。(C)解剖6-7天大的植物,显示芽尖分生组织相对于鞘翅目的位置。(D)注射4-5天陈旧的植物。(E)注射6-7天龄的植物。(F)使用染料溶液注射6-7天大的植物,显示染色的接种物从幼苗的涡旋中出来。(G)6-7日龄植物注射部位相对于鞘翅目节点的特写。(H)注射后6-7天老植物的特写,显示植物涡旋中的染色接种物。 请点击此处查看此图的放大版本。

图4:农用注射实验中使用的沉默对照基因的症状 (A)在植物注射FoMV-LES22后以17 DPI拍摄的叶子。FoMV-LES22携带329 bp插入的3'CDS病灶,在反义取向中 模拟22 个玉米基因。沉默导致有毒代谢物的积累,这反过来又导致坏死性病变,这些坏死性病变首先沿着脉管系统出现条纹并生长成更大的斑块,如图所示。(B)在植物注射FoMV-PDS后以17 DPI拍摄的叶子。FoMV-PDS携带高粱 植物脱饱和酶 基因3'CDS在反义取向中的313碱基对插入物。玉米中 pds 的沉默导致系统性光漂白表型,该表型从沿着脉管系统的小而细的条纹开始,沿着叶子的长度生长成更长的条纹,如图所示。 请点击此处查看此图的放大版本。
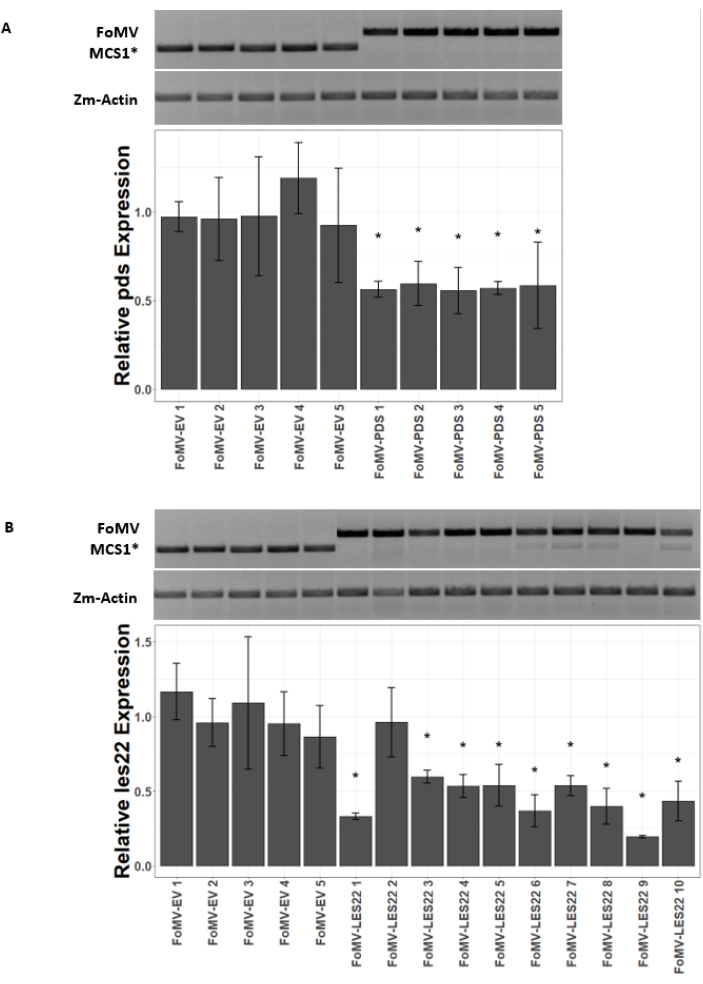
图5:注射FoMV基因沉默构建体的植物的qRT-PCR。 确认由甜玉米植物(Golden x Bantam)中通过农业注射传递的FoMV-LES22和FoMV-PDS构建体诱导的全身FoMV感染和基因沉默。(A)凝胶图像显示RT-PCR分析证实在五种植物的第6叶中存在FoMV-MCS1*空载体(315 bp扩增子)和FoMV-PDS(625 bp扩增子)。所使用的PCR引物产生跨越MCS1*的扩增子。玉米基因肌动蛋白(Zm-Actin)扩增子作为参考基因。条形图表示接种后37天通过FoMV-MCS1*或FoMV-PDS进行农业注射,叶6中pds表达的qRT-PCR相对表达值。在五个生物重复中的每一个中都可以检测到 pds 的抑制(p = 0.003;事后Dunnett测试;误差线表示三个技术重复的标准偏差(SD)。(B)凝胶图像显示RT-PCR分析,确认在五种植物的第6叶中存在FoMV-MCS1*(315 bp扩增子)。在10株植物的6叶组织(样品FoMV-LES22 1-5,38 DPI)和叶4(样品FoMV-LES22 6-10,20 DPI)中检测到FoMV-LES22(625 bp扩增子)。Zm-肌动蛋白扩增子作为参考基因。条形图表示通过FoMV-MCS1*或FoMV-LES22病毒构建体的农业注射在玉米组织中les22表达的qRT-PCR相对表达值。Les22抑制发生在10个生物重复中的9个(p = <0.0001;事后Dunnet测试;误差线表示三个技术重复的SD)。 请点击此处查看此图的放大版本。
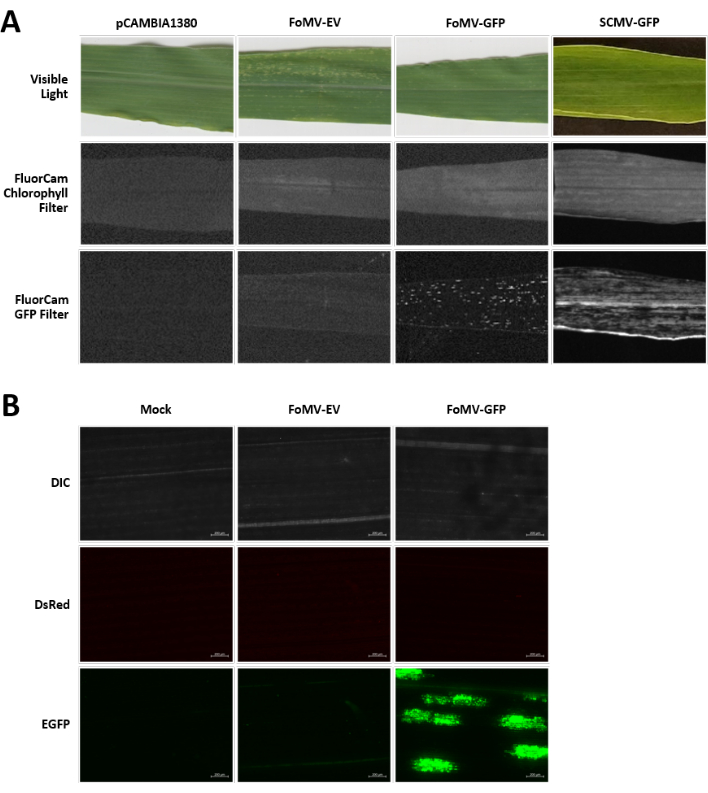
图 6.农业注射实验中使用的各种结构的表型。 所有成像植物在6-7天大时注射携带指示结构的 农杆菌 菌株GV3101。图像是在16 DPI下拍摄的。(A)pCAMBIA1380(空质粒骨架),FoMV-EV,FoMV-GFP和SCMV-GFP在可见光下,在250μs曝光的FluorCam叶绿素滤光片下,以及在10 ms曝光下的FluorCam GFP滤光片下的叶片症状。(B)模拟处理(仅注射MgSO4 溶液),FoMV-EV和FoMV-GFP注射植物的叶子的荧光显微镜图像。显示DIC,DsRed和EGFP通道,并且每个通道都是在1500 ms曝光下拍摄的。比例尺为200μm, 请点击此处查看此图的放大版本。

图 7.注射的形态学作用。 直接注射到分生组织中可能发生的更严重的形态学影响的一个例子。这种伤害可能导致叶子的"切碎"和茎的分裂。 请点击此处查看此图的放大版本。
| 病毒 | 生长条件 | 基因型 | # 受感染的植物 | 植物总数 | % 感染 | 平均感染百分比 |
| FoMV-EV | 生长室 | 甜玉米 | 22 | 23 | 96% | 97% |
| 抗氧化剂 B72 | 18 | 18 | 100% | |||
| 抗氧化剂 B104 | 20 | 21 | 95% | |||
| 温室 | 甜玉米 | 20 | 23 | 87% | 89% | |
| 抗氧化剂 B72 | 17 | 18 | 94% | |||
| 抗氧化剂 B104 | 16 | 19 | 84% | |||
| 断续器-电动汽车 | 生长室 | 甜玉米 | 14 | 21 | 67% | 47% |
| 抗氧化剂 B72 | 5 | 18 | 28% | |||
| 抗氧化剂 B104 | 10 | 21 | 48% | |||
| 温室 | 甜玉米 | 14 | 23 | 61% | 49% | |
| 抗氧化剂 B72 | 0 | 19 | 0% | |||
| 抗氧化剂 B104 | 19 | 22 | 86% |
表1:温室和生长室条件对农业注射接种效率的影响。 种子在相同的生长条件下发芽。将发芽的幼苗放入农业注射,其中一半被移动到生长室(25°C 16小时日光/ 22C 8小时夜间;185 PAR),另一半被移动到温室(22-25°C 16小时日光/22-25°C 8小时夜间;350-400 PAR)。该表以百分比形式报告感染率,该百分比由RT-PCR确认感染相应病毒的植物数量除以农业注射植物总数计算得出。生长室和温室条件之间的感染效率无统计学差异(FoMV两尾t检验p=0.08;SCMV 双尾 T 检验 p=0.96)。
| 玉米基因型 | FoMV-EV | FoMV-LES22 | 综合总计 | ||||
| 感染 | 总 | % 感染者 | 感染 | 总 | % 感染者 | % 感染者 | |
| 甜玉米 | 18 | 23 | 78% | 15 | 23 | 65% | 72% |
| MO47型 | 7 | 22 | 32% | 1 | 21 | 5% | 19% |
| K55型 | 1 | 15 | 7% | 3 | 17 | 18% | 13% |
| W64A | 10 | 22 | 45% | 8 | 20 | 40% | 43% |
| MO17 | 0 | 16 | 0% | 0 | 13 | 0% | 0% |
| 抗氧化剂 B72 | 10 | 18 | 56% | 7 | 17 | 41% | 49% |
| 抗氧化剂 B101 | 12 | 21 | 57% | 8 | 24 | 33% | 44% |
| FR1064 | 4 | 4 | 100% | 4 | 4 | 100% | 100% |
| 抗氧化剂 B104 | 10 | 22 | 45% | 5 | 21 | 24% | 35% |
| WCC22 | 2 | 7 | 29% | 4 | 6 | 67% | 46% |
| 空客 A188 | 0 | 3 | 0% | 4 | 6 | 67% | 44% |
表2:玉米基因型中FoMV构建体的感染效率。 将FoMV-EV和FoMV-LES22转化为11种玉米基因型。注射后,将幼苗移至温室。该表以百分比形式详细说明了感染率,该百分比由RT-PCR确认的感染FoMV的植物数量除以农业注射植物的总数计算得出。合并的总感染率显示了所测试的两种FoMV构建体的每种基因型的平均感染率。
| 工厂阶段 | 4-5天陈酿植物 | 6-7天陈年植物 | 综合总计 | ||||
| 症状的 | 总厂房 | % 感染者 | 症状的 | 总厂房 | % 感染者 | % 感染者 | |
| FoMV-EV | 42 | 72 | 58% | 80 | 170 | 47% | 53% (A) |
| FoMV-PDS | 65 | 157 | 41% | 66 | 184 | 36% | 39% (B C) |
| FoMV-LES22 | 115 | 195 | 59% | 144 | 292 | 49% | 54% (A B) |
| FoMV-GFP | 16 | 103 | 16% | 37 | 217 | 17% | 16% (C) |
| SCMV-GFP | 10 | 95 | 11% | 5 | 82 | 6% | 8% (C) |
表3:注射实验总结。 本表总结了2017年8月至2018年8月对金班塔姆甜玉米幼苗进行的注射实验。通过视觉(FoMV-EV,FoMV-PDS和FoMV-LES22)或FluorCam(FoMV-GFP和SCMV-GFP)筛查评估植物的病毒症状(FoMV-EV),沉默症状(pds和les22)或GFP荧光(GFP)。对于4-5天龄的植物和6-7天龄的植物,结果单独显示,以及所有植物年龄的摘要。4-5日龄植物和6-7日龄植物之间无显著差异(单因子方差分析,F=0.6513)。病毒构建体(Onaway ANOVA,F=<0.0001)与代表Tukey-Kramer HSD连接字母报告的字母之间存在差异。
补充表1:列出该方案中使用的所有引物名称和序列的表。请点击此处下载此表格。
补充表2:乙酰磺苷酮试验。 (A)初始乙酰汗酮试验,比较接种悬浮液与200μM乙酰汗甘酮(+)或不接种乙酰丝灵酮(-)之间的模拟,FoMV-EV和FoMV-LES22注射植物的症状发生率。(B)比较通过RT-PCR确定的FoMV-LES22的感染率,接种悬浮液不含乙酰甲磺灵酮(-),200μM乙酰丝金酮(+),并在将20μM乙酰汗酮加入细菌培养物前4小时在缓冲液中重悬,同时在最终悬浮液(++)中加入200μM乙酰香酮。总体而言,乙酰辛丁酮治疗之间未发现显着差异(单向方差分析,f= 0.5452)。 请点击此处下载此表格。
补充图1:玉米中农用注射SCMV的荧光成像和分子验证以及异源蛋白的表达。 用含有GFP和纳米荧光素酶(NLuc)的CDS的改良SCMV构建体对玉米进行农业注射。(A)荧光素成像用于筛查和检测GFP。左边是模拟注射植物,右边是SCMV-NLucGFP注射植物。(B)叶蛋白提取物通过SDS-PAGE分离,并通过凝胶内荧光素酶测定或免疫印迹评估NLuc,GFP和SCMV涂层蛋白(CP)的存在。 请点击此处下载此文件。
讨论
农杆菌 是促进植物相关研究中众多分子生物学技术的重要工具。本研究为将FoMV和SCMV病毒载体直接接种到玉米组织中用于VIGS和VOX应用提供了一种农业注射方案。主要目标是增加基于病毒的技术在单子叶植物中研究的便利性和实用性。虽然已经报道了几种病毒的直接玉米农艺接种,但作者并不知道详细的方案,并且在这些研究中没有VIGS和VOX应用的例子19,22。
据报道,并且在制定该协议时得到证实,注射位置是通过农业注射成功启动全身性病毒感染的关键因素19。在植物上持续注入推荐位置被认为是最大的变量,因为玉米幼苗中分生组织的确切位置几乎无法被眼睛检测到。为了尽量减少人际差异,建议将一些玉米幼苗解剖到分生组织,以更好地可视化其位置(图3C)。对于4-7天龄的植物,分生组织相对于鞘翅节点的位置应大致相同。此外,用染色液体进行注射提供了易于观察的演示,表明"接种物"如何填充叶旋涡,并且由于注射部位用染料标记,因此可以证实注射部位的准确性(图3G,H)。分生组织最容易受到农业注射的影响,但将 农杆菌 悬浮液直接注射到该组织中会导致不良的形态学效应(图6)19。具有受损分生组织的植物存活,但由此产生的缺陷是不可取的,因此,应避免直接注射这种组织。
有几个变量可能会影响通过农业注射成功启动全身性病毒感染,因为三个复杂的生物系统(植物,病毒和 农杆菌 菌株)必须协调相互作用。这种复杂的相互作用可能得益于分生区域快速分裂的细胞,使其成为农艺接种的理想地点19。 农杆菌 菌株必须能够感染植物组织的细胞以递送携带病毒基因组的T-DNA,并且植物必须对病毒敏感才能启动病毒复制和全身感染。玉米基因型对病毒(例如,Mo17对FoMV具有抗药性)或 农杆菌 菌株的易感性不同,但大多数测试似乎对FoMV和SCMV均敏感(表1 和 表2)53。例如,自交系FR1064和甜玉米品种Golden Bantam可能特别容易受到GV3101 农杆菌 和基于FoMV的载体的影响。
抽样的叶数和RT-PCR的取样时间对于准确评估病毒感染至关重要。在这里显示的示例中,叶数是通过从第一个圆形叶子(通常称为"拇指叶")开始向上计数来确定的。一旦叶子被扩展,叶子就被采样,下一片叶子已经开始出现。然而,哪些叶子最适合采样可能因所使用的病毒种类,生长条件和玉米基因型而异。因此,在将此方案应用于新的病毒系统时,建议进行初始时间过程实验,以优化有关叶子和时间的采样策略。
使用的特定结构显着影响该协议的效率。例如,空载体FoMV-EV和SCMV-EV以及FoMV-PDS和FoMV-LES22都含有小插入片段(分别为313 bp和329 bp),通常在这些实验中产生具有病毒症状的植物的最高百分比(表1 和 表2)。然而,与注射空载体或基因沉默构建体的植物相比,在FoMV-GFP和SCMV-GFP中携带较大GFP ORF(720 bp)插入物的重组病毒的感染率要低得多。这种趋势可能是由于病毒基因组中外源性遗传物质数量的增加对病毒适应性造成的负面影响。一些研究表明,植物病毒载体的插入稳定性在很大程度上取决于插入大小和序列36,54,55,56,57。此外,在接种FoMV或SCMV空载体后被感染的植物百分比存在显着差异,这表明需要额外的工作来优化SCMV的该方案(表1)。这些结果表明,在开发构造时可能需要进行一些故障排除,因为片段的顺序和长度都会影响效率。
总体而言,本研究表明,玉米幼苗的农用注射是两种不同RNA植物病毒、多种载体配置和11种玉米基因型的有效接种方法。这项与FoMV和SCMV的工作,结合先前利用玉米绿斑驳病毒(MCMV)或MSV注射的工作,表明农业注射适用于接种具有RNA和DNA病毒感染性克隆的玉米幼苗19,20,21,22。此外,这项工作进一步表明,农业注射是VIGS和VOX载体的可行方法,可以应用于幼年为四天的植物(表3)。预计这里提出的方案将很容易被玉米生物学家采用,以促进涉及瞬时基因沉默(VIGS)和过表达(VOX)的功能基因组学研究的研究。Agroinjection还具有促进基于病毒的基因编辑方法(VEdGE)的能力,否则这些方法将受到依赖植物转化的限制,从而可能提高编辑效率和可访问性58,59,60。鉴于适当的 农杆菌 菌株,玉米基因型和病毒载体经过深思熟虑的组合,通过农业注射接种有望成为玉米瞬时基因功能分析的宝贵工具。
披露声明
研究人员没有利益冲突要披露。
致谢
爱荷华州立大学是支持DARPA昆虫盟友计划HR0011-17-2-0053的团队的一部分。这项工作还得到了爱荷华州立大学植物科学研究所,爱荷华州立大学作物生物工程中心,美国农业部NIFA Hatch项目编号3808和爱荷华州基金的支持。K.L.H.还得到了爱荷华州立大学预测植物表型组学研究生培训计划的部分支持,该计划由美国国家科学基金会(DGE #1545453)资助,并由美国农业部国家食品和农业研究所的农业和食品研究计划拨款编号2019-07318资助。资助者在设计研究、收集、分析和解释数据以及撰写手稿方面没有任何作用。本材料中表达的任何意见、发现、结论或建议均为作者的观点,并不一定反映出资者的观点。
我们感谢Nick Lauter(USDA-ARS,Ames,IA)的玉米自交系种子,Christian F. Montes-Serey(爱荷华州立大学)制作FoMV-GFP克隆,以及Tyler Austin(爱荷华州立大学)的技术援助。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringes | Fisher Scientific | 14955450 | alternatively, BD 309659 |
| 15 mL Falcon Tubes | Corning Science | 352059 | |
| 1kb+ Ladder | ThermoFisher Scientific | 10787018 | For assessing sizes of PCR products |
| 25G x 5/8" PrecisionGlide Needles | Becton, Dickinson and Company (BD) | 305122 | |
| 28°C Incubator | For Agrobacterium | ||
| 37°C Incubator | For E. coli | ||
| Acetosyringone | MilliporeSigma | D134406 | Optional |
| Agar | MilliporeSigma | A4800 | |
| Agarose | GeneMate | E-3120 | For making gels to check for virus/insert stability |
| Agrobacterium tumefaciens Strain GV3101 | Carries vir plasmid encoding T-DNA transfer machinery, RifR, GmR, from lab stock | ||
| Bsu36I | New England Biolabs | R0524 | |
| cDNA Kit | ThermoFisher Scientific | K1672 | Maxima First Strand cDNA Synthesis Kit with Dnase |
| Chloroform | Fisher Scientific | C298 | For RNA extraction |
| Cuvettes | Fisher Scientific | 14955127 | 1.5 mL |
| D-(+)-Glucose | MilliporeSigma | G7528 | Alkaline Lysis |
| DH5alpha Competent E. coli Cells | New England Biolabs | C2987 | |
| DNA Ligase | ThermoFisher Scientific | K1422 | Rapid DNA Ligation Kit |
| EDTA (Ethylenediamine Tetraacetic Acid, Disodium Salt Dihydrate) | Fisher Scientific | S311 | Alkaline Lysis |
| Ethanol | For RNA extraction | ||
| Fertilizer | Peters Fertilizer 15-15-15 Concentrate | ||
| Flat Inserts | T.O. Plastics | 715357C | For germinating seeds in trays |
| Flats | T.O. Plastics | 710245C | For germinating seeds in trays |
| FluorCam | Photon Systems Instruments | To assess maize plants for GFP expression before microscope | |
| Fluorescence Microscope | |||
| Gel Electrophoresis Box | |||
| Gentamycin Sulfate | Fisher Scientific | BP918 | |
| Glacial Acetate | Fisher Scientific | A38 | Alkaline Lysis |
| Glycerol | Fisher Scientific | G33-500 | For saving frozen stocks of bacteria |
| Go-Taq, 2X | Promega | M7123 | |
| Hydrochloric Acid | Fisher Scientific | A144 | for pHing solutions |
| Isopropanol | Sigma-Aldrich | 109827 | For RNA extraction |
| Kanamycin, Monosulfate | Fisher Scientific | BP906 | |
| Large Pots | Kordlok | SQL0550 | 5x5x4" or bigger. For transplanting seedlings. |
| Luria Bertani (LB) Broth, Miller | Himedia | M1245 | |
| Magnesium Sulfate Heptahydrate | Amresco | 662 | |
| Maize Golden Bantam Sweet Corn Seed | American Meadows, West Coast Seeds | ||
| Maize Inbred Seed | Our seed comes from our institution, but we are not able to provide this for other researchers. | ||
| Maxima H Minus Reverse Transcriptase | ThermoFisher Scientific | EP0753 | |
| MilliQ | Elga | Purelab Ultra | |
| Monarch PCR & DNA Cleanup Kit | New England Biolabs | T1030 | |
| PacI | New England Biolabs | R0547 | |
| Peters Excel 15-5-15 Fertilizer | ICL Specialty Fertilizers | G99140 | |
| Petri Dish, 95 mm x 15 mm | Fisher Scientific | FB0875714G | |
| pH Meter | |||
| Potassium Acetate | Fisher Scientific | P171 | Alkaline Lysis |
| Primers | Our primers were synthesized through our institutional DNA facility or through IDT | ||
| PspOMI | New England Biolabs | R0653 | |
| Q5 High-Fidelity DNA Polymerase | New England Biolabs | M0491 | |
| Rifampicin | EMD Millipore Corp | 557303 | |
| Rnase A | ThermoFisher Scientific | 12091021 | Alkaline Lysis |
| SbfI | New England Biolabs | R0642 | |
| Scale | For weighing chemicals for media or buffers | ||
| SDS (Sodium Dodecyl Sulfate) | Fisher Scientific | BP166 | Alkaline Lysis |
| Sodium Hydroxide | Fisher Scientific | S318 | Alkaline Lysis |
| Soil Substrate | SunGro Horticulture | SS#1-F1P | Sunshine Mix #1/Fafard-1P, any soil mix that maize grows well in is sufficient |
| Spectrophotometer | For measuring OD600 | ||
| Sybr Safe, 10,000X | Invitrogen | S33102 | For making gels to check for virus/insert stability |
| Thermocycler | For PCR | ||
| Tris Base | Fisher Scientific | BP154 | Alkaline Lysis |
| Trizol | Ambion | 15596018 | For RNA extraction |
| Weigh Paper | For weighing chemicals for media or buffers | ||
| XbaI | New England Biolabs | R0145 |
参考文献
- Zaidi, S. E. A., Mansoor, S. Viral vectors for plant genome engineering. Frontiers in Plant Science. 8, 539(2017).
- Kant, R., Dasgupta, I. Gene silencing approaches through virus-based vectors: speeding up functional genomics in monocots. Plant Molecular Biology. 100, 3-18 (2019).
- Hu, J., et al. A barley stripe mosaic virus-based guide RNA delivery system for targeted mutagenesis in wheat and maize. Molecular Plant Pathology. 20 (10), 1463-1474 (2019).
- Pasin, F., Menzel, W., Daròs, J. A. Harnessed viruses in the age of metagenomics and synthetic biology: an update on infectious clone assembly and biotechnologies of plant viruses. Plant Biotechnology Journal. 17 (6), 1010-1026 (2019).
- Cody, W. B., Scholthof, H. B. Plant virus vectors 3.0: Transitioning into synthetic genomics. Annual Review of Phytopathology. 57 (1), 211-230 (2019).
- Mei, Y., et al. Protein expression and gene editing in monocots using foxtail mosaic virus vectors. Plant Direct. 3 (11), 00181(2019).
- Ruiz, M. T., Voinnet, O., Baulcombe, D. C. Initiation and maintenance of virus-induced gene silencing. Plant Cell. 10 (6), 937-946 (1998).
- Bekele, D., Tesfaye, K., Fikre, A. Applications of virus induced gene silencing (VIGS) in plant functional genomics studies. Journal of Plant Biochemistry & Physiology. 07 (01), 1000229(2019).
- Scholthof, H. B., Scholthof, K. B. G., Jackson, A. O. Plant virus gene vectors for transient expression of foreign proteins in plants. Annual Review of Phytopathology. 34 (1), 299-323 (1996).
- Holzberg, S., Brosio, P., Gross, C., Pogue, G. P. Barley stripe mosaic virus-induced gene silencing in a monocot plant. Plant Journal. 30 (3), 315-327 (2002).
- Wang, R., et al. An efficient virus-induced gene silencing vector for maize functional genomics research. Plant Journal. 86 (1), 102-115 (2016).
- Redinbaugh, M. G., et al. Transmission of viral RNA and DNA to maize kernels by vascular puncture inoculation. Journal of Virological Methods. 98 (2), 135-143 (2001).
- Scholthof, H. B. The capsid protein gene of tomato bushy stunt virus is dispensable for systemic movement and can be replaced for localized expression of foreign genes. Molecular Plant-Microbe Interactions. 6 (3), 309(1993).
- Scholthof, H. B., Scholthof, K. B. G., Kikkert, M., Jackson, A. O. Tomato bushy stunt virus spread is regulated by two nested genes that function in cell-to-cell movement and host-dependent systemic invasion. Virology. 213 (2), 425-438 (1995).
- Scholthof, H. B. Rapid delivery of foreign genes into plants by direct rub-inoculation with intact plasmid dna of a tomato bushy stunt virus gene vector. Journal of Virology. 73 (9), 7823-7829 (1999).
- Zhang, J., et al. Vacuum and co-cultivation agroinfiltration of (germinated) seeds results in tobacco rattle virus (TRV) mediated whole-plant virus-induced gene silencing (VIGS) in wheat and maize. Frontiers in Plant Science. 8, 393(2017).
- Vaghchhipawala, Z., Rojas, C. M., Senthil-Kumar, M., Mysore, K. S. Agroinoculation and agroinfiltration: simple tools for complex gene function analyses. Methods in Molecular Biology. 678, Clifton, N.J. 65-76 (2011).
- Grimsley, N., Hohn, B., Hohn, T., Walden, R. "Agroinfection," an alternative route for viral infection of plants by using the Ti plasmid. Proceedings of the National Academy of Sciences. 83 (10), 3282-3286 (1986).
- Grimsley, N. H., Ramos, C., Hein, T., Hohn, B. Merisfematic tissues of maize plants are most suscepnsle to agroinfection with maize streak virus. Bio/Technology. 6 (2), 185-189 (1988).
- Martin, D. P., Rybicki, E. P. Improved efficiency of Zea mays agroinoculation with Maize streak virus. Plant Disease. 84 (10), 1096(2000).
- Martin, D. P., Willment, J. A., Rybicki, E. P. Evaluation of maize streak virus pathogenicity in differentially resistant Zea mays genotypes. Phytopathology. 89 (8), 695-700 (1999).
- Wang, Q., et al. Further characterization of Maize chlorotic mottle virus and its synergistic interaction with Sugarcane mosaic virus in maize. Scientific Reports. 7, 39960(2017).
- Hsieh, M. H., et al. Optimizing virus-induced gene silencing efficiency with Cymbidium mosaic virus in Phalaenopsis flower. Plant Science. 201-202 (1), 25-41 (2013).
- Hsieh, M. H., et al. Virus-induced gene silencing unravels multiple transcription factors involved in floral growth and development in Phalaenopsis orchids. Journal of Experimental Botany. 64 (12), 3869-3884 (2013).
- Zenna, N. S., et al. Genetic analysis of tolerance to rice tungro bacilliform virus in rice (Oryza sativa L.) through agroinoculation. Journal of Phytopathology. 154 (4), 197-203 (2006).
- Marks, M. S., Kemp, J. M., Woolston, C. J., Dale, P. J. Agroinfection of wheat: A comparison of Agrobacterium strains. Plant Science. 63 (2), 247-256 (1989).
- Dasgupta, I., et al. Rice tungro bacilliform virus DNA independently infects rice after Agrobacterium-mediated transfer. Journal of General Virology. 72 (6), 1215-1221 (1991).
- Boulton, M. I., Buchholz, W. G., Marks, M. S., Markham, P. G., Davies, J. W. Specificity of Agrobacterium-mediated delivery of maize streak virus DNA to members of the Gramineae. Plant Molecular Biology. 12 (1), 31-40 (1989).
- Paulsen, A. Q. Purification and properties of foxtail mosaic virus. Phytopathology. 77 (11), 1346(1977).
- Bancroft, J. B., Rouleau, M., Johnston, R., Prins, L., Mackie, G. A. The entire nucleotide sequence of foxtail mosaic virus RNA. Journal of General Virology. 72 (9), 2173-2181 (1991).
- Bruun-Rasmussen, M., Madsen, C. T., Johansen, E., Albrechtsen, M. Revised sequence of foxtail mosaic virus reveals a triple gene block structure similar to potato virus X. Archives of Virology. 153 (1), 223-226 (2008).
- Rouleau, M., Bancroft, J. B., Mackie, G. A. Partial purification and characterization of foxtail mosaic potexvirus RNA-dependent RNA polymerase. Virology. 197 (2), 695-703 (1993).
- Rouleau, M., Smith, R. J., Bancroft, J. B., Mackie, G. A. Purification, properties, and subcellular localization of foxtail mosaic potexvirus 26-kDa protein. Virology. 204 (1), 254-265 (1994).
- Samuels, T. D., et al. Subcellular targeting and interactions among the potato virus X TGB proteins. Virology. 367 (2), 375-389 (2007).
- Cho, S. Y., Kim, K. H. Identification of the capsid protein-binding region of the SL1(+) RNA located at the 5' region of the potato virus X genome. Plant Pathology Journal. 28 (1), 75-80 (2012).
- Mei, Y., Zhang, C., Kernodle, B. M., Hill, J. H., Whitham, S. A. A foxtail mosaic virus vector for virus-induced gene silencing in maize. Plant Physiology. 171 (2), 760-772 (2016).
- Bouton, C., et al. Foxtail mosaic virus: A viral vector for protein expression in cereals. Plant Physiology. 177 (4), 1352-1367 (2018).
- Mei, Y., Liu, G., Zhang, C., Hill, J. H., Whitham, S. A. A sugarcane mosaic virus vector for gene expression in maize. Plant Direct. 3 (8), 00158(2019).
- Gal-On, A., Meiri, E., Huet, H., Hua, W. J., Raccah, B., Gaba, V. Particle bombardment drastically increases the infectivity of cloned DNA of zucchini yellow mosaic potyvirus. Journal of General Virology. 76 (12), (1995).
- Gao, R., et al. Construction of an infectious cDNA clone and gene expression vector of Tobacco vein banding mosaic virus (genus Potyvirus). Virus Research. 169 (1), 276-281 (2012).
- López-Moya, J. J., García, J. A. Construction of a stable and highly infectious intron-containing cDNA clone of plum pox potyvirus and its use to infect plants by particle bombardment. Virus Research. 68 (2), (2000).
- Choi, I. R., French, R., Hein, G. L., Stenger, D. C. Fully biologically active in vitro transcripts of the eriophyid mite-transmitted wheat streak mosaic tritimovirus. Phytopathology. 89 (12), (1999).
- Kim, K. S., et al. Infectivity of in vitro transcripts of Johnsongrass mosaic potyvirus full-length cDNA clones in maize and sorghum. Archives of Virology. 148 (3), 563-574 (2003).
- Stewart, L. R., Bouchard, R., Redinbaugh, M. G., Meulia, T. Complete sequence and development of a full-length infectious clone of an Ohio isolate of Maize dwarf mosaic virus (MDMV). Virus Research. 165 (2), 219-224 (2012).
- Wylie, S. J., et al. ICTV virus taxonomy profile: Potyviridae. Journal of General Virology. 98 (3), 352-354 (2017).
- Shukla, D. D. taxonomy of potyviruses infecting maize, sorghum, and sugarcane in Australia and the United States as determined by reactivities of polyclonal antibodies directed towards virus-specific N-termini of coat proteins. Phytopathology. 79 (2), 223(1989).
- Shukla, D. D., Ward, C. W. Amino Acid sequence homology of coat proteins as a basis for identification and classification of the potyvirus group. Journal of General Virology. 69 (11), 2703-2710 (1988).
- Chung, B. Y. W., Miller, W. A., Atkins, J. F., Firth, A. E. An overlapping essential gene in the Potyviridae. Proceedings of the National Academy of Sciences of the United States of America. 105 (15), 5897-5902 (2008).
- Jarchow, E., Grimsley, N. H., Hohn, B. virF, the host-range-determining virulence gene of Agrobacterium tumefaciens, affects T-DNA transfer to Zea mays. Proceedings of the National Academy of Sciences of the United States of America. 88 (23), 10426-10430 (1991).
- Hu, G., Yalpani, N., Briggs, S. P., Johal, G. S. A porphyrin pathway impairment is responsible for the phenotype of a dominant disease lesion mimic mutant of maize. The Plant Cell. 10 (7), 1095(2007).
- Qin, G., et al. Disruption of phytoene desaturase gene results in albino and dwarf phenotypes in Arabidopsis by impairing chlorophyll, carotenoid, and gibberellin biosynthesis. Cell Research. 17 (5), 471-482 (2007).
- Jones, P. Isolation of plasmid DNA from E. coli. Encyclopedia of Life Sciences. , (2003).
- Ji, Q., Yang, B., Lee, M., Chen, Y., Lübberstedt, T. Mapping of quantitative trait loci/locus conferring resistance to foxtail mosaic virus in maize using the intermated B73-×-Mo17 population. Plant Breeding. 129 (6), 721-723 (2010).
- Pacak, A., et al. The brome mosaic virus-based recombination vector triggers a limited gene silencing response depending on the orientation of the inserted sequence. Archives of Virology. 155 (2), 169-179 (2010).
- Miché, L., Battistoni, F., Gemmer, S., Belghazi, M., Reinhold-Hurek, B. Host-dependent expression of Rhizobium leguminosarum bv. viciae hydrogenase is controlled at transcriptional and post-transcriptional levels in legume nodules. Molecular Plant-Microbe Interactions. 19 (5), 1323-1331 (2018).
- Yamagishi, M., Masuta, C., Suzuki, M., Netsu, O. Peanut stunt virus-induced gene silencing in white lupin (lupinus albus). Plant Biotechnology. 32 (3), 181-191 (2015).
- Avesani, L., et al. Stability of Potato virus X expression vectors is related to insert size: Implications for replication models and risk assessment. Transgenic Research. 16 (5), 587-597 (2007).
- Ali, Z., et al. Efficient virus-mediated genome editing in plants using the CRISPR/Cas9 system. Molecular Plant. 8 (8), 1288-1291 (2015).
- Cody, W. B., Scholthof, H. B., Mirkov, T. E. Multiplexed gene editing and protein overexpression using a tobacco mosaic virus viral vector. Plant Physiology. 175 (1), 23-35 (2017).
- Ali, Z., Eid, A., Ali, S., Mahfouz, M. M. Pea early-browning virus-mediated genome editing via the CRISPR/Cas9 system in Nicotiana benthamiana and Arabidopsis. Virus Research. 244, 333-337 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。