Method Article
אגרוינוקולציה ישירה של שתילי תירס על ידי הזרקה עם וירוס פסיפס זנב שועל רקומביננטי ווירוס פסיפס קנה סוכר שיבוטים זיהומיות
* These authors contributed equally
In This Article
Summary
פרוטוקול הזרקה מבוסס אגרובקטריום (אגרובקטריה) מוצג לחיסון של וירוס פסיפס זנב שועל ווירוסי פסיפס קני סוכר לשתילי תירס. חיסון באופן זה מוביל לזיהום ויראלי, השתקת גנים הנגרמת על ידי וירוס של גנים סמן, ו overexpression ויראלי של GFP.
Abstract
גישות חיסון מבוססות אגרובקטריום נמצאות בשימוש נרחב להכנסת וקטורים ויראליים לרקמות הצמח. מחקר זה מפרט פרוטוקול להזרקת שתילי תירס ליד רקמה מריסטית עם אגרובקטריום הנושא וקטור ויראלי. שיבוטים של וירוס זנב שועל רקומביננטי (FoMV) שתוכננו להשתקת גנים וביטוי גנים שימשו לייעול שיטה זו, והשימוש בה הורחב כדי לכלול וירוס פסיפס קני סוכר רקומביננטי (SCMV) שתוכנן לביטוי גנים. רסיסי גנים או רצפי קידוד של עניין מוכנסים לגנום ויראלי מדבק שונה, אשר שוכפל לתוך PCAMBIA1380 וקטור פלסמיד T-DNA בינארי pCAMBIA1380. המבנים plasmid וכתוצאה מכך הופכים אגרובקטריום tumefaciens זן GV3101. שתילי תירס צעירים כמו 4 ימים ניתן להזריק ליד צומת coleoptilar עם חיידקים resuspended בתמיסת MgSO4. במהלך ההדבקה באגרובקטריום, ה- T-DNA הנושא את הגנום הנגיפי מועבר לתאי תירס, ומאפשר שעתוק של הגנום הנגיפי RNA. כאשר הנגיף רקומביננטי משכפל ומתפשט באופן שיטתי ברחבי הצמח, ניתן להבחין בתסמינים ויראליים ושינויים פנוטיפיים הנובעים מהשתקת הגנים המטרה נגע מחקה 22 (les22) או פיטואן דטוראז (pds) על העלים, או ביטוי של חלבון פלואורסצנטי ירוק (GFP) ניתן לזהות עם הארה עם אור UV או מיקרוסקופיה פלואורסצנטית. כדי לזהות את הנגיף ולהעריך את שלמות ההוספה בו זמנית, RNA מופק מעלי הצמח המוזרק ו- RT-PCR מתבצע באמצעות פריימרים מאגפים את אתר השיבוט המרובה (MCS) הנושא את הרצף המוחדר. פרוטוקול זה שימש ביעילות במספר גנוטיפים תירס והוא יכול בקלות להיות מורחב לווקטורים ויראליים אחרים, ובכך מציע כלי נגיש עבור הקדמה וקטורית ויראלית תירס.
Introduction
שיבוטים זיהומיים של וירוסים צמחיים רבים תוכננו להשתקת גנים הנגרמת על ידי וירוסים (VIGS), ביטוי יתר של גנים (VOX), ולאחרונה, עריכת גנים התומכת בווירוסים (VEdGE)1,2,3,4,5,6,7,8,9,10,11 . כמו מבנים ויראליים חדשים מפותחים, שיטות להדביק בהצלחה רקמות צמח עם וירוסים מותאמים אלה חייבים להיחשב גם. השיטות הנוכחיות להפעלת זיהומי וירוסים בצמחים כוללות הפגזת חלקיקים, חיסון לשפשף של תמלילי RNA במבחנה או שיבוטי DNA, חיסון ניקוב כלי דם, או חיסון אגרובקטריום טומפצ'ין (אגרונוקולציה)5,12,13,14,15,16,17 . לכל אחת משיטות החיסון הללו יש יתרונות וחסרונות אינהרנטיים, הכוללים עלות, צורך בציוד מיוחד והיתכנות בתוך מערכת צמחית-וירוס נתונה. שיטות המשתמשות בחדירה או הזרקה של זני אגרובקטריום המכילים מבני T-DNA בינאריים שנועדו לספק וירוסים רקומביננטיים עדיפים, מכיוון שהם פשוטים וזולים. עם זאת, שיטות אגרוינוקולציה מפורטות עבור מינים מונוקוטילדוניים כגון Zea mays (תירס) חסרים.
אחד הדיווחים הראשונים על אגרוינוקולציה למסירת וירוסים פורסם בשנת 1986, כאשר הגנום של וירוס פסיפס הכרובית (CaMV) הוכנס למבנה T-DNA, והאגרובקטריום שנוצר שנשא מבנה זה היה מחוסן על צמחי לפת18. שיטות נוספות לאגרוינוקולציה פותחו מאז. לדוגמה, במקרה של וירוס פסיפס זנב שועל (FoMV), Nicotiana benthamiana יכול לשמש כפונדקאי ביניים כדי ליצור חלקיקי וירוס בעלים המספקים מקור אינוקולום6. לשפשף את החיסון של תירס באמצעות עלי N. benthamiana נגועים הוא יעיל, מהיר, ופשוט, אבל השימוש של פונדקאי ביניים אינו עובד עבור כל וירוסים מדביקי תירס. וירוס פסיפס קנה סוכר (SCMV), למשל, לא יכול להדביק N. benthamiana, הדורש שימוש במקורות inoculum חלופיים עבור וקטורים נגזר וירוס זה. בשנת 1988, אגרובקטריום המכיל וירוס פס תירס (MSV), וירוס DNA, הוכנס לשתילי תירס על ידי הזרקה (אגרוינג'קציה), הדגמת שיטות חיסון מבוססות אגרובקטריום שימושיות גם עבור מונוקוטים19. למרות הצלחה מוקדמת זו עם אגרוינג'קציה, מעט מחקרים המשתמשים בטכניקה זו בתירס פורסמו, משאירים שאלות פתוחות על הישימות של שיטה זו עבור וירוסי RNA ו- VIGS, VOX ו- VEdGE וקטורים20,21,222. עם זאת, שימוש נרחב של אגרואינג'קציה במין מונוקוט הוא מבטיח, כי גישה כללית זו נוצלה סחלב, אורז, חיטה23,24,25,26,27,28.
פרוטוקול זה היה ממוטב עבור FoMV ו זן אגרובקטריום GV3101 וגם הוחל על וקטור SCMV. FoMV הוא וירוס פוטקסוירוס עם מגוון רחב של מארחים הכולל 56 מינים מונוקוט ודיקוט29. ל-FoMV יש חוש חיובי של 6.2 קילו-בסיס (kb), גנום RNA חד-גדילי המקודד חמישה חלבונים שונים מחמש מסגרות קריאה פתוחות (ORFs)30,31,32,33,34,35. FoMV פותחה בעבר הן לווקטור VIGS והן לווקטור VOX עבור תירס על ידי שילוב שיבוט זיהומי על עמוד שדרה פלסמיד T-DNA6,36,37. הגנום הנגיפי שונה עבור יישומי VIGS על ידי הוספת אתר שיבוט (MCS1*) מיד במורד הזרם של חלבון המעיל (CP) (איור 1A)36. עבור יישומי VOX ו- VEdGE, מקדם ה- CP שוכפל ונוספה אתר שיבוט שני (MCS2) כדי לאפשר הכנסת רצפים של אינטרסים בין ORF 4 ל- CP (איור 1B)6. וקטור ה-FoMV המכיל הן MCS1 והן MCS2 ללא תוספות הוא וקטור ריק FoMV (FoMV-EV) (איור 1).
SCMV הוא וירוס לא קשור שפותח עבור VOX ב- תירס38. הוא חבר במשפחת Potyviridae, אשר כמה חברים תוכננו להביע חלבונים זרים planta39,40,41,41,42,43,44. המגוון המארח של SCMV כולל תירס, דורה, קני סוכר45,46, מה שהופך אותו בעל ערך למחקרים פונקציונליים גנטיים בצמחי היבול העיקריים האלה36,38. SCMV יש חוש חיובי, גנום RNA חד גדילי של כ 10 kb אורך47,48. כדי ליצור את וקטור SCMV VOX, צומת P1/HCPro המבוסס היטב נוצל כאתר הכנסה עבור רצפים הטרולוגיים38. אתר שיבוט זה מלווה בקידוד רצף של אתר מחשוף פרוטאז NIa-Pro, מה שמוביל לייצור חלבונים ללא תלות בפוליפרוטאין SCMV (איור 1C).
פלסמידים T-DNA הנושאים cDNA זיהומיות של וירוסים רקומביננטיים אלה הפכו לזן אגרובקטריום GV3101. GV3101 הוא זן מסוג נופלין, אשר ידועים ביכולתם להעביר T-DNA למינים מונוקוטילדונים, כולל תירס26,28,49. בנוסף, מחקרים קודמים של אגרואינג'קציה השתמשו בזנים C58 או GV3101 הנגזרת שלו, כמו גם 19,20,22,27.
שלושה גני סמן שימשו בפיתוח פרוטוקול זה: שניים להשתקת גנים ואחד לביטוי גנים. קטע 329 בסיס-זוג (bp) מן נגע הגן תירס חיקוי 22 (les22, GRMZM2G044074) שימש לבניית וקטור ההשתקה FoMV-LES22. כאשר les22 מושתק בתירס, כתמים קטנים ועגולים של תאים נמקיים מופיעים לאורך כלי הדם של עלים המתרחבים ומתמזגים לאזורים גדולים של רקמת עלה נמק50. FoMV-PDS, המכיל שבר של 313 bp מהגן דורה פיטואן דטוראז (pds, LOC1110436156, 96% זהות רצף כדי pds תירס, GRMZM2G410515), גורם השתקה של pds בתירס, וכתוצאה מכך פסים קטנים של תאים פוטו מולבנים לאורך כלי הדם של העלים המתארכים לאורך זמן51. רצף הקידוד השלם של חלבון פלואורסצנטי ירוק (GFP) שימש להדגמת ביטוי חלבון הן עבור FoMV (FoMV-GFP) והן עבור SCMV (SCMV-GFP). ביטוי GFP בעלים הוא בדרך כלל ניתן לזיהוי ביותר ב 14 ימים לאחר החיסון (DPI)6. למרות שהיו מחקרים קודמים ניצול אגרואינג'קציה של וקטורים ויראליים בתירס, ניסויים אלה הראו רק כי agroinjection יכול רק להקל על זיהום ויראלי משיבוט זיהומיות בשתילי תירס ואינם מתרחבים וירוסים רקומביננטיים המיועדים ליישומי VIGS או VOX19,20,21,222. הפרוטוקול המוצג כאן מתבסס על שיטות אגרואינג'קציה קודמות, במיוחד Grismley et al.19. בסך הכל, שיטת agroinjection זו תואמת לווקטורים VIGS ו- VOX, אינה דורשת ציוד מיוחד או מארחים חלופיים כמקורות חיסון, ומפחיתה את הזמן והעלות הכוללים הנדרשים כדי להגדיר ולבצע חיסונים ביחס לשיטות נפוצות אחרות הדורשות ביוליסטיקה או תמלול הפריה חוץ גופית. פרוטוקול זה יאפשר מחקרי גנומיקה פונקציונליים בתירס עם יישומים הכוללים VIGS, VOX ו- VEdGE.
Protocol
1. בניית פלסמיד
הערה: פרוטוקול זה יכול להיות מיושם על וקטורים ויראליים אחרים או זני אגרובקטריום , אבל זה עשוי להשפיע על ההצלחה הכוללת של חיסון על ידי agroinjection. תמיד לבצע חיסון חיידקי וציפוי צעדים במכסה המנוע זרימה למינארית.
- מבנה השתקת FoMV
הערה: מדיה של לוריא-ברטאני (LB) (מילר) משמשת עבור כל המדיה, אלא אם צוין אחרת. נוזל LB נעשה על ידי השעיית 25 גרם של גרגירים לתוך 1,000 מ"ל של מים מזוקקים autoclaving במשך 15 דקות ב 121 °C (65 °F). מדיה LB מוצק נעשה באופן דומה עם תוספת של 1.5% אגר לפני autoclaving. אנטיביוטיקה מתווספת לאחר LB מקורר ~ 60 °C (60 °F), ואת הפתרון הוא שפך לתוך 95 x 15 מ"מ צלחות פטרי. ריכוזי האנטיביוטיקה לשימוש הם כדלקמן: ריפאמפיצין (ריף) ב 25 מיקרוגרם / מ"ל, גנטמיצין (ג'נטלמן) ב 50 מיקרוגרם / מ"ל, ו kanamycin (kan) ב 50 מיקרוגרם / מ"ל.- PCR להגביר שברים מהגן תירס להיות מושתק (למשל, les22 או pds) באמצעות פריימר קדימה עם אתר הגבלת PacI ופריימר הפוך עם אתר הגבלת XbaI. פעולה זו תאפשר קשירה של שברי הגנים לתוך MCS1* של הווקטור הבינארי FoMV-pCAMBIA1380 בכיוון האנטי-סנס.
הערה: הגדירו את ה-PCR באמצעות פולימראז DNA בעל אמינות גבוהה, פריימרים קדימה והפוך ב-10 מיקרומטר כל אחד, תבנית דנ"א פלסמיד ומים, בהתאם למפרטי ה-DNA פולימראז. להגביר במשך 35 מחזורים, באמצעות טמפרטורת חישול על פי DNA פולימראז וטמפרטורת ההיתוך פריימר (Tm), וסיומת של 30 s לכל קילו בסיס להיות מוגבר. - בצע טיהור PCR באמצעות ערכת טיהור PCR בהתאם למפרטי הערכה.
- לעכל את מוצר PCR מטוהר ואת FoMV-EV עם אנזימי הגבלה XbaI ו PacI. השתמש 1 מיקרוגרם של פלסמיד או כל מוצר PCR מטוהר, 2 μL של חיץ 10x, 1 μL של אנזים הגבלה, ולהוסיף מים כדי להפוך את נפח התגובה הסופי 20 μL. דגירה על פי מפרט האנזים.
- לייגטו את מוצר ה-PCR המעוכל ואת FoMV-EV יחד עם ligase DNA T4 בהתאם לפרוטוקול היצרן.
- להפוך את הפלסמיד קשור לתוך DH5α כימית מוסמך E. coli תאים באמצעות שיטת הלם חום.
- להפשיר תאים על קרח ולהוסיף 3 μL של plasmid לצינור. דגירה על קרח במשך 30 דקות, ולאחר מכן הלם חום עבור 30 s ב 42 °C (42 °F).
- מניחים על קרח במשך 5 דקות, מוסיפים 200 μL מרק סופר אופטימלי עם דיכוי קטבולי (SOC) ולאפשר לתאי E. coli להתאושש במדיה SOC במשך 1 שעות ב 37 °C (37 °F) עם רועד ב 225 סל"ד.
- צלחת על מדיה סלקטיבית LB קנאמיצין ודגור ב 37 °C (50 °F) לילה.
- בדוק מושבות לשיבוטים מדויקים על ידי ריצוף סנגר באמצעות פריימרים FM-5840F ו- FM-6138R (טבלה משלימה 1). שלח 250 ננוגרם של דנ"א פלסמיד למתקן שיבצע ריצוף סנגר. לניסוי זה נשלחו דגימות למתקן ליבת הדנ"א של אוניברסיטת איווה.
- לחסן 2 מ"ל של LB נוזלי עם המושבה שנבחרה ודגר ב 37 °C (50 °F) לילה עם רועד ב 225 סל"ד. לחלץ DNA plasmid מתרבות הלילה באמצעות תמוגה אלקליין פלסמיד DNA הכנה52.
- להפוך DNA פלסמיד לתוך זן אגרובקטריום GV3101 תאים באמצעות שיטת הפשרת הקפאה. אפשר 100 μL של תאים כימיים מוכשרים להפשיר על קרח, להוסיף 1-5 μL של פלסמיד ודגור על קרח במשך 30 דקות. מניחים חנקן נוזלי במשך 1 דקות, ולאחר מכן לדגור ב 37 °C (50 °F) במשך 3 דקות. הוסף 1 מ"ל של SOC, לאפשר להתאושש במשך 2-3 שעות ב 28 °C (28 °F) עם רעד, צלחת על ריף, ג'נטלמן, קאן סלקטיבי LB מדיה ודגרה ב 28 °C (50 °F) במשך 2 ימים.
- מושבות מסך לנוכחות של הוספה עם PCR מושבה. בחר מושבה חיידקית אחת ולערבב אותו ב 30 μL של מים. הגדר תגובת PCR על-ידי הוספת 12.5 μL של תערובת מאסטר פולימראז, 1.25 μL של כל פריימר 10 מיקרומטר, FM-5840F ו- FM-6138R, 3 μL של השעיית מושבת החיידקים, ומים לנפח סופי של 25 μL. מחזור 35 פעמים עם טמפרטורת חישול של 64 °C וזמן הארכה של 1 דקות (1 דקות עבור כל kb מוגבר).
- לחסן 2-5 מ"ל של LB נוזלי (ריף, ג'נטלמן, קאן) עם מושבת אגרובקטריום נכונה. תן לו לגדול בן לילה ב 28 °C (50 °F) עם רועד ב 225 סל"ד.
- מערבבים את תרבות הלילה עם פתרון גליצרול 50% 1:1. יש לאחסן בטמפרטורה של עד 80 °C (60 °F) לאחסון לטווח ארוך.
- PCR להגביר שברים מהגן תירס להיות מושתק (למשל, les22 או pds) באמצעות פריימר קדימה עם אתר הגבלת PacI ופריימר הפוך עם אתר הגבלת XbaI. פעולה זו תאפשר קשירה של שברי הגנים לתוך MCS1* של הווקטור הבינארי FoMV-pCAMBIA1380 בכיוון האנטי-סנס.
- מבנה ביטוי FoMV
- PCR מגביר את רצף הקידוד של עניין כולל קודונים התחלה והפסקה (למשל, GFP) כמתואר ב 1.1.1, הוספת אתר הגבלת Bsu36I בפריימר הקדמי ואתר הגבלת PspOMI בפריימר ההפוך כדי לאפשר שיבוט כיווני בכיוון החוש לתוך MCS2.
- בצע טיהור PCR באמצעות ערכת טיהור PCR בהתאם למפרטי הערכה.
- לעכל את מוצר PCR ואת FoMV-EV עם אנזימי ההגבלה Bsu36I ו - PspOMI, כמתואר ב 1.1.3.
- לייגטו את מוצר ה-PCR המעוכל ואת FoMV-EV יחד עם ligase DNA T4 בהתאם לפרוטוקול היצרן.
- להפוך DH5α כימית מוסמך E. coli תאים באמצעות שיטת הלם חום כמתואר ב 1.1.5. צלחת על מדיה סלקטיבית LB קנאמיצין ודגור ב 37 °C (50 °F) לילה.
- בדוק מושבות לשיבוטים מדויקים על ידי ריצוף סנגר כמתואר ב 1.1.6 באמצעות פריימרים 5AmuS2 ו 5AmuA2 (טבלה משלימה 1).
- לחסן 2 מ"ל של LB נוזלי עם המושבה שנבחרה ודגר ב 37 °C (50 °F) לילה עם רועד ב 225 סל"ד. לחלץ DNA plasmid מתרבות הלילה באמצעות תמוגה אלקליין פלסמיד DNA הכנה52.
- להפוך DNA פלסמיד לתוך זן אגרובקטריום GV3101 תאים מוסמכים כימית באמצעות שיטת הפשרת הקפאה כמתואר ב 1.1.8. צלחת על ריף, ג'נטלמן, קאן סלקטיבי LB מדיה ודגרה ב 28 °C (50 °F) במשך 2 ימים.
- מושבות מסך לנוכחות של הוספה עם PCR מושבה באמצעות פריימרים 5AmuS2 ו 5AmuA2.
- לחסן 2-5 מ"ל נוזלי LB (ריף, ג'נטלמן, קאן) עם מושבת אגרובקטריום נכונה. יש לנער למשך הלילה ב-225 סל"ד ב-28 מעלות צלזיוס.
- מערבבים את תרבות הלילה עם פתרון גליצרול 50% 1:1. יש לאחסן בטמפרטורה של עד 80 °C (60 °F) לאחסון לטווח ארוך.
- מבנה ביטוי SCMV
- PCR להגביר את הגן של עניין (למשל, GFP) למעט קודון עצירה כמתואר ב 1.1.1, כולל אתר עיכול PspOMI בפריימר הקדמי ואתר עיכול SbfI על פריימר הפוך כדי לאפשר שיבוט כיווני לתוך הווקטור הבינארי SCMV-pCAMBIA1380.
הערה: יש לשכפל את ההוספה במסגרת עם הפוליפרוטאין הנגיפי. - בצע טיהור PCR באמצעות ערכת טיהור PCR בהתאם למפרטי הערכה.
- לעכל את מוצר PCR ואת SCMV-EV עם אנזימי ההגבלה PspOMI ו - SbfI, כמתואר ב 1.1.3.
- לייגטו את מוצר ה-PCR המעוכל ואת ה-SCMV-EV יחד עם ligase DNA T4 בהתאם לפרוטוקול היצרן.
- להפוך את המוצר לתוך DH5α כימי מוסמך כימית E. coli תאים באמצעות שיטת הלם חום כמתואר ב 1.1.5. צלחת על קאן סלקטיבי LB מדיה ודגרה ב 37 °C (50 °F) לילה.
- מושבות מסך לשיבוטים מדויקים על-ידי רצף סנגר כמתואר ב- 1.1.6 באמצעות הפריימרים SC-745F ו- HCProR1 (טבלה משלימה 1).
- לחסן 2 מ"ל של LB נוזלי עם המושבה שנבחרה ודגר ב 37 °C (50 °F) לילה עם רועד ב 225 סל"ד. לחלץ את ה- DNA plasmid מתרבות הלילה באמצעות ליזה אלקליין פלסמיד DNA הכנה52.
- להפוך את ה- DNA plasmid לתוך זן אגרובקטריום GV3101 תאים כימיים מוכשרים באמצעות שיטת הפשרת הקפאה כמתואר ב 1.1.8. צלחת על ריף, ג'נטלמן, קאן סלקטיבי LB מדיה ודגרה ב 28 °C (50 °F) במשך 2 ימים.
- מושבות מסך לנוכחות של הוספה עם PCR מושבה עם פריימרים SC-745F ו- HCProR1 כמתואר ב 1.1.9.
- לחסן 2-5 מ"ל של LB נוזלי (ריף, ג'נטלמן, קאן) עם מושבת אגרובקטריום נכונה. יש לנער למשך הלילה ב-225 סל"ד ב-28 מעלות צלזיוס.
- מערבבים את תרבות הלילה עם פתרון גליצרול 50% 1:1. יש לאחסן בטמפרטורה של עד 80 °C (60 °F) לאחסון לטווח ארוך.
- PCR להגביר את הגן של עניין (למשל, GFP) למעט קודון עצירה כמתואר ב 1.1.1, כולל אתר עיכול PspOMI בפריימר הקדמי ואתר עיכול SbfI על פריימר הפוך כדי לאפשר שיבוט כיווני לתוך הווקטור הבינארי SCMV-pCAMBIA1380.
2. הכנת שתילים
- צמח 1-2 זרעי תירס (תירס מתוק 'זהוב Bantam', FR1064, B73, וכו ') במדיום גידול מבוסס כבול בתוספות קטנות להציב בתוך מגשים 4-7 ימים לפני ההזרקה. יש למקם בתא גדילה מתחת ל-16 שעות ביום ב-25°C ו-8 שעות בלילה בטמפרטורה של 22°C (כ-185 °C (~185 קרינה פעילה מבחינה פוטוסינתזה (PAR)) או בחממה מתחת ל-16 שעות ביום ב-22-25 °C (350-400 PAR).
הערה: הרגישות לאגרובקטריום משתנה בין גנוטיפים של תירס, ומשפיעה על שיעורי ההצלחה. בנוסף, וקטורים ויראליים מסוימים עשויים להיות לא תואמים לגנוטיפים מסוימים של תירס. - מים באופן קבוע ולהפרות פעם בשבוע עם 15-5-15 דשן נוזלי ב 330 חלקים למיליון (PPM).
3. הכנת אגרובקטריום
- יום אחד לפני הזריקה, להכין מדיה נוזלית LB עם אנטיביוטיקה המתאימה (ריף, ג'נט, קאן) ולחסן עם זן אגרובקטריום נושא את המבנה הנגיפי הרצוי. מומלץ להוסיף 20 μL של מלאי גליצרול לתוך 50 מ"ל של LB, אשר צריך להניב מספיק תרבות חיידקים כדי לחסן >100 צמחים וניתן לשנות את קנה המידה למעלה או למטה לפי הצורך.
הערה: הכן מספיק inoculum כדי לקבל כמות סופית של השעיה חיידקית של לפחות 1 מ"ל בצפיפות אופטית של 600 ננומטר (OD600) של 1.0 עבור כל 4-5 צמחים. - יש לנער ב-225 סל"ד ב-28 מעלות צלזיוס למשך 24 שעות.
- חיידקי גלולה במשך 10 דקות ב 4,000 x g בטמפרטורת החדר. זרוק את הסופר-טבעי.
- לשטוף את הכדור ביסודיות עם 1 מ"ל של מים deionized (DI) על ידי צנרת או מערבולת עדינה.
- חזור על שלב 3.3 לחיידקים כדוריים.
- Resuspend את הכדור ב 1 מ"ל של 10 mM MgSO4 פתרון על ידי pipetting או מערבולת עדינה.
- לחלופין, הוסף 200 μM acetosyringone לפתרון. למרות שנעשה שימוש נפוץ, acetosyringone רק משפר את יכולת הטרנספורמציה של כמה זני אגרובקטריום . המחברים לא מצאו כי תוספת של acetosyringone משפיע על היעילות בפרוטוקול זה (טבלה משלימה 2).
הערה: פתרון MgSO4 של 10 מ"מ יכול להתבצע מפתרון מלאי של 1 M עם pH של 6.3 מאוחסן בטמפרטורת החדר. סביר להניח שהפתרון לא ידרוש התאמת pH.
- לחלופין, הוסף 200 μM acetosyringone לפתרון. למרות שנעשה שימוש נפוץ, acetosyringone רק משפר את יכולת הטרנספורמציה של כמה זני אגרובקטריום . המחברים לא מצאו כי תוספת של acetosyringone משפיע על היעילות בפרוטוקול זה (טבלה משלימה 2).
- למדוד OD600 של המדגם עם spectrophotometer ולדלל ל 1.0 OD600 עם פתרון MgSO4 10 mM.
הערה: זוהי נקודת עצירה בטוחה. השעיה חיידקית ניתן לשמור בטמפרטורת החדר עד 5 שעות לפני ההזרקה.
4. הזרקה
הערה: שתילי תירס מגיל 4-7 ימים יכולים לשמש להזרקה. קצב גידול השתיל מושפע מאוד מתנאי הצמיחה, כמות PAR (כלומר, PAR גבוה יותר בחממה מאשר בתא הצמיחה), וגנוטיפ, בין היתר זה יכול להיות קשה לשלוט בתנאי החממה. צמחים יכולים להיות מוזרקים צעירים כמו 4 ימים כאשר הם 2-3 ס"מ גבוה ללא עלים מורחבים וישנים כמו 7 ימים כאשר העלה המעוגל התחתון ביותר מורחב. שיעור ההצלחה של שיטות חיסון אלה יורד במהירות כאשר צמחים מזדקנים מעבר ל -7 ימים לאחר הזריעה. אתר ההזרקה זהה לא משנה גיל השתילים.
- לובש משקפי בטיחות, להזריק את ההשעיה החיידקית לתוך השתילים 2-3 מ"מ מעל צומת coleoptilar באמצעות מחט 25G x 5/8 " מחובר מזרק חד פעמי 1 מ"ל.
הערה: צומת coleoptilar הוא המקום שבו שורשי הכתר בסופו של דבר ייווצרו. זהו הצומת הנמוך ביותר במפעל. בדרך כלל, יהיה שינוי צבע מירוק ללבן בצומת ומתחת לו. מיקום ההזרקה נמצא ממש מעל המריסם. ניתוח כמה שתילים בשלב זה עשוי לעזור לדמיין את המיקום של meristem וכתוצאה מכך את אתר ההזרקה הנכון. - החל לחץ עדין על המזרק עד ההשעיה ממלאת את coleoptile או גלוי whorl, בהתאם לשלב הצמיחה של הצמחים. זה בערך 100-200 μL של השעיה.
הערה: אם קשה להזריק את ההשעיה לשתיל, אתר ההזרקה עשוי להיות נמוך מדי. לחץ מתון הוא כל מה שצריך כדי להזריק את ההשעיה. - להזריק את כל השתילים, שינוי מזרקים ומחטים עבור כל מבנה.
5. המשך הטיפול בצמחים
- להשתיל את השתילים המוזרקים ל 13 x 13 x 13 x 15 ס"מ או סירים גדולים יותר כאשר הם בני 7-8 ימים.
- לשמור על תנאי הצמיחה (16 שעות photoperiod ודישון פעם בשבוע).
6. אישור של זיהום (Phenotypically ו RT-PCR)
- Phenotypically ציון צמחים בין 14-21 DPI. נגעים מהשתקת הגנים השליטה נגע לחקות 22 או פיטואן desaturase ניתן לראות בקלות על העלים והם נבדלים מתסמיני FoMV. ביטוי GFP ניתן לזהות באמצעות הדמיית מיקרוסקופ פלואורסצנטי או הדמיה אור UV אחרת.
הערה: מבנים מסוימים / וקטורים ויראליים עשויים להימשך זמן רב יותר כדי להראות סימפטומים או לא יכול להראות תסמינים בכלל. תנאי אור גבוהים להגדיל מאוד את פנוטיפים הנגרמים על ידי השתקת נגע לחקות 22 ו phytoene desaturase. נגעים עשויים להיות פחות גלויים או נעדרים אם צמחים נשמרים בתנאי אור נמוכים יותר כגון תא צמיחה, אולם שיעור ההדבקה בפועל כפי שנקבע על ידי RT-PCR לא צריך להיות מושפע (טבלה 1). - כדי לאשר זיהום מולקולרי, מדגם עלה 6 בין 14-21 DPI לחלץ RNA הכולל באמצעות מיצוי פנול-כלורופורם על פי הוראת היצרן.
- שימוש ברנ"א שחולץ כתבנית ליצירת cDNA בעל גדיל ראשון.
- הגדר את תגובת cDNA עם עד 5 מיקרוגרם של RNA הכולל, 1 μL של פריימרים הקסאמר אקראיים, 1 μL של oligo (dT)18 פריימרים, 1 μL של dNTPs, 1 μL של תמלול הפוך ומים עבור נפח סופי של 14.5 μL.
- באמצעות פריימרים המיועדים למבנה הנגיפי ול- cDNA כתבנית, בצע PCR על כל דגימה כדי לאשר זיהום ויראלי ולקבוע את שלמות הגן או שבר הגן של עניין כמתואר ב 1.1.1, למעט להפחית מחזורים ל 25 עבור FoMV ו 30 עבור SCMV כדי למנוע תוצאות חיוביות שגויות.
- עבור מבני השתקה של FoMV, השתמש בפריימרים FM-5840F ו- FM-6138R כדי להגביר את מעבר ל- MCS1*, המכיל את שבר גן התירס. עבור מבני ביטוי FoMV, השתמש בפריימרים 5AmuS2 ו- 5AmuA2 כדי להגביר על פני MCS2, המכיל את הגן שהוכנס.
- למבני ביטוי SCMV, השתמשו בפריימרים SC745-F ו-HCProR1 כדי להגביר את ה-MCS, המכיל את הגן שהוכנס (איור משלים 3).
- עבור גן בקרה אנדוגני, השתמש פריימרים ZmActS ו ZmActA, אשר להגביר שבר mRNA של אקטין תירס (GRMZM2G126010) או פריימרים ZmUbiF ו ZmUbiR, אשר להגביר שבר mRNA של פוליוביקוויטין תירס (GRMZM2G409726_T01).
- דמיינו את מוצר ה-PCR על ג'ל אגרוז 1% המכיל כתם חומצת גרעין כדי לקבוע את נוכחותם או היעדרם של וירוס ורסיס גן או גן או גן.
תוצאות
מטרת המחקר הייתה לפתח פרוטוקול פשוט להכנסה ישירה של וירוסים רקומביננטיים שתוכננו להשתקת גנים או לביטוי גנים לשתילי תירס (איור 2). וקטורים הנגיף הנושאים תוספות מתוכננים ומשוכפלים באמצעות טכניקות ביולוגיה מולקולרית סטנדרטיות. שברי גנים להשתקה מוכנסים ל- MCS1* ב- FoMV-EV ורצפי קידוד לביטוי מוכנסים ל- FoMV-EV ב- MCS2 או SCMV-EV ב- MCS. הפלסמידים המתקבלים מועברים לזן אגרובקטריום GV3101. לאחר מכן, שתילי תירס מוזרקים תוך שבוע או פחות לאחר השתילה. שבועיים לאחר ההזרקה, ניתן להעריך צמחים הן פנוטיפית והן מבחינה מולקולרית לזיהום ויראלי, השתקת גנים וביטוי גנים.
צמחי תירס גדלים במדיום מבוסס כבול במשך 4-7 ימים. בשלב זה, מריסת הצילום האפילית נמצאת ממש מעל צומת הקולופטילר (איור 3A). לאחר שהקולופטיל התארך ב-2-3 ס"מ או עד 7 ימים לאחר הזריעה, הצמחים מוזרקים 2-3 מ"מ מעל צומת הקולופטילר (איור 3B-F). בערך 12 ימים לאחר ההזרקה, צמחים יתחילו להציג פנוטיפים משתיקים על העלים שלהם, שנצפו בדרך כלל ליד רקמת כלי הדם, ונגעים אלה נבדלים חזותית מתסמיני פסיפס נגיפיים של FoMV (איור 4). הן נוכחותו של FoMV והן ההשתקה של גנים ממוקדים ניתנים לזיהוי בצמחים מוזרקים (איור 5). ביטוי GFP יכול להיות מזוהה על ידי שבועיים לאחר הזרקה תחת מיקרוסקופ פלואורסצנטי והוא החזק ביותר על עלים 5-7 (איור 6). כשמסתכלים עליהם תחת מערכת דימות פלואורסצנטית, ניתן לדמיין ביטוי GFP מ-FoMV כמו אזורים קטנים ומנוקדים רבים של פלואורסצנטיות המופצים על-פני עלים ליד רקמת כלי הדם, בעוד שביטוי GFP מ-SCMV מורכב מתיקונים גדולים יותר (איור 6, איור משלים 1). למרות שתסמיני פסיפס ויראליים נראים לעתים קרובות על צמחים נגועים במבני השתקה FoMV, צמחים מוזרקים עם מבני ביטוי GFP כי הם מבטאים בהצלחה GFP לעתים קרובות אין תסמינים אלה. כתוצאה מכך, צמח ללא תסמינים נראים לעין עדיין עשוי להיות חיובי עבור וירוס וביטוי GFP. בנוסף, יש להימנע מניקוב המריסטם במהלך הליך האגרואינג'קציה, שכן הדבר עלול לגרום לפגמים מורפולוגיים, אך הצמחים המתקבלים שורדים ולעתים קרובות הם סימפטומטיים (איור 7).
למרות פרוטוקול זה פותח במקור באמצעות תירס מתוק, כמה קווים מולדים תירס ניתן לחסן בהצלחה עם מבני השתקת גנים FoMV באמצעות agroinjection. לדוגמה, FR1064 ו- B73 בדרך כלל יש שיעורים גבוהים של זיהום ויראלי (טבלה 2). ראוי לציין, Mo17, קו עם עמידות גנטית ידועה FoMV, היה יעילות זיהום 0% כצפוי36,53. בנוסף, המבנה המשמש משפיע על יעילות הזיהום (לוח 3). במקרה של FoMV, FoMV-EV ו- FoMV-LES22 בדרך כלל יש את יעילות הזיהום הגבוהה ביותר ב 53% ו 54%, בהתאמה. FoMV-PDS יש יעילות נמוכה מעט יותר ב 38%, ו FoMV-GFP הוא הנמוך ביותר ב 17%. SCMV-GFP יש יעילות זיהום של 8%. אחוזים אלה הם ממוצעים על פני מספר ניסויים; ניסויים בודדים יכולים להיות בעלי יעילות זיהום גבוהה או נמוכה יותר.
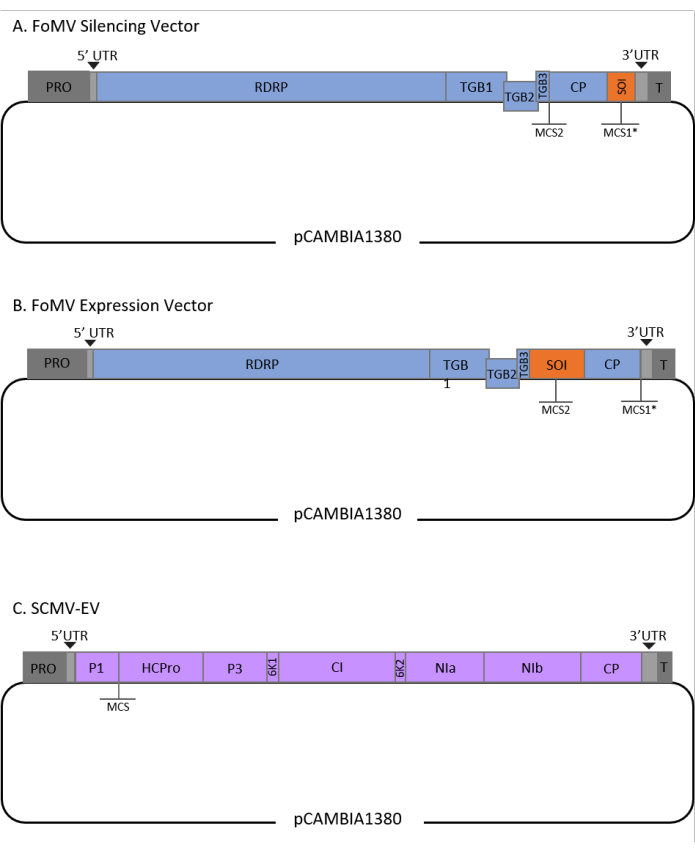
איור 1: ייצוגים סכמטיים של שיבוטי ה-T-DNA של FoMV ו-SCMV המשמשים לאגרו-ג'ינקציה בתירס. וקטור FoMV מכיל שני אתרי שיבוט מרובים (MCS1* ו- MCS2). הווקטור הריק, FoMV-EV, הוא 7,269 bp ואינו מכיל תוספות באף אחת מה- MCS. (A) השתקת גנים באמצעות וקטור FoMV ניתן להשיג על ידי החדרת שברי גנים לתוך MCS1 *, המיועד כרצף של עניין (SOI), בדרך כלל בכיוון אנטי חושי. (ב) ביטוי גנים באמצעות וקטור FoMV יכול להתבצע על ידי החדרת ORFs גן לתוך MCS2 בכיוון החוש, המיועד SOI. (ג) וקטור SCMV תוכנן כך שיהיה לו MCS אחד בין P1 ל- HCPro. הווקטור הריק, SCMV-EV, הוא 11,015 bp ואינו מכיל תוספות כלשהן ב- MCS. ג'ין ORFs מוכנס לתוך MCS כי הם במסגרת עם פוליפרוטאין SCMV יבוא לידי ביטוי כחלבונים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
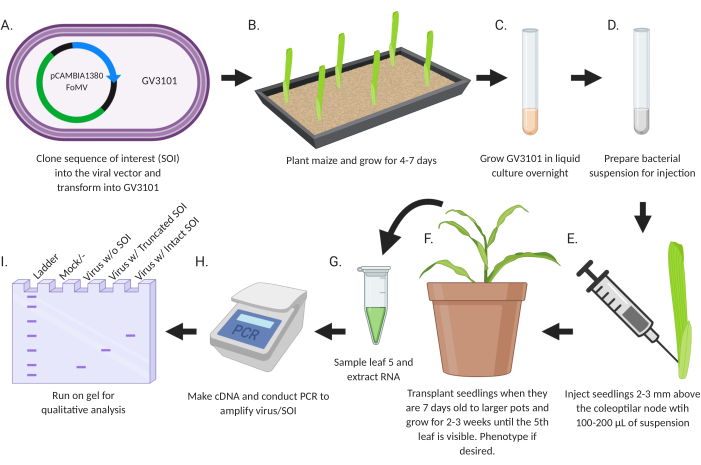
איור 2: סיכום סכמטי של פרוטוקול החקלאות. (A) Clone SOI, CDS או שבר גנים, לווקטור הנגיפי ולהפוך לזן אגרובקטריום GV3101. (ב) צמח תירס ולגדול במשך 4-7 ימים. (ג) לגדל GV3101 בתרבית נוזלית בן לילה ב 28 °C (D) להכין השעיה חיידקית להזרקה. (E) להזריק שתילים 2-3 מ"מ מעל צומת coleoptilar עם 100-200 μL של השעיה. (F) שתילים להשתלה כאשר הם בני 7 ימים לסירים גדולים יותר וגדלים במשך 2-3 שבועות עד שהעלה החמישי נראה לעין. פנוטיפ אם תרצה. (ז) דגימת עלה 5 וחילוץ RNA. (ח) לעשות cDNA ולהנהל PCR כדי להגביר וירוס / SOI. (I) הפעל על ג'ל לניתוח איכותי כדי לקבוע נוכחות / היעדר וירוס SOI חתוך או שלם. דמות זו נוצרה עם BioRender.com. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: שיטת אגרואינג'נט לחיסון שתילים ממש מעל צומת הקולופטיל. (A) צמחים בני 4-5 ימים. הקולופטיל מורחב לחלוטין, והעלה האמיתי הראשון עשוי להיות גלוי חלקית, אך אינו נפרש. (B) צמחים בני 6-7 ימים. הדף הראשון עשוי להיות מורחב אך לא יהיו קולרים גלויים. גם העלה השני יהיה גלוי וייתכן שיתחיל לפרוש בשלב זה. (ג) ביתור של צמחים בני 6-7 ימים המציגים את מיקום הריסטה האפית לירות ביחס לצומת coleoptile. (ד) הזרקת צמחים בני 4-5 ימים. (ה) הזרקת צמחים בני 6-7 ימים. (F) הזרקה של צמחים בני 6-7 ימים באמצעות תמיסת צבע, מראה inoculum צבוע יוצא מן whorl של השתיל. (ז) תקריב של אתר הזרקה של צמחים בני 6-7 ימים ביחס לצומת coleoptile. (ח) תקריב של צמח בן 6-7 ימים לאחר הזרקה, מראה inoculum צבוע ב whorl של הצמח. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: תסמינים של הגנים לבקרת ההשתקה המשמשים בניסויי האגרואינג'קציה. (A) עלה שצולם ב- 17 DPI לאחר שהצמח הוזרק ל- FoMV-LES22. FoMV-LES22 נושאת 329 bp להוסיף של 3 ' CDS של הנגע לחקות 22 תירס גן בכיוון אנטיסנס. ההשתקה גורמת להצטברות של מטבוליט רעיל אשר בתורו גורם נגעים נמקיים המופיעים לראשונה כמו פסים לאורך כלי דם לגדול לתוך כתמים גדולים יותר כפי שמוצג כאן. (ב) עלה שצולם ב 17 DPI לאחר הצמח הוזרק עם FoMV-PDS. FoMV-PDS נושאת 313 זוגות בסיסים של תקליטורי 3 אינץ' של הגן פיטואן דטוראז דורה בכיוון האנטי-מתיחה. השתקת pds בתירס גורמת פנוטיפ פוטו-הלבנה מערכתית שמתחילה כפסים קטנים ודקים לאורך כלי דם הגדלים לפסים ארוכים יותר לאורך העלה כפי שמוצג כאן. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
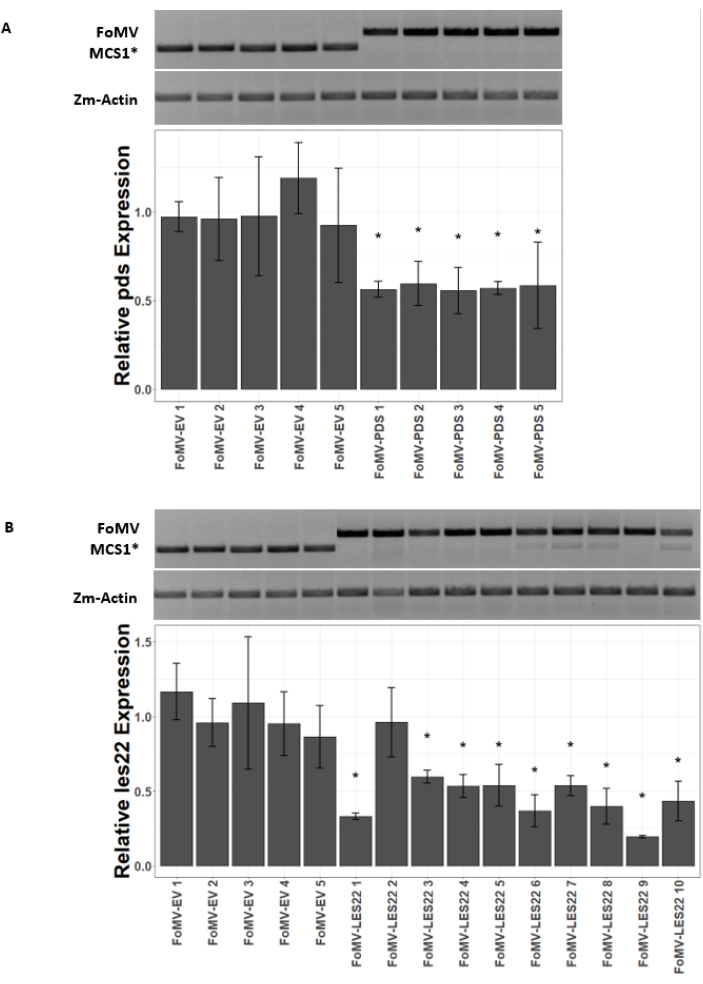
איור 5: qRT-PCR של צמחים המוזרקים למבני השתקת גנים של FoMV. אישור של זיהום FoMV מערכתי והשתקת גנים הנגרמים על ידי מבני FoMV-LES22 ו- FoMV-PDS המועברים באמצעות אגרואינג'קציה בצמחי תירס מתוקים (Golden x Bantam). (A) תמונות הג'ל מראות ניתוחי RT-PCR המאשרים את נוכחותם של FoMV-MCS1* וקטור ריק (315 bp amplicon) ו- FoMV-PDS (625 bp אמפלייקון) בדף 6 מתוך חמישה צמחים בודדים. פריימרים PCR בשימוש לייצר אמפלייקון המשתרע על פני MCS1 *. האמפליקון של גני התירס (Zm-Actin) משמש כגן הייחוס. גרף העמודות מייצג את ערכי הביטוי היחסי qRT-PCR עבור ביטוי PDs בדף 6 ב 37 ימים לאחר החיסון (DPI) על-ידי אגרוינג'קציה עם FoMV-MCS1* או FoMV-PDS. דיכוי של PDs ניתן לזיהוי בכל אחד מחמשת המשכפלים הביולוגיים (p = 0.003; הבדיקה של Post hoc Dunnett; קווי שגיאה מצביעים על סטיית תקן (SD) של שלושה משוכפלים טכניים). (B) תמונות הג'ל מראות ניתוחי RT-PCR המאשרים את נוכחותו של FoMV-MCS1* (315 bp amplicon) בדף 6 מתוך חמישה צמחים בודדים. FoMV-LES22 (625 bp amplicon) זוהה ברקמת עלה 6 (דגימות FoMV-LES22 1-5, 38 DPI) ועלה 4 (דגימות FoMV-LES22 6-10, 20 DPI) עבור עשרה צמחים בודדים. האמפליקון ZM-Actin שימש כגן הייחוס. גרף העמודות מייצג את ערכי הביטוי היחסי qRT-PCR עבור ביטוי les22 ברקמות תירס על-ידי agroinjection של מבנים נגיפיים של FoMV-MCS1* או FoMV-LES22. דיכוי Les22 מתרחש ב-9 מתוך 10 שכפולים ביולוגיים (p=<0.0001; הבדיקה של Post hoc Dunnett; קווי שגיאה מציינים SD עבור שלושה עותקים משוכפלים טכניים). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
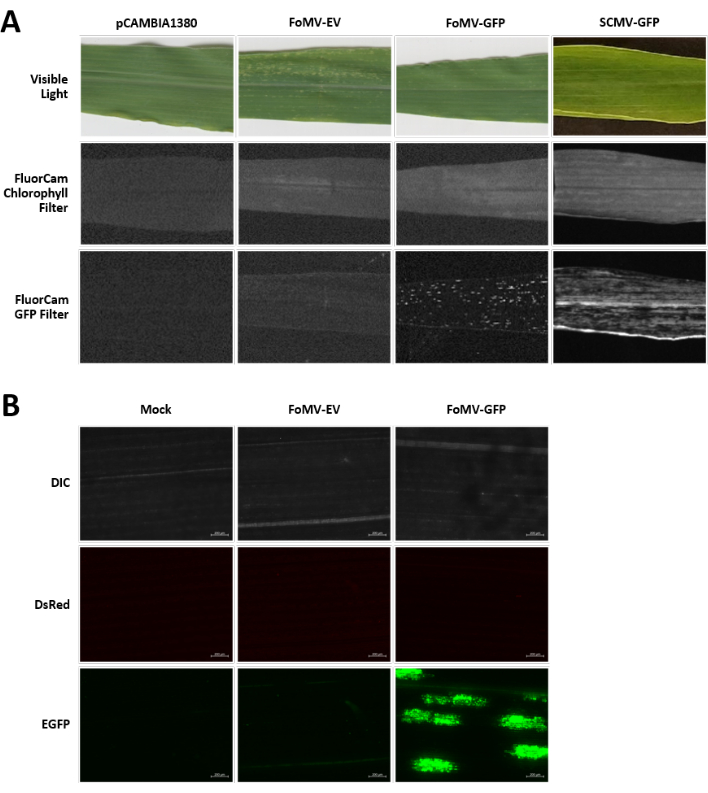
איור 6. פנוטיפים של מבנים שונים המשמשים בניסויי אגרואינג'קציה. כל הצמחים שצולמו הוזרקו כאשר הם היו בני 6-7 ימים עם זן אגרובקטריום GV3101 נושא את המבנים שצוינו. התמונות צולמו ב-16 DPI. (A) תסמיני עלים של pCAMBIA1380 (עמוד שדרה פלסמיד ריק), FoMV-EV, FoMV-GFP ו- SCMV-GFP באור נראה, תחת מסנן הכלורופיל FluorCam בחשיפה של 250 מיקרוגרם, ותחת מסנן ה- GFP FluorCam בחשיפה של 10 אלפיות השנייה. (B) תמונות מיקרוסקופיות פלואורסצנטיות של העלים של מטופלים מדומים (מוזרקים עם פתרון MgSO4 בלבד), FoMV-EV, וצמחים מוזרקים FoMV-GFP. ערוצי DIC, DsRed ו- EGFP מוצגים ונלקחו כל אחד בחשיפה של 1500 אלפיות השנייה. סרגל קנה המידה הוא 200 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 7. השפעות מורפולוגיות של הזרקה. דוגמה להשפעות המורפולוגיות החמורות יותר שיכולות להתרחש מהזרקה ישירה לרקמה מריסטמטית. פציעה זו עלולה לגרום "גריסה" של העלים ופיצול של הגבעול. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| נגיף | תנאי צמיחה | גנוטיפ | צמחים נגועים | סה"כ # של צמחים | % זיהום | אחוז ממוצע של זיהום |
| FoMV-EV | חדר צמיחה | תירס מתוק | 22 | 23 | 96% | 97% |
| B73 | 18 | 18 | 100% | |||
| B104 | 20 | 21 | 95% | |||
| חממה | תירס מתוק | 20 | 23 | 87% | 89% | |
| B73 | 17 | 18 | 94% | |||
| B104 | 16 | 19 | 84% | |||
| SCMV-EV | חדר צמיחה | תירס מתוק | 14 | 21 | 67% | 47% |
| B73 | 5 | 18 | 28% | |||
| B104 | 10 | 21 | 48% | |||
| חממה | תירס מתוק | 14 | 23 | 61% | 49% | |
| B73 | 0 | 19 | 0% | |||
| B104 | 19 | 22 | 86% |
טבלה 1: ההשפעה של תנאי החממה ותא הצמיחה על יעילות החיסון החקלאי. זרעים נבטו בתנאי גדילה זהים. שתילים נבטים היו agroinjected ומחציתם הועברו לתא גדילה (25 °C 16 °C 16 שעות אור יום / 22C 8 שעות בלילה; 185 PAR) ואת החצי השני הועברו לחממה (22-25 °C 16 °C 16 h אור יום / 22-25 °C 8 h לילה; 350-400 PAR). טבלה זו מדווחת על שיעור ההדבקה כאחוז, המחושב ממספר הצמחים שאושרו על ידי RT-PCR להידבק בנגיף המתאים חלקי המספר הכולל של צמחים חקלאיים. אין הבדל סטטיסטי ביעילות הזיהום בין תא גדילה לתנאי חממה (FoMV שני זנב t-test p = 0.08; SCMV שני זנב t-test p = 0.96).
| גנוטיפ תירס | FoMV-EV | FoMV-LES22 | סה"כ משולב | ||||
| נגוע | סך | % נגועים | נגוע | סך | % נגועים | % נגועים | |
| תירס מתוק | 18 | 23 | 78% | 15 | 23 | 65% | 72% |
| MO47 | 7 | 22 | 32% | 1 | 21 | 5% | 19% |
| K55 | 1 | 15 | 7% | 3 | 17 | 18% | 13% |
| W64A | 10 | 22 | 45% | 8 | 20 | 40% | 43% |
| MO17 | 0 | 16 | 0% | 0 | 13 | 0% | 0% |
| B73 | 10 | 18 | 56% | 7 | 17 | 41% | 49% |
| B101 | 12 | 21 | 57% | 8 | 24 | 33% | 44% |
| FR1064 | 4 | 4 | 100% | 4 | 4 | 100% | 100% |
| B104 | 10 | 22 | 45% | 5 | 21 | 24% | 35% |
| WCC22 | 2 | 7 | 29% | 4 | 6 | 67% | 46% |
| A188 | 0 | 3 | 0% | 4 | 6 | 67% | 44% |
טבלה 2: יעילות הזיהום של מבני FoMV על פני גנוטיפים של תירס. FoMV-EV ו- FoMV-LES22 הוכנסו ל-11 גנוטיפים של תירס. לאחר ההזרקה, השתילים הועברו לחממה. טבלה זו מפרטת את קצב ההדבקה כאחוז, המחושב ממספר הצמחים הנגועים ב- FoMV כפי שאושר על ידי RT-PCR חלקי המספר הכולל של צמחים חקלאיים. שיעור ההדבקה הכולל הכולל מראה את שיעורי ההדבקה הממוצעים של כל גנוטיפ עבור שני מבני FoMV שנבדקו.
| שלב הצמח | 4-5 יום צמחים ישנים | צמחים בני 6-7 ימים | סה"כ משולב | ||||
| תסמיני | סה"כ צמחים | % נגועים | תסמיני | סה"כ צמחים | % נגועים | % נגועים | |
| FoMV-EV | 42 | 72 | 58% | 80 | 170 | 47% | 53% (A) |
| FoMV-PDS | 65 | 157 | 41% | 66 | 184 | 36% | 39% (B C) |
| FoMV-LES22 | 115 | 195 | 59% | 144 | 292 | 49% | 54% (A B) |
| FoMV-GFP | 16 | 103 | 16% | 37 | 217 | 17% | 16% (ג) |
| SCMV-GFP | 10 | 95 | 11% | 5 | 82 | 6% | 8% (ג) |
טבלה 3: סיכום ניסויי הזרקה. טבלה זו מייצגת סיכום של ניסויי ההזרקה שנערכו מאוגוסט 2017 עד אוגוסט 2018 על שתילי תירס מתוקים של גולדן באנטם. צמחים הוערכו עבור תסמינים ויראליים (FoMV-EV), תסמיני השתקה (pds ו les22) או GFP פלואורסצנטיות (GFP) באמצעות חזותי (FoMV-EV, FoMV-PDS, ו FoMV-LES22) או פלואורקאם (FoMV-GFP ו SCMV-GFP) הקרנה. התוצאות מוצגות בנפרד עבור צמחים בני 4-5 ימים וצמחים בני 6-7 ימים, כמו גם סיכום על פני כל הגילאים הצמחיים. לא נמצא הבדל משמעותי בין צמחים בני 4-5 ימים לצמחים בני 6-7 ימים (ANOVA חד כיווני, F = 0.6513). נמצא הבדל בין מבנה ויראלי (Onaway ANOVA, F = <0.0001), לבין האותיות המייצגות את דוח המכתבים המחברים של Tukey-Kramer HSD.
טבלה משלימה 1: טבלה המפרטת את כל שמות הפריימרים והרצפים המשמשים בפרוטוקול זה. לחץ כאן כדי להוריד טבלה זו.
טבלה משלימה 2: בדיקת אצטוסירינגון. (A) בדיקת אצטוסירינגון ראשונית, השוואת שיעורים של סימפטומים של מדומה, FoMV-EV, ו FoMV-LES22 מוזרק צמחים בין השעיות חיסון עם 200 μM acetosyringone (+) או ללא אצטוסיבירינגון (-). (B) השוואת שיעורי הזיהום של FoMV-LES22 כפי שנקבע על ידי RT-PCR בין השעיות חיסון ללא אצטוסירינגטון (-), עם 200 μM acetosyringone (+), ותוספת של 20 מיקרומטר של acetosyringone לתרבות החיידקים 4 שעות לפני resuspension בחוצץ יחד עם תוספת של 200 uM acetosyringone להשעיה הסופית (++). בסך הכל, לא נמצא הבדל משמעותי בין טיפולים aceotysyringone (Oneway ANOVA, f = 0.5452). לחץ כאן כדי להוריד טבלה זו.
איור משלים 1: הדמיית פלואורסצנטיות ואימות מולקולרי של SCMV חקלאי וביטוי של חלבונים הטרולוגיים בתירס. תירס היה agroinjected עם מבנה SCMV שונה המכיל הן CDSs של GFP ו ננו לוציפראז (NLuc). (A) הדמיית Fluorcam שימשה להקרנה וזיהוי של GFP. השמאל הוא צמח מוזרק מדומה והימין הוא צמח מוזרק SCMV-NLucGFP. (B) תמציות חלבון עלים הופרדו על ידי SDS-PAGE והוערכו לנוכחות של NLuc, GFP, וחלבון מעיל SCMV (CP) על ידי בדיקת לוציפראז בג'ל או אימונובולוט כפי שצוין. נא לחץ כאן כדי להוריד קובץ זה.
Discussion
אגרובקטריום הוא כלי חיוני המאפשר טכניקות ביולוגיה מולקולרית רבות במחקר הקשור לצמחים. מחקר זה מספק פרוטוקול אגרואינג'קציה לחיסון וקטורים ויראליים FoMV ו- SCMV ישירות לתוך רקמות תירס עבור יישומי VIGS ו- VOX. המטרה העיקרית היא להגדיל את הקלות ואת התועלת של טכנולוגיות מבוססות וירוס למחקר בצמחי גידול מונוקוט. למרות אגרוינוקולציה ישירה של תירס דווח עבור כמה וירוסים, המחברים אינם מודעים לפרוטוקול מפורט, ואין דוגמאות של VIGS ו VOX יישומים במחקרים אלה19,22.
זה דווח, ואושר בעת פיתוח פרוטוקול זה, כי מיקום ההזרקה הוא גורם מפתח עבור בהצלחה השקת זיהום ויראלי מערכתי באמצעות agroinjection19. באופן עקבי הזרקת המיקום המומלץ על הצמח הוא הניח להיות המשתנה הגדול ביותר, כי המיקום המדויק של meristem בשתילי תירס הוא כמעט בלתי ניתן לגילוי על ידי העין. כדי למזער את השונות הבין-אישית, מומלץ לנתח כמה שתילי תירס עד לריסיסטם כדי לדמיין טוב יותר את מיקומו (איור 3C). המיקום של meristem ביחס לצומת coleoptilar צריך להיות בערך זהה עבור צמחים בגילאי 4-7 ימים. בנוסף, תרגול הזרקה עם נוזל צבוע מספק הדגמה גלויה לעין של האופן שבו ה"אינקולום" ממלא את העלה, ומכיוון שאתר ההזרקה מסומן בצבע, ניתן לאשש את הדיוק של אתר ההזרקה (איור 3G, H). רקמות מריסטמטיות הן הרגישות ביותר לאגרואינג'נטציה, אך הזרקת השעיות אגרובקטריום ישירות לרקמה זו גורמת להשפעות מורפולוגיות בלתי רצויות (איור 6)19. צמחים עם מריסטמים פגומים שורדים, אך הפגמים הנובעים מכך אינם רצויים, ולכן יש להימנע מהזרקה ישירה של רקמה זו.
ישנם מספר משתנים שעשויים להשפיע על ההשקה המוצלחת של זיהום ויראלי מערכתי באמצעות אגרואינג'קציה מכיוון ששלוש מערכות ביולוגיות מורכבות (צמח, וירוס וזן אגרובקטריום) חייבות לקיים אינטראקציה בתיאום. יחסי הגומלין המורכבים האלה עשויים להסתייע בתאים המתחלקים במהירות של האזור המריסטמטי, מה שהופך אותו למיקום אידיאלי לאגרוינוקולציה19. זן אגרובקטריום חייב להיות מסוגל להדביק תאים של רקמות הצמח כדי לספק את T-DNA הנושא את הגנום הנגיפי, והצמח חייב להיות רגיש לנגיף על מנת ליזום שכפול ויראלי וזיהום מערכתי. גנוטיפים של תירס שונים ברגישותם לווירוסים (למשל, Mo17 עמיד בפני FoMV) או זני אגרובקטריום, אך נראה כי הרוב שנבדקו רגישים הן ל- FoMV והן ל- SCMV (טבלה 1 ולטבלה 2)53. לדוגמה, הקו המולד FR1064 ומגוון התירס המתוק גולדן באנטם עשויים להיות רגישים במיוחד הן לאגרובקטריום GV3101 והן לווקטורים מבוססי FoMV.
מספר העלה שנדגם ותזמון הדגימה עבור RT-PCR הוא קריטי להערכה מדויקת של זיהום ויראלי. בדוגמאות המוצגות כאן, מספר העלה נקבע על ידי התחלה בעלה המעוגל הראשון (הידוע בכינויו "עלה האגודל") וספירה כלפי מעלה. העלים נדגמו לאחר שהורחבו והעלה הבא החל לצוץ. עם זאת, אילו עלים אופטימליים לדגימה עשויים להשתנות בהתאם למינים של וירוסים המשמשים, תנאי גדילה וגנוטיפ תירס. לכן, ניסוי קורס זמן ראשוני מומלץ בעת החלת פרוטוקול זה על מערכת וירוסים חדשה כדי לייעל את אסטרטגיית הדגימה ביחס לעלים ותזמון.
המבנה הספציפי המשמש משפיע באופן משמעותי על היעילות של פרוטוקול זה. לדוגמה, הווקטורים הריקים, FoMV-EV ו- SCMV-EV, ו- FoMV-PDS ו- FoMV-LES22, אשר שניהם מכילים תוספות קטנות (313 bp ו- 329 bp, בהתאמה), בדרך כלל מייצרים את האחוזים הגבוהים ביותר של צמחים עם תסמינים ויראליים בניסויים אלה (טבלאות 1 וטבלה 2). עם זאת, וירוסים רקומביננטיים הנושאים תוספות גדולות יותר של GFP ORF (720 bp) ב- FoMV-GFP ו- SCMV-GFP, היו בעלי שיעורי זיהום נמוכים בהרבה בהשוואה לצמחים שהוזרקו עם מבני וקטור או השתקת גנים ריקים. מגמה זו עשויה לנבוע מההשפעות השליליות על הכושר הנגיפי הנגרמות על ידי כמויות הולכות וגדלות של חומר גנטי אקסוגני בגנום הנגיפי. מספר מחקרים הראו כי יציבות ההוספה של וקטורים ויראליים צמחיים תלויה במידה רבה בגודל ההוספה וברצף36,54,55,56,57. בנוסף, היה הבדל בולט באחוז הצמחים שנדבקו בעקבות חיסון עם הווקטור הריק FoMV או SCMV, מה שמרמז על עבודה נוספת הדרושה כדי לייעל פרוטוקול זה עבור SCMV (טבלה 1). תוצאות אלה מצביעות על כך שייתכן שיהיה צורך בפתרון בעיות מסוים בעת פיתוח מבנה, מכיוון שהרצף והאורך של הקטע יכולים להשפיע על היעילות.
בסך הכל, מחקר זה הראה כי agroinjection של שתילי תירס היא שיטת חיסון יעילה עבור שני וירוסים שונים צמח RNA, תצורות וקטור מרובות, ו 11 גנוטיפים של תירס. עבודה זו עם FoMV ו- SCMV, בשילוב עם עבודות קודמות תוך ניצול הזרקה עם וירוס מטל כלורוטי תירס (MCMV) או MSV, מצביעה על כך שאגרוינג'נט מתאים לחיסון שתילי תירס עם שיבוטים זיהומיים של נגיפי RNA ו- DNA19,20,20,21,222. בנוסף, עבודה זו מראה עוד יותר agroinjection היא שיטה בת קיימא עבור וקטורים VIGS ו VOX והוא יכול להיות מיושם על צמחים צעירים כמו ארבעה ימים (טבלה 3). הפרוטוקול המוצג כאן צפוי להיות מותאם בקלות על ידי ביולוגים תירס כדי להקל על מחקר במחקרים גנומיים פונקציונליים מעורבים השתקת גנים חולפים (VIGS) ו overexpression (VOX). Agroinjection יש גם את היכולת להקל על גישות עריכת גנים מבוססות וירוסים (VEdGE) שאחרת היו מוגבלות על ידי הסתמכות על טרנספורמציה של צמחים, פוטנציאל שיפור יעילות העריכה, כמו גם נגישות58,59,60. בהתחשב בזן האגרובקטריום המתאים, גנוטיפים של תירס, וקטורים ויראליים משולבים בקפידה, חיסון על ידי אגרואינג'קציה צפוי להפוך לכלי בעל ערך לניתוחי תפקוד גנים ארעיים בתירס.
Disclosures
לחוקרים אין ניגודי עניינים לחשוף.
Acknowledgements
אוניברסיטת איווה סטייט היא חלק מצוות התומך בתוכנית בעלות הברית החרקים של DARPA HR0011-17-2-0053. עבודה זו נתמכה גם על ידי המכון למדעי הצמח של אוניברסיטת איווה, המרכז לביו-הנדסה של אוניברסיטת איווה סטייט, פרויקט NIFA Hatch מספר 3808 של משרד החקלאות האמריקאי, וקרנות מדינת איווה. K.L.H. נתמך באופן חלקי גם על ידי אוניברסיטת איווה המדינה חיזוי צמח פנומיקה בוגר תוכנית הכשרה במימון הקרן הלאומית למדע (DGE #1545453) ועל ידי מענק יוזמה חקלאית ומחקר מזון מס '2019-07318 מהמכון הלאומי למזון וחקלאות של משרד החקלאות. למממנים לא היה כל תפקיד בעיצוב המחקר והאיסוף, הניתוח והפרשנות של הנתונים ובכתיבת כתב היד. כל הדעות, הממצאים והמסקנות או ההמלצות המובעות בחומר זה הן של המחברים ואינן משקפות בהכרח את עמדותיהם של המממנים.
אנו מודים לניק לאוטר (USDA-ARS, איימס, IA) על זרעים של קווים מולדים תירס, כריסטיאן פ מונטס-סארי (אוניברסיטת איווה סטייט) על ביצוע שיבוט FoMV-GFP, וטיילר אוסטין (אוניברסיטת איווה סטייט) על סיוע טכני.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringes | Fisher Scientific | 14955450 | alternatively, BD 309659 |
| 15 mL Falcon Tubes | Corning Science | 352059 | |
| 1kb+ Ladder | ThermoFisher Scientific | 10787018 | For assessing sizes of PCR products |
| 25G x 5/8" PrecisionGlide Needles | Becton, Dickinson and Company (BD) | 305122 | |
| 28°C Incubator | For Agrobacterium | ||
| 37°C Incubator | For E. coli | ||
| Acetosyringone | MilliporeSigma | D134406 | Optional |
| Agar | MilliporeSigma | A4800 | |
| Agarose | GeneMate | E-3120 | For making gels to check for virus/insert stability |
| Agrobacterium tumefaciens Strain GV3101 | Carries vir plasmid encoding T-DNA transfer machinery, RifR, GmR, from lab stock | ||
| Bsu36I | New England Biolabs | R0524 | |
| cDNA Kit | ThermoFisher Scientific | K1672 | Maxima First Strand cDNA Synthesis Kit with Dnase |
| Chloroform | Fisher Scientific | C298 | For RNA extraction |
| Cuvettes | Fisher Scientific | 14955127 | 1.5 mL |
| D-(+)-Glucose | MilliporeSigma | G7528 | Alkaline Lysis |
| DH5alpha Competent E. coli Cells | New England Biolabs | C2987 | |
| DNA Ligase | ThermoFisher Scientific | K1422 | Rapid DNA Ligation Kit |
| EDTA (Ethylenediamine Tetraacetic Acid, Disodium Salt Dihydrate) | Fisher Scientific | S311 | Alkaline Lysis |
| Ethanol | For RNA extraction | ||
| Fertilizer | Peters Fertilizer 15-15-15 Concentrate | ||
| Flat Inserts | T.O. Plastics | 715357C | For germinating seeds in trays |
| Flats | T.O. Plastics | 710245C | For germinating seeds in trays |
| FluorCam | Photon Systems Instruments | To assess maize plants for GFP expression before microscope | |
| Fluorescence Microscope | |||
| Gel Electrophoresis Box | |||
| Gentamycin Sulfate | Fisher Scientific | BP918 | |
| Glacial Acetate | Fisher Scientific | A38 | Alkaline Lysis |
| Glycerol | Fisher Scientific | G33-500 | For saving frozen stocks of bacteria |
| Go-Taq, 2X | Promega | M7123 | |
| Hydrochloric Acid | Fisher Scientific | A144 | for pHing solutions |
| Isopropanol | Sigma-Aldrich | 109827 | For RNA extraction |
| Kanamycin, Monosulfate | Fisher Scientific | BP906 | |
| Large Pots | Kordlok | SQL0550 | 5x5x4" or bigger. For transplanting seedlings. |
| Luria Bertani (LB) Broth, Miller | Himedia | M1245 | |
| Magnesium Sulfate Heptahydrate | Amresco | 662 | |
| Maize Golden Bantam Sweet Corn Seed | American Meadows, West Coast Seeds | ||
| Maize Inbred Seed | Our seed comes from our institution, but we are not able to provide this for other researchers. | ||
| Maxima H Minus Reverse Transcriptase | ThermoFisher Scientific | EP0753 | |
| MilliQ | Elga | Purelab Ultra | |
| Monarch PCR & DNA Cleanup Kit | New England Biolabs | T1030 | |
| PacI | New England Biolabs | R0547 | |
| Peters Excel 15-5-15 Fertilizer | ICL Specialty Fertilizers | G99140 | |
| Petri Dish, 95 mm x 15 mm | Fisher Scientific | FB0875714G | |
| pH Meter | |||
| Potassium Acetate | Fisher Scientific | P171 | Alkaline Lysis |
| Primers | Our primers were synthesized through our institutional DNA facility or through IDT | ||
| PspOMI | New England Biolabs | R0653 | |
| Q5 High-Fidelity DNA Polymerase | New England Biolabs | M0491 | |
| Rifampicin | EMD Millipore Corp | 557303 | |
| Rnase A | ThermoFisher Scientific | 12091021 | Alkaline Lysis |
| SbfI | New England Biolabs | R0642 | |
| Scale | For weighing chemicals for media or buffers | ||
| SDS (Sodium Dodecyl Sulfate) | Fisher Scientific | BP166 | Alkaline Lysis |
| Sodium Hydroxide | Fisher Scientific | S318 | Alkaline Lysis |
| Soil Substrate | SunGro Horticulture | SS#1-F1P | Sunshine Mix #1/Fafard-1P, any soil mix that maize grows well in is sufficient |
| Spectrophotometer | For measuring OD600 | ||
| Sybr Safe, 10,000X | Invitrogen | S33102 | For making gels to check for virus/insert stability |
| Thermocycler | For PCR | ||
| Tris Base | Fisher Scientific | BP154 | Alkaline Lysis |
| Trizol | Ambion | 15596018 | For RNA extraction |
| Weigh Paper | For weighing chemicals for media or buffers | ||
| XbaI | New England Biolabs | R0145 |
References
- Zaidi, S. E. A., Mansoor, S. Viral vectors for plant genome engineering. Frontiers in Plant Science. 8, 539(2017).
- Kant, R., Dasgupta, I. Gene silencing approaches through virus-based vectors: speeding up functional genomics in monocots. Plant Molecular Biology. 100, 3-18 (2019).
- Hu, J., et al. A barley stripe mosaic virus-based guide RNA delivery system for targeted mutagenesis in wheat and maize. Molecular Plant Pathology. 20 (10), 1463-1474 (2019).
- Pasin, F., Menzel, W., Daròs, J. A. Harnessed viruses in the age of metagenomics and synthetic biology: an update on infectious clone assembly and biotechnologies of plant viruses. Plant Biotechnology Journal. 17 (6), 1010-1026 (2019).
- Cody, W. B., Scholthof, H. B. Plant virus vectors 3.0: Transitioning into synthetic genomics. Annual Review of Phytopathology. 57 (1), 211-230 (2019).
- Mei, Y., et al. Protein expression and gene editing in monocots using foxtail mosaic virus vectors. Plant Direct. 3 (11), 00181(2019).
- Ruiz, M. T., Voinnet, O., Baulcombe, D. C. Initiation and maintenance of virus-induced gene silencing. Plant Cell. 10 (6), 937-946 (1998).
- Bekele, D., Tesfaye, K., Fikre, A. Applications of virus induced gene silencing (VIGS) in plant functional genomics studies. Journal of Plant Biochemistry & Physiology. 07 (01), 1000229(2019).
- Scholthof, H. B., Scholthof, K. B. G., Jackson, A. O. Plant virus gene vectors for transient expression of foreign proteins in plants. Annual Review of Phytopathology. 34 (1), 299-323 (1996).
- Holzberg, S., Brosio, P., Gross, C., Pogue, G. P. Barley stripe mosaic virus-induced gene silencing in a monocot plant. Plant Journal. 30 (3), 315-327 (2002).
- Wang, R., et al. An efficient virus-induced gene silencing vector for maize functional genomics research. Plant Journal. 86 (1), 102-115 (2016).
- Redinbaugh, M. G., et al. Transmission of viral RNA and DNA to maize kernels by vascular puncture inoculation. Journal of Virological Methods. 98 (2), 135-143 (2001).
- Scholthof, H. B. The capsid protein gene of tomato bushy stunt virus is dispensable for systemic movement and can be replaced for localized expression of foreign genes. Molecular Plant-Microbe Interactions. 6 (3), 309(1993).
- Scholthof, H. B., Scholthof, K. B. G., Kikkert, M., Jackson, A. O. Tomato bushy stunt virus spread is regulated by two nested genes that function in cell-to-cell movement and host-dependent systemic invasion. Virology. 213 (2), 425-438 (1995).
- Scholthof, H. B. Rapid delivery of foreign genes into plants by direct rub-inoculation with intact plasmid dna of a tomato bushy stunt virus gene vector. Journal of Virology. 73 (9), 7823-7829 (1999).
- Zhang, J., et al. Vacuum and co-cultivation agroinfiltration of (germinated) seeds results in tobacco rattle virus (TRV) mediated whole-plant virus-induced gene silencing (VIGS) in wheat and maize. Frontiers in Plant Science. 8, 393(2017).
- Vaghchhipawala, Z., Rojas, C. M., Senthil-Kumar, M., Mysore, K. S. Agroinoculation and agroinfiltration: simple tools for complex gene function analyses. Methods in Molecular Biology. 678, Clifton, N.J. 65-76 (2011).
- Grimsley, N., Hohn, B., Hohn, T., Walden, R. "Agroinfection," an alternative route for viral infection of plants by using the Ti plasmid. Proceedings of the National Academy of Sciences. 83 (10), 3282-3286 (1986).
- Grimsley, N. H., Ramos, C., Hein, T., Hohn, B. Merisfematic tissues of maize plants are most suscepnsle to agroinfection with maize streak virus. Bio/Technology. 6 (2), 185-189 (1988).
- Martin, D. P., Rybicki, E. P. Improved efficiency of Zea mays agroinoculation with Maize streak virus. Plant Disease. 84 (10), 1096(2000).
- Martin, D. P., Willment, J. A., Rybicki, E. P. Evaluation of maize streak virus pathogenicity in differentially resistant Zea mays genotypes. Phytopathology. 89 (8), 695-700 (1999).
- Wang, Q., et al. Further characterization of Maize chlorotic mottle virus and its synergistic interaction with Sugarcane mosaic virus in maize. Scientific Reports. 7, 39960(2017).
- Hsieh, M. H., et al. Optimizing virus-induced gene silencing efficiency with Cymbidium mosaic virus in Phalaenopsis flower. Plant Science. 201-202 (1), 25-41 (2013).
- Hsieh, M. H., et al. Virus-induced gene silencing unravels multiple transcription factors involved in floral growth and development in Phalaenopsis orchids. Journal of Experimental Botany. 64 (12), 3869-3884 (2013).
- Zenna, N. S., et al. Genetic analysis of tolerance to rice tungro bacilliform virus in rice (Oryza sativa L.) through agroinoculation. Journal of Phytopathology. 154 (4), 197-203 (2006).
- Marks, M. S., Kemp, J. M., Woolston, C. J., Dale, P. J. Agroinfection of wheat: A comparison of Agrobacterium strains. Plant Science. 63 (2), 247-256 (1989).
- Dasgupta, I., et al. Rice tungro bacilliform virus DNA independently infects rice after Agrobacterium-mediated transfer. Journal of General Virology. 72 (6), 1215-1221 (1991).
- Boulton, M. I., Buchholz, W. G., Marks, M. S., Markham, P. G., Davies, J. W. Specificity of Agrobacterium-mediated delivery of maize streak virus DNA to members of the Gramineae. Plant Molecular Biology. 12 (1), 31-40 (1989).
- Paulsen, A. Q. Purification and properties of foxtail mosaic virus. Phytopathology. 77 (11), 1346(1977).
- Bancroft, J. B., Rouleau, M., Johnston, R., Prins, L., Mackie, G. A. The entire nucleotide sequence of foxtail mosaic virus RNA. Journal of General Virology. 72 (9), 2173-2181 (1991).
- Bruun-Rasmussen, M., Madsen, C. T., Johansen, E., Albrechtsen, M. Revised sequence of foxtail mosaic virus reveals a triple gene block structure similar to potato virus X. Archives of Virology. 153 (1), 223-226 (2008).
- Rouleau, M., Bancroft, J. B., Mackie, G. A. Partial purification and characterization of foxtail mosaic potexvirus RNA-dependent RNA polymerase. Virology. 197 (2), 695-703 (1993).
- Rouleau, M., Smith, R. J., Bancroft, J. B., Mackie, G. A. Purification, properties, and subcellular localization of foxtail mosaic potexvirus 26-kDa protein. Virology. 204 (1), 254-265 (1994).
- Samuels, T. D., et al. Subcellular targeting and interactions among the potato virus X TGB proteins. Virology. 367 (2), 375-389 (2007).
- Cho, S. Y., Kim, K. H. Identification of the capsid protein-binding region of the SL1(+) RNA located at the 5' region of the potato virus X genome. Plant Pathology Journal. 28 (1), 75-80 (2012).
- Mei, Y., Zhang, C., Kernodle, B. M., Hill, J. H., Whitham, S. A. A foxtail mosaic virus vector for virus-induced gene silencing in maize. Plant Physiology. 171 (2), 760-772 (2016).
- Bouton, C., et al. Foxtail mosaic virus: A viral vector for protein expression in cereals. Plant Physiology. 177 (4), 1352-1367 (2018).
- Mei, Y., Liu, G., Zhang, C., Hill, J. H., Whitham, S. A. A sugarcane mosaic virus vector for gene expression in maize. Plant Direct. 3 (8), 00158(2019).
- Gal-On, A., Meiri, E., Huet, H., Hua, W. J., Raccah, B., Gaba, V. Particle bombardment drastically increases the infectivity of cloned DNA of zucchini yellow mosaic potyvirus. Journal of General Virology. 76 (12), (1995).
- Gao, R., et al. Construction of an infectious cDNA clone and gene expression vector of Tobacco vein banding mosaic virus (genus Potyvirus). Virus Research. 169 (1), 276-281 (2012).
- López-Moya, J. J., García, J. A. Construction of a stable and highly infectious intron-containing cDNA clone of plum pox potyvirus and its use to infect plants by particle bombardment. Virus Research. 68 (2), (2000).
- Choi, I. R., French, R., Hein, G. L., Stenger, D. C. Fully biologically active in vitro transcripts of the eriophyid mite-transmitted wheat streak mosaic tritimovirus. Phytopathology. 89 (12), (1999).
- Kim, K. S., et al. Infectivity of in vitro transcripts of Johnsongrass mosaic potyvirus full-length cDNA clones in maize and sorghum. Archives of Virology. 148 (3), 563-574 (2003).
- Stewart, L. R., Bouchard, R., Redinbaugh, M. G., Meulia, T. Complete sequence and development of a full-length infectious clone of an Ohio isolate of Maize dwarf mosaic virus (MDMV). Virus Research. 165 (2), 219-224 (2012).
- Wylie, S. J., et al. ICTV virus taxonomy profile: Potyviridae. Journal of General Virology. 98 (3), 352-354 (2017).
- Shukla, D. D. taxonomy of potyviruses infecting maize, sorghum, and sugarcane in Australia and the United States as determined by reactivities of polyclonal antibodies directed towards virus-specific N-termini of coat proteins. Phytopathology. 79 (2), 223(1989).
- Shukla, D. D., Ward, C. W. Amino Acid sequence homology of coat proteins as a basis for identification and classification of the potyvirus group. Journal of General Virology. 69 (11), 2703-2710 (1988).
- Chung, B. Y. W., Miller, W. A., Atkins, J. F., Firth, A. E. An overlapping essential gene in the Potyviridae. Proceedings of the National Academy of Sciences of the United States of America. 105 (15), 5897-5902 (2008).
- Jarchow, E., Grimsley, N. H., Hohn, B. virF, the host-range-determining virulence gene of Agrobacterium tumefaciens, affects T-DNA transfer to Zea mays. Proceedings of the National Academy of Sciences of the United States of America. 88 (23), 10426-10430 (1991).
- Hu, G., Yalpani, N., Briggs, S. P., Johal, G. S. A porphyrin pathway impairment is responsible for the phenotype of a dominant disease lesion mimic mutant of maize. The Plant Cell. 10 (7), 1095(2007).
- Qin, G., et al. Disruption of phytoene desaturase gene results in albino and dwarf phenotypes in Arabidopsis by impairing chlorophyll, carotenoid, and gibberellin biosynthesis. Cell Research. 17 (5), 471-482 (2007).
- Jones, P. Isolation of plasmid DNA from E. coli. Encyclopedia of Life Sciences. , (2003).
- Ji, Q., Yang, B., Lee, M., Chen, Y., Lübberstedt, T. Mapping of quantitative trait loci/locus conferring resistance to foxtail mosaic virus in maize using the intermated B73-×-Mo17 population. Plant Breeding. 129 (6), 721-723 (2010).
- Pacak, A., et al. The brome mosaic virus-based recombination vector triggers a limited gene silencing response depending on the orientation of the inserted sequence. Archives of Virology. 155 (2), 169-179 (2010).
- Miché, L., Battistoni, F., Gemmer, S., Belghazi, M., Reinhold-Hurek, B. Host-dependent expression of Rhizobium leguminosarum bv. viciae hydrogenase is controlled at transcriptional and post-transcriptional levels in legume nodules. Molecular Plant-Microbe Interactions. 19 (5), 1323-1331 (2018).
- Yamagishi, M., Masuta, C., Suzuki, M., Netsu, O. Peanut stunt virus-induced gene silencing in white lupin (lupinus albus). Plant Biotechnology. 32 (3), 181-191 (2015).
- Avesani, L., et al. Stability of Potato virus X expression vectors is related to insert size: Implications for replication models and risk assessment. Transgenic Research. 16 (5), 587-597 (2007).
- Ali, Z., et al. Efficient virus-mediated genome editing in plants using the CRISPR/Cas9 system. Molecular Plant. 8 (8), 1288-1291 (2015).
- Cody, W. B., Scholthof, H. B., Mirkov, T. E. Multiplexed gene editing and protein overexpression using a tobacco mosaic virus viral vector. Plant Physiology. 175 (1), 23-35 (2017).
- Ali, Z., Eid, A., Ali, S., Mahfouz, M. M. Pea early-browning virus-mediated genome editing via the CRISPR/Cas9 system in Nicotiana benthamiana and Arabidopsis. Virus Research. 244, 333-337 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved