Method Article
Agroinoculación directa de plántulas de maíz por inyección con clones infecciosos recombinantes del virus del mosaico de la cola de zorro y virus del mosaico de la caña de azúcar
* Estos autores han contribuido por igual
En este artículo
Resumen
Se presenta un protocolo de inyección (agroinyección) a base de Agrobacterium para la inoculación del virus del mosaico de la cola de zorro y los clones del virus del mosaico de la caña de azúcar en las plántulas de maíz. La inoculación de esta manera conduce a la infección viral, el silenciamiento génico inducido por virus de los genes marcadores y la sobreexpresión viral de GFP.
Resumen
Los enfoques de inoculación basados en agrobacterias se utilizan ampliamente para introducir vectores virales en los tejidos vegetales. Este estudio detalla un protocolo para la inyección de plántulas de maíz cerca del tejido meristemático con Agrobacterium portadora de un vector viral. Se utilizaron clones recombinantes del virus del mosaico de la cola de zorro (FoMV) diseñados para el silenciamiento génico y la expresión génica para optimizar este método, y su uso se amplió para incluir un virus del mosaico de la caña de azúcar recombinante (SCMV) diseñado para la expresión génica. Fragmentos de genes o secuencias codificantes de interés se insertan en un genoma viral infeccioso modificado que ha sido clonado en el vector binario de plásmidos de ADN-T pCAMBIA1380. Las construcciones de plásmidos resultantes se transforman en la cepa GV3101 de Agrobacterium tumefaciens . Las plántulas de maíz de hasta 4 días de edad se pueden inyectar cerca del ganglio coleoptilar con bacterias resuspendidas en solución de MgSO4 . Durante la infección con Agrobacterium, el ADN-T que transporta el genoma viral se transfiere a las células de maíz, lo que permite la transcripción del genoma del ARN viral. A medida que el virus recombinante se replica y se propaga sistémicamente por toda la planta, se pueden observar síntomas virales y cambios fenotípicos resultantes del silenciamiento de la lesión de los genes diana imitación 22 (les22) o fitoeno desaturasa (pds) en las hojas, o la expresión de proteína fluorescente verde (GFP) se puede detectar al iluminar con luz UV o microscopía de fluorescencia. Para detectar el virus y evaluar la integridad del inserto simultáneamente, se extrae ARN de las hojas de la planta inyectada y se realiza RT-PCR utilizando cebadores que flanquean el sitio de clonación múltiple (MCS) que transporta la secuencia insertada. Este protocolo se ha utilizado eficazmente en varios genotipos de maíz y puede ampliarse fácilmente a otros vectores virales, ofreciendo así una herramienta accesible para la introducción de vectores virales en el maíz.
Introducción
Los clones infecciosos de muchos virus de plantas han sido diseñados para el silenciamiento génico inducido por virus (VIGS), la sobreexpresión génica (VOX) y, más recientemente, la edición de genes habilitada para virus (VEdGE)1,2,3,4,5,6,7,8,9,10,11 . A medida que se desarrollan nuevas construcciones virales, también se deben considerar métodos para infectar con éxito los tejidos vegetales con estos virus modificados. Los métodos actuales para iniciar infecciones por virus en las plantas incluyen el bombardeo de partículas, la inoculación por frotamiento de transcripciones de ARN in vitro o clones de ADN, la inoculación por punción vascular o la inoculación de Agrobacterium tumefaciens (agroinoculación)5,12,13,14,15,16,17 . Cada uno de estos métodos de inoculación tiene ventajas y desventajas inherentes, que incluyen el costo, la necesidad de equipo especializado y la viabilidad dentro de un sistema de virus de planta dado. Se prefieren los métodos que utilizan la infiltración o inyección de cepas de Agrobacterium que contienen construcciones binarias de ADN-T diseñadas para administrar virus recombinantes, ya que son simples y económicas. Sin embargo, faltan métodos detallados de agroinoculación para especies monocotiledóneas como Zea mays (maíz).
Uno de los primeros informes de agroinoculación para la administración de virus se publicó en 1986, cuando el genoma del virus del mosaico de la coliflor (CaMV) se insertó en una construcción de ADN-T, y la Agrobacterium resultante que lleva esta construcción fue inoculada por frotamiento en plantas de nabo18. Desde entonces se han desarrollado métodos adicionales para la agroinoculación. Por ejemplo, en el caso del virus del mosaico de la cola de zorro (FoMV), Nicotiana benthamiana se puede utilizar como huésped intermedio para generar partículas de virus en hojas que proporcionan una fuente de inóculo6. La inoculación de maíz con hojas infectadas de N. benthamiana es eficiente, rápida y simple, pero el uso de un huésped intermedio no funciona para todos los virus que infectan el maíz. El virus del mosaico de la caña de azúcar (SCMV), por ejemplo, no puede infectar a N. benthamiana, lo que requiere el uso de fuentes alternativas de inóculo para los vectores derivados de este virus. En 1988, Agrobacterium que contiene el virus de la raya del maíz (MSV), un virus de ADN, se introdujo en las plántulas de maíz por inyección (agroinyección), demostrando que los métodos de inoculación basados en Agrobacterium también son útiles para las monocotiledóneas19. A pesar de este éxito temprano con la agroinyección, se han publicado pocos estudios que utilicen esta técnica en maíz, dejando preguntas abiertas sobre la aplicabilidad de este método para virus RNA y vectores VIGS, VOX y VEdGE20,21,22. Sin embargo, el uso amplio de la agroinyección en especies de monocotiledóneas es prometedor, porque este enfoque general se ha utilizado en orquídeas, arroz y trigo23,24,25,26,27,28.
Este protocolo fue optimizado para FoMV y Agrobacterium cepa GV3101 y también se ha aplicado a un vector SCMV. FoMV es un potexvirus con un amplio rango de hospedadores que incluye 56 especies de monocotiledóneas y dicotiledóneas29. FoMV tiene un genoma de ARN monocatenario de sentido positivo de 6,2 kilobases (kb) que codifica cinco proteínas diferentes a partir de cinco marcos de lectura abiertos (ORF)30,31,32,33,34,35. FoMV se desarrolló previamente en un vector VIGS y VOX para maíz mediante la incorporación de un clon infeccioso en una columna vertebral de plásmido T-DNA6,36,37. El genoma viral se modificó para aplicaciones de VIGS mediante la adición de un sitio de clonación (MCS1*) inmediatamente aguas abajo de la proteína de la capa (CP) (Figura 1A)36. Para las aplicaciones VOX y VEdGE, se duplicó el promotor CP y se agregó un segundo sitio de clonación (MCS2) para permitir la inserción de secuencias de interés entre ORF 4 y el CP (Figura 1B)6. El vector FoMV que contiene mcs1 y MCS2 sin inserciones es el vector vacío FoMV (FoMV-EV) (Figura 1).
El SCMV es un virus no relacionado que se ha desarrollado para VOX en maíz38. Es un miembro de la familia Potyviridae, de la cual varios miembros han sido diseñados para expresar proteínas extrañas en planta39,40,41,42,43,44. El rango de huéspedes de SCMV incluye maíz, sorgo y caña de azúcar45,46, lo que lo hace valioso para estudios funcionales genéticos en estas principales plantas de cultivo36,38. SCMV tiene un sentido positivo, genoma de ARN monocatenario de aproximadamente 10 kb de longitud47,48. Para crear el vector SCMV VOX, se utilizó la bien establecida unión P1/HCPro como sitio de inserción para secuencias heterólogas38. Este sitio de clonación es seguido por la secuencia que codifica un sitio de escisión de la proteasa NIa-Pro, lo que lleva a la producción de proteínas independientes de la poliproteína SCMV (Figura 1C).
Los plásmidos de ADN-T portadores de ADNc infeccioso de estos virus recombinantes se han transformado en la cepa GV3101 de Agrobacterium. GV3101 es una cepa de tipo nopalino, que es bien conocida por ser capaz de transferir T-DNA a especies monocotiledóneas, incluyendo el maíz26,28,49. Adicionalmente, estudios previos de agroinyección han utilizado las cepas C58 o su derivado GV3101, así19,20,22,27.
En el desarrollo de este protocolo se utilizaron tres genes marcadores: dos para el silenciamiento génico y uno para la expresión génica. Se utilizó un fragmento de 329 pares de bases (pb) de la lesión del gen del maíz mimic 22 (les22, GRMZM2G044074) para construir el vector silenciador FoMV-LES22. Cuando les22 se silencia en el maíz, aparecen pequeños parches redondos de células necróticas a lo largo de la vasculatura de las hojas que se expanden y se fusionan en grandes áreas de tejido foliar necrótico50. FoMV-PDS, que contiene un fragmento de 313 pb del gen del sorgo fitoeno desaturasa (pds, LOC110436156, 96% de identidad de secuencia a pds de maíz, GRMZM2G410515), induce el silenciamiento de pds en el maíz, lo que resulta en pequeñas rayas de células fotoblanqueadas a lo largo de la vasculatura de las hojas que se alargan con el tiempo51. La secuencia codificante intacta para la proteína verde fluorescente (GFP) se utilizó para demostrar la expresión de proteínas tanto para FoMV (FoMV-GFP) como para SCMV (SCMV-GFP). La expresión de GFP en las hojas suele ser más detectable a los 14 días después de la inoculación (DPI)6. Aunque se han realizado estudios previos que utilizan la agroinyección de vectores virales en el maíz, estos experimentos solo han demostrado que la agroinyección puede facilitar la infección viral de un clon infeccioso en las plántulas de maíz y no se expanden a virus recombinantes diseñados para aplicaciones VIGS o VOX19,20,21,22. El protocolo aquí presentado se basa en métodos de agroinyección anteriores, particularmente Grismley et al.19. En general, este método de agroinyección es compatible con los vectores VIGS y VOX, no requiere equipo especializado ni huéspedes alternativos como fuentes de inóculo, y disminuye el tiempo y el costo totales necesarios para configurar y realizar inoculaciones en relación con otros métodos comunes que requieren biolística o transcripción in vitro. Este protocolo facilitará los estudios de genómica funcional en maíz con aplicaciones que involucran VIGS, VOX y VEdGE.
Protocolo
1. Construcción de plásmidos
NOTA: Este protocolo se puede aplicar a otros vectores virales o cepas de Agrobacterium , pero esto puede afectar el éxito general de la inoculación por agroinyección. Realice siempre los pasos de inoculación bacteriana y chapado en una campana de flujo laminar.
- Construcción silenciadora de FoMV
NOTA: Los medios Luria-Bertani (LB) (Miller) se utilizan para todos los medios a menos que se especifique lo contrario. El LB líquido se elabora suspendiendo 25 g de gránulos en 1.000 ml de agua destilada y autoclave durante 15 min a 121 °C. El medio LB sólido se fabrica de manera similar con la adición de agar al 1,5% antes del autoclave. Los antibióticos se agregan después de que LB se enfría a ~ 60 ° C, y la solución se vierte en placas de Petri de 95 x 15 mm. Las concentraciones de antibióticos a utilizar son las siguientes: rifampicina (rif) a 25 μg/mL, gentamicina (gent) a 50 μg/mL y kanamicina (kan) a 50 μg/mL.- La PCR amplifica los fragmentos del gen del maíz para ser silenciados (por ejemplo, les22 o pds) utilizando una imprimación hacia adelante con un sitio de restricción PacI y una imprimación inversa con un sitio de restricción XbaI. Esto permitirá la ligadura de los fragmentos de genes en el MCS1* del vector binario FoMV-pCAMBIA1380 en la orientación antisentido.
NOTA: Configure la PCR utilizando una ADN polimerasa de alta fidelidad, cebadores hacia adelante y hacia atrás a 10 μM cada uno, plantilla de ADN plásmido y agua, siguiendo las especificaciones de la ADN polimerasa. Amplificar durante 35 ciclos, utilizando una temperatura de recocido de acuerdo con la ADN polimerasa y la temperatura de fusión de la imprimación (Tm), y una extensión de 30 s por kilobase a amplificar. - Realice la purificación por PCR utilizando un kit de purificación por PCR de acuerdo con las especificaciones del kit.
- Digiera el producto de PCR purificado y el FoMV-EV con las enzimas de restricción XbaI y PacI. Use 1 μg de plásmido o todo el producto de PCR purificado, 2 μL de tampón 10x, 1 μL de enzima de restricción y agregue agua para hacer un volumen de reacción final de 20 μL. Incubar de acuerdo con la especificación de la enzima.
- Ligar el producto de PCR digerido y FoMV-EV junto con la ligasa de ADN T4 de acuerdo con el protocolo del fabricante.
- Transformar el plásmido ligado en células de E. coli DH5α químicamente competentes utilizando el método de choque térmico.
- Descongele las células en hielo y agregue 3 μL de plásmido al tubo. Incubar en hielo durante 30 min, luego choque térmico durante 30 s a 42 °C.
- Colocar en hielo durante 5 min, añadir 200 μL de caldo súper óptimo con represión catabólica (SOC) y dejar que las células de E. coli se recuperen en medios SOC durante 1 h a 37 °C con agitación a 225 rpm.
- Placa en medios LB selectivos de kanamicina e incubar a 37 °C durante la noche.
- Verifique las colonias en busca de clones precisos mediante la secuenciación de Sanger utilizando los cebadores FM-5840F y FM-6138R (Tabla suplementaria 1). Envíe 250 ng de ADN plásmido a una instalación que realizará la secuenciación de Sanger. Para este experimento, las muestras se enviaron a la Instalación Central de ADN de la Universidad Estatal de Iowa.
- Inocular 2 mL de LB líquido con la colonia elegida e incubar a 37 °C durante la noche con agitación a 225 rpm. Extraer ADN plásmido del cultivo nocturno mediante una preparación de ADN plásmido de lisis alcalina52.
- Transformar el ADN plásmido en células GV3101 de la cepa Agrobacterium utilizando el método de congelación-descongelación. Permita que 100 μL de células químicamente competentes se descongelen en el hielo, agregue 1-5 μL de plásmido e incube en hielo durante 30 min. Colocar en nitrógeno líquido durante 1 min, luego incubar a 37 °C durante 3 min. Agregue 1 ml de SOC, deje reposar durante 2-3 h a 28 ° C con agitación, placa en rif, suave y kan medios selectivos LB e incube a 28 ° C durante 2 días.
- Colonias de pantalla para la presencia de inserto con colonia PCR. Elija una sola colonia bacteriana y mézclela en 30 μL de agua. Configure una reacción de PCR agregando 12,5 μL de mezcla maestra de polimerasa, 1,25 μL de cada imprimación de 10 μM, FM-5840F y FM-6138R, 3 μL de la suspensión de colonias bacterianas y agua a un volumen final de 25 μL. Ciclo 35 veces con una temperatura de recocido de 64 °C y un tiempo de extensión de 1 min (1 min por cada kb amplificado).
- Inocular 2-5 mL de LB líquido (rif, gent, kan) con la colonia correcta de Agrobacterium . Deja que crezca durante la noche a 28 °C con agitación a 225 rpm.
- Mezclar el cultivo durante la noche con una solución de glicerol al 50% 1:1. Conservar a -80 °C para su almacenamiento a largo plazo.
- La PCR amplifica los fragmentos del gen del maíz para ser silenciados (por ejemplo, les22 o pds) utilizando una imprimación hacia adelante con un sitio de restricción PacI y una imprimación inversa con un sitio de restricción XbaI. Esto permitirá la ligadura de los fragmentos de genes en el MCS1* del vector binario FoMV-pCAMBIA1380 en la orientación antisentido.
- Construcción de expresión FoMV
- La PCR amplifica la secuencia de codificación de interés, incluidos los codones de inicio y parada (por ejemplo, GFP) como se describe en 1.1.1, agregando un sitio de restricción Bsu36I en el cebador delantero y un sitio de restricción PspOMI en el cebador inverso para permitir la clonación direccional en la orientación sensorial en MCS2.
- Realice la purificación por PCR utilizando un kit de purificación por PCR de acuerdo con las especificaciones del kit.
- Digerir el producto de PCR y el FoMV-EV con las enzimas de restricción Bsu36I y PspOMI, como se describe en 1.1.3.
- Ligar el producto de PCR digerido y FoMV-EV junto con la ligasa de ADN T4 de acuerdo con el protocolo del fabricante.
- Transformar en células de E. coli químicamente competentes DH5α utilizando el método de choque térmico descrito en 1.1.5. Placa en medios LB selectivos de kanamicina e incubar a 37 °C durante la noche.
- Compruebe las colonias en busca de clones precisos mediante secuenciación de Sanger como se describe en 1.1.6 utilizando los cebadores 5AmuS2 y 5AmuA2 (Tabla suplementaria 1).
- Inocular 2 mL de LB líquido con la colonia elegida e incubar a 37 °C durante la noche con agitación a 225 RPM. Extraer ADN plásmido del cultivo nocturno mediante una preparación de ADN plásmido de lisis alcalina52.
- Transformar el ADN plásmido en células químicamente competentes de la cepa GV3101 de Agrobacterium utilizando el método de congelación-descongelación descrito en 1.1.8. Placa en medios LB selectivos rif, gent y kan e incubar a 28 °C durante 2 días.
- Criba de colonias para la presencia de inserto con colonia PCR utilizando los cebadores 5AmuS2 y 5AmuA2.
- Inocular 2-5 mL de LB líquido (rif, gent, kan) con la colonia correcta de Agrobacterium . Agitar durante la noche a 225 rpm a 28 °C.
- Mezclar el cultivo durante la noche con una solución de glicerol al 50% 1:1. Conservar a -80 °C para su almacenamiento a largo plazo.
- Construcción de expresión SCMV
- La PCR amplifica el gen de interés (por ejemplo, GFP) excluyendo el codón de parada como se describe en 1.1.1, incluyendo un sitio de digestión PspOMI en la imprimación delantera y un sitio de digestión SbfI en la imprimación inversa para permitir la clonación direccional en el vector binario SCMV-pCAMBIA1380.
NOTA: El inserto debe ser clonado en marco con la poliproteína viral. - Realice la purificación por PCR utilizando un kit de purificación por PCR de acuerdo con las especificaciones del kit.
- Digerir el producto de PCR y el SCMV-EV con las enzimas de restricción PspOMI y SbfI, como se describe en 1.1.3.
- Ligar el producto de PCR digerido y SCMV-EV junto con la ligasa de ADN T4 de acuerdo con el protocolo del fabricante.
- Transformar el producto en células de E. coli químicamente competentes DH5α utilizando el método de choque térmico descrito en 1.1.5. Placa en medio selectivo lb kan e incubar a 37 °C durante la noche.
- Cribar colonias para clones precisos mediante secuenciación de Sanger como se describe en 1.1.6 utilizando los cebadores SC-745F y HCProR1 (Tabla suplementaria 1).
- Inocular 2 mL de LB líquido con la colonia elegida e incubar a 37 °C durante la noche con agitación a 225 rpm. Extraer el ADN plásmido del cultivo nocturno mediante una preparación de ADN plásmido de lisis alcalina52.
- Transformar el ADN plásmido en células químicamente competentes de la cepa GV3101 de Agrobacterium utilizando el método de congelación-descongelación descrito en 1.1.8. Placa en medios LB selectivos rif, gent y kan e incubar a 28 °C durante 2 días.
- Criba de colonias para detectar presencia de inserto con colonia PCR con los cebadores SC-745F y HCProR1 como se describe en 1.1.9.
- Inocular 2-5 mL de LB líquido (rif, gent, kan) con la colonia correcta de Agrobacterium . Agitar durante la noche a 225 rpm a 28 °C.
- Mezclar el cultivo durante la noche con una solución de glicerol al 50% 1:1. Conservar a -80 °C para su almacenamiento a largo plazo.
- La PCR amplifica el gen de interés (por ejemplo, GFP) excluyendo el codón de parada como se describe en 1.1.1, incluyendo un sitio de digestión PspOMI en la imprimación delantera y un sitio de digestión SbfI en la imprimación inversa para permitir la clonación direccional en el vector binario SCMV-pCAMBIA1380.
2. Preparación de plántulas
- Plante 1-2 semillas de maíz (maíz dulce 'Golden Bantam', FR1064, B73, etc.) en un medio de cultivo a base de turba en pequeños insertos colocados dentro de bandejas 4-7 días antes de la inyección. Colocar en una cámara de crecimiento de menos de 16 días a 25 °C y 8 h noches a 22 °C (~185 radiación fotosintéticamente activa (PAR)) o en un invernadero de menos de 16 h días a 22-25 °C y 8 h noches a 22-25 °C (350-400 PAR).
NOTA: La susceptibilidad a Agrobacterium varía entre los genotipos de maíz, lo que afecta las tasas de éxito. Además, algunos vectores virales pueden ser incompatibles con ciertos genotipos de maíz. - Riegue regularmente y fertilize una vez a la semana con fertilizante líquido 15-5-15 a 330 partes por millón (PPM).
3. Preparación de Agrobacterium
- Un día antes de la inyección, prepare el medio líquido LB con el antibiótico apropiado (rif, gent, kan) e inocule con la cepa Agrobacterium que lleva la construcción viral deseada. Se recomienda agregar 20 μL de caldo de glicerol en 50 ml de LB, lo que debería producir suficiente cultivo bacteriano para inocular >100 plantas y se puede escalar hacia arriba o hacia abajo según sea necesario.
NOTA: Prepare suficiente inóculo para tener una cantidad final de suspensión bacteriana de al menos 1 ml a una densidad óptica de 600 nm (OD600) de 1.0 por cada 4-5 plantas. - Agitar a 225 rpm a 28 °C durante 24 h.
- Bacterias de pellet durante 10 min a 4.000 x g a temperatura ambiente. Deseche el sobrenadante.
- Lave bien el pellet con 1 ml de agua desionizada (DI) mediante pipeteo o vórtice suave.
- Repita el paso 3.3 para granular las bacterias.
- Resuspend el pellet en 1 mL de solución de MgSO4 de 10 mM mediante pipeteo o vórtice suave.
- Opcionalmente, agregue 200 μM de acetosiringona a la solución. Aunque se usa comúnmente, la acetosyringona solo mejora la capacidad de transformación de algunas cepas de Agrobacterium . Los autores no han encontrado que la adición de acetosyringona afecte la eficiencia en este protocolo (Tabla suplementaria 2).
NOTA: La solución de MgSO4 de 10 mM se puede hacer a partir de una solución madre de 1 M con un pH de 6.3 almacenado a temperatura ambiente. Es probable que la solución no requiera un ajuste del pH.
- Opcionalmente, agregue 200 μM de acetosiringona a la solución. Aunque se usa comúnmente, la acetosyringona solo mejora la capacidad de transformación de algunas cepas de Agrobacterium . Los autores no han encontrado que la adición de acetosyringona afecte la eficiencia en este protocolo (Tabla suplementaria 2).
- Mida OD600 de la muestra con un espectrofotómetro y diluya a 1.0 OD600 con 10 mM mgSO4 solución.
NOTA: Este es un punto de parada seguro. La suspensión bacteriana se puede mantener a temperatura ambiente hasta 5 h antes de la inyección.
4. Inyección
NOTA: Las plántulas de maíz de 4-7 días de edad se pueden usar para inyección. La tasa de crecimiento de las plántulas se ve muy afectada por las condiciones de crecimiento, la cantidad de PAR (es decir, un PAR más alto en el invernadero que en la cámara de crecimiento) y el genotipo, entre otras cosas que pueden ser difíciles de controlar en condiciones de invernadero. Las plantas se pueden inyectar tan jóvenes como 4 días de edad cuando miden 2-3 cm de altura sin hojas expandidas y tan viejas como 7 días cuando se expande la hoja de punta redondeada más baja. La tasa de éxito de estos métodos de inoculación disminuye rápidamente a medida que las plantas envejecen más allá de los 7 días posteriores a la siembra. El sitio de inyección es el mismo sin importar la edad de las plántulas.
- Usando gafas de seguridad, inyecte la suspensión bacteriana en las plántulas 2-3 mm por encima del nódulo coleoptilar usando una aguja de 25G x 5/8 "conectada a una jeringa desechable de 1 ml.
NOTA: El nódulo coleoptilar es donde eventualmente se formarán las raíces de la corona. Este es el nodo más bajo de la planta. Por lo general, habrá un cambio de color de verde a blanco en y debajo del nodo. La ubicación de la inyección está justo encima del meristemo. La disección de algunas plántulas en esta etapa puede ayudar a visualizar la ubicación del meristemo y, en consecuencia, el sitio de inyección adecuado. - Aplique una presión suave a la jeringa hasta que la suspensión llene el coleoptilo o sea visible en el verticilo, dependiendo de la etapa de crecimiento de las plantas. Esto es aproximadamente 100-200 μL de suspensión.
NOTA: Si es difícil inyectar la suspensión en la plántula, el sitio de inyección puede ser demasiado bajo. La presión moderada es todo lo que se necesita para inyectar la suspensión. - Inyecte todas las plántulas, cambiando jeringas y agujas para cada construcción.
5. Cuidado continuo de las plantas
- Transplante las plántulas inyectadas a macetas de 13 x 13 x 15 cm o más grandes cuando tengan 7-8 días de edad.
- Mantener las condiciones de crecimiento (fotoperiodo de 16 h y fertilización una vez por semana).
6. Confirmación de infección (Fenotípicamente y RT-PCR)
- Fenotípicamente puntúan a las plantas entre 14-21 DPI. Las lesiones por silenciar los genes de control imitan la lesión 22 o fitoeno desaturasa se pueden ver fácilmente en las hojas y son distintas de los síntomas de FoMV. La expresión de GFP se puede detectar a través de imágenes de microscopio fluorescente u otras imágenes de luz UV.
NOTA: Algunos constructos/vectores virales pueden tardar más en mostrar síntomas o pueden no mostrar ningún síntoma en absoluto. Las condiciones de alta iluminación aumentan en gran medida los fenotipos causados por la lesión silenciadora imitación 22 y fitoeno desaturasa. Las lesiones pueden ser menos visibles o ausentes si las plantas se mantienen en condiciones de luz más bajas, como una cámara de crecimiento, sin embargo, la tasa de infección real determinada por RT-PCR no debe verse afectada (Tabla 1). - Para confirmar la infección molecularmente, muestree la hoja 6 entre 14-21 DPI y extraiga el ARN total utilizando una extracción de fenol-cloroformo de acuerdo con las instrucciones del fabricante.
- Uso del ARN extraído como plantilla para generar ADNc de primera hebra.
- Configure la reacción de ADNc con hasta 5 μg de ARN total, 1 μL de cebadores de hexámeros aleatorios, 1 μL de cebadores de oligo (dT)18 , 1 μL de dNTP, 1 μL de transcriptasa inversa y agua para un volumen final de 14,5 μL.
- Utilizando cebadores diseñados para la construcción viral y el ADNc como plantilla, realice PCR en cada muestra para confirmar la infección viral y determinar la integridad del gen o fragmento de gen de interés como se describe en 1.1.1, excepto reducir los ciclos a 25 para FoMV y 30 para SCMV para evitar falsos positivos.
- Para las construcciones de silenciamiento de FoMV, use cebadores FM-5840F y FM-6138R para amplificar a través del MCS1 *, que contiene el fragmento del gen del maíz. Para las construcciones de expresión de FoMV, use los cebadores 5AmuS2 y 5AmuA2 para amplificar a través del MCS2, que contiene el gen insertado.
- Para las construcciones de expresión de SCMV, use cebadores SC745-F y HCProR1 para amplificar a través del MCS, que contiene el gen insertado (Figura suplementaria 3).
- Para un gen de control endógeno, use cebadores ZmActS y ZmActA, que amplifican un fragmento de ARNm de actina de maíz (GRMZM2G126010) o cebadores ZmUbiF y ZmUbiR, que amplifican un fragmento de ARNm de poliubiquitina de maíz (GRMZM2G409726_T01).
- Visualice el producto de PCR en un gel de agarosa al 1% que contiene una mancha de ácido nucleico para determinar la presencia o ausencia de virus y un gen o fragmento de gen.
Resultados
El objetivo de este estudio fue desarrollar un protocolo simple para introducir directamente virus recombinantes diseñados para el silenciamiento génico o la expresión génica en las plántulas de maíz (Figura 2). Los vectores de virus que transportan insertos se diseñan y clonan utilizando técnicas estándar de biología molecular. Los fragmentos de genes para silenciamiento se insertan en MCS1* en FoMV-EV y las secuencias de codificación para la expresión se insertan en FoMV-EV en MCS2 o SCMV-EV en MCS. Los plásmidos resultantes se transfieren a la cepa GV3101 de Agrobacterium . Posteriormente, las plántulas de maíz se inyectan dentro de una semana o menos después de la siembra. Dos semanas después de la inyección, las plantas pueden ser evaluadas fenotípica y molecularmente para la infección viral, el silenciamiento génico y la expresión génica.
Las plantas de maíz se cultivan en un medio a base de turba durante 4-7 días. En esta etapa, el meristemo apical del brote está justo por encima del nodo coleoptilar (Figura 3A). Después de que el coleoptilo se haya extendido 2-3 centímetros o hasta 7 días después de la siembra, las plantas se inyectan 2-3 mm por encima del nódulo coleoptilar (Figura 3B-F). Aproximadamente a los 12 días después de la inyección, las plantas comenzarán a mostrar fenotipos silenciadores en sus hojas, comúnmente observados cerca del tejido vascular, y estas lesiones son visualmente distintas de los síntomas del mosaico viral de FoMV (Figura 4). Tanto la presencia de FoMV como el silenciamiento de genes diana es detectable en plantas inyectadas (Figura 5). La expresión de GFP se puede detectar 2 semanas después de la inyección bajo un microscopio fluorescente y es más fuerte en las hojas 5-7 (Figura 6). Cuando se observa bajo un sistema de imágenes de fluorescencia, la expresión de GFP de FoMV se puede visualizar como muchas áreas pequeñas y punteadas de fluorescencia distribuidas a través de las hojas cerca del tejido vascular, mientras que la expresión de GFP de SCMV consiste en parches más grandes (Figura 6, Figura suplementaria 1). Aunque los síntomas del mosaico viral a menudo son visibles en las plantas infectadas con construcciones silenciadoras de FoMV, las plantas inyectadas con construcciones de expresión de GFP que expresan con éxito GFP a menudo no tienen estos síntomas. Como resultado, una planta sin síntomas visibles aún puede ser positiva para la expresión del virus y la GFP. Además, se debe evitar la perforación del meristemo durante el procedimiento de agroinyección, ya que esto puede causar defectos morfológicos, pero las plantas resultantes sobreviven y a menudo son sintomáticas (Figura 7).
Aunque este protocolo se desarrolló originalmente utilizando maíz dulce, varias líneas endogámicas de maíz se pueden inocular con éxito con construcciones de silenciamiento de genes FoMV utilizando agroinyección. Por ejemplo, FR1064 y B73 suelen tener altas tasas de infección viral (Tabla 2). En particular, Mo17, una línea con resistencia genética conocida a FoMV, tuvo una eficiencia de infección del 0% como se esperaba36,53. Además, el constructo utilizado influye en la eficiencia de la infección (Tabla 3). En el caso de FoMV, FoMV-EV y FoMV-LES22 suelen tener las eficiencias de infección más altas con un 53% y un 54%, respectivamente. FoMV-PDS tiene una eficiencia ligeramente menor con un 38%, y FoMV-GFP es el más bajo con un 17%. SCMV-GFP tiene una eficiencia de infección del 8%. Estos porcentajes son promedios de varios experimentos; los experimentos individuales pueden tener eficiencias de infección más altas o más bajas.
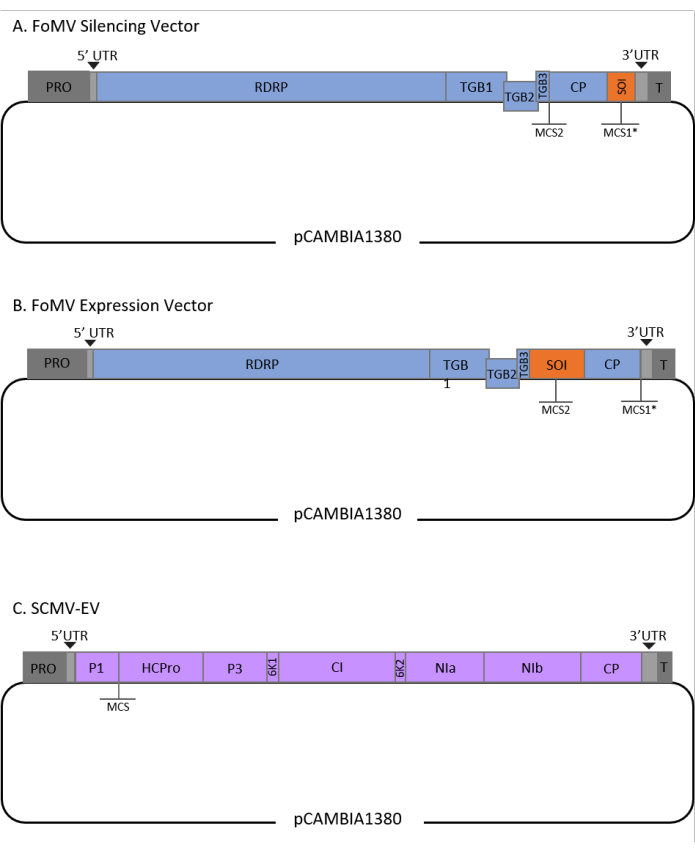
Figura 1: Representaciones esquemáticas de los clones de FoMV y SCMV T-DNA utilizados para la agroinyección en maíz. El vector FoMV contiene dos sitios de clonación múltiples (MCS1* y MCS2). El vector vacío, FoMV-EV, es de 7.269 pb y no contiene ningún inserto en ninguno de los MCS. (A) El silenciamiento génico utilizando el vector FoMV se puede lograr insertando fragmentos de genes en MCS1*, designados como secuencia de interés (SOI), típicamente en la orientación antisentido. (B) La expresión génica utilizando el vector FoMV se puede lograr insertando ORFs de genes en el MCS2 en la orientación de los sentidos, designado como SOI. (C) El vector SCMV fue diseñado para tener un MCS entre P1 y HCPro. El vector vacío, SCMV-EV, es de 11.015 pb y no contiene ningún inserto en el MCS. Los ORF de genes insertados en el MCS que están en marco con la poliproteína SCMV se expresarán como proteínas. Haga clic aquí para ver una versión más grande de esta figura.
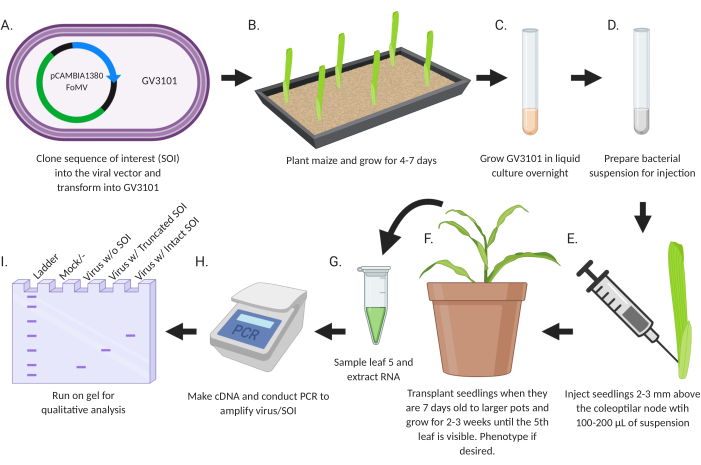
Figura 2: Resumen esquemático del protocolo de agroinyección. (A) Clonar SOI, ya sea un CDS o fragmento de gen, en el vector viral y transformarse en la cepa GV3101 de Agrobacterium . (B) Plantar maíz y crecer durante 4-7 días. (C) Cultivar GV3101 en cultivo líquido durante la noche a 28 °C. (D) Preparar suspensión bacteriana para inyección. (E) Inyectar plántulas 2-3 mm por encima del nódulo coleoptilar con 100-200 μL de suspensión. (F) Trasplantar plántulas cuando tengan 7 días de edad a macetas más grandes y crecer durante 2-3 semanas hasta que la 5ª hoja sea visible. Fenotipo si se desea. (G) Muestre la hoja 5 y extraiga el ARN. (H) Hacer ADNc y realizar PCR para amplificar el virus / SOI. (I) Ejecutar en gel para análisis cualitativo para determinar la presencia / ausencia de virus y una SOI truncada o intacta. Esta figura fue creada con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Método de agroinyección para inocular plántulas justo encima del nodo coleoptilo. (A) Plantas de 4-5 días de edad. El coleoptilo está completamente expandido, y la primera hoja verdadera puede ser parcialmente visible, pero no está desplegada. (B) Plantas de 6-7 días de edad. La primera hoja puede expandirse, pero no se verán collares. La segunda hoja también será visible y puede estar comenzando a desplegarse en esta etapa. (C) Disección de plantas de 6-7 días de edad que muestran la ubicación del meristemo apical del brote en relación con el nodo coleoptilo. (D) Inyección de plantas de 4-5 días de edad. (E) Inyección de plantas de 6-7 días de edad. (F) Inyección de plantas de 6-7 días de edad utilizando una solución de tinte, mostrando inóculo teñido que sale del verticilo de la plántula. (G) Primer plano del sitio de inyección de plantas de 6-7 días de edad en relación con el nodo coleoptilo. (H) Primer plano de una planta de 6-7 días de edad después de la inyección, que muestra un inóculo teñido en el verticilo de la planta. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Síntomas de los genes de control silenciadores utilizados en los experimentos de agroinyección. (A) Una hoja fotografiada a 17 DPI después de que la planta fue inyectada con FoMV-LES22. FoMV-LES22 lleva un inserto de 329 pb del CDS 3' de la lesión imitando el gen 22 del maíz en la orientación antisentido. El silenciamiento da como resultado la acumulación de un metabolito tóxico que a su vez causa las lesiones necróticas que primero aparecen como rayas a lo largo de la vasculatura y crecen en parches más grandes como se muestra aquí. (B) Una hoja fotografiada a 17 DPI después de que la planta fue inyectada con FoMV-PDS. FoMV-PDS lleva un inserto de 313 pares de bases del CDS de 3' del gen de la desaturasa de fitoeno de sorgo en la orientación antisentido. El silenciamiento de pds en el maíz causa un fenotipo de fotoblanqueo sistémico que comienza como rayas pequeñas y delgadas a lo largo de la vasculatura que crecen en rayas más largas a lo largo de la longitud de la hoja como se muestra aquí. Haga clic aquí para ver una versión más grande de esta figura.
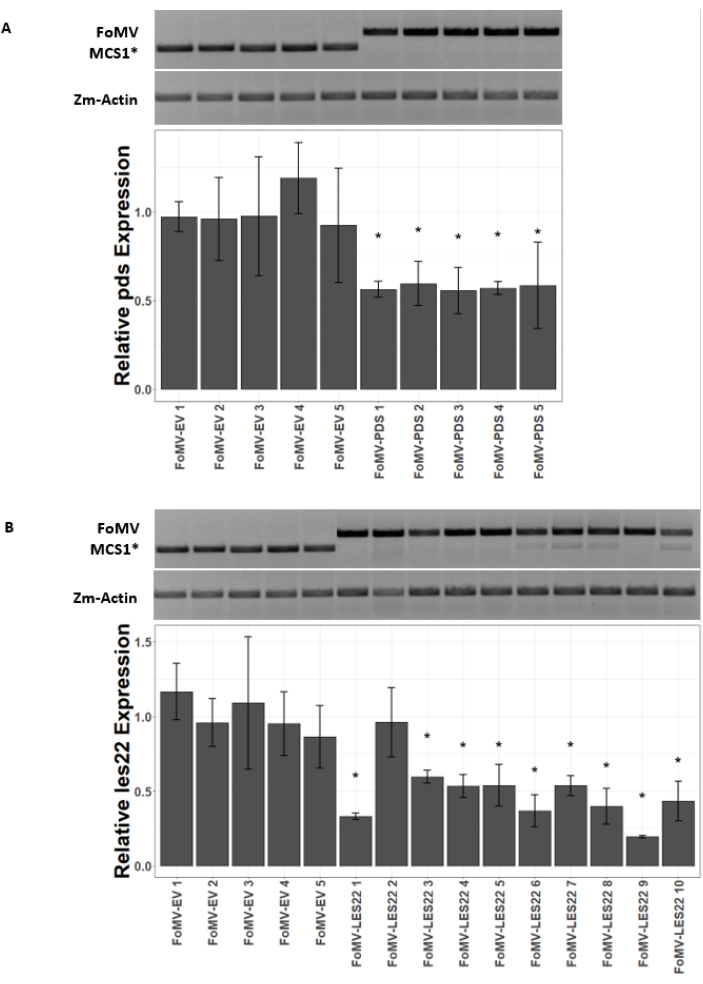
Figura 5: qRT-PCR de plantas inyectadas con construcciones silenciadoras del gen FoMV. Confirmación de la infección sistémica por FoMV y silenciamiento génico inducido por los constructos FoMV-LES22 y FoMV-PDS entregados a través de la agroinyección en plantas de maíz dulce (Golden x Bantam). (A) Las imágenes en gel muestran análisis de RT-PCR que confirman la presencia de vector vacío FoMV-MCS1* (amplicón de 315 pb) y FoMV-PDS (amplicón de 625 pb) en la hoja 6 de cinco plantas individuales. Los cebadores de PCR utilizados producen un amplicón que abarca MCS1*. El amplicón actina del gen del maíz (Zm-Actin) sirve como gen de referencia. El gráfico de barras representa los valores de expresión relativa de qRT-PCR para la expresión de pds en la hoja 6 a los 37 días después de la inoculación (DPI) por agroinyección con FoMV-MCS1* o FoMV-PDS. La supresión de pds es detectable en cada una de las cinco réplicas biológicas (p = 0,003; prueba de Dunnett post hoc; las barras de error indican la desviación estándar (DE) de tres réplicas técnicas). (B) Las imágenes en gel muestran análisis de RT-PCR que confirman la presencia de FoMV-MCS1* (amplicón de 315 pb) en la hoja 6 de cinco plantas individuales. Se detectó FoMV-LES22 (amplicón de 625 pb) en tejido foliar 6 (muestras FoMV-LES22 1-5, 38 DPI) y hoja 4 (muestras FoMV-LES22 6-10, 20 DPI) para diez plantas individuales. El amplicón Zm-Actin sirvió como gen de referencia. El gráfico de barras representa los valores de expresión relativa de qRT-PCR para la expresión de les22 en tejidos de maíz por agroinyección de construcciones virales FoMV-MCS1* o FoMV-LES22. La supresión de Les22 ocurre en 9 de 10 réplicas biológicas (p = <0.0001; prueba de Dunnett post hoc; las barras de error indican SD para tres réplicas técnicas). Haga clic aquí para ver una versión más grande de esta figura.
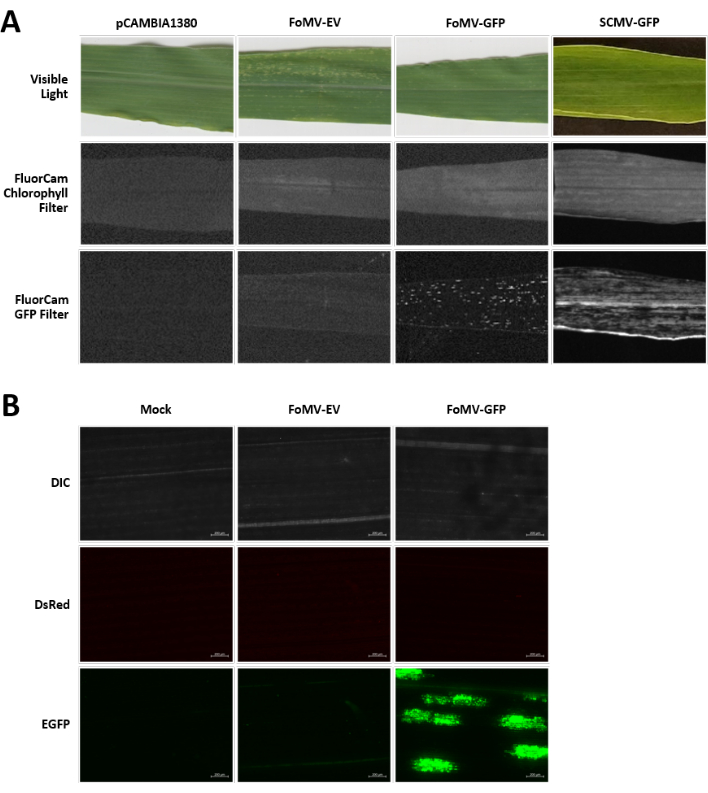
Figura 6. Fenotipos de diversos constructos utilizados en los experimentos de agroinyección. Todas las plantas fotografiadas fueron inyectadas cuando tenían 6-7 días de edad con la cepa GV3101 de Agrobacterium que llevaba las construcciones indicadas. Las imágenes fueron tomadas a 16 DPI. (A) Síntomas foliares de pCAMBIA1380 (columna vertebral de plásmido vacía), FoMV-EV, FoMV-GFP y SCMV-GFP en luz visible, bajo el filtro de clorofila FluorCam a una exposición de 250 μs y bajo el filtro FluorCam GFP a 10 ms de exposición. (B) Imágenes de microscopía fluorescente de las hojas de plantas inyectadas simuladas (inyectadas solo con solución mgSO4), FoMV-EV y FoMV-GFP. Se muestran los canales DIC, DsRed y EGFP y se tomaron cada uno a 1500 ms de exposición. La barra de escala es de 200 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7. Efectos morfológicos de la inyección. Un ejemplo de los efectos morfológicos más severos que pueden ocurrir por la inyección directa en el tejido meristemático. Esta lesión puede resultar en la "trituración" de las hojas y la división del tallo. Haga clic aquí para ver una versión más grande de esta figura.
| Virus | Condiciones de crecimiento | Genotipo | # Plantas infectadas | Número total de plantas | % Infección | % medio de infección |
| FoMV-EV | Cámara de Crecimiento | Maíz dulce | 22 | 23 | 96% | 97% |
| B73 | 18 | 18 | 100% | |||
| B104 | 20 | 21 | 95% | |||
| Invernadero | Maíz dulce | 20 | 23 | 87% | 89% | |
| B73 | 17 | 18 | 94% | |||
| B104 | 16 | 19 | 84% | |||
| SCMV-EV | Cámara de Crecimiento | Maíz dulce | 14 | 21 | 67% | 47% |
| B73 | 5 | 18 | 28% | |||
| B104 | 10 | 21 | 48% | |||
| Invernadero | Maíz dulce | 14 | 23 | 61% | 49% | |
| B73 | 0 | 19 | 0% | |||
| B104 | 19 | 22 | 86% |
Tabla 1: Efecto de las condiciones del invernadero y de la cámara de crecimiento en la eficiencia de la inoculación de agroinyección. Las semillas germinaron en condiciones de crecimiento idénticas. Las plántulas germinadas fueron agroinyectadas y la mitad de ellas se trasladaron a una cámara de crecimiento (25 °C 16 h de luz diurna / 22C 8 h de noche; 185 de PAR) y la otra mitad se trasladó a un invernadero (22-25 °C de 16 h de luz diurna/22-25 °C de 8 h de noche; 350-400 DE PAR). Esta tabla informa la tasa de infección como porcentaje, calculado a partir del número de plantas confirmadas por RT-PCR para estar infectadas con el virus respectivo dividido por el número total de plantas agroinyectadas. No hay diferencias estadísticas en la eficiencia de la infección entre la cámara de crecimiento y las condiciones del invernadero (FoMV prueba t de cola de dos colas p = 0,08; Prueba en T de dos colas de SCMV p=0,96).
| Genotipo del maíz | FoMV-EV | FoMV-LES22 | Total combinado | ||||
| Infectado | Total | % Infectados | Infectado | Total | % Infectados | % Infectados | |
| Maíz dulce | 18 | 23 | 78% | 15 | 23 | 65% | 72% |
| MO47 | 7 | 22 | 32% | 1 | 21 | 5% | 19% |
| K55 | 1 | 15 | 7% | 3 | 17 | 18% | 13% |
| W64A | 10 | 22 | 45% | 8 | 20 | 40% | 43% |
| MO17 | 0 | 16 | 0% | 0 | 13 | 0% | 0% |
| B73 | 10 | 18 | 56% | 7 | 17 | 41% | 49% |
| B101 | 12 | 21 | 57% | 8 | 24 | 33% | 44% |
| FR1064 | 4 | 4 | 100% | 4 | 4 | 100% | 100% |
| B104 | 10 | 22 | 45% | 5 | 21 | 24% | 35% |
| CMI22 | 2 | 7 | 29% | 4 | 6 | 67% | 46% |
| A188 | 0 | 3 | 0% | 4 | 6 | 67% | 44% |
Tabla 2: Eficiencia de infección de los constructos de FoMV en todos los genotipos de maíz. FoMV-EV y FoMV-LES22 fueron agroinyectados en 11 genotipos de maíz. Después de la inyección, las plántulas se trasladaron al invernadero. Esta tabla detalla la tasa de infección como porcentaje, calculada a partir del número de plantas infectadas con FoMV confirmado por RT-PCR dividido por el número total de plantas agroinyectadas. La tasa total combinada de infección muestra las tasas promedio de infección de cada genotipo para ambos constructos de FoMV probados.
| Etapa de la planta | Plantas de 4-5 días de edad | Plantas de 6-7 días de edad | Total combinado | ||||
| Sintomático | Total de Plantas | % Infectados | Sintomático | Total de Plantas | % Infectados | % Infectados | |
| FoMV-EV | 42 | 72 | 58% | 80 | 170 | 47% | 53% (A) |
| FoMV-PDS | 65 | 157 | 41% | 66 | 184 | 36% | 39% (B C) |
| FoMV-LES22 | 115 | 195 | 59% | 144 | 292 | 49% | 54% (A B) |
| FoMV-GFP | 16 | 103 | 16% | 37 | 217 | 17% | 16% (C) |
| SCMV-GFP | 10 | 95 | 11% | 5 | 82 | 6% | 8% (C) |
Tabla 3: Resumen de los experimentos de inyección. Esta tabla representa un resumen de los experimentos de inyección realizados desde agosto de 2017 hasta agosto de 2018 en plántulas de maíz dulce Golden Bantam. Las plantas fueron evaluadas para detectar síntomas virales (FoMV-EV), síntomas de silenciamiento (pds y les22) o fluorescencia GFP (GFP) a través de exámenes visuales (FoMV-EV, FoMV-PDS y FoMV-LES22) o FluorCam (FoMV-GFP y SCMV-GFP). Los resultados se muestran individualmente para plantas de 4-5 días de edad y plantas de 6-7 días de edad, así como un resumen de todas las edades de las plantas. No se encuentran diferencias significativas entre las plantas de 4-5 días de edad y las plantas de 6-7 días de edad (ANOVA unidireccional, F = 0.6513). Hay una diferencia encontrada entre la construcción viral (Onaway ANOVA, F = <0.0001), con las letras que representan el informe de cartas de conexión HSD de Tukey-Kramer.
Tabla suplementaria 1: Tabla que enumera todos los nombres y secuencias de imprimación utilizados en este protocolo. Haga clic aquí para descargar esta tabla.
Tabla suplementaria 2: Prueba de acetosingona. (A) Prueba inicial de acetojerona, que compara las tasas de síntomas de plantas inyectadas simuladas, FoMV-EV y FoMV-LES22 entre suspensiones de inoculación con acetosingona de 200 μM (+) o sin acetosiringona (-). (B) Comparación de las tasas de infección de FoMV-LES22 determinadas por RT-PCR entre suspensiones de inoculación sin acetosyringona (-), con 200 μM de acetosyringona (+), y adición de 20 μM de acetosyringona al cultivo bacteriano 4 horas antes de la resuspensión en tampón junto con la adición de 200 uM de acetosyringona a la suspensión final (++). En general, no se encontraron diferencias significativas entre los tratamientos con aceotisingona (ANOVA unidireccional, f = 0,5452). Haga clic aquí para descargar esta tabla.
Figura suplementaria 1: Imágenes de fluorescencia y validación molecular de SCMV agroinyectado y expresión de proteínas heterólogas en maíz. El maíz fue agroinyectado con una construcción SCMV modificada que contenía tanto CDS de GFP como nano luciferasa (NLuc). (A) Se utilizaron imágenes de fluorcam para la detección y detección de GFP. La izquierda es una planta inyectada simulada y la derecha es una planta inyectada SCMV-NLucGFP. (B) Los extractos de proteína foliar fueron separados por SDS-PAGE y evaluados para detectar la presencia de NLuc, GFP y proteína de recubrimiento SCMV (CP) mediante ensayo de luciferasa en gel o inmunoblot según lo indicado. Haga clic aquí para descargar este archivo.
Discusión
Agrobacterium es una herramienta esencial que facilita numerosas técnicas de biología molecular en la investigación relacionada con las plantas. Este estudio proporciona un protocolo de agroinyección para inocular vectores virales FoMV y SCMV directamente en tejidos de maíz para aplicaciones de VIGS y VOX. El objetivo principal es aumentar la facilidad y la utilidad de las tecnologías basadas en virus para la investigación en plantas de cultivos monocotiledóneos. Aunque se ha reportado agroinoculación directa de maíz para algunos virus, los autores no conocen un protocolo detallado, y no hay ejemplos de aplicaciones de VIGS y VOX en esos estudios19,22.
Se ha informado, y se confirmó durante el desarrollo de este protocolo, que la ubicación de la inyección es un factor clave para lanzar con éxito una infección viral sistémica a través de la agroinyección19. Se supone que inyectar constantemente la ubicación recomendada en la planta es la variable más grande, porque la posición exacta del meristemo en las plántulas de maíz es prácticamente indetectable a simple vista. Para minimizar la variación interpersonal, se recomienda diseccionar algunas plántulas de maíz hasta el meristemo para visualizar mejor su ubicación (Figura 3C). La posición del meristemo en relación con el nódulo coleoptilar debe ser aproximadamente la misma para las plantas de 4 a 7 días de edad. Además, la práctica de la inyección con un líquido teñido proporciona una demostración fácilmente visible de cómo el "inóculo" llena el verticilo de la hoja, y debido a que el sitio de inyección está marcado con tinte, se puede corroborar la precisión del sitio de inyección (Figura 3G, H). Los tejidos meristemáticos son los más susceptibles a la agroinyección, pero la inyección de suspensiones de Agrobacterium directamente en este tejido produce efectos morfológicos indeseables (Figura 6)19. Las plantas con meristemas dañados sobreviven, pero los defectos resultantes son indeseables y, por lo tanto, se debe evitar la inyección directa de este tejido.
Hay varias variables que pueden afectar el lanzamiento exitoso de una infección viral sistémica a través de la agroinyección porque tres sistemas biológicos complejos (planta, virus y cepa de Agrobacterium) deben interactuar en coordinación. Esta compleja interacción puede ser ayudada por las células que se dividen rápidamente de la región meristemática, lo que la convierte en un lugar ideal para la agroinoculación19. La cepa Agrobacterium debe ser capaz de infectar las células de los tejidos vegetales para entregar el ADN-T que lleva el genoma viral, y la planta debe ser susceptible al virus para iniciar la replicación viral y la infección sistémica. Los genotipos de maíz difieren en su susceptibilidad a los virus (por ejemplo, Mo17 es resistente a FoMV) o a las cepas de Agrobacterium, pero la mayoría de las que se probaron parecen ser susceptibles tanto a FoMV como a SCMV (Tabla 1 y Tabla 2)53. Por ejemplo, la línea consanguínea FR1064 y la variedad de maíz dulce Golden Bantam pueden ser particularmente susceptibles tanto a GV3101 Agrobacterium como a vectores basados en FoMV.
El número de hojas muestreadas y el momento del muestreo para RT-PCR es fundamental para una evaluación precisa de la infección viral. En los ejemplos que se muestran aquí, el número de hojas se determinó comenzando en la primera hoja redondeada (comúnmente conocida como la "hoja del pulgar") y contando hacia arriba. Las hojas se muestrearon una vez que se expandieron y la siguiente hoja había comenzado a emerger. Sin embargo, las hojas que son óptimas para el muestreo pueden variar según la especie de virus utilizada, las condiciones de crecimiento y el genotipo del maíz. Por lo tanto, se recomienda un experimento de curso de tiempo inicial al aplicar este protocolo a un nuevo sistema de virus para optimizar la estrategia de muestreo con respecto a las hojas y el tiempo.
El constructo específico utilizado afecta significativamente la eficiencia de este protocolo. Por ejemplo, los vectores vacíos, FoMV-EV y SCMV-EV, y FoMV-PDS y FoMV-LES22, que contienen pequeños insertos (313 pb y 329 pb, respectivamente), suelen producir los porcentajes más altos de plantas con síntomas virales en estos experimentos (Tablas 1 y Tabla 2). Sin embargo, los virus recombinantes portadores de inserciones más grandes del GFP ORF (720 pb) en FoMV-GFP y SCMV-GFP, tuvieron tasas de infección mucho más bajas en comparación con las plantas inyectadas con el vector vacío o construcciones de silenciamiento génico. Esta tendencia puede deberse a los impactos negativos en la aptitud viral causados por el aumento de las cantidades de material genético exógeno en el genoma viral. Varios estudios han demostrado que la estabilidad del inserto de los vectores virales de las plantas depende en gran medida del tamaño y la secuencia del inserto36,54,55,56,57. Además, hubo una diferencia notable en el porcentaje de plantas que se infectaron después de la inoculación con el vector vacío FoMV o SCMV, lo que sugiere que se necesita trabajo adicional para optimizar este protocolo para SCMV (Tabla 1). Estos resultados indican que puede ser necesario solucionar algunos problemas al desarrollar una construcción, ya que la secuencia y la longitud del fragmento pueden afectar la eficiencia.
En general, este estudio ha demostrado que la agroinyección de plántulas de maíz es un método de inoculación eficaz para dos virus de plantas de ARN diferentes, configuraciones de vectores múltiples y 11 genotipos de maíz. Este trabajo con FoMV y SCMV, junto con trabajos previos que utilizan la inyección con el virus moteado clorótico del maíz (MCMV) o MSV, indica que la agroinyección es adecuada para inocular plántulas de maíz con clones infecciosos de virus de ARN y ADN19,20,21,22. Además, este trabajo muestra además que la agroinyección es un método viable para los vectores VIGS y VOX y se puede aplicar a plantas de tan solo cuatro días de edad (Tabla 3). Se espera que el protocolo presentado aquí sea fácilmente adaptado por los biólogos del maíz para facilitar la investigación en estudios de genómica funcional que involucran silenciamiento génico transitorio (VIGS) y sobreexpresión (VOX). La agroinyección también tiene la capacidad de facilitar los enfoques de edición de genes basados en virus (VEdGE) que de otro modo estarían limitados por la dependencia de la transformación de las plantas, lo que podría mejorar la eficiencia de edición y la accesibilidad58,59,60. Dado que la cepa apropiada de Agrobacterium, los genotipos de maíz y los vectores virales se combinan cuidadosamente, se espera que la inoculación por agroinyección se convierta en una herramienta valiosa para los análisis transitorios de la función génica en el maíz.
Divulgaciones
Los investigadores no tienen conflictos de intereses que revelar.
Agradecimientos
La Universidad Estatal de Iowa es parte de un equipo que apoya el programa Insect Allies de DARPA HR0011-17-2-0053. Este trabajo también fue apoyado por el Instituto de Ciencias de Plantas de la Universidad Estatal de Iowa, el Centro de Bioingeniería de Cultivos de la Universidad Estatal de Iowa, el proyecto NIFA Hatch número 3808 del USDA y los Fondos del Estado de Iowa. K.L.H. también fue parcialmente apoyado por el programa de capacitación de posgrado Predictive Plant Phenomics de la Universidad Estatal de Iowa financiado por la Fundación Nacional de Ciencias (DGE # 1545453) y por la subvención de la Iniciativa de Investigación Agrícola y Alimentaria no. 2019-07318 del Instituto Nacional de Alimentos y Agricultura del USDA. Los financiadores no tuvieron ningún papel en el diseño del estudio y la recopilación, análisis e interpretación de los datos y en la redacción del manuscrito. Cualquier opinión, hallazgo y conclusión o recomendación expresada en este material son las de los autores y no reflejan necesariamente los puntos de vista de los financiadores.
Agradecemos a Nick Lauter (USDA-ARS, Ames, IA) por la semilla de líneas endogámicas de maíz, a Christian F. Montes-Serey (Iowa State University) por hacer el clon de FoMV-GFP, y a Tyler Austin (Iowa State University) por la asistencia técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL syringes | Fisher Scientific | 14955450 | alternatively, BD 309659 |
| 15 mL Falcon Tubes | Corning Science | 352059 | |
| 1kb+ Ladder | ThermoFisher Scientific | 10787018 | For assessing sizes of PCR products |
| 25G x 5/8" PrecisionGlide Needles | Becton, Dickinson and Company (BD) | 305122 | |
| 28°C Incubator | For Agrobacterium | ||
| 37°C Incubator | For E. coli | ||
| Acetosyringone | MilliporeSigma | D134406 | Optional |
| Agar | MilliporeSigma | A4800 | |
| Agarose | GeneMate | E-3120 | For making gels to check for virus/insert stability |
| Agrobacterium tumefaciens Strain GV3101 | Carries vir plasmid encoding T-DNA transfer machinery, RifR, GmR, from lab stock | ||
| Bsu36I | New England Biolabs | R0524 | |
| cDNA Kit | ThermoFisher Scientific | K1672 | Maxima First Strand cDNA Synthesis Kit with Dnase |
| Chloroform | Fisher Scientific | C298 | For RNA extraction |
| Cuvettes | Fisher Scientific | 14955127 | 1.5 mL |
| D-(+)-Glucose | MilliporeSigma | G7528 | Alkaline Lysis |
| DH5alpha Competent E. coli Cells | New England Biolabs | C2987 | |
| DNA Ligase | ThermoFisher Scientific | K1422 | Rapid DNA Ligation Kit |
| EDTA (Ethylenediamine Tetraacetic Acid, Disodium Salt Dihydrate) | Fisher Scientific | S311 | Alkaline Lysis |
| Ethanol | For RNA extraction | ||
| Fertilizer | Peters Fertilizer 15-15-15 Concentrate | ||
| Flat Inserts | T.O. Plastics | 715357C | For germinating seeds in trays |
| Flats | T.O. Plastics | 710245C | For germinating seeds in trays |
| FluorCam | Photon Systems Instruments | To assess maize plants for GFP expression before microscope | |
| Fluorescence Microscope | |||
| Gel Electrophoresis Box | |||
| Gentamycin Sulfate | Fisher Scientific | BP918 | |
| Glacial Acetate | Fisher Scientific | A38 | Alkaline Lysis |
| Glycerol | Fisher Scientific | G33-500 | For saving frozen stocks of bacteria |
| Go-Taq, 2X | Promega | M7123 | |
| Hydrochloric Acid | Fisher Scientific | A144 | for pHing solutions |
| Isopropanol | Sigma-Aldrich | 109827 | For RNA extraction |
| Kanamycin, Monosulfate | Fisher Scientific | BP906 | |
| Large Pots | Kordlok | SQL0550 | 5x5x4" or bigger. For transplanting seedlings. |
| Luria Bertani (LB) Broth, Miller | Himedia | M1245 | |
| Magnesium Sulfate Heptahydrate | Amresco | 662 | |
| Maize Golden Bantam Sweet Corn Seed | American Meadows, West Coast Seeds | ||
| Maize Inbred Seed | Our seed comes from our institution, but we are not able to provide this for other researchers. | ||
| Maxima H Minus Reverse Transcriptase | ThermoFisher Scientific | EP0753 | |
| MilliQ | Elga | Purelab Ultra | |
| Monarch PCR & DNA Cleanup Kit | New England Biolabs | T1030 | |
| PacI | New England Biolabs | R0547 | |
| Peters Excel 15-5-15 Fertilizer | ICL Specialty Fertilizers | G99140 | |
| Petri Dish, 95 mm x 15 mm | Fisher Scientific | FB0875714G | |
| pH Meter | |||
| Potassium Acetate | Fisher Scientific | P171 | Alkaline Lysis |
| Primers | Our primers were synthesized through our institutional DNA facility or through IDT | ||
| PspOMI | New England Biolabs | R0653 | |
| Q5 High-Fidelity DNA Polymerase | New England Biolabs | M0491 | |
| Rifampicin | EMD Millipore Corp | 557303 | |
| Rnase A | ThermoFisher Scientific | 12091021 | Alkaline Lysis |
| SbfI | New England Biolabs | R0642 | |
| Scale | For weighing chemicals for media or buffers | ||
| SDS (Sodium Dodecyl Sulfate) | Fisher Scientific | BP166 | Alkaline Lysis |
| Sodium Hydroxide | Fisher Scientific | S318 | Alkaline Lysis |
| Soil Substrate | SunGro Horticulture | SS#1-F1P | Sunshine Mix #1/Fafard-1P, any soil mix that maize grows well in is sufficient |
| Spectrophotometer | For measuring OD600 | ||
| Sybr Safe, 10,000X | Invitrogen | S33102 | For making gels to check for virus/insert stability |
| Thermocycler | For PCR | ||
| Tris Base | Fisher Scientific | BP154 | Alkaline Lysis |
| Trizol | Ambion | 15596018 | For RNA extraction |
| Weigh Paper | For weighing chemicals for media or buffers | ||
| XbaI | New England Biolabs | R0145 |
Referencias
- Zaidi, S. E. A., Mansoor, S. Viral vectors for plant genome engineering. Frontiers in Plant Science. 8, 539(2017).
- Kant, R., Dasgupta, I. Gene silencing approaches through virus-based vectors: speeding up functional genomics in monocots. Plant Molecular Biology. 100, 3-18 (2019).
- Hu, J., et al. A barley stripe mosaic virus-based guide RNA delivery system for targeted mutagenesis in wheat and maize. Molecular Plant Pathology. 20 (10), 1463-1474 (2019).
- Pasin, F., Menzel, W., Daròs, J. A. Harnessed viruses in the age of metagenomics and synthetic biology: an update on infectious clone assembly and biotechnologies of plant viruses. Plant Biotechnology Journal. 17 (6), 1010-1026 (2019).
- Cody, W. B., Scholthof, H. B. Plant virus vectors 3.0: Transitioning into synthetic genomics. Annual Review of Phytopathology. 57 (1), 211-230 (2019).
- Mei, Y., et al. Protein expression and gene editing in monocots using foxtail mosaic virus vectors. Plant Direct. 3 (11), 00181(2019).
- Ruiz, M. T., Voinnet, O., Baulcombe, D. C. Initiation and maintenance of virus-induced gene silencing. Plant Cell. 10 (6), 937-946 (1998).
- Bekele, D., Tesfaye, K., Fikre, A. Applications of virus induced gene silencing (VIGS) in plant functional genomics studies. Journal of Plant Biochemistry & Physiology. 07 (01), 1000229(2019).
- Scholthof, H. B., Scholthof, K. B. G., Jackson, A. O. Plant virus gene vectors for transient expression of foreign proteins in plants. Annual Review of Phytopathology. 34 (1), 299-323 (1996).
- Holzberg, S., Brosio, P., Gross, C., Pogue, G. P. Barley stripe mosaic virus-induced gene silencing in a monocot plant. Plant Journal. 30 (3), 315-327 (2002).
- Wang, R., et al. An efficient virus-induced gene silencing vector for maize functional genomics research. Plant Journal. 86 (1), 102-115 (2016).
- Redinbaugh, M. G., et al. Transmission of viral RNA and DNA to maize kernels by vascular puncture inoculation. Journal of Virological Methods. 98 (2), 135-143 (2001).
- Scholthof, H. B. The capsid protein gene of tomato bushy stunt virus is dispensable for systemic movement and can be replaced for localized expression of foreign genes. Molecular Plant-Microbe Interactions. 6 (3), 309(1993).
- Scholthof, H. B., Scholthof, K. B. G., Kikkert, M., Jackson, A. O. Tomato bushy stunt virus spread is regulated by two nested genes that function in cell-to-cell movement and host-dependent systemic invasion. Virology. 213 (2), 425-438 (1995).
- Scholthof, H. B. Rapid delivery of foreign genes into plants by direct rub-inoculation with intact plasmid dna of a tomato bushy stunt virus gene vector. Journal of Virology. 73 (9), 7823-7829 (1999).
- Zhang, J., et al. Vacuum and co-cultivation agroinfiltration of (germinated) seeds results in tobacco rattle virus (TRV) mediated whole-plant virus-induced gene silencing (VIGS) in wheat and maize. Frontiers in Plant Science. 8, 393(2017).
- Vaghchhipawala, Z., Rojas, C. M., Senthil-Kumar, M., Mysore, K. S. Agroinoculation and agroinfiltration: simple tools for complex gene function analyses. Methods in Molecular Biology. 678, Clifton, N.J. 65-76 (2011).
- Grimsley, N., Hohn, B., Hohn, T., Walden, R. "Agroinfection," an alternative route for viral infection of plants by using the Ti plasmid. Proceedings of the National Academy of Sciences. 83 (10), 3282-3286 (1986).
- Grimsley, N. H., Ramos, C., Hein, T., Hohn, B. Merisfematic tissues of maize plants are most suscepnsle to agroinfection with maize streak virus. Bio/Technology. 6 (2), 185-189 (1988).
- Martin, D. P., Rybicki, E. P. Improved efficiency of Zea mays agroinoculation with Maize streak virus. Plant Disease. 84 (10), 1096(2000).
- Martin, D. P., Willment, J. A., Rybicki, E. P. Evaluation of maize streak virus pathogenicity in differentially resistant Zea mays genotypes. Phytopathology. 89 (8), 695-700 (1999).
- Wang, Q., et al. Further characterization of Maize chlorotic mottle virus and its synergistic interaction with Sugarcane mosaic virus in maize. Scientific Reports. 7, 39960(2017).
- Hsieh, M. H., et al. Optimizing virus-induced gene silencing efficiency with Cymbidium mosaic virus in Phalaenopsis flower. Plant Science. 201-202 (1), 25-41 (2013).
- Hsieh, M. H., et al. Virus-induced gene silencing unravels multiple transcription factors involved in floral growth and development in Phalaenopsis orchids. Journal of Experimental Botany. 64 (12), 3869-3884 (2013).
- Zenna, N. S., et al. Genetic analysis of tolerance to rice tungro bacilliform virus in rice (Oryza sativa L.) through agroinoculation. Journal of Phytopathology. 154 (4), 197-203 (2006).
- Marks, M. S., Kemp, J. M., Woolston, C. J., Dale, P. J. Agroinfection of wheat: A comparison of Agrobacterium strains. Plant Science. 63 (2), 247-256 (1989).
- Dasgupta, I., et al. Rice tungro bacilliform virus DNA independently infects rice after Agrobacterium-mediated transfer. Journal of General Virology. 72 (6), 1215-1221 (1991).
- Boulton, M. I., Buchholz, W. G., Marks, M. S., Markham, P. G., Davies, J. W. Specificity of Agrobacterium-mediated delivery of maize streak virus DNA to members of the Gramineae. Plant Molecular Biology. 12 (1), 31-40 (1989).
- Paulsen, A. Q. Purification and properties of foxtail mosaic virus. Phytopathology. 77 (11), 1346(1977).
- Bancroft, J. B., Rouleau, M., Johnston, R., Prins, L., Mackie, G. A. The entire nucleotide sequence of foxtail mosaic virus RNA. Journal of General Virology. 72 (9), 2173-2181 (1991).
- Bruun-Rasmussen, M., Madsen, C. T., Johansen, E., Albrechtsen, M. Revised sequence of foxtail mosaic virus reveals a triple gene block structure similar to potato virus X. Archives of Virology. 153 (1), 223-226 (2008).
- Rouleau, M., Bancroft, J. B., Mackie, G. A. Partial purification and characterization of foxtail mosaic potexvirus RNA-dependent RNA polymerase. Virology. 197 (2), 695-703 (1993).
- Rouleau, M., Smith, R. J., Bancroft, J. B., Mackie, G. A. Purification, properties, and subcellular localization of foxtail mosaic potexvirus 26-kDa protein. Virology. 204 (1), 254-265 (1994).
- Samuels, T. D., et al. Subcellular targeting and interactions among the potato virus X TGB proteins. Virology. 367 (2), 375-389 (2007).
- Cho, S. Y., Kim, K. H. Identification of the capsid protein-binding region of the SL1(+) RNA located at the 5' region of the potato virus X genome. Plant Pathology Journal. 28 (1), 75-80 (2012).
- Mei, Y., Zhang, C., Kernodle, B. M., Hill, J. H., Whitham, S. A. A foxtail mosaic virus vector for virus-induced gene silencing in maize. Plant Physiology. 171 (2), 760-772 (2016).
- Bouton, C., et al. Foxtail mosaic virus: A viral vector for protein expression in cereals. Plant Physiology. 177 (4), 1352-1367 (2018).
- Mei, Y., Liu, G., Zhang, C., Hill, J. H., Whitham, S. A. A sugarcane mosaic virus vector for gene expression in maize. Plant Direct. 3 (8), 00158(2019).
- Gal-On, A., Meiri, E., Huet, H., Hua, W. J., Raccah, B., Gaba, V. Particle bombardment drastically increases the infectivity of cloned DNA of zucchini yellow mosaic potyvirus. Journal of General Virology. 76 (12), (1995).
- Gao, R., et al. Construction of an infectious cDNA clone and gene expression vector of Tobacco vein banding mosaic virus (genus Potyvirus). Virus Research. 169 (1), 276-281 (2012).
- López-Moya, J. J., García, J. A. Construction of a stable and highly infectious intron-containing cDNA clone of plum pox potyvirus and its use to infect plants by particle bombardment. Virus Research. 68 (2), (2000).
- Choi, I. R., French, R., Hein, G. L., Stenger, D. C. Fully biologically active in vitro transcripts of the eriophyid mite-transmitted wheat streak mosaic tritimovirus. Phytopathology. 89 (12), (1999).
- Kim, K. S., et al. Infectivity of in vitro transcripts of Johnsongrass mosaic potyvirus full-length cDNA clones in maize and sorghum. Archives of Virology. 148 (3), 563-574 (2003).
- Stewart, L. R., Bouchard, R., Redinbaugh, M. G., Meulia, T. Complete sequence and development of a full-length infectious clone of an Ohio isolate of Maize dwarf mosaic virus (MDMV). Virus Research. 165 (2), 219-224 (2012).
- Wylie, S. J., et al. ICTV virus taxonomy profile: Potyviridae. Journal of General Virology. 98 (3), 352-354 (2017).
- Shukla, D. D. taxonomy of potyviruses infecting maize, sorghum, and sugarcane in Australia and the United States as determined by reactivities of polyclonal antibodies directed towards virus-specific N-termini of coat proteins. Phytopathology. 79 (2), 223(1989).
- Shukla, D. D., Ward, C. W. Amino Acid sequence homology of coat proteins as a basis for identification and classification of the potyvirus group. Journal of General Virology. 69 (11), 2703-2710 (1988).
- Chung, B. Y. W., Miller, W. A., Atkins, J. F., Firth, A. E. An overlapping essential gene in the Potyviridae. Proceedings of the National Academy of Sciences of the United States of America. 105 (15), 5897-5902 (2008).
- Jarchow, E., Grimsley, N. H., Hohn, B. virF, the host-range-determining virulence gene of Agrobacterium tumefaciens, affects T-DNA transfer to Zea mays. Proceedings of the National Academy of Sciences of the United States of America. 88 (23), 10426-10430 (1991).
- Hu, G., Yalpani, N., Briggs, S. P., Johal, G. S. A porphyrin pathway impairment is responsible for the phenotype of a dominant disease lesion mimic mutant of maize. The Plant Cell. 10 (7), 1095(2007).
- Qin, G., et al. Disruption of phytoene desaturase gene results in albino and dwarf phenotypes in Arabidopsis by impairing chlorophyll, carotenoid, and gibberellin biosynthesis. Cell Research. 17 (5), 471-482 (2007).
- Jones, P. Isolation of plasmid DNA from E. coli. Encyclopedia of Life Sciences. , (2003).
- Ji, Q., Yang, B., Lee, M., Chen, Y., Lübberstedt, T. Mapping of quantitative trait loci/locus conferring resistance to foxtail mosaic virus in maize using the intermated B73-×-Mo17 population. Plant Breeding. 129 (6), 721-723 (2010).
- Pacak, A., et al. The brome mosaic virus-based recombination vector triggers a limited gene silencing response depending on the orientation of the inserted sequence. Archives of Virology. 155 (2), 169-179 (2010).
- Miché, L., Battistoni, F., Gemmer, S., Belghazi, M., Reinhold-Hurek, B. Host-dependent expression of Rhizobium leguminosarum bv. viciae hydrogenase is controlled at transcriptional and post-transcriptional levels in legume nodules. Molecular Plant-Microbe Interactions. 19 (5), 1323-1331 (2018).
- Yamagishi, M., Masuta, C., Suzuki, M., Netsu, O. Peanut stunt virus-induced gene silencing in white lupin (lupinus albus). Plant Biotechnology. 32 (3), 181-191 (2015).
- Avesani, L., et al. Stability of Potato virus X expression vectors is related to insert size: Implications for replication models and risk assessment. Transgenic Research. 16 (5), 587-597 (2007).
- Ali, Z., et al. Efficient virus-mediated genome editing in plants using the CRISPR/Cas9 system. Molecular Plant. 8 (8), 1288-1291 (2015).
- Cody, W. B., Scholthof, H. B., Mirkov, T. E. Multiplexed gene editing and protein overexpression using a tobacco mosaic virus viral vector. Plant Physiology. 175 (1), 23-35 (2017).
- Ali, Z., Eid, A., Ali, S., Mahfouz, M. M. Pea early-browning virus-mediated genome editing via the CRISPR/Cas9 system in Nicotiana benthamiana and Arabidopsis. Virus Research. 244, 333-337 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados