Method Article
Agroinoculation directe de plants de maïs par injection avec le virus recombinant de la mosaïque de la queue de renard et le virus de la mosaïque de la canne à sucre Clones infectieux
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Un protocole d’injection (agroinjection) à base d’Agrobacterium est présenté pour l’inoculation du virus de la mosaïque de la queue de renard et du virus de la mosaïque de la canne à sucre dans les semis de maïs. L’inoculation de cette manière conduit à une infection virale, à un silençage génique induit par le virus des gènes marqueurs et à une surexpression virale de GFP.
Résumé
Les approches d’inoculation basées sur Agrobacterium sont largement utilisées pour introduire des vecteurs viraux dans les tissus végétaux. Cette étude détaille un protocole pour l’injection de plants de maïs près du tissu méristématique avec Agrobacterium portant un vecteur viral. Des clones recombinants du virus de la mosaïque de la queue de renard (FoMV) conçus pour le silençage et l’expression des gènes ont été utilisés pour optimiser cette méthode, et son utilisation a été étendue pour inclure un virus de la mosaïque de la canne à sucre recombinant (SCMV) conçu pour l’expression des gènes. Des fragments de gènes ou des séquences codantes d’intérêt sont insérés dans un génome viral infectieux modifié qui a été cloné dans le vecteur plasmidique binaire de l’ADN-T pCAMBIA1380. Les constructions plasmidiques résultantes sont transformées en souche GV3101 d’Agrobacterium tumefaciens. Les plants de maïs âgés de 4 jours peuvent être injectés près du nœud coléoptiaire avec des bactéries remises en suspension dans une solution de MgSO4. Lors de l’infection par Agrobacterium, l’ADN-T porteur du génome viral est transféré aux cellules de maïs, ce qui permet la transcription du génome de l’ARN viral. Au fur et à mesure que le virus recombinant se réplique et se propage systématiquement dans toute la plante, des symptômes viraux et des changements phénotypiques résultant du silence de la lésion des gènes cibles imitant 22 (les22) ou phytoène désaturase (pds) peuvent être observés sur les feuilles, ou l’expression de la protéine fluorescente verte (GFP) peut être détectée lors de l’éclairage avec la lumière UV ou la microscopie à fluorescence. Pour détecter le virus et évaluer simultanément l’intégrité de l’insert, l’ARN est extrait des feuilles de la plante injectée et la RT-PCR est réalisée à l’aide d’amorces flanquant le site de clonage multiple (MCS) portant la séquence insérée. Ce protocole a été utilisé efficacement dans plusieurs génotypes de maïs et peut facilement être étendu à d’autres vecteurs viraux, offrant ainsi un outil accessible pour l’introduction de vecteurs viraux dans le maïs.
Introduction
Des clones infectieux de nombreux virus végétaux ont été conçus pour le silençage génique induit par le virus (VIGS), la surexpression génique (VOX) et, plus récemment, l’édition de gènes activée par le virus (VEdGE)1,2,3,4,5,6,7,8,9,10,11 . Au fur et à mesure que de nouvelles constructions virales sont développées, des méthodes pour infecter avec succès les tissus végétaux avec ces virus modifiés doivent également être envisagées. Les méthodes actuelles pour lancer des infections virales dans les plantes comprennent le bombardement de particules, l’inoculation par frottement de transcriptions d’ARN in vitro ou de clones d’ADN, l’inoculation par ponction vasculaire ou l’inoculation d’Agrobacterium tumefaciens (agroinoculation)5,12,13,14,15,16,17 . Chacune de ces méthodes d’inoculation présente des avantages et des inconvénients inhérents, notamment le coût, le besoin d’équipement spécialisé et la faisabilité au sein d’un système végétal-virus donné. Les méthodes qui utilisent l’infiltration ou l’injection de souches d’Agrobacterium contenant des constructions binaires d’ADN-T conçues pour délivrer des virus recombinants sont préférées, car elles sont simples et peu coûteuses. Cependant, les méthodes d’agroinoculation détaillées pour les espèces monocotylédones telles que Zea mays (maïs) font défaut.
L’un des premiers rapports d’agroinoculation pour l’administration du virus a été publié en 1986, lorsque le génome du virus de la mosaïque du chou-fleur (CaMV) a été inséré dans une construction d’ADN-T, et l’Agrobacterium résultant portant cette construction a été inoculé par frottement sur des plants de navet18. D’autres méthodes d’agroinoculation ont depuis été développées. Par exemple, dans le cas du virus de la mosaïque de la queue de renard (FoMV), Nicotiana benthamiana peut être utilisé comme hôte intermédiaire pour générer des particules virales dans les feuilles qui fournissent une source d’inoculum6. L’inoculation par frottement du maïs à l’aide de feuilles infectées de N. benthamiana est efficace, rapide et simple, mais l’utilisation d’un hôte intermédiaire ne fonctionne pas pour tous les virus infectant le maïs. Le virus de la mosaïque de la canne à sucre (SCMV), par exemple, ne peut pas infecter N. benthamiana, ce qui nécessite l’utilisation d’autres sources d’inoculum pour les vecteurs dérivés de ce virus. En 1988, Agrobacterium contenant le virus de la striure du maïs (MSV), un virus à ADN, a été introduit dans les plants de maïs par injection (agroinjection), démontrant que les méthodes d’inoculation à base d’Agrobacterium sont également utiles pour les monocotylédones19. Malgré ce succès précoce avec l’agro-injection, peu d’études utilisant cette technique dans le maïs ont été publiées, laissant des questions ouvertes sur l’applicabilité de cette méthode pour les virus à ARN et les vecteurs VIGS, VOX et VEdGE20,21,22. Cependant, une large utilisation de l’agroinjection chez les espèces monocotylédones est prometteuse, car cette approche générale a été utilisée dans les orchidées, le riz et le blé23,24,25,26,27,28.
Ce protocole a été optimisé pour la souche FoMV et Agrobacterium GV3101 et a également été appliqué à un vecteur SCMV. FoMV est un potexvirus avec une large gamme d’hôtes qui comprend 56 espèces de monocotylédones et de dicotylédones29. FoMV a un génome d’ARN simple brin à sens positif de 6,2 kilobases (kb) qui code cinq protéines différentes à partir de cinq cadres de lecture ouverts (ORF)30,31,32,33,34,35. FoMV a déjà été développé en un vecteur VIGS et VOX pour le maïs en incorporant un clone infectieux sur un squelette plasmidique d’ADN-T6,36,37. Le génome viral a été modifié pour les applications VIGS en ajoutant un site de clonage (MCS1*) immédiatement en aval de la protéine de pelage (CP) (Figure 1A)36. Pour les applications VOX et VEdGE, le promoteur CP a été dupliqué et un deuxième site de clonage (MCS2) a été ajouté pour permettre l’insertion de séquences d’intérêt entre ORF 4 et le CP (Figure 1B)6. Le vecteur FoMV contenant à la fois MCS1 et MCS2 sans inserts est le vecteur vide FoMV (FoMV-EV) (Figure 1).
ScMV est un virus non apparenté qui a été développé pour VOX dans le maïs38. C’est un membre de la famille des Potyviridae, dont plusieurs membres ont été conçus pour exprimer des protéines étrangères dans planta39,40,41,42,43,44. La gamme d’hôtes du SCMV comprend le maïs, le sorgho et la canne à sucre45,46, ce qui le rend précieux pour les études fonctionnelles des gènes dans ces principales plantes cultivées36,38. ScMV a un sens positif, génome d’ARN simple brin d’environ 10 kb de longueur47,48. Pour créer le vecteur VOX SCMV, la jonction P1/HCPro bien établie a été utilisée comme site d’insertion pour les séquences hétérologues38. Ce site de clonage est suivi d’un codage séquentiel d’un site de clivage de la protéase NIa-Pro, conduisant à la production de protéines indépendantes de la polyprotéine SCMV (Figure 1C).
Les plasmides d’ADN-T porteurs de l’ADNc infectieux de ces virus recombinants ont été transformés en souche Agrobacterium GV3101. GV3101 est une souche de type nopaline, qui est bien connue pour être capable de transférer l’ADN-T à des espèces monocotylédones, y compris le maïs26,28,49. De plus, des études d’agroinjection antérieures ont utilisé les souches C58 ou son dérivé GV3101, ainsi que 19,20,22,27.
Trois gènes marqueurs ont été utilisés dans le développement de ce protocole : deux pour le silençage génique et un pour l’expression génique. Un fragment de 329 paires de bases (pb) de la lésion du gène du maïs imitant 22 (les22, GRMZM2G044074) a été utilisé pour construire le vecteur de silencieux FoMV-LES22. Lorsque les22 est réduit au silence dans le maïs, de petites plaques rondes de cellules nécrotiques apparaissent le long du système vasculaire des feuilles qui se dilatent et fusionnent en de grandes zones de tissu foliaire nécrotique50. FoMV-PDS, contenant un fragment de 313 pb du gène du sorgho phytoène désaturase (pds, LOC110436156, 96% d’identité de séquence au maïs pds, GRMZM2G410515), induit un silence de pds dans le maïs, résultant en de petites traînées de cellules photoblanchis le long du vascularis des feuilles qui s’allongent au fil du temps51. La séquence codante intacte pour la protéine fluorescente verte (GFP) a été utilisée pour démontrer l’expression des protéines pour FoMV (FoMV-GFP) et SCMV (SCMV-GFP). L’expression de GFP dans les feuilles est généralement plus détectable 14 jours après l’inoculation (DPI)6. Bien qu’il y ait eu des études antérieures utilisant l’agro-injection de vecteurs viraux dans le maïs, ces expériences ont seulement montré que l’agroinjection peut faciliter l’infection virale à partir d’un clone infectieux dans les semis de maïs et ne se développe pas aux virus recombinants conçus pour les applications VIGS ou VOX19,20,21,22. Le protocole présenté ici s’appuie sur les méthodes d’agro-injection précédentes, en particulier Grismley et al.19. Dans l’ensemble, cette méthode d’agro-injection est compatible avec les vecteurs VIGS et VOX, ne nécessite pas d’équipement spécialisé ou d’hôtes alternatifs comme sources d’inoculum, et diminue le temps et le coût globaux nécessaires à la mise en place et à la réalisation d’inoculations par rapport à d’autres méthodes courantes nécessitant une biolistique ou une transcription in vitro. Ce protocole facilitera les études de génomique fonctionnelle dans le maïs avec des applications impliquant VIGS, VOX et VEdGE.
Protocole
1. Construction plasmidique
REMARQUE: Ce protocole peut être appliqué à d’autres vecteurs viraux ou souches d’Agrobacterium , mais cela peut affecter le succès global de l’inoculation par agroinjection. Effectuez toujours des étapes d’inoculation et de placage bactériens dans une hotte à écoulement laminaire.
- Construction de silencieux FoMV
REMARQUE: Les médias Luria-Bertani (LB) (Miller) sont utilisés pour tous les médias, sauf indication contraire. Le LB liquide est obtenu en suspendant 25 g de granulés dans 1 000 mL d’eau distillée et en autoclavant pendant 15 min à 121 °C. Les supports LB solides sont fabriqués de la même manière avec l’ajout de 1,5% de gélose avant l’autoclavage. Les antibiotiques sont ajoutés après que LB est refroidi à ~ 60 ° C et la solution est versée dans des plaques de Petri de 95 x 15 mm. Les concentrations d’antibiotiques à utiliser sont les suivantes : rifampicine (rif) à 25 μg/mL, gentamycine (gent) à 50 μg/mL et kanamycine (kan) à 50 μg/mL.- La PCR amplifie les fragments du gène du maïs à faire taire (par exemple, les22 ou pds) à l’aide d’un apprêt avant avec un site de restriction PacI et d’un apprêt inverse avec un site de restriction XbaI. Cela permettra la ligature des fragments de gènes dans le MCS1* du vecteur binaire FoMV-pCAMBIA1380 dans l’orientation antisens.
REMARQUE: Configurez la PCR à l’aide d’une ADN polymérase haute fidélité, d’amorces avant et arrière à 10 μM chacune, d’un gabarit d’ADN plasmidique et d’eau, conformément aux spécifications de l’ADN polymérase. Amplifier pendant 35 cycles, en utilisant une température de recuit en fonction de l’ADN polymérase et de la température de fusion de l’apprêt (Tm), et une extension de 30 s par kilobase à amplifier. - Effectuer la purification PCR à l’aide d’un kit de purification PCR selon les spécifications du kit.
- Digérer le produit PCR purifié et le FoMV-EV avec les enzymes de restriction XbaI et PacI. Utilisez 1 μg de plasmide ou la totalité du produit PCR purifié, 2 μL de tampon 10x, 1 μL d’enzyme de restriction et ajoutez de l’eau pour obtenir un volume de réaction finale de 20 μL. Incuber selon les spécifications enzymatiques.
- Ligaturez le produit PCR digéré et le FoMV-EV avec la ligase d’ADN T4 selon le protocole du fabricant.
- Transformez le plasmide ligaturé en cellules E. coli chimiquement compétentes DH5α à l’aide de la méthode du choc thermique.
- Décongelez les cellules sur la glace et ajoutez 3 μL de plasmide au tube. Incuber sur de la glace pendant 30 min, puis un choc thermique pendant 30 s à 42 °C.
- Placer sur la glace pendant 5 min, ajouter 200 μL de bouillon super optimal avec répression catabolique (SOC) et laisser les cellules d’E. coli récupérer dans un milieu SOC pendant 1 h à 37 °C en agitant à 225 tr/min.
- Plaquer sur un milieu LB sélectif à la kanamycine et incuber à 37 °C pendant la nuit.
- Vérifiez les colonies pour obtenir des clones précis par séquençage Sanger à l’aide des amorces FM-5840F et FM-6138R (tableau supplémentaire 1). Soumettre 250 ng d’ADN plasmidique à une installation qui effectuera le séquençage de Sanger. Pour cette expérience, des échantillons ont été envoyés à l’Iowa State University DNA Core Facility.
- Inoculer 2 mL de LB liquide avec la colonie choisie et incuber à 37 °C pendant la nuit en agitant à 225 tr/min. Extraire l’ADN plasmidique de la culture pendant la nuit grâce à une préparation d’ADN plasmidique de lyse alcaline52.
- Transformez l’ADN plasmidique en cellules GV3101 de la souche Agrobacterium à l’aide de la méthode de congélation-décongélation. Laisser décongeler 100 μL de cellules chimiquement compétentes sur la glace, ajouter 1 à 5 μL de plasmide et incuber sur de la glace pendant 30 min. Placer dans l’azote liquide pendant 1 min, puis incuber à 37 °C pendant 3 min. Ajouter 1 mL de SOC, laisser reposer pendant 2-3 h à 28 °C en agitant, plaquer sur rif, gent, et kan milieu LB sélectif et incuber à 28 °C pendant 2 jours.
- Filtrer les colonies pour la présence d’insert avec la PCR de colonie. Choisissez une seule colonie bactérienne et mélangez-la dans 30 μL d’eau. Mettre en place une réaction pcR en ajoutant 12,5 μL de mélange maître de polymérase, 1,25 μL de chaque amorce de 10 μM, FM-5840F et FM-6138R, 3 μL de suspension de colonie bactérienne et de l’eau à un volume final de 25 μL. Cycle 35 fois avec une température de recuit de 64 °C et un temps d’extension de 1 min (1 min pour chaque kb amplifié).
- Inoculer 2-5 mL de LB liquide (rif, gent, kan) avec la colonie d’Agrobacterium correcte. Laissez-le pousser pendant la nuit à 28 °C en secouant à 225 tr/min.
- Mélanger la culture pendant la nuit avec une solution de glycérol à 50% 1:1. Conserver à -80 °C pour un stockage à long terme.
- La PCR amplifie les fragments du gène du maïs à faire taire (par exemple, les22 ou pds) à l’aide d’un apprêt avant avec un site de restriction PacI et d’un apprêt inverse avec un site de restriction XbaI. Cela permettra la ligature des fragments de gènes dans le MCS1* du vecteur binaire FoMV-pCAMBIA1380 dans l’orientation antisens.
- Construction d’expression FoMV
- La PCR amplifie la séquence de codage d’intérêt, y compris les codons de démarrage et d’arrêt (par exemple, GFP) comme décrit au point 1.1.1, en ajoutant un site de restriction Bsu36I sur l’amorce avant et un site de restriction PspOMI sur l’amorce inverse pour permettre le clonage directionnel dans le sens orientation dans MCS2.
- Effectuez la purification PAR PCR à l’aide d’un kit de purification par PCR conformément aux spécifications du kit.
- Digérer le produit PCR et le FoMV-EV avec les enzymes de restriction Bsu36I et PspOMI, comme décrit au point 1.1.3.
- Ligaturez le produit PCR digéré et le FoMV-EV avec la ligase d’ADN T4 selon le protocole du fabricant.
- Transformer en cellules E. coli chimiquement compétentes en DH5α en utilisant la méthode du choc thermique décrite au point 1.1.5. Plaquer sur un milieu LB sélectif à la kanamycine et incuber à 37 °C pendant la nuit.
- Vérifier les colonies pour des clones précis par séquençage de Sanger comme décrit dans 1.1.6 en utilisant les amorces 5AmuS2 et 5AmuA2 (tableau supplémentaire 1).
- Inoculer 2 mL de LB liquide avec la colonie choisie et incuber à 37 °C pendant la nuit en agitant à 225 tr/min. Extraire l’ADN plasmidique de la culture pendant la nuit grâce à une préparation d’ADN plasmidique de lyse alcaline52.
- Transformer l’ADN plasmidique en cellules chimiquement compétentes de la souche GV3101 d’Agrobacterium en utilisant la méthode de congélation-décongélation décrite au point 1.1.8. Plaquer sur des milieux LB sélectifs rif, gent et kan et incuber à 28 °C pendant 2 jours.
- Filtrer les colonies pour la présence d’insert avec PCR de colonie en utilisant les amorces 5AmuS2 et 5AmuA2.
- Inoculer 2-5 mL de LB liquide (rif, gent, kan) avec la colonie d’Agrobacterium correcte. Agiter toute la nuit à 225 tr/min à 28 °C.
- Mélanger la culture pendant la nuit avec une solution de glycérol à 50% 1:1. Conserver à -80 °C pour un stockage à long terme.
- Construction d’expression SCMV
- La PCR amplifie le gène d’intérêt (par exemple, GFP) en excluant le codon stop tel que décrit au point 1.1.1, y compris un site de digestion PspOMI sur l’amorce avant et un site de digestion SbfI sur l’amorce inverse pour permettre le clonage directionnel dans le vecteur binaire SCMV-pCAMBIA1380.
REMARQUE: L’insert doit être cloné dans le cadre avec la polyprotéine virale. - Effectuez la purification PAR PCR à l’aide d’un kit de purification par PCR conformément aux spécifications du kit.
- Digérer le produit PCR et le SCMV-EV avec les enzymes de restriction PspOMI et SbfI, comme décrit au point 1.1.3.
- Ligaturez le produit PCR digéré et SCMV-EV avec la ligase d’ADN T4 selon le protocole du fabricant.
- Transformer le produit en cellules E. coli chimiquement compétentes DH5α à l’aide de la méthode du choc thermique décrite au point 1.1.5. Plaquer sur un milieu LB sélectif kan et incuber à 37 °C pendant la nuit.
- Filtrer les colonies pour des clones précis par séquençage de Sanger comme décrit au point 1.1.6 à l’aide des amorces SC-745F et HCProR1 (tableau supplémentaire 1).
- Inoculer 2 mL de LB liquide avec la colonie choisie et incuber à 37 °C pendant la nuit en agitant à 225 tr/min. Extraire l’ADN plasmidique de la culture pendant la nuit grâce à une préparation d’ADN plasmidique de lyse alcaline52.
- Transformer l’ADN plasmidique en cellules chimiquement compétentes de la souche GV3101 d’Agrobacterium en utilisant la méthode de congélation-dégel décrite au point 1.1.8. Plaquer sur des milieux LB sélectifs rif, gent et kan et incuber à 28 °C pendant 2 jours.
- Filtrer les colonies pour la présence d’insert avec pcR de colonie avec les amorces SC-745F et HCProR1 comme décrit au point 1.1.9.
- Inoculer 2-5 mL de LB liquide (rif, gent, kan) avec la colonie d’Agrobacterium correcte. Agiter toute la nuit à 225 tr/min à 28 °C.
- Mélanger la culture pendant la nuit avec une solution de glycérol à 50% 1:1. Conserver à -80 °C pour un stockage à long terme.
- La PCR amplifie le gène d’intérêt (par exemple, GFP) en excluant le codon stop tel que décrit au point 1.1.1, y compris un site de digestion PspOMI sur l’amorce avant et un site de digestion SbfI sur l’amorce inverse pour permettre le clonage directionnel dans le vecteur binaire SCMV-pCAMBIA1380.
2. Préparation des semis
- Plantez 1-2 graines de maïs (maïs doux 'Golden Bantam', FR1064, B73, etc.) dans un milieu de culture à base de tourbe dans de petits inserts placés dans des plateaux 4-7 jours avant l’injection. Placer dans une chambre de croissance sous 16 h jours à 25 °C et 8 h nuits à 22 °C (~185 rayonnement photosynthétiquement actif (PAR)) ou dans une serre sous 16 h jours à 22-25 °C et 8 h nuits à 22-25 °C (350-400 PAR).
REMARQUE: La susceptibilité à Agrobacterium varie selon les génotypes de maïs, ce qui affecte les taux de réussite. De plus, certains vecteurs viraux peuvent être incompatibles avec certains génotypes de maïs. - Arrosez régulièrement et fertilisez une fois par semaine avec 15-5-15 engrais liquides à 330 parties par million (PPM).
3. Préparation d’Agrobacterium
- Un jour avant l’injection, préparez le milieu liquide LB avec l’antibiotique approprié (rif, gent, kan) et inoculez avec la souche Agrobacterium portant la construction virale souhaitée. Il est recommandé d’ajouter 20 μL de stock de glycérol dans 50 mL de LB, ce qui devrait produire suffisamment de culture bactérienne pour inoculer >100 plantes et peut être augmenté ou réduit au besoin.
REMARQUE: Préparez suffisamment d’inoculum pour avoir une quantité finale de suspension bactérienne d’au moins 1 mL à une densité optique de 600 nm (OD600) de 1,0 pour chaque 4-5 plantes. - Agiter à 225 tr/min à 28 °C pendant 24 h.
- Bactéries en granulés pendant 10 min à 4 000 x g à température ambiante. Jetez le surnageant.
- Lavez soigneusement la pastille avec 1 mL d’eau désionisée (DI) par pipetage ou vortex doux.
- Répétez l’étape 3.3 pour granuler les bactéries.
- Remettre la pastille dans 1 mL de solution mgSO4 de 10 mM par pipetage ou vortex doux.
- Éventuellement, ajouter 200 μM d’acétosyringone à la solution. Bien que couramment utilisée, l’acétosyringone n’améliore que la capacité de transformation de certaines souches d’Agrobacterium . Les auteurs n’ont pas constaté que l’ajout d’acétosyringone affecte l’efficacité de ce protocole (tableau supplémentaire 2).
REMARQUE: La solution MgSO4 de 10 mM peut être fabriquée à partir d’une solution mère de 1 M avec un pH de 6,3 stockée à température ambiante. La solution ne nécessitera probablement pas d’ajustement du pH.
- Éventuellement, ajouter 200 μM d’acétosyringone à la solution. Bien que couramment utilisée, l’acétosyringone n’améliore que la capacité de transformation de certaines souches d’Agrobacterium . Les auteurs n’ont pas constaté que l’ajout d’acétosyringone affecte l’efficacité de ce protocole (tableau supplémentaire 2).
- Mesurer OD600 de l’échantillon avec un spectrophotomètre et diluer à 1,0 OD600 avec 10 mM de solution de MgSO4 .
REMARQUE: Il s’agit d’un point d’arrêt sûr. La suspension bactérienne peut être maintenue à température ambiante jusqu’à 5 h avant l’injection.
4. Injection
REMARQUE: Les plants de maïs âgés de 4 à 7 jours peuvent être utilisés pour injection. Le taux de croissance des semis est grandement affecté par les conditions de croissance, la quantité de PAR (c.-à-d. un PAR plus élevé en serre que dans la chambre de croissance) et le génotype, entre autres choses qui peuvent être difficiles à contrôler dans des conditions de serre. Les plantes peuvent être injectées dès l’âge de 4 jours lorsqu’elles mesurent 2 à 3 cm de haut sans feuilles dilatées et aussi vieilles que 7 jours lorsque la feuille à pointe arrondie la plus basse est élargie. Le taux de réussite de ces méthodes d’inoculation diminue rapidement à mesure que les plantes vieillissent au-delà de 7 jours après le semis. Le site d’injection est le même quel que soit l’âge des semis.
- En portant des lunettes de sécurité, injecter la suspension bactérienne dans les semis à 2-3 mm au-dessus du nœud coléoptilaire à l’aide d’une aiguille de 25G x 5/8 » attachée à une seringue jetable de 1 mL.
REMARQUE: Le nœud coléoptiaire est l’endroit où les racines de la couronne finiront par se former. C’est le nœud le plus bas de l’usine. En règle générale, il y aura un changement de couleur du vert au blanc au niveau et en dessous du nœud. Le lieu d’injection est juste au-dessus du méristème. Disséquer quelques semis à ce stade peut aider à visualiser l’emplacement du méristème et, par conséquent, le site d’injection approprié. - Appliquez une légère pression sur la seringue jusqu’à ce que la suspension remplisse le coléoptile ou soit visible dans la verticille, selon le stade de croissance des plantes. Il s’agit d’environ 100 à 200 μL de suspension.
REMARQUE: S’il est difficile d’injecter la suspension dans le semis, le site d’injection peut être trop bas. Une pression modérée est tout ce qui devrait être nécessaire pour injecter la suspension. - Injecter tous les semis, en changeant les seringues et les aiguilles pour chaque construction.
5. Soins continus des plantes
- Transplantez les plants injectés dans des pots de 13 x 13 x 15 cm ou plus grands lorsqu’ils ont 7 à 8 jours.
- Maintenir les conditions de croissance (photopériode de 16 h et fertilisation une fois par semaine).
6. Confirmation de l’infection (phénotypique et RT-PCR)
- Score phénotypique des plantes entre 14 et 21 DPI. Les lésions dues au silence des gènes témoins de la lésion imitent la 22 ou la phytoène désaturase peuvent facilement être vues sur les feuilles et sont distinctes des symptômes de FoMV. L’expression de GFP peut être détectée par imagerie au microscope fluorescent ou par d’autres images de lumière UV.
REMARQUE: Certaines constructions / vecteurs viraux peuvent prendre plus de temps à montrer des symptômes ou peuvent ne présenter aucun symptôme du tout. Les conditions de lumière élevée augmentent considérablement les phénotypes causés par le silence de la lésion imitant la 22 et la phytoène désaturase. Les lésions peuvent être moins visibles ou absentes si les plantes sont maintenues dans des conditions de faible luminosité telles qu’une chambre de croissance, mais le taux d’infection réel déterminé par RT-PCR ne devrait pas être affecté (tableau 1). - Pour confirmer l’infection moléculairement, échantillonnez la feuille 6 entre 14 et 21 DPI et extrayez l’ARN total à l’aide d’une extraction phénol-chloroforme selon les instructions du fabricant.
- Utiliser l’ARN extrait comme modèle pour générer de l’ADNc de premier brin.
- Mettre en place la réaction d’ADNc avec jusqu’à 5 μg d’ARN total, 1 μL d’amorces hexamères aléatoires, 1 μL d’oligo (dT)18 amorces, 1 μL de dNTP, 1 μL de transcriptase inverse et de l’eau pour un volume final de 14,5 μL.
- En utilisant des amorces conçues pour la construction virale et l’ADNc comme modèle, effectuez une PCR sur chaque échantillon pour confirmer l’infection virale et déterminer l’intégrité du gène ou du fragment de gène d’intérêt comme décrit au point 1.1.1, sauf réduire les cycles à 25 pour foMV et 30 pour SCMV pour éviter les faux positifs.
- Pour les constructions de silencieux FoMV, utilisez les amorces FM-5840F et FM-6138R pour amplifier le MCS1*, qui contient le fragment de gène du maïs. Pour les constructions d’expression FoMV, utilisez les amorces 5AmuS2 et 5AmuA2 pour amplifier à travers le MCS2, qui contient le gène inséré.
- Pour les constructions d’expression SCMV, utilisez les amorces SC745-F et HCProR1 pour amplifier à travers le MCS, qui contient le gène inséré (Figure supplémentaire 3).
- Pour un gène de contrôle endogène, utilisez les amorces ZmActS et ZmActA, qui amplifient un fragment d’ARNm d’actine de maïs (GRMZM2G126010) ou les amorces ZmUbiF et ZmUbiR, qui amplifient un fragment d’ARNm de polyubiquitine de maïs (GRMZM2G409726_T01).
- Visualisez le produit PCR sur un gel d’agarose à 1 % contenant une coloration d’acide nucléique pour déterminer la présence ou l’absence de virus et de gène ou de fragment de gène.
Résultats
L’objectif de cette étude était de développer un protocole simple pour introduire directement des virus recombinants conçus pour le silençage génique ou l’expression des gènes dans les semis de maïs (Figure 2). Les vecteurs viraux porteurs d’inserts sont conçus et clonés à l’aide de techniques de biologie moléculaire standard. Des fragments de gènes pour le silence sont insérés dans MCS1* dans FoMV-EV et des séquences codantes pour l’expression sont insérées dans FoMV-EV à MCS2 ou SCMV-EV à MCS. Les plasmides résultants sont transférés à la souche GV3101 d’Agrobacterium . Par la suite, les plants de maïs sont injectés dans la semaine ou moins après la plantation. Deux semaines après l’injection, les plantes peuvent être évaluées à la fois phénotypiquement et moléculairement pour l’infection virale, le silençage génique et l’expression des gènes.
Les plants de maïs sont cultivés dans un milieu à base de tourbe pendant 4 à 7 jours. À ce stade, le méristème apical de la pousse se trouve juste au-dessus du nœud coléoptiaire (Figure 3A). Une fois que le coléoptile s’est étendu de 2 à 3 centimètres ou jusqu’à 7 jours après le semis, les plantes sont injectées à 2-3 mm au-dessus du nœud coléoptilaire (Figure 3B-F). Environ 12 jours après l’injection, les plantes commenceront à présenter des phénotypes silencieux sur leurs feuilles, couramment observés près du tissu vasculaire, et ces lésions sont visuellement distinctes des symptômes de la mosaïque virale FoMV (Figure 4). La présence de FoMV et le silence des gènes cibles sont détectables chez les plantes injectées (Figure 5). L’expression de GFP peut être détectée 2 semaines après l’injection sous un microscope fluorescent et est plus forte sur les feuilles 5-7 (Figure 6). Lorsqu’elle est observée dans un système d’imagerie par fluorescence, l’expression de la GFP à partir de FoMV peut être visualisée comme de nombreuses petites zones ponctuées de fluorescence réparties sur les feuilles près du tissu vasculaire, tandis que l’expression de GFP à partir de SCMV consiste en des patchs plus grands (Figure 6, Figure supplémentaire 1). Bien que les symptômes de la mosaïque virale soient souvent visibles sur les plantes infectées par des constructions de silencieux FoMV, les plantes injectées avec des constructions d’expression de GFP qui expriment avec succès GFP ne présentent souvent pas ces symptômes. En conséquence, une plante sans symptômes visibles peut toujours être positive pour l’expression du virus et de la GFP. De plus, la perforation du méristème pendant la procédure d’agro-injection doit être évitée car cela peut causer des défauts morphologiques, mais les plantes résultantes survivent et sont souvent symptomatiques (Figure 7).
Bien que ce protocole ait été développé à l’origine à l’aide de maïs doux, plusieurs lignées consanguines de maïs peuvent être inoculées avec succès avec des constructions de silençage génique FoMV utilisant l’agro-injection. Par exemple, FR1064 et B73 ont généralement des taux élevés d’infection virale (tableau 2). Notamment, Mo17, une lignée avec une résistance génétique connue à FoMV, avait une efficacité d’infection de 0% comme prévu36,53. De plus, la construction utilisée influe sur l’efficacité de l’infection (tableau 3). Dans le cas de FoMV, FoMV-EV et FoMV-LES22 ont généralement les rendements d’infection les plus élevés à 53% et 54%, respectivement. FoMV-PDS a une efficacité légèrement inférieure à 38%, et FoMV-GFP est le plus bas à 17%. SCMV-GFP a une efficacité d’infection de 8%. Ces pourcentages sont des moyennes sur plusieurs expériences; les expériences individuelles peuvent avoir des rendements d’infection plus ou moins élevés.
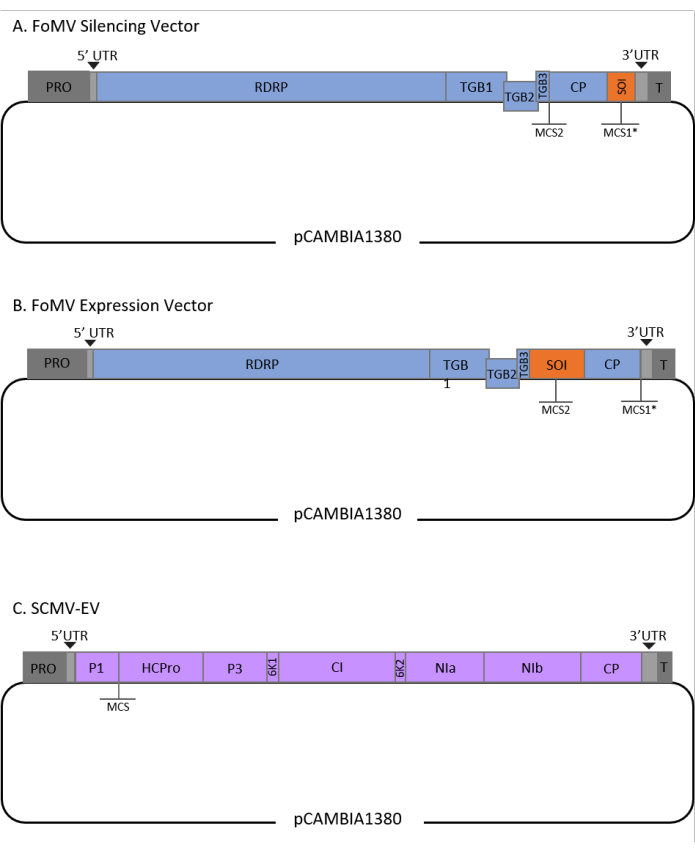
Figure 1 : Représentations schématiques des clones d’ADN-T FoMV et SCMV utilisés pour l’agroinjection dans le maïs. Le vecteur FoMV contient deux sites de clonage multiples (MCS1* et MCS2). Le vecteur vide, FoMV-EV, est de 7 269 bp et ne contient aucun insert dans l’un ou l’autre MCS. (A) Le silençage génique à l’aide du vecteur FoMV peut être réalisé en insérant des fragments de gènes dans MCS1*, désignés comme séquence d’intérêt (SOI), généralement dans l’orientation anti-sens. (B) L’expression des gènes à l’aide du vecteur FoMV peut être réalisée en insérant des ORF géniques dans le MCS2 dans l’orientation des sens, désignée comme SOI. (C) Le vecteur SCMV a été conçu pour avoir un MCS entre P1 et HCPro. Le vecteur vide, SCMV-EV, est de 11 015 bp et ne contient aucun insert dans le MCS. Les ORF génétiques insérés dans le MCS qui sont dans le cadre de la polyprotéine SCMV seront exprimés sous forme de protéines. Veuillez cliquer ici pour voir une version agrandie de cette figure.
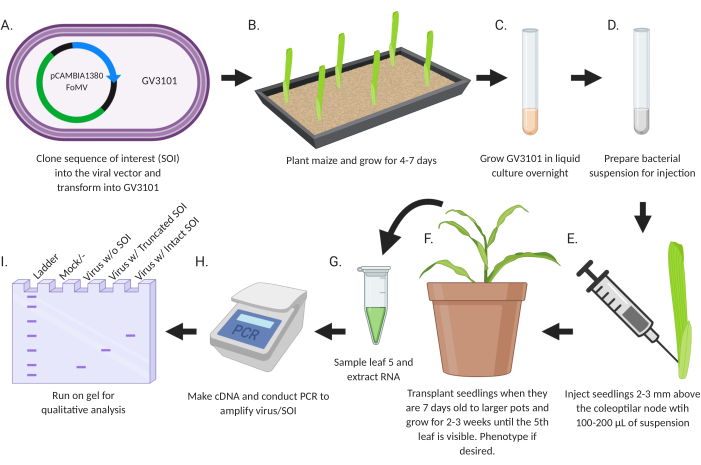
Figure 2: Résumé schématique du protocole d’agroinjection. (A) Clone SOI, soit un CDS ou un fragment de gène, dans le vecteur viral et se transforme en souche Agrobacterium GV3101. (B) Planter du maïs et le cultiver pendant 4 à 7 jours. (C) Cultiver le GV3101 en culture liquide pendant la nuit à 28 °C. (D) Préparer la suspension bactérienne pour injection. (E) Injecter des semis à 2-3 mm au-dessus du nœud coléoptiaire avec 100-200 μL de suspension. (F) Transplanter les semis lorsqu’ils ont 7 jours dans des pots plus grands et grandir pendant 2-3 semaines jusqu’à ce que la 5ème feuille soit visible. Phénotype si désiré. (G) Échantillonner la feuille 5 et extraire l’ARN. (H) Fabriquer de l’ADNc et effectuer une PCR pour amplifier le virus / SOI. (I) Exécuter sur gel pour analyse qualitative afin de déterminer la présence/l’absence de virus et un SOI tronqué ou intact. Cette figure a été créée avec BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3: Méthode d’agro-injection pour inoculer des semis juste au-dessus du nœud coléoptile. (A) Plantes âgées de 4 à 5 jours. Le coléoptile est complètement dilaté et la première vraie feuille peut être partiellement visible, mais n’est pas déployée. (B) Plantes âgées de 6 à 7 jours. La première feuille peut être élargie mais aucun collier ne sera visible. La deuxième feuille sera également visible et pourrait commencer à se déployer à ce stade. (C) Dissection de plantes âgées de 6 à 7 jours montrant l’emplacement du méristème apical de la pousse par rapport au nœud coléoptile. (D) Injection de plantes âgées de 4 à 5 jours. (E) Injection de plantes âgées de 6 à 7 jours. (F) Injection de plantes âgées de 6 à 7 jours à l’aide d’une solution de colorant, montrant un inoculum teint sortant de la verticille du semis. G) Gros plan du site d’injection de plantes âgées de 6 à 7 jours par rapport au nœud coléoptile. (H) Gros plan d’une plante âgée de 6 à 7 jours après l’injection, montrant un inoculum teint dans la verticille de la plante. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Symptômes des gènes témoins de silencieux utilisés dans les expériences d’agro-injection. (A) Une feuille photographiée à 17 DPI après l’injection de FoMV-LES22 dans la plante. FoMV-LES22 porte un insert de 329 bp du CDS 3' de la lésion imitant le gène du maïs 22 dans l’orientation antisens. Le silence entraîne l’accumulation d’un métabolite toxique qui, à son tour, provoque les lésions nécrotiques qui apparaissent d’abord sous forme de stries le long du système vasculaire et se développent en plaques plus grandes, comme indiqué ici. (B) Une feuille photographiée à 17 DPI après l’injection de FoMV-PDS à la plante. FoMV-PDS porte un insert de paire de bases 313 du CDS 3' du gène de la désaturase phytoène sorgho dans l’orientation antisens. Le silence de pds dans le maïs provoque un phénotype de photoblanchiment systémique qui commence par de petites stries minces le long du système vasculaire qui se transforment en stries plus longues le long de la feuille, comme indiqué ici. Veuillez cliquer ici pour voir une version agrandie de cette figure.
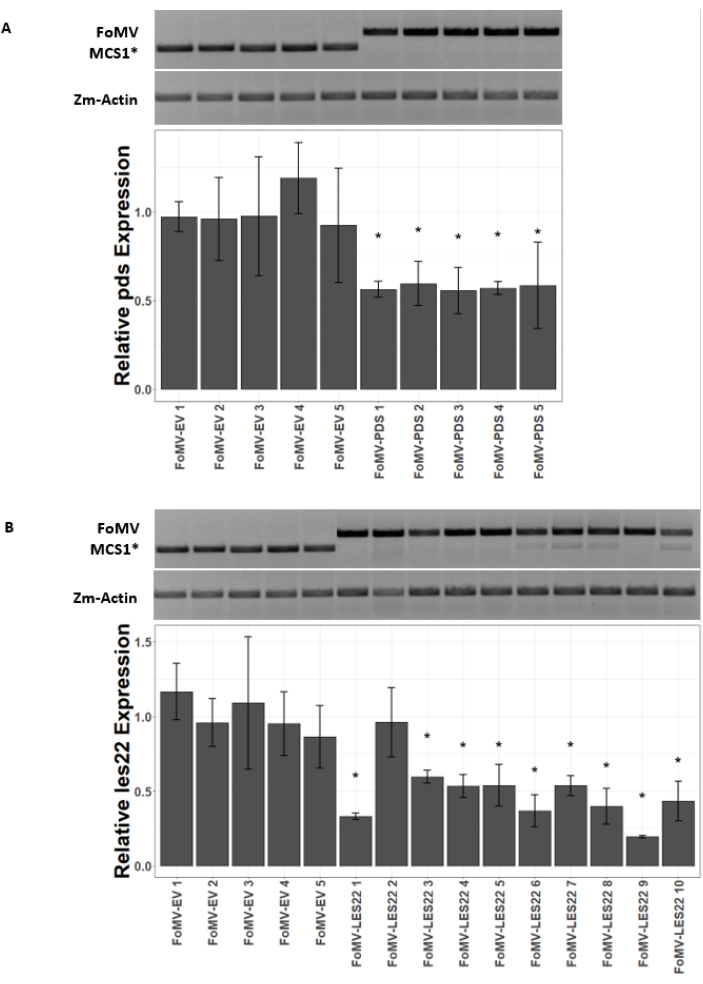
Figure 5 : qRT-PCR de plantes injectées avec des constructions de silençage du gène FoMV. Confirmation de l’infection systémique par FoMV et du silençage génique induit par les constructions FoMV-LES22 et FoMV-PDS délivrées par agro-injection dans les plants de maïs doux (Golden x Bantam). (A) Les images sur gel montrent des analyses RT-PCR confirmant la présence d’un vecteur vide FoMV-MCS1* (amplicon de 315 pb) et de FoMV-PDS (amplicon de 625 pb) dans la feuille 6 de cinq plantes individuelles. Les amorces PCR utilisées produisent un amplicon qui couvre MCS1*. L’amplicon du gène du maïs actine (Zm-Actin) sert de gène de référence. Le graphique à barres représente les valeurs d’expression relative qRT-PCR pour l’expression pds dans la feuille 6 à 37 jours après l’inoculation (DPI) par agroinjection avec FoMV-MCS1* ou FoMV-PDS. La suppression de pds est détectable dans chacun des cinq réplicats biologiques (p = 0,003; test de Dunnett post-hoc; les barres d’erreur indiquent l’écart type (ET) de trois réplicats techniques). (B) Les images de gel montrent des analyses RT-PCR confirmant la présence de FoMV-MCS1* (amplicon de 315 pb) dans la feuille 6 de cinq plantes individuelles. FoMV-LES22 (amplicon de 625 pb) a été détecté dans le tissu de la feuille 6 (échantillons FoMV-LES22 1-5, 38 DPI) et de la feuille 4 (échantillons FoMV-LES22 6-10, 20 DPI) pour dix plantes individuelles. L’amplicon Zm-Actin a servi de gène de référence. Le graphique à barres représente les valeurs d’expression relative qRT-PCR pour l’expression de les22 dans les tissus de maïs par agroinjection de constructions virales FoMV-MCS1* ou FoMV-LES22. La suppression de Les22 se produit dans 9 des 10 répliques biologiques (p = <0,0001; test de Dunnett post-hoc; les barres d’erreur indiquent SD pour trois réplications techniques). Veuillez cliquer ici pour voir une version agrandie de cette figure.
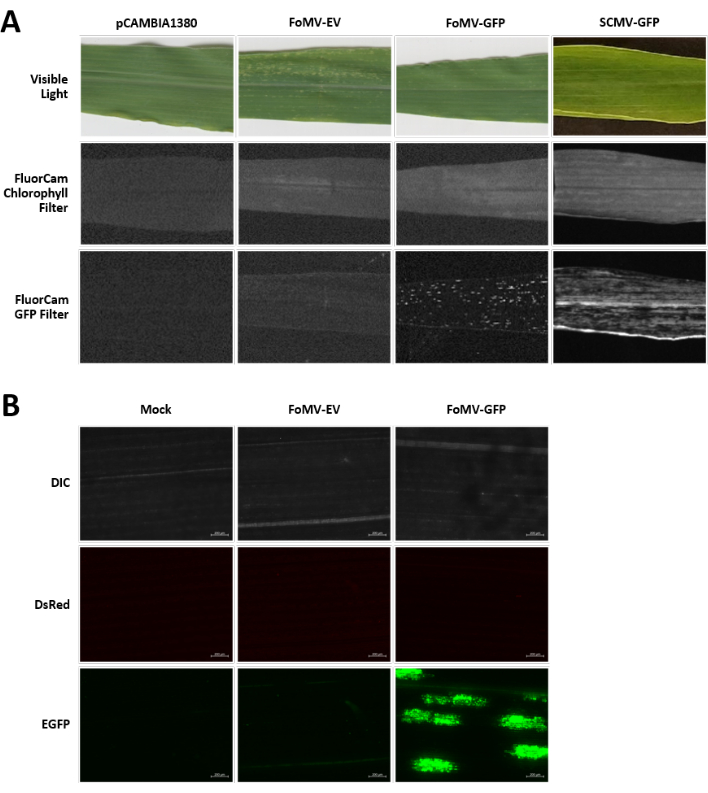
Graphique 6. Phénotypes de diverses constructions utilisées dans les expériences d’agroinjection. Toutes les plantes imagées ont été injectées à l’âge de 6-7 jours avec la souche Agrobacterium GV3101 portant les constructions indiquées. Les images ont été prises à 16 DPI. (A) Symptômes foliaires de pCAMBIA1380 (colonne vertébrale plasmidique vide), FoMV-EV, FoMV-GFP et SCMV-GFP en lumière visible, sous le filtre à chlorophylle FluorCam à une exposition de 250 μs et sous le filtre FluorCam GFP à 10 ms d’exposition. (B) Images de microscopie fluorescente des feuilles de plantes simulées traitées (injectées avec une solution de MgSO4 uniquement), FoMV-EV et FoMV-GFP injectées. Les canaux DIC, DsRed et EGFP sont montrés et ont été pris chacun à une exposition de 1500 ms. La barre d’échelle est de 200 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Graphique 7. Effets morphologiques de l’injection. Un exemple des effets morphologiques plus graves qui peuvent survenir lors de l’injection directe dans le tissu méristématique. Cette blessure peut entraîner un « déchiquetage » des feuilles et la scission de la tige. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Virus | Conditions de croissance | Génotype | # Plantes infectées | Nombre total de plantes | % d’infection | Pourcentage moyen d’infection |
| FoMV-EV | Chambre de croissance | Maïs | 22 | 23 | 96% | 97% |
| B73 | 18 | 18 | 100% | |||
| B104 | 20 | 21 | 95% | |||
| Serre | Maïs | 20 | 23 | 87% | 89% | |
| B73 | 17 | 18 | 94% | |||
| B104 | 16 | 19 | 84% | |||
| SCMV-EV | Chambre de croissance | Maïs | 14 | 21 | 67% | 47% |
| B73 | 5 | 18 | 28% | |||
| B104 | 10 | 21 | 48% | |||
| Serre | Maïs | 14 | 23 | 61% | 49% | |
| B73 | 0 | 19 | 0% | |||
| B104 | 19 | 22 | 86% |
Tableau 1 : Effet des conditions de serre et de chambre de croissance sur l’efficacité de l’inoculation agro-industrielle. Les graines ont germé dans des conditions de croissance identiques. Les semis germés ont été agro-injectés et la moitié d’entre eux ont été déplacés dans une chambre de croissance (25 °C 16 h de lumière du jour / 22C 8 h de nuit; 185 PAR) et l’autre moitié a été déplacée dans une serre (22-25 °C 16 h de lumière du jour / 22-25 °C 8 h de nuit; 350-400 PAR). Ce tableau indique le taux d’infection en pourcentage, calculé à partir du nombre de plantes confirmées par RT-PCR comme étant infectées par le virus respectif divisé par le nombre total de plantes agro-injectées. Il n’y a pas de différence statistique dans l’efficacité des infections entre les conditions de la chambre de croissance et de la serre (Test t à deux queues FoMV p = 0,08; SCMV test t à deux queues p = 0,96).
| Génotype du maïs | FoMV-EV | FoMV-LES22 | Total combiné | ||||
| Infecté | Total | % Infectés | Infecté | Total | % Infectés | % Infectés | |
| Maïs | 18 | 23 | 78% | 15 | 23 | 65% | 72% |
| MO47 | 7 | 22 | 32% | 1 | 21 | 5% | 19% |
| K55 | 1 | 15 | 7% | 3 | 17 | 18% | 13% |
| W64A | 10 | 22 | 45% | 8 | 20 | 40% | 43% |
| MO17 | 0 | 16 | 0% | 0 | 13 | 0% | 0% |
| B73 | 10 | 18 | 56% | 7 | 17 | 41% | 49% |
| B101 | 12 | 21 | 57% | 8 | 24 | 33% | 44% |
| FR1064 | 4 | 4 | 100% | 4 | 4 | 100% | 100% |
| B104 | 10 | 22 | 45% | 5 | 21 | 24% | 35% |
| COE22 | 2 | 7 | 29% | 4 | 6 | 67% | 46% |
| A188 | 0 | 3 | 0% | 4 | 6 | 67% | 44% |
Tableau 2 : Efficacité de l’infection des constructions foMV dans les génotypes de maïs. FoMV-EV et FoMV-LES22 ont été agroinjectés dans 11 génotypes de maïs. Après l’injection, les semis ont été déplacés vers la serre. Ce tableau détaille le taux d’infection en pourcentage, calculé à partir du nombre de plantes infectées par le FoMV tel que confirmé par RT-PCR divisé par le nombre total de plantes agro-injectées. Le taux total combiné d’infection montre les taux moyens d’infection de chaque génotype pour les deux constructions FoMV testées.
| Stade de la plante | Plantes âgées de 4 à 5 jours | Plantes âgées de 6 à 7 jours | Total combiné | ||||
| Symptomatique | Nombre total de plantes | % Infectés | Symptomatique | Nombre total de plantes | % Infectés | % Infectés | |
| FoMV-EV | 42 | 72 | 58% | 80 | 170 | 47% | 53 % (A) |
| FoMV-PDS | 65 | 157 | 41% | 66 | 184 | 36% | 39 % (B C) |
| FoMV-LES22 | 115 | 195 | 59% | 144 | 292 | 49% | 54 % (A B) |
| FoMV-GFP | 16 | 103 | 16% | 37 | 217 | 17% | 16 % (C) |
| SCMV-GFP | 10 | 95 | 11% | 5 | 82 | 6% | 8 % (C) |
Tableau 3 : Résumé des expériences d’injection. Ce tableau représente un résumé des expériences d’injection menées d’août 2017 à août 2018 sur des plants de maïs doux Golden Bantam. Les plantes ont été évaluées pour les symptômes viraux (FoMV-EV), les symptômes de silençage (pds et les22) ou la fluorescence GFP (GFP) par dépistage visuel (FoMV-EV, FoMV-PDS et FoMV-LES22) ou FluorCam (FoMV-GFP et SCMV-GFP). Les résultats sont présentés individuellement pour les plantes âgées de 4 à 5 jours et les plantes âgées de 6 à 7 jours, ainsi qu’un résumé de tous les âges. Il n’y a pas de différence significative entre les plantes de 4 à 5 jours et les plantes de 6 à 7 jours (ANOVA unidirectionnelle, F = 0,6513). Il y a une différence entre la construction virale (Onaway ANOVA, F = <0,0001), avec les lettres représentant le rapport de lettres de connexion Tukey-Kramer HSD.
Tableau supplémentaire 1 : Tableau répertoriant tous les noms et séquences d’amorces utilisés dans ce protocole. Veuillez cliquer ici pour télécharger ce tableau.
Tableau supplémentaire 2 : Test d’acétosyringone. (A) Test initial de l’acétosyringone, comparant les taux de symptômes des plantes injectées simulées, FoMV-EV et FoMV-LES22 entre des suspensions d’inoculation avec 200 μM d’acétosyringone (+) ou sans acétosyringone (-). (B) Comparaison des taux d’infection par le FoMV-LES22 déterminés par RT-PCR entre les suspensions d’inoculation sans acétosyringone (-), avec 200 μM d’acétosyringone (+), et l’ajout de 20 μM d’acétosyringone à la culture bactérienne 4 heures avant la remise en suspension dans le tampon avec l’ajout de 200 uM d’acétosyringone à la suspension finale (++). Dans l’ensemble, aucune différence significative n’a été trouvée entre les traitements à l’acéotysyringone (ANOVA à sens unique, f = 0,5452). Veuillez cliquer ici pour télécharger ce tableau.
Figure supplémentaire 1 : Imagerie par fluorescence et validation moléculaire du SCMV agroinjecté et expression des protéines hétérologues dans le maïs. Le maïs a été agroinjecté avec une construction SCMV modifiée contenant à la fois des CDS de GFP et de nano luciférase (NLuc). (A) L’imagerie Fluorcam a été utilisée pour le dépistage et la détection des GFP. La gauche est une plante injectée simulée et la droite est une plante injectée SCMV-NLucGFP. (B) Les extraits de protéines foliaires ont été séparés par SDS-PAGE et évalués pour la présence de NLuc, GFP et SCMV coat protein (CP) par dosage de la luciférase en gel ou immunoblot comme indiqué. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Agrobacterium est un outil essentiel qui facilite de nombreuses techniques de biologie moléculaire dans la recherche liée aux plantes. Cette étude fournit un protocole d’agro-injection pour l’inoculation de vecteurs viraux FoMV et SCMV directement dans les tissus de maïs pour les applications VIGS et VOX. L’objectif principal est d’accroître la facilité et l’utilité des technologies à base de virus pour la recherche sur les plantes monocotylédones. Bien que l’agroinoculation directe du maïs ait été rapportée pour quelques virus, les auteurs ne connaissent pas de protocole détaillé et il n’y a pas d’exemples d’applications VIGS et VOX dans ces études19,22.
Il a été rapporté, et a été confirmé lors du développement de ce protocole, que le lieu d’injection est un facteur clé pour le lancement réussi d’une infection virale systémique via agroinjection19. L’injection systématique de l’emplacement recommandé sur la plante est supposée être la plus grande variable, car la position exacte du méristème dans les semis de maïs est pratiquement indétectable à l’œil. Pour minimiser les variations interpersonnelles, il est recommandé de disséquer quelques plants de maïs jusqu’au méristème afin de mieux visualiser son emplacement (Figure 3C). La position du méristème par rapport au nœud coléoptilaire devrait être à peu près la même pour les plantes âgées de 4 à 7 jours. De plus, la pratique de l’injection avec un liquide teint fournit une démonstration facilement visible de la façon dont « l’inoculum » remplit la verticille de la feuille, et parce que le site d’injection est marqué avec un colorant, la précision du site d’injection peut être corroborée (Figure 3G, H). Les tissus méristématiques sont les plus sensibles à l’agroinjection, mais l’injection de suspensions d’Agrobacterium directement dans ce tissu entraîne des effets morphologiques indésirables (Figure 6)19. Les plantes avec des méristèmes endommagés survivent, mais les défauts qui en résultent sont indésirables et, par conséquent, l’injection directe de ce tissu doit être évitée.
Plusieurs variables peuvent avoir un impact sur le lancement réussi d’une infection virale systémique par agroinjection, car trois systèmes biologiques complexes (plante, virus et souche d’Agrobacterium) doivent interagir en coordination. Cette interaction complexe peut être facilitée par les cellules à division rapide de la région méristématique, ce qui en fait un endroit idéal pour l’agro-ininculation19. La souche Agrobacterium doit être capable d’infecter les cellules des tissus végétaux pour délivrer l’ADN-T porteur du génome viral, et la plante doit être sensible au virus afin d’initier la réplication virale et l’infection systémique. Les génotypes du maïs diffèrent dans leur sensibilité aux virus (p. ex., le Mo17 est résistant au FoMV) ou aux souches d’Agrobacterium, mais la majorité des souches testées semblent être sensibles à la fois au FoMV et au SCMV (tableau 1 et tableau 2)53. Par exemple, la lignée consanguine FR1064 et la variété de maïs doux Golden Bantam peuvent être particulièrement sensibles aux vecteurs GV3101 Agrobacterium et FoMV.
Le nombre de feuilles échantillonnées et le moment de l’échantillonnage pour la RT-PCR sont essentiels pour une évaluation précise de l’infection virale. Dans les exemples présentés ici, le nombre de feuilles a été déterminé en commençant par la première feuille arrondie (communément appelée « feuille du pouce ») et en comptant vers le haut. Les feuilles ont été échantillonnées une fois qu’elles ont été agrandies et que la feuille suivante a commencé à émerger. Cependant, les feuilles optimales pour l’échantillonnage peuvent varier en fonction des espèces virales utilisées, des conditions de croissance et du génotype du maïs. Par conséquent, une expérience initiale de cours temporel est recommandée lors de l’application de ce protocole à un nouveau système de virus afin d’optimiser la stratégie d’échantillonnage en ce qui concerne les feuilles et le moment.
La construction spécifique utilisée affecte de manière significative l’efficacité de ce protocole. Par exemple, les vecteurs vides, FoMV-EV et SCMV-EV, et FoMV-PDS et FoMV-LES22, qui contiennent tous deux de petits inserts (313 pb et 329 pb, respectivement), produisent généralement les pourcentages les plus élevés de plantes présentant des symptômes viraux dans ces expériences (tableaux 1 et tableau 2). Cependant, les virus recombinants porteurs d’inserts plus grands de l’ORF GFP (720 pb) dans FoMV-GFP et SCMV-GFP, avaient des taux d’infection beaucoup plus faibles par rapport aux plantes injectées avec le vecteur vide ou les constructions de silençage génique. Cette tendance peut être due aux impacts négatifs sur la forme virale causés par des quantités croissantes de matériel génétique exogène dans le génome viral. Plusieurs études ont montré que la stabilité de l’insert des vecteurs viraux végétaux dépend en grande partie de la taille et de la séquence de l’insert36,54,55,56,57. De plus, il y avait une différence notable dans le pourcentage de plantes infectées après l’inoculation avec le vecteur vide FoMV ou SCMV, ce qui suggère que des travaux supplémentaires sont nécessaires pour optimiser ce protocole pour SCMV (tableau 1). Ces résultats indiquent qu’un certain dépannage peut être nécessaire lors du développement d’une construction, car la séquence et la longueur du fragment peuvent toutes deux affecter l’efficacité.
Dans l’ensemble, cette étude a montré que l’agro-injection de plants de maïs est une méthode d’inoculation efficace pour deux virus végétaux à ARN différents, des configurations vectorielles multiples et 11 génotypes de maïs. Ce travail avec FoMV et SCMV, associé à des travaux antérieurs utilisant l’injection avec le virus de la marbrure chlorotique du maïs (MCMV) ou MSV, indique que l’agroinjection convient à l’inoculation de plants de maïs avec des clones infectieux de virus à ARN et à ADN19,20,21,22. En outre, ces travaux montrent en outre que l’agroinjection est une méthode viable pour les vecteurs VIGS et VOX et peut être appliquée à des plantes aussi jeunes que quatre jours (tableau 3). Le protocole présenté ici devrait être facilement adapté par les biologistes du maïs pour faciliter la recherche dans les études de génomique fonctionnelle impliquant le silençage génique transitoire (VIGS) et la surexpression (VOX). L’agroinjection a également la capacité de faciliter les approches d’édition de gènes basées sur le virus (VEdGE) qui seraient autrement limitées par la dépendance à la transformation des plantes, améliorant potentiellement l’efficacité de l’édition ainsi que l’accessibilité58,59,60. Étant donné que la souche d’Agrobacterium appropriée, les génotypes de maïs et les vecteurs viraux sont soigneusement combinés, l’inoculation par agroinjection devrait devenir un outil précieux pour les analyses transitoires de la fonction génique du maïs.
Déclarations de divulgation
Les chercheurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
L’Iowa State University fait partie d’une équipe soutenant le programme Insect Allies hr0011-17-2-0053 de la DARPA. Ce travail a également été soutenu par l’Iowa State University Plant Sciences Institute, l’Iowa State University Crop Bioengineering Center, le projet USDA NIFA Hatch numéro 3808 et les fonds de l’État de l’Iowa. K.L.H. a également été partiellement soutenu par le programme de formation supérieure Predictive Plant Phenomics de l’Iowa State University financé par la National Science Foundation (DGE #1545453) et par la subvention de l’Agricultural and Food Research Initiative n ° 2019-07318 de l’USDA National Institute of Food and Agriculture. Les bailleurs de fonds n’ont joué aucun rôle dans la conception de l’étude et de la collecte, de l’analyse et de l’interprétation des données et dans la rédaction du manuscrit. Toutes les opinions, constatations, conclusions ou recommandations exprimées dans ce document sont celles des auteurs et ne reflètent pas nécessairement les points de vue des bailleurs de fonds.
Nous remercions Nick Lauter (USDA-ARS, Ames, IA) pour les semences de lignées consanguines de maïs, Christian F. Montes-Serey (Iowa State University) pour la fabrication du clone FoMV-GFP et Tyler Austin (Iowa State University) pour l’assistance technique.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL syringes | Fisher Scientific | 14955450 | alternatively, BD 309659 |
| 15 mL Falcon Tubes | Corning Science | 352059 | |
| 1kb+ Ladder | ThermoFisher Scientific | 10787018 | For assessing sizes of PCR products |
| 25G x 5/8" PrecisionGlide Needles | Becton, Dickinson and Company (BD) | 305122 | |
| 28°C Incubator | For Agrobacterium | ||
| 37°C Incubator | For E. coli | ||
| Acetosyringone | MilliporeSigma | D134406 | Optional |
| Agar | MilliporeSigma | A4800 | |
| Agarose | GeneMate | E-3120 | For making gels to check for virus/insert stability |
| Agrobacterium tumefaciens Strain GV3101 | Carries vir plasmid encoding T-DNA transfer machinery, RifR, GmR, from lab stock | ||
| Bsu36I | New England Biolabs | R0524 | |
| cDNA Kit | ThermoFisher Scientific | K1672 | Maxima First Strand cDNA Synthesis Kit with Dnase |
| Chloroform | Fisher Scientific | C298 | For RNA extraction |
| Cuvettes | Fisher Scientific | 14955127 | 1.5 mL |
| D-(+)-Glucose | MilliporeSigma | G7528 | Alkaline Lysis |
| DH5alpha Competent E. coli Cells | New England Biolabs | C2987 | |
| DNA Ligase | ThermoFisher Scientific | K1422 | Rapid DNA Ligation Kit |
| EDTA (Ethylenediamine Tetraacetic Acid, Disodium Salt Dihydrate) | Fisher Scientific | S311 | Alkaline Lysis |
| Ethanol | For RNA extraction | ||
| Fertilizer | Peters Fertilizer 15-15-15 Concentrate | ||
| Flat Inserts | T.O. Plastics | 715357C | For germinating seeds in trays |
| Flats | T.O. Plastics | 710245C | For germinating seeds in trays |
| FluorCam | Photon Systems Instruments | To assess maize plants for GFP expression before microscope | |
| Fluorescence Microscope | |||
| Gel Electrophoresis Box | |||
| Gentamycin Sulfate | Fisher Scientific | BP918 | |
| Glacial Acetate | Fisher Scientific | A38 | Alkaline Lysis |
| Glycerol | Fisher Scientific | G33-500 | For saving frozen stocks of bacteria |
| Go-Taq, 2X | Promega | M7123 | |
| Hydrochloric Acid | Fisher Scientific | A144 | for pHing solutions |
| Isopropanol | Sigma-Aldrich | 109827 | For RNA extraction |
| Kanamycin, Monosulfate | Fisher Scientific | BP906 | |
| Large Pots | Kordlok | SQL0550 | 5x5x4" or bigger. For transplanting seedlings. |
| Luria Bertani (LB) Broth, Miller | Himedia | M1245 | |
| Magnesium Sulfate Heptahydrate | Amresco | 662 | |
| Maize Golden Bantam Sweet Corn Seed | American Meadows, West Coast Seeds | ||
| Maize Inbred Seed | Our seed comes from our institution, but we are not able to provide this for other researchers. | ||
| Maxima H Minus Reverse Transcriptase | ThermoFisher Scientific | EP0753 | |
| MilliQ | Elga | Purelab Ultra | |
| Monarch PCR & DNA Cleanup Kit | New England Biolabs | T1030 | |
| PacI | New England Biolabs | R0547 | |
| Peters Excel 15-5-15 Fertilizer | ICL Specialty Fertilizers | G99140 | |
| Petri Dish, 95 mm x 15 mm | Fisher Scientific | FB0875714G | |
| pH Meter | |||
| Potassium Acetate | Fisher Scientific | P171 | Alkaline Lysis |
| Primers | Our primers were synthesized through our institutional DNA facility or through IDT | ||
| PspOMI | New England Biolabs | R0653 | |
| Q5 High-Fidelity DNA Polymerase | New England Biolabs | M0491 | |
| Rifampicin | EMD Millipore Corp | 557303 | |
| Rnase A | ThermoFisher Scientific | 12091021 | Alkaline Lysis |
| SbfI | New England Biolabs | R0642 | |
| Scale | For weighing chemicals for media or buffers | ||
| SDS (Sodium Dodecyl Sulfate) | Fisher Scientific | BP166 | Alkaline Lysis |
| Sodium Hydroxide | Fisher Scientific | S318 | Alkaline Lysis |
| Soil Substrate | SunGro Horticulture | SS#1-F1P | Sunshine Mix #1/Fafard-1P, any soil mix that maize grows well in is sufficient |
| Spectrophotometer | For measuring OD600 | ||
| Sybr Safe, 10,000X | Invitrogen | S33102 | For making gels to check for virus/insert stability |
| Thermocycler | For PCR | ||
| Tris Base | Fisher Scientific | BP154 | Alkaline Lysis |
| Trizol | Ambion | 15596018 | For RNA extraction |
| Weigh Paper | For weighing chemicals for media or buffers | ||
| XbaI | New England Biolabs | R0145 |
Références
- Zaidi, S. E. A., Mansoor, S. Viral vectors for plant genome engineering. Frontiers in Plant Science. 8, 539(2017).
- Kant, R., Dasgupta, I. Gene silencing approaches through virus-based vectors: speeding up functional genomics in monocots. Plant Molecular Biology. 100, 3-18 (2019).
- Hu, J., et al. A barley stripe mosaic virus-based guide RNA delivery system for targeted mutagenesis in wheat and maize. Molecular Plant Pathology. 20 (10), 1463-1474 (2019).
- Pasin, F., Menzel, W., Daròs, J. A. Harnessed viruses in the age of metagenomics and synthetic biology: an update on infectious clone assembly and biotechnologies of plant viruses. Plant Biotechnology Journal. 17 (6), 1010-1026 (2019).
- Cody, W. B., Scholthof, H. B. Plant virus vectors 3.0: Transitioning into synthetic genomics. Annual Review of Phytopathology. 57 (1), 211-230 (2019).
- Mei, Y., et al. Protein expression and gene editing in monocots using foxtail mosaic virus vectors. Plant Direct. 3 (11), 00181(2019).
- Ruiz, M. T., Voinnet, O., Baulcombe, D. C. Initiation and maintenance of virus-induced gene silencing. Plant Cell. 10 (6), 937-946 (1998).
- Bekele, D., Tesfaye, K., Fikre, A. Applications of virus induced gene silencing (VIGS) in plant functional genomics studies. Journal of Plant Biochemistry & Physiology. 07 (01), 1000229(2019).
- Scholthof, H. B., Scholthof, K. B. G., Jackson, A. O. Plant virus gene vectors for transient expression of foreign proteins in plants. Annual Review of Phytopathology. 34 (1), 299-323 (1996).
- Holzberg, S., Brosio, P., Gross, C., Pogue, G. P. Barley stripe mosaic virus-induced gene silencing in a monocot plant. Plant Journal. 30 (3), 315-327 (2002).
- Wang, R., et al. An efficient virus-induced gene silencing vector for maize functional genomics research. Plant Journal. 86 (1), 102-115 (2016).
- Redinbaugh, M. G., et al. Transmission of viral RNA and DNA to maize kernels by vascular puncture inoculation. Journal of Virological Methods. 98 (2), 135-143 (2001).
- Scholthof, H. B. The capsid protein gene of tomato bushy stunt virus is dispensable for systemic movement and can be replaced for localized expression of foreign genes. Molecular Plant-Microbe Interactions. 6 (3), 309(1993).
- Scholthof, H. B., Scholthof, K. B. G., Kikkert, M., Jackson, A. O. Tomato bushy stunt virus spread is regulated by two nested genes that function in cell-to-cell movement and host-dependent systemic invasion. Virology. 213 (2), 425-438 (1995).
- Scholthof, H. B. Rapid delivery of foreign genes into plants by direct rub-inoculation with intact plasmid dna of a tomato bushy stunt virus gene vector. Journal of Virology. 73 (9), 7823-7829 (1999).
- Zhang, J., et al. Vacuum and co-cultivation agroinfiltration of (germinated) seeds results in tobacco rattle virus (TRV) mediated whole-plant virus-induced gene silencing (VIGS) in wheat and maize. Frontiers in Plant Science. 8, 393(2017).
- Vaghchhipawala, Z., Rojas, C. M., Senthil-Kumar, M., Mysore, K. S. Agroinoculation and agroinfiltration: simple tools for complex gene function analyses. Methods in Molecular Biology. 678, Clifton, N.J. 65-76 (2011).
- Grimsley, N., Hohn, B., Hohn, T., Walden, R. "Agroinfection," an alternative route for viral infection of plants by using the Ti plasmid. Proceedings of the National Academy of Sciences. 83 (10), 3282-3286 (1986).
- Grimsley, N. H., Ramos, C., Hein, T., Hohn, B. Merisfematic tissues of maize plants are most suscepnsle to agroinfection with maize streak virus. Bio/Technology. 6 (2), 185-189 (1988).
- Martin, D. P., Rybicki, E. P. Improved efficiency of Zea mays agroinoculation with Maize streak virus. Plant Disease. 84 (10), 1096(2000).
- Martin, D. P., Willment, J. A., Rybicki, E. P. Evaluation of maize streak virus pathogenicity in differentially resistant Zea mays genotypes. Phytopathology. 89 (8), 695-700 (1999).
- Wang, Q., et al. Further characterization of Maize chlorotic mottle virus and its synergistic interaction with Sugarcane mosaic virus in maize. Scientific Reports. 7, 39960(2017).
- Hsieh, M. H., et al. Optimizing virus-induced gene silencing efficiency with Cymbidium mosaic virus in Phalaenopsis flower. Plant Science. 201-202 (1), 25-41 (2013).
- Hsieh, M. H., et al. Virus-induced gene silencing unravels multiple transcription factors involved in floral growth and development in Phalaenopsis orchids. Journal of Experimental Botany. 64 (12), 3869-3884 (2013).
- Zenna, N. S., et al. Genetic analysis of tolerance to rice tungro bacilliform virus in rice (Oryza sativa L.) through agroinoculation. Journal of Phytopathology. 154 (4), 197-203 (2006).
- Marks, M. S., Kemp, J. M., Woolston, C. J., Dale, P. J. Agroinfection of wheat: A comparison of Agrobacterium strains. Plant Science. 63 (2), 247-256 (1989).
- Dasgupta, I., et al. Rice tungro bacilliform virus DNA independently infects rice after Agrobacterium-mediated transfer. Journal of General Virology. 72 (6), 1215-1221 (1991).
- Boulton, M. I., Buchholz, W. G., Marks, M. S., Markham, P. G., Davies, J. W. Specificity of Agrobacterium-mediated delivery of maize streak virus DNA to members of the Gramineae. Plant Molecular Biology. 12 (1), 31-40 (1989).
- Paulsen, A. Q. Purification and properties of foxtail mosaic virus. Phytopathology. 77 (11), 1346(1977).
- Bancroft, J. B., Rouleau, M., Johnston, R., Prins, L., Mackie, G. A. The entire nucleotide sequence of foxtail mosaic virus RNA. Journal of General Virology. 72 (9), 2173-2181 (1991).
- Bruun-Rasmussen, M., Madsen, C. T., Johansen, E., Albrechtsen, M. Revised sequence of foxtail mosaic virus reveals a triple gene block structure similar to potato virus X. Archives of Virology. 153 (1), 223-226 (2008).
- Rouleau, M., Bancroft, J. B., Mackie, G. A. Partial purification and characterization of foxtail mosaic potexvirus RNA-dependent RNA polymerase. Virology. 197 (2), 695-703 (1993).
- Rouleau, M., Smith, R. J., Bancroft, J. B., Mackie, G. A. Purification, properties, and subcellular localization of foxtail mosaic potexvirus 26-kDa protein. Virology. 204 (1), 254-265 (1994).
- Samuels, T. D., et al. Subcellular targeting and interactions among the potato virus X TGB proteins. Virology. 367 (2), 375-389 (2007).
- Cho, S. Y., Kim, K. H. Identification of the capsid protein-binding region of the SL1(+) RNA located at the 5' region of the potato virus X genome. Plant Pathology Journal. 28 (1), 75-80 (2012).
- Mei, Y., Zhang, C., Kernodle, B. M., Hill, J. H., Whitham, S. A. A foxtail mosaic virus vector for virus-induced gene silencing in maize. Plant Physiology. 171 (2), 760-772 (2016).
- Bouton, C., et al. Foxtail mosaic virus: A viral vector for protein expression in cereals. Plant Physiology. 177 (4), 1352-1367 (2018).
- Mei, Y., Liu, G., Zhang, C., Hill, J. H., Whitham, S. A. A sugarcane mosaic virus vector for gene expression in maize. Plant Direct. 3 (8), 00158(2019).
- Gal-On, A., Meiri, E., Huet, H., Hua, W. J., Raccah, B., Gaba, V. Particle bombardment drastically increases the infectivity of cloned DNA of zucchini yellow mosaic potyvirus. Journal of General Virology. 76 (12), (1995).
- Gao, R., et al. Construction of an infectious cDNA clone and gene expression vector of Tobacco vein banding mosaic virus (genus Potyvirus). Virus Research. 169 (1), 276-281 (2012).
- López-Moya, J. J., García, J. A. Construction of a stable and highly infectious intron-containing cDNA clone of plum pox potyvirus and its use to infect plants by particle bombardment. Virus Research. 68 (2), (2000).
- Choi, I. R., French, R., Hein, G. L., Stenger, D. C. Fully biologically active in vitro transcripts of the eriophyid mite-transmitted wheat streak mosaic tritimovirus. Phytopathology. 89 (12), (1999).
- Kim, K. S., et al. Infectivity of in vitro transcripts of Johnsongrass mosaic potyvirus full-length cDNA clones in maize and sorghum. Archives of Virology. 148 (3), 563-574 (2003).
- Stewart, L. R., Bouchard, R., Redinbaugh, M. G., Meulia, T. Complete sequence and development of a full-length infectious clone of an Ohio isolate of Maize dwarf mosaic virus (MDMV). Virus Research. 165 (2), 219-224 (2012).
- Wylie, S. J., et al. ICTV virus taxonomy profile: Potyviridae. Journal of General Virology. 98 (3), 352-354 (2017).
- Shukla, D. D. taxonomy of potyviruses infecting maize, sorghum, and sugarcane in Australia and the United States as determined by reactivities of polyclonal antibodies directed towards virus-specific N-termini of coat proteins. Phytopathology. 79 (2), 223(1989).
- Shukla, D. D., Ward, C. W. Amino Acid sequence homology of coat proteins as a basis for identification and classification of the potyvirus group. Journal of General Virology. 69 (11), 2703-2710 (1988).
- Chung, B. Y. W., Miller, W. A., Atkins, J. F., Firth, A. E. An overlapping essential gene in the Potyviridae. Proceedings of the National Academy of Sciences of the United States of America. 105 (15), 5897-5902 (2008).
- Jarchow, E., Grimsley, N. H., Hohn, B. virF, the host-range-determining virulence gene of Agrobacterium tumefaciens, affects T-DNA transfer to Zea mays. Proceedings of the National Academy of Sciences of the United States of America. 88 (23), 10426-10430 (1991).
- Hu, G., Yalpani, N., Briggs, S. P., Johal, G. S. A porphyrin pathway impairment is responsible for the phenotype of a dominant disease lesion mimic mutant of maize. The Plant Cell. 10 (7), 1095(2007).
- Qin, G., et al. Disruption of phytoene desaturase gene results in albino and dwarf phenotypes in Arabidopsis by impairing chlorophyll, carotenoid, and gibberellin biosynthesis. Cell Research. 17 (5), 471-482 (2007).
- Jones, P. Isolation of plasmid DNA from E. coli. Encyclopedia of Life Sciences. , (2003).
- Ji, Q., Yang, B., Lee, M., Chen, Y., Lübberstedt, T. Mapping of quantitative trait loci/locus conferring resistance to foxtail mosaic virus in maize using the intermated B73-×-Mo17 population. Plant Breeding. 129 (6), 721-723 (2010).
- Pacak, A., et al. The brome mosaic virus-based recombination vector triggers a limited gene silencing response depending on the orientation of the inserted sequence. Archives of Virology. 155 (2), 169-179 (2010).
- Miché, L., Battistoni, F., Gemmer, S., Belghazi, M., Reinhold-Hurek, B. Host-dependent expression of Rhizobium leguminosarum bv. viciae hydrogenase is controlled at transcriptional and post-transcriptional levels in legume nodules. Molecular Plant-Microbe Interactions. 19 (5), 1323-1331 (2018).
- Yamagishi, M., Masuta, C., Suzuki, M., Netsu, O. Peanut stunt virus-induced gene silencing in white lupin (lupinus albus). Plant Biotechnology. 32 (3), 181-191 (2015).
- Avesani, L., et al. Stability of Potato virus X expression vectors is related to insert size: Implications for replication models and risk assessment. Transgenic Research. 16 (5), 587-597 (2007).
- Ali, Z., et al. Efficient virus-mediated genome editing in plants using the CRISPR/Cas9 system. Molecular Plant. 8 (8), 1288-1291 (2015).
- Cody, W. B., Scholthof, H. B., Mirkov, T. E. Multiplexed gene editing and protein overexpression using a tobacco mosaic virus viral vector. Plant Physiology. 175 (1), 23-35 (2017).
- Ali, Z., Eid, A., Ali, S., Mahfouz, M. M. Pea early-browning virus-mediated genome editing via the CRISPR/Cas9 system in Nicotiana benthamiana and Arabidopsis. Virus Research. 244, 333-337 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon