Method Article
組換えフォックステールモザイクウイルスおよびサトウキビモザイクウイルス感染性クローンの注射によるトウモロコシ苗木の直接農業接種
要約
アグロバクテリウムベースの注射(アグロインジェクション)プロトコルは、トウモロコシの苗木にフォックステールモザイクウイルスとサトウキビモザイクウイルスクローンを接種するために提示されています。このようにして接種すると、ウイルス感染、マーカー遺伝子のウイルス誘発遺伝子サイレンシング、およびGFPのウイルス過剰発現がもたらされる。
要約
アグロバクテリウムベースの接種アプローチは、植物組織にウイルスベクターを導入するために広く使用されている。この研究は、ウイルスベクターを保有するアグロバクテリウム菌を用いたメリステマティック組織付近のトウモロコシ苗木の注射のためのプロトコールを詳述する。遺伝子サイレンシングおよび遺伝子発現のために操作された組換えフォックステールモザイクウイルス(FoMV)クローンを使用してこの方法を最適化し、その使用を遺伝子発現用に操作された組換えサトウキビモザイクウイルス(SCMV)を含むように拡大した。目的の遺伝子断片またはコード配列は、バイナリT-DNAプラスミドベクターpCAMBIA1380にクローニングされた改変された感染性ウイルスゲノムに挿入される。得られたプラスミド構築物をアグロバクテリウム・ツメファシエンス株GV3101に形質転換する。生後4日ほどのトウモロコシの苗木は、MgSO4溶液に再懸濁された細菌で鞘窩結節の近くに注射することができる。アグロバクテリウム菌の感染中、ウイルスゲノムを保持するT-DNAはトウモロコシ細胞に転写され、ウイルスRNAゲノムの転写を可能にする。組換えウイルスが植物全体に複製および全身に広がるにつれて、標的遺伝子病変模倣体22(les22)またはフィトエンデサチュラーゼ(pds)のサイレンシングに起因するウイルス症状および表現型変化が葉上で観察され得るか、または緑色蛍光タンパク質(GFP)の発現をUV光または蛍光顕微鏡による照明時に検出することができる。ウイルスを検出し、インサートの完全性を同時に評価するために、注入された植物の葉からRNAを抽出し、挿入された配列を保持するマルチクローニングサイト(MCS)に隣接するプライマーを用いてRT-PCRを行う。このプロトコルは、いくつかのトウモロコシ遺伝子型で効果的に使用されており、他のウイルスベクターに容易に拡張することができ、それによってトウモロコシにおけるウイルスベクター導入のためのアクセス可能なツールを提供する。
概要
多くの植物ウイルスの感染性クローンは、ウイルス誘発性遺伝子サイレンシング(VIGS)、遺伝子過剰発現(VOX)、そして最近ではウイルス対応遺伝子編集(VEdGE)のために操作されている1、2、3、4、5、6、7、8、9、10、11.新しいウイルス構築物が開発されるにつれて、これらの改変されたウイルスで植物組織に首尾よく感染させる方法も考慮されなければならない。植物においてウイルス感染を誘発する現在の方法には、粒子衝突、in vitroRNA転写産物またはDNAクローンの摩擦接種、血管穿刺接種、またはアグロバクテリウム・ツメファシエンス接種(agroinoculation)5、12、13、14、15、16、17が含まれる。.これらの接種方法のそれぞれは、コスト、特殊な装置の必要性、および所与の植物ウイルス系内での実現可能性を含む固有の長所および短所を有する。組換えウイルスを送達するように設計されたバイナリT−DNA構築物を含むアグロバクテリウム株の浸潤または注射を利用する方法は、それらが単純かつ安価であるため好ましい。しかしながら、ゼアメイズ(トウモロコシ)などの単子葉種に対する詳細な農耕接種方法は欠けている。
ウイルス送達のためのアグロシンベーションの最初の報告の1つは、カリフラワーモザイクウイルス(CaMV)のゲノムがT-DNA構築物に挿入され、得られたアグロバクテリウムがこの構築物を運ぶカブ植物にこ接種された1986年に発表された18。それ以来、農業接種のためのさらなる方法が開発されている。例えば、フォックステールモザイクウイルス(FoMV)の場合、ニコチアナ・ベンタミアナは、接種源を提供する葉にウイルス粒子を生成する中間宿主として使用することができる6。感染したN. benthamianaの葉を用いたトウモロコシの摩擦接種は効率的、迅速、かつ単純であるが、中間宿主の使用はすべてのトウモロコシ感染ウイルスに対して機能するわけではない。例えば、サトウキビモザイクウイルス(SCMV)は、N. benthamianaに感染することができず、このウイルスに由来するベクターのための代替接種源の使用を必要とする。1988年、DNAウイルスであるトウモロコシストリークウイルス(MSV)を含むアグロバクテリウム菌を、注射(アグロインジェクション)によりトウモロコシ苗木に導入し、単子葉植物にも有用であるアグロバクテリウムベースの接種方法を実証した19。アグロインジェクションによるこの初期の成功にもかかわらず、トウモロコシにおけるこの技術を利用する研究はほとんど発表されておらず、RNAウイルスおよびVIGS、VOX、およびVEdGEベクターに対するこの方法の適用性について未解決の疑問が残されている20,21,22。しかし、この一般的なアプローチが蘭、米、および小麦で利用されてきたため、単子葉植物種におけるアグロインジェクションの広範な使用は有望である23,24,25,26,27,28。
このプロトコルは、FoMVおよびアグロバクテリウム株GV3101に対して最適化され、SCMVベクターにも適用されている。FoMVは、56種の単子葉植物および双子葉植物種を含む広い宿主範囲を有するポテックスウイルスである29。FoMVは、5つのオープンリーディングフレーム(ORF)から5つの異なるタンパク質をコードする6.2キロベース(kb)ポジティブセンス、一本鎖RNAゲノムを有する30,31,32,33,34,35。FoMVは以前、感染性クローンをT-DNAプラスミド骨格上に組み込むことによってトウモロコシ用のVIGSおよびVOXベクターの両方に開発されました6,36,37。ウイルスゲノムは、コートタンパク質(CP)のすぐ下流にクローニングサイト(MCS1*)を追加することによって、VIGSアプリケーション用に改変されました(図1A)36。VOXおよびVEdGEアプリケーションでは、CPプロモーターを複製し、第2のクローニングサイト(MCS2)を追加して、ORF4とCPの間に目的の配列を挿入できるようにしました(図1B)6。挿入のないMCS1とMCS2の両方を含むFoMVベクトルは、FoMV空のベクトル(FoMV-EV)です(図1)。
SCMVは、トウモロコシのVOX用に開発された無関係のウイルスです38。それはPotyviridae科のメンバーであり、そのうちのいくつかはplanta39,40,41,42,43,44で外来タンパク質を発現するように操作されています。SCMVの宿主範囲にはトウモロコシ、ソルガム、サトウキビ45,46が含まれ、これらの主要な作物植物における遺伝子機能研究にとって有益である36,38。SCMVは、長さ約10 kbのポジティブセンス、一本鎖RNAゲノムを有する47,48。SCMV VOXベクターを作成するために、十分に確立されたP1/HCPro接合を異種配列の挿入部位として利用した38。このクローニング部位に続いて、NIa-Proプロテアーゼ切断部位をコードする配列が続き、SCMVポリタンパク質から独立したタンパク質の産生につながる(図1C)。
これらの組換えウイルスの感染性cDNAを担持したT-DNAプラスミドは、アグロバクテリウム株GV3101に形質転換されている。GV3101はノパリン型株であり、トウモロコシ26、28、49を含む単子葉種にT-DNAを転写できることがよく知られている。さらに、以前のアグロインジェクション研究では、株C58またはその誘導体GV3101、ならびに19、20、22、27が使用されている。
このプロトコルの開発には、3つのマーカー遺伝子が使用されました:2つは遺伝子サイレンシング用、もう1つは遺伝子発現用です。トウモロコシ遺伝子病変模倣体22(les22、GRMZM2G044074)からの329塩基対(bp)断片を用いて、サイレンシングベクターFoMV-LES22を構築した。トウモロコシでles22を沈黙させると、壊死細胞の小さな丸い斑点が葉の血管系に沿って現れ、それが拡大して壊死した葉組織の広い領域に合体する50。FoMV-PDSは、ソルガム遺伝子フィトエンデサチュラーゼ(pds、LOC110436156、トウモロコシpdsに対する96%の配列同一性、GRMZM2G410515)からの313bp断片を含有し、トウモロコシ中のpdsのサイレンシングを誘導し、時間の経過とともに長くなる葉の血管系に沿って光漂白された細胞の小さな縞をもたらす51。緑色蛍光タンパク質(GFP)のインタクトなコード配列を用いて、FoMV(FoMV-GFP)およびSCMV(SCMV-GFP)の両方に対するタンパク質発現を実証した。葉におけるGFP発現は、典型的には、接種後14日目(DPI)において最も検出可能である6。トウモロコシ中のウイルスベクターのアグロインジェクションを利用した以前の研究があったが、これらの実験は、アグロインジェクションがトウモロコシの苗木における感染性クローンからのウイルス感染を促進し、VIGSまたはVOX用途のために設計された組換えウイルスに拡大しないことを示したにすぎない19,20,21,22。ここで提示されたプロトコルは、以前のアグロインジェクション方法、特にGrismleyら19に基づいている。全体として、このアグロインジェクション法はVIGSおよびVOXベクターと互換性があり、接種源として特殊な装置または代替宿主を必要とせず、バイオリスティックスまたはインビトロ転写を必要とする他の一般的な方法と比較して、接種をセットアップおよび実行するために必要な全体的な時間とコストを削減します。このプロトコルは、VIGS、VOX、およびVEdGEを含むアプリケーションによるトウモロコシにおける機能ゲノミクス研究を容易にします。
プロトコル
1. プラスミド構築
注:このプロトコルは、他のウイルスベクターまたは アグロバクテリウム 株に適用することができますが、これはアグロインジェクションによる接種の全体的な成功に影響を与える可能性があります。細菌接種およびめっき工程は、常に層流フード内で行ってください。
- FoMV サイレンシング構造
メモ: Luria-Bertani(LB)メディア(Miller)は、特に指定のない限り、すべてのメディアに使用されます。液体LBは、25gの顆粒を1,000mLの蒸留水に懸濁し、121°Cで15分間オートクレーブ処理することによって作られる。 固体LB培地は、オートクレーブ処理前に1.5%寒天を添加して同様に作製される。LBを〜60°Cに冷却した後に抗生物質を添加し、溶液を95 x 15mmのペトリプレートに注ぐ。使用する抗生物質濃度は、リファンピシン(rif)が25μg/mL、ゲンタマイシン(ジェント)が50μg/mL、カナマイシン(kan)が50μg/mLです。- PCRは、サイレンシングされるトウモロコシ遺伝子からの断片(例えば 、les22 または pds)を 、PacI制限部位を有するフォワードプライマーおよび XbaI制限部位を有するリバースプライマーを用いて増幅する。これにより、アンチセンス配向でFoMV-pCAMBIA1380バイナリベクターのMCS1*に遺伝子断片をライゲーションすることができます。
注: DNA ポリメラーゼの仕様に従って、高忠実度の DNA ポリメラーゼ、それぞれ 10 μM のフォワードプライマーとリバースプライマー、プラスミド DNA テンプレート、および水を使用して PCR をセットアップします。35サイクルの増幅は、DNAポリメラーゼおよびプライマー融解温度(Tm)によるアニーリング温度を用いて、増幅されるキロ塩基あたり30秒伸長とした。 - キットの仕様に従ってPCR精製キットを用いてPCR精製を行う。
- 精製 PCR 産物と FoMV-EV を制限酵素 XbaI および PacI で消化します。1 μg のプラスミドまたはすべての精製 PCR 産物、2 μL の 10 x バッファー、1 μL の制限酵素、および水を加えて 20 μL の最終反応量を作成します。酵素仕様に従ってインキュベートする。
- 消化されたPCR産物およびFoMV-EVをT4 DNAリガーゼと共に、製造業者のプロトコールに従ってライゲートする。
- ライゲーションプラスミドをヒートショック法を用いて化学的に有能な 大腸菌 細胞にDH5αに形質転換する。
- 細胞を氷上で解凍し、3 μLのプラスミドをチューブに加える。氷上で30分間インキュベートし、その後42°Cで30秒間ヒートショックする。
- 氷上に5分間置き、異化抑制(SOC)で200μLの超最適ブロスを加え、 大腸菌 細胞をSOC培地中で225rpmで振とうしながら37°Cで1時間回復させる。
- カナマイシン選択的LB培地上のプレートを、37°Cで一晩インキュベートした。
- FM-5840FおよびFM-6138Rのプライマーを用いたサンガーシークエンシングにより、コロニーの正確なクローンについて確認する(補足表1)。250 ng のプラスミド DNA をサンガーシーケンシングを行う施設に提出します。この実験のために、サンプルはアイオワ州立大学DNAコア施設に送られた。
- 2mLの液体LBを選択したコロニーに接種し、225rpmで振とうしながら37°Cで一晩インキュベートした。アルカリ溶解プラスミドDNA調製物52を介して一晩培養物からプラスミドDNAを抽出する。
- 凍結融解法を用いてプラスミドDNAを アグロバクテリウム 菌株GV3101細胞に形質転換する。100 μL の化学的コンピテントセルを氷上で解凍し、1 ~ 5 μL のプラスミドを加えて氷上で 30 分間インキュベートします。液体窒素中に1分間置き、次いで37°Cで3分間インキュベートする。1mLのSOCを加え、振とうしながら28°Cで2〜3時間回復させ、プレートをrif、gent、およびkan選択的LB培地上に、28°Cで2日間インキュベートする。
- コロニーPCRによるインサートの存在についてコロニーをスクリーニングする。単一の細菌コロニーを選び、それを30μLの水に混ぜる。12.5 μLのポリメラーゼマスターミックス、各10 μMプライマーの1.25 μL、FM-5840FおよびFM-6138R、3 μLの細菌コロニー懸濁液、および最終容量25 μLの水を加えてPCR反応をセットアップします。
- 2〜5mLの液体LB(rif、gent、kan)に正しい アグロバクテリウム コロニーを接種する。225rpmで振とうしながら28°Cで一晩成長させてください。
- 一晩培養物を50%グリセロール溶液と1:1で混合する。長期保存のため-80°Cで保管してください。
- PCRは、サイレンシングされるトウモロコシ遺伝子からの断片(例えば 、les22 または pds)を 、PacI制限部位を有するフォワードプライマーおよび XbaI制限部位を有するリバースプライマーを用いて増幅する。これにより、アンチセンス配向でFoMV-pCAMBIA1380バイナリベクターのMCS1*に遺伝子断片をライゲーションすることができます。
- FoMV 式コンストラクト
- PCRは、1.1.1に記載されているように開始コドンおよび終止コドン(例えばGFP)を含む目的のコード配列を増幅し、フォワードプライマー上の Bsu36I制限部位およびリバースプライマー上の PspOMI制限部位を付加して、MCS2へのセンス配向における指向性クローニングを可能にする。
- キットの仕様に従ってPCR精製キットを用いてPCR精製を行う。
- PCR産物およびFoMV-EVを、1.1.3に記載されているように、制限酵素 Bsu36Iおよび PspOMIで消化する。
- 消化されたPCR産物およびFoMV-EVをT4 DNAリガーゼと共に、製造業者のプロトコールに従ってライゲートする。
- 1.1.5に記載のヒートショック法を用いて化学的に有能な 大腸菌 細胞をDH5αに形質転換する。カナマイシン選択的LB培地上のプレートを、37°Cで一晩インキュベートした。
- プライマー5AmuS2および5AmuA2を用いて1.1.6に記載されるようにサンガーシークエンシングによって正確なクローンについてコロニーをチェックする(補足表1)。
- 2mLの液体LBを選択したコロニーに接種し、225RPMで振とうしながら37°Cで一晩インキュベートする。アルカリ溶解プラスミドDNA調製物52を介して一晩培養物からプラスミドDNAを抽出する。
- プラスミドDNAを、1.1.8に記載の凍結融解法を用いて アグロバクテリウム 株GV3101化学コンピテントセルに形質転換する。プレートをrif、gent、およびkan選択LB培地上に、28°Cで2日間インキュベートする。
- インサートの存在についてコロニーをスクリーニングし、プライマー5AmuS2および5AmuA2を用いたコロニーPCRを行った。
- 2〜5mLの液体LB(rif、gent、kan)に正しい アグロバクテリウム コロニーを接種する。28°Cで225rpmで一晩振る。
- 一晩培養物を50%グリセロール溶液と1:1で混合する。長期保存のため-80°Cで保管してください。
- SCMV 式コンストラクト
- PCRは、フォワードプライマー上の PspOMI消化部位およびリバースプライマー上の SbfI消化部位を含む、1.1.1に記載の終止コドンを除いた目的遺伝子(例えばGFP)を増幅し、SCMV-pCAMBIA1380バイナリーベクターへの指向性クローニングを可能にする。
メモ: インサートは、ウイルスポリタンパク質でフレーム内でクローニングする必要があります。 - キットの仕様に従ってPCR精製キットを用いてPCR精製を行う。
- PCR産物とSCMV-EVを、1.1.3に記載されているように制限酵素 PspOMIおよび SbfIで消化する。
- 消化されたPCR産物およびSCMV-EVをT4 DNAリガーゼと共に、製造業者のプロトコールに従ってライゲートする。
- 1.1.5に記載のヒートショック法を用いて化学的に有能な 大腸菌 細胞に産物を形質転換する。プレートをkan選択的LB培地上に、37°Cで一晩インキュベートした。
- プライマーSC-745FおよびHCProR1を用いて1.1.6に記載されるようなサンガーシークエンシングによって正確なクローンについてコロニーをスクリーニングする(補足表1)。
- 2mLの液体LBを選択したコロニーに接種し、225rpmで振とうしながら37°Cで一晩インキュベートした。アルカリ溶解プラスミドDNA調製物52を通して一晩培養物からプラスミドDNAを抽出する。
- プラスミドDNAを1.1.8に記載の凍結融解法を用いて アグロバクテリウム GV3101株の化学的コンピテントセルに形質転換する。プレートをrif、gent、およびkan選択LB培地上に、28°Cで2日間インキュベートする。
- 1.1.9に記載のプライマーSC-745FおよびHCProR1を用いたコロニーPCRを用いてインサートの存在についてコロニーをスクリーニングする。
- 2〜5mLの液体LB(rif、gent、kan)に正しい アグロバクテリウム コロニーを接種する。28°Cで225rpmで一晩振る。
- 一晩培養物を50%グリセロール溶液と1:1で混合する。長期保存のため-80°Cで保管してください。
- PCRは、フォワードプライマー上の PspOMI消化部位およびリバースプライマー上の SbfI消化部位を含む、1.1.1に記載の終止コドンを除いた目的遺伝子(例えばGFP)を増幅し、SCMV-pCAMBIA1380バイナリーベクターへの指向性クローニングを可能にする。
2. 苗の準備
- 1-2トウモロコシの種子(「ゴールデンバンタム」スイートコーン、FR1064、B73など)を泥炭ベースの栽培培地に、注射の4〜7日前にトレイの内側に置いた小さなインサートに植える。25°Cで16時間下、22°Cで8時間夜(〜185光合成活性放射線(PAR))または温室に22〜25°Cで16時間下および22〜25°Cで8時間夜(350〜400PAR)置く。
注: アグロバクテリウム 菌に対する感受性はトウモロコシの遺伝子型によって異なり、成功率に影響を与えます。さらに、いくつかのウイルスベクターは、特定のトウモロコシ遺伝子型と互換性がない可能性がある。 - 定期的に水をやり、週に1回、15-5-15の液体肥料を330ppm(PPM)で施肥します。
3. アグロバクテリウム菌の調製
- 注射の1日前に、適切な抗生物質(rif、gent、kan)を含むLB液体培地を調製し、所望のウイルス構築物を運ぶ アグロバクテリウム 株を接種する。50 mLのLBに20 μLのグリセロールストックを添加することが推奨され、>100の植物を接種するのに十分な細菌培養物が得られるはずであり、必要に応じてスケールアップまたはスケールダウンすることができる。
注:4〜5匹の植物ごとに600nm(OD600)の光学密度で少なくとも1mLの細菌懸濁液の最終量を有するのに十分な接種剤を調製する。 - 28°Cで225rpmで24時間振る。
- ペレット細菌を室温で4,000 x g で10分間。上清を捨てる。
- ペレットを1 mLの脱イオン(DI)水で十分に洗浄し、ピペッティングまたは穏やかなボルテックス処理を行います。
- ステップ3.3を繰り返して細菌をペレット化する。
- ペレットを1mLの10mM MgSO4溶液にピペッティングまたは穏やかなボルテックス処理によって再懸濁する。
- 任意選択で、200μMアセトシリンゴンを溶液に加える。一般的に使用されるが、アセトシリンゴンは、いくつかの アグロバクテリウム 株の形質転換能力を増強するのみである。著者らは、アセトシリンゴンの添加がこのプロトコールの効率に影響を与えることを見いだしていない(補足表2)。
注:10 mM MgSO4 溶液は、室温で保存されたpHが6.3の1 Mストック溶液から製造することができる。溶液はおそらくpH調整を必要としないでしょう。
- 任意選択で、200μMアセトシリンゴンを溶液に加える。一般的に使用されるが、アセトシリンゴンは、いくつかの アグロバクテリウム 株の形質転換能力を増強するのみである。著者らは、アセトシリンゴンの添加がこのプロトコールの効率に影響を与えることを見いだしていない(補足表2)。
- 分光光度計でサンプルのOD600を測定し、10 mM MgSO4溶液で1.0 OD600に希釈します。
メモ: これは安全な停止点です。細菌懸濁液は、注射前に最大5時間室温に保持することができる。
4. インジェクション
注:生後4〜7日のトウモロコシの苗木を注射に使用することができます。苗の成長速度は、生育条件、PARの量(すなわち、成長室内よりも温室内のPARが高い)、および遺伝子型、とりわけ温室条件での制御が困難なものによって大きく影響される。植物は、葉が拡大していない高さ2〜3cmの場合、生後4日、最下部の丸みを帯びた先端の葉が拡大した場合は7日齢まで注射することができます。この接種方法の成功率は、播種後7日を超えて植物が熟成するにつれて急速に低下する。注射部位は苗の年齢に関係なく同じです。
- 安全ゴーグルを着用し、1mLの使い捨てシリンジに取り付けられた25G x 5/8インチ針を使用して、コアオプチラー節の2〜3mm上の苗に細菌懸濁液を注入する。
注:コレオプティラーノードは、クラウンの根が最終的に形成される場所です。これはプラントの最下位ノードです。通常、ノードとその下で緑色から白色に色が変わります。注入位置は分裂組織のすぐ上にあります。この段階でいくつかの苗を解剖することは、分裂組織の位置を視覚化し、その結果として適切な注射部位を視覚化するのに役立ちます。 - 植物の成長段階に応じて、懸濁液が鞘窩骨を満たすか、渦巻きに見えるまで、シリンジに穏やかな圧力をかけます。これは約100〜200μLの懸濁液である。
注:懸濁液を苗木に注入することが困難な場合、注入部位が低すぎる可能性があります。適度な圧力は、懸濁液を注入するために必要なすべてです。 - すべての苗を注入し、各構築物の注射器と針を交換します。
5. 植物ケアの継続
- 注射した苗を13 x 13 x 15 cm以上の鉢に移植し、生後7〜8日で移植する。
- 成長条件を維持する(16時間の光周期および週に1回の受精)。
6. 感染の確認(表現型およびRT-PCR)
- 表現型的に14〜21DPIの植物をスコアリングする。病変22またはフィトエンデサチュラーゼを模倣する対照遺伝子をサイレンシングすることによる病変は、葉に容易に見ることができ、FoMV症状とは区別される。GFP発現は、蛍光顕微鏡画像化または他のUV光画像化を介して検出することができる。
注:一部のコンストラクト/ウイルスベクターは、症状を示すのに時間がかかる場合や、まったく症状を示さない場合があります。高照度条件は、 病変模倣22 および フィトエンデサチュラーゼのサイレンシングによって引き起こされる表現型を大幅に増加させる。植物が成長室などの低い光条件下で維持されている場合、病変は目立たなくなったり、存在しない可能性がありますが、RT-PCRによって決定された実際の感染率は影響を受けません(表1)。 - 分子的に感染を確認するために、14〜21DPIの間のサンプル葉6を、製造業者の指示に従ってフェノール−クロロホルム抽出を用いて総RNAを抽出した。
- 抽出したRNAを鋳型として用いて、第一鎖cDNAを作製した。
- 最大 5 μg の全 RNA、1 μL のランダム 6 量体プライマー、1 μL のオリゴ (dT)18 個のプライマー、1 μL の dNTP、1 μL の逆転写酵素、および最終容量 14.5 μL の水で cDNA 反応をセットアップします。
- ウイルス構築物用に設計されたプライマーおよびcDNAを鋳型として用いて、各サンプルに対してPCRを行い、ウイルス感染を確認し、1.1.1に記載されているように目的の遺伝子または遺伝子断片の完全性を決定するが、偽陽性を避けるためにFoMVでは25、SCMVでは30サイクルに短縮する。
- FoMVサイレンシングコンストラクトの場合、プライマーFM-5840FおよびFM-6138Rを使用して、トウモロコシ遺伝子断片を含むMCS1*全体で増幅します。FoMV発現構築物の場合、プライマー5AmuS2および5AmuA2を使用して、挿入された遺伝子を含むMCS2全体にわたって増幅する。
- SCMV発現構築物の場合、プライマーSC745-FおよびHCProR1を使用して、挿入された遺伝子を含むMCS全体にわたって増幅する(補足図3)。
- 内因性コントロール遺伝子については、トウモロコシアクチンのmRNA断片を増幅するプライマーZmActSおよび ZmActA (GRMZM2G126010)またはトウモロコシ ポリユビキチン のmRNA断片を増幅するプライマーZmUbiFおよびZmUbiR(GRMZM2G409726_T01)を使用する。
- 核酸染色を含む1%アガロースゲル上でPCR産物を視覚化し、ウイルスおよび遺伝子または遺伝子断片の有無を決定する。
結果
この研究の目的は、遺伝子サイレンシングまたは遺伝子発現用に設計された組換えウイルスをトウモロコシの苗木に直接導入するための簡単なプロトコルを開発することでした(図2)。インサートを運ぶウイルスベクターは、標準的な分子生物学技術を使用して設計およびクローニングされます。サイレンシングのための遺伝子断片をFoMV-EVのMCS1*に挿入し、発現のためのコード配列をMCS2のFoMV-EVまたはMCSのSCMV-EVに挿入する。得られたプラスミドを アグロバクテリウム GV3101株に移す。続いて、トウモロコシの苗木は植え付け後1週間以内に注入される。注射後2週間で、植物は、ウイルス感染、遺伝子サイレンシング、および遺伝子発現について表現型的および分子的に評価することができる。
トウモロコシの植物は泥炭ベースの培地中で4〜7日間栽培される。この段階では、茎頂分裂組織は、鞘翅目節のすぐ上にある(図3A)。鞘翅目が2〜3センチメートル延長した後、または播種後7日まで、植物を鞘翅目節の2〜3mm上に注射する(図3B−F)。注射後約12日で、植物は血管組織の近くで一般的に観察される葉にサイレンシング表現型を示し始め、これらの病変はFoMVウイルスモザイク症状とは視覚的に区別される(図4)。FoMVの存在と標的遺伝子のサイレンシングの両方が、注射された植物において検出可能である(図5)。GFP発現は、蛍光顕微鏡下で注射後2週間で検出することができ、葉5〜7において最も強い(図6)。蛍光イメージングシステム下で観察すると、FoMVからのGFP発現は、血管組織の近くの葉に分布する蛍光の小さな点状領域として視覚化することができ、SCMVからのGFP発現はより大きなパッチからなる(図6、補足図1)。ウイルスモザイク症状は、FoMVサイレンシング構築物に感染した植物にしばしば見られるが、GFPを首尾よく発現しているGFP発現構築物を注射された植物は、しばしばこれらの症状を示さない。その結果、目に見える症状のない植物は、依然としてウイルスおよびGFP発現に対して陽性であり得る。さらに、アグロインジェクション手順中にメリステムを穿刺することは形態学的欠陥を引き起こす可能性があるため避けるべきですが、結果として生じる植物は生き残り、しばしば症候性です(図7)。
このプロトコルはもともとスイートコーンを使用して開発されましたが、いくつかのトウモロコシ近交系は、アグロインジェクションを使用してFoMV遺伝子サイレンシング構築物をうまく接種することができます。例えば、FR1064およびB73は、典型的には、ウイルス感染率が高い(表2)。特に、FoMVに対する既知の遺伝的耐性を有するラインであるMo17は、予想通り0%の感染効率を有していた36,53。さらに、使用される構築物は感染効率に影響する(表3)。FoMVの場合、FoMV-EVおよびFoMV-LES22は、典型的には、それぞれ53%および54%で最も高い感染効率を有する。FoMV-PDSの効率は38%とわずかに低く、FoMV-GFPは17%と最も低い。SCMV-GFPの感染効率は8%である。これらのパーセンテージは、いくつかの実験の平均です。個々の実験は、より高いまたはより低い感染効率を有することができる。
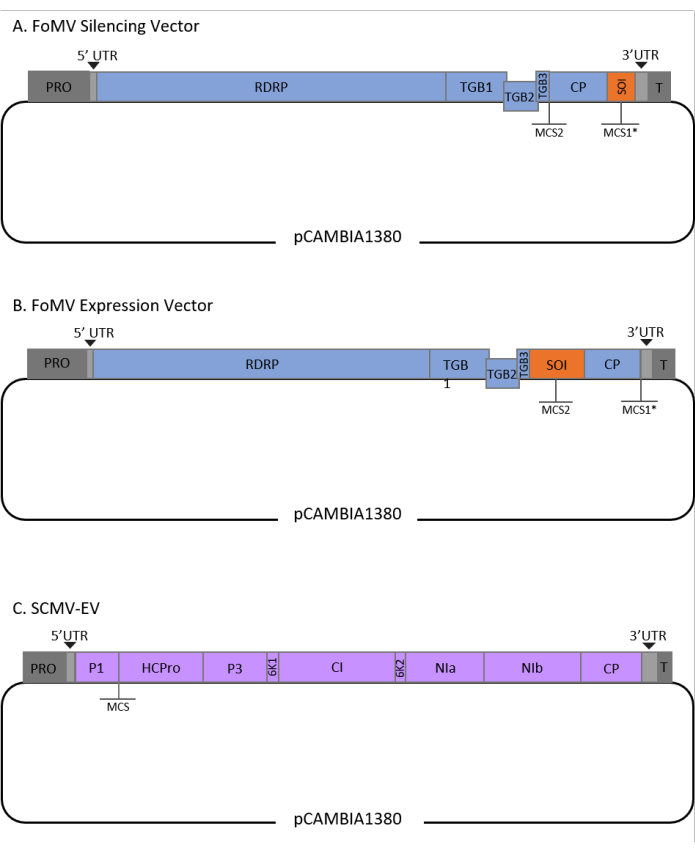
図1:トウモロコシのアグロインジェクションに使用したFoMVおよびSCMV T-DNAクローンの概略図。 FoMVベクターには、2つのマルチクローニングサイト(MCS1*とMCS2)が含まれています。空のベクトル FoMV-EV は 7,269 bp で、どちらの MCS にも挿入物は含まれていません。(A)FoMVベクターを用いた遺伝子サイレンシングは、目的配列(SOI)として指定されるMCS1*に、典型的にはアンチセンス配向で遺伝子断片を挿入することによって達成することができる。(b)FoMVベクターを用いた遺伝子発現は、SOIと称されるセンス配向で遺伝子ORFをMCS2に挿入することによって達成することができる。(C) SCMVベクトルは、P1とHCProの間に1つのMCSを有するように設計されている。空のベクトルSCMV-EVは11,015 bpで、MCSにインサートは含まれていません。SCMVポリタンパク質とインフレームしているMCSに挿入された遺伝子ORFは、タンパク質として発現されるであろう。 この図の拡大版を表示するには、ここをクリックしてください。
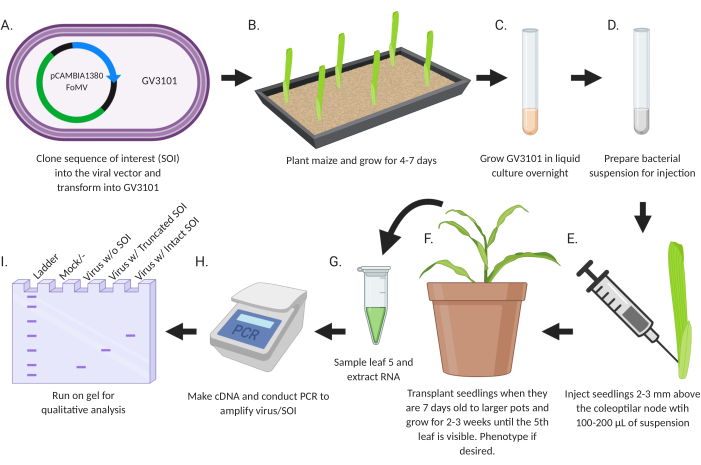
(A)クローンSOI(CDSまたは遺伝子断片のいずれか)をウイルスベクターに組み込み、アグロバクテリウム株GV3101に形質転換する。(B)トウモロコシを植え、4〜7日間成長させる。(C)GV3101を28°Cで一晩液体培養して増殖させる。(E)苗木をコレオプチラー節の上方2〜3mmに100〜200μLの懸濁液で注入する。(F)生後7日経過した苗を大きな鉢に移植し、5枚目の葉が見えるまで2~3週間生育させる。必要に応じて表現型。(g)試料葉5およびRNAを抽出する。(H)ウイルス/SOIを増幅するためにcDNAを作り、PCRを行う。(I)定性分析のためにゲル上で実行し、ウイルスおよび切り詰められたSOIまたは無傷のSOIの存在/不在を決定する。この図は BioRender.com で作成されました。この図の拡大版を表示するには、ここをクリックしてください。

図3:(A)生後4~5日齢の植物を鞘瞼瞼直上の苗に接種するアグロインジェクション法。鞘翅目は完全に拡大され、最初の真の葉は部分的に見えるかもしれないが、広げられていない。(B)生後6~7日齢の植物。最初の葉は広げることができますが、襟は見えません。2枚目の葉も見え、この段階で展開し始めている可能性があります。(c)子窩結節に対する茎頂分裂組織の位置を示す生後6〜7日齢植物の解剖。(D)4〜5日齢の植物の注射。(E)生後6〜7日の植物の注射。(f)色素溶液を用いた6~7日齢の植物体の注射による、苗の渦巻きから出てくる染色された種菌を示す。(g)鞘窩結節に関する生後6〜7日齢の植物の注射部位のクローズアップ。(h)注射後6〜7日齢の植物のクローズアップ、植物の渦巻き内の染色された接種物を示す。この図の拡大版を表示するには、ここをクリックしてください。

図4:アグロインジェクション実験で使用したサイレンシング対照遺伝子の症状。 (A)植物にFoMV-LES22を注射した後、17DPIで撮影された葉。FoMV-LES22は、病変の3' CDSの329 bpインサートをアンチセンス配向で22トウモロコシ遺伝子を 模倣 する。サイレンシングは、毒性代謝産物の蓄積をもたらし、それが次に、血管系に沿って最初に縞として現れ、ここに示すようにより大きなパッチに成長する壊死性病変を引き起こす。(B)植物にFoMV-PDSを注射した後、17DPIで撮影された葉。FoMV−PDSは、ソルガム フィトエンデサチュラーゼ 遺伝子の3'CDSの313塩基対インサートをアンチセンス配向で運ぶ。トウモロコシ中の pds のサイレンシングは、血管系に沿った小さくて細い縞として始まり、ここに示すように葉の長さに沿ってより長い縞に成長する全身性光退色表現型を引き起こす。 この図の拡大版を表示するには、ここをクリックしてください。
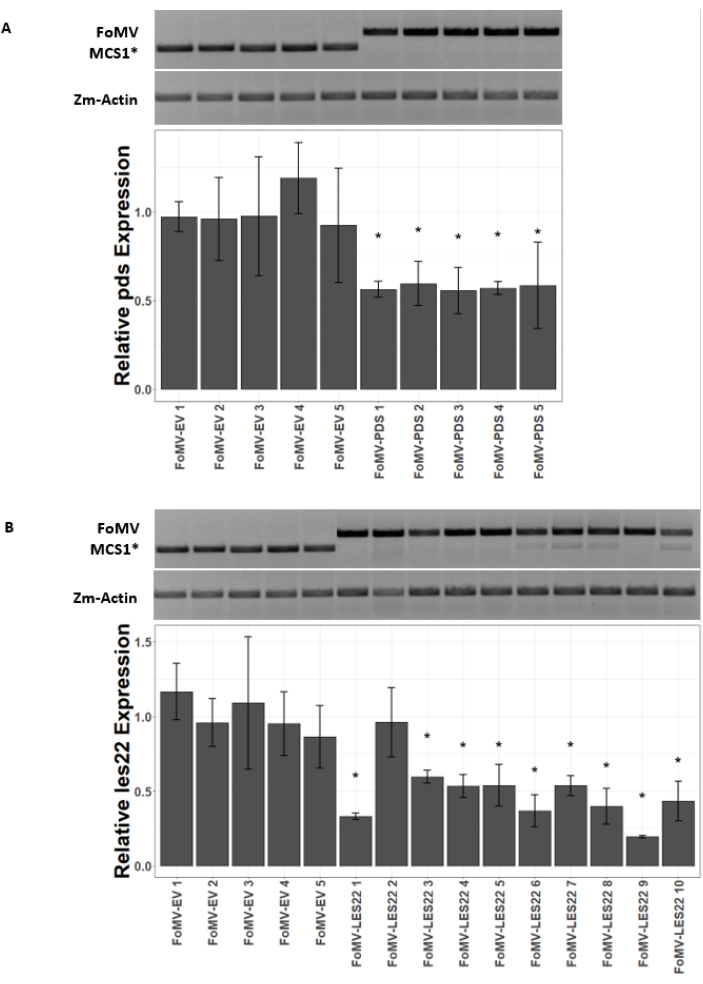
図5:FoMV遺伝子サイレンシング構築物を注射した植物のqRT-PCR。 スイートコーン植物(ゴールデン×バンタム)においてアグロインジェクションを介して送達されるFoMV−LES22およびFoMV−PDS構築物によって誘導される全身性FoMV感染および遺伝子サイレンシングの確認。(A)ゲル画像は、5つの植物の葉6にFoMV-MCS1*空ベクター(315bpアンプリコン)およびFoMV-PDS(625bpアンプリコン)の存在を確認するRT-PCR分析を示しています。使用したPCRプライマーは、MCS1*にまたがるアンプリコンを産生します。トウモロコシ遺伝子アクチン(Zm-Actin)アンプリコンは、参照遺伝子として機能する。棒グラフは、FoMV-MCS1*またはFoMV-PDSによるアグロインジェクションによる接種後37日目(DPI)におけるリーフ6におけるpds発現のqRT-PCR相対発現値を表す。 pds の抑制は、5つの生物学的反復のそれぞれで検出可能である(p = 0.003;ポストホックダネットの検定;エラーバーは3つの技術的反復の標準偏差(SD)を示す)。(B)ゲル画像は、5つの個体植物の葉6におけるFoMV-MCS1*(315bpアンプリコン)の存在を確認するRT-PCR分析を示す。FoMV−LES22(625bpアンプリコン)は、10個の植物について葉6組織(試料FoMV−LES22 1〜5、38DPI)および葉4(試料FoMV−LES22 6〜10、20DPI)において検出された。Zm-アクチンアンプリコンは参照遺伝子として役立った。棒グラフは、FoMV-MCS1*またはFoMV-LES22ウイルス構築物のアグロインジェクションによるトウモロコシ組織におけるles22発現のqRT-PCR相対発現値を表す。Les22抑制は、10回の生物学的反復のうち9回で起こる(p=<0.0001;ポストホック・ダネットの検定;エラーバーは3回の技術的反復のSDを示す)。 この図の拡大版を表示するには、ここをクリックしてください。
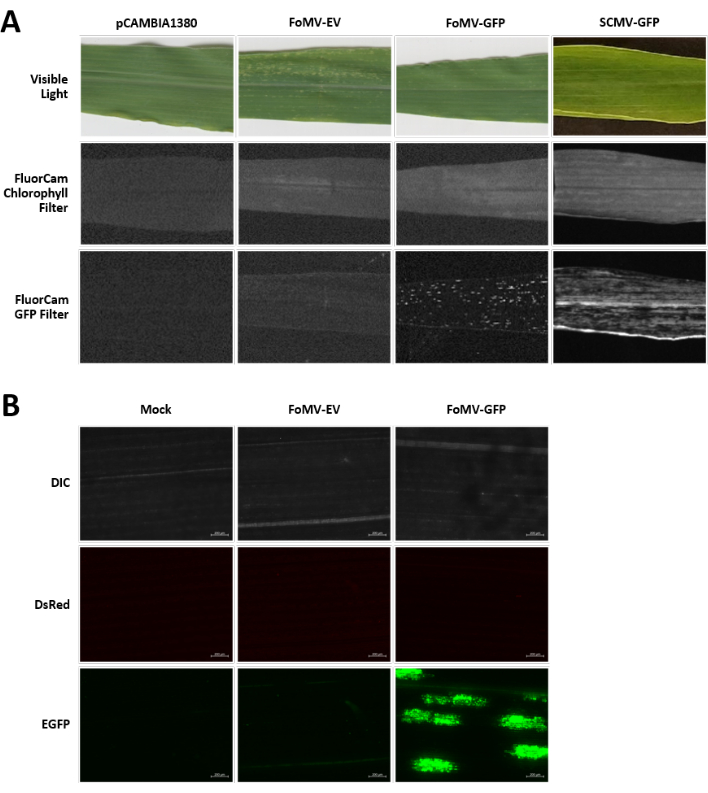
図6.アグロインジェクション実験で用いた各種構築物の表現型。画像化されたすべての植物は、示された構築物を運ぶアグロバクテリウム株GV3101を生後6〜7日齢のときに注射した。画像は16DPIで撮影されました。(A) 可視光におけるpCAMBIA1380(空のプラスミド骨格)、FoMV-EV、FoMV-GFP、SCMV-GFPの葉の症状、250μs暴露時のFluorCamクロロフィルフィルター下、および10ms暴露時のFluorCam GFPフィルター下。(b)模擬処理(MgSO4溶液のみを注入)、FoMV-EV、およびFoMV-GFP注入植物の葉の蛍光顕微鏡観察画像。DIC、DsRed、およびEGFPチャネルが示されており、それぞれ1500msの露光で撮影された。スケール バーは 200 μm です。この図の拡大版を表示するには、ここをクリックしてください。

図7.注射の形態学的効果。 メリステマティック組織への直接注射から生じ得るより重篤な形態学的影響の一例。この傷害は、葉の「細断」および茎の分裂をもたらす可能性がある。 この図の拡大版を表示するには、ここをクリックしてください。
| ウイルス | 成長条件 | 遺伝子型 | # 感染した植物 | 工場総数 | % 感染 | 平均感染率 % |
| フォム-エバー | 成長室 | スイートコーン | 22 | 23 | 96% | 97% |
| B73 · | 18 | 18 | 100% | |||
| B104 · | 20 | 21 | 95% | |||
| 温室 | スイートコーン | 20 | 23 | 87% | 89% | |
| B73 · | 17 | 18 | 94% | |||
| B104 · | 16 | 19 | 84% | |||
| SCMV-EV | 成長室 | スイートコーン | 14 | 21 | 67% | 47% |
| B73 · | 5 | 18 | 28% | |||
| B104 · | 10 | 21 | 48% | |||
| 温室 | スイートコーン | 14 | 23 | 61% | 49% | |
| B73 · | 0 | 19 | 0% | |||
| B104 · | 19 | 22 | 86% |
表1:アグロインジェクション接種効率に対する温室および成長室条件の影響。 種子は、同一の成長条件下で発芽した。発芽した苗木を農業注射し、それらの半分を成長室に移し(25°C 16時間昼光/22°C8時間夜;185PAR)、残りの半分を温室に移した(22-25°C 16時間昼光/22-25°C 8時間夜;350-400PAR)。この表は、RT-PCRによってそれぞれのウイルスに感染していることが確認された植物の数から農地注射された植物の総数で割ったものから計算されたパーセンテージで感染率を報告します。成長室と温室条件の間に感染効率に統計的差はない(FoMV両側t検定p=0.08;SCMV 2両側 t 検定 p=0.96)。
| トウモロコシの遺伝子型 | フォム-エバー | FoMV-LES22 | 合計 | ||||
| 感染 | トータル | 感染率 | 感染 | トータル | 感染率 | 感染率 | |
| スイートコーン | 18 | 23 | 78% | 15 | 23 | 65% | 72% |
| モ47 | 7 | 22 | 32% | 1 | 21 | 5% | 19% |
| K55 · | 1 | 15 | 7% | 3 | 17 | 18% | 13% |
| W64A | 10 | 22 | 45% | 8 | 20 | 40% | 43% |
| モ17 | 0 | 16 | 0% | 0 | 13 | 0% | 0% |
| B73 · | 10 | 18 | 56% | 7 | 17 | 41% | 49% |
| B101 · | 12 | 21 | 57% | 8 | 24 | 33% | 44% |
| FR1064 · | 4 | 4 | 100% | 4 | 4 | 100% | 100% |
| B104 · | 10 | 22 | 45% | 5 | 21 | 24% | 35% |
| WCC22 | 2 | 7 | 29% | 4 | 6 | 67% | 46% |
| A188 · | 0 | 3 | 0% | 4 | 6 | 67% | 44% |
表2:トウモロコシ遺伝子型にわたるFoMV構築物の感染効率。 FoMV-EVおよびFoMV-LES22を11遺伝子型のトウモロコシに栄養注射した。注射後、苗を温室に移した。この表は、RT-PCRによって確認されたFoMVに感染した植物の数から農薬注入された植物の総数で割った値から計算されたパーセントとしての感染率を詳述する。総感染率を合わせた、試験した両方のFoMV構築物に対する各遺伝子型の平均感染率を示す。
| プラントステージ | 4-5日古い植物 | 6-7日古い植物 | 合計 | ||||
| 症候性 | 総工場数 | 感染率 | 症候性 | 総工場数 | 感染率 | 感染率 | |
| フォム-エバー | 42 | 72 | 58% | 80 | 170 | 47% | 53% (A) |
| FoMV-PDS | 65 | 157 | 41% | 66 | 184 | 36% | 39% (BC) |
| FoMV-LES22 | 115 | 195 | 59% | 144 | 292 | 49% | 54% (A B) |
| FoMV-GFP | 16 | 103 | 16% | 37 | 217 | 17% | 16% (C) |
| SCMV-GFP | 10 | 95 | 11% | 5 | 82 | 6% | 8% (C) |
表3:注射実験の概要。 この表は、ゴールデンバンタムスイートコーンの苗木について2017年8月から2018年8月に実施された注射実験の概要を表しています。植物は、視覚的(FoMV-EV、FoMV-PDS、およびFoMV-LES22)またはFluorCam(FoMV-GFPおよびSCMV-GFP)スクリーニングを通じて、ウイルス症状(FoMV-EV)、サイレンシング症状(pdsおよびles22)またはGFP蛍光(GFP)について評価した。生後4~5日齢の植物と生後6~7日の植物について個別に結果を示し、すべての植物年齢にわたる要約も示します。生後4~5日齢の植物と生後6~7日の植物の間に有意差は認められない(一元配置分散分析、F=0.6513)。ウイルス構造(Onaway ANOVA、F=<0.0001)と、Tukey-Kramer HSD接続文字レポートを表す文字との間には違いがあります。
補足表1:このプロトコルで使用されるすべてのプライマー名および配列を列挙した表。この表をダウンロードするには、ここをクリックしてください。
補足表2:アセトシリンゴン試験。 (A)200μMアセトシリンゴン(+)またはアセトシリンゴン(-)を含まない接種懸濁液間の偽、FoMV-EV、およびFoMV-LES22注射植物の症状率を比較する初期アセトシリンゴン試験。(b)アセトシリンゴンを含まない接種懸濁液(-)と、200 μMアセトシリンゴン(+)との接種懸濁液と、最終懸濁液に200 uMアセトシリンゴンを添加するとともに緩衝液に再懸濁する4時間前に20 μMのアセトシリンゴンを添加した(++)間のRT-PCRによって決定されたFoMV-LES22の感染率を比較する。全体として、アセオチシリンゴン治療間に有意差は認められなかった(Oneway ANOVA、f=0.5452)。 この表をダウンロードするには、ここをクリックしてください。
補足図1:アグロインジェクションSCMVの蛍光イメージングと分子検証、トウモロコシにおける異種タンパク質の発現。 トウモロコシを、GFPおよびナノルシフェラーゼ(NLuc)の両方のCDSを含む修飾SCMV構築物をアグロインジェクションした。(A)GFPのスクリーニングおよび検出にフルオーカムイメージングを使用した。左は模擬注入植物であり、右はSCMV-NLucGFP注入植物である。(b)葉タンパク質抽出物をSDS−PAGEによって分離し、NLuc、GFP、およびSCMVコートタンパク質(CP)の存在について、示されたゲル内ルシフェラーゼアッセイまたはイムノブロットによって評価した。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
アグロバクテリウム菌は、植物関連研究における多数の分子生物学技術を容易にする不可欠なツールである。この研究は、VIGSおよびVOX用途のために、FoMVおよびSCMVウイルスベクターをトウモロコシ組織に直接接種するためのアグロインジェクションプロトコルを提供する。主な目標は、単子葉植物の研究のためのウイルスベースの技術の容易さと有用性を高めることです。トウモロコシの直接農業接種はいくつかのウイルスについて報告されているが、著者らは詳細なプロトコルを認識しておらず、これらの研究におけるVIGSおよびVOX適用の例はない19,22。
このプロトコルの開発中に、注射場所がアグロインジェクションを介して全身性ウイルス感染を首尾よく開始するための重要な要素であることが報告され、確認されました19。トウモロコシの苗木におけるメリステムの正確な位置は事実上目では検出できないため、植物に推奨される位置を一貫して注入することが最大の変数であると仮定される。対人差の変動を最小限に抑えるには、トウモロコシの苗木を数本からメリステムまで解剖して、その場所をよりよく視覚化することをお勧めします(図3C)。コレオプチラー節に対する分裂組織の位置は、生後4〜7日齢の植物でほぼ同じであるべきである。さらに、染色された液体で注射を練習することは、「接種剤」が葉の渦巻きをどのように満たすかの目に見えるデモンストレーションを提供し、注射部位が染料でマークされているため、注射部位の精度を裏付けることができる(図3G、H)。メリステマティック組織はアグロインジェクションに対して最も感受性が高いが、 アグロバクテリウム 懸濁液をこの組織に直接注入すると、望ましくない形態学的影響をもたらす(図6)19。損傷した分裂組織を有する植物は生存するが、結果として生じる欠陥は望ましくないので、この組織の直接注入は避けるべきである。
3つの複雑な生物学的系(植物、ウイルス、およびアグロ バクテリウム 株)が協調して相互作用しなければならないため、アグロインジェクションによる全身ウイルス感染の成功に影響を及ぼす可能性のあるいくつかの変数があります。この複雑な相互作用は、メリステマティック領域の急速に分裂する細胞によって支援される可能性があり、農業接種に理想的な場所となっています19。 アグロバクテリウム 株は、ウイルスゲノムを保持するT-DNAを送達するために植物組織の細胞に感染することができなければならず、植物はウイルス複製および全身感染を開始するためにウイルスに感受性でなければならない。トウモロコシの遺伝子型は、ウイルス(例えば、Mo17はFoMVに耐性である)または アグロバクテリウム 株に対する感受性において異なるが、試験された大多数はFoMVおよびSCMVの両方に感受性であるようである(表1 および 表2)53。例えば、近交系株FR1064およびスイートコーン品種ゴールデンバンタムは、GV3101 アグロバクテリウム およびFoMVベースのベクターの両方に特に感受性であり得る。
サンプリングされたリーフ番号とRT-PCRのサンプリングのタイミングは、ウイルス感染の正確な評価に不可欠です。ここに示す例では、葉の数は、最初の丸みを帯びた葉(一般に「親指の葉」として知られている)から始めて、上向きに数えることによって決定された。葉は拡大されるとサンプリングされ、次の葉が出現し始めていました。しかし、どの葉がサンプリングに最適かは、使用するウイルス種、生育条件、トウモロコシの遺伝子型によって異なる場合があります。したがって、このプロトコルを新しいウイルスシステムに適用する場合は、葉とタイミングに関するサンプリング戦略を最適化するために、最初のタイムコース実験をお勧めします。
使用される特定の構造は、このプロトコルの効率に大きく影響します。例えば、空のベクター、FoMV-EVおよびSCMV-EV、ならびにFoMV-PDSおよびFoMV-LES22は、いずれも小さなインサート(それぞれ313bpおよび329bp)を含み、典型的には、これらの実験においてウイルス症状を有する植物の割合が最も高い(表1および表2)。しかし、FoMV-GFPおよびSCMV-GFPにおいてGFP ORF(720bp)のより大きな挿入物を有する組換えウイルスは、空のベクターまたは遺伝子サイレンシング構築物を注射した植物と比較して、はるかに低い感染率を有していた。この傾向は、ウイルスゲノム中の外因性遺伝物質の量の増加によって引き起こされるウイルス適応度への悪影響に起因する可能性がある。いくつかの研究は、植物ウイルスベクターのインサート安定性がインサートサイズおよび配列に大きく依存することを示している36、54、55、56、57。さらに、FoMVまたはSCMVの空のベクターのいずれかを接種した後に感染する植物の割合に顕著な差があり、SCMVに対してこのプロトコルを最適化するために追加の作業が必要であることが示唆された(表1)。これらの結果は、フラグメントの配列と長さの両方が効率に影響を与える可能性があるため、構築物を開発するときに何らかのトラブルシューティングが必要になる可能性があることを示しています。
全体として、この研究は、トウモロコシの苗木のアグロインジェクションが、2つの異なるRNA植物ウイルス、複数のベクター構成、およびトウモロコシの11遺伝子型に対する効果的な接種方法であることを示した。FoMVとSCMVを用いたこの研究は、トウモロコシクロロティック斑点ウイルス(MCMV)またはMSVによる注射を利用した以前の研究と対になって、アグロインジェクションがトウモロコシの苗木にRNAウイルスとDNAウイルスの両方の感染性クローンを接種するのに適していることを示しています19,20,21,22。さらに、この研究は、アグロインジェクションがVIGSおよびVOXベクターの実行可能な方法であり、生後4日という若い植物に適用できることをさらに示しています(表3)。ここで提示されたプロトコルは、一過性遺伝子サイレンシング(VIGS)および過剰発現(VOX)を含む機能的ゲノミクス研究における研究を促進するために、トウモロコシ生物学者によって容易に適応されることが期待される。アグロインジェクションはまた、植物形質転換への依存によって制限されるウイルスベースの遺伝子編集アプローチ(VEdGE)を促進する能力も有しており、編集効率とアクセシビリティを向上させる可能性があります58,59,60。適切なアグロバクテリウム株、トウモロコシの遺伝子型、ウイルスベクターが慎重に組み合わされていることを考えると、アグロインジェクションによる接種はトウモロコシの一過性遺伝子機能解析のための貴重なツールになることが期待されています。
開示事項
研究者は、開示する利益相反はありません。
謝辞
アイオワ州立大学は、DARPAの昆虫同盟プログラムHR0011-17-2-0053をサポートするチームの一部です。この研究は、アイオワ州立大学植物科学研究所、アイオワ州立大学作物生物工学センター、USDA NIFAハッチプロジェクト番号3808、およびアイオワ州基金によっても支援されました。K.L.H.はまた、国立科学財団(DGE #1545453)が資金提供するアイオワ州立大学予測植物フェノミクス大学院トレーニングプログラムと、USDA国立食糧農業研究所からの農業食品研究イニシアチブ助成金番号2019-07318によって部分的に支援されました。資金提供者は、研究とデータの収集、分析、解釈の設計、および原稿の作成において何の役割も果たしていませんでした。本資料に記載されている意見、所見、結論または勧告は、著者のものであり、必ずしも資金提供者の見解を反映するものではありません。
トウモロコシ近交系の種を栽培してくれたニック・ローター(USDA-ARS、エイムズ、IA)、FoMV-GFPクローンの作成に協力してくれたクリスチャン・F・モンテス・セリー(アイオワ州立大学)、技術支援をしてくれたタイラー・オースティン(アイオワ州立大学)に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringes | Fisher Scientific | 14955450 | alternatively, BD 309659 |
| 15 mL Falcon Tubes | Corning Science | 352059 | |
| 1kb+ Ladder | ThermoFisher Scientific | 10787018 | For assessing sizes of PCR products |
| 25G x 5/8" PrecisionGlide Needles | Becton, Dickinson and Company (BD) | 305122 | |
| 28°C Incubator | For Agrobacterium | ||
| 37°C Incubator | For E. coli | ||
| Acetosyringone | MilliporeSigma | D134406 | Optional |
| Agar | MilliporeSigma | A4800 | |
| Agarose | GeneMate | E-3120 | For making gels to check for virus/insert stability |
| Agrobacterium tumefaciens Strain GV3101 | Carries vir plasmid encoding T-DNA transfer machinery, RifR, GmR, from lab stock | ||
| Bsu36I | New England Biolabs | R0524 | |
| cDNA Kit | ThermoFisher Scientific | K1672 | Maxima First Strand cDNA Synthesis Kit with Dnase |
| Chloroform | Fisher Scientific | C298 | For RNA extraction |
| Cuvettes | Fisher Scientific | 14955127 | 1.5 mL |
| D-(+)-Glucose | MilliporeSigma | G7528 | Alkaline Lysis |
| DH5alpha Competent E. coli Cells | New England Biolabs | C2987 | |
| DNA Ligase | ThermoFisher Scientific | K1422 | Rapid DNA Ligation Kit |
| EDTA (Ethylenediamine Tetraacetic Acid, Disodium Salt Dihydrate) | Fisher Scientific | S311 | Alkaline Lysis |
| Ethanol | For RNA extraction | ||
| Fertilizer | Peters Fertilizer 15-15-15 Concentrate | ||
| Flat Inserts | T.O. Plastics | 715357C | For germinating seeds in trays |
| Flats | T.O. Plastics | 710245C | For germinating seeds in trays |
| FluorCam | Photon Systems Instruments | To assess maize plants for GFP expression before microscope | |
| Fluorescence Microscope | |||
| Gel Electrophoresis Box | |||
| Gentamycin Sulfate | Fisher Scientific | BP918 | |
| Glacial Acetate | Fisher Scientific | A38 | Alkaline Lysis |
| Glycerol | Fisher Scientific | G33-500 | For saving frozen stocks of bacteria |
| Go-Taq, 2X | Promega | M7123 | |
| Hydrochloric Acid | Fisher Scientific | A144 | for pHing solutions |
| Isopropanol | Sigma-Aldrich | 109827 | For RNA extraction |
| Kanamycin, Monosulfate | Fisher Scientific | BP906 | |
| Large Pots | Kordlok | SQL0550 | 5x5x4" or bigger. For transplanting seedlings. |
| Luria Bertani (LB) Broth, Miller | Himedia | M1245 | |
| Magnesium Sulfate Heptahydrate | Amresco | 662 | |
| Maize Golden Bantam Sweet Corn Seed | American Meadows, West Coast Seeds | ||
| Maize Inbred Seed | Our seed comes from our institution, but we are not able to provide this for other researchers. | ||
| Maxima H Minus Reverse Transcriptase | ThermoFisher Scientific | EP0753 | |
| MilliQ | Elga | Purelab Ultra | |
| Monarch PCR & DNA Cleanup Kit | New England Biolabs | T1030 | |
| PacI | New England Biolabs | R0547 | |
| Peters Excel 15-5-15 Fertilizer | ICL Specialty Fertilizers | G99140 | |
| Petri Dish, 95 mm x 15 mm | Fisher Scientific | FB0875714G | |
| pH Meter | |||
| Potassium Acetate | Fisher Scientific | P171 | Alkaline Lysis |
| Primers | Our primers were synthesized through our institutional DNA facility or through IDT | ||
| PspOMI | New England Biolabs | R0653 | |
| Q5 High-Fidelity DNA Polymerase | New England Biolabs | M0491 | |
| Rifampicin | EMD Millipore Corp | 557303 | |
| Rnase A | ThermoFisher Scientific | 12091021 | Alkaline Lysis |
| SbfI | New England Biolabs | R0642 | |
| Scale | For weighing chemicals for media or buffers | ||
| SDS (Sodium Dodecyl Sulfate) | Fisher Scientific | BP166 | Alkaline Lysis |
| Sodium Hydroxide | Fisher Scientific | S318 | Alkaline Lysis |
| Soil Substrate | SunGro Horticulture | SS#1-F1P | Sunshine Mix #1/Fafard-1P, any soil mix that maize grows well in is sufficient |
| Spectrophotometer | For measuring OD600 | ||
| Sybr Safe, 10,000X | Invitrogen | S33102 | For making gels to check for virus/insert stability |
| Thermocycler | For PCR | ||
| Tris Base | Fisher Scientific | BP154 | Alkaline Lysis |
| Trizol | Ambion | 15596018 | For RNA extraction |
| Weigh Paper | For weighing chemicals for media or buffers | ||
| XbaI | New England Biolabs | R0145 |
参考文献
- Zaidi, S. E. A., Mansoor, S. Viral vectors for plant genome engineering. Frontiers in Plant Science. 8, 539 (2017).
- Kant, R., Dasgupta, I. Gene silencing approaches through virus-based vectors: speeding up functional genomics in monocots. Plant Molecular Biology. 100, 3-18 (2019).
- Hu, J., et al. A barley stripe mosaic virus-based guide RNA delivery system for targeted mutagenesis in wheat and maize. Molecular Plant Pathology. 20 (10), 1463-1474 (2019).
- Pasin, F., Menzel, W., Daròs, J. A. Harnessed viruses in the age of metagenomics and synthetic biology: an update on infectious clone assembly and biotechnologies of plant viruses. Plant Biotechnology Journal. 17 (6), 1010-1026 (2019).
- Cody, W. B., Scholthof, H. B. Plant virus vectors 3.0: Transitioning into synthetic genomics. Annual Review of Phytopathology. 57 (1), 211-230 (2019).
- Mei, Y., et al. Protein expression and gene editing in monocots using foxtail mosaic virus vectors. Plant Direct. 3 (11), 00181 (2019).
- Ruiz, M. T., Voinnet, O., Baulcombe, D. C. Initiation and maintenance of virus-induced gene silencing. Plant Cell. 10 (6), 937-946 (1998).
- Bekele, D., Tesfaye, K., Fikre, A. Applications of virus induced gene silencing (VIGS) in plant functional genomics studies. Journal of Plant Biochemistry & Physiology. 07 (01), 1000229 (2019).
- Scholthof, H. B., Scholthof, K. B. G., Jackson, A. O. Plant virus gene vectors for transient expression of foreign proteins in plants. Annual Review of Phytopathology. 34 (1), 299-323 (1996).
- Holzberg, S., Brosio, P., Gross, C., Pogue, G. P. Barley stripe mosaic virus-induced gene silencing in a monocot plant. Plant Journal. 30 (3), 315-327 (2002).
- Wang, R., et al. An efficient virus-induced gene silencing vector for maize functional genomics research. Plant Journal. 86 (1), 102-115 (2016).
- Redinbaugh, M. G., et al. Transmission of viral RNA and DNA to maize kernels by vascular puncture inoculation. Journal of Virological Methods. 98 (2), 135-143 (2001).
- Scholthof, H. B. The capsid protein gene of tomato bushy stunt virus is dispensable for systemic movement and can be replaced for localized expression of foreign genes. Molecular Plant-Microbe Interactions. 6 (3), 309 (1993).
- Scholthof, H. B., Scholthof, K. B. G., Kikkert, M., Jackson, A. O. Tomato bushy stunt virus spread is regulated by two nested genes that function in cell-to-cell movement and host-dependent systemic invasion. Virology. 213 (2), 425-438 (1995).
- Scholthof, H. B. Rapid delivery of foreign genes into plants by direct rub-inoculation with intact plasmid dna of a tomato bushy stunt virus gene vector. Journal of Virology. 73 (9), 7823-7829 (1999).
- Zhang, J., et al. Vacuum and co-cultivation agroinfiltration of (germinated) seeds results in tobacco rattle virus (TRV) mediated whole-plant virus-induced gene silencing (VIGS) in wheat and maize. Frontiers in Plant Science. 8, 393 (2017).
- Vaghchhipawala, Z., Rojas, C. M., Senthil-Kumar, M., Mysore, K. S. Agroinoculation and agroinfiltration: simple tools for complex gene function analyses. Methods in Molecular Biology. 678, 65-76 (2011).
- Grimsley, N., Hohn, B., Hohn, T., Walden, R. "Agroinfection," an alternative route for viral infection of plants by using the Ti plasmid. Proceedings of the National Academy of Sciences. 83 (10), 3282-3286 (1986).
- Grimsley, N. H., Ramos, C., Hein, T., Hohn, B. Merisfematic tissues of maize plants are most suscepnsle to agroinfection with maize streak virus. Bio/Technology. 6 (2), 185-189 (1988).
- Martin, D. P., Rybicki, E. P. Improved efficiency of Zea mays agroinoculation with Maize streak virus. Plant Disease. 84 (10), 1096 (2000).
- Martin, D. P., Willment, J. A., Rybicki, E. P. Evaluation of maize streak virus pathogenicity in differentially resistant Zea mays genotypes. Phytopathology. 89 (8), 695-700 (1999).
- Wang, Q., et al. Further characterization of Maize chlorotic mottle virus and its synergistic interaction with Sugarcane mosaic virus in maize. Scientific Reports. 7, 39960 (2017).
- Hsieh, M. H., et al. Optimizing virus-induced gene silencing efficiency with Cymbidium mosaic virus in Phalaenopsis flower. Plant Science. 201-202 (1), 25-41 (2013).
- Hsieh, M. H., et al. Virus-induced gene silencing unravels multiple transcription factors involved in floral growth and development in Phalaenopsis orchids. Journal of Experimental Botany. 64 (12), 3869-3884 (2013).
- Zenna, N. S., et al. Genetic analysis of tolerance to rice tungro bacilliform virus in rice (Oryza sativa L.) through agroinoculation. Journal of Phytopathology. 154 (4), 197-203 (2006).
- Marks, M. S., Kemp, J. M., Woolston, C. J., Dale, P. J. Agroinfection of wheat: A comparison of Agrobacterium strains. Plant Science. 63 (2), 247-256 (1989).
- Dasgupta, I., et al. Rice tungro bacilliform virus DNA independently infects rice after Agrobacterium-mediated transfer. Journal of General Virology. 72 (6), 1215-1221 (1991).
- Boulton, M. I., Buchholz, W. G., Marks, M. S., Markham, P. G., Davies, J. W. Specificity of Agrobacterium-mediated delivery of maize streak virus DNA to members of the Gramineae. Plant Molecular Biology. 12 (1), 31-40 (1989).
- Paulsen, A. Q. Purification and properties of foxtail mosaic virus. Phytopathology. 77 (11), 1346 (1977).
- Bancroft, J. B., Rouleau, M., Johnston, R., Prins, L., Mackie, G. A. The entire nucleotide sequence of foxtail mosaic virus RNA. Journal of General Virology. 72 (9), 2173-2181 (1991).
- Bruun-Rasmussen, M., Madsen, C. T., Johansen, E., Albrechtsen, M. Revised sequence of foxtail mosaic virus reveals a triple gene block structure similar to potato virus X. Archives of Virology. 153 (1), 223-226 (2008).
- Rouleau, M., Bancroft, J. B., Mackie, G. A. Partial purification and characterization of foxtail mosaic potexvirus RNA-dependent RNA polymerase. Virology. 197 (2), 695-703 (1993).
- Rouleau, M., Smith, R. J., Bancroft, J. B., Mackie, G. A. Purification, properties, and subcellular localization of foxtail mosaic potexvirus 26-kDa protein. Virology. 204 (1), 254-265 (1994).
- Samuels, T. D., et al. Subcellular targeting and interactions among the potato virus X TGB proteins. Virology. 367 (2), 375-389 (2007).
- Cho, S. Y., Kim, K. H. Identification of the capsid protein-binding region of the SL1(+) RNA located at the 5' region of the potato virus X genome. Plant Pathology Journal. 28 (1), 75-80 (2012).
- Mei, Y., Zhang, C., Kernodle, B. M., Hill, J. H., Whitham, S. A. A foxtail mosaic virus vector for virus-induced gene silencing in maize. Plant Physiology. 171 (2), 760-772 (2016).
- Bouton, C., et al. Foxtail mosaic virus: A viral vector for protein expression in cereals. Plant Physiology. 177 (4), 1352-1367 (2018).
- Mei, Y., Liu, G., Zhang, C., Hill, J. H., Whitham, S. A. A sugarcane mosaic virus vector for gene expression in maize. Plant Direct. 3 (8), 00158 (2019).
- Gal-On, A., Meiri, E., Huet, H., Hua, W. J., Raccah, B., Gaba, V. Particle bombardment drastically increases the infectivity of cloned DNA of zucchini yellow mosaic potyvirus. Journal of General Virology. 76 (12), (1995).
- Gao, R., et al. Construction of an infectious cDNA clone and gene expression vector of Tobacco vein banding mosaic virus (genus Potyvirus). Virus Research. 169 (1), 276-281 (2012).
- López-Moya, J. J., García, J. A. Construction of a stable and highly infectious intron-containing cDNA clone of plum pox potyvirus and its use to infect plants by particle bombardment. Virus Research. 68 (2), (2000).
- Choi, I. R., French, R., Hein, G. L., Stenger, D. C. Fully biologically active in vitro transcripts of the eriophyid mite-transmitted wheat streak mosaic tritimovirus. Phytopathology. 89 (12), (1999).
- Kim, K. S., et al. Infectivity of in vitro transcripts of Johnsongrass mosaic potyvirus full-length cDNA clones in maize and sorghum. Archives of Virology. 148 (3), 563-574 (2003).
- Stewart, L. R., Bouchard, R., Redinbaugh, M. G., Meulia, T. Complete sequence and development of a full-length infectious clone of an Ohio isolate of Maize dwarf mosaic virus (MDMV). Virus Research. 165 (2), 219-224 (2012).
- Wylie, S. J., et al. ICTV virus taxonomy profile: Potyviridae. Journal of General Virology. 98 (3), 352-354 (2017).
- Shukla, D. D. taxonomy of potyviruses infecting maize, sorghum, and sugarcane in Australia and the United States as determined by reactivities of polyclonal antibodies directed towards virus-specific N-termini of coat proteins. Phytopathology. 79 (2), 223 (1989).
- Shukla, D. D., Ward, C. W. Amino Acid sequence homology of coat proteins as a basis for identification and classification of the potyvirus group. Journal of General Virology. 69 (11), 2703-2710 (1988).
- Chung, B. Y. W., Miller, W. A., Atkins, J. F., Firth, A. E. An overlapping essential gene in the Potyviridae. Proceedings of the National Academy of Sciences of the United States of America. 105 (15), 5897-5902 (2008).
- Jarchow, E., Grimsley, N. H., Hohn, B. virF, the host-range-determining virulence gene of Agrobacterium tumefaciens, affects T-DNA transfer to Zea mays. Proceedings of the National Academy of Sciences of the United States of America. 88 (23), 10426-10430 (1991).
- Hu, G., Yalpani, N., Briggs, S. P., Johal, G. S. A porphyrin pathway impairment is responsible for the phenotype of a dominant disease lesion mimic mutant of maize. The Plant Cell. 10 (7), 1095 (2007).
- Qin, G., et al. Disruption of phytoene desaturase gene results in albino and dwarf phenotypes in Arabidopsis by impairing chlorophyll, carotenoid, and gibberellin biosynthesis. Cell Research. 17 (5), 471-482 (2007).
- Jones, P. Isolation of plasmid DNA from E. coli. Encyclopedia of Life Sciences. , (2003).
- Ji, Q., Yang, B., Lee, M., Chen, Y., Lübberstedt, T. Mapping of quantitative trait loci/locus conferring resistance to foxtail mosaic virus in maize using the intermated B73-×-Mo17 population. Plant Breeding. 129 (6), 721-723 (2010).
- Pacak, A., et al. The brome mosaic virus-based recombination vector triggers a limited gene silencing response depending on the orientation of the inserted sequence. Archives of Virology. 155 (2), 169-179 (2010).
- Miché, L., Battistoni, F., Gemmer, S., Belghazi, M., Reinhold-Hurek, B. Host-dependent expression of Rhizobium leguminosarum bv. viciae hydrogenase is controlled at transcriptional and post-transcriptional levels in legume nodules. Molecular Plant-Microbe Interactions. 19 (5), 1323-1331 (2018).
- Yamagishi, M., Masuta, C., Suzuki, M., Netsu, O. Peanut stunt virus-induced gene silencing in white lupin (lupinus albus). Plant Biotechnology. 32 (3), 181-191 (2015).
- Avesani, L., et al. Stability of Potato virus X expression vectors is related to insert size: Implications for replication models and risk assessment. Transgenic Research. 16 (5), 587-597 (2007).
- Ali, Z., et al. Efficient virus-mediated genome editing in plants using the CRISPR/Cas9 system. Molecular Plant. 8 (8), 1288-1291 (2015).
- Cody, W. B., Scholthof, H. B., Mirkov, T. E. Multiplexed gene editing and protein overexpression using a tobacco mosaic virus viral vector. Plant Physiology. 175 (1), 23-35 (2017).
- Ali, Z., Eid, A., Ali, S., Mahfouz, M. M. Pea early-browning virus-mediated genome editing via the CRISPR/Cas9 system in Nicotiana benthamiana and Arabidopsis. Virus Research. 244, 333-337 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved