Method Article
Rekombinant Foxtail Mozaik Virüs ve Şeker Kamışı Mozaik Virüs Bulaşıcı Klonlar ile Enjeksiyon ile Mısır Fidelerinin Doğrudan Agroinokokülasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Tilki kuyruğu mozaik virüsünün ve şeker kamışı mozaik virüslerinin mısır fidelerine aşılanması için Agrobacterium bazlı enjeksiyon (agroinjection) protokolü sunulmaktadır. Bu şekilde aşılama viral enfeksiyona, belirteç genlerinin virüs kaynaklı gen susturmalarına ve GFP'nin viral aşırı ekspresyonuna yol açar.
Özet
Agrobakteri bazlı aşılama yaklaşımları, viral vektörlerin bitki dokularına sokulduğı için yaygın olarak kullanılmaktadır. Bu çalışma, meristematik dokunun yakınındaki mısır fidelerinin viral bir vektör taşıyan Agrobacterium ile enjeksiyonu için bir protokolü detaylandırmamaktadır. Bu yöntemi optimize etmek için gen susturma ve gen ekspresyöneti için tasarlanmış rekombinant foxtail mozaik virüs (FoMV) klonları kullanıldı ve kullanımı gen ekspresyöneti için tasarlanmış bir rekombinant şeker kamışı mozaik virüsünü (SCMV) içerecek şekilde genişletildi. Gen parçaları veya kodlama ilgi dizileri, ikili T-DNA plazmid vektör pCAMBIA1380 içine klonlanmış modifiye edilmiş, enfeksiyöz bir viral genoma yerleştirilir. Elde edilen plazmid yapılar Agrobacterium tumefaciens strain GV3101'e dönüştürülür. 4 günlük kadar genç mısır fideleri, MgSO4 çözeltisinde yeniden canlanan bakterilerle koleoptiler düğümün yakınına enjekte edilebilir. Agrobacterium ile enfeksiyon sırasında, viral genom taşıyan T-DNA mısır hücrelerine aktarılır ve viral RNA genomunun transkripsiyonuna izin verir. Rekombinant virüs çoğaldıkça ve sistemik olarak bitkinin her kısmına yayıldıkça, hedef genlerin susturılmasından kaynaklanan viral semptomlar ve fenotipik değişiklikler lezyon mimik 22 (les22) veya fitoen desaturaz (pds) yapraklarda gözlenebilir veya UV ışığı veya floresan mikroskopi ile aydınlatıldıktan sonra yeşil floresan protein (GFP) ekspresyonu tespit edilebilir. Virüsü tespit etmek ve kesici ucun bütünlüğünü aynı anda değerlendirmek için, RNA enjekte edilen bitkinin yapraklarından çıkarılır ve RT-PCR, eklenen sırayı taşıyan çoklu klonlama bölgesini (MCS) kuşatan astarlar kullanılarak gerçekleştirilir. Bu protokol birkaç mısır genotipinde etkili bir şekilde kullanılmıştır ve diğer viral vektörlere kolayca genişletilebilir, böylece mısırda viral vektör tanıtımı için erişilebilir bir araç sunar.
Giriş
Birçok bitki virüsünün enfeksiyöz klonları virüs kaynaklı gen susturma (VIGS), gen aşırı ekspresyonu (VOX) ve en son virüs özellikli gen düzenleme (VEdGE)1,2,3,4,5,6,7,8,9,10,11 için tasarlanmıştır. . Yeni viral yapılar geliştikçe, bitki dokularını bu değiştirilmiş virüslerle başarılı bir şekilde enfekte etme yöntemleri de göz önünde bulundurulmalıdır. Bitkilerde virüs enfeksiyonlarını başlatmak için mevcut yöntemler arasında parçacık bombardımanı, in vitro RNA transkriptlerinin veya DNA klonlarının ovma-aşılanması, vasküler delinme infülasyonu veya Agrobakteriyum tumefaciens aşılanması (agroinoculation)5,12,13,14,15,16,17 . Bu aşılama yöntemlerinin her biri, maliyet, özel ekipman ihtiyacı ve belirli bir bitki-virüs sistemi içinde fizibiliteyi içeren doğal avantajlara ve dezavantajlara sahiptir. Rekombinant virüsler sunmak için tasarlanmış ikili T-DNA yapıları içeren Agrobacterium suşlarının sızmasını veya enjeksiyonunu kullanan yöntemler, basit ve ucuz oldukları için tercih edilir. Bununla birlikte, Zea mays (mısır) gibi monokotiledonlu türler için ayrıntılı agroinokomlama yöntemleri eksiktir.
Virüs teslimatı için ilk agroinokokasyon raporlarından biri, karnabahar mozaik virüsünün (CaMV) genomunun bir T-DNA yapısına eklendiği 1986 yılında yayınlandı ve bu yapıyı taşıyan Agrobacterium şalgam bitkilerine ovuldu18. O zamandan beri agroinokülasyon için ek yöntemler geliştirilmiştir. Örneğin, foxtail mozaik virüsü (FoMV) durumunda, Nicotiana benthamiana, inoculum kaynağı sağlayan yapraklarda virüs parçacıkları oluşturmak için bir ara konak olarak kullanılabilir6. Enfekte N. benthamiana yaprakları kullanarak mısırın ovulması verimli, hızlı ve basittir, ancak bir ara konağın kullanımı tüm mısır bulaştıran virüsler için işe yaramaz. Örneğin Şeker Kamışı mozaik virüsü (SCMV), N. benthamiana'yı enfekte edemez ve bu virüsten elde edilen vektörler için alternatif inoculum kaynaklarının kullanılmasını gerektirir. 1988 yılında, bir DNA virüsü olan mısır çizgisi virüsü (MSV) içeren Agrobacterium, enjeksiyon (agroinjeksiyon) ile mısır fidelerine sokuldu ve Agrobakteri bazlı aşılama yöntemlerinin monokotlar için de yararlı olduğunu gösterdi19. Agroinjection ile bu erken başarıya rağmen, mısırda bu tekniği kullanan çok az çalışma yayınlanmıştır ve bu yöntemin RNA virüsleri ve VIGS, VOX ve VEdGE vektörleri için uygulanabilirliği hakkında açık sorular bırakmaktadır20,21,22. Bununla birlikte, monokot türlerinde agroinjeksiyonun geniş kullanımı umut vericidir, çünkü bu genel yaklaşım orkide, pirinç ve buğdayda kullanılmıştır23,24,25,26,27,28.
Bu protokol FoMV ve Agrobacterium strain GV3101 için optimize edilmiştir ve ayrıca bir SCMV vektörüne uygulanmıştır. FoMV, 56 monokot ve dikot türü içeren geniş bir konak aralığına sahip bir potexvirusdur29. FoMV, beş açık okuma çerçevesinden (ORF) beş farklı proteini kodlayan 6,2 kilobase (kb) pozitif duyuya, tek iplikli RNA genomuna sahiptir 30,31,32,33,34,35. FoMV daha önce bir T-DNA plazmid omurgasına bulaşıcı bir klon ekleyerek mısır için hem VIGS hem de VOX vektörü haline geliştirilmiştir6,36,37. Viral genom, kat proteininin (CP) hemen aşağı akışına bir klonlama bölgesi (MCS1*) eklenerek VIGS uygulamaları için değiştirilmiştir (Şekil 1A)36. VOX ve VEdGE uygulamaları için CP promotörü çoğaltıldı ve ORF 4 ile CP (Şekil 1B)6 arasında ilgi çekici dizilerin eklenmesini sağlamak için ikinci bir klonlama sitesi (MCS2) eklendi. Kesici uçsuz hem MCS1 hem de MCS2 içeren FoMV vektörü FoMV boş vektördür (FoMV-EV) (Şekil 1).
SCMV, mısır38'de VOX için geliştirilmiş alakasız bir virüstür. Birkaç üyesi planta39,40,41,42,43,44 yabancı proteinleri ifade etmek için tasarlanmış potyviridae ailesinin bir üyesidir. SCMV'nin konak serisi mısır, sorgum ve şeker kamişi45,46 içerir ve bu da onu bu büyük mahsul bitkilerinde gen fonksiyonel çalışmaları için değerli hale getirir36,38. SCMV pozitif bir duyuya sahiptir, yaklaşık 10 kb uzunluğunda tek iplikli RNA genomuna sahiptir47,48. SCMV VOX vektörü oluşturmak için, köklü P1/HCPro kavşağı heterolog diziler için bir ekleme alanı olarak kullanılmıştır38. Bu klonlama bölgesini, SCMV poliproteinden bağımsız proteinlerin üretimine yol açan bir NIa-Pro proteaz bölünme bölgesini dizi kodlaması takip eder (Şekil 1C).
Bu rekombinant virüslerin enfeksiyöz cDNA'sını taşıyan T-DNA plazmidleri Agrobacterium strain GV3101'e dönüştürülmüştür. GV3101, T-DNA'yı mısır26,28,49 dahil olmak üzere monokotidon türlere aktarabildiği iyi bilinen nopalin tipi bir suşdur. Ek olarak, önceki agroinjeksiyon çalışmalarında C58 veya türevi GV3101 suşlarının yanı sıra 19.20.22.27 suş kullanılmıştır.
Bu protokolün geliştirilmesinde üç belirteç geni kullanılmıştır: ikisi gen susturma ve biri gen ekspresyörü için. Susturma vektörü FoMV-LES22'yi oluşturmak için mısır gen lezyonundan 329 baz-çift (bp) parça 22 (les22, GRMZM2G044074) kullanıldı. Les22 mısırda susturulduğunda, nekrotik doku dokusunun geniş alanlarına genişleyen ve birleşen yaprakların vaskülatları boyunca küçük, yuvarlak nekrotik hücre lekeleri ortaya çıkar50. FoMV-PDS, sorgum gen fitoene desaturazından 313 bp'lik bir parça içerir (pds, LOC110436156, 96% dizi kimliği mısır pds, GRMZM2G410515), mısır pds susturma neden, zaman içinde uzayan yaprakların vaskülat boyunca fotobleached hücrelerin küçük çizgiler neden51. Yeşil floresan protein (GFP) için bozulmamış kodlama dizisi, hem FoMV (FoMV-GFP) hem de SCMV (SCMV-GFP) için protein ekspresyonini göstermek için kullanılmıştır. Yapraklardaki GFP ifadesi genellikle en çok 14 gün sonra aşılama (DPI)6'da algılanabilir. Mısırda viral vektörlerin agroinjeksiyonunu kullanan daha önce çalışmalar olmasına rağmen, bu deneyler sadece agroinjeksiyonun mısır fidelerindeki bulaşıcı bir klondan viral enfeksiyonu kolaylaştırabileceğini ve VIGS veya VOX uygulamaları için tasarlanmış rekombinant virüslere genişlemediğini göstermiştir19,20,21,22. Burada sunulan protokol, özellikle Grismley ve ark.19 olmak üzere önceki agroinjeksiyon yöntemlerine daymaktadır. Genel olarak, bu agroinjeksiyon yöntemi VIGS ve VOX vektörleri ile uyumludur, inoculum kaynakları olarak özel ekipman veya alternatif konaklar gerektirmez ve biyolistik veya in vitro transkripsiyon gerektiren diğer yaygın yöntemlere göre aşıları kurmak ve gerçekleştirmek için gereken genel süreyi ve maliyeti azaltır. Bu protokol, VIGS, VOX ve VEdGE içeren uygulamalarla mısırda fonksiyonel genomik çalışmaları kolaylaştıracaktır.
Protokol
1. Plazmid yapımı
NOT: Bu protokol diğer viral vektörlere veya Agrobakteri suşlarına uygulanabilir, ancak bu agroinjeksiyon ile aşılamanın genel başarısını etkileyebilir. Laminer akış davlumbazında her zaman bakteriyel aşılama ve kaplama adımları uygulayın.
- FoMV susturma yapısı
NOT: Luria-Bertani (LB) medya (Miller), aksi belirtilmedikçe tüm medya için kullanılır. Sıvı LB, 25 g granüllerin 1.000 mL damıtılmış suya asılması ve 121 °C'de 15 dakika boyunca otoklavlanarak yapılır. Katı LB ortam, otomatik kapanmadan önce% 1,5 agar ilavesiyle benzer şekilde yapılır. LB ~60 °C'ye soğutulduktan sonra antibiyotikler eklenir ve çözelti 95 x 15 mm Petri plakalarına dökülür. Kullanılacak antibiyotik konsantrasyonları aşağıdaki gibidir: 25 μg/mL'de rifampicin (rif), 50 μg/mL'de gentamycin (gent) ve 50 μg/mL'de kanamycin (kan).- PCR, susturulacak mısır geninden parçaları (örneğin, les22 veya pds) PacI kısıtlama bölgesine sahip bir ileri astar ve XbaI kısıtlama bölgesine sahip bir ters astar kullanarak güçlendirir. Bu, gen parçalarının antisense yöneliminde FoMV-pCAMBIA1380 ikili vektörün MCS1* içine ligasyonunu sağlayacaktır.
NOT: PCR'yi, DNA polimeraz spesifikasyonlarını izleyerek her biri 10 μM'de yüksek kaliteli DNA polimeraz, ileri ve ters astarlar, plazmid DNA şablonu ve su kullanarak ayarlayın. DNA polimeraz ve astar erime sıcaklığına (Tm) göre bir tavlama sıcaklığı ve yükseltilecek kilobase başına 30 s uzatma kullanarak 35 döngü için güçlendirin. - Kit özelliklerine göre bir PCR saflaştırma kiti kullanarak PCR saflaştırması gerçekleştirin.
- Saflaştırılmış PCR ürününü ve FoMV-EV'yi kısıtlama enzimleri XbaI ve PacI ile sindirin. Enzim spesifikasyonuna göre kuluçkaya yatır.
- Sindirilen PCR ürününü ve FoMV-EV'yi üreticinin protokolüne göre T4 DNA ligaz ile birlikte ligatlayın.
- Isı şoku yöntemini kullanarak ligated plazmidi DH5α kimyasal olarak yetkin E. coli hücrelerine dönüştürün.
- Hücreleri buz üzerinde çözün ve tüpe 3 μL plazmid ekleyin. Buz üzerinde 30 dakika kuluçkaya yaslanın, ardından 42 ° C'de 30 sn ısı şoku.
- 5 dakika boyunca buza yerleştirin, katabolik baskı (SOC) ile 200 μL süper optimal et suyu ekleyin ve E. coli hücrelerinin 225 rpm'de sallanarak 37 ° C'de 1 saat boyunca SOC ortamlarında iyileşmesine izin verin.
- Kanamycin seçici LB ortam üzerinde plaka ve gece boyunca 37 °C'de kuluçkaya yatır.
- FM-5840F ve FM-6138R (Ek Tablo 1) astarlarını kullanarak Sanger dizileme ile kolonileri doğru klonlar için kontrol edin. Sanger dizilimini gerçekleştirecek bir tesise 250 ng plazmid DNA gönderin. Bu deney için örnekler Iowa Eyalet Üniversitesi DNA Çekirdek Tesisi'ne gönderildi.
- Seçilen koloni ile 2 mL sıvı LB aşılayın ve 225 rpm'de sallanarak bir gecede 37 °C'de kuluçkaya yatırın. Alkali lizis plazmid DNA preparası ile gece kültüründen plazmid DNA'sı çıkarın52.
- Dondurma yöntemini kullanarak plazmid DNA'sını Agrobacterium strain GV3101 hücrelerine dönüştürün. 100 μL kimyasal olarak yetkin hücrelerin buzda çözülmesine izin verin, 1-5 μL plazmid ekleyin ve 30 dakika boyunca buz üzerinde kuluçkaya yatın. 1 dakika sıvı nitrojene yerleştirin, ardından 37 °C'de 3 dakika kuluçkaya yatırın. 1 mL SOC ekleyin, titreme ile 28 °C'de 2-3 saat iyileşmeye izin verin, rif, gent ve kan seçici LB ortamlarında plaka ve 2 gün boyunca 28 °C'de kuluçkaya yatırın.
- Koloni PCR ile kesici uç varlığı için ekran kolonileri. Tek bir bakteri kolonisi seçin ve 30 μL suda karıştırın. 12,5 μL polimeraz ana karışımı ekleyerek PCR reaksiyonu ayarlayın, Her 10 μM astarın 1,25 μL'si, FM-5840F ve FM-6138R, 3 μL'si bakteri koloni süspansiyonu ve 25 μL'lik son hacme kadar su.
- Doğru Agrobacterium kolonisi ile 2-5 mL sıvı LB (rif, gent, kan) aşılayın. 28 °C'de gece boyunca 225 rpm'de sallanarak büyümesine izin verin.
- Gece kültürünü% 50 gliserol çözeltisi 1:1 ile karıştırın. Uzun süreli depolama için -80 °C'de saklayın.
- PCR, susturulacak mısır geninden parçaları (örneğin, les22 veya pds) PacI kısıtlama bölgesine sahip bir ileri astar ve XbaI kısıtlama bölgesine sahip bir ters astar kullanarak güçlendirir. Bu, gen parçalarının antisense yöneliminde FoMV-pCAMBIA1380 ikili vektörün MCS1* içine ligasyonunu sağlayacaktır.
- FoMV ifade yapısı
- PCR, 1.1.1'de açıklandığı gibi başlangıç ve durdurma kodonları (örneğin, GFP) dahil olmak üzere ilgi çekici kodlama sırasını güçlendirerek, mcs2'ye yön klonlamayı etkinleştirmek için ileri astara bir Bsu36I kısıtlama sitesi ve ters astarda bir PspOMI kısıtlama sitesi ekler.
- Kitin özelliklerine göre bir PCR saflaştırma kiti kullanarak PCR saflaştırması gerçekleştirin.
- PCR ürününü ve FoMV-EV'yi 1.1.3'te açıklandığı gibi Bsu36I ve PspOMI kısıtlama enzimleriyle sindirin.
- Sindirilen PCR ürününü ve FoMV-EV'yi üreticinin protokolüne göre T4 DNA ligaz ile birlikte ligatlayın.
- 1.1.5'te açıklandığı gibi ısı şoku yöntemini kullanarak DH5α kimyasal olarak yetkin E. coli hücrelerine dönüştürün. Kanamycin seçici LB ortam üzerinde plaka ve gece boyunca 37 °C'de kuluçkaya yatır.
- 5AmuS2 ve 5AmuA2 (Ek Tablo 1) astarlarını kullanarak 1.1.6'da açıklandığı gibi Sanger dizilimi ile kolonileri doğru klonlar için kontrol edin.
- Seçilen koloni ile 2 mL sıvı LB aşılayın ve 225 RPM'de sallanarak bir gecede 37 °C'de kuluçkaya yatırın. Alkali lizis plazmid DNA preparası ile gece kültüründen plazmid DNA'sı çıkarın52.
- Plazmid DNA'sını 1.1.8'de açıklandığı gibi dondurarak çözme yöntemini kullanarak Agrobacterium strain GV3101 kimyasal olarak yetkin hücrelere dönüştürün. Plaka rif, gent ve kan seçici LB ortam ve 28 °C'de 2 gün kuluçkaya yatır.
- Astarları 5AmuS2 ve 5AmuA2 kullanarak koloni PCR ile kesici uç varlığı için ekran kolonileri.
- Doğru Agrobacterium kolonisi ile 2-5 mL sıvı LB (rif, gent, kan) aşılayın. 28 °C'de 225 rpm'de gece boyunca çalkalayın.
- Gece kültürünü% 50 gliserol çözeltisi 1:1 ile karıştırın. Uzun süreli depolama için -80 °C'de saklayın.
- SCMV ifade yapısı
- PCR, ileri astardaki bir PspOMI sindirim bölgesi ve SCMV-pCAMBIA1380 ikili vektörüne yönlü klonlamayı etkinleştirmek için ters astardaki bir SbfI sindirim bölgesi de dahil olmak üzere, 1.1.1'de açıklandığı gibi stop kodonu hariç ilgi genini (örneğin, GFP) güçlendirir.
NOT: Kesici uç viral poliprotein ile çerçevede klonlanmalıdır. - Kitin özelliklerine göre bir PCR saflaştırma kiti kullanarak PCR saflaştırması gerçekleştirin.
- PCR ürününü ve SCMV-EV'yi 1.1.3'te açıklandığı gibi PspOMI ve SbfI kısıtlama enzimleriyle sindirin.
- Sindirilen PCR ürününü ve SCMV-EV'yi üreticinin protokolüne göre T4 DNA ligaz ile birlikte lige edin.
- 1.1.5'te açıklandığı gibi ısı şoku yöntemini kullanarak ürünü DH5α kimyasal olarak yetkin E. coli hücrelerine dönüştürün. Kan seçici LB medyasında plaka ve gece boyunca 37 °C'de kuluçkaya yatırın.
- SC-745F ve HCProR1 (Ek Tablo 1) astarlarını kullanarak 1.1.6'da açıklandığı gibi Sanger dizilimi ile doğru klonlar için ekran kolonileri.
- Seçilen koloni ile 2 mL sıvı LB aşılayın ve 225 rpm'de sallanarak bir gecede 37 °C'de kuluçkaya yatırın. Plazmid DNA'sını bir alkalin lizis plazmid DNA preparatı ile gece kültüründen çıkarın52.
- Plazmid DNA'sını 1.1.8'de açıklandığı gibi donma-çözme yöntemini kullanarak Agrobacterium strain GV3101 kimyasal olarak yetkin hücrelere dönüştürün. Plaka rif, gent ve kan seçici LB ortam ve 28 °C'de 2 gün kuluçkaya yatır.
- 1.1.9'da açıklandığı gibi SC-745F ve HCProR1 astarlarına sahip koloni PCR'li kesici uç varlığı için ekran kolonileri.
- Doğru Agrobacterium kolonisi ile 2-5 mL sıvı LB (rif, gent, kan) aşılayın. 28 °C'de 225 rpm'de gece boyunca çalkalayın.
- Gece kültürünü% 50 gliserol çözeltisi 1:1 ile karıştırın. Uzun süreli depolama için -80 °C'de saklayın.
- PCR, ileri astardaki bir PspOMI sindirim bölgesi ve SCMV-pCAMBIA1380 ikili vektörüne yönlü klonlamayı etkinleştirmek için ters astardaki bir SbfI sindirim bölgesi de dahil olmak üzere, 1.1.1'de açıklandığı gibi stop kodonu hariç ilgi genini (örneğin, GFP) güçlendirir.
2. Fide hazırlığı
- Enjeksiyondan 4-7 gün önce tepsilerin içine yerleştirilen küçük uçlarda turba bazlı yetiştirme ortamına 1-2 mısır tohumu ('Altın Bantam' tatlı mısır, FR1064, B73 vb.) ekin. 25 °C'de (~185 fototiretik olarak aktif radyasyon (PAR)) 16 saatin altında bir büyüme odasına veya 22-25 °C'de (350-400 PAR) 16 saatin altındaki bir seraya yerleştirin.
NOT: Agrobakteriye yatkınlık mısır genotipleri arasında değişerek başarı oranlarını etkiler. Ek olarak, bazı viral vektörler bazı mısır genotipleriyle uyumsuz olabilir. - Su düzenli olarak ve haftada bir kez milyonda 330 parçada (PPM) 15-5-15 sıvı gübre ile döllenir.
3. Agrobakteri preparatı
- Enjeksiyondan bir gün önce, LB sıvı medyayı uygun antibiyotikle (rif, gent, kan) hazırlayın ve istenen viral yapıyı taşıyan Agrobacterium suşu ile aşılayın. 50 mL LB'ye 20 μL gliserol stoğu eklenmesi önerilir, bu da >100 bitki aşılamak için yeterli bakteri kültürü vermelidir ve gerektiğinde yukarı veya aşağı ölçeklendirilebilir.
NOT: Her 4-5 bitki için 1,0'ın 600 nm (OD600) optik yoğunluğunda en az 1 mL'lik son miktarda bakteri süspansiyonu olacak kadar inokülyum hazırlayın. - 24 saat boyunca 28 °C'de 225 rpm'de çalkalayın.
- Oda sıcaklığında 4.000 x g'da 10 dakika boyunca pelet bakterileri. Üstnatant atın.
- Peletin pipetleme veya nazik girdaplama ile 1 mL deiyonize (DI) su ile iyice yıkayın.
- Pellet bakterisi için 3.3.
- Peletin pipetleme veya nazik girdaplama ile 1 mL 10 mM MgSO4 çözeltisinde yeniden depolansın.
- İsteğe bağlı olarak, çözeltiye 200 μM asetosyringone ekleyin. Yaygın olarak kullanılmasına rağmen, asetosyringone sadece bazı Agrobacterium suşlarının dönüşüm yeteneğini arttırır. Yazarlar asetosyringone ilavesinin bu protokoldeki verimliliği etkilediğini bulamamışlardır (Ek Tablo 2).
NOT: Oda sıcaklığında saklanan 6,3 pH'lık 1 M stok çözeltisinden 10 mM MgSO4 çözeltisi yapılabilir. Çözüm muhtemelen pH ayarı gerektirmeyecektir.
- İsteğe bağlı olarak, çözeltiye 200 μM asetosyringone ekleyin. Yaygın olarak kullanılmasına rağmen, asetosyringone sadece bazı Agrobacterium suşlarının dönüşüm yeteneğini arttırır. Yazarlar asetosyringone ilavesinin bu protokoldeki verimliliği etkilediğini bulamamışlardır (Ek Tablo 2).
- Numunenin OD600'ünü spektrofotometre ile ölçün ve 10 mM MgSO4 çözeltisi ile 1.0 OD600'e seyreltin.
NOT: Bu güvenli bir durma noktasıdır. Bakteriyel süspansiyon enjeksiyondan önce oda sıcaklığında 5 saate kadar tutulabilir.
4. Enjeksiyon
NOT: Enjeksiyon için 4-7 günlük mısır fideleri kullanılabilir. Fide büyüme hızı, büyüme koşullarında kontrol edilmesi zor olabilecek diğer şeylerin yanı sıra büyüme koşullarından, PAR miktarından (yani serada büyüme odasından daha yüksek PAR) ve genotipten büyük ölçüde etkilenir. Bitkiler, yaprakları genişletilmedikçe 2-3 cm boyunda ve en alt yuvarlak uçlu yaprak genişletildiğinde 7 gün kadar eski olduklarında 4 günlük kadar genç enjekte edilebilir. Bitkiler ekimden 7 gün sonra yaşlandıkça bu aşılama yöntemlerinin başarı oranı hızla düşer. Enjeksiyon bölgesi, fidelerin yaşı ne olursa olsun aynıdır.
- Güvenlik gözlükleri takarak, bakteri süspansiyonu, 1 mL tek kullanımlık şırıngaya bağlı 25G x 5/8" iğne kullanarak koleoptiler düğümün 2-3 mm yukarısındaki fidelere enjekte edin.
NOT: Coleoptilar düğüm, taç köklerinin sonunda oluşacağı yerdir. Bu, bitkideki en düşük düğümdür. Genellikle, düğümde ve altında yeşilden beyaza bir renk değişikliği olur. Enjeksiyon yeri meristemin hemen üstünde. Bu aşamada birkaç fidenin parçalandırılması, meristemin yerini ve dolayısıyla uygun enjeksiyon bölgesini görselleştirmeye yardımcı olabilir. - Süspansiyon coleoptile'yi doldurana veya bitkilerin büyüme aşamasına bağlı olarak whorl'da görünene kadar şırıngama hafif basınç uygulayın. Bu yaklaşık 100-200 μL süspansiyondur.
NOT: Süspansiyonu fideye enjekte etmek zorsa, enjeksiyon bölgesi çok düşük olabilir. Süspansiyonu enjekte etmek için gereken tek şey orta basınçtır. - Her yapı için şırıngaları ve iğneleri değiştirerek tüm fideleri enjekte edin.
5. Sürekli bitki bakımı
- Enjekte edilen fideleri 7-8 günlükken 13 x 13 x 15 cm veya daha büyük saksılara nakledin.
- Büyüme koşullarını koruyun (haftada bir kez 16 saat fotoperiyod ve gübreleme).
6. Enfeksiyonun onaylanması (Fenotipik ve RT-PCR)
- Fenotipik olarak bitkileri 14-21 DPI arasında puanlar. Kontrol genlerinin susturılmasından kaynaklanan lezyonlar lezyon 22'yi taklit eder veya fitoen desaturaz yapraklarda kolayca görülebilir ve FoMV semptomlarından farklıdır. GFP ekspresyolü floresan mikroskop görüntüleme veya diğer UV ışık görüntüleme ile tespit edilebilir.
NOT: Bazı yapıların/viral vektörlerin semptomları göstermesi daha uzun sürebilir veya herhangi bir semptom göstermeyebilir. Yüksek ışık koşulları, susturma lezyonunun neden olduğu fenotipleri büyük ölçüde arttırır 22 ve fitoen desaturazını taklit eder. Bitkiler büyüme odası gibi daha düşük ışık koşullarında tutulursa lezyonlar daha az görünür veya yok olabilir, ancak RT-PCR tarafından belirlenen gerçek enfeksiyon oranı etkilenmemelidir (Tablo 1). - Enfeksiyonu moleküler olarak doğrulamak için, yaprak 6'yı 14-21 DPI arasında örnekleyin ve üreticinin talimatına göre fenol-kloroform ekstraksiyonu kullanarak toplam RNA'yı çıkarın.
- İlk iplikçikli cDNA oluşturmak için ayıklanan RNA'yı şablon olarak kullanma.
- CDNA reaksiyonunun toplam RNA'sının 5 μg'sine kadar, 1 μL rastgele altıgen astarı, 1 μL oligo (dT)18 astar, 1 μL dNTP, 1 μL ters transkriptaz ve su ile 14,5 μL'lik son hacim için ayarlayın.
- Viral yapı ve cDNA için tasarlanmış astarları şablon olarak kullanarak, viral enfeksiyonu doğrulamak ve 1.1.1'de açıklandığı gibi ilgi çekici gen veya gen parçasının bütünlüğünü belirlemek için her örnekte PCR gerçekleştirin, ancak yanlış pozitifleri önlemek için döngüleri FoMV için 25'e ve SCMV için 30'a düşürün.
- FoMV susturma yapıları için, mısır gen parçasını içeren MCS1* boyunca yükseltmek için FM-5840F ve FM-6138R astarlarını kullanın. FoMV ifade yapıları için, eklenen geni içeren MCS2 boyunca yükseltmek için 5AmuS2 ve 5AmuA2 astarlarını kullanın.
- SCMV ifade yapıları için, eklenen geni içeren MCS boyunca yükseltmek için SC745-F ve HCProR1 astarlarını kullanın (Tamamlayıcı Şekil 3).
- Endojen bir kontrol geni için, mısır akinin mRNA parçasını güçlendiren astarlar ZmActS ve ZmActA 'yı (GRMZM2G126010) veya mısır poliubikininin mRNA parçasını güçlendiren astarlar ZmUbiF ve ZmUbiR'i kullanın (GRMZM2G409726_T01).
- Pcr ürününü, virüs ve gen veya gen parçasının varlığını veya yokluğunu belirlemek için nükleik asit lekesi içeren% 1 agarose jel üzerinde görselleştirin.
Sonuçlar
Bu çalışmanın amacı, gen susturma veya gen ekspresyoz için tasarlanmış rekombinant virüslerin doğrudan mısır fidelerine sokulması için basit bir protokol geliştirmektir (Şekil 2). Kesici uçları taşıyan virüs vektörleri standart moleküler biyoloji teknikleri kullanılarak tasarlanmış ve klonlanmıştır. Susturma için gen parçaları FoMV-EV'de MCS1*'e* ve ifade için kodlama dizileri MCS2'de FoMV-EV'ye veya MCS'de SCMV-EV'ye eklenir. Elde edilen plazmidler Agrobacterium strain GV3101'e aktarılır. Daha sonra, mısır fideleri dikimden sonra bir hafta veya daha kısa bir süre içinde enjekte edilir. Enjeksiyondan iki hafta sonra, bitkiler viral enfeksiyon, gen susturma ve gen ekspresyonu için hem fenotipik hem de moleküler olarak değerlendirilebilir.
Mısır bitkileri 4-7 gün boyunca turba bazlı bir ortamda yetiştirilir. Bu aşamada, çekim apikal meristem coleoptilar düğümün hemen üzerindedir (Şekil 3A). Coleoptile ekimden 7 gün sonrasına kadar 2-3 santimetre veya kadar uzadıktan sonra, bitkiler coleoptilar düğümün 2-3 mm üzerine enjekte edilir (Şekil 3B-F). Enjeksiyondan yaklaşık 12 gün sonra, bitkiler yapraklarında genellikle vasküler dokunun yakınında gözlenen susturma fenotipleri göstermeye başlayacaktır ve bu lezyonlar FoMV viral mozaik semptomlarından görsel olarak farklıdır (Şekil 4). Enjekte edilen bitkilerde hem FoMV varlığı hem de hedef genlerin susturma tespit edilebilir (Şekil 5). GFP ekspresyolü floresan mikroskop altında enjeksiyondan 2 hafta sonra saptenebilir ve 5-7 yapraklarında en güçlüsüdür (Şekil 6). Bir floresan görüntüleme sistemi altında gözlendiğinde, FoMV'den GFP ekspresyonu, vasküler dokunun yakınındaki yapraklara dağılmış floresanların birçok küçük, dakik alanı olarak görselleştirilebilirken, SCMV'den GFP ifadesi daha büyük yamalardan oluşur (Şekil 6, Ek Şekil 1). Viral mozaik semptomları genellikle FoMV susturma yapıları ile enfekte olmuş bitkilerde görülse de, GFP'yi başarıyla ifade eden GFP ifade yapıları ile enjekte edilen bitkiler genellikle bu semptomlara sahip değildir. Sonuç olarak, görünür semptomları olmayan bir bitki virüs ve GFP ekspresy ekspresyüsü için hala pozitif olabilir. Ek olarak, agroinjeksiyon prosedürü sırasında meristemin delinmesi morfolojik kusurlara neden olabileceği için kaçınılmalıdır, ancak ortaya çıkan bitkiler hayatta kalır ve genellikle semptomatiktir (Şekil 7).
Bu protokol başlangıçta tatlı mısır kullanılarak geliştirilmiş olmasına rağmen, birkaç mısır yetiştirilmiş çizgi, agroinjeksiyon kullanılarak FoMV gen susturma yapıları ile başarıyla aşılanabilir. Örneğin, FR1064 ve B73 tipik olarak yüksek viral enfeksiyon oranlarına sahiptir (Tablo 2). Özellikle, FoMV'ye karşı bilinen genetik direnci olan bir çizgi olan Mo17, beklendiği gibi% 0 enfeksiyon verimliliğine sahipti36,53. Ayrıca, kullanılan yapı enfeksiyon verimliliğini etkiler (Tablo 3). FoMV durumunda, FoMV-EV ve FoMV-LES22 tipik olarak sırasıyla% 53 ve% 54 ile en yüksek enfeksiyon verimliliğine sahiptir. FoMV-PDS %38 ile biraz daha düşük bir verimliliğe sahiptir ve FoMV-GFP %17 ile en düşük verimliliktir. SCMV-GFP%8 enfeksiyon verimliliğine sahiptir. Bu yüzdeler birkaç deneyden daha ortalamadır; bireysel deneyler daha yüksek veya daha düşük enfeksiyon verimliliğine sahip olabilir.
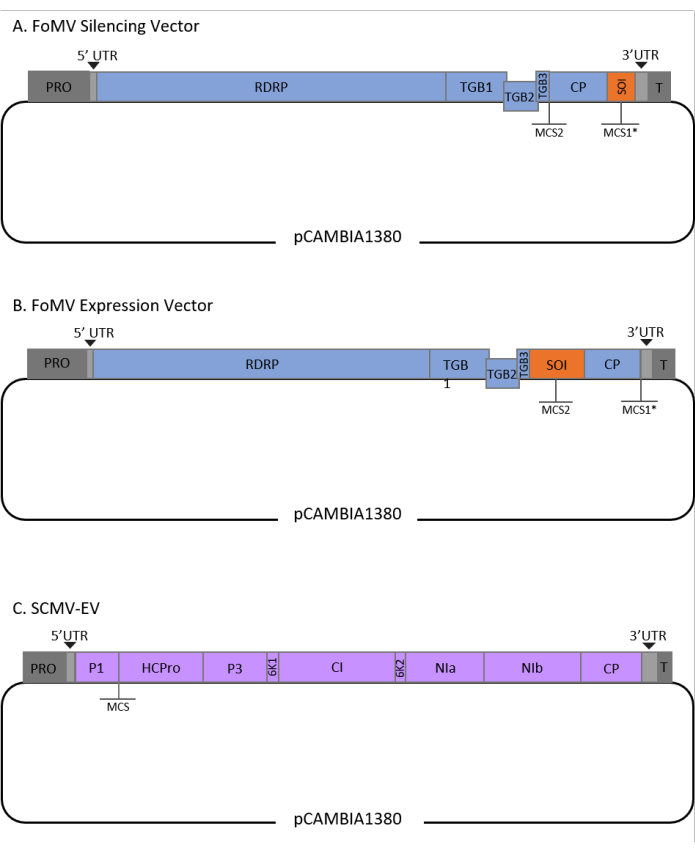
Şekil 1: Mısırda agroinjeksiyon için kullanılan FoMV ve SCMV T-DNA klonlarının şematik gösterimleri. FoMV vektörü iki çoklu klonlama sitesi (MCS1* ve MCS2) içerir. Boş vektör, FoMV-EV, 7.269 bp'dir ve her iki MCS'de de herhangi bir kesici uç içermez. (A) FoMV vektörü kullanılarak gen susturma, genellikle anti-duyu yöneliminde ilgi sırası (SOI) olarak belirlenen MCS1*'e gen parçaları yerleştirilerek elde edilebilir. (B) FoMV vektörü kullanılarak gen ekspresyasyonu, SOI olarak belirlenen duyu yöneliminde MCS2'ye gen ORF'leri yerleştirilerek gerçekleştirilebilir. (C) SCMV vektörü P1 ve HCPro arasında bir MCS'ye sahip olacak şekilde tasarlanmıştır. Boş vektör SCMV-EV, 11.015 bp'dir ve MCS'de herhangi bir kesici uç içermez. SCMV poliprotein ile çerçevede olan MCS'ye yerleştirilen gen ORF'leri protein olarak ifade edilecektir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
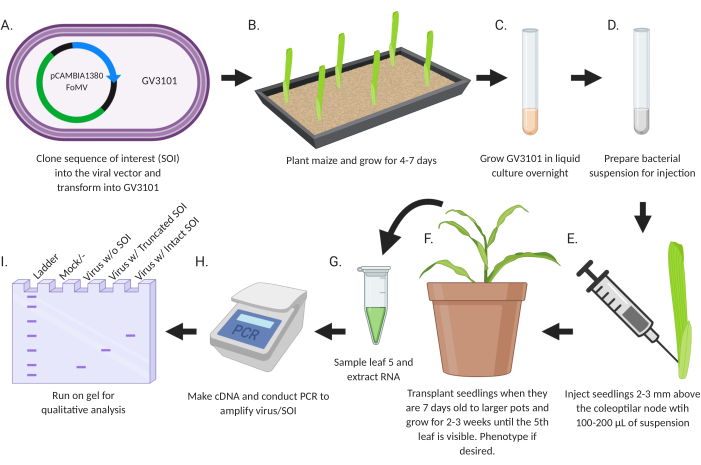
Şekil 2: Agroinjeksiyon protokolünün şematik özeti. (A) CDS veya gen parçası olan SOI'yi viral vektöre klonla ve Agrobacterium strain GV3101'e dönüştür. (B) Mısır ekin ve 4-7 gün boyunca büyüyün. (C) GV3101'i sıvı kültüründe bir gecede 28 °C'de büyütün(D) Enjeksiyon için bakteri süspansiyonu hazırlayın. (E) Fideleri coleoptilar düğümün 2-3 mm yukarısına 100-200 μL süspansiyon ile enjekte edin. (F) Fideleri 7 günlükken daha büyük saksılara nakledin ve 5. yaprak görünene kadar 2-3 hafta büyüyün. İstenirse fenotip. (G) Örnek yaprak 5 ve RNA çıkarın. (H) Virüs/SOI'yi güçlendirmek için cDNA yapın ve PCR yapın. (I) Virüsün varlığını/yokluğunu ve kesilmiş veya bozulmamış bir SOI'yi belirlemek için nitel analiz için jel üzerinde çalıştırın. Bu rakam BioRender.com ile oluşturulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Coleoptile düğümünün hemen üzerindeki fideleri aşılamanın agroinjeksiyon yöntemi. (A) 4-5 günlük eski bitkiler. Koleoptil tamamen genişlemiş ve ilk gerçek yaprak kısmen görülebilir, ancak çözülmez. (B) 6-7 günlük eski bitkiler. İlk yaprak genişletilebilir, ancak hiçbir yaka görünmez. İkinci yaprak da görülebilir ve bu aşamada çözülmeye başlıyor olabilir. (C) Coleoptile düğümü ile ilgili olarak sürgün apikal meristeminin yerini gösteren 6-7 günlük eski bitkilerin diseksiyonu. (D) 4-5 günlük bitkilerin enjeksiyonu. (E) 6-7 günlük bitkilerin enjeksiyonu. (F) Fidenin tüttürmelerinden çıkan boyalı inoculum gösteren bir boya çözeltisi kullanarak 6-7 günlük bitkilerin enjeksiyonu. (G) Koleoptil düğümü ile ilgili olarak 6-7 günlük eski bitkilerin enjeksiyon bölgesinin yakın çekimi. (H) Enjeksiyon sonrası 6-7 günlük bir bitkinin yakın çekimi, bitkinin tübürlerinde boyalı inoculum gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Agroinjeksiyon deneylerinde kullanılan susturma kontrol genlerinin belirtileri. (A) Bitkiye FoMV-LES22 enjekte edildikten sonra 17 DPI'da fotoğraflanan bir yaprak. FoMV-LES22, antisense yöneliminde 22 mısır genini taklit eden lezyonun 3' CDS'inin 329 bp'lik bir eksktini taşır. Susturma toksik bir metabolit birikimi ile sonuçlanır ve bu da ilk olarak vaskülür boyunca çizgiler olarak ortaya çıkan ve burada gösterildiği gibi daha büyük yamalara dönüşen nekrotik lezyonlara neden olur. (B) Bitkiye FoMV-PDS enjekte edildikten sonra 17 DPI'da fotoğraflanan bir yaprak. FoMV-PDS, antisense yöneliminde sorgum fitoene desaturaz geninin 3' CDS'inin 313 baz çifti ekini taşır. Mısırdaki pds'lerin susturülme, burada gösterildiği gibi yaprak uzunluğu boyunca daha uzun çizgilere dönüşen vaskültür boyunca küçük, ince çizgiler olarak başlayan sistemik bir fotobleaching fenotipine neden olur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
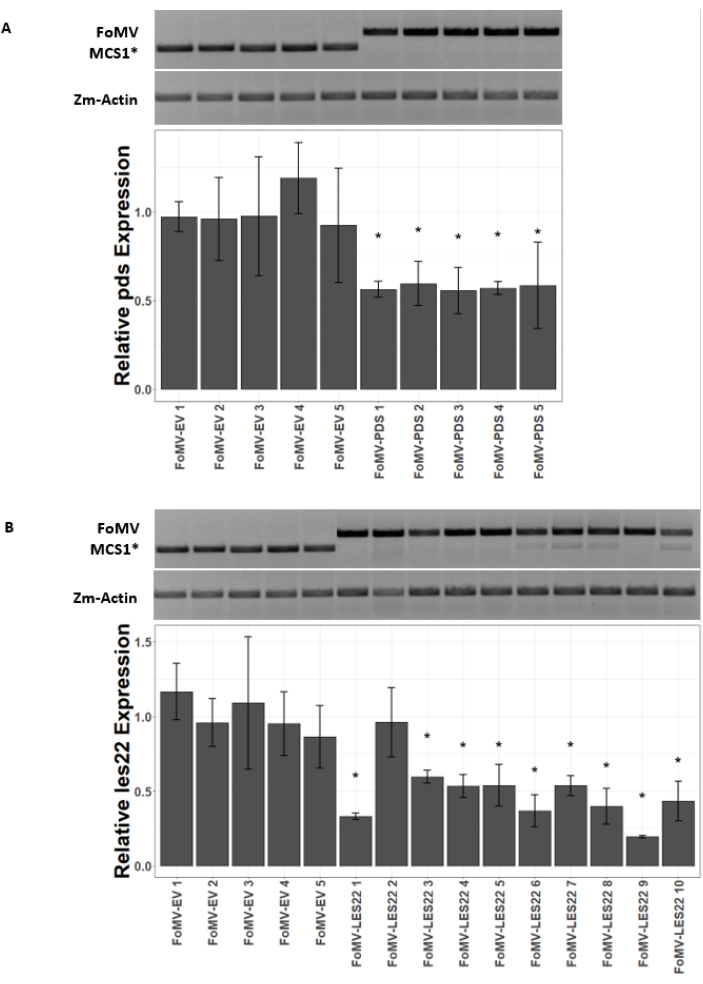
Şekil 5: FoMV gen susturma yapıları ile enjekte edilen bitkilerin qRT-PCR'si. Tatlı mısır bitkilerinde agroinjeksiyon yoluyla teslim edilen FoMV-LES22 ve FoMV-PDS yapılarının neden olduğu sistemik FoMV enfeksiyonu ve gen susturma teyidi (Altın x Bantam). (A) Jel görüntüler, beş ayrı bitkinin 6. Kullanılan PCR astarları MCS1* yayılan bir amplicon üretir. Mısır gen aktini (Zm-Actin) amplicon referans gen görevi görür. Çubuk grafik, FoMV-MCS1* veya FoMV-PDS ile agroinjection tarafından 37 gün sonrası aşılama (DPI) yaprak 6'da pds ifadesi için qRT-PCR göreli ifade değerlerini temsil eder. Pds'nin bastırılması beş biyolojik yinelemenin her birinde tespit edilebilir (p=0.003; post hoc Dunnett'in testi; hata çubukları üç teknik yinelemenin standart sapması (SD) gösterir). (B) Jel görüntüler, beş ayrı bitkinin 6. On ayrı bitki için yaprak 6 dokuda (FoMV-LES22 1-5, 38 DPI örnekleri) ve yaprak 4'te (FoMV-LES22 6-10, 20 DPI örnekleri) FoMV-LES22 (625 bp amplicon) saptadı. Zm-Actin amplicon referans gen olarak hizmet etti. Çubuk grafik, FoMV-MCS1* veya FoMV-LES22 viral yapılarının agroinjeksiyon ile mısır dokularında les22 ekspresyonu için qRT-PCR göreli ifade değerlerini temsil eder. Les22 bastırma 10 biyolojik kopyanın 9'unda meydana gelir (p=<0.0001; post hoc Dunnett'in testi; hata çubukları üç teknik kopya için SD'ye işaret eder). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
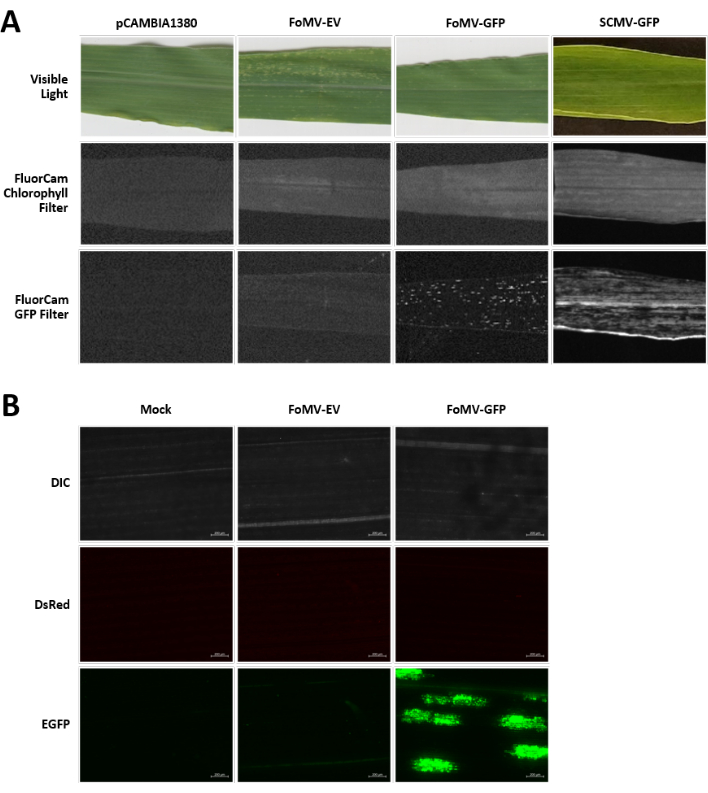
Şekil 6. Agroinjeksiyon deneylerinde kullanılan çeşitli yapıların fenotipleri. Tüm görüntülenmiş bitkiler 6-7 günlükken belirtilen yapıları taşıyan Agrobacterium strain GV3101 ile enjekte edildi. Görüntüler 16 DPI'da çekildi. (A) pCAMBIA1380 yaprak belirtileri (boş plazmid omurga), FoMV-EV, FoMV-GFP ve SCMV-GFP görünür ışıkta, FluorCam klorofil filtresi altında 250 μs maruziyette ve FluorCam GFP filtresi altında 10 ms maruz kalmada. (B) Sahte işlem görmüş yaprakların floresan mikroskopi görüntüleri (sadece MgSO4 çözeltisi ile enjekte edilir), FoMV-EV ve FoMV-GFP enjekte edilen bitkiler. DIC, DsRed ve EGFP kanalları gösterilir ve her biri 1500 ms pozlamada alınır. Ölçek çubuğu 200 μm'dir . Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 7. Enjeksiyonun morfolojik etkileri. Doğrudan meristematik dokuya enjeksiyondan ortaya çıkabilecek daha şiddetli morfolojik etkilere bir örnek. Bu yaralanma yaprakların "parçalanmasına" ve gövdenin bölünmesine neden olabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Virüs | Büyüme Koşulları | Genotip | # Enfekte Bitkiler | Bitkilerin Toplam Sayısı | Enfeksiyon Yüzdesi | Enfeksiyonun Ort Yüzdesi |
| FoMV-EV | Büyüme Odası | Tatlı Mısır | 22 | 23 | 96% | 97% |
| B73 | 18 | 18 | 100% | |||
| B104 | 20 | 21 | 95% | |||
| Sera | Tatlı Mısır | 20 | 23 | 87% | 89% | |
| B73 | 17 | 18 | 94% | |||
| B104 | 16 | 19 | 84% | |||
| SCMV-EV | Büyüme Odası | Tatlı Mısır | 14 | 21 | 67% | 47% |
| B73 | 5 | 18 | 28% | |||
| B104 | 10 | 21 | 48% | |||
| Sera | Tatlı Mısır | 14 | 23 | 61% | 49% | |
| B73 | 0 | 19 | 0% | |||
| B104 | 19 | 22 | 86% |
Tablo 1: Sera ve büyüme odası koşullarının agroinjeksiyon aşılama verimliliğine etkisi. Tohumlar aynı büyüme koşullarında çimlendi. Çimlenmiş fideler agroinjected ve yarısı bir büyüme odasına taşındı (25 °C 16 h gün ışığı / 22C 8 h gece; 185 PAR) ve diğer yarısı bir seraya taşındı (22-25 °C 16 h gün ışığı / 22-25 °C 8 saat gece; 350-400 PAR). Bu tablo, RT-PCR tarafından ilgili virüsle enfekte olduğu doğrulanan bitki sayısından hesaplanan enfeksiyon oranını, toplam agroinjected bitki sayısına bölünerek yüzde olarak raporlar. Büyüme odası ve sera koşulları arasında enfeksiyon verimliliğinde istatistiksel bir fark yoktur (FoMV iki kuyruklu t-test p=0.08; SCMV iki kuyruklu t-test p=0.96).
| Mısır Genotipi | FoMV-EV | FoMV-LES22 | Birleşik Toplam | ||||
| Enfekte | Toplam | Virüslü % | Enfekte | Toplam | Virüslü % | Virüslü % | |
| Tatlı Mısır | 18 | 23 | 78% | 15 | 23 | 65% | 72% |
| MO47 | 7 | 22 | 32% | 1 | 21 | 5% | 19% |
| K55 | 1 | 15 | 7% | 3 | 17 | 18% | 13% |
| W64A | 10 | 22 | 45% | 8 | 20 | 40% | 43% |
| MO17 | 0 | 16 | 0% | 0 | 13 | 0% | 0% |
| B73 | 10 | 18 | 56% | 7 | 17 | 41% | 49% |
| B101 | 12 | 21 | 57% | 8 | 24 | 33% | 44% |
| FR1064 | 4 | 4 | 100% | 4 | 4 | 100% | 100% |
| B104 | 10 | 22 | 45% | 5 | 21 | 24% | 35% |
| WCC22 | 2 | 7 | 29% | 4 | 6 | 67% | 46% |
| A188 | 0 | 3 | 0% | 4 | 6 | 67% | 44% |
Tablo 2: Mısır genotipleri genelinde FoMV yapılarının enfeksiyon verimliliği. FoMV-EV ve FoMV-LES22 11 genotip mısıra dahil edildi. Enjeksiyondan sonra fideler seraya taşındı. Bu tablo, RT-PCR tarafından doğrulanan FoMV ile enfekte olan bitki sayısından hesaplanan enfeksiyon oranının toplam agroinjected bitki sayısına bölünmesiyle açıklanmıştır. Toplam enfeksiyon oranı, test edilen her iki FoMV yapısı için her genotipin ortalama enfeksiyon oranlarını göstermektedir.
| Bitki Aşaması | 4-5 Günlük Bitkiler | 6-7 Günlük Bitkiler | Birleşik Toplam | ||||
| Semptomatik | Toplam Bitki Sayısı | Virüslü % | Semptomatik | Toplam Bitki Sayısı | Virüslü % | Virüslü % | |
| FoMV-EV | 42 | 72 | 58% | 80 | 170 | 47% | %53 (A) |
| FoMV-PDS | 65 | 157 | 41% | 66 | 184 | 36% | %39 (B C) |
| FoMV-LES22 | 115 | 195 | 59% | 144 | 292 | 49% | %54 (A B) |
| FoMV-GFP | 16 | 103 | 16% | 37 | 217 | 17% | %16 (C) |
| SCMV-GFP | 10 | 95 | 11% | 5 | 82 | 6% | %8 (C) |
Tablo 3: Enjeksiyon deneylerinin özeti. Bu tablo, Golden Bantam tatlı mısır fideleri üzerinde Ağustos 2017'den Ağustos 2018'e kadar yapılan enjeksiyon deneylerinin bir özetini temsil ediyor. Bitkiler viral semptomlar (FoMV-EV), susturma semptomları (pds ve les22) veya GFP floresan (GFP) için görsel (FoMV-EV, FoMV-PDS ve FoMV-LES22) veya FluorCam (FoMV-GFP ve SCMV-GFP) taraması için değerlendirildi. Sonuçlar, 4-5 günlük bitkiler ve 6-7 günlük bitkiler için ayrı ayrı ve tüm bitki yaşlarında bir özet olarak gösterilmiştir. 4-5 günlük bitkiler ile 6-7 günlük bitkiler arasında anlamlı bir fark yoktur (Tek yönlü ANOVA, F=0.6513). Tukey-Kramer HSD bağlantı harfleri raporunu temsil eden harflerle viral yapı (Onaway ANOVA, F=<0.0001) arasında fark vardır.
Ek Tablo 1: Bu protokolde kullanılan tüm astar adlarını ve dizilerini listeleyen tablo. Bu Tabloyu indirmek için lütfen tıklayınız.
Ek Tablo 2: Asetosyringone testi. (A) İlk asetosyringon testi, mock semptomlarının oranlarını karşılaştırarak, FoMV-EV ve FoMV-LES22 enjekte edilen bitkiler, 200 μM asetosyringonlu (+) veya asetosyringone (-) olmayan aşılama süspansiyonları arasında. (B) Asetosyringon içermeyen aşılama süspansiyonları (-), 200 μM asetosyringon (+) ve ilave ile RT-PCR tarafından belirlenen FoMV-LES22 enfeksiyon oranlarını karşılaştırma tamponda yeniden canlanmadan 4 saat önce bakteri kültürüne 20 μM asetosyringon ve son süspansiyona 200 uM asetosyringon eklenmesi (++). Genel olarak, aseotysyringone tedavileri arasında anlamlı bir fark bulunmadı (Oneway ANOVA, f=0.5452). Bu Tabloyu indirmek için lütfen tıklayınız.
Ek Şekil 1: Agroinjected SCMV'nin floresan görüntüleme ve moleküler doğrulaması ve mısırda heterolog proteinlerin ekspresyolü. Mısır, hem GFP CDS'lerini hem de nano luciferaz (NLuc) içeren değiştirilmiş bir SCMV yapısı ile agroinjected edildi. (A) GFP'nin taranması ve tespiti için florkam görüntüleme kullanıldı. Sol sahte enjekte edilmiş bir bitkidir ve sağ SCMV-NLucGFP enjekte edilmiş bitkidir. (B) Yaprak proteini özleri SDS-PAGE ile ayrıldı ve NLuc, GFP ve SCMV kat proteininin (CP) varlığı için in-jel luciferaz tahlil veya immünoblot ile değerlendirildi. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Agrobakteri, bitki ile ilgili araştırmalarda çok sayıda moleküler biyoloji tekniğini kolaylaştıran önemli bir araçtır. Bu çalışma, FoMV ve SCMV viral vektörlerini VIGS ve VOX uygulamaları için doğrudan mısır dokularına aşılamak için bir agroinjeksiyon protokolü sunmaktadır. Temel amaç, monokot mahsul bitkilerinde araştırma için virüs tabanlı teknolojilerin kolaylığını ve faydasını artırmaktır. Mısırın doğrudan agroinokomasyonu birkaç virüs için bildirilmiş olsa da, yazarlar ayrıntılı bir protokolden haberdar değildir ve bu çalışmalarda VIGS ve VOX uygulamalarına örnek yoktur19,22.
Bu protokol geliştirilirken, enjeksiyon yerinin agroinjection19 yoluyla sistemik bir viral enfeksiyonu başarıyla başlatmak için önemli bir faktör olduğu bildirilmiştir ve doğrulanmıştır. Bitkiye önerilen konumun sürekli olarak enjekte edilmesi en büyük değişken olarak kabul edilir, çünkü mısır fidelerindeki meristemin tam konumu gözle neredeyse tespit edilemez. Kişilerarası varyasyonu en aza indirmek için, konumunu daha iyi görselleştirmek için birkaç mısır fidesini meristem'e kadar parçalamanız önerilir (Şekil 3C). Meristem'in coleoptilar düğüme göre konumu, 4-7 günlük bitkiler için kabaca aynı olmalıdır. Ek olarak, boyalı bir sıvı ile enjeksiyon uygulamak, "inoculum"un yaprak whorl'u nasıl doldurduğuna dair kolayca görülebilir bir gösteri sağlar ve enjeksiyon bölgesi boya ile işaretlendiği için enjeksiyon bölgesinin doğruluğu doğrulanabilir (Şekil 3G, H). Meristematik dokular agroinjeksiyona en duyarlı dokulardır, ancak Agrobakteri süspansiyonlarının doğrudan bu dokuya enjekte etmesi istenmeyen morfolojik etkilere neden olur (Şekil 6)19. Hasarlı meristemlere sahip bitkiler hayatta kalır, ancak ortaya çıkan kusurlar istenmez ve bu nedenle bu dokunun doğrudan enjeksiyonundan kaçınılmalıdır.
Agroinjeksiyon yoluyla sistemik viral enfeksiyonun başarılı bir şekilde başlatılmasını etkileyebilecek çeşitli değişkenler vardır, çünkü üç karmaşık biyolojik sistem (bitki, virüs ve Agrobakteri suşu) eşgüdüm içinde etkileşime girmelidir. Bu karmaşık etkileşim, meristematik bölgenin hızla bölünen hücreleri tarafından yardımcı olabilir ve bu da onu agroinokoklama için ideal bir yer haline getirir19. Agrobacterium suşu, viral genom taşıyan T-DNA'sını sağlamak için bitki dokularının hücrelerini enfekte edebilmeli ve viral replikasyon ve sistemik enfeksiyonu başlatmak için bitki virüse karşı duyarlı olmalıdır. Mısır genotipleri virüslere (örneğin, Mo17 FoMV veya Agrobakteri suşlarına karşı dirençlidir) duyarlılıklarında farklılık gösterir, ancak test edilen çoğunluğun hem FoMV hem de SCMV'ye (Tablo 1 ve Tablo 2)53'e duyarlı olduğu görülmektedir. Örneğin, fr1064 inbred hattı ve tatlı mısır çeşidi Golden Bantam hem GV3101 Agrobacterium hem de FoMV tabanlı vektörlere karşı özellikle hassas olabilir.
Örnek alınan yaprak numarası ve RT-PCR için örnekleme zamanlaması viral enfeksiyonun doğru değerlendirilmesi için kritik öneme sahiptir. Burada gösterilen örneklerde yaprak sayısı ilk yuvarlatılmış yaprakta (genellikle "başparmak yaprağı" olarak bilinir) başlayıp yukarı doğru sayılarak belirlenmiştir. Yapraklar genişletildikten sonra örneklendi ve bir sonraki yaprak ortaya çıktı. Bununla birlikte, örnekleme için en uygun yapraklar kullanılan virüs türlere, büyüme koşullarına ve mısır genotipine bağlı olarak değişebilir. Bu nedenle, bu protokol yeni bir virüs sistemine uygulanırken, örnekleme stratejisini yapraklara ve zamanlamaya göre optimize etmek için bir başlangıç kursu denemesi önerilir.
Kullanılan özel yapı, bu iletişim kuralının verimliliğini önemli ölçüde etkiler. Örneğin, her ikisi de küçük kesici uçlar (sırasıyla 313 bp ve 329 bp) içeren boş vektörler, FoMV-EV ve SCMV-EV ve FoMV-PDS ve FoMV-LES22, genellikle bu deneylerde viral semptomları olan bitkilerin en yüksek yüzdelerini üretir (Tablo 1 ve Tablo 2). Bununla birlikte, FoMV-GFP ve SCMV-GFP'de GFP ORF'nin (720 bp) daha büyük kesici uçlarını taşıyan rekombinant virüsler, boş vektör veya gen susturma yapıları ile enjekte edilen bitkilere kıyasla çok daha düşük enfeksiyon oranlarına sahipti. Bu eğilim, viral genomdaki eksojen genetik materyalin artan miktarlarda neden olduğu viral uygunluk üzerindeki olumsuz etkilerden kaynaklanabilir. Çeşitli çalışmalar, bitki viral vektörlerinin kesici uç stabilitesinin büyük ölçüde kesici uç boyutuna ve dizisine bağlı olduğunu göstermiştir36,54,55,56,57. Ek olarak, FoMV veya SCMV boş vektörü ile aşılamadan sonra enfekte olan bitkilerin yüzdesinde önemli bir fark vardı, bu da bu protokolü SCMV için optimize etmek için ek çalışma gerektiğini düşündürmektedir (Tablo 1). Bu sonuçlar, bir yapı geliştirirken bazı sorun giderme gerekebileceğini gösterir, çünkü parçanın sırası ve uzunluğu her ikisi de verimliliği etkileyebilir.
Genel olarak, bu çalışma mısır fidelerinin agroinjeksiyonunun iki farklı RNA bitki virüsü, çoklu vektör konfigürasyonu ve 11 cinotip mısır için etkili bir aşılama yöntemi olduğunu göstermiştir. FoMV ve SCMV ile yapılan bu çalışma, mısır klorotik mottle virüsü (MCMV) veya MSV ile enjeksiyon kullanılarak yapılan önceki çalışmalarla eşleştirilmiştir, agroinjection'ın mısır fidelerini hem RNA hem de DNA virüslerinin enfeksiyöz klonları ile aşılamak için uygun olduğunu göstermektedir19,20,21,22. Ek olarak, bu çalışma ayrıca agroinjection'ın VIGS ve VOX vektörleri için uygun bir yöntem olduğunu ve dört günlük kadar genç bitkilere uygulanabileceğini göstermektedir (Tablo 3). Burada sunulan protokolün, geçici gen susturma (VIGS) ve aşırı ekspresyon (VOX) içeren fonksiyonel genomik çalışmalarındaki araştırmaları kolaylaştırmak için mısır biyologları tarafından kolayca uyarlanması beklanmaktadır. Agroinjection ayrıca, aksi takdirde bitki dönüşümüne güvenerek sınırlı kalacak, düzenleme verimliliğini ve erişilebilirliği artırma potansiyeline sahip virüs tabanlı gen düzenleme yaklaşımlarını (VEdGE) kolaylaştırma kapasitesine sahiptir58,59,60. Uygun Agrobacterium suşu, mısır genotipleri ve viral vektörler düşünceli bir şekilde birleştirildiği göz önüne alındığında, agroinjeksiyon ile aşılamanın mısırda geçici gen fonksiyon analizleri için değerli bir araç haline gelmesi beklenmektedir.
Açıklamalar
Araştırmacıların açıklayacak bir çıkar çatışması yok.
Teşekkürler
Iowa Eyalet Üniversitesi, DARPA'nın Böcek Müttefikleri programı HR0011-17-2-0053'i destekleyen bir ekibin parçasıdır. Bu çalışma ayrıca Iowa Eyalet Üniversitesi Bitki Bilimleri Enstitüsü, Iowa Eyalet Üniversitesi Mahsul Biyomühendislik Merkezi, USDA NIFA Hatch proje numarası 3808 ve State of Iowa Funds tarafından da desteklendi. K.L.H. ayrıca Ulusal Bilim Vakfı (DGE #1545453) tarafından finanse edilen Iowa Eyalet Üniversitesi Tahmine Dayalı Bitki Fenomik lisansüstü eğitim programı ve USDA Ulusal Gıda ve Tarım Enstitüsü'nden 2019-07318 sayılı Tarım ve Gıda Araştırma Girişimi hibesi tarafından kısmen desteklenmiştir. Fon sağlayıcılar, çalışmanın tasarımında ve verilerin toplanmasında, analizinde ve yorumlanmasında ve makalenin yazılmasında hiçbir rol oynamamışlardır. Bu materyalde ifade edilen herhangi bir görüş, bulgu ve sonuç veya öneri yazarların görüşleridir ve mutlaka fon sağlayıcıların görüşlerini yansıtmaz.
Mısır inbred hatlarının tohumu için Nick Lauter'e (USDA-ARS, Ames, IA), FoMV-GFP klonunu yaptığı için Christian F. Montes-Serey'e (Iowa Eyalet Üniversitesi) ve teknik yardım için Tyler Austin'e (Iowa Eyalet Üniversitesi) teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL syringes | Fisher Scientific | 14955450 | alternatively, BD 309659 |
| 15 mL Falcon Tubes | Corning Science | 352059 | |
| 1kb+ Ladder | ThermoFisher Scientific | 10787018 | For assessing sizes of PCR products |
| 25G x 5/8" PrecisionGlide Needles | Becton, Dickinson and Company (BD) | 305122 | |
| 28°C Incubator | For Agrobacterium | ||
| 37°C Incubator | For E. coli | ||
| Acetosyringone | MilliporeSigma | D134406 | Optional |
| Agar | MilliporeSigma | A4800 | |
| Agarose | GeneMate | E-3120 | For making gels to check for virus/insert stability |
| Agrobacterium tumefaciens Strain GV3101 | Carries vir plasmid encoding T-DNA transfer machinery, RifR, GmR, from lab stock | ||
| Bsu36I | New England Biolabs | R0524 | |
| cDNA Kit | ThermoFisher Scientific | K1672 | Maxima First Strand cDNA Synthesis Kit with Dnase |
| Chloroform | Fisher Scientific | C298 | For RNA extraction |
| Cuvettes | Fisher Scientific | 14955127 | 1.5 mL |
| D-(+)-Glucose | MilliporeSigma | G7528 | Alkaline Lysis |
| DH5alpha Competent E. coli Cells | New England Biolabs | C2987 | |
| DNA Ligase | ThermoFisher Scientific | K1422 | Rapid DNA Ligation Kit |
| EDTA (Ethylenediamine Tetraacetic Acid, Disodium Salt Dihydrate) | Fisher Scientific | S311 | Alkaline Lysis |
| Ethanol | For RNA extraction | ||
| Fertilizer | Peters Fertilizer 15-15-15 Concentrate | ||
| Flat Inserts | T.O. Plastics | 715357C | For germinating seeds in trays |
| Flats | T.O. Plastics | 710245C | For germinating seeds in trays |
| FluorCam | Photon Systems Instruments | To assess maize plants for GFP expression before microscope | |
| Fluorescence Microscope | |||
| Gel Electrophoresis Box | |||
| Gentamycin Sulfate | Fisher Scientific | BP918 | |
| Glacial Acetate | Fisher Scientific | A38 | Alkaline Lysis |
| Glycerol | Fisher Scientific | G33-500 | For saving frozen stocks of bacteria |
| Go-Taq, 2X | Promega | M7123 | |
| Hydrochloric Acid | Fisher Scientific | A144 | for pHing solutions |
| Isopropanol | Sigma-Aldrich | 109827 | For RNA extraction |
| Kanamycin, Monosulfate | Fisher Scientific | BP906 | |
| Large Pots | Kordlok | SQL0550 | 5x5x4" or bigger. For transplanting seedlings. |
| Luria Bertani (LB) Broth, Miller | Himedia | M1245 | |
| Magnesium Sulfate Heptahydrate | Amresco | 662 | |
| Maize Golden Bantam Sweet Corn Seed | American Meadows, West Coast Seeds | ||
| Maize Inbred Seed | Our seed comes from our institution, but we are not able to provide this for other researchers. | ||
| Maxima H Minus Reverse Transcriptase | ThermoFisher Scientific | EP0753 | |
| MilliQ | Elga | Purelab Ultra | |
| Monarch PCR & DNA Cleanup Kit | New England Biolabs | T1030 | |
| PacI | New England Biolabs | R0547 | |
| Peters Excel 15-5-15 Fertilizer | ICL Specialty Fertilizers | G99140 | |
| Petri Dish, 95 mm x 15 mm | Fisher Scientific | FB0875714G | |
| pH Meter | |||
| Potassium Acetate | Fisher Scientific | P171 | Alkaline Lysis |
| Primers | Our primers were synthesized through our institutional DNA facility or through IDT | ||
| PspOMI | New England Biolabs | R0653 | |
| Q5 High-Fidelity DNA Polymerase | New England Biolabs | M0491 | |
| Rifampicin | EMD Millipore Corp | 557303 | |
| Rnase A | ThermoFisher Scientific | 12091021 | Alkaline Lysis |
| SbfI | New England Biolabs | R0642 | |
| Scale | For weighing chemicals for media or buffers | ||
| SDS (Sodium Dodecyl Sulfate) | Fisher Scientific | BP166 | Alkaline Lysis |
| Sodium Hydroxide | Fisher Scientific | S318 | Alkaline Lysis |
| Soil Substrate | SunGro Horticulture | SS#1-F1P | Sunshine Mix #1/Fafard-1P, any soil mix that maize grows well in is sufficient |
| Spectrophotometer | For measuring OD600 | ||
| Sybr Safe, 10,000X | Invitrogen | S33102 | For making gels to check for virus/insert stability |
| Thermocycler | For PCR | ||
| Tris Base | Fisher Scientific | BP154 | Alkaline Lysis |
| Trizol | Ambion | 15596018 | For RNA extraction |
| Weigh Paper | For weighing chemicals for media or buffers | ||
| XbaI | New England Biolabs | R0145 |
Referanslar
- Zaidi, S. E. A., Mansoor, S. Viral vectors for plant genome engineering. Frontiers in Plant Science. 8, 539(2017).
- Kant, R., Dasgupta, I. Gene silencing approaches through virus-based vectors: speeding up functional genomics in monocots. Plant Molecular Biology. 100, 3-18 (2019).
- Hu, J., et al. A barley stripe mosaic virus-based guide RNA delivery system for targeted mutagenesis in wheat and maize. Molecular Plant Pathology. 20 (10), 1463-1474 (2019).
- Pasin, F., Menzel, W., Daròs, J. A. Harnessed viruses in the age of metagenomics and synthetic biology: an update on infectious clone assembly and biotechnologies of plant viruses. Plant Biotechnology Journal. 17 (6), 1010-1026 (2019).
- Cody, W. B., Scholthof, H. B. Plant virus vectors 3.0: Transitioning into synthetic genomics. Annual Review of Phytopathology. 57 (1), 211-230 (2019).
- Mei, Y., et al. Protein expression and gene editing in monocots using foxtail mosaic virus vectors. Plant Direct. 3 (11), 00181(2019).
- Ruiz, M. T., Voinnet, O., Baulcombe, D. C. Initiation and maintenance of virus-induced gene silencing. Plant Cell. 10 (6), 937-946 (1998).
- Bekele, D., Tesfaye, K., Fikre, A. Applications of virus induced gene silencing (VIGS) in plant functional genomics studies. Journal of Plant Biochemistry & Physiology. 07 (01), 1000229(2019).
- Scholthof, H. B., Scholthof, K. B. G., Jackson, A. O. Plant virus gene vectors for transient expression of foreign proteins in plants. Annual Review of Phytopathology. 34 (1), 299-323 (1996).
- Holzberg, S., Brosio, P., Gross, C., Pogue, G. P. Barley stripe mosaic virus-induced gene silencing in a monocot plant. Plant Journal. 30 (3), 315-327 (2002).
- Wang, R., et al. An efficient virus-induced gene silencing vector for maize functional genomics research. Plant Journal. 86 (1), 102-115 (2016).
- Redinbaugh, M. G., et al. Transmission of viral RNA and DNA to maize kernels by vascular puncture inoculation. Journal of Virological Methods. 98 (2), 135-143 (2001).
- Scholthof, H. B. The capsid protein gene of tomato bushy stunt virus is dispensable for systemic movement and can be replaced for localized expression of foreign genes. Molecular Plant-Microbe Interactions. 6 (3), 309(1993).
- Scholthof, H. B., Scholthof, K. B. G., Kikkert, M., Jackson, A. O. Tomato bushy stunt virus spread is regulated by two nested genes that function in cell-to-cell movement and host-dependent systemic invasion. Virology. 213 (2), 425-438 (1995).
- Scholthof, H. B. Rapid delivery of foreign genes into plants by direct rub-inoculation with intact plasmid dna of a tomato bushy stunt virus gene vector. Journal of Virology. 73 (9), 7823-7829 (1999).
- Zhang, J., et al. Vacuum and co-cultivation agroinfiltration of (germinated) seeds results in tobacco rattle virus (TRV) mediated whole-plant virus-induced gene silencing (VIGS) in wheat and maize. Frontiers in Plant Science. 8, 393(2017).
- Vaghchhipawala, Z., Rojas, C. M., Senthil-Kumar, M., Mysore, K. S. Agroinoculation and agroinfiltration: simple tools for complex gene function analyses. Methods in Molecular Biology. 678, Clifton, N.J. 65-76 (2011).
- Grimsley, N., Hohn, B., Hohn, T., Walden, R. "Agroinfection," an alternative route for viral infection of plants by using the Ti plasmid. Proceedings of the National Academy of Sciences. 83 (10), 3282-3286 (1986).
- Grimsley, N. H., Ramos, C., Hein, T., Hohn, B. Merisfematic tissues of maize plants are most suscepnsle to agroinfection with maize streak virus. Bio/Technology. 6 (2), 185-189 (1988).
- Martin, D. P., Rybicki, E. P. Improved efficiency of Zea mays agroinoculation with Maize streak virus. Plant Disease. 84 (10), 1096(2000).
- Martin, D. P., Willment, J. A., Rybicki, E. P. Evaluation of maize streak virus pathogenicity in differentially resistant Zea mays genotypes. Phytopathology. 89 (8), 695-700 (1999).
- Wang, Q., et al. Further characterization of Maize chlorotic mottle virus and its synergistic interaction with Sugarcane mosaic virus in maize. Scientific Reports. 7, 39960(2017).
- Hsieh, M. H., et al. Optimizing virus-induced gene silencing efficiency with Cymbidium mosaic virus in Phalaenopsis flower. Plant Science. 201-202 (1), 25-41 (2013).
- Hsieh, M. H., et al. Virus-induced gene silencing unravels multiple transcription factors involved in floral growth and development in Phalaenopsis orchids. Journal of Experimental Botany. 64 (12), 3869-3884 (2013).
- Zenna, N. S., et al. Genetic analysis of tolerance to rice tungro bacilliform virus in rice (Oryza sativa L.) through agroinoculation. Journal of Phytopathology. 154 (4), 197-203 (2006).
- Marks, M. S., Kemp, J. M., Woolston, C. J., Dale, P. J. Agroinfection of wheat: A comparison of Agrobacterium strains. Plant Science. 63 (2), 247-256 (1989).
- Dasgupta, I., et al. Rice tungro bacilliform virus DNA independently infects rice after Agrobacterium-mediated transfer. Journal of General Virology. 72 (6), 1215-1221 (1991).
- Boulton, M. I., Buchholz, W. G., Marks, M. S., Markham, P. G., Davies, J. W. Specificity of Agrobacterium-mediated delivery of maize streak virus DNA to members of the Gramineae. Plant Molecular Biology. 12 (1), 31-40 (1989).
- Paulsen, A. Q. Purification and properties of foxtail mosaic virus. Phytopathology. 77 (11), 1346(1977).
- Bancroft, J. B., Rouleau, M., Johnston, R., Prins, L., Mackie, G. A. The entire nucleotide sequence of foxtail mosaic virus RNA. Journal of General Virology. 72 (9), 2173-2181 (1991).
- Bruun-Rasmussen, M., Madsen, C. T., Johansen, E., Albrechtsen, M. Revised sequence of foxtail mosaic virus reveals a triple gene block structure similar to potato virus X. Archives of Virology. 153 (1), 223-226 (2008).
- Rouleau, M., Bancroft, J. B., Mackie, G. A. Partial purification and characterization of foxtail mosaic potexvirus RNA-dependent RNA polymerase. Virology. 197 (2), 695-703 (1993).
- Rouleau, M., Smith, R. J., Bancroft, J. B., Mackie, G. A. Purification, properties, and subcellular localization of foxtail mosaic potexvirus 26-kDa protein. Virology. 204 (1), 254-265 (1994).
- Samuels, T. D., et al. Subcellular targeting and interactions among the potato virus X TGB proteins. Virology. 367 (2), 375-389 (2007).
- Cho, S. Y., Kim, K. H. Identification of the capsid protein-binding region of the SL1(+) RNA located at the 5' region of the potato virus X genome. Plant Pathology Journal. 28 (1), 75-80 (2012).
- Mei, Y., Zhang, C., Kernodle, B. M., Hill, J. H., Whitham, S. A. A foxtail mosaic virus vector for virus-induced gene silencing in maize. Plant Physiology. 171 (2), 760-772 (2016).
- Bouton, C., et al. Foxtail mosaic virus: A viral vector for protein expression in cereals. Plant Physiology. 177 (4), 1352-1367 (2018).
- Mei, Y., Liu, G., Zhang, C., Hill, J. H., Whitham, S. A. A sugarcane mosaic virus vector for gene expression in maize. Plant Direct. 3 (8), 00158(2019).
- Gal-On, A., Meiri, E., Huet, H., Hua, W. J., Raccah, B., Gaba, V. Particle bombardment drastically increases the infectivity of cloned DNA of zucchini yellow mosaic potyvirus. Journal of General Virology. 76 (12), (1995).
- Gao, R., et al. Construction of an infectious cDNA clone and gene expression vector of Tobacco vein banding mosaic virus (genus Potyvirus). Virus Research. 169 (1), 276-281 (2012).
- López-Moya, J. J., García, J. A. Construction of a stable and highly infectious intron-containing cDNA clone of plum pox potyvirus and its use to infect plants by particle bombardment. Virus Research. 68 (2), (2000).
- Choi, I. R., French, R., Hein, G. L., Stenger, D. C. Fully biologically active in vitro transcripts of the eriophyid mite-transmitted wheat streak mosaic tritimovirus. Phytopathology. 89 (12), (1999).
- Kim, K. S., et al. Infectivity of in vitro transcripts of Johnsongrass mosaic potyvirus full-length cDNA clones in maize and sorghum. Archives of Virology. 148 (3), 563-574 (2003).
- Stewart, L. R., Bouchard, R., Redinbaugh, M. G., Meulia, T. Complete sequence and development of a full-length infectious clone of an Ohio isolate of Maize dwarf mosaic virus (MDMV). Virus Research. 165 (2), 219-224 (2012).
- Wylie, S. J., et al. ICTV virus taxonomy profile: Potyviridae. Journal of General Virology. 98 (3), 352-354 (2017).
- Shukla, D. D. taxonomy of potyviruses infecting maize, sorghum, and sugarcane in Australia and the United States as determined by reactivities of polyclonal antibodies directed towards virus-specific N-termini of coat proteins. Phytopathology. 79 (2), 223(1989).
- Shukla, D. D., Ward, C. W. Amino Acid sequence homology of coat proteins as a basis for identification and classification of the potyvirus group. Journal of General Virology. 69 (11), 2703-2710 (1988).
- Chung, B. Y. W., Miller, W. A., Atkins, J. F., Firth, A. E. An overlapping essential gene in the Potyviridae. Proceedings of the National Academy of Sciences of the United States of America. 105 (15), 5897-5902 (2008).
- Jarchow, E., Grimsley, N. H., Hohn, B. virF, the host-range-determining virulence gene of Agrobacterium tumefaciens, affects T-DNA transfer to Zea mays. Proceedings of the National Academy of Sciences of the United States of America. 88 (23), 10426-10430 (1991).
- Hu, G., Yalpani, N., Briggs, S. P., Johal, G. S. A porphyrin pathway impairment is responsible for the phenotype of a dominant disease lesion mimic mutant of maize. The Plant Cell. 10 (7), 1095(2007).
- Qin, G., et al. Disruption of phytoene desaturase gene results in albino and dwarf phenotypes in Arabidopsis by impairing chlorophyll, carotenoid, and gibberellin biosynthesis. Cell Research. 17 (5), 471-482 (2007).
- Jones, P. Isolation of plasmid DNA from E. coli. Encyclopedia of Life Sciences. , (2003).
- Ji, Q., Yang, B., Lee, M., Chen, Y., Lübberstedt, T. Mapping of quantitative trait loci/locus conferring resistance to foxtail mosaic virus in maize using the intermated B73-×-Mo17 population. Plant Breeding. 129 (6), 721-723 (2010).
- Pacak, A., et al. The brome mosaic virus-based recombination vector triggers a limited gene silencing response depending on the orientation of the inserted sequence. Archives of Virology. 155 (2), 169-179 (2010).
- Miché, L., Battistoni, F., Gemmer, S., Belghazi, M., Reinhold-Hurek, B. Host-dependent expression of Rhizobium leguminosarum bv. viciae hydrogenase is controlled at transcriptional and post-transcriptional levels in legume nodules. Molecular Plant-Microbe Interactions. 19 (5), 1323-1331 (2018).
- Yamagishi, M., Masuta, C., Suzuki, M., Netsu, O. Peanut stunt virus-induced gene silencing in white lupin (lupinus albus). Plant Biotechnology. 32 (3), 181-191 (2015).
- Avesani, L., et al. Stability of Potato virus X expression vectors is related to insert size: Implications for replication models and risk assessment. Transgenic Research. 16 (5), 587-597 (2007).
- Ali, Z., et al. Efficient virus-mediated genome editing in plants using the CRISPR/Cas9 system. Molecular Plant. 8 (8), 1288-1291 (2015).
- Cody, W. B., Scholthof, H. B., Mirkov, T. E. Multiplexed gene editing and protein overexpression using a tobacco mosaic virus viral vector. Plant Physiology. 175 (1), 23-35 (2017).
- Ali, Z., Eid, A., Ali, S., Mahfouz, M. M. Pea early-browning virus-mediated genome editing via the CRISPR/Cas9 system in Nicotiana benthamiana and Arabidopsis. Virus Research. 244, 333-337 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır