需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用稀疏腺相关病毒标记遗传靶向视网膜细胞群的神经元树化延时成像
摘要
在这里,我们提出了一种通过延时共聚焦显微镜研究产后小鼠视网膜外植体中神经突形态发生的方法。我们描述了一种使用重组腺相关病毒载体(以 Cre依赖性方式表达膜靶向荧光蛋白)对视网膜细胞类型及其精细过程进行稀疏标记和获取的方法。
摘要
发现树突状乔木的模式需要方法在发育过程中可视化,成像和分析树突。小鼠视网膜是一个强大的模型系统,用于研究神经元形态发生和连接的细胞类型特异性机制。视网膜亚型的组织和组成是明确的,遗传工具可用于在发育过程中访问特定类型。许多视网膜细胞类型也将其树突和/或轴突限制在狭窄的层,这有助于延时成像。小鼠视网膜外植体培养物非常适合使用共聚焦或多光子显微镜进行活细胞成像,但缺乏针对具有时间和结构分辨率的树突动力学成像优化的方法。这里介绍的是一种稀疏地标记和成像由Cre-Lox系统标记的特定视网膜群体发展的方法。这里使用的市售腺相关病毒(AAV)以Cre依赖性方式表达膜靶向荧光蛋白。新生儿小鼠中AAV的眼内递送在注射后4-5天(dpi)产生靶向细胞类型的荧光标记。膜荧光信号可通过共聚焦成像进行检测,并解析精细的分支结构和动力学。从充满含氧人工脑脊液(aCSF)的视网膜平片成像仪获取跨越2-4小时的高质量视频。还提供了用于反卷积和三维(3D)漂移校正的图像后处理管道。该协议可用于捕获完整视网膜中的几种细胞行为,并确定控制神经突起形态的新因素。在视网膜中学到的许多发育策略将与理解中枢神经系统其他地方的神经回路的形成有关。
引言
视网膜神经元的树突形成复杂但特定的模式,影响它们在神经回路中的功能。在脊椎动物视网膜中,不同类型的视网膜神经节细胞(RGC)和柏宁细胞中间神经元具有独特的树突形态,其树突形态在心轴大小、位置、分支长度和密度上有所不同1。在产后发育过程中,RGC和amcrine细胞将旺盛的树突突延伸到称为内丛状层(IPL)的神经瞳孔中,在那里它们接收双极细胞输入,发送光感受器信号2。通过对雏鸡或斑马鱼幼虫中荧光标记的视网膜种群进行延时成像捕获,树突形态发生具有高度动态性3,4,5。在几天内,树突状乔木膨胀,重塑并撞击到IPL的狭窄子层,在那里它们与选定的伙伴突触。乔木在发育过程中表现出不同的结构动力学,分支增加,收缩和稳定的相对速率发生变化。Amacrine和RGC枝晶也表现出不同的生长和重塑行为,这可能反映了特定类型的树木化。然而,这些研究追踪了广泛的amcrine或RGC群体,并专注于层流靶向,这只是形态学的一个方面。
产生在视网膜亚型中观察到的巨大形态多样性的机制知之甚少。该小组的目标是开发一种方法来捕获小鼠中定义的视网膜亚型的树突动力学和乔木重塑。识别树突图案化的细胞类型特异性机制需要可视化和测量目标细胞的树突行为的方法。小鼠视网膜的器官型培养非常适合使用共聚焦或多光子显微镜的活细胞成像研究。将发育中的视网膜解剖并安装到平坦的外植体中,该外植体可以在记录室中成像数小时或在几天内培养,对电路的影响有限6,7。活的视网膜神经元可以通过多种技术进行标记,包括通过电极填充染料,电穿孔,涂有亲脂性染料或编码荧光蛋白的质粒(例如,Gene Gun)的颗粒的生物传递,以及遗传编码的细胞标签7,8,9,10.然而,这些方法对于特定视网膜亚型的树突动力学成像效率低下。例如,染料填充方法的通量较低,需要电生理学设备和额外的遗传标记才能可靠地靶向感兴趣的细胞。此外,体细胞中的强荧光信号会遮挡附近的树突。
生物基因递送方法可以同时标记数十个细胞,但涉及高压颗粒递送和孤立视网膜过夜孵育的步骤可能会损害细胞生理学和树突生长。本文提出,根据以下实验标准,可以利用最近的遗传工具来捕获具有细胞类型和结构分辨率的早期树突动力学。首先,为了解决主导发育中的乔木的细枝和丝状体,该方法应该用明亮的荧光蛋白标记神经元,这些蛋白填充了整个心轴中的过程。在成像期间,荧光标记不应因光漂白而褪色。已经生成了多种荧光蛋白变体,并根据亮度和光稳定性比较了其对体内/离体成像的适用性11 。其次,荧光蛋白(XFPs)必须在树突形态发生的最早阶段以足够高的水平表达,以便不会错过狭窄的发育窗口。在对小鼠视网膜静态时间点的分析中,树突发育发生在出生后的第一周,包括生长,重塑和稳定阶段10,12,13,14,15。第三,该方法应导致选择性标记或增加感兴趣的神经元亚群的标记概率。第四,目标亚群的标记必须足够稀疏,以便可以识别和追踪整个神经元乔木。虽然RGC和amacrine亚型可以通过其成熟的形态特征和IPL分层模式来区分16,17,18,19,20,但挑战在于基于未成熟结构在发育过程中识别亚型。通过扩增转基因工具在发育过程中标记特定的视网膜细胞类型,可以促进这项任务。
转基因和敲入小鼠品系,其中荧光蛋白或Cre的细胞和时间表达由基因调节元件决定,被广泛用于研究视网膜细胞类型13,21,22,23。对树突发育亚型特异性模式的关键观察来自静态时间点对转基因小鼠视网膜的研究10,14,24,25。特别是Cre-Lox系统,它可以使用各种重组酶依赖性报告基因,传感器和光遗传学激活剂对亚型进行精细的基因操作和监测。这些工具导致了亚型特异性分子程序和功能特性的发现,这些功能特性是视网膜电路组装的基础26,27,28,29,30。然而,它们尚未被用于研究小鼠视网膜中亚型特异性的树突动力学。通过将Cre小鼠品系与通过电穿孔或重组AAV引入的转基因相结合,可以实现低密度标记。如果可行,也可以使用他莫昔芬诱导的Cre系或交叉遗传策略。最后,应以微创方式标记细胞,并使用采集参数进行成像,以免损害组织或干扰树突形态发生所需的细胞功能。
这里介绍的是一种应用转基因工具和共聚焦显微镜来研究活小鼠视网膜外植体中的树突动力学的方法。Cre转基因小鼠品系已与AAV载体相结合,后者在Cre重组时表达荧光蛋白,这允许对感兴趣的视网膜细胞进行稀疏标记。市售的 AAV 通过玻璃体内注射输送到新生儿视网膜。本文表明,AAV以4 dpi产生显着的高和细胞类型特异性荧光表达,允许访问产后时间点。为了说明这种方法,通过在表达胆碱乙酰转移酶(ChAT)-内部核糖体进入位点(IRES)-Cre转基因的新生小鼠中传递Brainbow AAV来标记胆碱能"星爆"amacrine中间神经元,该基因在产后早期视网膜中活跃31,32。Starburst amacrine细胞发展出一种刻板的放射状乔木形态,由簇状的原钙粘蛋白介导的树突自我回避形成33,34。本文表明,通过添加用于Brainbow AAVs31的经过法呢基化的CAAX基序,XFP显着提高了星爆树突和丝状体的分辨率。最后,已经确定了延时成像和后处理方案,可产生适合树突重建和形态量化的高质量图像。该协议可用于识别控制树突形态发生的因素,并捕获完整视网膜中的几种细胞行为。
研究方案
注意:该方案跨越2天,实验日之间的病毒转导最短时间为4-5天(图1A)。动物实验是根据加拿大动物护理委员会根据病童医院动物服务实验室动物使用和护理委员会批准的协议进行的,用于研究和实验动物护理。
1. 新生儿AAV注射和成像实验的准备
- 选择Cre小鼠线以标记感兴趣的视网膜细胞群。在AAV注射时,通过与Cre转基因报告基因交叉或通过Cre抗体免疫染色来确认Cre重组酶的表达。
- 繁殖转基因Cre小鼠(8-16周龄)以产生Cre阳性的新生动物。
注意:对于此演示,ChAT-IRES-Cre敲入小鼠用于靶向胆碱能星爆amacrine细胞。 - 获得编码荧光蛋白的重组酶依赖性AAV病毒。为了对精细过程进行最佳标记,请选择表达靶向质膜的修饰XFP的载体。
注意:本研究使用了Brainbow病毒(BBV),AAV-EF1a-BbTagBY和AAV9-EF1a-BbChT(见材料表),它们提供了多色标记的选择(图1B)。法呢基化的增强型黄色荧光蛋白(eYFP)和单体樱桃(mCherry)表达为实时成像产生了最强的荧光信号。单个BBV可用于对单个心轴进行成像,而BBV的共同注射可用于标记具有不同荧光团的更多细胞或相邻心轴。如果使用多种荧光蛋白,请确保最小的发射光谱重叠(图1C)。必须调整显微镜采集参数以捕获不同的XFP信号。 - 在单个低结合管中制备∼3-5μL等分的AAV,用于一次性储备,以避免冻融循环。储存在-80°C。
- 使用微量移液器用非常细的尖端制备硼硅酸盐玻璃微量移液器。
注:拉拔器设置因所使用的灯丝和拉拔器而异。有关最终的尖端尺寸和形状,请参见 图2A 。典型的液滴直径为600μm。 - 获得显微注射系统和相关管道。将微型注射器连接到加压气口。

图1:实验概述。 (A)该协议跨越2天的实验,实验日之间的感染期至少为4-5天。在不超过产后第3天的新生小鼠上进行眼内注射。然后解剖视网膜,平装和实时成像,以捕捉所需的发育窗口。标记的细胞可以在病毒表达所需的4-5天后的任何时间成像,因为延长的AAV表达对树突形态没有明显的影响。(B)将Cre依赖性Brainbow AAV载体(BBV)注射到表达Cre31的动物中。在这项研究中,ChAT-Cre敲入小鼠用于驱动星爆amacrine细胞中的Cre重组。两个BBV编码修饰的eYFP或tagBFP,或mCherry和mTFP,它们以 CAAX 基序终止,该基序依次法呢基化以进行膜定位。Lox遗址用三角形描绘。向量以随机和组合的方式表达法呢基化的XFP,这取决于Cre重组。 EF1α 启动子包括来自伸长因子1α基因的调节元件。W表示来自土拨鼠肝炎病毒转录后调节因子的元素,pA表示多腺苷酸化序列。(C)本研究中成像的bbV荧光团mCherry和eYFP的激发和发射光谱。当对多个荧光蛋白进行实时成像时,必须安排检测参数以将发射光谱充分分离到不同的通道中。缩写: AAV = 腺相关病毒;BBV = Brainbow AAV;ChAT = 胆碱乙酰转移酶;iRES =内部核糖体进入位点;eYFP = 增强型黄色荧光蛋白;iTR = 倒置端子重复;tagBP = 标签蓝色荧光蛋白;m樱桃=单体樱桃;mTFP = 蓝绿色荧光蛋白;XFP = 任何荧光蛋白;EF1α=伸长系数1α。 请点击此处查看此图的放大版本。
2. 新生小鼠体内注射AAV
- 在冰上解冻AAV等分试样。使用无菌盐水或磷酸盐缓冲盐水制备〜1:4 AAV稀释液。每只动物准备约0.5μLAAV稀释液(每只眼睛约0.25μL),以防微量移液器破裂,并且需要填充新的移液器。将剩余的未稀释的AAV储存在4°C,并在2周内使用。
注意:在本实验中,供应商AAV浓度约为1-2×1013 基因组含量(GC)/mL,并稀释至终浓度为4×1012 GC/mL。优化病毒浓度以获得所需的标记密度。 - 为了可视化注射,每15μLAAV稀释液加入约1μL0.02%快速绿色FCF染料溶液,以使溶液变为蓝色。
- 将装有母亲和新生儿窝的小鼠笼(产后日(P)0.5-3)转移到装有显微注射设备的手术室。将动物放在有巢和垫料的同一笼子里,以尽量减少母体的压力和对幼崽的排斥。
- 用70%乙醇对注射区域进行消毒,并将无菌尿布垫放在工作台表面上。准备一个温暖的平台(例如,加热垫)以从体温过低引起的麻醉中恢复。
- 使用微量注射器用AAV稀释液回填微量移液器。在立体显微镜下,用30 G针头打破微量移液管尖端以解封尖端。
注: 图2A 显示了回填尖端 - 密封(顶部)和未密封(中间)。 - 通过将1-2只动物放在冰上来通过低温麻醉新生小鼠。将动物放在乳胶手套上,以保护皮肤不直接接触冰块。一旦动物不再响应爪子捏动(约2分钟),将动物置于立体显微镜下。如果需要,用纹身墨水和30克针头纹身爪垫,并收集尾部剪以进行DNA分离,以通过基因分型识别动物。
注意:在整个手术过程中必须对麻醉深度进行适当的监测。 - 用70%乙醇擦拭眼睛上方的皮肤。使用30 G针头打开融合的眼睑(图2B)。用手指轻轻按压以睁开眼睛,并在角膜 - 巩膜连接处的角膜上戳一个小孔(图2C)。
- 将玻璃微量移液器插入孔中,然后按压微注射器脚踏板2-4次,将AAV注入玻璃体内空间。慢慢取出微量移液管,并通过通过瞳孔可视化蓝色染料来确认AAV注射(图2D)。
注:喷射压力为6-8 psi,脉冲时间为600-800 ms时,可喷射直径为600 μm的液滴(图2A,底部)。每只眼睛注射约0.23-0.45μLAAV溶液。眼睛外的蓝色溶液表明AAV没有注射到眼睛中。从注射部位泄漏的蓝色溶液表明AAV可能已经泄漏出来,降低了转染效率。 - 轻轻地将眼睑按在一起以重新密封,然后将幼崽放在加热的垫上。一旦动物恢复粉红色并反应灵敏,轻轻地将它们移回笼子。
注意:确保采取适当的预防措施,以避免幼崽过快地重新升温。 - 对窝中剩余的动物重复注射程序。在视网膜成像之前,至少等待4-5天的病毒转导。

图2:新生儿眼内注射(A)后充微量移液管显示移液器吸头密封时(顶部)和吸头解封后(底部,左侧)的形状。6-8 psi 的 Pico 注射压力和 600-800 ms 的脉冲时间会产生直径为 600 μm 的液滴(右下)。比例尺 = 1 mm.(B) 在 16 倍放大镜下麻醉的 P0 幼崽。融合的眼睑接头(白色)使用锋利的30 G针切开。(C)施加在眼睛上的轻压使角膜暴露;比例尺 = 2 毫米。缩放部分(红色)显示角膜 - 巩膜交界处的小孔(黄色),用30 G针头创建;比例尺 = 0.5 mm. (D) 注射后移液器吸头的抽出(左)。与注射前的光瞳孔颜色(右)相比,AAV溶液中的快速绿色染料通过瞳孔(中间)显示为蓝灰色。(E)4天后,眼睑愈合并融合闭合(左);比例尺 = 2 毫米。去核后,愈合的注射部位可见(黄色);比例尺 = 1 毫米。注意注射部位在角膜和巩膜之间边界的位置。请点击此处查看此图的放大版本。
3. 用于影像学实验的视网膜夹层
- 制备视网膜 aCSF (119 mM NaCl, 2.5 mM KCl, 1.3 mM MgCl2·6H2O, 2.5 mM CaCl2·2H2O, 1 mM NaH2PO4, 11 mM 葡萄糖和 20 mM 4-(2-羟乙基)-1-哌嗪乙烷磺酸 (HEPES 游离酸)35.如果需要,准备并冷冻10x溶液;解冻并根据需要稀释至1倍。
- 通过用碳水化合物(95%O2,5%CO 2)冒泡至少15分钟来氧化视网膜aCSF。将pH值调节至7.4。保存在密封的容器中,直到使用,以确保aCSF保持含氧。
注意:视网膜需要高浓度的O2。在整个实验过程中保持aCSF的含氧性很重要。 - 将直径为60毫米的培养皿嵌入冰盘中(用实验室塑料制作冰盘,例如移液器盒盖),并将其置于立体显微镜下。用含氧视网膜aCSF填充培养皿。
- 通过斩首对小鼠P9及更年轻的小鼠实施安乐死。通过异氟醚诱导或根据动物方案批准的替代方法对P10及以上的小鼠实施安乐死,然后进行斩首。
- 如果眼睑被密封,请切开眼睑瓣以暴露眼睛。使用镊子对眼睛进行去核,并从步骤3.3将其转移到冷视网膜aCSF中。
- 要解剖视网膜杯,在立体显微镜(放大倍数25倍)下,使用Dumont #5镊子紧握视神经来稳定眼睛(图3A)。
- 用30 G针头在角膜中心戳一个洞,然后将微剪刀的一个尖端插入孔中,从孔到角膜末端做一个切口。重复此步骤,在基本方向上做4个切片,形成4个"襟翼"(图3A)。
- 用两个Dumont #5镊子,抓住并拉开两个相邻的皮瓣,轻轻地将巩膜从视网膜上剥离。对剩余的角膜瓣重复上述步骤,并从视网膜上取出巩膜(图3B)。
- 使用镊子从视网膜杯中取出晶状体。用微剪刀,从视网膜边缘向视神经做4个桡向切口,形成4个相等的花瓣(图3B)。对第二只眼睛重复步骤3.4-3.7。
4. 视网膜平装制备
- 准备灰色混合纤维素酯(MCE)膜过滤盘进行安装。如果使用大直径MCE膜过滤器,请将圆盘切成象限(直径约1厘米)。将 MCE 光盘放在较大的白色滤纸的中心(图 3D)。
注意:MCE 过滤器也提供直径为 1 cm 的圆盘。MCE滤光片必须足够大,可以容纳1-2个视网膜,但又要足够小,可以放入成像室。由于 MCE 膜具有静电荷,因此可最大限度地减少 MCE 膜的接触和处理。 - 使用两个尺寸的3/0画笔处理视网膜,将一个视网膜杯翻转到画笔上,视网膜神经节细胞面朝下。轻轻地将视网膜从aCSF中抬起,确保水张力不会撕裂视网膜(图3C)。
- 在仍然用视网膜握住画笔的同时,使用转移移液管将一滴aCSF放在MCE滤纸的中心(图3C,右)。将视网膜漂浮到由表面张力产生的aCSF液滴中。使用画笔将视网膜RGC的一面朝上放置在液滴内,并展开四片花瓣。
- 定位后,在画笔和白色滤纸之间形成一个水桥,以打破液滴的表面张力。
注意:当aCSF消失时,视网膜将粘附在MCE滤纸上(图3D,E)。平安装的视网膜可以通过用镊子抓住MCE椎间盘来处理。如果aCSF液滴在形成水桥之前迅速渗出,这可能表明MCE膜未带电。使用新鲜的MCE膜,并在将视网膜移入成像室之前立即解剖和平贴视网膜,从而最大限度地减少去核和成像之间的时间。

图 3:视网膜夹层和平面安装到混合纤维素酯过滤膜上。 (A) 左,通过用 Dumont #5 镊子抓住视神经(左)稳定去核的眼睛。使用30 G针头(中心)在角膜中心形成一个小孔。使用显微解剖剪刀将角膜切成4个相等的皮瓣(右)。比例尺 = 1 mm. (B) 解剖视网膜,使用两个 Dumont #5 镊子(左)剥离巩膜,取出晶状体(中)。视网膜有4个相等的切口,切入视网膜的一半(右)。比例尺 = 1 毫米。(C) 用两支精细画笔处理视网膜(尺寸 3/0,左)。视网膜将视网膜神经节细胞侧向下翻转到画笔(中心)上,然后从aCSF中取出,确保水张力不会撕裂视网膜(右)。比例尺 = 2 mm. (D) 灰色 MCE 膜盘放置在白色滤纸上(左)。MCE光盘上的aCSF液滴(右)。(E)将视网膜漂浮到液滴中并放置它们后,用白色滤纸形成一个水桥以吸湿aCSF,将视网膜拉到带电的MCE纸上(左);比例尺 = 1 厘米。MCE膜的缩放图像(红色)显示2个视网膜与视网膜神经节细胞一起朝上(右);比例尺 = 2 毫米。一个视网膜以白色勾勒。缩写: MCE = 混合纤维素酯;aCSF = 人工脑脊液。 请点击此处查看此图的放大版本。
5. 全坐式视网膜活体制剂的延时共聚焦成像
- 组装实时成像孵育室,用于直立共聚焦显微镜,如图 4所示。
注:对于倒置共聚焦系统,将平安装座直接将RGC面朝下放置在孵育室的玻璃底盖玻片上。一旦视网膜与盖玻片接触,它们就无法移动。 - 用含氧的aCSF填充腔室,然后打开泵和温度控制器(温度32-34°C,流量1 mL / min)。不要让温度上升到34°C以上。
- 要将视网膜平装件转移到灌注室,请停止泵,并取出腔室中的aCSF。将带有视网膜平安装座的MCE盘放入(空)孵育室。
- 将样品砝码放在平板上;预润湿砝码以打破表面张力。用加热的aCSF重新填充腔室,并以~1mL / min循环aCSF。
- 将物镜转换器与25倍浸水物镜(数值孔径0.95)定位到成像室中。使用落射荧光筛选感兴趣的标记细胞(图4C)。
- 调整成像体积以捕获感兴趣的树突状特征。
注:本研究以每帧1024 x 1024像素,z步进1μm和每个z-stack之间的帧速率2分钟捕获了完整的树突轴。最终图像尺寸约为 100 μm x 100 μm x 20 μm。 - 要将激光功率调整到最佳设置,请使用可识别过饱和不足像素的查找表。扫描时,调整激光功率,使没有像素过度饱和(即,强度为255或更高)。根据需要继续成像,或直到荧光信号显着且可检测到的下降和噪声的增加(通常为2-4小时)。
注:建议降低激光功率,因为当像素分布在整个动态范围内时,反卷积算法的工作效果最佳。像素强度不应超过254;对神经突起的实证分析表明,低于170的像素值是解卷积的理想选择。具有线平均(2-3)的快速扫描速度(400-600 Hz)比相同总像素停留时间的单次较慢扫描更可取。长时间成像的区域经常出现光漂白,但其他外植体切片仍然可行。可以对平装中的多个区域进行成像,每个区域成像2-4小时,总孵育时间为6小时。超过 6 小时的影像学检查尚未得到系统测试。神经突起降解和起泡是外植体活力下降的迹象。 - 成像后,用4%多聚甲醛的冷固定视网膜平片和膜过滤器,在4°C下1-2小时。 通过免疫组织化学扩增固定视网膜中的荧光标记以进行进一步分析。
注意:使用倒置共聚焦时,无法进行成像后固定。视网膜在不破坏组织的情况下是不可移动的。
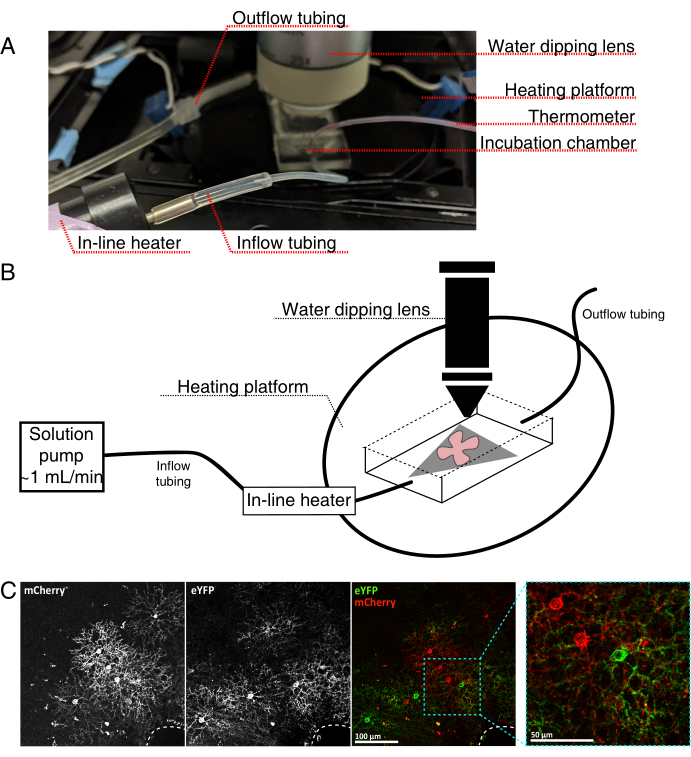
图 4:活细胞成像孵育室设置。 (A) 显示加热、溶液和成像组件的活体成像孵育装置。双加热器包括一个加热的培养箱平台(带有蓝色连接器电极的后圈)和一个在线溶液加热器。(二) 4A的示意图。将MCE膜(灰色)上的视网膜平装(红色)置于孵育室中。在线溶液加热器连接到溶液泵( 4A中未示出)。成像室尺寸为浸渍物镜鼻提供了良好的工作区域。(C)25x观察视网膜外植体,注入0.23-0.45μL的4×1012 GC / mL的AAV稀释液;比例尺 = 100 μm。细胞的密集标记通常围绕视神经头(虚线,右下角);比例尺 = 50 μm。缩写: MCE = 混合纤维素酯;GC = 基因组拷贝;m樱桃=单体樱桃;eYFP = 增强型黄色荧光蛋白。 请点击此处查看此图的放大版本。
6. ImageJ中的图像反卷积和后处理
- 导入图像系列,按时间拆分序列,如果是多色图像,则为彩色图像着色。确保一种颜色的所有时间点都包含在同一文件夹中。
注意:如果使用ImageJ,则导入生物格式(生物格式自动包含在斐济中)。 - 使用 ImageJ 插件 衍射 PSF 3D 创建理论点扩散函数 (PSF)。
注意:每个成像通道都需要自己的PSF,因为荧光蛋白发射波长会影响PSF。 - 使用插件|宏|运行以使用提供的宏对所有时间点执行批处理并行迭代反卷积(补充文件 1)。
注意:此宏运行 25 次迭代的 Wiener Filter 预处理 Landweber (WPL) 迭代算法。每个颜色通道必须单独解除卷积。 - 合并颜色通道,并将所有时间点编译为超堆栈(图像|超栈|堆栈到超堆栈)。使用插件|纠正 3D 漂移 注册|校正 3D 漂移。
- 将图像返回到常规堆栈(图像|超栈|超堆叠到堆栈),并拆分时间点(图像|堆栈|工具|堆栈拆分器)。使用批处理为所有时间点创建最大投影(处理|批次|宏| run("Z Project...", "projection=[Max Intensity]"); ).
- 导入延时图像序列(文件|导入|图像序列)。使用传统的 ImageJ 工具对解卷积和后处理的二维 (2D) 视频进行所需的分析。
注意:四维(3D + 时间)反卷积和漂移校正视频可以被视为超堆栈。省略上一步以保持 3D 时间点。
结果
使用上述协议,采集了星爆细胞枝晶发育的高分辨率3D视频,对其进行了解卷积,并针对3D漂移进行了校正。生成Z平面最大投影以制作用于分析的2D视频(补充视频1, 图5A)。每个时间点的3D反卷积提高了细丝状突起的分辨率(图5B,C)。细丝状突起是视网膜树突发育的特征36 ,在影像学检查过程中应可见。AA...
讨论
该视频演示了一个实验管道,该管道利用现有的遗传工具,通过共聚焦实时成像对发育中的视网膜神经元的树突动力学进行成像。还证明了将编码膜靶向荧光蛋白的Cre依赖性AAVs的眼内注射到新生小鼠中。遗传靶向群体的单细胞早在4-5 dpi时就被明确标记。为标准成像室准备视网膜平片支架以执行活细胞共聚焦成像。这种方法可以生成单个细胞及其精细投影的高分辨率延时视频。使用开源软件(包?...
披露声明
作者没有任何内容可披露。
致谢
我们感谢麦迪逊·格雷(Madison Gray)在我没有帮助的时候帮了我一把。这项研究得到了NSERC发现补助金(RGPIN-2016-06128),斯隆神经科学奖学金和加拿大研究主席Tier 2(J.L.L)的支持。S. Ing-Esteves得到了视觉科学研究计划和NSERC研究生奖学金博士的支持。
材料
| Name | Company | Catalog Number | Comments |
| Addgene viral prep #45185-AAV9 | |||
| Addgene viral prep #45186-AAV9 | |||
| Dissection tools | |||
| Cellulose filter paper | Whatman | 1001-070 | |
| Dumont #5 fine forceps | FST | 11252-20 | Two Dumont #5 forceps are required for retinal micro-dissection |
| Dumont forceps | VWR | 82027-426 | |
| Fine Scissors | FST | 14058-09 | |
| Mixed cellulose ester membrane (MCE) filter papers, hydrophilic, 0.45 µm pore size | Millipore | HABG01 300 | |
| Petri Dish, 50 × 15 mm | VWR | 470313-352 | |
| Polyethylene disposable transfer pipette | VWR | 470225-034 | |
| Round tip paint brush, size 3/0 | Conventional art supply store | Two size 3/0 paint brushes (or smaller) are required for retinal flat-mounting | |
| Surgical Scissors | FST | 14007-14 | |
| Vannas Spring Scissors - 2.5 mm Cutting Edge | FST | 15000-08 | |
| Live-imaging incubation system | |||
| Chamber polyethylene tubing, PE-160 10' | Warner Instruments | 64-0755 | |
| Dual channel heater controller, Model TC-344C | Warner Instruments | 64-2401 | |
| HC FLUOTAR L 25x/0.95 W VISIR dipping objective | Leica | 15506374 | |
| Heater controller cable | Warner Instruments | CC-28 | |
| Large bath incubation chamber with slice support | Warner Instruments | RC-27L | |
| MPII Mini-Peristaltic Pump | Harvard Apparatus | 70-2027 | |
| PM-6D Magnetic Heated Platform (incubation chamber heater) | Warner Instruments | PM-6D | |
| Pump Head Tubing Pieces For MPII Mini-Peristaltic Pump | Harvard Apparatus | 55-4148 | |
| Sample anchor (Harps) | Warner Instruments | 64-0260 | Sample anchor must be compatible with incubation chamber |
| Sloflo In-line Solution Heater | Warner Instruments | SF-28 | |
| Neonatal Injections | |||
| 10 µL Microliter Syringe Series 700, Removable Needle | Hamilton Company | 80314 | |
| 30 G Hypodermic Needles (0.5 inch) | BD PrecisionGlide | 305106 | |
| 4 inch thinwall glass capillary, no filament (1.0 mm outer diameter/0.75 mm) | WPI World Precision Instruments | TW100-4 | |
| Ethanol 99.8% (to dilute to 70% with double-distilled water [ddH2O]) | Sigma-Aldrich | V001229 | |
| AAV9.hEF1a.lox.TagBFP. lox.eYFP.lox.WPRE.hGH-InvBYF | Penn Vector Core | AV-9-PV2453 | Addgene Plasmid #45185 |
| AAV9.hEF1a.lox.mCherry.lox.mTFP 1.lox.WPRE.hGH-InvCheTF | Penn Vector Core | AV-9-PV2454 | Addgene Plasmid #45186 |
| ChAT-IRES-Cre knock-in transgenic mouse line | The Jackson Laboratory | 6410 | |
| Fast Green FCF Dye content ≥85 % | Sigma-Aldrich | F7252-25G | |
| Flaming/Brown Micropipette Puller, model P-97 | Sutter Instrument Co. | P-97 | |
| Green tattoo paste | Ketchum MFG Co | 329A | |
| Phosphate-Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | 806552 | |
| Pneumatic PicoPump | WPI World Precision Instruments | PV-820 | |
| Oxygenated artifiial cerebrospinal fluid (aCSF) Reagents | |||
| Calcium chloride dihydrate (CaCl2·2H2O) | Sigma-Aldrich | C7902 | |
| Carbogen (5% CO2, 95% O2) | AirGas | X02OX95C2003102 | Supplier may vary depending on region |
| D-(+)-Glucose | Sigma-Aldrich | G7021 | |
| HEPES, Free Acid | Bio Basic | HB0264 | |
| Hydrochloric acid solution, 1 N | Sigma-Aldrich | H9892 | |
| Magnesium chloride hexahydrate (MgCl2·6H2O) | Sigma-Aldrich | M2670 | |
| pH-Test strips (6.0-7.7) | VWR | BDH35317.604 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| Sodium chloride (NaCl) | Bio Basic | DB0483 | |
| Sodium phosphate monobasic (NaH2PO4) | Sigma-Aldrich | RDD007 | |
| Software | |||
| ImageJ | National Institutes of Health (NIH) | Open source |
参考文献
- Lefebvre, J. L., Sanes, J. R., Kay, J. N. Development of dendritic form and function. Annual Review of Cell and Developmental Biology. 31, 741-777 (2015).
- Graham, H. K., Duan, X. Molecular mechanisms regulating synaptic specificity and retinal circuit formation. Wiley Interdisciplinary Reviews Developmental biology. 10 (1), 379 (2021).
- Godinho, L., et al. Targeting of amacrine cell neurites to appropriate synaptic laminae in the developing zebrafish retina. Development. 132 (22), 5069-5079 (2005).
- Mumm, J. S., et al. In vivo imaging reveals dendritic targeting of laminated afferents by zebrafish retinal ganglion cells. Neuron. 52 (4), 609-621 (2006).
- Wong, W. T., Faulkner-Jones, B. E., Sanes, J. R., Wong, R. O. Rapid dendritic remodeling in the developing retina: dependence on neurotransmission and reciprocal regulation by Rac and Rho. The Journal of Neuroscience. 20 (13), 5024-5036 (2000).
- Wei, W., Elstrott, J., Feller, M. B. Two-photon targeted recording of GFP-expressing neurons for light responses and live-cell imaging in the mouse retina. Nature Protocols. 5 (7), 1347-1352 (2010).
- Morgan, J. L., Wong, R. O. L. Ballistic labeling with fluorescent dyes and indicators. Current Protocols in Neuroscience. 43 (1), 1-10 (2008).
- Nickerson, P. E. B., et al. Live imaging and analysis of postnatal mouse retinal development. BMC Developmental Biology. 13, 24 (2013).
- Morgan, J. L., Dhingra, A., Vardi, N., Wong, R. O. L. Axons and dendrites originate from neuroepithelial-like processes of retinal bipolar cells. Nature Neuroscience. 9 (1), 85-92 (2006).
- Coombs, J. L., Van Der List, D., Chalupa, L. M. Morphological properties of mouse retinal ganglion cells during postnatal development. The Journal of Comparative Neurology. 503 (6), 803-814 (2007).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nature Methods. 13 (7), 557-562 (2016).
- Stacy, R. C., Wong, R. O. L. Developmental relationship between cholinergic amacrine cell processes and ganglion cell dendrites of the mouse retina. The Journal of Comparative Neurology. 456 (2), 154-166 (2003).
- Kay, J. N., et al. Retinal ganglion cells with distinct directional preferences differ in molecular identity, structure, and central projections. The Journal of Neuroscience. 31 (21), 7753-7762 (2011).
- Liu, J., Sanes, J. R. Cellular and molecular analysis of dendritic morphogenesis in a retinal cell type that senses color contrast and ventral motion. The Journal of Neuroscience. 37 (50), 12247-12262 (2017).
- Diao, L., Sun, W., Deng, Q., He, S. Development of the mouse retina: emerging morphological diversity of the ganglion cells. Journal of Neurobiology. 61 (2), 236-249 (2004).
- Coombs, J., vander List, D., Wang, G. Y., Chalupa, L. M. Morphological properties of mouse retinal ganglion cells. Neuroscience. 140 (1), 123-136 (2006).
- Sanes, J. R., Masland, R. H. The types of retinal ganglion cells: current status and implications for neuronal classification. Annual Review of Neuroscience. 38, 221-246 (2015).
- Sümbül, U., et al. A genetic and computational approach to structurally classify neuronal types. Nature Communications. 5, 3512 (2014).
- Lin, B., Masland, R. H. Populations of wide-field amacrine cells in the mouse retina. The Journal of Comparative Neurology. 499 (5), 797-809 (2006).
- Macneil, M. A., Heussy, J. K., Dacheux, R. F., Raviola, E., Masland, R. H. The shapes and numbers of amacrine cells: Matching of photofilled with Golgi-stained cells in the rabbit retina and comparison with other mammalian species. Journal of Comparative Neurology. 413 (2), 305-326 (1999).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Jo, A., Xu, J., Deniz, S., Cherian, S., DeVries, S. H., Zhu, Y. Intersectional strategies for targeting amacrine and ganglion cell types in the mouse retina. Frontiers in Neural Circuits. 12, 66 (2018).
- Siegert, S., et al. Genetic address book for retinal cell types. Nature Neuroscience. 12 (9), 1197-1204 (2009).
- Kim, I. -. J., Zhang, Y., Meister, M., Sanes, J. R. Laminar restriction of retinal ganglion cell dendrites and axons: subtype-specific developmental patterns revealed with transgenic markers. The Journal of Neuroscience. 30 (4), 1452-1462 (2010).
- Peng, Y. -. R., Tran, N. M., Krishnaswamy, A., Kostadinov, D., Martersteck, E. M., Sanes, J. R. Satb1 regulates contactin 5 to pattern dendrites of a mammalian retinal ganglion cell. Neuron. 95 (4), 869-883 (2017).
- Duan, X., Krishnaswamy, A., Dela Huerta, I., Sanes, J. R. Type II cadherins guide assembly of a direction-selective retinal circuit. Cell. 158 (4), 793-807 (2014).
- Ray, T. A., et al. Formation of retinal direction-selective circuitry initiated by starburst amacrine cell homotypic contact. eLife. 7, 34241 (2018).
- Krishnaswamy, A., Yamagata, M., Duan, X., Hong, Y. K., Sanes, J. R. Sidekick 2 directs formation of a retinal circuit that detects differential motion. Nature. 524 (7566), 466-470 (2015).
- Caval-Holme, F., Zhang, Y., Feller, M. B. Gap junction coupling shapes the encoding of light in the developing retina. Current Biology. 29 (23), 4024-4035 (2019).
- Lucas, J. A., Schmidt, T. M. Cellular properties of intrinsically photosensitive retinal ganglion cells during postnatal development. Neural Development. 14 (1), 8 (2019).
- Cai, D., Cohen, K. B., Luo, T., Lichtman, J. W., Sanes, J. R. Improved tools for the Brainbow toolbox. Nature Methods. 10 (6), 540-547 (2013).
- Rossi, J., et al. Melanocortin-4 receptors expressed by cholinergic neurons regulate energy balance and glucose homeostasis. Cell Metabolism. 13 (2), 195-204 (2011).
- Lefebvre, J. L., Kostadinov, D., Chen, W. V., Maniatis, T., Sanes, J. R. Protocadherins mediate dendritic self-avoidance in the mammalian nervous system. Nature. 488 (7412), 517-521 (2012).
- Ing-Esteves, S., et al. Combinatorial effects of alpha- and gamma-protocadherins on neuronal survival and dendritic self-avoidance. The Journal of Neuroscience. 38 (11), 2713-2729 (2018).
- Williams, P. R., Morgan, J. L., Kerschensteiner, D., Wong, R. O. L. In vitro imaging of retinal whole mounts. Cold Spring Harbor Protocols. 2013 (1), (2013).
- Ramoa, A. S., Campbell, G., Shatz, C. J. Transient morphological features of identified ganglion cells in living fetal and neonatal retina. Science. 237 (4814), 522-525 (1987).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nature Biotechnology. 28 (4), 348-353 (2010).
- Cuntz, H., Forstner, F., Borst, A., Häusser, M. One rule to grow them all: a general theory of neuronal branching and its practical application. PLoS Computational Biology. 6 (8), 1000877 (2010).
- Xiao, H., Peng, H. APP2: automatic tracing of 3D neuron morphology based on hierarchical pruning of a gray-weighted image distance-tree. Bioinformatics. 29 (11), 1448-1454 (2013).
- Nanda, S., et al. Design and implementation of multi-signal and time-varying neural reconstructions. Scientific data. 5, 170207 (2018).
- Sherry, D. M., Wang, M. M., Bates, J., Frishman, L. J. Expression of vesicular glutamate transporter 1 in the mouse retina reveals temporal ordering in development of rod vs. cone and ON vs. OFF circuits. The Journal of Comparative Neurology. 465 (4), 480-498 (2003).
- Johnson, J., et al. Vesicular neurotransmitter transporter expression in developing postnatal rodent retina: GABA and glycine precede glutamate. The Journal of Neuroscience. 23 (2), 518-529 (2003).
- Jüttner, J., et al. Targeting neuronal and glial cell types with synthetic promoter AAVs in mice, non-human primates and humans. Nature Neuroscience. 22 (8), 1345-1356 (2019).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. Journal of Visualized Experiments: JoVE. (31), e1333 (2009).
- Lye, M. H., Jakobs, T. C., Masland, R. H., Koizumi, A. Organotypic culture of adult rabbit retina. Journal of Visualized Experiments: JoVE. (3), e190 (2007).
- Pignatelli, V., Strettoi, E. Bipolar cells of the mouse retina: a gene gun, morphological study. The Journal of Comparative Neurology. 476 (3), 254-266 (2004).
- Huckfeldt, R. M., et al. Transient neurites of retinal horizontal cells exhibit columnar tiling via homotypic interactions. Nature Neuroscience. 12 (1), 35-43 (2009).
- Prahst, C., et al. Mouse retinal cell behaviour in space and time using light sheet fluorescence microscopy. eLife. 9, 49779 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。