Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Покадровая визуализация арборизации нейронов с использованием разреженной аденоассоциированной вирусной маркировки генетически целевых популяций клеток сетчатки
В этой статье
Резюме
Здесь мы представляем метод исследования морфогенеза нейритов в постнатальных эксплантах сетчатки мышей методом покадровой конфокальной микроскопии. Описан подход к разреженной маркировке и приобретению типов клеток сетчатки и их тонких процессов с использованием рекомбинантных аденоассоциированных вирусных векторов, которые экспрессируют мембранно-целевые флуоресцентные белки cre-зависимым образом.
Аннотация
Обнаружение механизмов, которые формируют дендритные беседки, требует методов визуализации, изображения и анализа дендритов во время развития. Сетчатка мыши является мощной модельной системой для исследования специфических для типа клеток механизмов морфогенеза и связности нейронов. Организация и состав подтипов сетчатки четко определены, и генетические инструменты доступны для доступа к конкретным типам во время развития. Многие типы клеток сетчатки также ограничивают свои дендриты и / или аксоны узкими слоями, что облегчает покадровую визуализацию. Эксплантные культуры сетчатки мышей хорошо подходят для визуализации живых клеток с использованием конфокальной или многофотонной микроскопии, но методы, оптимизированные для визуализации динамики дендритов с временным и структурным разрешением, отсутствуют. Здесь представлен метод разреженной маркировки и изображения развития специфических популяций сетчатки, отмеченных системой Cre-Lox. Коммерчески доступные аденоассоциированные вирусы (AAV), используемые здесь, экспрессировали мембранно-целевые флуоресцентные белки cre-зависимым образом. Внутриглазная доставка AAV у неонатальных мышей производит флуоресцентную маркировку целевых типов клеток через 4-5 дней после инъекции (dpi). Мембранные флуоресцентные сигналы обнаруживаются с помощью конфокальной визуализации и разрешают тонкие ветви структур и динамику. Высококачественные видео, охватывающие 2-4 часа, получены из плоских креплений сетчатки, перфузированных оксигенированной искусственной спинномозговой жидкостью (aCSF). Также предоставляется конвейер постобработки изображений для деконволюции и трехмерной (3D) коррекции дрейфа. Этот протокол может быть использован для захвата нескольких клеточных поведений в интактной сетчатке и для выявления новых факторов, контролирующих морфогенез нейритов. Многие стратегии развития, изученные в сетчатке, будут иметь отношение к пониманию формирования нейронных цепей в других частях центральной нервной системы.
Введение
Дендриты нейронов сетчатки образуют сложные, но специфические паттерны, которые влияют на их функцию в нейронных цепях. В сетчатке позвоночных различные типы ганглиозных клеток сетчатки (RGC) и интернейроны амакриновых клеток имеют уникальную дендритную морфологию, которая отличается размером беседки, расположением, длиной ветвей и плотностью1. Во время постнатального развития RGC и амакриновые клетки распространяют обильные дендритные процессы в нейропил, называемый внутренним плексиформным слоем (IPL), где они получают биполярные клеточные входы, передающие сигналы фоторецепторов2. С учетом покадровой визуализации флуоресцентно меченых популяций сетчатки у личинок цыплят или рыбок данио, морфогенез дендритов очень динамичен3,4,5. В течение нескольких дней дендритные беседки расширяются, реконструируются и разветвляются до узких подслоев IPL, где они синапсируются с избранными партнерами. Беседки демонстрируют различную структурную динамику над развитием, с изменениями относительных скоростей добавления ветвей, втягивания и стабилизации. Дендриты амакрина и RGC также демонстрируют различное поведение роста и ремоделирования, которое может отражать типоспецифическую арборизацию. Тем не менее, эти исследования отслеживали широкие популяции амакрина или RGC и были сосредоточены на ламинарном нацеливании, которое является лишь одним из аспектов морфологии.
Механизмы, которые производят огромное морфологическое разнообразие, наблюдаемое среди подтипов сетчатки, плохо изучены. Целью этой группы была разработка метода захвата динамики дендритов и ремоделирования беседки определенных подтипов сетчатки у мышей. Идентификация специфических для типа клеток механизмов дендритового паттерна требует методов визуализации и измерения дендритового поведения интересующих клеток. Органотипические культуры сетчатки мышей хорошо подходят для исследований изображений живых клеток с использованием конфокальной или многофотонной микроскопии. Развивающиеся сетчатки рассекаются и монтируются в плоскую эксплант, которая может быть изображена в течение нескольких часов в записывающей камере или культивирована в течение нескольких дней с ограниченным воздействием на схему6,7. Живые нейроны сетчатки могут быть помечены различными методами, включая заполнение красителем электродами, электропорацию, биолистическую доставку частиц, покрытых липофильными красителями или плазмидами, кодирующими флуоресцентные белки (например, Gene Gun), а также генетически закодированные клеточные метки7,8,9,10 . Однако эти подходы неэффективны для визуализации динамики дендритов конкретных подтипов сетчатки. Например, методы наполнения красителем имеют низкую пропускную способность и требуют электрофизиологического аппарата и дополнительных генетических меток для надежного нацеливания на интересующие клетки. Кроме того, сильные флуоресцентные сигналы в соме могут скрывать близлежащие дендриты.
Биолистические методы доставки генов могут одновременно маркировать десятки клеток, но этапы, включающие доставку частиц высокого давления и ночную инкубацию изолированной сетчатки, могут поставить под угрозу физиологию клеток и дендритный рост. В этой статье предполагается, что последние генетические инструменты могут быть использованы для захвата ранней динамики дендритов с типом клеток и структурным разрешением, учитывая следующие экспериментальные критерии. Во-первых, чтобы разрешить тонкие ветви и филоподии, которые доминируют над развивающимися беседками, метод должен маркировать нейроны яркими, флуоресцентными белками, которые заполняют процессы во всей беседке. Флуоресцентная маркировка не должна исчезать из-за фотоотбеливания в течение периода визуализации. Различные варианты флуоресцентных белков были сгенерированы и сравнены на предмет пригодности для визуализации in vivo/ex vivo11 на основе яркости и фотостабильности. Во-вторых, флуоресцентные белки (XFP) должны быть выражены на достаточно высоких уровнях на самой ранней стадии морфогенеза дендритов, чтобы не пропустить узкое окно развития. При анализе статических временных точек в сетчатке мыши развитие дендрита происходит в течение первой постнатальной недели и включает фазы роста, ремоделирования и стабилизации10,12,13,14,15. В-третьих, метод должен привести к селективной маркировке или к повышенной вероятности маркировки интересующей нейронной субпопуляции. В-четвертых, маркировка целевой субпопуляции должна быть достаточно разреженной, чтобы можно было идентифицировать и проследить всю нейрональную беседку. Хотя подтипы RGC и amacrine можно отличить по их зрелым морфологическим характеристикам и моделям стратификации IPL16,17,18,19,20, задача состоит в том, чтобы идентифицировать подтипы во время развития на основе незрелых структур. Этой задаче способствует расширение трансгенных инструментов для маркировки конкретных типов клеток сетчатки во время развития.
Трансгенные и мышиные линии, в которых клеточная и временная экспрессия флуоресцентных белков или Cre определяется регуляторными элементами генов, широко используются для изучения типов клеток сетчатки13,21,22,23. Основные наблюдения за субтип-специфическими паттернами развития дендритов были получены из исследований трансгенных сетчаток мыши в статических точках времени10,14,24,25. Система Cre-Lox, в частности, позволяет осуществлять изысканные манипуляции с генами и мониторинг подтипов с использованием различных рекомбиназозависимых репортеров, датчиков и оптогенетических активаторов. Эти инструменты привели к открытию подтип-специфических молекулярных программ и функциональных свойств, которые лежат в основе сборки схем сетчатки26,27,28,29,30. Тем не менее, их еще предстоит использовать для изучения подтип-специфической динамики дендритов в сетчатке мыши. Маркировка низкой плотности может быть достигнута путем объединения линий мыши Cre с трансгенами, введенными электропорацией или рекомбинантными AAV. При наличии также могут быть использованы тамоксифен-индуцируемые линии Cre или интерсекциональные генетические стратегии. Наконец, клетка должна быть помечена минимально инвазивным способом и визуализирована с использованием параметров приобретения, чтобы не компрометировать ткань или не вмешиваться в клеточную функцию, необходимую для морфогенеза дендрита.
Здесь представлен метод применения трансгенных инструментов и конфокальной микроскопии для исследования динамики дендритов в живых эксплантах сетчатки живых мышей. Трансгенные линии мыши Cre были объединены с векторами AAV, которые экспрессируют флуоресцентные белки при рекомбинации Cre, что позволяет разреженно маркировать интересующие клетки сетчатки. Коммерчески доступные AAV доставляются в неонатальную сетчатку с помощью интравитреальных инъекций. В этой статье показано, что AAV производят значительно высокую и специфическую для типа клеток флуоресцентную экспрессию на 4 dpi, что позволяет получить доступ к постнатальным временным точкам. Чтобы проиллюстрировать этот подход, холинергический «звездообразующий» интернейрон амакрина был помечен путем доставки Brainbow AAV у неонатальных мышей, экспрессирующих холинацетилтрансферазу (ChAT)-внутренний сайт входа рибосомы (IRES)-Трансген Cre, который активен в ранней постнатальной сетчатке31,32. Звездообразующие амакриновые клетки развивают стереотипную и радиальную морфологию беседки, которая формируется дендрритным самоизбытием, опосредованным кластеризованными протокадгеринами33,34. В данной работе показано, что разрешение звездообразования дендритов и филоподий значительно улучшается XFP к плазматической мембране с добавлением мотива CAAX, который подвергается фарнезилированию, как это используется для Brainbow AAVs31. Наконец, были определены протоколы покадровой визуализации и постобработки, которые дают высококачественные изображения, поддающиеся реконструкции дендритов и морфометрической количественной оценке. Этот протокол может быть использован для идентификации факторов, контролирующих морфогенез дендритов, и для захвата нескольких клеточных поведений в интактной сетчатке.
протокол
ПРИМЕЧАНИЕ: Этот протокол охватывает 2 дня с минимальным периодом 4-5 дней для вирусной трансдукции между экспериментальными днями (рисунок 1A). Эксперименты на животных проводятся в соответствии с Руководящими принципами Канадского совета по уходу за животными для использования животных в исследованиях и уходе за лабораторными животными в соответствии с протоколами, утвержденными Комитетом по использованию и уходу за животными Лаборатории по обслуживанию животных при Больнице для больных детей (Торонто, Канада).
1. Подготовка к неонатальным инъекциям AAV и эксперименты по визуализации
- Выберите линию мыши Cre, чтобы пометить интересующие популяции клеток сетчатки. Подтвердить экспрессию рекомбиназы Cre во время инъекций AAV путем скрещивания с трансгенным репортером Cre или путем иммуноокраширования антителом Cre.
- Разводите трансгенных мышей Cre (8-16 недель) для получения Cre-положительных неонатальных животных.
ПРИМЕЧАНИЕ: Для этой демонстрации мыши ChAT-IRES-Cre использовались для нацеливания на холинергические амакриновые клетки Starburst. - Получить рекомбиназно-зависимый вирус AAV, кодирующий флуоресцентный белок (белки). Для оптимальной маркировки тонких процессов выбирайте векторы, которые выражают модифицированные XFP, нацеленные на плазматическую мембрану.
ПРИМЕЧАНИЕ: В этом исследовании использовались вирус Brainbow (BBV), AAV-EF1a-BbTagBY и AAV9-EF1a-BbChT (см. Таблицу материалов), которые предоставляют возможность для многоцветной маркировки (рисунок 1B). Фарнезилированный улучшенный желтый флуоресцентный белок (eYFP) и мономерная экспрессия Cherry (mCherry) произвели самые сильные флуоресцентные сигналы для живой визуализации. Один BBV может быть использован для изображения отдельных беседок, в то время как совместная инъекция BBV может быть использована для маркировки большего количества клеток или соседних беседок с отчетливыми флуорофорами. При использовании нескольких флуоресцентных белков обеспечьте минимальное перекрытие спектра излучения (рисунок 1С). Параметры захвата микроскопа должны быть скорректированы для захвата различных сигналов XFP. - Подготовьте ∼3-5 мкл аликвот ААВ в отдельных низкосвязывающих трубках для одноразовых запасов, чтобы избежать циклов замораживания/оттаивания. Хранить при температуре -80 °C.
- Приготовьте боросиликатные стеклянные микропипетты с очень тонкими наконечниками с помощью съемника микропипетки.
ПРИМЕЧАНИЕ: Настройки съемника варьируются в зависимости от используемой нити накала и съемника; Окончательный размер и форму наконечника см. на рисунке 2A . Типичный диаметр капель составляет 600 мкм. - Получите систему микроинъекции и связанные с ней трубки. Подключите микроинжектор к воздушному порту под давлением.

Рисунок 1: Экспериментальный обзор. (A) Этот протокол охватывает 2 дня экспериментов с минимальным 4-5-дневным периодом заражения между экспериментальными днями. Внутриглазные инъекции выполняются неонатальным мышам не старше 3-го дня. Затем сетчатка рассекается, устанавливается плоско и в реальном времени, чтобы захватить желаемое окно развития. Меченые клетки могут быть визуализированы в любое время после требуемых 4-5 дней, необходимых для экспрессии вируса, поскольку нет никаких видимых эффектов длительной экспрессии AAV на морфологию дендрита. (B) Крезависимые векторы Brainbow AAV (BBV) вводят животным, экспрессирующим Cre31. В этом исследовании мыши ChAT-Cre использовались для рекомбинации Cre в звездообразующих амакриновых клетках. Два BBV кодируют модифицированный eYFP или tagBFP, или mCherry и mTFP, которые заканчиваются мотивом CAAX , который последовательно фарнезилируется для локализации мембраны. Локсские участки изображены треугольниками. Векторы экспрессируют фарнезилированные XFP стохастическим и комбинаторным способом, зависящим от рекомбинации Cre. Промотор EF1α включает регуляторные элементы из гена фактора удлинения 1α. W представляет собой элементы из посттранскрипционного регуляторного элемента вируса гепатита Вудчака, а pA указывает на последовательность полиаденилирования. (C) Спектры возбуждения и излучения mCherry и eYFP, флуорофоров BBV, изображенных в этом исследовании. При визуализации в реальном времени нескольких флуоресцентных белков параметры обнаружения должны быть организованы таким образом, чтобы адекватно разделять спектры излучения на отдельные каналы. Сокращения: AAV = аденоассоциированный вирус; BBV = Brainbow AAV; ChAT = холин ацетилтрансфераза; iRES = внутренний сайт входа рибосомы; eYFP = усиленный желтый флуоресцентный белок; iTR = инвертированный терминальный повтор; tagBP = бирка синего флуоресцентного белка; m Вишня = мономерная вишня; mTFP = флуоресцентный белок чирка; XFP = любой флуоресцентный белок; EF1α= коэффициент удлинения 1 альфа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Интравитреальные инъекции AAV у мышей-новорожденных
- Разморозьте аликвоту AAV на льду. Приготовьте разбавление ~1:4 AAV с использованием стерильного физиологического раствора или фосфатно-буферного физиологического раствора. Приготовьте ~ 0,5 мкл разведения AAV на животное (~ 0,25 мкл на глаз) на случай, если микропипетка сломается, и новая пипетка должна быть заполнена. Храните оставшийся неразбавленный AAV при 4 °C и используйте в течение 2 недель.
ПРИМЕЧАНИЕ: В этом эксперименте концентрация AAV поставщика составляла ~1-2 × 1013 содержанием генома (GC)/мл и разбавлялась до конечной концентрации 4 × 1012 ГК/мл. Оптимизировать концентрацию вируса для получения желаемой плотности маркировки. - Для визуализации инъекций добавляют примерно 1 мкл 0,02% раствора красителя Fast Green FCF на каждые 15 мкл разведения AAV, чтобы окрасить раствор в синий цвет.
- Перенесите клетку для мыши с дамбой и пометом новорожденных (послеродовой день (P) 0,5-3) в процедурный кабинет с оборудованием для микроинъекций. Держите животных в одной клетке с гнездами и подстилкой, чтобы свести к минимуму материнский стресс и отторжение детенышей.
- Стерилизуйте область инъекции 70% этанолом и поместите стерильные прокладки для подгузников на поверхности скамейки. Подготовьте теплую платформу (например, грелку) для восстановления после анестезии, вызванной гипотермией.
- Засыпьте микропипетку разбавлением AAV с помощью микрошприца. Под стереомикроскопом разбейте наконечник микропипетки иглой весом 30 Г, чтобы распечатать наконечник.
ПРИМЕЧАНИЕ: На рисунке 2А показан задний заполненный наконечник - как герметичный (сверху), так и незапечатанный (посередине). - Обезболивать неонатальных мышей путем переохлаждения, помещая на лед 1-2 животных. Поместите животных на латексную перчатку, чтобы защитить кожу от прямого контакта со льдом. Как только животное перестанет двигаться в ответ на ущемление лапы (~2 мин), поместите животное под стереомикроскоп. При желании татуируйте подушечки лап чернилами для татуировок и иглой 30 г, а также собирайте обрезки хвоста для выделения ДНК, чтобы идентифицировать животных путем генотипирования.
ПРИМЕЧАНИЕ: Соответствующий мониторинг глубины анестезии должен происходить на протяжении всей процедуры. - Смажьте кожу, покрывающую глаза, 70% этанолом. Используйте иглу весом 30 г, чтобы открыть сросшееся веко (рисунок 2B). Приложите легкое давление пальцами, чтобы открыть глаз, и проткните небольшое отверстие через роговицу в соединении роговица-склера (рисунок 2C).
- Вставьте стеклянную микропипетку в отверстие и нажмите на ножную педаль микроинжектора 2-4 раза, чтобы ввести AAV в интравитреальное пространство. Медленно извлеките микропипетку и подтвердите инъекцию AAV, визуализируя синий краситель через зрачок (рисунок 2D).
ПРИМЕЧАНИЕ: При давлении выброса 6-8 фунтов на квадратный дюйм и времени импульса 600-800 мс выбрасывается капля диаметром 600 мкм (рисунок 2A, внизу). Приблизительно 0,23-0,45 мкл раствора AAV вводится на глаз. Синий раствор снаружи глаза указывает на то, что AAV не был введен в глаз. Утечка синего раствора из места инъекции указывает на то, что AAV, возможно, просочился наружу, снижая эффективность трансфекции. - Осторожно прижмите веки друг к другу, чтобы снова запечатать, и поместите щенка на грелую прокладку. Как только животные восстановятся в розоватом цвете и будут реагировать, осторожно перенесите их обратно в клетку.
ПРИМЕЧАНИЕ: Убедитесь, что приняты соответствующие меры предосторожности, чтобы избежать слишком быстрого повторного нагрева щенков. - Повторите процедуру инъекции для оставшихся животных в помете. Оставьте минимум 4-5 дней для вирусной трансдукции, прежде чем визуализировать сетчатку.

Рисунок 2: Внутриглазные инъекции новорожденным. (А) Микропипетка с обратным заполнением показывает форму кончика пипетки при герметизации (сверху) и после того, как наконечник расстегнут (внизу, слева). Пико-давление впрыска 6-8 фунтов на квадратный дюйм и время импульса 600-800 мс производят каплю диаметром 600 мкм (внизу, справа). Шкала стержня = 1 мм.(B) Обезболенный щенок P0 при 16-кратном увеличении. Сросшееся соединение век (белое) разрезается с помощью острой иглы 30 G. Шкала стержня = 2 мм. (C) Легкое давление, приложенное к глазу, обнажает роговицу; шкала стержня = 2 мм. Увеличенный участок (красный) показывает небольшое отверстие на стыке роговицы и склеры (желтое), созданное иглой 30 G; шкала стержня = 0,5 мм. (D) Снятие наконечника пипетки после впрыска (слева). Быстрый зеленый краситель в растворе AAV проявляется как сине-серый через зрачок (средний), по сравнению со светлым цветом зрачка до инъекции (справа). Шкала стержня = 1 мм. (E) Через 4 дня веко зажило и срослось (слева); шкала стержня = 2 мм. При энуклеации видно зажившее место инъекции (желтый); шкала = 1 мм. Обратите внимание на расположение места инъекции на границе между роговицей и склерой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Рассечение сетчатки для визуализационного эксперимента
- Готовят сетчатку aCSF (119 мМ NaCl, 2,5 мМ KCl, 1,3 мМ MgCl2·6H2O, 2,5 мМ CaCl2·2H2O, 1 мМ NaH2PO4, 11 мМ глюкозы и 20 мМ 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота (HEPES free acid)35. При желании приготовьте и заморозьте 10-кратный раствор; разморозить и разбавить до 1 раза по мере необходимости.
- Насыщают оксигеном aCSF сетчатки, пузыря с карбогеном (95% O2, 5% CO2) в течение минимум 15 мин. Отрегулируйте pH до 7,4. Хранить в герметичном контейнере до использования, чтобы гарантировать, что aCSF остается насыщенным кислородом.
ПРИМЕЧАНИЕ: Сетчатке требуется высокая концентрация O2. Важно поддерживать оксигенацию aCSF на протяжении всего эксперимента. - Вставьте чашку Петри диаметром 60 мм в лоток для льда (сделайте лоток для льда из лабораторного пластика, например, крышку коробки для пипетки) и поместите ее под стереомикроскоп. Наполните чашку Петри насыщенным кислородом сетчаткой aCSF.
- Усыпляют мышей P9 и моложе путем обезглавливания. Эвтаназия мышей P10 и старше путем индукции изофлурана или альтернативным методом, одобренным в соответствии с протоколом животных, с последующим обезглавливанием.
- Если веки запечатаны, обрежьте лоскут века, чтобы обнажить глаз. Используйте щипцы для энуклеации глаз и переведите их в холодную сетчатку aCSF с шага 3.3.
- Чтобы рассечь чашечку сетчатки под стереомикроскопом (увеличение 25x), стабилизируйте глаз, обхватив зрительный нерв с помощью щипца Дюмона No 5 (рисунок 3A).
- Проткните отверстие в центре роговицы иглой 30 Г, а затем вставьте один кончик микросубчиков в отверстие, чтобы сделать разрез от отверстия до конца роговицы. Повторите, чтобы сделать 4 среза по сторонам света, создав 4 «лоскута» (рисунок 3A).
- С помощью двух щипцов Дюмона No 5 схватите и раздвиньте два соседних лоскута, осторожно отшелушивая склеру от сетчатки. Повторите с оставшимися лоскутами роговицы и удалите склеру из сетчатки (рисунок 3B).
- Снимите хрусталик с чашечки сетчатки с помощью щипцов. С помощью микросублиц, сделайте 4 радиальных разреза от края сетчатки в сторону зрительного нерва, создав 4 равных лепестка (рисунок 3B). Повторите шаги 3.4-3.7 для второго глаза.
4. Подготовка к плоскому креплению сетчатки
- Подготовьте серые мембранные фильтрующие диски из эфира целлюлозы (MCE) для монтажа. При использовании мембранных фильтров MCE большого диаметра разрежьте диск на квадранты (примерно 1 см в поперечнике). Поместите диск MCE в центр большой белой фильтровальной бумаги (рисунок 3D).
ПРИМЕЧАНИЕ: Фильтры MCE также доступны в дисках диаметром 1 см. Фильтрующий диск MCE должен быть достаточно большим, чтобы вместить 1-2 сетчатки, но достаточно маленьким, чтобы поместиться в камере визуализации. Поскольку мембраны MCE удерживают статический заряд, минимизируйте контакт и обработку мембраны MCE. - Обрабатывая сетчатку с помощью двух кистей размера 3/0, переверните одну чашку сетчатки на кисть с ганглиозной клеткой сетчатки стороной вниз. Осторожно поднимите сетчатку из aCSF, убедившись, что натяжение воды не разрывает сетчатку (рисунок 3C).
- Все еще держа кисть с сетчаткой, используйте переносную пипетку, чтобы поместить каплю aCSF в центр фильтровальной бумаги MCE (рисунок 3C, справа). Поместите сетчатку в каплю aCSF, созданную поверхностным натяжением. Используйте кисти, чтобы расположить RGC сетчатки стороной вверх внутри капли и развернуть четыре лепестка.
- После позиционирования создайте водный мост между кистью и белой фильтровальной бумагой, чтобы разрушить поверхностное натяжение капли.
ПРИМЕЧАНИЕ: Когда aCSF удаляется, сетчатка будет прилипать к фильтровальной бумаге MCE (рисунок 3D, E). Плоские сетчатки можно обрабатывать, захватывая диск MCE щипцами. Если капля aCSF быстро оттекает до формирования водного моста, это может указывать на то, что мембрана MCE не заряжена. Используйте свежую мембрану MCE и минимизируйте время между энуклеацией и визуализацией путем рассечения и плоского монтажа сетчатки непосредственно перед перемещением сетчатки в камеру визуализации.

Рисунок 3: Рассечение сетчатки и плоское крепление на смешанных мембранах фильтрующего эфира целлюлозы. (А) Слева энуклеированный глаз стабилизируется путем захвата зрительного нерва щипцами Дюмона No 5 (слева). Небольшое отверстие создается в центре роговицы с помощью иглы 30 г (в центре). Микродиссекционные ножницы используются для разрезания роговицы на 4 равных лоскута (справа). Шкала стержня = 1 мм. (B) Рассеченная сетчатка со склерой, отслоенной с помощью двух щипцов Дюмона #5 (слева) и со снятой линзой (в центре). Сетчатка с 4 равными разрезами на полпути в сетчатку (справа). Шкала = 1 мм. (C) Обработка сетчатки двумя тонкими кистями (размер 3/0, слева). Сетчатка перевернулась с ганглиозными клетками сетчатки стороной вниз на кисть (в центре) и поднялась из aCSF, убедившись, что натяжение воды не разрывает сетчатку (справа). Шкала = 2 мм. (D) Серый мембранный диск MCE помещен на белую фильтровальную бумагу (слева). Капля aCSF на диске MCE (справа). Шкала = 1 см. (E) После плавания сетчатки в каплю и их позиционирования создайте водный мост с белой фильтровальной бумагой, чтобы вместить aCSF, потянув сетчатку на заряженную бумагу MCE (слева); шкала = 1 см. Увеличенное изображение мембраны MCE (красный) показывает 2 сетчатки, установленные с ганглиозными клетками сетчатки, стороной вверх (справа); шкала стержня = 2 мм. Одна сетчатка очерчена белым цветом. Сокращения: MCE = смешанный эфир целлюлозы; aCSF = искусственная спинномозговая жидкость. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Покадровая конфокальная визуализация живых препаратов сетчатки с цельным креплением
- Соберите инкубационную камеру с живой визуализацией для вертикального конфокального микроскопа, как показано на рисунке 4.
ПРИМЕЧАНИЕ: Для перевернутых конфокальных систем плоские крепления размещаются стороной RGC вниз непосредственно на стеклянном нижнем крышке инкубационной камеры. Как только сетчатка вступает в контакт с покровом, их нельзя перемещать. - Наполните камеру насыщенным кислородом aCSF, включите насос и регулятор температуры (температура 32-34 °C, расход 1 мл/мин). Не допускайте повышения температуры выше 34 °C.
- Чтобы перенести плоское крепление сетчатки в перфузионную камеру, остановите насос и удалите aCSF, который находится в камере. Поместите диск MCE с плоским креплением сетчатки в (пустую) инкубационную камеру.
- Поместите вес образца на плоское крепление; предварительно смажьте вес, чтобы нарушить поверхностное натяжение. Наполните камеру нагретым aCSF и циркулируйте aCSF со скоростью ~1 мл/мин.
- Поместите носовую часть с 25-кратным водоопускательным объективом (числовая диафрагма 0,95) в камеру визуализации. Экран для меченых клеток, представляющих интерес, с использованием эпифлуоресцентного света (рисунок 4C).
- Отрегулируйте объем изображения, чтобы захватить интересующие дендритные особенности.
ПРИМЕЧАНИЕ: Это исследование зафиксировало полную дендритную беседку при 1024 x 1024 пикселях на кадр, z-шаг 1 мкм и частоту кадров 2 мин между каждым z-стеком. Окончательные размеры изображения ~ 100 мкм x 100 мкм x 20 мкм. - Чтобы настроить мощность лазера на оптимальную настройку, используйте таблицу поиска, которая идентифицирует как перенасыщенные, так и недонасыщенные пиксели. Во время сканирования отрегулируйте мощность лазера таким образом, чтобы ни один пиксель не был перенасыщен (т.е. с интенсивностью 255 или выше). Продолжайте визуализацию до тех пор, пока это необходимо, или до тех пор, пока не произойдет значительного и обнаруживаемого снижения флуоресцентного сигнала и увеличения шума (обычно 2-4 ч).
ПРИМЕЧАНИЕ: Рекомендуется уменьшить мощность лазера, так как алгоритмы деконволюции работают оптимально, когда пиксели распределены по всему динамическому диапазону. Интенсивность пикселей не должна превышать 254; Эмпирический анализ нейритов показал, что значения пикселей ниже 170 идеально подходят для деконволюции. Высокая скорость сканирования (400-600 Гц) с усреднением строк (2-3) предпочтительнее одиночного, более медленного сканирования с тем же общим временем ожидания пикселя. Область длительной визуализации часто имеет фотоблоки, но другие эксплантные участки остаются жизнеспособными. Несколько областей в плоском креплении могут быть сфотографированы, каждая в течение 2-4 ч, с общим временем инкубации 6 часов. Сеансы визуализации после 6 ч не подвергались систематическому тестированию. Деградация нейритов и блеббинг являются признаками того, что жизнеспособность экспланта снижается. - После визуализации зафиксируйте плоские крепления сетчатки и мембранный фильтр холодным 4% параформальдегидом в течение 1-2 ч при 4 °C. Усиливайте флуоресцентные метки в фиксированных сетчатках с помощью иммуногистохимии для дальнейших анализов.
ПРИМЕЧАНИЕ: Поствизуальная фиксация невозможна при использовании перевернутого конфокала; сетчатки не удаляются без разрушения тканей.
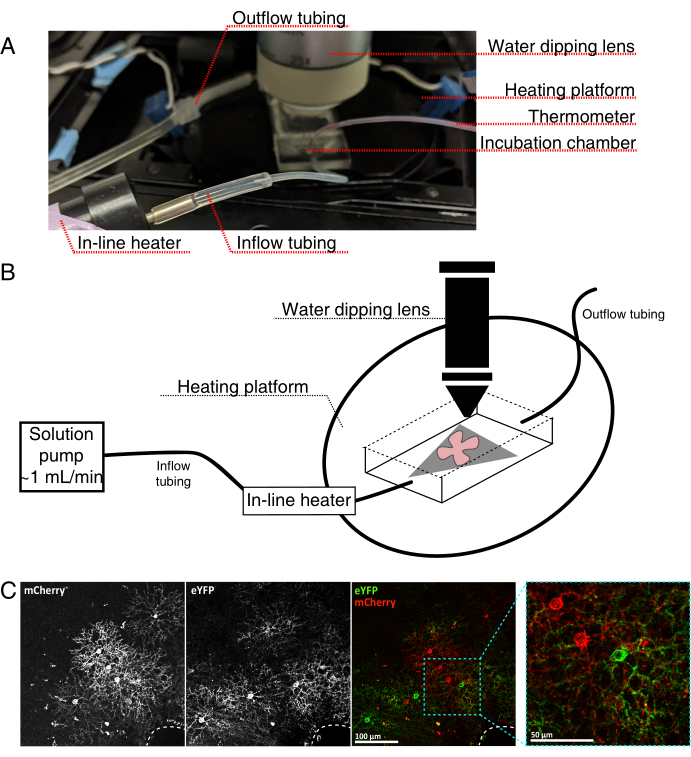
Рисунок 4: Установка инкубационной камеры визуализации живых клеток. (A) Инкубационное устройство с живой визуализацией, показывающее компоненты нагрева, раствора и визуализации. Двойной нагреватель включает в себя платформу с подогревом инкубационной камеры (задний круг с синими соединительными электродами) и встроенный нагреватель раствора. (B) Принципиальная схема 4A. Плоское крепление сетчатки (красное) на мембране MCE (серое) помещается в инкубационную камеру. Встроенный нагреватель раствора соединен с насосом раствора (не изображен на рисунке 4А). Размеры камеры визуализации обеспечивают хорошую рабочую зону для опускающегося объективного носа. (C) 25-кратный вид эксплантата сетчатки, вводимого с 0,23-0,45 мкл 4 × 1012 ГК/мл разбавления AAV; шкала бар = 100 мкм. Плотная маркировка клеток часто окружает головку зрительного нерва (пунктирная линия, внизу справа); шкала шкалы = 50 мкм. Сокращения: MCE = смешанный эфир целлюлозы; GC = копии генома; m Вишня = мономерная вишня; eYFP = усиленный желтый флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Деконволюция и постобработка изображений в ImageJ
- Импортируйте серию изображений, разделите серию по времени и цвету, если это многоцветное изображение. Убедитесь, что все временные точки для одного цвета содержатся в одной папке.
ПРИМЕЧАНИЕ: Импорт биоформатов при использовании ImageJ (биоформаты автоматически включаются в FIJI). - Создайте теоретическую функцию точечного разброса (PSF) с помощью плагина ImageJ, Diffraction PSF 3D.
ПРИМЕЧАНИЕ: Каждый канал визуализации требует своего собственного PSF, поскольку длина волны флуоресцентного излучения белка влияет на PSF. - Использование плагинов | Макросы | Запустите для выполнения пакетной параллельной итеративной деконволюции для всех временных точек с помощью предоставленного макроса (дополнительный файл 1).
ПРИМЕЧАНИЕ: Этот макрос выполняет 25 итераций итеративного алгоритма Landweber (WPL) wiener Filter Preconditioned Landweber (WPL). Каждый цветовой канал должен быть деконволюцией отдельно. - Объедините цветовые каналы и скомпилируйте все временные точки в Гиперстек (Image | Гиперстеки | Стеки в Гиперстек). Исправьте 3D-дрейф с помощью плагинов | Регистрационный | Правильный 3D дрифт.
- Возврат изображения в обычный стек (Image | Гиперстеки | Hyperstack to Stack) и разделение временных точек (Image | Стеки | Инструменты | Сплиттер стека). Используйте пакетную обработку для создания максимальной проекции для всех временных точек (Process | Пакетная | Макро | run("Z Project...", "projection=[Max Intensity]"); ).
- Импорт последовательности покадровых изображений (файл | Импорт | Последовательность изображений). Используйте обычные инструменты ImageJ для желаемого анализа деконволюционного и постобработанного двумерного (2D) видео.
ПРИМЕЧАНИЕ: Четырехмерные (3D + время) деконволюционные и дрифт-скорректированные видео можно рассматривать как гиперстек. Опустите предыдущий шаг, чтобы сохранить 3D-точки времени.
Результаты
Используя вышеуказанный протокол, было получено, деконволюционное и скорректировано для 3D-дрейфа 3D-видео с высоким разрешением разработки дендритов звездообразующих клеток. Максимальные проекции Z-плоскости были созданы для создания 2D-видео для анализа (Дополнительное видео 1
Обсуждение
Это видео демонстрирует экспериментальный конвейер, который использует существующие генетические инструменты для изображения динамики дендритов развивающихся нейронов сетчатки с помощью конфокальной живой визуализации. Также продемонстрированы внутриглазные инъекции Cre-зависимы...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим Мэдисон Грей за то, что она протянула мне руку, когда у меня ее не было. Это исследование было поддержано грантом NSERC Discovery Grant (RGPIN-2016-06128), стипендией Слоуна в области неврологии и канадской исследовательской кафедрой Tier 2 (для J.L.L.L). S. Ing-Esteves был поддержан Программой исследований в области науки о зрении и NSERC Postgraduate Scholarships-Doctorals.
Материалы
| Name | Company | Catalog Number | Comments |
| Addgene viral prep #45185-AAV9 | |||
| Addgene viral prep #45186-AAV9 | |||
| Dissection tools | |||
| Cellulose filter paper | Whatman | 1001-070 | |
| Dumont #5 fine forceps | FST | 11252-20 | Two Dumont #5 forceps are required for retinal micro-dissection |
| Dumont forceps | VWR | 82027-426 | |
| Fine Scissors | FST | 14058-09 | |
| Mixed cellulose ester membrane (MCE) filter papers, hydrophilic, 0.45 µm pore size | Millipore | HABG01 300 | |
| Petri Dish, 50 × 15 mm | VWR | 470313-352 | |
| Polyethylene disposable transfer pipette | VWR | 470225-034 | |
| Round tip paint brush, size 3/0 | Conventional art supply store | Two size 3/0 paint brushes (or smaller) are required for retinal flat-mounting | |
| Surgical Scissors | FST | 14007-14 | |
| Vannas Spring Scissors - 2.5 mm Cutting Edge | FST | 15000-08 | |
| Live-imaging incubation system | |||
| Chamber polyethylene tubing, PE-160 10' | Warner Instruments | 64-0755 | |
| Dual channel heater controller, Model TC-344C | Warner Instruments | 64-2401 | |
| HC FLUOTAR L 25x/0.95 W VISIR dipping objective | Leica | 15506374 | |
| Heater controller cable | Warner Instruments | CC-28 | |
| Large bath incubation chamber with slice support | Warner Instruments | RC-27L | |
| MPII Mini-Peristaltic Pump | Harvard Apparatus | 70-2027 | |
| PM-6D Magnetic Heated Platform (incubation chamber heater) | Warner Instruments | PM-6D | |
| Pump Head Tubing Pieces For MPII Mini-Peristaltic Pump | Harvard Apparatus | 55-4148 | |
| Sample anchor (Harps) | Warner Instruments | 64-0260 | Sample anchor must be compatible with incubation chamber |
| Sloflo In-line Solution Heater | Warner Instruments | SF-28 | |
| Neonatal Injections | |||
| 10 µL Microliter Syringe Series 700, Removable Needle | Hamilton Company | 80314 | |
| 30 G Hypodermic Needles (0.5 inch) | BD PrecisionGlide | 305106 | |
| 4 inch thinwall glass capillary, no filament (1.0 mm outer diameter/0.75 mm) | WPI World Precision Instruments | TW100-4 | |
| Ethanol 99.8% (to dilute to 70% with double-distilled water [ddH2O]) | Sigma-Aldrich | V001229 | |
| AAV9.hEF1a.lox.TagBFP. lox.eYFP.lox.WPRE.hGH-InvBYF | Penn Vector Core | AV-9-PV2453 | Addgene Plasmid #45185 |
| AAV9.hEF1a.lox.mCherry.lox.mTFP 1.lox.WPRE.hGH-InvCheTF | Penn Vector Core | AV-9-PV2454 | Addgene Plasmid #45186 |
| ChAT-IRES-Cre knock-in transgenic mouse line | The Jackson Laboratory | 6410 | |
| Fast Green FCF Dye content ≥85 % | Sigma-Aldrich | F7252-25G | |
| Flaming/Brown Micropipette Puller, model P-97 | Sutter Instrument Co. | P-97 | |
| Green tattoo paste | Ketchum MFG Co | 329A | |
| Phosphate-Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | 806552 | |
| Pneumatic PicoPump | WPI World Precision Instruments | PV-820 | |
| Oxygenated artifiial cerebrospinal fluid (aCSF) Reagents | |||
| Calcium chloride dihydrate (CaCl2·2H2O) | Sigma-Aldrich | C7902 | |
| Carbogen (5% CO2, 95% O2) | AirGas | X02OX95C2003102 | Supplier may vary depending on region |
| D-(+)-Glucose | Sigma-Aldrich | G7021 | |
| HEPES, Free Acid | Bio Basic | HB0264 | |
| Hydrochloric acid solution, 1 N | Sigma-Aldrich | H9892 | |
| Magnesium chloride hexahydrate (MgCl2·6H2O) | Sigma-Aldrich | M2670 | |
| pH-Test strips (6.0-7.7) | VWR | BDH35317.604 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| Sodium chloride (NaCl) | Bio Basic | DB0483 | |
| Sodium phosphate monobasic (NaH2PO4) | Sigma-Aldrich | RDD007 | |
| Software | |||
| ImageJ | National Institutes of Health (NIH) | Open source |
Ссылки
- Lefebvre, J. L., Sanes, J. R., Kay, J. N. Development of dendritic form and function. Annual Review of Cell and Developmental Biology. 31, 741-777 (2015).
- Graham, H. K., Duan, X. Molecular mechanisms regulating synaptic specificity and retinal circuit formation. Wiley Interdisciplinary Reviews Developmental biology. 10 (1), 379 (2021).
- Godinho, L., et al. Targeting of amacrine cell neurites to appropriate synaptic laminae in the developing zebrafish retina. Development. 132 (22), 5069-5079 (2005).
- Mumm, J. S., et al. In vivo imaging reveals dendritic targeting of laminated afferents by zebrafish retinal ganglion cells. Neuron. 52 (4), 609-621 (2006).
- Wong, W. T., Faulkner-Jones, B. E., Sanes, J. R., Wong, R. O. Rapid dendritic remodeling in the developing retina: dependence on neurotransmission and reciprocal regulation by Rac and Rho. The Journal of Neuroscience. 20 (13), 5024-5036 (2000).
- Wei, W., Elstrott, J., Feller, M. B. Two-photon targeted recording of GFP-expressing neurons for light responses and live-cell imaging in the mouse retina. Nature Protocols. 5 (7), 1347-1352 (2010).
- Morgan, J. L., Wong, R. O. L. Ballistic labeling with fluorescent dyes and indicators. Current Protocols in Neuroscience. 43 (1), 1-10 (2008).
- Nickerson, P. E. B., et al. Live imaging and analysis of postnatal mouse retinal development. BMC Developmental Biology. 13, 24 (2013).
- Morgan, J. L., Dhingra, A., Vardi, N., Wong, R. O. L. Axons and dendrites originate from neuroepithelial-like processes of retinal bipolar cells. Nature Neuroscience. 9 (1), 85-92 (2006).
- Coombs, J. L., Van Der List, D., Chalupa, L. M. Morphological properties of mouse retinal ganglion cells during postnatal development. The Journal of Comparative Neurology. 503 (6), 803-814 (2007).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nature Methods. 13 (7), 557-562 (2016).
- Stacy, R. C., Wong, R. O. L. Developmental relationship between cholinergic amacrine cell processes and ganglion cell dendrites of the mouse retina. The Journal of Comparative Neurology. 456 (2), 154-166 (2003).
- Kay, J. N., et al. Retinal ganglion cells with distinct directional preferences differ in molecular identity, structure, and central projections. The Journal of Neuroscience. 31 (21), 7753-7762 (2011).
- Liu, J., Sanes, J. R. Cellular and molecular analysis of dendritic morphogenesis in a retinal cell type that senses color contrast and ventral motion. The Journal of Neuroscience. 37 (50), 12247-12262 (2017).
- Diao, L., Sun, W., Deng, Q., He, S. Development of the mouse retina: emerging morphological diversity of the ganglion cells. Journal of Neurobiology. 61 (2), 236-249 (2004).
- Coombs, J., vander List, D., Wang, G. Y., Chalupa, L. M. Morphological properties of mouse retinal ganglion cells. Neuroscience. 140 (1), 123-136 (2006).
- Sanes, J. R., Masland, R. H. The types of retinal ganglion cells: current status and implications for neuronal classification. Annual Review of Neuroscience. 38, 221-246 (2015).
- Sümbül, U., et al. A genetic and computational approach to structurally classify neuronal types. Nature Communications. 5, 3512 (2014).
- Lin, B., Masland, R. H. Populations of wide-field amacrine cells in the mouse retina. The Journal of Comparative Neurology. 499 (5), 797-809 (2006).
- Macneil, M. A., Heussy, J. K., Dacheux, R. F., Raviola, E., Masland, R. H. The shapes and numbers of amacrine cells: Matching of photofilled with Golgi-stained cells in the rabbit retina and comparison with other mammalian species. Journal of Comparative Neurology. 413 (2), 305-326 (1999).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Jo, A., Xu, J., Deniz, S., Cherian, S., DeVries, S. H., Zhu, Y. Intersectional strategies for targeting amacrine and ganglion cell types in the mouse retina. Frontiers in Neural Circuits. 12, 66 (2018).
- Siegert, S., et al. Genetic address book for retinal cell types. Nature Neuroscience. 12 (9), 1197-1204 (2009).
- Kim, I. -. J., Zhang, Y., Meister, M., Sanes, J. R. Laminar restriction of retinal ganglion cell dendrites and axons: subtype-specific developmental patterns revealed with transgenic markers. The Journal of Neuroscience. 30 (4), 1452-1462 (2010).
- Peng, Y. -. R., Tran, N. M., Krishnaswamy, A., Kostadinov, D., Martersteck, E. M., Sanes, J. R. Satb1 regulates contactin 5 to pattern dendrites of a mammalian retinal ganglion cell. Neuron. 95 (4), 869-883 (2017).
- Duan, X., Krishnaswamy, A., Dela Huerta, I., Sanes, J. R. Type II cadherins guide assembly of a direction-selective retinal circuit. Cell. 158 (4), 793-807 (2014).
- Ray, T. A., et al. Formation of retinal direction-selective circuitry initiated by starburst amacrine cell homotypic contact. eLife. 7, 34241 (2018).
- Krishnaswamy, A., Yamagata, M., Duan, X., Hong, Y. K., Sanes, J. R. Sidekick 2 directs formation of a retinal circuit that detects differential motion. Nature. 524 (7566), 466-470 (2015).
- Caval-Holme, F., Zhang, Y., Feller, M. B. Gap junction coupling shapes the encoding of light in the developing retina. Current Biology. 29 (23), 4024-4035 (2019).
- Lucas, J. A., Schmidt, T. M. Cellular properties of intrinsically photosensitive retinal ganglion cells during postnatal development. Neural Development. 14 (1), 8 (2019).
- Cai, D., Cohen, K. B., Luo, T., Lichtman, J. W., Sanes, J. R. Improved tools for the Brainbow toolbox. Nature Methods. 10 (6), 540-547 (2013).
- Rossi, J., et al. Melanocortin-4 receptors expressed by cholinergic neurons regulate energy balance and glucose homeostasis. Cell Metabolism. 13 (2), 195-204 (2011).
- Lefebvre, J. L., Kostadinov, D., Chen, W. V., Maniatis, T., Sanes, J. R. Protocadherins mediate dendritic self-avoidance in the mammalian nervous system. Nature. 488 (7412), 517-521 (2012).
- Ing-Esteves, S., et al. Combinatorial effects of alpha- and gamma-protocadherins on neuronal survival and dendritic self-avoidance. The Journal of Neuroscience. 38 (11), 2713-2729 (2018).
- Williams, P. R., Morgan, J. L., Kerschensteiner, D., Wong, R. O. L. In vitro imaging of retinal whole mounts. Cold Spring Harbor Protocols. 2013 (1), (2013).
- Ramoa, A. S., Campbell, G., Shatz, C. J. Transient morphological features of identified ganglion cells in living fetal and neonatal retina. Science. 237 (4814), 522-525 (1987).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nature Biotechnology. 28 (4), 348-353 (2010).
- Cuntz, H., Forstner, F., Borst, A., Häusser, M. One rule to grow them all: a general theory of neuronal branching and its practical application. PLoS Computational Biology. 6 (8), 1000877 (2010).
- Xiao, H., Peng, H. APP2: automatic tracing of 3D neuron morphology based on hierarchical pruning of a gray-weighted image distance-tree. Bioinformatics. 29 (11), 1448-1454 (2013).
- Nanda, S., et al. Design and implementation of multi-signal and time-varying neural reconstructions. Scientific data. 5, 170207 (2018).
- Sherry, D. M., Wang, M. M., Bates, J., Frishman, L. J. Expression of vesicular glutamate transporter 1 in the mouse retina reveals temporal ordering in development of rod vs. cone and ON vs. OFF circuits. The Journal of Comparative Neurology. 465 (4), 480-498 (2003).
- Johnson, J., et al. Vesicular neurotransmitter transporter expression in developing postnatal rodent retina: GABA and glycine precede glutamate. The Journal of Neuroscience. 23 (2), 518-529 (2003).
- Jüttner, J., et al. Targeting neuronal and glial cell types with synthetic promoter AAVs in mice, non-human primates and humans. Nature Neuroscience. 22 (8), 1345-1356 (2019).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. Journal of Visualized Experiments: JoVE. (31), e1333 (2009).
- Lye, M. H., Jakobs, T. C., Masland, R. H., Koizumi, A. Organotypic culture of adult rabbit retina. Journal of Visualized Experiments: JoVE. (3), e190 (2007).
- Pignatelli, V., Strettoi, E. Bipolar cells of the mouse retina: a gene gun, morphological study. The Journal of Comparative Neurology. 476 (3), 254-266 (2004).
- Huckfeldt, R. M., et al. Transient neurites of retinal horizontal cells exhibit columnar tiling via homotypic interactions. Nature Neuroscience. 12 (1), 35-43 (2009).
- Prahst, C., et al. Mouse retinal cell behaviour in space and time using light sheet fluorescence microscopy. eLife. 9, 49779 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены