Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Genetik Olarak Hedeflenmiş Retinal Hücre Popülasyonlarının Seyrek Adeno İlişkili Virüs Etiketlemesi Kullanılarak Nöronal Arborizasyonun Hızlandırılmış Görüntülenmesi
Bu Makalede
Özet
Burada, postnatal fare retinal eksplantlarında nörit morfogenezini hızlandırılmış konfokal mikroskopi ile araştırmak için bir yöntem sunuyoruz. Membran hedefli floresan proteinlerini Cre'e bağımlı bir şekilde eksprese eden rekombinant adeno ilişkili virüs vektörlerini kullanarak retina hücre tiplerinin ve ince süreçlerinin seyrek etiketlenmesi ve edinilmesi için bir yaklaşım tanımladık.
Özet
Dendritik arborsları modelleyen mekanizmaları keşfetmek, gelişim sırasında dendritleri görselleştirmek, görüntülemek ve analiz etmek için yöntemler gerektirir. Fare retinası, nöronal morfogenez ve bağlantının hücre tipine özgü mekanizmalarının araştırılması için güçlü bir model sistemidir. Retinal alt tiplerin organizasyonu ve bileşimi iyi tanımlanmıştır ve gelişim sırasında belirli tiplere erişmek için genetik araçlar mevcuttur. Birçok retinal hücre tipi ayrıca dendritlerini ve / veya aksonlarını dar tabakalarla sınırlar, bu da hızlandırılmış görüntülemeyi kolaylaştırır. Fare retina eksplant kültürleri, konfokal veya multifoton mikroskopisi kullanarak canlı hücre görüntüleme için çok uygundur, ancak dendrit dinamiklerini zamansal ve yapısal çözünürlükle görüntülemek için optimize edilmiş yöntemler eksiktir. Burada Cre-Lox sistemi tarafından işaretlenmiş spesifik retinal popülasyonların gelişimini seyrek olarak etiketlemek ve görüntülemek için bir yöntem sunulmaktadır. Burada kullanılan ticari olarak temin edilebilen adeno ilişkili virüsler (AAV'ler), membran hedefli floresan proteinlerini Cre'ye bağımlı bir şekilde ifade etti. Yenidoğan farelerde AAV'lerin göz içi doğumu, enjeksiyondan 4-5 gün sonra (dpi) hedeflenen hücre tiplerinin floresan etiketlemesini sağlar. Membran floresan sinyalleri konfokal görüntüleme ile algılanabilir ve ince dal yapılarını ve dinamiklerini çözer. 2-4 saate yayılan yüksek kaliteli videolar, oksijenli yapay beyin omurilik sıvısı (aCSF) ile perfüze edilmiş görüntüleme retinal düz montajlarından elde edilir. Ayrıca, dekonvolüsyon ve üç boyutlu (3B) sapma düzeltmesi için bir görüntü son işleme ardışık düzenidir. Bu protokol, sağlam retinadaki çeşitli hücresel davranışları yakalamak ve nörit morfogenezini kontrol eden yeni faktörleri tanımlamak için kullanılabilir. Retinada öğrenilen birçok gelişimsel strateji, merkezi sinir sisteminin başka yerlerinde nöral devrelerin oluşumunu anlamak için geçerli olacaktır.
Giriş
Retinal nöronların dendritleri, nöral devreler içindeki işlevlerini etkileyen karmaşık, ancak spesifik kalıplar oluşturur. Omurgalı retinasında, çeşitli tipte retinal ganglion hücreleri (RGC'ler) ve amakrin hücre internöronları, ağaç dikme boyutu, yeri, dal uzunluğu ve yoğunluğu bakımından farklılık gösteren benzersiz dendritik morfolojiler taşır1. Postnatal gelişim sırasında, RGC'ler ve amakrin hücreler, coşkulu dendritik süreçleri, fotoreseptör sinyallerini ileten bipolar hücre girdilerini aldıkları iç pleksiform tabaka (IPL) adı verilen bir nöropil içine genişletirler2. Civciv veya zebra balığı larvalarında floresan olarak etiketlenmiş retinal popülasyonların hızlandırılmış görüntülenmesiyle yakalandığı gibi, dendrit morfogenezi oldukça dinamiktir3,4,5. Birkaç gün içinde, dendritik arborslar IPL'nin dar alt katmanlarına genişler, yeniden şekillenir ve yükselir, burada seçkin ortaklarla sinaps yaparlar. Arbors, gelişim üzerinde farklı yapısal dinamikler sergiler ve göreceli dal ilavesi, geri çekme ve stabilizasyon oranlarındaki değişikliklerle birlikte. Amakrin ve RGC dendritleri ayrıca tipe özgü ağaçlandırmayı yansıtabilecek farklı büyüme ve yeniden şekillendirme davranışları sergiler. Bununla birlikte, bu çalışmalar geniş amakrin veya RGC popülasyonlarını izlemiş ve morfolojinin sadece bir yönü olan laminer hedeflemeye odaklanmıştır.
Retinal alt tiplerde gözlenen geniş morfolojik çeşitliliği üreten mekanizmalar tam olarak anlaşılamamıştır. Bu grubun amacı, farelerde tanımlanmış retinal alt tiplerin dendrit dinamiklerini ve arbor yeniden şekillenmesini yakalamak için bir yöntem geliştirmekti. Dendrit desenlemesinin hücre tipine özgü mekanizmalarını tanımlamak, ilgilenilen hücrelerin dendrit davranışlarını görselleştirmek ve ölçmek için yöntemler gerektirir. Fare retinalarının organotipik kültürleri, konfokal veya multifoton mikroskopi kullanan canlı hücre görüntüleme çalışmaları için çok uygundur. Gelişmekte olan retinalar diseke edilir ve bir kayıt odasında birkaç saat boyunca görüntülenebilen veya devre üzerinde sınırlı etkilerle birkaç gün boyunca kültürlenebilen düz bir eksplanta monte edilir6,7. Canlı retinal nöronlar, elektrotlarla boya doldurma, elektroporasyon, lipofilik boyalarla kaplanmış parçacıkların biyolistik iletimi veya floresan proteinleri kodlayan plazmidler (örneğin, Gen Tabancası) ve genetik olarak kodlanmış hücre etiketleri7,8,9,10 dahil olmak üzere çeşitli tekniklerle etiketlenebilir7,8,9,10 . Bununla birlikte, bu yaklaşımlar spesifik retinal alt tiplerin dendrit dinamiklerini görüntülemede verimsizdir. Örneğin, boya doldurma yöntemleri düşük verimlidir ve ilgilenilen hücreleri güvenilir bir şekilde hedeflemek için elektrofizyoloji aparatı ve ek genetik etiketler gerektirir. Dahası, somadaki güçlü floresan sinyalleri yakındaki dendritleri gizleyebilir.
Biyolistik gen verme yöntemleri aynı anda düzinelerce hücreyi etiketleyebilir, ancak yüksek basınçlı parçacık dağıtımını ve izole retinanın gece boyunca inkübasyonunu içeren adımlar hücre fizyolojisini ve dendritik büyümeyi tehlikeye atabilir. Bu makale, aşağıdaki deneysel kriterler göz önüne alındığında, hücre tipi ve yapısal çözünürlük ile erken dendrit dinamiklerini yakalamak için son genetik araçların kullanılabileceğini önermektedir. İlk olarak, gelişmekte olan arborslara hakim olan ince dalları ve filopodia'yı çözmek için, yöntem nöronları tüm çardaktaki süreçleri dolduran parlak, floresan proteinlerle etiketlemelidir. Görüntüleme süresi boyunca fotobeyazlatma nedeniyle floresan etiketleme solmamalıdır. Çeşitli floresan protein varyantları üretilmiş ve parlaklık ve fotostabiliteye dayalı olarak in vivo/ex vivo görüntülemeye11 uygunluk açısından karşılaştırılmıştır. İkincisi, floresan proteinler (XFP'ler), dendrit morfogenezinin en erken aşaması ile yeterince yüksek seviyelerde eksprese edilmelidir, böylece dar gelişim penceresi kaçırılmaz. Fare retinasındaki statik zaman noktalarının analizlerinde, dendrit gelişimi doğum sonrası ilk haftada meydana gelir ve büyüme, yeniden modelleme ve stabilizasyon aşamalarını içerir10,12,13,14,15. Üçüncüsü, yöntem seçici etiketlemeye veya ilgilenilen nöronal alt popülasyonun etiketlenme olasılığının artmasına yol açmalıdır. Dördüncüsü, hedef alt popülasyonun etiketlenmesi yeterince seyrek olmalıdır, böylece tüm nöronal ağaç dikme tanımlanabilir ve izlenebilir. RGC ve amakrin alt tipleri olgun morfolojik özellikleri ve IPL tabakalaşma paternleri16,17,18,19,20 ile ayırt edilebilse de, zorluk, olgunlaşmamış yapılara dayanarak gelişim sırasında alt tipleri tanımlamaktır. Bu görev, geliştirme sırasında spesifik retinal hücre tiplerini etiketlemek için transgenik araçların genişletilmesiyle kolaylaştırılmıştır.
Floresan proteinlerin veya Cre'nin hücresel ve zamansal ekspresyonunun gen düzenleyici elementler tarafından belirlendiği transgenik ve knock-in fare çizgileri, retinal hücre tiplerini incelemek için yaygın olarak kullanılmaktadır13,21,22,23. Dendrit gelişiminin alt tipe özgü kalıpları üzerine yapılan temel gözlemler, statik zaman noktalarında transgenik fare retinaları üzerine yapılan çalışmalardan gelmiştir10,14,24,25. Özellikle Cre-Lox sistemi, çeşitli rekombinaze bağımlı muhabirler, sensörler ve optogenetik aktivatörler kullanarak alt tiplerin mükemmel gen manipülasyonunu ve izlenmesini sağlar. Bu araçlar, retinal devre düzeneğinin altında yatan alt tipe özgü moleküler programların ve fonksiyonel özelliklerin keşfedilmesine yol açmıştır26,27,28,29,30. Bununla birlikte, fare retinasındaki alt tipe özgü dendrit dinamiklerini incelemek için henüz kullanılmamışlardır. Düşük yoğunluklu etiketleme, Cre fare çizgilerinin elektroporasyon veya rekombinant AAV'ler tarafından tanıtılan transgenlerle birleştirilmesiyle elde edilebilir. Varsa, tamoksifen ile indüklenebilir Cre hatları veya kesişimsel genetik stratejiler de kullanılabilir. Son olarak, hücre minimal invaziv bir şekilde etiketlenmeli ve dokudan ödün vermemek veya dendrit morfogenezi için gerekli hücresel fonksiyona müdahale etmemek için edinim parametreleri kullanılarak görüntülenmelidir.
Burada canlı fare retinal eksplantlarında dendrit dinamiklerini araştırmak için transgenik araçlar ve konfokal mikroskopi uygulamak için bir yöntem sunulmaktadır. Cre transgenik fare çizgileri, Cre rekombinasyonu üzerine floresan proteinleri eksprese eden AAV vektörleri ile birleştirilmiştir, bu da ilgilenilen retinal hücrelerin seyrek etiketlenmesine izin verir. Ticari olarak temin edilebilen AAV'ler intravitreal enjeksiyonlarla yenidoğan retinasına verilir. Bu makale, AAV'lerin 4 dpi ile önemli ölçüde yüksek ve hücre tipine özgü floresan ekspresyonu ürettiğini ve doğum sonrası zaman noktalarına erişime izin verdiğini göstermektedir. Bu yaklaşımı göstermek için, kolinerjik "starburst" amakrin internöron, yenidoğan farelerde kolin asetiltransferaz (ChAT)-internal ribozom giriş bölgesi (IRES)-Pre transgenini eksprese eden Brainbow AAV verilerek etiketlendi31,32. Starburst amakrin hücreleri, kümelenmiş protokadherinlerin aracılık ettiği dendrit kendinden kaçınma ile şekillenen stereotipli ve radyal bir ağaç dikme morfolojisi geliştirir33,34. Bu makale, yıldız patlaması dendritlerinin ve filopodia'nın çözünürlüğünün, Brainbow AAV'ler için kullanıldığı gibi, farzesilasyona uğrayan CAAX motifinin eklenmesiyle XFP'ler tarafından plazma zarına önemli ölçüde iyileştirildiğini göstermektedir31. Son olarak, dendrit rekonstrüksiyonu ve morfometrik niceleme için uygun yüksek kaliteli görüntüler üreten hızlandırılmış görüntüleme ve işlem sonrası protokoller belirlenmiştir. Bu protokol, dendrit morfogenezini kontrol eden faktörleri tanımlamak ve sağlam retinadaki çeşitli hücresel davranışları yakalamak için kullanılabilir.
Protokol
NOT: Bu protokol, deney günleri arasında viral transdüksiyon için minimum 4-5 günlük bir süre ile 2 güne yayılmaktadır (Şekil 1A). Hayvan deneyleri, Kanada Hasta Çocuklar Hastanesi (Toronto, Kanada) Hayvan Hizmetleri Laboratuvarı Hayvan Kullanımı ve Bakım Komitesi tarafından onaylanan protokoller kapsamında Araştırma ve Laboratuvar Hayvan Bakımında Hayvanların Kullanımı için Hayvan Bakım Kılavuzları Konseyi'ne uygun olarak gerçekleştirilir.
1. Yenidoğan AAV enjeksiyonları ve görüntüleme deneyleri için hazırlıklar
- İlgilenilen retinal hücre popülasyonlarını etiketlemek için bir Cre fare çizgisi seçin. AAV enjeksiyonları sırasında Cre rekombinaz ekspresyonunu bir Cre transgenik muhabirine geçerek veya bir Cre antikoru ile immün boyama yoluyla onaylayın.
- Cre-pozitif yenidoğan hayvanları üretmek için transgenik Cre farelerini (8-16 haftalık) yetiştirin.
NOT: Bu gösteri için, kolinerjik Starburst amakrin hücrelerini hedeflemek için ChAT-IRES-Cre knock-in fareleri kullanılmıştır. - Rekombinaz-bağımlı AAV virüsü kodlayan floresan protein(ler)i elde edin. İnce proseslerin optimum şekilde etiketlenmesi için, plazma membranını hedefleyen modifiye XFP'leri ifade eden vektörleri seçin.
NOT: Bu çalışmada, çok renkli etiketleme seçeneği sunan Brainbow virüsü (BBV), AAV-EF1a-BbTagBY ve AAV9-EF1a-BbChT (bkz. Malzeme Tablosu) kullanılmıştır (Şekil 1B). Farnesile geliştirilmiş sarı floresan protein (eYFP) ve monomerik Kiraz (mCherry) ekspresyonu, canlı görüntüleme için en güçlü floresan sinyallerini üretti. Tek bir BBV, tek tek arborları görüntülemek için kullanılabilirken, BBV'lerin birlikte enjeksiyonu, daha fazla hücreyi veya komşu arborsları farklı floroforlarla etiketlemek için kullanılabilir. Birden fazla floresan proteini kullanılıyorsa, minimum emisyon spektrumu çakışmasını sağlayın (Şekil 1C). Mikroskop toplama parametreleri, farklı XFP sinyallerini yakalamak için ayarlanmalıdır. - Donma/çözülme döngülerini önlemek için tek kullanımlık stoklar için ayrı ayrı düşük bağlayıcı tüplerde ∼3-5 μL AAV alikotları hazırlayın. -80 °C'de saklayın.
- Bir mikropipet çektirici kullanarak çok ince uçlu borosilikat cam mikropipetler hazırlayın.
NOT: Çektirme ayarları, kullanılan filament ve çektirmeye bağlı olarak değişir; Son uç boyutu ve şekli için Şekil 2A'ya bakınız. Tipik damlacık çapları 600 μm'dir. - Bir mikroenjeksiyon sistemi ve ilgili boruları edinin. Mikroenjektörü basınçlı bir hava portuna bağlayın.

Şekil 1: Deneysel genel bakış . (A) Bu protokol, deney günleri arasında en az 4-5 günlük enfeksiyon süresi olan 2 günlük deneyleri kapsar. Göz içi enjeksiyonları, doğum sonrası 3. günden daha eski olmayan yenidoğan farelerde gerçekleştirilir. Retinalar daha sonra istenen gelişimsel pencereyi yakalamak için disseke edilir, düz monte edilir ve canlı olarak görüntülenir. Etiketli hücreler, viral ekspresyon için gerekli 4-5 gün sonra herhangi bir zamanda görüntülenebilir, çünkü uzun süreli AAV ekspresyonunun dendrit morfolojisi üzerinde belirgin bir etkisi yoktur. (B) Cre-dependent Brainbow AAV vektörleri (BBV), Cre31'i ifade eden hayvanlara enjekte edilir. Bu çalışmada, yıldız patlaması amakrin hücrelerinde Cre rekombinasyonunu sürmek için ChAT-Cre knock-in fareleri kullanılmıştır. İki BBV, membran lokalizasyonu için sıralı olarak farnesilleştirilen bir CAAX motifinde sona eren değiştirilmiş eYFP veya tagBFP veya mCherry ve mTFP'yi kodlar. Lox siteleri üçgenlerle tasvir edilmiştir. Vektörler, farzesillenmiş XFP'leri Cre rekombinasyonuna bağlı olarak stokastik ve kombinatoryal bir şekilde eksprese eder. EF1α promotörü, uzama faktörü 1α geninden düzenleyici elementler içerir. W, woodchuck hepatit virüsü posttranskripsiyonel düzenleyici elementinden elementleri temsil eder ve pA, poliadenilasyon dizisini gösterir. (C) Bu çalışmada görüntülenen BBV floroforları olan mCherry ve eYFP'nin uyarılması ve emisyon spektrumları. Çoklu floresan proteinleri canlı görüntülerken, algılama parametreleri emisyon spektrumlarını farklı kanallara yeterince ayıracak şekilde düzenlenmelidir. Kısaltmalar: AAV = adeno ilişkili virüs; BBV = Brainbow AAV; ChAT = kolin asetiltransferaz; iRES = dahili ribozom giriş sitesi; eYFP = gelişmiş sarı floresan proteini; iTR = ters çevrilmiş terminal tekrarı; tagBP = Tag-blue floresan proteini; mCherry = monomerik Kiraz; mTFP = deniz mavisi floresan proteini; XFP = herhangi bir floresan protein; EF1α= uzama faktörü 1 alfa. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2. Yenidoğan farelerde AAV'lerin intravitreal enjeksiyonları
- Buz üzerinde bir AAV aliquot çözün. Steril salin veya fosfat tamponlu salin kullanarak ~ 1: 4 AAV seyreltme hazırlayın. Mikropipetin kırılması ve yeni bir pipetin doldurulması gerekmesi durumunda hayvan başına ~0,5 μL AAV seyreltme (göz başına ~0,25 μL) hazırlayın. Kalan seyreltilmemiş AAV'yi 4 ° C'de saklayın ve 2 hafta içinde kullanın.
NOT: Bu deneyde, tedarikçi AAV konsantrasyonu ~ 1-2 × 1013 genom içeriği (GC) / mL idi ve 4 × 1012 GC / mL'lik bir nihai konsantrasyona seyreltildi. İstenilen etiketleme yoğunluğunu elde etmek için viral konsantrasyonu optimize edin. - Enjeksiyonları görselleştirmek için, çözeltiyi maviye boyamak üzere her 15 μL AAV seyreltme için yaklaşık 1 μL% 0.02 Hızlı Yeşil FCF boya çözeltisi ekleyin.
- Barajlı ve yenidoğan çöplü bir fare kafesini (doğum sonrası gün (P) 0.5-3) mikroenjeksiyon ekipmanı olan bir prosedür odasına aktarın. Anne stresini ve yavruların reddedilmesini en aza indirmek için hayvanları yuvalar ve yataklarla aynı kafeste tutun.
- Enjeksiyon alanını% 70 etanol ile sterilize edin ve steril bebek bezi pedlerini tezgah yüzeylerine yerleştirin. Hipotermiye bağlı anesteziden kurtulmak için sıcak bir platform (örneğin, bir ısıtma yastığı) hazırlayın.
- Mikropipeti bir mikroşırınga kullanarak AAV seyreltme ile doldurun. Bir stereomikroskop altında, ucun mührünü açmak için mikropipet ucunu 30 G'lik bir iğneyle kırın.
NOT: Şekil 2A , hem kapalı (üstte) hem de mühürsüz (ortada) arkadan doldurulmuş ucu göstermektedir. - Yenidoğan farelerini buz üzerine 1-2 hayvan yerleştirerek hipotermi ile anestezi altına alın. Cildi buzla doğrudan temastan korumak için hayvanları lateks eldiven üzerine yerleştirin. Hayvan artık pençe sıkışmasına (~ 2 dakika) yanıt olarak hareket etmediğinde, hayvanı bir stereomikroskop altına yerleştirin. İstenirse, dövme mürekkebi ve 30 G iğneli dövme pençesi pedleri ve DNA izolasyonu için kuyruk kırpıntıları toplayarak hayvanları genotipleme ile tanımlayın.
NOT: Anestezi derinliğinin uygun şekilde izlenmesi prosedür boyunca yapılmalıdır. - Gözlerin üzerindeki cildi% 70 etanol ile silin. Kaynaşmış göz kapağını açmak için 30 G'lık bir iğne kullanın (Şekil 2B). Gözü açmak için parmaklarınızla hafif basınç uygulayın ve kornea-sklera kavşağında korneadan küçük bir delik açın (Şekil 2C).
- Cam mikropipeti deliğe yerleştirin ve AAV'yi intravitreal boşluğa enjekte etmek için mikroenjektör ayak pedalına 2-4 kez basın. Mikropipeti yavaşça çıkarın ve mavi boyayı göz bebeğinden görselleştirerek AAV enjeksiyonunu onaylayın (Şekil 2D).
NOT: 6-8 psi ejeksiyon basıncı ve 600-800 ms darbe süresi ile 600 μm çapında bir damlacık dışarı atılır (Şekil 2A, alt). Göz başına yaklaşık 0.23-0.45 μL AAV çözeltisi enjekte edilir. Gözün dışındaki mavi çözelti, AAV'nin göze enjekte edilmediğini gösterir. Enjeksiyon bölgesinden sızan mavi çözelti, AAV'nin dışarı sızmış olabileceğini ve transfeksiyon verimliliğini azalttığını gösterir. - Yeniden kapatmak için göz kapaklarını yavaşça birbirine bastırın ve yavruyu ısıtılmış bir pedin üzerine yerleştirin. Hayvanlar pembemsi bir renge kavuştuktan ve duyarlı olduktan sonra, yavaşça onları muhafaza kafesine geri aktarın.
NOT: Yavruların çok hızlı bir şekilde yeniden ısınmasını önlemek için uygun önlemlerin alındığından emin olun. - Çöpte kalan hayvanlar için enjeksiyon prosedürünü tekrarlayın. Retinayı görüntülemeden önce viral transdüksiyon için en az 4-5 gün bekleyin.

Şekil 2: Yenidoğan göz içi enjeksiyonları . (A) Geri doldurulmuş mikropipet, pipet ucunun kapatıldığında (üstte) ve uç açıldıktan sonra (altta, solda) şeklini gösterir. 6-8 psi'lik piko enjeksiyon basıncı ve 600-800 ms'lik darbe süresi, 600 μm çapında bir damlacık üretir (alt, sağ). Ölçek çubuğu = 1 mm.(B) 16x büyütme altında anestezi uygulanmış P0 yavrusu. Kaynaşmış göz kapağı bağlantısı (beyaz), keskin bir 30 G iğne kullanılarak yarık açılır. Ölçek çubuğu = 2 mm. (C) Göze uygulanan hafif basınç korneayı açığa çıkarır; ölçek çubuğu = 2 mm. Yakınlaştırılmış bölüm (kırmızı), 30 G'lik bir iğne ile oluşturulan kornea-sklera kavşağındaki (sarı) küçük deliği gösterir; ölçek çubuğu = 0,5 mm. (D) Enjeksiyondan sonra pipet ucunun çekilmesi (solda). AAV çözeltisindeki Hızlı Yeşil boya, enjeksiyondan önceki açık göz bebeği rengine kıyasla (sağda) göz bebeği boyunca mavi-gri olarak görünür (ortada). Ölçek çubuğu = 1 mm. (E) 4 gün sonra, göz kapağı iyileşti ve kaynaşarak kapandı (solda); ölçek çubuğu = 2 mm. Enükleasyon üzerine, iyileşmiş enjeksiyon bölgesi görülebilir (sarı); ölçek çubuğu = 1 mm. Enjeksiyon bölgesinin kornea ve sklera arasındaki sınırdaki konumuna dikkat edin. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
3. Görüntüleme deneyi için retina diseksiyonları
- Retinal aCSF (119 mM NaCl, 2.5 mM KCl, 1.3 mM MgCl2·6H2O, 2.5 mM CaCl2·2H2O, 1 mM NaH2PO4, 11 mM glikoz ve 20 mM 4-(2-hidroksietil)-1-piperazineetansülfonik asit (HEPES serbest asit)35 hazırlayın. İstenirse, 10x çözeltisini hazırlayın ve dondurun; çözülür ve gerektiğinde 1x'e kadar seyreltilir.
- Retinal aCSF'yi en az 15 dakika boyunca karbojenle (%95 O2, %5 CO2) köpürterek oksijenlendirin. PH'ı 7,4'e ayarlayın. aCSF'nin oksijenli kalmasını sağlamak için kullanıma kadar kapalı bir kapta saklayın.
NOT: Retinalar yüksek konsantrasyonda O2 gerektirir. Deney boyunca aCSF'yi oksijenli tutmak önemlidir. - 60 mm çapında bir Petri kabını bir buz tepsisine yerleştirin (laboratuvar plastiğinden bir buz tepsisi tasarlayın, örneğin bir pipet kutusu kapağı) ve bir stereomikroskop altına yerleştirin. Petri kabını oksijenli retinal aCSF ile doldurun.
- Ötenazi fareler P9 ve daha genç dekapitasyon ile. İzofluran indüksiyonu veya hayvan protokolü altında onaylanan alternatif bir yöntem ile P10 ve daha yaşlı fareleri ötenazileştirin, ardından kafa kesme işlemi yapılır.
- Göz kapakları kapalıysa, gözü açığa çıkarmak için göz kapağı kapağını kesin. Gözleri enüklee etmek için forseps kullanın ve bunları adım 3.3'ten itibaren soğuk retinal aCSF'ye aktarın.
- Retina kabını diseke etmek için, bir stereomikroskop altında (büyütme 25x), bir Dumont #5 forseps kullanarak optik siniri sıkıştırarak gözü stabilize edin (Şekil 3A).
- Korneanın merkezinde 30 G'lik bir iğne ile bir delik açın ve ardından delikten korneanın sonuna kadar bir kesi yapmak için mikro makasın bir ucunu deliğe yerleştirin. Kardinal yönlerde 4 dilim yapmak için tekrarlayın, 4 "kanat" oluşturun (Şekil 3A).
- İki Dumont #5 forseps ile, iki bitişik flebi kavrayın ve çekin, sklerayı retinadan yavaşça soyun. Kalan kornea flepleriyle tekrarlayın ve sklerayı retinadan çıkarın (Şekil 3B).
- Forsepsleri kullanarak lensi retina kapağından çıkarın. Mikromakas ile, retinanın kenarından optik sinire doğru 4 radyal kesi yapın ve 4 eşit yaprak oluşturun (Şekil 3B). İkinci göz için 3.4-3.7 arasındaki adımları tekrarlayın.
4. Retinal düz montajlı hazırlık
- Montaj için gri karışık selüloz ester (MCE) membran filtre diskleri hazırlayın. Büyük çaplı MCE membran filtreler kullanıyorsanız, diski kadranlar halinde kesin (kabaca 1 cm genişliğinde). MCE diskini daha büyük bir beyaz filtre kağıdının ortasına yerleştirin (Şekil 3D).
NOT: MCE filtreleri 1 cm çapında disklerde de mevcuttur. MCE filtre diski 1-2 retinaya sığacak kadar büyük, ancak görüntüleme odasına sığacak kadar küçük olmalıdır. MCE membranları statik yük taşıdığından, MCE membranının temasını ve kullanımını en aza indirin. - İki boyutlu 3/0 boya fırçası kullanarak retinaları elleçleyerek, retinal gangliyon hücresi tarafı aşağı bakacak şekilde bir retina kabını boya fırçasına çevirin. Retinayı nazikçe aCSF'den kaldırın, su gerginliğinin retinayı yırtmadığından emin olun (Şekil 3C).
- Boya fırçasını retina ile tutmaya devam ederken, MCE filtre kağıdının ortasına bir aCSF damlacığı yerleştirmek için bir transfer pipeti kullanın (Şekil 3C, sağda). Retinayı, yüzey gerilimi tarafından oluşturulan aCSF damlacığına doğru yüzdürün. Retina RGC tarafını damlacık içinde yukarı doğru konumlandırmak ve dört yaprağı açmak için boya fırçaları kullanın.
- Yerleştirildikten sonra, damlacığın yüzey gerilimini kırmak için boya fırçası ile beyaz filtre kağıdı arasında bir su köprüsü oluşturun.
NOT: aCSF kötü bir şekilde uzaklaştırıldığında, retina MCE filtre kağıdına yapışacaktır (Şekil 3D,E). Düz monte retinalar, MCE diskinin forseps ile kavranmasıyla ele alınabilir. aCSF damlacığı bir su köprüsü oluşturmadan önce hızla uzaklaşırsa, bu MCE membranının şarj edilmediğini gösterebilir. Yeni bir MCE membranı kullanın ve retinaları görüntüleme odasına taşımadan hemen önce retinaları diseke ederek ve düz monte ederek enükleasyon ve görüntüleme arasındaki süreyi en aza indirin.

Şekil 3: Retinal diseksiyon ve karışık selüloz ester filtre membranlarına düz montaj . (A) Solda, enüklee bir göz, optik siniri Dumont #5 forseps (solda) ile kavrayarak stabilize edilir. Korneanın merkezinde 30 G'lık bir iğne (merkez) kullanılarak küçük bir delik oluşturulur. Mikrodiseksiyon makasları, korneayı 4 eşit flebe (sağda) kesmek için kullanılır. Ölçek çubuğu = 1 mm. (B) İki Dumont #5 forseps (solda) ve lens çıkarılmış (ortada) kullanılarak sklera soyulmuş disseke retina. 4 eşit kesime sahip retina, retinanın yarısına kadar keser (sağda). Ölçek çubuğu = 1 mm. (C) Retinanın iki ince boya fırçasıyla taşınması (boyut 3/0, sol). Retina, retinal ganglion hücreleri ile bir boya fırçasına (ortada) yan yana çevrildi ve su gerginliğinin retinayı yırtmadığından emin olmak için aCSF'den kaldırıldı (sağda). Ölçek çubuğu = 2 mm. (D) Beyaz filtre kağıdına yerleştirilmiş gri MCE membran diski (solda). MCE diskinde bir aCSF damlacığı (sağda). Ölçek çubuğu = 1 cm. (E) Retinaları damlacığa yüzdürdükten ve konumlandırdıktan sonra, retinayı yüklü MCE kağıdına çekerek aCSF'yi fitillemek için beyaz filtre kağıdıyla bir su köprüsü oluşturun (solda); ölçek çubuğu = 1 cm. MCE zarının yakınlaştırılmış görüntüsü (kırmızı), retinal ganglion hücreleri ile yan yana (sağda) monte edilmiş 2 retinayı gösterir; ölçek çubuğu = 2 mm. Bir retina beyaz renkle özetlenmiştir. Kısaltmalar: MCE = karışık selüloz ester; aCSF = yapay beyin omurilik sıvısı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
5. Canlı tam montajlı retina preparatlarının hızlandırılmış konfokal görüntülenmesi
- Canlı görüntüleme inkübasyon odasını Şekil 4'te görüldüğü gibi dik bir konfokal mikroskop için monte edin.
NOT: Ters konfokal sistemler için, düz montajlar RGC tarafı aşağı doğru doğrudan inkübasyon odasının cam alt kapağına yerleştirilir. Retinalar kapak kayması ile temas ettiğinde, hareket ettirilemezler. - Odayı oksijenli aCSF ile doldurun ve pompayı ve sıcaklık kontrol cihazını açın (sıcaklık 32-34 °C, akış hızı 1 mL / dak). Sıcaklığın 34 °C'nin üzerine çıkmasına izin vermeyin.
- Retinal düz montajı perfüzyon odasına aktarmak için, pompayı durdurun ve odadaki aCSF'yi çıkarın. MCE diskini retinal düz montajlı olarak (boş) inkübasyon odasına yerleştirin.
- Düz montaja bir numune ağırlığı yerleştirin; yüzey gerilimini kırmak için ağırlığı önceden ıslatın. Odayı ısıtılmış aCSF ile doldurun ve aCSF'yi ~1 mL/dk'da dolaştırın.
- Burun parçasını 25x suya daldırma hedefi (sayısal diyafram açıklığı 0,95) ile görüntüleme odasına yerleştirin. Epifloresan ışık kullanılarak etiketlenmiş hücreler için tarama (Şekil 4C).
- İlgilendiğiniz dendritik özellikleri yakalamak için görüntüleme ses seviyesini ayarlayın.
NOT: Bu çalışma, kare başına 1024 x 1024 piksel, z-adım 1 μm ve her z-yığını arasında 2 dakikalık bir kare hızında tüm dendritik çardak yakaladı. Son görüntü boyutları ~100 μm x 100 μm x 20 μm'dir. - Lazer gücünü en uygun ayara ayarlamak için, hem aşırı doymuş hem de az doymuş pikselleri tanımlayan bir arama tablosu kullanın. Tarama sırasında, lazer gücünü hiçbir pikselin aşırı doygun olmayacağı şekilde ayarlayın (yani, 255 veya daha yüksek bir yoğunlukta). Gerektiği sürece veya floresan sinyalinde önemli ve tespit edilebilir bir düşüş ve gürültüde artış (tipik olarak 2-4 saat) olana kadar görüntülemeye devam edin.
NOT: Pikseller tam dinamik aralığa dağıtıldığında dekonvolüsyon algoritmaları en iyi şekilde çalıştığından, lazer gücünün azaltılması önerilir. Piksel yoğunluğu 254'ü geçmemelidir; Nöritlerin ampirik analizleri, 170'in altındaki piksel değerlerinin dekonvolüsyon için ideal olduğunu ortaya koymuştur. Satır ortalaması (2-3) ile yüksek tarama hızları (400-600 Hz), aynı toplam piksel bekleme süresine sahip tek, daha yavaş taramalara tercih edilir. Uzun süreli görüntüleme alanı genellikle fotobeyazlatıcıdır, ancak diğer eksplant bölümleri canlı kalır. Düz montajdaki birden fazla bölge, her biri 2-4 saat boyunca, toplam 6 saatlik bir kuluçka süresiyle görüntülenebilir. 6 saatten sonraki görüntüleme seansları sistematik olarak test edilmemiştir. Nörit yıkımı ve ağartması, eksplant canlılığının azaldığının işaretleridir. - Görüntülemeden sonra, retinal düz montajları ve membran filtresini 4 ° C'de 1-2 saat boyunca soğuk% 4 paraformaldehit ile sabitleyin. Daha ileri analizler için sabit retinalardaki floresan etiketleri immünohistokimya ile yükseltin.
NOT: Ters çevrilmiş bir konfokal kullanıldığında görüntüleme sonrası fiksasyon mümkün değildir; retinalar dokuyu tahrip etmeden çıkarılamaz.
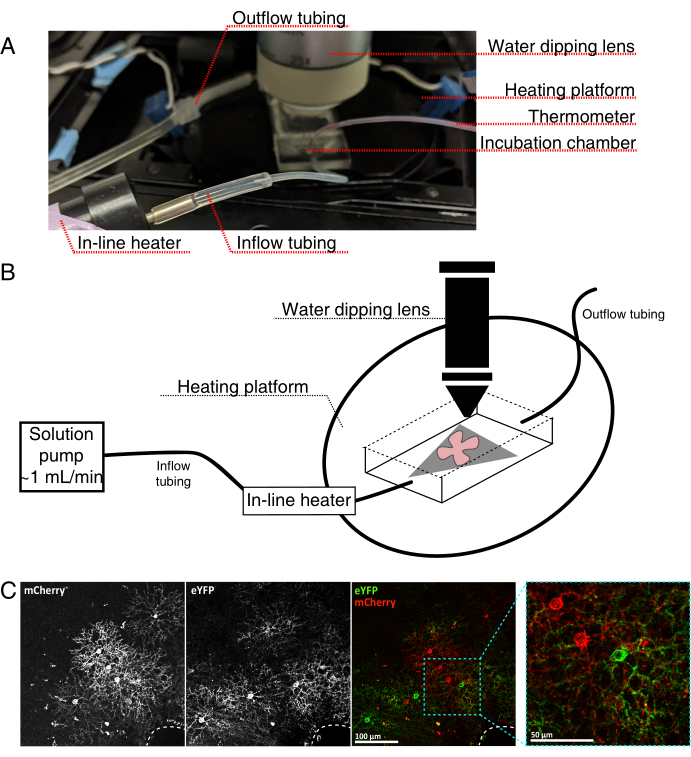
Şekil 4: Canlı hücre görüntüleme inkübasyon odası kurulumu. (A) Isıtma, çözelti ve görüntüleme bileşenlerini gösteren canlı görüntüleme inkübasyon aparatı. Çift ısıtıcı, ısıtmalı bir inkübasyon odası platformu (mavi konektör elektrotlu arka daire) ve bir sıralı çözelti ısıtıcı içerir. (B) 4A'nın şematik diyagramı. MCE membran (gri) üzerindeki retinal düz montaj (kırmızı) kuluçka odasına yerleştirilir. Sıralı çözelti ısıtıcısı, bir çözelti pompasına bağlanır (4A'da resmedilmemiştir). Görüntüleme odası boyutları, daldırma objektif burnu için iyi bir çalışma alanı sağlar. (C) 0.23-0.45 μL 4 × 1012 GC/mL AAV seyreltme ile enjekte edilen retinal eksplantın 25 kat görünümü; ölçek çubuğu = 100 μm. Hücrelerin yoğun etiketlenmesi genellikle optik sinir kafasını çevreler (kesikli çizgi, sağ altta); ölçek çubuğu = 50 μm. Kısaltmalar: MCE = karışık selüloz ester; GC = genom kopyaları; mCherry = monomerik Kiraz; eYFP = gelişmiş sarı floresan proteini. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
6. ImageJ'de görüntü dekonvolüsyonu ve son işleme
- Görüntü serisini içe aktarın, seriyi zamana göre bölün ve çok renkli bir görüntüyse renklendirin. Bir renk için tüm zaman noktalarının aynı klasörde bulunduğundan emin olun.
NOT: ImageJ kullanıyorsanız Biyo biçimleri içe aktarın (Biyo-biçimler FIJI'ye otomatik olarak dahil edilir). - ImageJ eklentisi Diffraction PSF 3D'yi kullanarak teorik bir nokta yayılma işlevi (PSF) oluşturun.
NOT: Floresan protein emisyon dalga boyu PSF'yi etkilediğinden her görüntüleme kanalı kendi PSF'sini gerektirir. - Eklentileri | kullanın Makro | Sağlanan makroyu (Ek Dosya 1) kullanarak tüm zaman noktaları için toplu Paralel Yinelemeli Dekonvolüsyon gerçekleştirmek üzere çalıştırın.
NOT: Bu makro, Wiener Filtresi Önceden Koşullandırılmış Landweber (WPL) yinelemeli algoritmasının 25 yinelemesini çalıştırır. Her renk kanalı ayrı ayrı deconvolved edilmelidir. - Renk kanallarını birleştirin ve tüm zaman noktalarını bir Hyperstack'te derleyin (Görüntü | Hiper yığınlar | Yığınlar için Hyperstack). Eklentiler | kullanarak 3B sapmayı düzeltin Kayıt | Doğru 3B Sürüklenme.
- Görüntüyü normal bir yığına döndürme (Görüntü | Hiper yığınlar | Hiperyığından Yığına) ve zaman noktalarını bölmek (Görüntü | Yığınlar | Araçlar | Yığın Ayırıcı). Tüm zaman noktaları için maksimum projeksiyon oluşturmak üzere toplu işlemeyi kullanma (İşlem | Toplu | Makro | run("Z Projesi...", "projeksiyon=[Maksimum Yoğunluk]"); ).
- Hızlandırılmış görüntü dizisini içe aktarma (Dosya | | içe aktar Görüntü Dizisi). Katkısız ve sonradan işlenmiş iki boyutlu (2B) videonun istenen analizi için geleneksel ImageJ araçlarını kullanın.
NOT: Dört boyutlu (3D + zaman) deconvolved ve drift düzeltmeli videolar hiperstack olarak görüntülenebilir. 3B zaman noktalarını korumak için önceki adımı atlayın.
Sonuçlar
Yukarıdaki protokolü kullanarak, yıldız patlaması hücresi dendritlerinin geliştirilmesinin yüksek çözünürlüklü bir 3D videosu elde edildi, deconvolved edildi ve 3D sürüklenme için düzeltildi. Analiz için 2D videolar yapmak üzere Z-düzlemi maksimum projeksiyonları üretildi (Ek Video 1, Şekil 5A). Her zaman noktasının 3D dekonvolüsyonu, ince filopodia projeksiyonlarının çözünürlüğünü arttırmıştır (Şekil 5B...
Tartışmalar
Bu video, gelişmekte olan retinal nöronların dendrit dinamiklerini konfokal canlı görüntüleme ile görüntülemek için mevcut genetik araçları kullanan deneysel bir boru hattını göstermektedir. Ayrıca, membran hedefli floresan proteinlerini yenidoğan farelere kodlayan Cre-bağımlı AAV'lerin göz içi enjeksiyonları da gösterilmiştir. Genetik olarak hedeflenmiş popülasyonların tek hücreleri, 4-5 dpi kadar erken bir sürede parlak bir şekilde etiketlenir. Standart görüntüleme odalarının canlı...
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Madison Gray'e, hiç sahip olmadığım zamanlarda bana yardım ettiği için teşekkür ederiz. Bu araştırma bir NSERC Keşif Bursu (RGPIN-2016-06128), Nörobilimde bir Sloan Bursu ve bir Kanada Araştırma Başkanı Tier 2 (J.L.L.'ye) tarafından desteklenmiştir. S. Ing-Esteves, Görme Bilimleri Araştırma Programı ve NSERC Yüksek Lisans Bursları-Doktora tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Addgene viral prep #45185-AAV9 | |||
| Addgene viral prep #45186-AAV9 | |||
| Dissection tools | |||
| Cellulose filter paper | Whatman | 1001-070 | |
| Dumont #5 fine forceps | FST | 11252-20 | Two Dumont #5 forceps are required for retinal micro-dissection |
| Dumont forceps | VWR | 82027-426 | |
| Fine Scissors | FST | 14058-09 | |
| Mixed cellulose ester membrane (MCE) filter papers, hydrophilic, 0.45 µm pore size | Millipore | HABG01 300 | |
| Petri Dish, 50 × 15 mm | VWR | 470313-352 | |
| Polyethylene disposable transfer pipette | VWR | 470225-034 | |
| Round tip paint brush, size 3/0 | Conventional art supply store | Two size 3/0 paint brushes (or smaller) are required for retinal flat-mounting | |
| Surgical Scissors | FST | 14007-14 | |
| Vannas Spring Scissors - 2.5 mm Cutting Edge | FST | 15000-08 | |
| Live-imaging incubation system | |||
| Chamber polyethylene tubing, PE-160 10' | Warner Instruments | 64-0755 | |
| Dual channel heater controller, Model TC-344C | Warner Instruments | 64-2401 | |
| HC FLUOTAR L 25x/0.95 W VISIR dipping objective | Leica | 15506374 | |
| Heater controller cable | Warner Instruments | CC-28 | |
| Large bath incubation chamber with slice support | Warner Instruments | RC-27L | |
| MPII Mini-Peristaltic Pump | Harvard Apparatus | 70-2027 | |
| PM-6D Magnetic Heated Platform (incubation chamber heater) | Warner Instruments | PM-6D | |
| Pump Head Tubing Pieces For MPII Mini-Peristaltic Pump | Harvard Apparatus | 55-4148 | |
| Sample anchor (Harps) | Warner Instruments | 64-0260 | Sample anchor must be compatible with incubation chamber |
| Sloflo In-line Solution Heater | Warner Instruments | SF-28 | |
| Neonatal Injections | |||
| 10 µL Microliter Syringe Series 700, Removable Needle | Hamilton Company | 80314 | |
| 30 G Hypodermic Needles (0.5 inch) | BD PrecisionGlide | 305106 | |
| 4 inch thinwall glass capillary, no filament (1.0 mm outer diameter/0.75 mm) | WPI World Precision Instruments | TW100-4 | |
| Ethanol 99.8% (to dilute to 70% with double-distilled water [ddH2O]) | Sigma-Aldrich | V001229 | |
| AAV9.hEF1a.lox.TagBFP. lox.eYFP.lox.WPRE.hGH-InvBYF | Penn Vector Core | AV-9-PV2453 | Addgene Plasmid #45185 |
| AAV9.hEF1a.lox.mCherry.lox.mTFP 1.lox.WPRE.hGH-InvCheTF | Penn Vector Core | AV-9-PV2454 | Addgene Plasmid #45186 |
| ChAT-IRES-Cre knock-in transgenic mouse line | The Jackson Laboratory | 6410 | |
| Fast Green FCF Dye content ≥85 % | Sigma-Aldrich | F7252-25G | |
| Flaming/Brown Micropipette Puller, model P-97 | Sutter Instrument Co. | P-97 | |
| Green tattoo paste | Ketchum MFG Co | 329A | |
| Phosphate-Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | 806552 | |
| Pneumatic PicoPump | WPI World Precision Instruments | PV-820 | |
| Oxygenated artifiial cerebrospinal fluid (aCSF) Reagents | |||
| Calcium chloride dihydrate (CaCl2·2H2O) | Sigma-Aldrich | C7902 | |
| Carbogen (5% CO2, 95% O2) | AirGas | X02OX95C2003102 | Supplier may vary depending on region |
| D-(+)-Glucose | Sigma-Aldrich | G7021 | |
| HEPES, Free Acid | Bio Basic | HB0264 | |
| Hydrochloric acid solution, 1 N | Sigma-Aldrich | H9892 | |
| Magnesium chloride hexahydrate (MgCl2·6H2O) | Sigma-Aldrich | M2670 | |
| pH-Test strips (6.0-7.7) | VWR | BDH35317.604 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| Sodium chloride (NaCl) | Bio Basic | DB0483 | |
| Sodium phosphate monobasic (NaH2PO4) | Sigma-Aldrich | RDD007 | |
| Software | |||
| ImageJ | National Institutes of Health (NIH) | Open source |
Referanslar
- Lefebvre, J. L., Sanes, J. R., Kay, J. N. Development of dendritic form and function. Annual Review of Cell and Developmental Biology. 31, 741-777 (2015).
- Graham, H. K., Duan, X. Molecular mechanisms regulating synaptic specificity and retinal circuit formation. Wiley Interdisciplinary Reviews Developmental biology. 10 (1), 379 (2021).
- Godinho, L., et al. Targeting of amacrine cell neurites to appropriate synaptic laminae in the developing zebrafish retina. Development. 132 (22), 5069-5079 (2005).
- Mumm, J. S., et al. In vivo imaging reveals dendritic targeting of laminated afferents by zebrafish retinal ganglion cells. Neuron. 52 (4), 609-621 (2006).
- Wong, W. T., Faulkner-Jones, B. E., Sanes, J. R., Wong, R. O. Rapid dendritic remodeling in the developing retina: dependence on neurotransmission and reciprocal regulation by Rac and Rho. The Journal of Neuroscience. 20 (13), 5024-5036 (2000).
- Wei, W., Elstrott, J., Feller, M. B. Two-photon targeted recording of GFP-expressing neurons for light responses and live-cell imaging in the mouse retina. Nature Protocols. 5 (7), 1347-1352 (2010).
- Morgan, J. L., Wong, R. O. L. Ballistic labeling with fluorescent dyes and indicators. Current Protocols in Neuroscience. 43 (1), 1-10 (2008).
- Nickerson, P. E. B., et al. Live imaging and analysis of postnatal mouse retinal development. BMC Developmental Biology. 13, 24 (2013).
- Morgan, J. L., Dhingra, A., Vardi, N., Wong, R. O. L. Axons and dendrites originate from neuroepithelial-like processes of retinal bipolar cells. Nature Neuroscience. 9 (1), 85-92 (2006).
- Coombs, J. L., Van Der List, D., Chalupa, L. M. Morphological properties of mouse retinal ganglion cells during postnatal development. The Journal of Comparative Neurology. 503 (6), 803-814 (2007).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nature Methods. 13 (7), 557-562 (2016).
- Stacy, R. C., Wong, R. O. L. Developmental relationship between cholinergic amacrine cell processes and ganglion cell dendrites of the mouse retina. The Journal of Comparative Neurology. 456 (2), 154-166 (2003).
- Kay, J. N., et al. Retinal ganglion cells with distinct directional preferences differ in molecular identity, structure, and central projections. The Journal of Neuroscience. 31 (21), 7753-7762 (2011).
- Liu, J., Sanes, J. R. Cellular and molecular analysis of dendritic morphogenesis in a retinal cell type that senses color contrast and ventral motion. The Journal of Neuroscience. 37 (50), 12247-12262 (2017).
- Diao, L., Sun, W., Deng, Q., He, S. Development of the mouse retina: emerging morphological diversity of the ganglion cells. Journal of Neurobiology. 61 (2), 236-249 (2004).
- Coombs, J., vander List, D., Wang, G. Y., Chalupa, L. M. Morphological properties of mouse retinal ganglion cells. Neuroscience. 140 (1), 123-136 (2006).
- Sanes, J. R., Masland, R. H. The types of retinal ganglion cells: current status and implications for neuronal classification. Annual Review of Neuroscience. 38, 221-246 (2015).
- Sümbül, U., et al. A genetic and computational approach to structurally classify neuronal types. Nature Communications. 5, 3512 (2014).
- Lin, B., Masland, R. H. Populations of wide-field amacrine cells in the mouse retina. The Journal of Comparative Neurology. 499 (5), 797-809 (2006).
- Macneil, M. A., Heussy, J. K., Dacheux, R. F., Raviola, E., Masland, R. H. The shapes and numbers of amacrine cells: Matching of photofilled with Golgi-stained cells in the rabbit retina and comparison with other mammalian species. Journal of Comparative Neurology. 413 (2), 305-326 (1999).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Jo, A., Xu, J., Deniz, S., Cherian, S., DeVries, S. H., Zhu, Y. Intersectional strategies for targeting amacrine and ganglion cell types in the mouse retina. Frontiers in Neural Circuits. 12, 66 (2018).
- Siegert, S., et al. Genetic address book for retinal cell types. Nature Neuroscience. 12 (9), 1197-1204 (2009).
- Kim, I. -. J., Zhang, Y., Meister, M., Sanes, J. R. Laminar restriction of retinal ganglion cell dendrites and axons: subtype-specific developmental patterns revealed with transgenic markers. The Journal of Neuroscience. 30 (4), 1452-1462 (2010).
- Peng, Y. -. R., Tran, N. M., Krishnaswamy, A., Kostadinov, D., Martersteck, E. M., Sanes, J. R. Satb1 regulates contactin 5 to pattern dendrites of a mammalian retinal ganglion cell. Neuron. 95 (4), 869-883 (2017).
- Duan, X., Krishnaswamy, A., Dela Huerta, I., Sanes, J. R. Type II cadherins guide assembly of a direction-selective retinal circuit. Cell. 158 (4), 793-807 (2014).
- Ray, T. A., et al. Formation of retinal direction-selective circuitry initiated by starburst amacrine cell homotypic contact. eLife. 7, 34241 (2018).
- Krishnaswamy, A., Yamagata, M., Duan, X., Hong, Y. K., Sanes, J. R. Sidekick 2 directs formation of a retinal circuit that detects differential motion. Nature. 524 (7566), 466-470 (2015).
- Caval-Holme, F., Zhang, Y., Feller, M. B. Gap junction coupling shapes the encoding of light in the developing retina. Current Biology. 29 (23), 4024-4035 (2019).
- Lucas, J. A., Schmidt, T. M. Cellular properties of intrinsically photosensitive retinal ganglion cells during postnatal development. Neural Development. 14 (1), 8 (2019).
- Cai, D., Cohen, K. B., Luo, T., Lichtman, J. W., Sanes, J. R. Improved tools for the Brainbow toolbox. Nature Methods. 10 (6), 540-547 (2013).
- Rossi, J., et al. Melanocortin-4 receptors expressed by cholinergic neurons regulate energy balance and glucose homeostasis. Cell Metabolism. 13 (2), 195-204 (2011).
- Lefebvre, J. L., Kostadinov, D., Chen, W. V., Maniatis, T., Sanes, J. R. Protocadherins mediate dendritic self-avoidance in the mammalian nervous system. Nature. 488 (7412), 517-521 (2012).
- Ing-Esteves, S., et al. Combinatorial effects of alpha- and gamma-protocadherins on neuronal survival and dendritic self-avoidance. The Journal of Neuroscience. 38 (11), 2713-2729 (2018).
- Williams, P. R., Morgan, J. L., Kerschensteiner, D., Wong, R. O. L. In vitro imaging of retinal whole mounts. Cold Spring Harbor Protocols. 2013 (1), (2013).
- Ramoa, A. S., Campbell, G., Shatz, C. J. Transient morphological features of identified ganglion cells in living fetal and neonatal retina. Science. 237 (4814), 522-525 (1987).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nature Biotechnology. 28 (4), 348-353 (2010).
- Cuntz, H., Forstner, F., Borst, A., Häusser, M. One rule to grow them all: a general theory of neuronal branching and its practical application. PLoS Computational Biology. 6 (8), 1000877 (2010).
- Xiao, H., Peng, H. APP2: automatic tracing of 3D neuron morphology based on hierarchical pruning of a gray-weighted image distance-tree. Bioinformatics. 29 (11), 1448-1454 (2013).
- Nanda, S., et al. Design and implementation of multi-signal and time-varying neural reconstructions. Scientific data. 5, 170207 (2018).
- Sherry, D. M., Wang, M. M., Bates, J., Frishman, L. J. Expression of vesicular glutamate transporter 1 in the mouse retina reveals temporal ordering in development of rod vs. cone and ON vs. OFF circuits. The Journal of Comparative Neurology. 465 (4), 480-498 (2003).
- Johnson, J., et al. Vesicular neurotransmitter transporter expression in developing postnatal rodent retina: GABA and glycine precede glutamate. The Journal of Neuroscience. 23 (2), 518-529 (2003).
- Jüttner, J., et al. Targeting neuronal and glial cell types with synthetic promoter AAVs in mice, non-human primates and humans. Nature Neuroscience. 22 (8), 1345-1356 (2019).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. Journal of Visualized Experiments: JoVE. (31), e1333 (2009).
- Lye, M. H., Jakobs, T. C., Masland, R. H., Koizumi, A. Organotypic culture of adult rabbit retina. Journal of Visualized Experiments: JoVE. (3), e190 (2007).
- Pignatelli, V., Strettoi, E. Bipolar cells of the mouse retina: a gene gun, morphological study. The Journal of Comparative Neurology. 476 (3), 254-266 (2004).
- Huckfeldt, R. M., et al. Transient neurites of retinal horizontal cells exhibit columnar tiling via homotypic interactions. Nature Neuroscience. 12 (1), 35-43 (2009).
- Prahst, C., et al. Mouse retinal cell behaviour in space and time using light sheet fluorescence microscopy. eLife. 9, 49779 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır