A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמיה בזמן לשגות של arborization עצבי באמצעות תיוג וירוסים דליל אדנו הקשורים של אוכלוסיות תאי רשתית ממוקדים גנטית
In This Article
Summary
כאן, אנו מציגים שיטה לחקירת מורפוגנזה נויריט ברשתית לאחר הלידה על ידי מיקרוסקופיה קונפוקלית לשגות זמן. אנו מתארים גישה לתיוג דליל ורכישה של סוגי תאי רשתית ותהליכים עדינים שלהם באמצעות וקטורים וירוס הקשורים אדנו רקומביננטי המבטאים חלבונים פלואורסצנטיים ממוקדי ממברנה באופן תלוי Cre.
Abstract
גילוי מנגנונים שמעצבים ארבורים דנדריטיים דורש שיטות להמחשה, דימוי וניתוח דנדריטים במהלך הפיתוח. רשתית העכבר היא מערכת מודל רבת עוצמה לחקירה של מנגנונים ספציפיים לסוג התא של מורפוגנזה עצבית וקישוריות. הארגון וההרכב של תת-סוגים ברשתית מוגדרים היטב, וכלים גנטיים זמינים כדי לגשת לסוגים ספציפיים במהלך הפיתוח. סוגי תאי רשתית רבים מגבילים גם את הדנדריטים ו/או האקסונים שלהם לשכבות צרות, מה שמאפשר הדמיה בזמן לשגות. תרביות רשתית העכבר מתאימות היטב להדמיית תאים חיים באמצעות מיקרוסקופיה קונפוקלית או מולטיפוטונית, אך חסרות שיטות המותאמות לדינמיקת דנדריט הדמיה עם רזולוציה זמנית ומבנית. מוצג כאן היא שיטה לתייג ולדמיין בדלילות את ההתפתחות של אוכלוסיות רשתית ספציפיות המסומנות על ידי מערכת Cre-Lox. וירוסים הקשורים לאדנו (AAVs) הזמינים מסחרית המשמשים כאן מבטאים חלבונים פלואורסצנטיים ממוקדי ממברנה באופן תלוי Cre- תלוי. משלוח תוך עיני של AAVs בעכברים יילודים מייצר תיוג פלואורסצנטי של סוגי תאים ממוקדים על ידי 4-5 ימים לאחר ההזרקה (dpi). אותות פלואורסצנטיים ממברנה ניתנים לזיהוי על ידי הדמיה קונפוקלית ולפתור מבני ענף עדינים ודינמיקה. קטעי וידאו באיכות גבוהה המשתרעים על פני 2-4 שעות נרכשים מהדמיית רשתית שטוחה-תושבות עם נוזל שדרתי מלאכותי מחומצן (aCSF). כמו כן מסופק צינור לאחר עיבוד תמונה עבור deconvolution ותיקון סחיפה תלת מימדי (3D). פרוטוקול זה יכול לשמש כדי ללכוד כמה התנהגויות תאיות ברשתית שלמה ולזהות גורמים חדשניים השולטים מורפוגנזה neurite. אסטרטגיות התפתחותיות רבות הנלמדות ברשתית יהיו רלוונטיות להבנת היווצרות מעגלים עצביים במקומות אחרים במערכת העצבים המרכזית.
Introduction
דנדריטים של נוירונים ברשתית יוצרים דפוסים מורכבים, אך ספציפיים, המשפיעים על תפקידם בתוך מעגלים עצביים. ברשתית החולייתנית, סוגים מגוונים של תאי גנגליון רשתית (RGCs) ואינטראורונים תא amacrine נושאים מורפולוגיות דנדריטיות ייחודיות השונות בגודל ארבור, מיקום, אורך ענף, וצפיפות1. במהלך התפתחות לאחר הלידה, RGCs ותאי amacrine להרחיב תהליכים דנדריטיים תוססים לתוך נוירופיל הנקרא שכבת plexiform הפנימית (IPL), שם הם מקבלים קלט תא דו קוטבי המשדר אותות photoreceptor2. כפי שנתפס על ידי הדמיה בזמן-לשגות של אוכלוסיות רשתית שכותרתו פלואורסצנטית בזחלי אפרוחים או דגי זברה, מורפוגנזה דנדריט הוא דינמי מאוד 3,4,5. בתוך ימים, arbors דנדריטי להרחיב, לשפץ, ו ramify כדי לצמצם את שכבות המשנה של IPL, שם הם סינפסה עם שותפים נבחרים. הארבורים מציגים דינמיקה מבנית שונה על פני ההתפתחות, עם שינויים בשיעורים היחסיים של תוספת ענף, נסיגה וייצוב. אמקרין ודנדריטים של RGC מפגינים גם התנהגויות שונות של צמיחה ושיפוץ שעשויות לשקף ארבוריזציה ספציפית לסוג. עם זאת, מחקרים אלה עקבו אחר אוכלוסיות אמקרין או RGC רחבות והתמקדו במיקוד למינארי, שהוא רק היבט אחד של המורפולוגיה.
המנגנונים המייצרים את המגוון המורפולוגי העצום שנצפו על פני תת-סוגים ברשתית אינם מובנים כהלכה. מטרתה של קבוצה זו הייתה לפתח שיטה ללכידת דינמיקה דנדריקית ושיפוץ ארבור של תת-סוגים מוגדרים של רשתית בעכברים. זיהוי מנגנונים ספציפיים לסוג התא של דפוסי דנדריט דורש שיטות כדי לדמיין ולמדוד התנהגויות דנדריט של תאים מעניינים. תרביות אורגנוטיפיות של רשתיות עכבר מתאימות היטב למחקרי הדמיה של תאים חיים באמצעות מיקרוסקופיה קונפוקלית או רב-פוטונית. הרשתיות המתפתחות מנותחות ומורכבות לתוך גולה שטוח שניתן לצלם במשך מספר שעות בחדר הקלטות או לתרבות במשך כמה ימים עם השפעות מוגבלות על המעגלים 6,7. נוירוני רשתית חיים יכולים להיות מסומנים על ידי מגוון טכניקות, כולל מילוי צבע על ידי אלקטרודות, אלקטרופורציה, משלוח ביוליסטי של חלקיקים מצופים בצבעים ליפופיליים או פלסמידים קידוד חלבונים פלואורסצנטיים (למשל, Gene Gun), כמו גם תוויות תאים מקודדים גנטית7,8,9,10 . עם זאת, גישות אלה אינן יעילות עבור הדמיה דנדריט דינמיקה של תת סוגים ספציפיים ברשתית. לדוגמה, שיטות מילוי צבע הן בעלות תפוקה נמוכה ודורשות מנגנון אלקטרופיזיולוגי ותוויות גנטיות נוספות לתאי יעד אמינים של עניין. יתר על כן, אותות הפלואורסצנטיות החזקים בסומא יכולים לטשטש דנדריטים סמוכים.
שיטות העברת גנים ביוליסטיות יכולות לתייג בו זמנית עשרות תאים, אך צעדים הכוללים אספקת חלקיקים בלחץ גבוה ודגרה לילית של רשתית מבודדת עלולים לסכן את הפיזיולוגיה של התא ואת הצמיחה הדנדריטית. מאמר זה מציע כי כלים גנטיים אחרונים ניתן להשתמש כדי ללכוד דינמיקה דנדריט מוקדם עם סוג התא ורזולוציה מבנית, בהתחשב בקריטריונים הניסיוניים הבאים. ראשית, כדי לפתור את הענפים העדינים ואת הפילופודיה השולטים arbors המתפתחים, השיטה צריכה לתייג נוירונים עם חלבונים בהירים, פלואורסצנטיים הממלאים תהליכים בכל הארבור. תיוג הפלואורסצנטיות לא אמור לדעוך עקב הלבנת פוטואורסצנטיות במהלך תקופת ההדמיה. מגוון גרסאות חלבון פלואורסצנטיות נוצרו והושוו להתאמה להדמיית vivo/ex vivo/ex vivo11 המבוססת על בהירות ופוטוסטיות. שנית, החלבונים הפלואורסצנטיים (XFPs) חייבים לבוא לידי ביטוי ברמות גבוהות מספיק בשלב המוקדם ביותר של מורפוגנזה דנדריט, כך שהחלון ההתפתחותי הצר לא יוחמץ. בניתוחים של נקודות זמן סטטיות ברשתית העכבר, התפתחות דנדריט מתרחשת במהלך השבוע הראשון שלאחר הלידה וכוללת שלבים של צמיחה, שיפוץ וייצוב10,12,13,14,15. שלישית, השיטה צריכה להוביל תיוג סלקטיבי או להסתברות מוגברת של תיוג של תת האוכלוסייה העצבית של עניין. רביעית, תיוג של אוכלוסיית המשנה של היעד חייב להיות דליל מספיק, כך שניתן יהיה לזהות את הארבור העצבי כולו ולעקוב אחריו. למרות שתת-סוגים של משמרות המהפכה ואמקרין יכולים להיות מובחנים על ידי המאפיינים המורפולוגיים הבוגרים שלהם ודפוסי ריבוד IPL16,17,18,19,20, האתגר הוא לזהות תת-סוגים במהלך הפיתוח המבוססים על מבנים לא בוגרים. משימה זו מתאפשרת על ידי הרחבת כלים מהונדסים לתייג סוגי תאים ספציפיים ברשתית במהלך הפיתוח.
קווי עכבר מהונדסים ונוק-אין שבהם ביטוי תאי וטמפורלי של חלבונים פלואורסצנטיים או Cre נקבע על ידי אלמנטים רגולטוריים גנטיים נמצאים בשימוש נרחב כדי לחקור סוגי תאי רשתית13,21,22,23. תצפיות מפתח על דפוסים ספציפיים תת-סוג של התפתחות דנדריט הגיעו ממחקרים של רשתות עכבר מהונדסות בנקודות זמן סטטיות10,14,24,25. מערכת Cre-Lox, בפרט, מאפשרת מניפולציה וניטור גנים מעולים של תת-סוגים באמצעות מגוון כתבים, חיישנים ומפעילים אופטוגנטיים תלויי רקומבינאז. כלים אלה הובילו לתגליות של תוכניות מולקולריות ספציפיות לתת-סוג ומאפיינים פונקציונליים העומדים בבסיס הרכבת מעגל רשתית26,27,28,29,30. עם זאת, הם עדיין לא להיות ממונפים ללמוד דינמיקה דנדריט ספציפית תת סוג ברשתית העכבר. תיוג בצפיפות נמוכה ניתן להשיג על ידי שילוב קווי עכבר Cre עם טרנסג'נים שהוצגו על ידי אלקטרופורציה או על ידי AAVs רקומביננטי. אם זמין, טמוקסיפן-inducable Cre קווים או אסטרטגיות גנטיות הצטלבות ניתן להשתמש גם. לבסוף, התא צריך להיות מתויג באופן זעיר פולשני ותמונה באמצעות פרמטרי רכישה כדי לא לסכן את הרקמה או להפריע לתפקוד התאי הנדרש עבור מורפוגנזה דנדריט.
מוצגת כאן שיטה ליישם כלים מהונדסים ומיקרוסקופיה קונפוקלית כדי לחקור את הדינמיקה של דנדריט ברשתית חיה. קווי עכבר מהונדסים Cre שולבו עם וקטורים AAV המבטאים חלבונים פלואורסצנטיים על recombination Cre, המאפשר תיוג דליל של תאי רשתית של עניין. AAVs זמין מסחרית מועברים לרשתית היילוד על ידי זריקות intravitreal. מאמר זה מדגים כי AAVs לייצר ביטוי פלואורסצנטי גבוה באופן משמעותי סוג התא על ידי 4 dpi, המאפשר גישה לנקודות זמן לאחר הלידה. כדי להמחיש גישה זו, cholinergic "starburst" amacrine interneuron תויג על ידי מתן Brainbow AAV בעכברים יילודים המבטאים את כולין acetyltransferase (ChAT)-אתר הכניסה לריבוזום פנימי (IRES)-Cre transgene, אשר פעיל ברשתית שלאחר הלידה המוקדמת31,32. תאי amacrine Starburst לפתח מורפולוגיה ארבור סטריאוטיפית רדיאלית כי הוא מעוצב על ידי דנדריט הימנעות עצמית בתיווך protocadherins מקובצים33,34. מאמר זה מראה כי הרזולוציה של דנדריטים starburst ו filopodia משופרת באופן משמעותי על ידי XFPs לקרום הפלזמה עם תוספת של מוטיב CAAX אשר עובר farnesylation, כפי המשמש Brainbow AAVs31. לבסוף, נקבעו פרוטוקולי הדמיה ופוסט-עיבוד של זמן המייצרים תמונות באיכות גבוהה הניתנות לשחזור דנדריט וכימות מורפומטרי. פרוטוקול זה יכול לשמש כדי לזהות גורמים השולטים מורפוגנזה דנדריט וכדי ללכוד כמה התנהגויות תאיות ברשתית שלמה.
Protocol
הערה: פרוטוקול זה משתרע על פני יומיים עם פרק זמן מינימלי של 4-5 ימים להעברה ויראלית בין ימי ניסוי (איור 1A). ניסויים בבעלי חיים מבוצעים בהתאם להנחיות המועצה הקנדית לטיפול בבעלי חיים לשימוש בבעלי חיים במחקר וטיפול בבעלי חיים במעבדה תחת פרוטוקולים שאושרו על ידי המעבדה לשירותים לבעלי חיים שימוש וטיפול בבעלי חיים הוועדה בבית החולים לילדים חולים (טורונטו, קנדה).
1. הכנות לזריקות AAV יילודים וניסויי הדמיה
- בחר קו עכבר Cre כדי לתייג את אוכלוסיות תאי הרשתית של עניין. אשר ביטוי רקומבינאז Cre בזמן זריקות AAV על ידי מעבר לכתב מהונדס Cre או באמצעות חיסונים עם נוגדן Cre.
- לגדל עכברי Cre מהונדסים (בני 8-16 שבועות) כדי ליצור חיות יילודים חיוביות Cre.
הערה: עבור הדגמה זו, עכברי ChAT-IRES-Cre נוק-אין שימשו כדי למקד את תאי amacrine Starburst השימושיים. - להשיג רקומבינאז תלוי AAV וירוס קידוד חלבונים פלואורסצנטיים(ים). לקבלת תיוג אופטימלי של תהליכים עדינים, בחר וקטורים המבטאים XFPs שונה מיקוד קרום הפלזמה.
הערה: מחקר זה השתמש בווירוס Brainbow (BBV), AAV-EF1a-BbTagBY ו- AAV9-EF1a-BbChT (ראה טבלת חומרים), המספקים את האפשרות לתיוג בצבעים מרובים (איור 1B). חלבון פלואורסצנטי צהוב משופר (eYFP) וביטוי דובדבן מונומרי (mCherry) יצרו את האותות הפלואורסצנטיים החזקים ביותר להדמיה חיה. BBV יחיד יכול לשמש כדי לדמיין arbors בודדים, בעוד הזרקה משותפת של BBVs יכול לשמש כדי לתייג תאים נוספים או arbors שכנים עם פלואורופורים ברורים. אם אתם משתמשים בחלבונים פלואורסצנטיים מרובים, ודאו חפיפה מינימלית בספקטרום הפליטה (איור 1C). יש להתאים פרמטרי רכישת מיקרוסקופ כדי ללכוד אותות XFP נפרדים. - הכן ∼3-5 μL aliquots של AAVs בצינורות מחייבים נמוכים בודדים עבור מניות חד פעמיות כדי למנוע הקפאה / הפשרה מחזורים. יש לאחסן בטמפרטורה של עד 80 מעלות צלזיוס.
- הכן micropipettes זכוכית borosilicate עם טיפים עדינים מאוד באמצעות משיכת micropipette.
הערה: הגדרות Puller משתנות בהתאם לתפירה ולמשיכה הנמצאות בשימוש; ראו איור 2A לקבלת גודל וצורה סופיים של קצה. קוטר טיפה טיפוסי הם 600 מיקרומטר. - להשיג מערכת microinjection וצינורות הקשורים. חבר את המיקרו-מקרן ליציאת אוויר בלחץ.

איור 1: סקירה ניסיונית. (A) פרוטוקול זה משתרע על פני יומיים של ניסויים עם תקופת זיהום מינימלית של 4-5 ימים בין ימי הניסוי. זריקות תוך עיניות מבוצעות על עכברים יילודים לא יותר מיום לאחר הלידה 3. לאחר מכן, הרשתיות מנותחות, מותקנות באופן שטוח ותמונות חיות כדי ללכוד את החלון ההתפתחותי הרצוי. תאים מסומנים בתווית ניתן לדמיין בכל עת לאחר 4-5 הימים הדרושים לביטוי ויראלי, שכן אין השפעות נראות לעין של ביטוי AAV ממושך על מורפולוגיה דנדריט. (B) וקטורים תלויי Crebow AAV (BBV) מוזרקים לבעלי חיים המבטאים את Cre31. במחקר זה, עכברי ChAT-Cre נוק-אין שימשו כדי לנהוג Cre recombination בתאי amacrine starburst. שני BBVs מקודדים eYFP שונה או tagBFP, או mCherry ו- mTFP, אשר מסתיימים במוטיב CAAX כי הוא ברצף farnesylated עבור לוקליזציה ממברנה. אתרי לקס מתוארים במשולשים. הווקטורים מבטאים XFPs מופרכים באופן סטוכסטי וקומבינטורי התלוי רקומבינציה בקרומבינציה. מקדם EF1α כולל אלמנטים רגולטוריים מהגן גורם התארכות 1α. W מייצג אלמנטים מן אלמנטים של וירוס הפטיטיס הפטיטיס woodchuck אלמנט רגולטורי posttranscriptional, ו- pA מציין את רצף polyadenylation. (ג) ספקטרום העירור והפליטה של mCherry ו- eYFP, פלואורופורים BBV בתמונה במחקר זה. כאשר הדמיה חיה חלבונים פלואורסצנטיים מרובים, הפרמטרים לזיהוי חייבים להיות מסודרים כדי להפריד כראוי ספקטרום פליטה לערוצים נפרדים. קיצורים: AAV = וירוס הקשור לאדנו; BBV = Brainbow AAV; ChAT = כולין acetyltransferase; iRES = אתר כניסה פנימי לריבוזום; eYFP = חלבון פלואורסצנטי צהוב משופר; iTR = חזרה הפוכה על המסוף; tagBP = חלבון פלואורסצנטי כחול תג; mCherry = דובדבן מונומרי; mTFP = חלבון פלואורסצנטי צהבהב; XFP = כל חלבון פלואורסצנטי; EF1α= גורם התארכות 1 אלפא. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
2. זריקות תוך-יומיות של AAVs בעכברים יילודים
- להפשיר aliquot AAV על קרח. הכן ~1:4 דילול AAV באמצעות מלוחים סטריליים או מלוחים חוצצי פוספט. הכן ~ 0.5 μL של דילול AAV לכל בעל חיים (~ 0.25 μL לכל עין) במקרה המיקרופיפט נשבר, ופיפטה חדשה צריכה להיות מלאה. יש לאחסן את ה-AAV הנותר ב-4 °C °C (4 °F), ולהשתמש תוך שבועיים.
הערה: בניסוי זה, ריכוז AAV הספק היה ~ 1-2 × 1013 תוכן הגנום (GC)/ mL ומדולל לריכוז סופי של 4 × 1012 GC / mL. מטב את הריכוז הנגיפי כדי להשיג את צפיפות התיוג הרצויה. - כדי לדמיין את הזריקות, להוסיף כ 1 μL של 0.02% פתרון צבע FCF ירוק מהיר עבור כל 15 μL של דילול AAV לצבוע את הפתרון כחול.
- העבר כלוב עכברים עם סכר ופסולת שזה עתה נולדה (יום לאחר הלידה (P) 0.5-3) לחדר ניתוח עם ציוד microinjection. שמור את בעלי החיים באותו כלוב עם קינים ומצעים כדי למזער את הלחץ האימהי ודחייה של גורים.
- לחטא את אזור ההזרקה עם 70% אתנול, ולהניח רפידות חיתולים סטריליות על משטחי ספסל. הכן פלטפורמה חמה (למשל, כרית חימום) להתאוששות מהרדמה הנגרמת על ידי היפותרמיה.
- מלאו את המיקרופיפט בדילול AAV באמצעות מיקרו-מזרק. תחת סטריאומיקרוסקופ, לשבור את קצה micropipette עם מחט 30 G כדי לפתוח את הקצה.
הערה: איור 2A מציג את הקצה הממולא בגב - הן אטום (עליון) והן חתום (אמצע). - מרדים עכברים יילודים על ידי היפותרמיה על ידי הצבת 1-2 בעלי חיים על קרח. מניחים בעלי חיים על כפפת לטקס כדי להגן על העור מפני מגע ישיר עם קרח. ברגע שהחיה כבר לא זזה בתגובה לצביטת כף הרגל (~ 2 דקות), מניחים את החיה תחת סטריאומיקרוסקופ. אם תרצה, רפידות כף רגל קעקוע עם דיו קעקוע ומחט 30 G, ולאסוף גזירי זנב עבור בידוד DNA כדי לזהות בעלי חיים על ידי genotyping.
הערה: ניטור מתאים של עומק ההרדמה חייב להתרחש לאורך כל ההליך. - ספוגית העור מעל העיניים עם 70% אתנול. השתמשו במחט של 30 גר' כדי לפתוח את העפעף המותך (איור 2B). הפעילו לחץ קל עם האצבעות כדי לפתוח את העין, ותקעו חור קטן בקרנית בצומת הקרנית-סקלרה (איור 2C).
- הכנס את מיקרופיפט הזכוכית לתוך החור, ולחץ על דוושת כף הרגל microinjector 2-4 פעמים כדי להזריק את AAV לתוך החלל התוך כיווני. הסירו באיטיות את המיקרופיפט, ואשרו הזרקת AAV על-ידי הדמיית הצבע הכחול דרך האישון (איור 2D).
הערה: עם לחץ פליטה של 6-8 פסאיי וזמן פעימה של 600-800 אלפיות השנייה, טיפה בקוטר 600 מיקרומטר הוצאה (איור 2A, למטה). כ 0.23-0.45 μL של פתרון AAV מוזרק לכל עין. פתרון כחול מחוץ לעין מציין כי AAV לא הוזרק לתוך העין. פתרון כחול דולף מאתר ההזרקה מציין כי AAV אולי דלף החוצה, הפחתת יעילות transfection. - לחץ בעדינות על העפעפיים יחד כדי לאטום מחדש, ומניחים את הגור על כרית מחוממת. ברגע שבעלי החיים משחזרים צבע ורדרד ומגיבים, מעבירים אותם בעדינות בחזרה לכלוב הדיור.
הערה: ודאו שננקטים אמצעי זהירות מתאימים כדי למנוע התחממות מהירה מדי של הגורים. - חזור על הליך ההזרקה עבור בעלי החיים הנותרים במלטה. אפשר מינימום של 4-5 ימים עבור transduction ויראלי לפני הדמיית הרשתית.

איור 2: זריקות תוך עיניות של יילודים. (A) מיקרופיפט במילוי גב מראה את צורת קצה הפיפטה כאשר הוא אטום (למעלה) ולאחר פתיחת הקצה (למטה, משמאל). לחץ הזרקת פיקו של 6-8 פסאיי וזמן דופק של 600-800 מילישניות מייצר טיפה בקוטר 600 מיקרומטר (למטה, מימין). סרגל קנה מידה = 1 מ"מ.(B) גור P0 מורדם תחת הגדלה של פי 16. צומת העפעפיים המותך (לבן) נחתך באמצעות מחט חדה של 30 גרם. סרגל קנה מידה = 2 מ"מ. (C) לחץ קל המופעל על העין חושף את הקרנית; סרגל קנה מידה = 2 מ"מ. קטע מוגדל (אדום) מציג את החור הקטן בצומת הקרנית-סקלרה (צהוב) שנוצר עם מחט של 30 גרם; סרגל קנה מידה = 0.5 מ"מ. (D) נסיגה של קצה פיפטה לאחר הזרקה (משמאל). צבע ירוק מהיר בתמיסת AAV מופיע כחול-אפור דרך האישון (באמצע), בהשוואה לצבע האישון הקל לפני ההזרקה (מימין). סרגל קנה מידה = 1 מ"מ. (E) לאחר 4 ימים, העפעף נרפא והתמזג סגור (משמאל); סרגל קנה מידה = 2 מ"מ. עם עידוד, אתר ההזרקה נרפא גלוי (צהוב); סרגל קנה מידה = 1 מ"מ. שימו לב למיקום אתר ההזרקה בגבול בין הקרנית לסקלרה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
3. ניתוחי רשתית לניסוי הדמיה
- הכן רשתית aCSF (119 mM NaCl, 2.5 mM KCl, 1.3 mM MgCl2·6H2O, 2.5 מ"מ CaCl2·2H2O, 1 מ"מ NaH2PO4, 11 מ"מ גלוקוז, ו 20 מ"מ 4-(2-הידרוקסיאתיל)-1-חומצה piperazineethanesulfonic (חומצה ללא HEPES)35. אם תרצה, להכין ולהקפיא פתרון 10x; להפשיר ולדלל ל 1x לפי הצורך.
- לחמצן את רשתית aCSF על ידי מבעבע עם קרבוגן (95% O2, 5% CO2) במשך מינימום של 15 דקות. כוונן את רמת החומציות ל-7.4. יש לשמור במיכל אטום עד לשימוש כדי לוודא שה-ACSF נשאר מחומצן.
הערה: רשתיות דורשות ריכוז גבוה של O2. חשוב לשמור על ACSF מחומצן לאורך כל הניסוי. - הטמע צלחת פטרי בקוטר 60 מ"מ לתוך מגש קרח (לעצב מגש קרח מתוך פלסטיק מעבדה, למשל, מכסה תיבת פיפטה), ומניחים אותו תחת סטריאומיקרוסקופ. מלאו את צלחת הפטרי ברשתית מחומצנת ACSF.
- המתת חסד עכברים P9 ומטה על ידי עריפת ראש. המתת חסד של עכברים P10 ומעלה על ידי אינדוקציה איזופלוריין, או שיטה חלופית שאושרה על פי פרוטוקול בעלי החיים, ואחריה עריפת ראש.
- אם העפעפיים אטומים, חותכים את דש העפעף כדי לחשוף את העין. השתמש מלקחיים כדי לעטוף את העיניים, ולהעביר אותם לתוך רשתית קרה ACSF משלב 3.3.
- כדי לנתח את הרשתית, תחת סטריאומיקרוסקופ (הגדלה פי 25), לייצב את העין על ידי הידוק עצב הראייה באמצעות מלקחיים של דומונט מס' 5 (איור 3A).
- לתקוע חור במרכז הקרנית עם מחט 30 גרם, ולאחר מכן להכניס קצה אחד של microscissors לתוך החור כדי לבצע חתך מהחור עד סוף הקרנית. חוזרים על הפעולה כדי ליצור 4 פרוסות בכיוונים הקרדינליים, ויוצרים 4 "מדפים" (איור 3A).
- עם שני מלקחיים של דומונט מס' 5, אוחזים ומפרקים את שני המדפים הסמוכים, מקלפים בעדינות את הסקלרה מהרשתית. חוזרים על הפעולה עם מדפים הקרנית הנותרים, ומסירים את הסקלרה מהרשתית (איור 3B).
- הסר את העדשה מכוס הרשתית באמצעות מלקחיים. בעזרת מיקרו-חתכים, בצעו 4 חתכים רדיאליים מקצה הרשתית לכיוון עצב הראייה, ויצרו 4 עלי כותרת שווים (איור 3B). חזור על שלבים 3.4-3.7 עבור העין השנייה.
4. הכנת הרכבה שטוחה ברשתית
- הכן דיסקי מסנן מסנן קרום אסתר תאית מעורבת אפורה (MCE) להרכבה. אם משתמשים במסנני קרום MCE בקוטר גדול, חותכים את הדיסק לרבעים (בערך 1 ס"מ לרוחב). מקם את דיסק MCE במרכז נייר סינון לבן גדול יותר (איור 3D).
הערה: מסנני MCE זמינים גם בדיסקים בקוטר 1 ס"מ. דיסק המסנן של MCE חייב להיות גדול מספיק כדי להתאים לרשתיות 1-2, אך קטן מספיק כדי להתאים לתא ההדמיה. כמו ממברנות MCE להחזיק מטען סטטי, למזער מגע וטיפול של קרום MCE. - טיפול ברשתיות באמצעות שתי מברשות צבע בגודל 3/0, להפוך רשתית אחת על מברשת צבע עם צד תא גנגליון רשתית למטה. הרימו בעדינות את הרשתית מה-ACSF, וודאו שמתח המים לא יקרע את הרשתית (איור 3C).
- בעודכם מחזיקים את המכחול עם הרשתית, השתמשו בפיפטת העברה כדי למקם טיפה של aCSF במרכז נייר הסינון של MCE (איור 3C, מימין). לצוף את הרשתית לתוך טיפה של ACSF שנוצר על ידי מתח פני השטח. השתמש במברשות צבע כדי למקם את הרשתית RGC בצד למעלה בתוך טיפה ולפתוח את ארבעת עלי הכותרת.
- לאחר מיקום, ליצור גשר מים בין מברשת צבע ונייר סינון לבן כדי לשבור את מתח פני השטח של טיפה.
הערה: כאשר ACSF הוא רשע משם, הרשתית תדבק נייר מסנן MCE (איור 3D,E). ניתן לטפל ברשתיות שטוחות על-ידי אחיזת דיסק MCE במלקחיים. אם טיפת ACSF מתפתלת במהירות לפני יצירת גשר מים, הדבר עשוי להצביע על כך שקרום ה- MCE אינו טעון. השתמש קרום MCE טרי, ולמזער את הזמן בין enucleation והדמיה על ידי ניתוח רשתיות הרכבה שטוחה מיד לפני העברת רשתיות לתוך תא ההדמיה.

איור 3: כריתת רשתית והתקנה שטוחה על קרומי מסנן אסתר תאית מעורבים. (A) משמאל, עין מוערכת מתייצבת על ידי אחיזה בעצב הראייה עם מלקחיים של דומונט #5 (משמאל). חור קטן נוצר במרכז הקרנית באמצעות מחט 30 גרם (במרכז). מספריים מיקרו-חתך משמשים לחיתוך הקרנית ל -4 מדפים שווים (מימין). סרגל קנה מידה = 1 מ"מ. (B) רשתית ניתחה עם הסקלרה קלופה באמצעות שני מלקחיים דומונט #5 (משמאל) ועם העדשה הוסרה (במרכז). רשתית עם 4 חתכים שווים באמצע הרשתית (מימין). סרגל קנה מידה = 1 מ"מ. (ג) טיפול ברשתית עם שתי מברשות צבע עדינות (גודל 3/0, משמאל). רשתית התהפכה עם תאי גנגליון רשתית בצד למטה על מברשת צבע (במרכז) והרימה מתוך ACSF, מוודא מתח המים לא לקרוע את הרשתית (מימין). סרגל קנה מידה = 2 מ"מ. (D) דיסק קרום MCE אפור ממוקם על נייר סינון לבן (משמאל). טיפה של ACSF בדיסק MCE (מימין). סרגל קנה מידה = 1 ס"מ. (E) לאחר הצפת הרשתיות לתוך טיפה ומיצוב אותם, ליצור גשר מים עם נייר המסנן הלבן כדי לפתיל את aCSF, מושך את הרשתית על נייר MCE טעון (משמאל); סרגל קנה מידה = 1 ס"מ. תמונה מוגדלת של קרום MCE (אדום) מראה 2 רשתות המותקנות עם תאי גנגליון רשתית בצד למעלה (מימין); סרגל קנה מידה = 2 מ"מ. רשתית אחת מסומנת בלבן. קיצורים: MCE = אסתר תאית מעורבת; aCSF = נוזל שדרתי מלאכותי. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
5. הדמיה קונפוקלית לשגות זמן של תכשירי רשתית שלמים חיים
- הרכיבו את תא הדגירה של הדמיה חיה למיקרוסקופ קונפוקלי זקוף כפי שניתן לראות באיור 4.
הערה: עבור מערכות קונפוקליות הפוכות, הרכבות שטוחות ממוקמות בצד RGC כלפי מטה ישירות על מכסה תחתית הזכוכית של תא הדגירה. ברגע שהרשתיות יוצרות קשר עם כיסוי הכיסוי, לא ניתן להזיז אותן. - מלאו את התא ב-ACSF מחומצן, והפעילו את המשאבה ואת בקר הטמפרטורה (טמפרטורה 32-34 מעלות צלזיוס, קצב זרימה 1 מ"ל/דקה). אין לאפשר לטמפרטורה לעלות מעל 34 °C (65 °F).
- כדי להעביר את הרשתית שטוחה להרכבה שטוחה לתא הזלוף, לעצור את המשאבה, ולהסיר את aCSF כי הוא בתא. הנח את דיסק MCE עם הרשתית שטוחה להרכבה שטוחה לתוך תא הדגירה (הריק).
- מניחים משקל מדגם על ההרכבה השטוחה; להרטיב מראש את המשקל כדי לשבור את מתח פני השטח. מלאו מחדש את התא ב-ACSF המחומם, והפיצו את ה-ACSF במהירות של כ-1 מ"ל/דקה.
- מקם את האף עם המטרה 25x מים טבילה (צמצם מספרי 0.95) לתוך חדר ההדמיה. מסך לתאים בעלי תווית של עניין באמצעות אור אפיפלואורסצנטי (איור 4C).
- התאם את עוצמת ההדמיה כדי ללכוד תכונות דנדריטיות של עניין.
הערה: מחקר זה לכד את הארבור הדנדריטי המלא ב- 1024 x 1024 פיקסלים למסגרת, z-step 1 מיקרומטר וקצב פריימים של 2 דקות בין כל מחסנית z. גדלי תמונה סופיים הם ~ 100 מיקרומטר x 100 מיקרומטר x 20 מיקרומטר. - כדי להתאים את עוצמת הלייזר להגדרה אופטימלית, השתמש בטבלת חיפוש המזהה פיקסלים רוויים ולא רוויים. בעת הסריקה, התאם את עוצמת הלייזר כך שלא יהיו פיקסלים רוויים יתר על המידה (כלומר, בעוצמה של 255 ומעלה). המשך הדמיה כל עוד יש צורך, או עד שיש ירידה משמעותית וניתן לגילוי באות פלואורסצנטי ולהגביר את הרעש (בדרך כלל 2-4 שעות).
הערה: עוצמת לייזר מופחתת מומלצת מכיוון שאלגוריתמים של דה-מפכות פועלים בצורה אופטימלית כאשר פיקסלים מופצים על פני הטווח הדינמי המלא. עוצמת הפיקסלים לא תעלה על 254; ניתוחים אמפיריים של נוריטים גילו שערכי פיקסלים מתחת ל-170 אידיאליים לדה-פיתולציה. מהירויות סריקה גבוהות (400-600 הרץ) עם ממוצע קווים (2-3) עדיפות על סריקות בודדות ואיטיות יותר של אותו זמן השתהות פיקסלים כולל. האזור של הדמיה ממושכת לעתים קרובות photobleaches, אבל קטעים explant אחרים נשארים קיימא. ניתן לצלם אזורים מרובים בהרכבה שטוחה, כל אחד למשך 2-4 שעות, עם זמן דגירה כולל של 6 שעות. מפגשי הדמיה מעבר ל-6 שעות לא נבדקו באופן שיטתי. התדרדרות נויריט ופעימות הם סימנים לכך שהכדאיות המהוללת הולכת ופוחתת. - לאחר הדמיה, לתקן את הרשתית שטוחה הרכבות ומסנן ממברנה עם קר 4% paraformaldehyde עבור 1-2 שעות ב 4 °C (60 °F). הגבר את התוויות הפלואורסצנטיות ברשתיות הקבועות על ידי אימונוהיסטוכימיה לניתוחים נוספים.
הערה: קיבעון לאחר הדמיה אינו אפשרי בעת שימוש בקונפוקל הפוך; רשתיות אינן ניתנות להסרה מבלי להרוס את הרקמה.
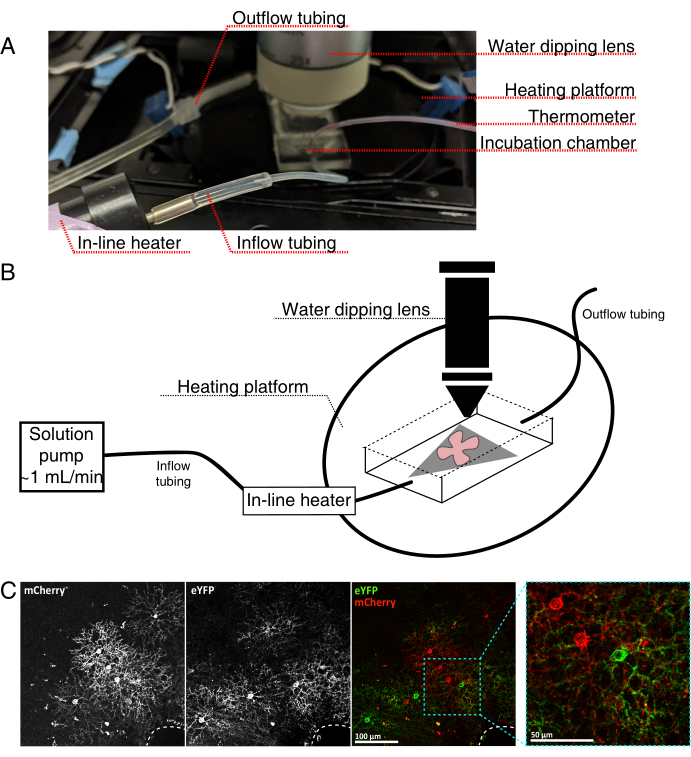
איור 4: הגדרת תאי הדגירה של הדמיה של תאים חיים. (A) מנגנון דגירה בהדמיה חיה המציג רכיבי חימום, פתרון והדמיה. תנור חימום כפול כולל פלטפורמת תא דגירה מחוממת (עיגול אחורי עם אלקטרודות מחבר כחולות) ותנור פתרון בשורה. (ב) דיאגרמה סכמטית של 4A. רשתית שטוחה הרכבה (אדום) על קרום MCE (אפור) ממוקם בתא הדגירה. מחמם התמיסה בשורה מחובר למשאבת פתרון (לא בתמונה ב- 4A). מידות תא ההדמיה מאפשרות אזור עבודה טוב לאף המטרה של הטבילה. (C) 25x להציג explant רשתית מוזרק עם 0.23-0.45 μL של 4 × 1012 GC / mL של דילול AAV; סרגל קנה מידה = 100 מיקרומטר. תיוג צפוף של תאים מקיף לעתים קרובות את ראש עצב הראייה (קו מקווקו, מימין למטה); סרגל קנה מידה = 50 מיקרומטר. קיצורים: MCE = אסתר תאית מעורבת; GC = עותקי גנום; mCherry = דובדבן מונומרי; eYFP = חלבון פלואורסצנטי צהוב משופר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
6. פירוק התמונה ופוסט-עיבוד ב- ImageJ
- יבא את סידרת התמונה, פצל את הסידרה לפי שעה וצבע אם מדובר בתמונה מרובת צבעים. ודא שכל נקודות הזמן עבור צבע אחד כלולות באותה תיקיה.
הערה: יבא תבניות ביו אם אתה משתמש ב- ImageJ (תבניות ביולוגיות כלולות באופן אוטומטי ב- FIJI). - צרו פונקציית פיזור נקודות תיאורטית (PSF) באמצעות התוסף ImageJ, Dspraction PSF 3D.
הערה: כל ערוץ הדמיה דורש PSF משלו, שכן אורך הגל של פליטת חלבונים פלואורסצנטיים משפיע על ה-PSF. - שימוש בתוספים | פקודות מאקרו | הפעל כדי לבצע פירוק איטרטיבי מקבילי של אצווה עבור כל נקודות הזמן באמצעות המאקרו שסופק (קובץ משלים 1).
הערה: מאקרו זה מפעיל 25 איטראציות של אלגוריתם האיטרטיבי Landweber (WPL) של מסנן הווינר. יש לנתק כל ערוץ צבע בנפרד. - מזג את ערוצי הצבע והידור כל נקודות הזמן לערימת יתר (תמונה | ערימות יתר | ערימות לערימת יתר). תיקון הסחף התלת-ממדי באמצעות תוספים | | רישום תקן 3D דריפט.
- החזרת התמונה לערימה רגילה (תמונה | ערימות יתר | הסטת יתר לערימה) ופיצול נקודות הזמן (תמונה | ערימות | כלים | מפצל מחסנית). השתמש בעיבוד אצווה כדי ליצור הקרנה מרבית עבור כל נקודות הזמן (תהליך | | אצווה | מאקרו run("Z Project...", "הקרנה=[עוצמה מרבית]"); ).
- יבא את רצף התמונה לשגות זמן (קובץ | | ייבוא רצף תמונות). השתמש בכלים קונבנציונליים של ImageJ לניתוח הרצוי של וידאו דו-ממדי (דו-ממדי) מנותק ופוסט-מעובד.
הערה: ניתן להציג סרטונים ארבעה-ממדיים (תלת-ממדיים + זמן) מפורקים ומתוקנים על-ידי הסחף כערימת-על. השמט את השלב הקודם כדי לשמור על נקודות זמן תלת-ממדיות.
תוצאות
באמצעות הפרוטוקול לעיל, וידאו 3D ברזולוציה גבוהה של דנדריטים תאים starburst פיתוח נרכש, פירוק, ותיקן עבור סחיפה 3D. הקרנות מקסימליות של מטוס Z הופקו כדי ליצור סרטוני דו-ממד לניתוח (סרטון משלים 1, איור 5A). פירוק תלת-ממדי של כל נקודת זמן הגביר את הרזולוציה של תחזיות פילופודיה ...
Discussion
וידאו זה מדגים צינור ניסיוני המשתמש בכלים גנטיים קיימים כדי לדמיין דינמיקה של דנדריט של פיתוח נוירונים ברשתית עם הדמיה חיה קונפוקלית. כמו כן הוכחו זריקות תוך עיניות של AAVs תלויי Cre קידוד חלבונים פלואורסצנטיים ממוקדי ממברנה לעכברים יילודים. תאים בודדים של אוכלוסיות ממוקדות גנטית מסומנים ב?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים למדיסון גריי על שעזרה לי כשלא היה לי. מחקר זה נתמך על ידי מענק גילוי NSERC (RGPIN-2016-06128), מלגת סלואן במדעי המוח ויו"ר מחקר קנדה רובד 2 (ל- J.L.L. ). ס. אינג-אסטבס נתמך על ידי תוכנית המחקר למדעי הראייה ומלגות לתואר שני של NSERC- דוקטורט.
Materials
| Name | Company | Catalog Number | Comments |
| Addgene viral prep #45185-AAV9 | |||
| Addgene viral prep #45186-AAV9 | |||
| Dissection tools | |||
| Cellulose filter paper | Whatman | 1001-070 | |
| Dumont #5 fine forceps | FST | 11252-20 | Two Dumont #5 forceps are required for retinal micro-dissection |
| Dumont forceps | VWR | 82027-426 | |
| Fine Scissors | FST | 14058-09 | |
| Mixed cellulose ester membrane (MCE) filter papers, hydrophilic, 0.45 µm pore size | Millipore | HABG01 300 | |
| Petri Dish, 50 × 15 mm | VWR | 470313-352 | |
| Polyethylene disposable transfer pipette | VWR | 470225-034 | |
| Round tip paint brush, size 3/0 | Conventional art supply store | Two size 3/0 paint brushes (or smaller) are required for retinal flat-mounting | |
| Surgical Scissors | FST | 14007-14 | |
| Vannas Spring Scissors - 2.5 mm Cutting Edge | FST | 15000-08 | |
| Live-imaging incubation system | |||
| Chamber polyethylene tubing, PE-160 10' | Warner Instruments | 64-0755 | |
| Dual channel heater controller, Model TC-344C | Warner Instruments | 64-2401 | |
| HC FLUOTAR L 25x/0.95 W VISIR dipping objective | Leica | 15506374 | |
| Heater controller cable | Warner Instruments | CC-28 | |
| Large bath incubation chamber with slice support | Warner Instruments | RC-27L | |
| MPII Mini-Peristaltic Pump | Harvard Apparatus | 70-2027 | |
| PM-6D Magnetic Heated Platform (incubation chamber heater) | Warner Instruments | PM-6D | |
| Pump Head Tubing Pieces For MPII Mini-Peristaltic Pump | Harvard Apparatus | 55-4148 | |
| Sample anchor (Harps) | Warner Instruments | 64-0260 | Sample anchor must be compatible with incubation chamber |
| Sloflo In-line Solution Heater | Warner Instruments | SF-28 | |
| Neonatal Injections | |||
| 10 µL Microliter Syringe Series 700, Removable Needle | Hamilton Company | 80314 | |
| 30 G Hypodermic Needles (0.5 inch) | BD PrecisionGlide | 305106 | |
| 4 inch thinwall glass capillary, no filament (1.0 mm outer diameter/0.75 mm) | WPI World Precision Instruments | TW100-4 | |
| Ethanol 99.8% (to dilute to 70% with double-distilled water [ddH2O]) | Sigma-Aldrich | V001229 | |
| AAV9.hEF1a.lox.TagBFP. lox.eYFP.lox.WPRE.hGH-InvBYF | Penn Vector Core | AV-9-PV2453 | Addgene Plasmid #45185 |
| AAV9.hEF1a.lox.mCherry.lox.mTFP 1.lox.WPRE.hGH-InvCheTF | Penn Vector Core | AV-9-PV2454 | Addgene Plasmid #45186 |
| ChAT-IRES-Cre knock-in transgenic mouse line | The Jackson Laboratory | 6410 | |
| Fast Green FCF Dye content ≥85 % | Sigma-Aldrich | F7252-25G | |
| Flaming/Brown Micropipette Puller, model P-97 | Sutter Instrument Co. | P-97 | |
| Green tattoo paste | Ketchum MFG Co | 329A | |
| Phosphate-Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | 806552 | |
| Pneumatic PicoPump | WPI World Precision Instruments | PV-820 | |
| Oxygenated artifiial cerebrospinal fluid (aCSF) Reagents | |||
| Calcium chloride dihydrate (CaCl2·2H2O) | Sigma-Aldrich | C7902 | |
| Carbogen (5% CO2, 95% O2) | AirGas | X02OX95C2003102 | Supplier may vary depending on region |
| D-(+)-Glucose | Sigma-Aldrich | G7021 | |
| HEPES, Free Acid | Bio Basic | HB0264 | |
| Hydrochloric acid solution, 1 N | Sigma-Aldrich | H9892 | |
| Magnesium chloride hexahydrate (MgCl2·6H2O) | Sigma-Aldrich | M2670 | |
| pH-Test strips (6.0-7.7) | VWR | BDH35317.604 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| Sodium chloride (NaCl) | Bio Basic | DB0483 | |
| Sodium phosphate monobasic (NaH2PO4) | Sigma-Aldrich | RDD007 | |
| Software | |||
| ImageJ | National Institutes of Health (NIH) | Open source |
References
- Lefebvre, J. L., Sanes, J. R., Kay, J. N. Development of dendritic form and function. Annual Review of Cell and Developmental Biology. 31, 741-777 (2015).
- Graham, H. K., Duan, X. Molecular mechanisms regulating synaptic specificity and retinal circuit formation. Wiley Interdisciplinary Reviews Developmental biology. 10 (1), 379 (2021).
- Godinho, L., et al. Targeting of amacrine cell neurites to appropriate synaptic laminae in the developing zebrafish retina. Development. 132 (22), 5069-5079 (2005).
- Mumm, J. S., et al. In vivo imaging reveals dendritic targeting of laminated afferents by zebrafish retinal ganglion cells. Neuron. 52 (4), 609-621 (2006).
- Wong, W. T., Faulkner-Jones, B. E., Sanes, J. R., Wong, R. O. Rapid dendritic remodeling in the developing retina: dependence on neurotransmission and reciprocal regulation by Rac and Rho. The Journal of Neuroscience. 20 (13), 5024-5036 (2000).
- Wei, W., Elstrott, J., Feller, M. B. Two-photon targeted recording of GFP-expressing neurons for light responses and live-cell imaging in the mouse retina. Nature Protocols. 5 (7), 1347-1352 (2010).
- Morgan, J. L., Wong, R. O. L. Ballistic labeling with fluorescent dyes and indicators. Current Protocols in Neuroscience. 43 (1), 1-10 (2008).
- Nickerson, P. E. B., et al. Live imaging and analysis of postnatal mouse retinal development. BMC Developmental Biology. 13, 24 (2013).
- Morgan, J. L., Dhingra, A., Vardi, N., Wong, R. O. L. Axons and dendrites originate from neuroepithelial-like processes of retinal bipolar cells. Nature Neuroscience. 9 (1), 85-92 (2006).
- Coombs, J. L., Van Der List, D., Chalupa, L. M. Morphological properties of mouse retinal ganglion cells during postnatal development. The Journal of Comparative Neurology. 503 (6), 803-814 (2007).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nature Methods. 13 (7), 557-562 (2016).
- Stacy, R. C., Wong, R. O. L. Developmental relationship between cholinergic amacrine cell processes and ganglion cell dendrites of the mouse retina. The Journal of Comparative Neurology. 456 (2), 154-166 (2003).
- Kay, J. N., et al. Retinal ganglion cells with distinct directional preferences differ in molecular identity, structure, and central projections. The Journal of Neuroscience. 31 (21), 7753-7762 (2011).
- Liu, J., Sanes, J. R. Cellular and molecular analysis of dendritic morphogenesis in a retinal cell type that senses color contrast and ventral motion. The Journal of Neuroscience. 37 (50), 12247-12262 (2017).
- Diao, L., Sun, W., Deng, Q., He, S. Development of the mouse retina: emerging morphological diversity of the ganglion cells. Journal of Neurobiology. 61 (2), 236-249 (2004).
- Coombs, J., vander List, D., Wang, G. Y., Chalupa, L. M. Morphological properties of mouse retinal ganglion cells. Neuroscience. 140 (1), 123-136 (2006).
- Sanes, J. R., Masland, R. H. The types of retinal ganglion cells: current status and implications for neuronal classification. Annual Review of Neuroscience. 38, 221-246 (2015).
- Sümbül, U., et al. A genetic and computational approach to structurally classify neuronal types. Nature Communications. 5, 3512 (2014).
- Lin, B., Masland, R. H. Populations of wide-field amacrine cells in the mouse retina. The Journal of Comparative Neurology. 499 (5), 797-809 (2006).
- Macneil, M. A., Heussy, J. K., Dacheux, R. F., Raviola, E., Masland, R. H. The shapes and numbers of amacrine cells: Matching of photofilled with Golgi-stained cells in the rabbit retina and comparison with other mammalian species. Journal of Comparative Neurology. 413 (2), 305-326 (1999).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Jo, A., Xu, J., Deniz, S., Cherian, S., DeVries, S. H., Zhu, Y. Intersectional strategies for targeting amacrine and ganglion cell types in the mouse retina. Frontiers in Neural Circuits. 12, 66 (2018).
- Siegert, S., et al. Genetic address book for retinal cell types. Nature Neuroscience. 12 (9), 1197-1204 (2009).
- Kim, I. -. J., Zhang, Y., Meister, M., Sanes, J. R. Laminar restriction of retinal ganglion cell dendrites and axons: subtype-specific developmental patterns revealed with transgenic markers. The Journal of Neuroscience. 30 (4), 1452-1462 (2010).
- Peng, Y. -. R., Tran, N. M., Krishnaswamy, A., Kostadinov, D., Martersteck, E. M., Sanes, J. R. Satb1 regulates contactin 5 to pattern dendrites of a mammalian retinal ganglion cell. Neuron. 95 (4), 869-883 (2017).
- Duan, X., Krishnaswamy, A., Dela Huerta, I., Sanes, J. R. Type II cadherins guide assembly of a direction-selective retinal circuit. Cell. 158 (4), 793-807 (2014).
- Ray, T. A., et al. Formation of retinal direction-selective circuitry initiated by starburst amacrine cell homotypic contact. eLife. 7, 34241 (2018).
- Krishnaswamy, A., Yamagata, M., Duan, X., Hong, Y. K., Sanes, J. R. Sidekick 2 directs formation of a retinal circuit that detects differential motion. Nature. 524 (7566), 466-470 (2015).
- Caval-Holme, F., Zhang, Y., Feller, M. B. Gap junction coupling shapes the encoding of light in the developing retina. Current Biology. 29 (23), 4024-4035 (2019).
- Lucas, J. A., Schmidt, T. M. Cellular properties of intrinsically photosensitive retinal ganglion cells during postnatal development. Neural Development. 14 (1), 8 (2019).
- Cai, D., Cohen, K. B., Luo, T., Lichtman, J. W., Sanes, J. R. Improved tools for the Brainbow toolbox. Nature Methods. 10 (6), 540-547 (2013).
- Rossi, J., et al. Melanocortin-4 receptors expressed by cholinergic neurons regulate energy balance and glucose homeostasis. Cell Metabolism. 13 (2), 195-204 (2011).
- Lefebvre, J. L., Kostadinov, D., Chen, W. V., Maniatis, T., Sanes, J. R. Protocadherins mediate dendritic self-avoidance in the mammalian nervous system. Nature. 488 (7412), 517-521 (2012).
- Ing-Esteves, S., et al. Combinatorial effects of alpha- and gamma-protocadherins on neuronal survival and dendritic self-avoidance. The Journal of Neuroscience. 38 (11), 2713-2729 (2018).
- Williams, P. R., Morgan, J. L., Kerschensteiner, D., Wong, R. O. L. In vitro imaging of retinal whole mounts. Cold Spring Harbor Protocols. 2013 (1), (2013).
- Ramoa, A. S., Campbell, G., Shatz, C. J. Transient morphological features of identified ganglion cells in living fetal and neonatal retina. Science. 237 (4814), 522-525 (1987).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nature Biotechnology. 28 (4), 348-353 (2010).
- Cuntz, H., Forstner, F., Borst, A., Häusser, M. One rule to grow them all: a general theory of neuronal branching and its practical application. PLoS Computational Biology. 6 (8), 1000877 (2010).
- Xiao, H., Peng, H. APP2: automatic tracing of 3D neuron morphology based on hierarchical pruning of a gray-weighted image distance-tree. Bioinformatics. 29 (11), 1448-1454 (2013).
- Nanda, S., et al. Design and implementation of multi-signal and time-varying neural reconstructions. Scientific data. 5, 170207 (2018).
- Sherry, D. M., Wang, M. M., Bates, J., Frishman, L. J. Expression of vesicular glutamate transporter 1 in the mouse retina reveals temporal ordering in development of rod vs. cone and ON vs. OFF circuits. The Journal of Comparative Neurology. 465 (4), 480-498 (2003).
- Johnson, J., et al. Vesicular neurotransmitter transporter expression in developing postnatal rodent retina: GABA and glycine precede glutamate. The Journal of Neuroscience. 23 (2), 518-529 (2003).
- Jüttner, J., et al. Targeting neuronal and glial cell types with synthetic promoter AAVs in mice, non-human primates and humans. Nature Neuroscience. 22 (8), 1345-1356 (2019).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. Journal of Visualized Experiments: JoVE. (31), e1333 (2009).
- Lye, M. H., Jakobs, T. C., Masland, R. H., Koizumi, A. Organotypic culture of adult rabbit retina. Journal of Visualized Experiments: JoVE. (3), e190 (2007).
- Pignatelli, V., Strettoi, E. Bipolar cells of the mouse retina: a gene gun, morphological study. The Journal of Comparative Neurology. 476 (3), 254-266 (2004).
- Huckfeldt, R. M., et al. Transient neurites of retinal horizontal cells exhibit columnar tiling via homotypic interactions. Nature Neuroscience. 12 (1), 35-43 (2009).
- Prahst, C., et al. Mouse retinal cell behaviour in space and time using light sheet fluorescence microscopy. eLife. 9, 49779 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved