Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Imagerie en accéléré de l’arborisation neuronale à l’aide du marquage clairsemé du virus adéno-associé à des populations de cellules rétiniennes génétiquement ciblées
Dans cet article
Résumé
Nous présentons ici une méthode pour étudier la morphogenèse des neurites dans les explants rétiniens postnatals de souris par microscopie confocale time-lapse. Nous décrivons une approche pour le marquage clairsemé et l’acquisition de types de cellules rétiniennes et de leurs processus fins en utilisant des vecteurs de virus adéno-associés recombinants qui expriment des protéines fluorescentes ciblées sur la membrane d’une manière dépendante de Cre.
Résumé
La découverte des mécanismes qui forment les tonnelles dendritiques nécessite des méthodes pour visualiser, imager et analyser les dendrites pendant le développement. La rétine de souris est un puissant système modèle pour l’étude des mécanismes spécifiques au type cellulaire de morphogenèse neuronale et de connectivité. L’organisation et la composition des sous-types rétiniens sont bien définies, et des outils génétiques sont disponibles pour accéder à des types spécifiques au cours du développement. De nombreux types de cellules rétiniennes contraignent également leurs dendrites et / ou axones à des couches étroites, ce qui facilite l’imagerie time-lapse. Les cultures d’explants de rétine de souris sont bien adaptées à l’imagerie de cellules vivantes à l’aide de la microscopie confocale ou multiphotonique, mais les méthodes optimisées pour l’imagerie de la dynamique des dendrites avec une résolution temporelle et structurelle font défaut. Présenté ici est une méthode pour étiqueter et imager de manière éparse le développement de populations rétiniennes spécifiques marquées par le système Cre-Lox. Les virus adéno-associés (AAV) disponibles dans le commerce utilisés ici ont exprimé des protéines fluorescentes ciblées sur la membrane d’une manière dépendante de Cre. L’administration intraoculaire d’AAV chez les souris néonatales produit un marquage fluorescent des types de cellules ciblées 4 à 5 jours après l’injection (dpi). Les signaux fluorescents membranaires sont détectables par imagerie confocale et résolvent les structures et la dynamique fines des branches. Des vidéos de haute qualité couvrant 2 à 4 h sont acquises à partir de supports plats rétiniens d’imagerie perfusés de liquide céphalo-rachidien artificiel oxygéné (CSPa). Un pipeline de post-traitement d’image pour la déconvolution et la correction de dérive tridimensionnelle (3D) est également fourni. Ce protocole peut être utilisé pour capturer plusieurs comportements cellulaires dans la rétine intacte et pour identifier de nouveaux facteurs contrôlant la morphogenèse des neurites. De nombreuses stratégies de développement apprises dans la rétine seront pertinentes pour comprendre la formation de circuits neuronaux ailleurs dans le système nerveux central.
Introduction
Les dendrites des neurones rétiniens forment des modèles complexes, mais spécifiques, qui influencent leur fonction dans les circuits neuronaux. Dans la rétine des vertébrés, divers types de cellules ganglionnaires rétiniennes (RGC) et d’interneurones de cellules amacrines présentent des morphologies dendritiques uniques qui diffèrent par la taille, l’emplacement, la longueur des branches et la densité1. Au cours du développement postnatal, les RGC et les cellules amacrines étendent les processus dendritiques exubérants dans un neuropil appelé couche plexiforme interne (IPL), où ils reçoivent des entrées de cellules bipolaires transmettant des signaux photorécepteurs2. Comme l’a montré l’imagerie en accéléré des populations rétiniennes marquées par fluorescence chez les larves de poussins ou de poissons-zèbres, la morphogenèse dendrite est très dynamique3,4,5. En quelques jours, les tonnelles dendritiques se dilatent, se remodèlent et se ramifient en sous-couches étroites de l’IPL, où elles synapsent avec des partenaires sélectionnés. Les tonnelles présentent une dynamique structurelle différente au cours du développement, avec des changements dans les taux relatifs d’ajout, de rétraction et de stabilisation des branches. Les dendrites d’amacrine et de RGC présentent également des comportements de croissance et de remodelage différents qui pourraient refléter une arborisation spécifique au type. Cependant, ces études ont suivi de larges populations d’amacrine ou de RGC et se sont concentrées sur le ciblage laminaire, qui n’est qu’un aspect de la morphologie.
Les mécanismes qui produisent la grande diversité morphologique observée entre les sous-types rétiniens sont mal compris. L’objectif de ce groupe était de développer une méthode pour capturer la dynamique des dendrites et le remodelage arboricole de sous-types rétiniens définis chez la souris. L’identification des mécanismes spécifiques au type de cellule de la modélisation des dendrites nécessite des méthodes pour visualiser et mesurer les comportements de dendrite des cellules d’intérêt. Les cultures organotypiques de rétines de souris sont bien adaptées aux études d’imagerie de cellules vivantes utilisant la microscopie confocale ou multiphotonique. Les rétines en développement sont disséquées et montées dans une explante plate qui peut être imagée pendant plusieurs heures dans une chambre d’enregistrement ou cultivée sur quelques jours avec des effets limités sur le circuit6,7. Les neurones rétiniens vivants peuvent être marqués par une variété de techniques, y compris le remplissage de colorants par électrodes, l’électroporation, l’administration biolistique de particules recouvertes de colorants lipophiles ou de plasmides codant pour des protéines fluorescentes (par exemple, Gene Gun), ainsi que des étiquettes cellulaires génétiquement codées7,8,9,10 . Cependant, ces approches sont inefficaces pour l’imagerie de la dynamique des dendrites de sous-types rétiniens spécifiques. Par exemple, les méthodes de remplissage de colorant sont à faible débit et nécessitent un appareil d’électrophysiologie et des étiquettes génétiques supplémentaires pour cibler de manière fiable les cellules d’intérêt. De plus, les forts signaux de fluorescence dans le soma peuvent obscurcir les dendrites voisines.
Les méthodes d’administration de gènes biolistiques peuvent marquer simultanément des dizaines de cellules, mais les étapes impliquant l’administration de particules à haute pression et l’incubation nocturne de la rétine isolée peuvent compromettre la physiologie cellulaire et l’excroissance dendritique. Cet article propose que des outils génétiques récents puissent être utilisés pour capturer la dynamique précoce des dendrites avec le type cellulaire et la résolution structurelle, compte tenu des critères expérimentaux suivants. Tout d’abord, pour résoudre les fines branches et les filopodes qui dominent les tonnelles en développement, la méthode devrait marquer les neurones avec des protéines fluorescentes brillantes qui remplissent les processus dans toute la tonnelle. Le marquage par fluorescence ne doit pas s’estomper en raison du photoblanchiment pendant la période d’imagerie. Diverses variantes de protéines fluorescentes ont été générées et comparées pour déterminer si elles conviennent à l’imagerie in vivo/ex vivo11 en fonction de la luminosité et de la photostabilité. Deuxièmement, les protéines fluorescentes (XFP) doivent être exprimées à des niveaux suffisamment élevés au stade le plus précoce de la morphogenèse de la dendrite, de sorte que la fenêtre de développement étroite ne soit pas manquée. Dans les analyses des points temporels statiques dans la rétine de la souris, le développement de la dendrite se produit au cours de la première semaine postnatale et comprend des phases d’excroissance, de remodelage et de stabilisation10,12,13,14,15. Troisièmement, la méthode devrait conduire à un étiquetage sélectif ou à une probabilité accrue de marquage de la sous-population neuronale d’intérêt. Quatrièmement, l’étiquetage de la sous-population cible doit être suffisamment clairsemé pour que l’ensemble de la tonnelle neuronale puisse être identifié et tracé. Bien que les sous-types de RGC et d’amacrine puissent être distingués par leurs caractéristiques morphologiques matures et leurs profils de stratification IPL16,17,18,19,20, le défi consiste à identifier des sous-types au cours du développement basés sur des structures immatures. Cette tâche est facilitée par l’expansion d’outils transgéniques pour marquer des types de cellules rétiniennes spécifiques au cours du développement.
Les lignées de souris transgéniques et knock-in dans lesquelles l’expression cellulaire et temporelle des protéines fluorescentes ou Cre est déterminée par des éléments régulateurs géniques sont largement utilisées pour étudier les types de cellules rétiniennes13,21,22,23. Des observations clés sur les modèles spécifiques de sous-type du développement de la dendrite proviennent d’études sur des rétines de souris transgéniques à des points temporels statiques10,14,24,25. Le système Cre-Lox, en particulier, permet une manipulation génique et une surveillance exquises des sous-types à l’aide d’une variété de rapporteurs, de capteurs et d’activateurs optogénétiques dépendants de la recombinase. Ces outils ont conduit à la découverte de programmes moléculaires spécifiques à un sous-type et de propriétés fonctionnelles qui sous-tendent l’assemblage de circuits rétiniens26,27,28,29,30. Cependant, ils n’ont pas encore été exploités pour étudier la dynamique des dendrites spécifiques au sous-type dans la rétine de la souris. Le marquage à faible densité peut être obtenu en combinant des lignées de souris Cre avec des transgènes introduits par électroporation ou par des AAV recombinants. Si elles sont disponibles, des lignées de Cre inductibles au tamoxifène ou des stratégies génétiques intersectionnelles peuvent également être utilisées. Enfin, la cellule doit être marquée de manière peu invasive et imagée à l’aide de paramètres d’acquisition afin de ne pas compromettre le tissu ou interférer avec la fonction cellulaire requise pour la morphogenèse dendrite.
Présenté ici est une méthode pour appliquer des outils transgéniques et la microscopie confocale pour étudier la dynamique de la dendrite dans les explants rétiniens de souris vivantes. Les lignées de souris transgéniques Cre ont été combinées avec des vecteurs AAV qui expriment des protéines fluorescentes lors de la recombinaison Cre, ce qui permet un marquage clairsemé des cellules rétiniennes d’intérêt. Les AAV disponibles dans le commerce sont administrés à la rétine néonatale par injections intravitréennes. Cet article démontre que les AAV produisent une expression fluorescente significativement élevée et spécifique au type de cellule de 4 dpi, permettant l’accès aux points de temps postnatals. Pour illustrer cette approche, l’interneuron amacrine cholinergique « starburst » a été marqué en délivrant Brainbow AAV chez des souris néonatales exprimant le transgène de la choline acétyltransférase (ChAT)-site interne du ribosome (IRES)-Cre, qui est actif dans la rétine postnatale précoce31,32. Les cellules amacrines Starburst développent une morphologie de tonnelle stéréotypée et radiale qui est façonnée par l’auto-évitement de la dendrite médiée par les protocadhérines groupées33,34. Cet article montre que la résolution des dendrites et des filopodestes d’étoiles est considérablement améliorée par les XFP à la membrane plasmique avec l’ajout du motif CAAX qui subit une farnésylation, tel qu’utilisé pour les AAV Brainbow31. Enfin, des protocoles d’imagerie en accéléré et de post-traitement ont été déterminés pour produire des images de haute qualité susceptibles d’être reconstruites dendrites et quantifiées morphométriques. Ce protocole peut être utilisé pour identifier les facteurs contrôlant la morphogenèse dendrite et pour capturer plusieurs comportements cellulaires dans la rétine intacte.
Protocole
REMARQUE: Ce protocole s’étend sur 2 jours avec une période minimale de 4-5 jours pour la transduction virale entre les jours expérimentaux (Figure 1A). Les expériences sur les animaux sont effectuées conformément aux Lignes directrices du Conseil canadien sur les soins aux animaux pour l’utilisation des animaux en recherche et les soins aux animaux de laboratoire en vertu des protocoles approuvés par le Comité d’utilisation et de soins des animaux du Laboratoire des services aux animaux de l’Hôpital pour enfants malades (Toronto, Canada).
1. Préparations pour les injections néonatales d’AAV et les expériences d’imagerie
- Sélectionnez une ligne de souris Cre pour étiqueter les populations de cellules rétiniennes d’intérêt. Confirmer l’expression de la Cre recombinase au moment des injections d’AAV en passant à un rapporteur transgénique Cre ou par immunocoloration avec un anticorps Cre.
- Élever des souris Cre transgéniques (âgées de 8 à 16 semaines) pour générer des animaux néonatals Cre-positifs.
REMARQUE: Pour cette démonstration, des souris Knock-in ChAT-IRES-Cre ont été utilisées pour cibler les cellules amacrines cholinergiques Starburst. - Obtenir le virus AAV dépendant de la recombinase codant pour des protéines fluorescentes. Pour un marquage optimal des processus fins, sélectionnez des vecteurs qui expriment des XFP modifiés ciblant la membrane plasmique.
REMARQUE : Cette étude a utilisé le virus Brainbow (BBV), AAV-EF1a-BbTagBY et AAV9-EF1a-BbChT (voir tableau des matériaux), qui offrent l’option d’étiquetage multicolore (Figure 1B). L’expression de la protéine fluorescente jaune améliorée farnésylée (eYFP) et de la cerise monomère (mCherry) a produit les signaux fluorescents les plus puissants pour l’imagerie en direct. Un seul BBV peut être utilisé pour imager des tonnelles individuelles, tandis que la co-injection de BBV peut être utilisée pour marquer plus de cellules ou de tonnelles voisines avec des fluorophores distincts. Si vous utilisez plusieurs protéines fluorescentes, assurez-vous que le spectre d’émission se chevauche au minimum (figure 1C). Les paramètres d’acquisition du microscope doivent être ajustés pour capturer des signaux XFP distincts. - Préparer des aliquotes ∼de 3 à 5 μL d’AAV dans des tubes individuels à faible liaison pour les stocks à usage unique afin d’éviter les cycles de gel/dégel. Conserver à -80 °C.
- Préparez des micropipettes en verre borosilicate avec des pointes très fines à l’aide d’un extracteur de micropipette.
REMARQUE: Les paramètres du tireur varient en fonction du filament et du tireur utilisés; voir la figure 2A pour connaître la taille et la forme finales de la pointe. Les diamètres typiques des gouttelettes sont de 600 μm. - Obtenir un système de micro-injection et les tubes associés. Connectez le micro-injecteur à un port d’air sous pression.

Figure 1 : Aperçu expérimental. (A) Ce protocole couvre 2 jours d’expériences avec une période d’infection minimale de 4 à 5 jours entre les jours expérimentaux. Les injections intraoculaires sont effectuées sur des souris néonatales pas plus âgées que le jour postnatal 3. Les rétines sont ensuite disséquées, montées à plat et imagées en direct pour capturer la fenêtre de développement souhaitée. Les cellules marquées peuvent être imagées à tout moment après les 4 à 5 jours nécessaires à l’expression virale, car il n’y a pas d’effets apparents de l’expression prolongée de l’AAV sur la morphologie de la dendrite. (B) Les vecteurs AAV Brainbow (BBV) dépendants de la cre sont injectés dans les animaux exprimant Cre31. Dans cette étude, des souris Knock-in ChAT-Cre ont été utilisées pour conduire la recombinaison Cre dans les cellules amacrines starburst. Les deux BBV codent eYFP ou tagBFP modifié, ou mCherry et mTFP, qui se terminent par un motif CAAX qui est périodiquement farnésylé pour la localisation de la membrane. Les sites Lox sont représentés par des triangles. Les vecteurs expriment soit des XFP farnésylés de manière stochastique et combinatoire dépendant de la recombinaison De Cre. Le promoteur EF1α comprend des éléments régulateurs du gène du facteur d’élongation 1α. W représente les éléments de l’élément régulateur posttranscriptionnel du virus de l’hépatite woodchuck, et pA indique la séquence de polyadénylation. (C) Les spectres d’excitation et d’émission de mCherry et eYFP, les fluorophores BBV imagés dans cette étude. Lors de l’imagerie en direct de plusieurs protéines fluorescentes, les paramètres de détection doivent être disposés de manière à séparer adéquatement les spectres d’émission en canaux distincts. Abréviations : AAV = virus adéno-associé; BBV = Brainbow AAV; ChAT = choline acétyltransférase; iRES = site interne d’entrée des ribosomes; eYFP = protéine fluorescente jaune améliorée; iTR = répétition terminale inversée; tagBP = Protéine fluorescente bleu tag; mCherry = cerise monomère; mTFP = protéine fluorescente sarcelle; XFP = toute protéine fluorescente; EF1α= facteur d’allongement 1 alpha. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Injections intravitréennes d’AAV chez des souris néonatales
- Décongeler une aliquote AAV sur la glace. Préparer une dilution AAV ~1:4 en utilisant une solution saline stérile ou une solution saline tamponnée au phosphate. Préparez ~0,5 μL de dilution AAV par animal (~0,25 μL par œil) au cas où la micropipette se brise et qu’une nouvelle pipette doit être remplie. Conservez le reste de l’AAV non dilué à 4 °C et utilisez-le dans les 2 semaines.
REMARQUE: Dans cette expérience, la concentration d’AAV du fournisseur était d’environ 1-2 × 1013 teneur en génome (GC) / mL et diluée à une concentration finale de 4 × 1012 GC / mL. Optimiser la concentration virale pour obtenir la densité de marquage souhaitée. - Pour visualiser les injections, ajoutez environ 1 μL de solution de colorant FCF Fast Green à 0,02 % pour chaque dilution AAV de 15 μL pour colorer la solution en bleu.
- Transférer une cage de souris avec une mère et une litière pour nouveau-nés (jour postnatal (P) 0,5-3) dans une salle d’intervention avec équipement de micro-injection. Gardez les animaux dans la même cage avec des nids et de la litière pour minimiser le stress maternel et le rejet des petits.
- Stérilisez la zone d’injection avec 70% d’éthanol et placez des coussinets de couche stériles sur les surfaces du banc. Préparez une plate-forme chaude (p. ex., un coussin chauffant) pour la récupération de l’anesthésie induite par l’hypothermie.
- Remblayer la micropipette avec la dilution AAV à l’aide d’un microsyringe. Sous un stéréomicroscope, cassez la pointe de la micropipette avec une aiguille de 30 G pour desceller la pointe.
REMARQUE : La figure 2A montre la pointe remblayée, à la fois scellée (en haut) et non scellée (au milieu). - Anesthésier les souris néonatales par hypothermie en plaçant 1-2 animaux sur la glace. Placez les animaux sur un gant en latex pour protéger la peau du contact direct avec la glace. Une fois que l’animal ne bouge plus en réponse au pincement de la patte (~2 min), placez l’animal sous un stéréomicroscope. Si vous le souhaitez, tatouez des coussinets de pattes avec de l’encre de tatouage et une aiguille de 30 G, et collectez des coupures de queue pour isoler l’ADN afin d’identifier les animaux par génotypage.
REMARQUE: Une surveillance appropriée de la profondeur de l’anesthésie doit avoir lieu tout au long de la procédure. - Écouvillonnez la peau recouvrant les yeux avec de l’éthanol à 70%. Utilisez une aiguille de 30 G pour ouvrir la paupière fusionnée (Figure 2B). Appliquez une légère pression avec les doigts pour ouvrir l’œil et percez un petit trou dans la cornée à la jonction cornée-sclérotique (Figure 2C).
- Insérez la micropipette en verre dans le trou et appuyez 2 à 4 fois sur la pédale du micro-injecteur pour injecter l’AAV dans l’espace intravitréen. Retirez lentement la micropipette et confirmez l’injection d’AAV en visualisant le colorant bleu à travers la pupille (Figure 2D).
REMARQUE: Avec une pression d’éjection de 6-8 psi et un temps d’impulsion de 600-800 ms, une gouttelette de 600 μm de diamètre est éjectée (Figure 2A, en bas). Environ 0,23-0,45 μL de solution d’AAV est injecté par œil. La solution bleue à l’extérieur de l’œil indique que l’AAV n’a pas été injecté dans l’œil. La fuite de solution bleue du site d’injection indique que l’AAV peut avoir fui, ce qui réduit l’efficacité de la transfection. - Appuyez doucement sur les paupières ensemble pour refermer le sceau et placez le chiot sur un coussin chauffant. Une fois que les animaux ont retrouvé une couleur rosâtre et sont réactifs, transférez-les doucement dans la cage de logement.
REMARQUE: Assurez-vous que les précautions appropriées sont prises pour éviter un réchauffement trop rapide des chiots. - Répétez la procédure d’injection pour les animaux restants dans la litière. Prévoyez un minimum de 4 à 5 jours pour la transduction virale avant d’imager la rétine.

Figure 2 : Injections intraoculaires néonatales. (A) La micropipette remblayée montre la forme de l’embout de la pipette lorsqu’elle est scellée (en haut) et après que la pointe est descellée (en bas, à gauche). La pression de pico-injection de 6-8 psi et le temps d’impulsion de 600-800 ms produisent une gouttelette de 600 μm de diamètre (en bas, à droite). Barre d’échelle = 1 mm.(B) Chiot P0 anesthésié sous grossissement 16x. La jonction de la paupière fusionnée (blanche) est fendue à l’aide d’une aiguille pointue de 30 G. Barre d’échelle = 2 mm. (C) La légère pression appliquée à l’œil expose la cornée; barre d’échelle = 2 mm. La section zoomée (rouge) montre le petit trou à la jonction cornée-sclérotique (jaune) créé avec une aiguille de 30 G; barre d’échelle = 0,5 mm. (D) Retrait de l’embout de la pipette après injection (à gauche). Le colorant Fast Green dans la solution AAV apparaît en bleu-gris à travers la pupille (milieu), par rapport à la couleur de la pupille claire avant l’injection (à droite). Barre d’échelle = 1 mm. (E) Après 4 jours, la paupière a guéri et fusionné fermée (à gauche); barre d’échelle = 2 mm. Lors de l’énucléation, le site d’injection guéri est visible (jaune); barre d’échelle = 1 mm. Notez l’emplacement du site d’injection à la frontière entre la cornée et la sclérotique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Dissections rétiniennes pour l’expérience d’imagerie
- Préparer l’aCSF rétinien (119 mM NaCl, 2,5 mM KCl, 1,3 mM MgCl2·6H2O, 2,5 mM CaCl2·2H2O, 1 mM NaH2PO4, 11 mM de glucose et 20 mM d’acide 4-(2-hydroxyéthyl)-1-pipérazineéthanesulfonique (acide libre HEPES)35. Si vous le souhaitez, préparez et congelez la solution 10x; décongeler et diluer à 1x au besoin.
- Oxygéner l’aCSF rétinien en bouillonnant avec du carbogène (95% O2, 5% CO2) pendant au moins 15 min. Ajustez le pH à 7,4. Conserver dans un récipient scellé jusqu’à utilisation pour s’assurer que l’aCSF reste oxygéné.
REMARQUE: Les rétines nécessitent une concentration élevée d’O2. Il est important de garder l’aCSF oxygéné tout au long de l’expérience. - Intégrez une boîte de Petri de 60 mm de diamètre dans un bac à glace (façonnez un bac à glace en plastique de laboratoire, par exemple un couvercle de boîte à pipette) et placez-la sous un stéréomicroscope. Remplissez la boîte de Petri avec de l’aCSF rétinien oxygéné.
- Euthanasier les souris P9 et plus jeunes par décapitation. Euthanasier les souris P10 et plus par induction d’isoflurane, ou une autre méthode approuvée en vertu du protocole animal, suivie d’une décapitation.
- Si les paupières sont scellées, coupez le rabat des paupières pour exposer l’œil. Utilisez des pinces pour énucléer les yeux et transférez-les dans le CCSF rétinien froid à partir de l’étape 3.3.
- Pour disséquer la coupe rétinienne, sous un stéréomicroscope (grossissement 25x), stabiliser l’œil en serrant le nerf optique à l’aide d’une pince Dumont #5 (Figure 3A).
- Percez un trou au centre de la cornée avec une aiguille de 30 G, puis insérez une pointe des microcisseurs dans le trou pour faire une incision du trou à l’extrémité de la cornée. Répétez l’opération pour faire 4 tranches dans les directions cardinales, en créant 4 « rabats » (Figure 3A).
- Avec deux pinces Dumont #5, saisissez et écartez les deux volets adjacents, en pelant doucement la sclérotique de la rétine. Répétez l’opération avec les lambeaux de cornée restants et retirez la sclérotique de la rétine (Figure 3B).
- Retirez le cristallin de la coupe rétinienne à l’aide de la pince. Avec des microcisseurs, faites 4 incisions radiales du bord de la rétine vers le nerf optique, créant 4 pétales égaux (Figure 3B). Répétez les étapes 3.4 à 3.7 pour le deuxième œil.
4. Préparation rétinienne à montage plat
- Préparez des disques filtrants à membrane d’ester de cellulose mixte (MCE) gris pour le montage. Si vous utilisez des filtres à membrane MCE de grand diamètre, coupez le disque en quadrants (environ 1 cm de diamètre). Placez le disque MCE au centre d’un papier filtre blanc plus grand (Figure 3D).
REMARQUE: Les filtres MCE sont également disponibles en disques de 1 cm de diamètre. Le disque filtrant MCE doit être assez grand pour accueillir 1 à 2 rétines, mais suffisamment petit pour tenir dans la chambre d’imagerie. Comme les membranes MCE maintiennent une charge statique, minimisez le contact et la manipulation de la membrane MCE. - Manipulation des rétines à l’aide de deux pinceaux de taille 3/0, retournez une tasse rétinienne sur un pinceau avec la cellule ganglionnaire rétinienne vers le bas. Soulevez doucement la rétine hors de l’aCSF, en vous assurant que la tension de l’eau ne déchire pas la rétine (Figure 3C).
- Tout en tenant toujours le pinceau avec la rétine, utilisez une pipette de transfert pour placer une gouttelette d’aCSF au centre du papier filtre MCE (Figure 3C, à droite). Faites flotter la rétine dans la gouttelette d’aCSF créée par la tension superficielle. Utilisez des pinceaux pour positionner le côté RGC de la rétine vers le haut dans la gouttelette et pour déplier les quatre pétales.
- Une fois positionné, créez un pont d’eau entre le pinceau et le papier filtre blanc pour briser la tension superficielle de la gouttelette.
REMARQUE: Lorsque l’aCSF est méchant, la rétine adhère au papier filtre MCE (Figure 3D, E). Les rétines plates peuvent être manipulées en saisissant le disque MCE avec une pince. Si la gouttelette d’aCSF s’évacue rapidement avant de former un pont d’eau, cela peut indiquer que la membrane MCE n’est pas chargée. Utilisez une membrane MCE fraîche et minimisez le temps entre l’énucléation et l’imagerie en disséquant et en installant à plat les rétines immédiatement avant de déplacer les rétines dans la chambre d’imagerie.

Figure 3 : Dissection rétinienne et montage à plat sur des membranes filtrantes d’ester de cellulose mixte. (A) À gauche, un œil énucléé est stabilisé en saisissant le nerf optique avec une pince Dumont #5 (à gauche). Un petit trou est créé au centre de la cornée à l’aide d’une aiguille de 30 G (centre). Les ciseaux à micro-dissection sont utilisés pour couper la cornée en 4 rabats égaux (à droite). Barre d’échelle = 1 mm. (B) Rétine disséquée avec la sclérotique décollée à l’aide de deux pinces Dumont #5 (à gauche) et avec la lentille retirée (au centre). Rétine avec 4 coupures égales à mi-chemin dans la rétine (à droite). Barre d’échelle = 1 mm. (C) Manipulation de la rétine avec deux pinceaux fins (taille 3/0, à gauche). Rétine retournée avec des cellules ganglionnaires rétiniennes latéralement vers le bas sur un pinceau (centre) et soulevée hors de l’aCSF, en s’assurant que la tension de l’eau ne déchire pas la rétine (à droite). Barre d’échelle = 2 mm. (D) Disque à membrane MCE gris placé sur un papier filtre blanc (à gauche). Une gouttelette d’aCSF sur le disque MCE (à droite). Barre d’échelle = 1 cm. (E) Après avoir fait flotter les rétines dans la gouttelette et les avoir positionnées, créez un pont d’eau avec le papier filtre blanc pour évacuer l’aCSF, en tirant la rétine sur le papier MCE chargé (à gauche); barre d’échelle = 1 cm. L’image zoomée de la membrane MCE (rouge) montre 2 rétines montées avec des cellules ganglionnaires rétiniennes côté haut (à droite); barre d’échelle = 2 mm. Une rétine est soulignée en blanc. Abréviations: MCE = ester de cellulose mélangé; aCSF = liquide céphalo-rachidien artificiel. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Imagerie confocale en accéléré de préparations vivantes de la rétine à monture entière
- Assemblez la chambre d’incubation d’imagerie en direct pour un microscope confocal vertical, comme le montre la figure 4.
REMARQUE: Pour les systèmes confocaux inversés, les supports plats sont placés côté RGC directement sur le couvercle inférieur en verre de la chambre d’incubation. Une fois que les rétines entrent en contact avec le couvercle, elles ne peuvent pas être déplacées. - Remplissez la chambre avec de l’aCSF oxygéné et allumez la pompe et le régulateur de température (température 32-34 °C, débit 1 mL/min). Ne laissez pas la température dépasser 34 °C.
- Pour transférer le support plat rétinien dans la chambre de perfusion, arrêtez la pompe et retirez l’aCSF qui se trouve dans la chambre. Placez le disque MCE avec le support plat rétinien dans la chambre d’incubation (vide).
- Placez un poids d’échantillon sur le support plat; pré-mouiller le poids pour briser la tension superficielle. Remplissez la chambre avec l’aCSF réchauffé et faites circuler l’aCSF à ~1 mL/min.
- Positionnez le nez avec l’objectif de trempage d’eau 25x (ouverture numérique 0,95) dans la chambre d’imagerie. Dépister les cellules marquées d’intérêt à l’aide d’une lumière épifluorescente (figure 4C).
- Ajustez le volume d’imagerie pour capturer les caractéristiques dendritiques d’intérêt.
REMARQUE: Cette étude a capturé la tonnelle dendritique complète à 1024 x 1024 pixels par image, z-step 1 μm et une fréquence d’images de 2 min entre chaque pile z. Les tailles d’image finales sont d’environ 100 μm x 100 μm x 20 μm. - Pour ajuster la puissance du laser à un réglage optimal, utilisez une table de recherche qui identifie les pixels sursaturés et sous-saturés. Pendant la numérisation, ajustez la puissance du laser de manière à ce qu’aucun pixel ne soit sursaturé (c.-à-d. à une intensité de 255 ou plus). Continuez l’imagerie aussi longtemps que nécessaire, ou jusqu’à ce qu’il y ait une diminution significative et détectable du signal fluorescent et une augmentation du bruit (généralement 2-4 h).
REMARQUE: Une puissance laser réduite est recommandée car les algorithmes de déconvolution fonctionnent de manière optimale lorsque les pixels sont répartis sur toute la plage dynamique. L’intensité des pixels ne doit pas dépasser 254; des analyses empiriques des neurites ont révélé que les valeurs de pixels inférieures à 170 sont idéales pour la déconvolution. Des vitesses de balayage rapides (400-600 Hz) avec une moyenne de ligne (2-3) sont préférables à des balayages simples et plus lents du même temps total de séjour en pixels. La zone d’imagerie prolongée comporte souvent des photoblanchiments, mais d’autres sections d’explants restent viables. Plusieurs régions d’une monture plate peuvent être imagées, chacune pendant 2 à 4 h, avec un temps d’incubation total de 6 heures. Les séances d’imagerie au-delà de 6 h n’ont pas été systématiquement testées. La dégradation des neurites et le blebbing sont des signes que la viabilité de l’explant est en déclin. - Après l’imagerie, fixez les supports plats rétiniens et le filtre à membrane avec du paraformaldéhyde froid à 4% pendant 1-2 h à 4 °C. Amplifier les étiquettes fluorescentes dans les rétines fixes par immunohistochimie pour d’autres analyses.
REMARQUE: La fixation post-imagerie n’est pas possible lors de l’utilisation d’un confocal inversé; les rétines ne sont pas amovibles sans détruire le tissu.
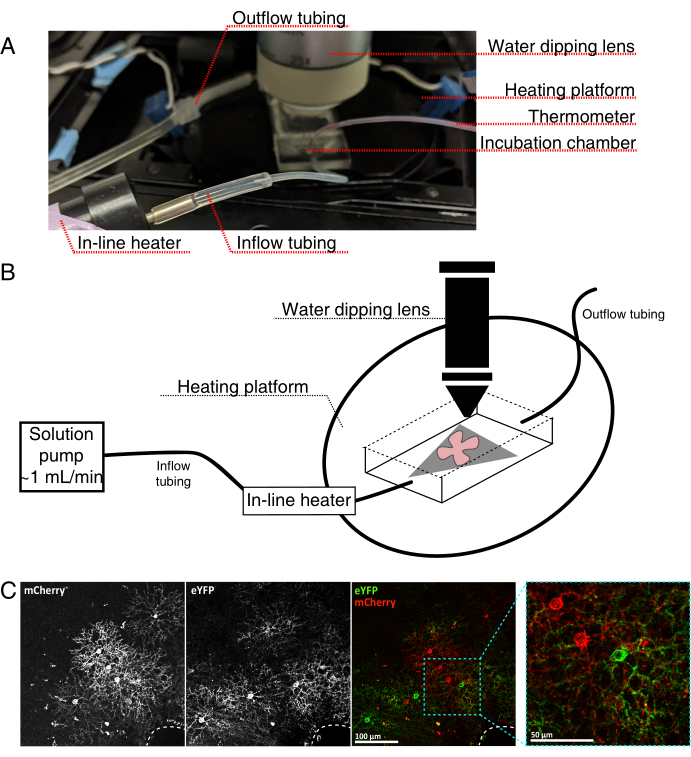
Figure 4 : Configuration de la chambre d’incubation d’imagerie de cellules vivantes. (A) Appareil d’incubation d’imagerie en direct montrant des composants de chauffage, de solution et d’imagerie. Le double chauffage comprend une plate-forme de chambre d’incubation chauffée (cercle arrière avec électrodes de connecteur bleues) et un réchauffeur de solution en ligne. (B) Schéma de 4A. La monture plate rétinienne (rouge) sur la membrane MCE (grise) est placée dans la chambre d’incubation. Le réchauffeur de solution en ligne est connecté à une pompe de solution (non illustrée en 4A). Les dimensions de la chambre d’imagerie permettent une bonne zone de travail pour le nez objectif de trempage. (C) 25x voir une explante rétinienne injectée avec 0,23-0,45 μL de 4 × 1012 GC/mL de dilution AAV; barre d’échelle = 100 μm. L’étiquetage dense des cellules entoure souvent la tête du nerf optique (ligne pointillée, en bas à droite); barre d’échelle = 50 μm. Abréviations: MCE = ester de cellulose mélangé; GC = copies du génome; mCherry = cerise monomère; eYFP = protéine fluorescente jaune améliorée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Déconvolution et post-traitement des images dans ImageJ
- Importez la série d’images, divisez la série en fonction du temps et de la couleur s’il s’agit d’une image multicolore. Assurez-vous que tous les points temporels d’une couleur sont contenus dans le même dossier.
REMARQUE: Importez les bio-formats si vous utilisez ImageJ (les bio-formats sont automatiquement inclus dans FIJI). - Créez une fonction théorique d’étalement de points (PSF) à l’aide du plugin ImageJ, Diffraction PSF 3D.
REMARQUE: Chaque canal d’imagerie nécessite son propre PSF car la longueur d’onde d’émission de protéines fluorescentes a un impact sur le PSF. - Utiliser les plugins | Macros | Exécuter pour effectuer la déconvolution itérative parallèle par lots pour tous les points temporels à l’aide de la macro fournie (fichier supplémentaire 1).
REMARQUE : Cette macro exécute 25 itérations de l’algorithme itératif WPL (Wiener Filter Preconditioned Landweber). Chaque couche de couleur doit être déconvolvée séparément. - Fusionnez les couches de couleur et compilez tous les points temporels dans une Hyperstack (Image | | Hyperstacks Piles vers Hyperstack). Corrigez la dérive 3D à l’aide de Plugins | | d’inscription Dérive 3D correcte.
- Renvoyer l’image à une pile normale (Image | | Hyperstacks Hyperstack to Stack), et fractionner les points de temps (Image | Piles | Outils | Séparateur de pile). Utilisez le traitement par lots pour créer une projection maximale pour tous les points temporels (Process | | par lots Macro | run(« Z Project... », « projection=[Intensité maximale] »); ).
- Importer la séquence d’images time-lapse (File | Importer | Séquence d’images). Utilisez les outils ImageJ conventionnels pour l’analyse souhaitée de la vidéo bidimensionnelle (2D) déconcentrée et post-traitée.
REMARQUE: Les vidéos quadridimensionnelles (3D + temps) déconcentrées et corrigées de la dérive peuvent être visualisées comme une hyperstack. Omettez l’étape précédente pour conserver les points de temps 3D.
Résultats
En utilisant le protocole ci-dessus, une vidéo 3D haute résolution du développement de dendrites de cellules starburst a été acquise, déconcentrée et corrigée pour la dérive 3D. Des projections maximales du plan Z ont été produites pour réaliser des vidéos 2D à des fins d’analyse (vidéo supplémentaire 1, figure 5A). La déconvolution 3D de chaque point temporel a augmenté la résolution des projections de filopodia fines (Figure 5B,C
Discussion
Cette vidéo démontre un pipeline expérimental qui utilise des outils génétiques existants pour imager la dynamique des dendrites des neurones rétiniens en développement avec l’imagerie confocale en direct. Les injections intraoculaires d’AAV créo-dépendants codant pour des protéines fluorescentes ciblant la membrane chez des souris néonatales ont également été démontrées. Les cellules individuelles de populations génétiquement ciblées sont marquées de manière brillante dès 4-5 dpi. Des supports ...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Madison Gray de m’avoir donné un coup de main alors que je n’en avais pas. Cette recherche a été soutenue par une subvention de découverte du CRSNG (RGPIN-2016-06128), une bourse Sloan en neurosciences et une chaire de recherche du Canada de niveau 2 (à J.L.L.). S. Ing-Esteves a été soutenu par le Programme de recherche en sciences de la vision et les bourses d’études supérieures-doctorales du CRSNG.
matériels
| Name | Company | Catalog Number | Comments |
| Addgene viral prep #45185-AAV9 | |||
| Addgene viral prep #45186-AAV9 | |||
| Dissection tools | |||
| Cellulose filter paper | Whatman | 1001-070 | |
| Dumont #5 fine forceps | FST | 11252-20 | Two Dumont #5 forceps are required for retinal micro-dissection |
| Dumont forceps | VWR | 82027-426 | |
| Fine Scissors | FST | 14058-09 | |
| Mixed cellulose ester membrane (MCE) filter papers, hydrophilic, 0.45 µm pore size | Millipore | HABG01 300 | |
| Petri Dish, 50 × 15 mm | VWR | 470313-352 | |
| Polyethylene disposable transfer pipette | VWR | 470225-034 | |
| Round tip paint brush, size 3/0 | Conventional art supply store | Two size 3/0 paint brushes (or smaller) are required for retinal flat-mounting | |
| Surgical Scissors | FST | 14007-14 | |
| Vannas Spring Scissors - 2.5 mm Cutting Edge | FST | 15000-08 | |
| Live-imaging incubation system | |||
| Chamber polyethylene tubing, PE-160 10' | Warner Instruments | 64-0755 | |
| Dual channel heater controller, Model TC-344C | Warner Instruments | 64-2401 | |
| HC FLUOTAR L 25x/0.95 W VISIR dipping objective | Leica | 15506374 | |
| Heater controller cable | Warner Instruments | CC-28 | |
| Large bath incubation chamber with slice support | Warner Instruments | RC-27L | |
| MPII Mini-Peristaltic Pump | Harvard Apparatus | 70-2027 | |
| PM-6D Magnetic Heated Platform (incubation chamber heater) | Warner Instruments | PM-6D | |
| Pump Head Tubing Pieces For MPII Mini-Peristaltic Pump | Harvard Apparatus | 55-4148 | |
| Sample anchor (Harps) | Warner Instruments | 64-0260 | Sample anchor must be compatible with incubation chamber |
| Sloflo In-line Solution Heater | Warner Instruments | SF-28 | |
| Neonatal Injections | |||
| 10 µL Microliter Syringe Series 700, Removable Needle | Hamilton Company | 80314 | |
| 30 G Hypodermic Needles (0.5 inch) | BD PrecisionGlide | 305106 | |
| 4 inch thinwall glass capillary, no filament (1.0 mm outer diameter/0.75 mm) | WPI World Precision Instruments | TW100-4 | |
| Ethanol 99.8% (to dilute to 70% with double-distilled water [ddH2O]) | Sigma-Aldrich | V001229 | |
| AAV9.hEF1a.lox.TagBFP. lox.eYFP.lox.WPRE.hGH-InvBYF | Penn Vector Core | AV-9-PV2453 | Addgene Plasmid #45185 |
| AAV9.hEF1a.lox.mCherry.lox.mTFP 1.lox.WPRE.hGH-InvCheTF | Penn Vector Core | AV-9-PV2454 | Addgene Plasmid #45186 |
| ChAT-IRES-Cre knock-in transgenic mouse line | The Jackson Laboratory | 6410 | |
| Fast Green FCF Dye content ≥85 % | Sigma-Aldrich | F7252-25G | |
| Flaming/Brown Micropipette Puller, model P-97 | Sutter Instrument Co. | P-97 | |
| Green tattoo paste | Ketchum MFG Co | 329A | |
| Phosphate-Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | 806552 | |
| Pneumatic PicoPump | WPI World Precision Instruments | PV-820 | |
| Oxygenated artifiial cerebrospinal fluid (aCSF) Reagents | |||
| Calcium chloride dihydrate (CaCl2·2H2O) | Sigma-Aldrich | C7902 | |
| Carbogen (5% CO2, 95% O2) | AirGas | X02OX95C2003102 | Supplier may vary depending on region |
| D-(+)-Glucose | Sigma-Aldrich | G7021 | |
| HEPES, Free Acid | Bio Basic | HB0264 | |
| Hydrochloric acid solution, 1 N | Sigma-Aldrich | H9892 | |
| Magnesium chloride hexahydrate (MgCl2·6H2O) | Sigma-Aldrich | M2670 | |
| pH-Test strips (6.0-7.7) | VWR | BDH35317.604 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| Sodium chloride (NaCl) | Bio Basic | DB0483 | |
| Sodium phosphate monobasic (NaH2PO4) | Sigma-Aldrich | RDD007 | |
| Software | |||
| ImageJ | National Institutes of Health (NIH) | Open source |
Références
- Lefebvre, J. L., Sanes, J. R., Kay, J. N. Development of dendritic form and function. Annual Review of Cell and Developmental Biology. 31, 741-777 (2015).
- Graham, H. K., Duan, X. Molecular mechanisms regulating synaptic specificity and retinal circuit formation. Wiley Interdisciplinary Reviews Developmental biology. 10 (1), 379 (2021).
- Godinho, L., et al. Targeting of amacrine cell neurites to appropriate synaptic laminae in the developing zebrafish retina. Development. 132 (22), 5069-5079 (2005).
- Mumm, J. S., et al. In vivo imaging reveals dendritic targeting of laminated afferents by zebrafish retinal ganglion cells. Neuron. 52 (4), 609-621 (2006).
- Wong, W. T., Faulkner-Jones, B. E., Sanes, J. R., Wong, R. O. Rapid dendritic remodeling in the developing retina: dependence on neurotransmission and reciprocal regulation by Rac and Rho. The Journal of Neuroscience. 20 (13), 5024-5036 (2000).
- Wei, W., Elstrott, J., Feller, M. B. Two-photon targeted recording of GFP-expressing neurons for light responses and live-cell imaging in the mouse retina. Nature Protocols. 5 (7), 1347-1352 (2010).
- Morgan, J. L., Wong, R. O. L. Ballistic labeling with fluorescent dyes and indicators. Current Protocols in Neuroscience. 43 (1), 1-10 (2008).
- Nickerson, P. E. B., et al. Live imaging and analysis of postnatal mouse retinal development. BMC Developmental Biology. 13, 24 (2013).
- Morgan, J. L., Dhingra, A., Vardi, N., Wong, R. O. L. Axons and dendrites originate from neuroepithelial-like processes of retinal bipolar cells. Nature Neuroscience. 9 (1), 85-92 (2006).
- Coombs, J. L., Van Der List, D., Chalupa, L. M. Morphological properties of mouse retinal ganglion cells during postnatal development. The Journal of Comparative Neurology. 503 (6), 803-814 (2007).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nature Methods. 13 (7), 557-562 (2016).
- Stacy, R. C., Wong, R. O. L. Developmental relationship between cholinergic amacrine cell processes and ganglion cell dendrites of the mouse retina. The Journal of Comparative Neurology. 456 (2), 154-166 (2003).
- Kay, J. N., et al. Retinal ganglion cells with distinct directional preferences differ in molecular identity, structure, and central projections. The Journal of Neuroscience. 31 (21), 7753-7762 (2011).
- Liu, J., Sanes, J. R. Cellular and molecular analysis of dendritic morphogenesis in a retinal cell type that senses color contrast and ventral motion. The Journal of Neuroscience. 37 (50), 12247-12262 (2017).
- Diao, L., Sun, W., Deng, Q., He, S. Development of the mouse retina: emerging morphological diversity of the ganglion cells. Journal of Neurobiology. 61 (2), 236-249 (2004).
- Coombs, J., vander List, D., Wang, G. Y., Chalupa, L. M. Morphological properties of mouse retinal ganglion cells. Neuroscience. 140 (1), 123-136 (2006).
- Sanes, J. R., Masland, R. H. The types of retinal ganglion cells: current status and implications for neuronal classification. Annual Review of Neuroscience. 38, 221-246 (2015).
- Sümbül, U., et al. A genetic and computational approach to structurally classify neuronal types. Nature Communications. 5, 3512 (2014).
- Lin, B., Masland, R. H. Populations of wide-field amacrine cells in the mouse retina. The Journal of Comparative Neurology. 499 (5), 797-809 (2006).
- Macneil, M. A., Heussy, J. K., Dacheux, R. F., Raviola, E., Masland, R. H. The shapes and numbers of amacrine cells: Matching of photofilled with Golgi-stained cells in the rabbit retina and comparison with other mammalian species. Journal of Comparative Neurology. 413 (2), 305-326 (1999).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Jo, A., Xu, J., Deniz, S., Cherian, S., DeVries, S. H., Zhu, Y. Intersectional strategies for targeting amacrine and ganglion cell types in the mouse retina. Frontiers in Neural Circuits. 12, 66 (2018).
- Siegert, S., et al. Genetic address book for retinal cell types. Nature Neuroscience. 12 (9), 1197-1204 (2009).
- Kim, I. -. J., Zhang, Y., Meister, M., Sanes, J. R. Laminar restriction of retinal ganglion cell dendrites and axons: subtype-specific developmental patterns revealed with transgenic markers. The Journal of Neuroscience. 30 (4), 1452-1462 (2010).
- Peng, Y. -. R., Tran, N. M., Krishnaswamy, A., Kostadinov, D., Martersteck, E. M., Sanes, J. R. Satb1 regulates contactin 5 to pattern dendrites of a mammalian retinal ganglion cell. Neuron. 95 (4), 869-883 (2017).
- Duan, X., Krishnaswamy, A., Dela Huerta, I., Sanes, J. R. Type II cadherins guide assembly of a direction-selective retinal circuit. Cell. 158 (4), 793-807 (2014).
- Ray, T. A., et al. Formation of retinal direction-selective circuitry initiated by starburst amacrine cell homotypic contact. eLife. 7, 34241 (2018).
- Krishnaswamy, A., Yamagata, M., Duan, X., Hong, Y. K., Sanes, J. R. Sidekick 2 directs formation of a retinal circuit that detects differential motion. Nature. 524 (7566), 466-470 (2015).
- Caval-Holme, F., Zhang, Y., Feller, M. B. Gap junction coupling shapes the encoding of light in the developing retina. Current Biology. 29 (23), 4024-4035 (2019).
- Lucas, J. A., Schmidt, T. M. Cellular properties of intrinsically photosensitive retinal ganglion cells during postnatal development. Neural Development. 14 (1), 8 (2019).
- Cai, D., Cohen, K. B., Luo, T., Lichtman, J. W., Sanes, J. R. Improved tools for the Brainbow toolbox. Nature Methods. 10 (6), 540-547 (2013).
- Rossi, J., et al. Melanocortin-4 receptors expressed by cholinergic neurons regulate energy balance and glucose homeostasis. Cell Metabolism. 13 (2), 195-204 (2011).
- Lefebvre, J. L., Kostadinov, D., Chen, W. V., Maniatis, T., Sanes, J. R. Protocadherins mediate dendritic self-avoidance in the mammalian nervous system. Nature. 488 (7412), 517-521 (2012).
- Ing-Esteves, S., et al. Combinatorial effects of alpha- and gamma-protocadherins on neuronal survival and dendritic self-avoidance. The Journal of Neuroscience. 38 (11), 2713-2729 (2018).
- Williams, P. R., Morgan, J. L., Kerschensteiner, D., Wong, R. O. L. In vitro imaging of retinal whole mounts. Cold Spring Harbor Protocols. 2013 (1), (2013).
- Ramoa, A. S., Campbell, G., Shatz, C. J. Transient morphological features of identified ganglion cells in living fetal and neonatal retina. Science. 237 (4814), 522-525 (1987).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nature Biotechnology. 28 (4), 348-353 (2010).
- Cuntz, H., Forstner, F., Borst, A., Häusser, M. One rule to grow them all: a general theory of neuronal branching and its practical application. PLoS Computational Biology. 6 (8), 1000877 (2010).
- Xiao, H., Peng, H. APP2: automatic tracing of 3D neuron morphology based on hierarchical pruning of a gray-weighted image distance-tree. Bioinformatics. 29 (11), 1448-1454 (2013).
- Nanda, S., et al. Design and implementation of multi-signal and time-varying neural reconstructions. Scientific data. 5, 170207 (2018).
- Sherry, D. M., Wang, M. M., Bates, J., Frishman, L. J. Expression of vesicular glutamate transporter 1 in the mouse retina reveals temporal ordering in development of rod vs. cone and ON vs. OFF circuits. The Journal of Comparative Neurology. 465 (4), 480-498 (2003).
- Johnson, J., et al. Vesicular neurotransmitter transporter expression in developing postnatal rodent retina: GABA and glycine precede glutamate. The Journal of Neuroscience. 23 (2), 518-529 (2003).
- Jüttner, J., et al. Targeting neuronal and glial cell types with synthetic promoter AAVs in mice, non-human primates and humans. Nature Neuroscience. 22 (8), 1345-1356 (2019).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. Journal of Visualized Experiments: JoVE. (31), e1333 (2009).
- Lye, M. H., Jakobs, T. C., Masland, R. H., Koizumi, A. Organotypic culture of adult rabbit retina. Journal of Visualized Experiments: JoVE. (3), e190 (2007).
- Pignatelli, V., Strettoi, E. Bipolar cells of the mouse retina: a gene gun, morphological study. The Journal of Comparative Neurology. 476 (3), 254-266 (2004).
- Huckfeldt, R. M., et al. Transient neurites of retinal horizontal cells exhibit columnar tiling via homotypic interactions. Nature Neuroscience. 12 (1), 35-43 (2009).
- Prahst, C., et al. Mouse retinal cell behaviour in space and time using light sheet fluorescence microscopy. eLife. 9, 49779 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon