Method Article
使用荧光染料,罗达明B,研究雄性 伊蚊 的交配竞争力
摘要
在这里,我们提出了一个协议,研究雄性 伊蚊 的交配竞争力使用荧光染料作为标记。雌性蚊子接触有标记和无标记的雄性进行交配。交配后,在荧光显微镜下检查他们的精子,以确定他们的交配伙伴。
摘要
无菌或不相容的昆虫技术为基础的种群抑制计划的成功取决于被释放的雄性竞争野生型雌性的能力,并诱发目标种群的不育。因此,实验室评估男配竞争力对于在野外释放前评估释放菌株的体能至关重要。通常,这种检测是通过确定雌性在同时接触两组雄性(野生型和释放菌株)进行交配后产生的活卵的比例来进行的。然而,这个过程是耗时和费力的,因为需要首先血液喂养女性的卵子生产,然后孵化和列举孵化的鸡蛋,以确定鸡蛋的生存能力。
此外,这种方法无法辨别两种无菌或 沃尔巴契亚感染的蚊子线之间的竞争力,因为野生型雌性蚊子只有在与两种蚊子交配后才会产生不可行的卵子。为了规避这些限制,本文描述了一种更直接的方法,利用荧光染料Rhodamine B(RhB)测量雄性蚊子在实验室环境中的交配竞争力,这种染料可用于用含有RhB的蔗糖溶液喂养雄性蚊子来标记雄性蚊子。交配后,女性精子中是否有荧光精子可用于确定其交配伙伴。这种方法具有成本效益,将实验时间缩短了90%,并允许比较两条无菌或 沃尔巴契亚感染线之间的交配体能。
引言
目前,该领域正在评估饲养和释放无菌或不相容的雄性以抑制伊蚊种群,这是预防登革热和其他伊蚊传播疾病爆发的新工具。目前正在实地试验的男性释放抑制策略包括使用遗传方法2,辐照(无菌昆虫技术,SIT)3,内同体菌沃尔巴契亚(昆虫不相容技术,IIT)4,或后两种技术的组合5,6。这些方法的成功在很大程度上取决于被释放的雄性的能力,以超越野生类型的男性,并寻求女性,以确保交配。否则,目标人群不能诱发不育。
例如,在经典的 SIT 计划中,男配体能可能受到辐射剂量7 、 8 、 9 、大规模饲养协议和10 、 11 、 12 、 13 、 14等群体近亲繁殖程度等因素的影响。此外,关于交配竞争力的研究可以提供有关蚊子交配行为的重要知识,可用于为病媒控制策略提供信息。
在SIT和IIT中,雄性蚊子的交配竞争力通常通过允许野生蚊子和释放菌株在8、11、15、16号笼子中争夺野生型雌性蚊子来评估。然后,女性被血液喂养,他们的卵子孵化,以确定生存能力。产下不可行的卵子或孵化率低的卵子的雌性被认为与释放菌株雄配,而产下可行卵子的女性则被认为与野生型雄配。然后用弗里德指数17计算交配竞争力。不幸的是,这种方法是资源密集型和耗时的,整体 Fried 指数可能受到影响鸡蛋生存能力的外部混淆因素的影响,如鸡蛋处理不良和过度干燥可能导致兼容叉的低孵化率,然后可能导致人为地降低油炸指数。
此外,这种方法不允许直接比较感染不同菌株的沃尔巴契亚或暴露于不同剂量辐照的伊蚊之间的交配竞争力。因此,需要一种更直接的方法来应对这些挑战。最近的研究18,19已经证明使用荧光染料RhB,以标记雄性蚊子的开创性液体的有效性。标记的开创性液体在成功交配后被转移到雌性蚊子的精子中,从而能够直接测量雌配与标记的雄配。罗达明B是一种硫醇反应氟染料,常用于昆虫等动物的生态和行为研究的生物标志物。在蚊子研究方面,RhB是通过用含溶解RhB粉18、19、21、22、23、24的糖或蜂蜜水喂养而引入的。吸收后,RhB 染料与蛋白质结合,用发红粉色的污渍染色身体组织,在荧光光源下荧光明亮的橙色。
强烈的荧光信号和稳定的标记,加上它的能力,染色昆虫的开创性液体,允许监测标记的开创性液体从标记的男性转移到精子储存器官的女性昆虫交配研究18,19,21,24。在雄配竞争力测试中使用 RhB 不仅能够直接测量雌性与有标记和无标记的雄配相互作用,而且结果也可以在 24 小时内获得,因为它可以避免确定卵子生存能力的过程,这通常需要大约 10 至 14 天。此外,当雌性蚊子不喂血或在放血前死亡时,这种方法克服了数据的潜在损失。这一点尤其重要,因为在半场试验中,雌性蚊子在交配后使用背包或机械吸气器容易受到损害和死亡。为了解决目前使用女性生育能力的局限性,我们提出了一种替代方法,使用RhB染色直接测量雄性蚊子交配的竞争力。该方法简化了工作流程,将实验时间从大约两周缩短到一天,允许进行更多的实验复制,并允许对两个释放菌株进行比较。该协议将适用于正在开展基于男性释放的蚊子种群抑制计划的实验室,并可用于日常质量控制和菌株评估。
研究方案
1. 饲养蚊子
- 在 27 ± 1 °C和 75 - 80% 相对湿度的标准昆虫条件下进行所有蚊子饲养和雄配竞争力检测,光周期为 12 h : 12 h 光:暗循环。
- 将两组竞争男性指定为A组和B组,以便于本文所述的方法参考。在标准化条件下饲养蚊子,以确保在检测过程中公平比较其体能。以2升水中500只幼虫的幼虫密度饲养蚊子,用地面鱼粉 喂养它们。
注:对于具有代表性的结果,A组和B组是 沃尔巴契亚感染的A的近亲繁殖和交叉的雄性 。艾吉普蒂,分别。 - 性别雄性蚊子和雌性蚊子在幼虫阶段,并分别包含在笼子(见 材料表)的尺寸W 32.5厘米 x D 32.5厘米xH 32.5厘米,网状大小为150×150和160μm光圈。用10%蔗糖溶液保护所有成年蚊子。
2. 准备雄性蚊子和雌性蚊子
- 根据雌性蚊子的大小差异(雄性幼虫比雌性幼虫小)在幼虫阶段进行(图 1 )。
- 每组蚊子(A组或B组),将100只雄性幼虫转移到预先标记的笼子中,用于蔗糖喂养或RhB-蔗糖喂养。
- 将雌性幼崽分小批量放入每笼40-50只。一出现伊玛戈,检查笼子是否有雄性蚊子。
注:成年雄性蚊子比雌性蚊子小,天线更浓密、更毛茸茸(图2)。只使用处女蚊子进行交配竞争力测定。使用预授精的女性将使所有结果的数据无效。因此,在阶段必须格外小心。不要使用被雄性蚊子污染的笼子里的雌性蚊子。应准备额外的女性笼子。
3. 制备 0.2% RhB - 蔗糖溶液
注:RhB 是干形的绿色粉末,溶液中是红粉色粉末。处理这种化学品时,应佩戴标准的个人防护装备(PPE:实验室防护服、亚硝酸盐手套和眼部防护)。为了避免吸入,将 RhB 粉末称重在烟气罩中。
- 要准备 0.2% w/v RhB 蔗糖溶液,每 100 mL 10% w/v/ 蔗糖溶液溶解 200 毫克 RhB 粉末。混合好,以确保所有的粉末溶解。
注:由于 RhB 对光线敏感,请使用琥珀色瓶子,或用铝箔完全包装透明瓶。
4. 喂养雄性蚊子
注:来自RhB蔗糖喂养优化的数据在 补充材料,第1节。
- 准备20个含糖的糖喂食瓶和一个芯子。在 10 个进料瓶中加入 10 mL 的 10% 蔗糖,在其他 10 个进料瓶中加入 10 mL 的 10% 蔗糖和 10 mL 的 0.2% RhB 蔗糖溶液(使用琥珀瓶,或用铝箔包装瓶子)。
- 将喂食瓶放在各自的男性笼子中(每个笼子5瓶),分2.2步和2.3步准备。让雄性蚊子在交配实验前喂食三天。
5. 检查雄性蚊子的RhB荧光
- 吸气RhB-蔗糖喂养的雄性蚊子,并在荧光立体显微镜下观察它们,以确保所有由RhB-蔗糖喂养的雄性蚊子都成功标有RhB。
- 打开汞燃烧器灯和立体显微镜。让汞燃烧灯的光源稳定10分钟。设置红色荧光蛋白1(RFP1)(激发波长540纳米,发射波长625纳米)的荧光过滤器。
- 一次向口腔吸气器的玻璃管中吸气少量蚊子(四或五只)。通过玻璃管,在荧光立体显微镜下观察雄性蚊子的身体。将未标有 RhB 的雄性蚊子排除在实验之外。
注:标有RhB的雄性蚊子腹部在白光下呈粉红色(图3A),荧光灯下呈亮橙色(图3B)。 - 将雄性蚊子转移到12个纸杯中,用网固定(网状尺寸150×150,160μm光圈);6杯,每杯10只蔗糖喂养的雄性蚊子,其他6杯每杯10只RhB蔗糖喂养的雄性蚊子。重复此步骤设置 B 雄性蚊子。
6. 交配竞争力分析
- 设置 12 W 60 厘米 x D 60 厘米 x H 60 厘米笼子,网状尺寸为 44 x 32,650 μm 光圈,用于交配检测。在六个笼子中,每个笼子中都有10组A(RhB标记)雄性蚊子,10组B(无标记)雄性蚊子,以及10只处女野生型雌性蚊子。在其他6个笼子中,包括10组A(无标记)雄性蚊子、10套B(RhB标记)雄性蚊子和10只处女野生型雌性蚊子。标记这些笼子,以清楚地区分两个交配组合。
注:根据经验,一个60厘米×60厘米×60厘米的笼子用于交配检测,因为一个较小的笼子可能鼓励混合交配。 - 根据第 6.1 步的标签,将第 5.4 步准备的雄性杯放入交配笼中。取下网,轻轻敲击杯子,将雄性从杯子中挤出。小心地从笼子里取出纸杯和网,确保没有蚊子从笼子里逃出来。让雄性蚊子在交配笼中适应至少一个小时。
- 使用口服吸气器,将处女野生型雌性蚊子转移到12个纸杯中,每个杯子含有10只蚊子。
- 雄性蚊子的适应期结束后,将一杯雌性蚊子转移到每个交配笼中,并取出网。轻轻地把杯子挤出来,鼓励剩下的雌性蚊子离开杯子。小心地从笼子里取出纸杯和网,确保没有蚊子从笼子里逃出来。
- 允许交配进行3小时。
注:建议的交配时间是通过先前对野生型 伊吉普提的观察确定的。在涉及10名女性和20名男性被关在60厘米×60厘米×60厘米的笼子里的实验中,90%的女性授精是在3小时(补充材料,第2节)中完成的。在此期间,不要打扰笼子,因为搅拌可能导致中断和混合交配。混合交配(其中女性与有标记的和无标记的雄配)导致对 RhB 标记的男性的偏见,因为很难区分无标记的精子和 RhB 标记的精子在荧光显微镜下。 - 要终止交配实验,请使用机械吸气器将每个笼子中的所有蚊子移走。冷麻醉在冰上的蚊子至少5分钟。当蚊子完全麻醉时,轻轻地拿起雌性蚊子,并把它们放在一个单独的纸杯里,用网固定(网状尺寸为150 x 150,160μm光圈)。将相应的标签从交配笼转移到纸杯上,从而标记纸杯。
注意:此时可以暂停实验,用10%蔗糖溶液维持雌性。RhB标记的开创性液体将在女性精子内保持稳定至少一周。最好在解剖前让雌性存活,因为死亡和干燥的标本很难解剖。 - 为了给雌性精子打分,在立体显微镜下解剖之前,在冰上对雌性蚊子进行至少5分钟的冷麻醉(视频1)。在复合光显微镜下检查精子的授精状态(图4)。对于受精个体,通过在装有RFP1滤光片和相机成像系统的荧光立体显微镜下检查精子是否含有RhB标记的开创性液体。
注:使用带附加成像系统的荧光立体显微镜时,建议利用较长的暴露时间(5s)来提高检测灵敏度。如果雌性蚊子与有标记的雄配,她的精子会荧光亮橙色(图 5A )。然而,如果雌性蚊子与一只没有标记的雄性蚊子交配,她的授精精精不会发荧光(图5B)。
7. 处理 RhB 废物
- 用活性炭25 处理水性RhB废物,然后将其作为一般废水排放。将固体 RhB 废物(标有 RhB 的蚊子、纸巾和用 RhB 浸泡的芯子)作为化学废物处理。处理 Rhb 废物时不要标准 Ppe 。
结果
w阿尔布-SG是本地化(新加坡) 的E.aegypti 线稳定感染沃尔巴契亚的wAlbB菌株。利用本文中描述的协议,我们评估了近亲繁殖的雄配竞争力和 一条跨越线的 wAlbB - SG ,以确定近亲繁殖是否会导致男配体能的损失。近亲繁殖线在昆虫中保持了11代,而外向线则通过与野生型雄性Ae背对雌性产生。艾吉普蒂来自近亲繁殖和外向的雄性为了与野生型野生型雌性 雌交配竞争力测定是在三重进行。
结果表明, RhB 并不影响男性的体能,因为女性授精的数据没有偏向或反对与 RhB 蔗糖喂养的雄配(表 1 和 图 6 ),因为 RhB 不影响男性的交配体能,我们继续分析数据的基础上,受精女配的近亲繁殖或越界线的百分比(表 2 和 图 7 )。实验三方的结果是一致的:在所有三个复制品中,与外向雄配的女性比例明显高于近亲繁殖的雄性( P ≤0 . 05 ,曼 - 惠特尼 U -测试)。这些结果表明,在实验室中经过几代近亲繁殖后,男配体能可能下降。

图1:男性(左)和女性(右) 伊蚊 的横向视图。 在相同的饲养条件下 , Ae . aegypti 可以根据大小在幼崽阶段进行:男性明显小于女性。 请单击此处查看此图的较大版本。
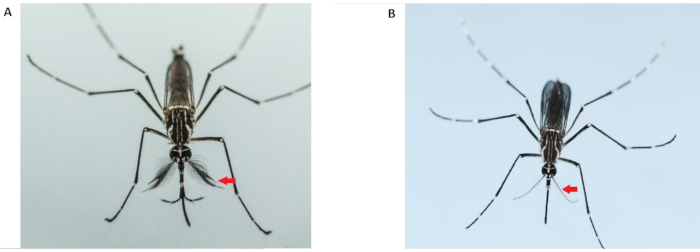
图2:雄性(左)和雌性(右) 伊蚊 成人的差异。 成年雄性蚊子(左)的天线比成年雌性蚊子更浓密、更毛茸茸:红色箭头表示天线。 请单击此处查看此图的较大版本。
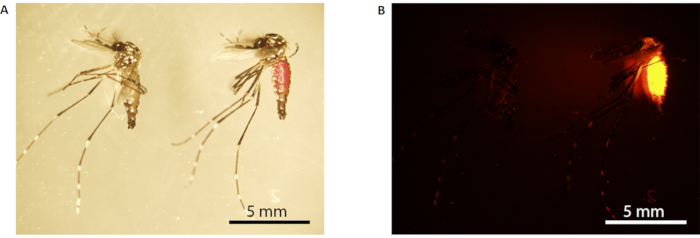
图3: 雄性蚊子的罗丹B标记。 (A) 光显微镜:(B) 荧光显微镜。左边的蚊子没有标记(用10%的蔗糖喂养),右边的蚊子有标记(用0.2%的RhB蔗糖喂养)。标记的蚊子在白光下有一个可见的粉红色腹部 (A形右侧的蚊子),在荧光显微镜下荧光(B)下荧光橙色。刻度条 = 5 毫米。 缩写: Rhb = 罗达明 B. 请单击此处查看此图的较大版本。
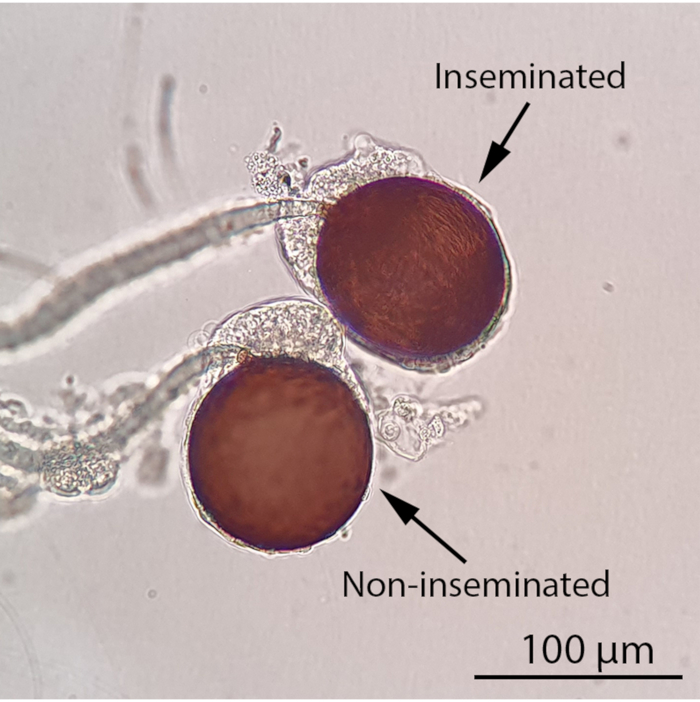
图4:在复合光显微镜下授精和非授精女性精子(100倍放大)。 雌性蚊子的授精状态可以通过在复合光显微镜下观察其精子来确定。授精雌性蚊子将包含至少一个填充的精子,而所有三个精子的非授精雌性蚊子将是空的。在复合光显微镜下,在充满精子的精子中可以看到类似线程的、运动精子。缩放栏 = 100 μm. 请单击此处查看此图的较大版本。

图 5 :雌性蚊子精子在荧光立体显微镜下用开创性液体授精。 ( A) RhB 标记和( B)未标记的精子与 RhB 标记的授精,将在荧光显微镜下荧光橙。刻度条 = 100 μm。 请单击此处查看此图的较大版本。
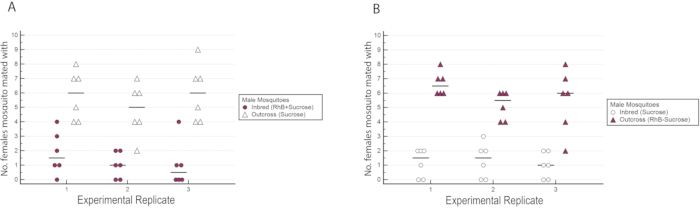
图6:实验三足鼎鼎的近亲繁殖或外生雄性受精的野生雌性数量,与互惠标记。 (A) 近亲繁殖雄性被标记为RhB,而外生雄性没有标记。(B) 外向雄性标记为RhB,而近亲繁殖的雄性没有标记。观察到,与交叉男配的女性人数较高,而不管其标记状况如何。 请单击此处查看此图的较大版本。
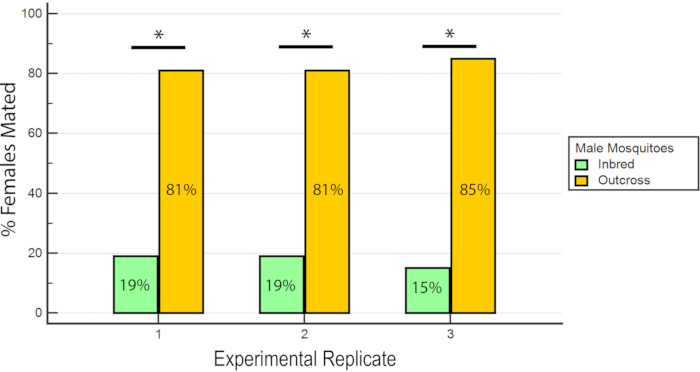
图 7 :在 3 个实验复制品中,与近亲繁殖或异配的受精雌性比例。 对于每个实验复制,有明显较高的比例的女性与交叉男配( P ≤0 . 05 ,曼 - 惠特尼 U测试)。 请单击此处查看此图的较大版本。
视频1:在光立体显微镜下解剖雌性伊蚊的精子。请点击这里下载此视频。
| ♀ x 近亲繁殖 (Rhb) ♂ | ♀ x 外交叉 (无标记) ♂ b | ♀ x 近亲繁殖 (无标记) ♂ c | ♀ x 外十字 (Rhb) ♂ d | 整体授精率 (a+b+c=d/120) | |
| 复制 1 | 11 | 35 | 7 | 40 | 77.5% (93/120) |
| 复制 2 | 6 | 29 | 8 | 31 | 61.7% (74/120) |
| 复制 3 | 6 | 36 | 6 | 33 | 67.5% (81/120) |
表 1 :与 RhB 标记和无标记的 w阿尔布 - Sg Aedes aegypti近亲繁殖和外向雄配的女性人数。每个复制品总共使用了120名女性。
| 百分比授精女性 | ||
| 近亲繁殖的雄性 | 超越男性 | |
| 复制 1 | 19% (18/93) | 81% (75/93) |
| 复制 2 | 19% (14/74) | 81% (60/74) |
| 复制 3 | 15% (12/81) | 85% (69/81) |
表2:与wAlbb - sg Aedes aegypti 近亲繁殖和交叉雄性交配的受精雌性百分比。
补充图 S1:基于 RhB 和传统交配竞争力测定的工作流程比较。 与传统的交配竞争力分析相比,基于RhB的交配竞争力检测的简化和缩短工作流程显著缩短了实验持续时间。请点击这里下载此文件。
补充图S2:卡普兰迈尔生存曲线的雄性成年伊蚊在喂养期间和喂养后与0.2%和0.4%的罗达明B-蔗糖喂养。与仅用蔗糖喂养的对照组相比,雄性野生型和(B)在三天喂养期间和三天后存活率分别为0.2%和0.4%。请点击这里下载此文件。
补充表S1:W 60厘米 x D 60厘米 x H 60厘米笼中女性的授精率(10个女性与20个男性的比例)在1、2和3小时时间点。 请点击这里下载此表。
讨论
标记常用于昆虫种群动力学、分散性、行为学和交配生物学的研究。在 SIT 和 IIT 计划中,进行标记以区分释放应变与现场人群,以研究其分散性和优化释放率。使用的标记方法包括遗传标记27,28,在幼虫食物29,30,荧光尘埃31和染料32中加入同位素。为了抑制蚊子种群使用 SIT 或 IT ,其中男配健身是一个关键组成部分,荧光染料已被用作标记,研究蚊子交配生物学18 , 19 。
通常,使用女性生育力测定评估释放菌株的男配竞争力。然而,由于交配后的下游实验过程(补充图S1),这种检测是耗时和劳动密集型的。这些过程包括女性的血液喂养、卵子采集、卵子孵化以及孵化卵子的比例的列举,以确定卵子的生存能力。平均而言,这种检测需要 30 小时和两周的实验工作(从建立竞争力检测笼开始),到最终确定男配竞争力。
他的论文介绍了使用荧光染料RhB(喂0.2%的RhB-蔗糖蚊子, 补充图S2)直接测量女性和RhB标记的雄性之间的交配相互作用。虽然此协议需要荧光立体显微镜,但它无需执行上述耗时的实验程序。平均而言,这种基于RhB的检测需要大约10个工时和大约一天才能从女性生育力检测中获取与此相当的数据。这 & gt ; 90% 的时间节省,使研究人员能够进行多个实验复制,提供男配体能更有力的验证。此外,这种检测可用于比较两条无菌或沃尔巴契亚感染蚊子线之间的交配竞争力。
这种类型的比较是不可能与传统的女性生育力测定,因为女性会产生不可行的卵子交配时,这两个这样的线。 尽管如此,实验中的任何混合交配都会导致对有标记人群的偏向,因为很难识别女性精子中含有来自 RhB 标记和无标记男性的的无标记精子。在一项使用 RhB18评估阿诺菲莱斯甘比亚交配竞争力的研究中也得出了类似的结论,根据该研究,在交配测定中,有较大比例的女性被发现由有标记的雄配。由于多变更可能发生在以前参与中断交配33的女性中,因此在这项研究中,通过在这些实验中使用较少的蚊子(20个雄性到10个雌性)来降低这种交配的概率。
结果显示,对RhB标记的种群没有偏见,表明混合交配是有限的。总之,将 RhB 纳入交配竞争力测定中,是评估男配体能的一种经济和快速的方法。这种方法还允许直接比较在不同饲养制度下接受不同剂量辐照的雄性或感染了不同菌株 的沃尔巴契亚的雄性之间的交配竞争力,使其成为评估男配适应任何男性释放型蚊子种群抑制计划的宝贵工具。
披露声明
作者宣称他们没有相互竞争的经济利益。
致谢
这项研究由新加坡国家环境局(NEA)资助。我们感谢国家卫生局(卫生署)副行政总裁周明辉先生批准发表这项研究,以及国家环境局环境健康研究所组长吴丽清教授对这项研究的支持。我们也感谢辛淑贞博士和谭德瑞博士校对手稿。
材料
| Name | Company | Catalog Number | Comments |
| Compound light microscope | Olympus | CX23 | To score for spermathecae insemination |
| Dissection forceps | Bioquip | Rubis forceps (4524) | |
| Fluorescence stereo-light microscope with RFP1 filter | Olympus | SZX16 | To check for Rhodamine B fluorescence signal |
| Mosquito cages | Bugdorm | 4F3030 | W 32.5 cm x D 32.5 cm x H 32.5 cm; mesh size of 150 x 150; 160 µm aperture For holding of male and female adult mosquitoes prior to mating assay |
| 6M610 | W 60 cm x D 60 cm x H 60 cm; mesh size of 44 x 32; 650 µm aperture For mating competitiveness assay | ||
| Mosquito netting | 150 x 150, 160 µm aperture | ||
| Rhodamine B | Sigma Aldrich | R6626 | ≥95% (HPLC) |
| Stereo-light microscope | Olympus | SZ61 | For spermathecae dissection |
| Sucrose | MP Biomedicals | SKU 029047138 | Food grade |
| TetraMin tropical flakes | Tetra | 77101 | Fish food for feeding larvae |
参考文献
- Achee, N. L., et al. A critical assessment of vector control for dengue prevention. PLoS Neglected Tropical Diseases. 9 (5), 0003655(2015).
- Carvalho, D. O., et al. Suppression of a field population of Aedes aegypti in Brazil by sustained release of transgenic male mosquitoes. PLoS Neglected Tropical Diseases. 9 (7), 0003964(2015).
- Lees, R. S., Gilles, J. R. L., Hendrichs, J., Vreysen, M. J. B., Bourtzis, K. Back to the future: the sterile insect technique against mosquito disease vectors. Current Opinion in Insect Science. 10, 156-162 (2015).
- Bourtzis, K., et al. Harnessing mosquito-Wolbachia symbiosis for vector and disease control. Acta Tropica. 132, 150-163 (2014).
- Zhang, D., Lees, R. S., Xi, Z., Gilles, J. R. L., Bourtzis, K. Combining the sterile insect technique with Wolbachia-based approaches: II--A safer approach to Aedes albopictus population suppression programmes, designed to minimize the consequences of inadvertent female release. PloS One. 10 (8), 0135194(2015).
- Zheng, X., et al. Incompatible and sterile insect techniques combined eliminate mosquitoes. Nature. 572 (7767), 56-61 (2019).
- Balestrino, F., et al. Gamma ray dosimetry and mating capacity studies in the laboratory on Aedes albopictus males. Journal of Medical Entomology. 47 (4), 581-591 (2010).
- Bellini, R., et al. Mating competitiveness of Aedes albopictus radio-sterilized males in large enclosures exposed to natural conditions. Journal of Medical Entomology. 50 (1), 94-102 (2013).
- Helinski, M. E., Parker, A. G., Knols, B. G. Radiation biology of mosquitoes. Malaria Journal. 8, Suppl 2 6(2009).
- Aldersley, A., et al. Too "sexy" for the field? Paired measures of laboratory and semi-field performance highlight variability in the apparent mating fitness of Aedes aegypti transgenic strains. Parasites & Vectors. 12 (1), 357(2019).
- Axford, J. K., Ross, P. A., Yeap, H. L., Callahan, A. G., Hoffmann, A. A. Fitness of wAlbB Wolbachia infection in Aedes aegypti: parameter estimates in an outcrossed background and potential for population invasion. The American Journal of Tropical Medicine and Hygiene. 94 (3), 507-516 (2016).
- Benedict, M. Q., et al. Colonisation and mass rearing: learning from others. Malaria Journal. 8 (2), 4(2009).
- Ross, P. A., Axford, J. K., Richardson, K. M., Endersby-Harshman, N. M., Hoffmann, A. A. Maintaining Aedes aegypti mosquitoes infected with Wolbachia. Journal of Visualized Experiments: JoVE. (126), e56124(2017).
- Ross, P. A., Endersby-Harshman, N. M., Hoffmann, A. A. A comprehensive assessment of inbreeding and laboratory adaptation in Aedes aegypti mosquitoes. Evolutionary Applications. 12 (3), 572-586 (2019).
- Segoli, M., Hoffmann, A. A., Lloyd, J., Omodei, G. J., Ritchie, S. A. The effect of virus-blocking Wolbachia on male competitiveness of the dengue vector mosquito, Aedes aegypti. PLoS Neglected Tropical Diseases. 8 (12), 3294(2014).
- Zhang, D., Lees, R. S., Xi, Z., Bourtzis, K., Gilles, J. R. Combining the sterile insect technique with the incompatible insect technique: III-Robust mating competitiveness of irradiated triple Wolbachia-infected Aedes albopictus males under semi-field conditions. PloS One. 11 (3), 0151864(2016).
- Fried, M. Determination of sterile-insect competitiveness. Journal of Economic Entomology. 64 (4), 869-872 (1971).
- Aviles, E. I., Rotenberry, R. D., Collins, C. M., Dotson, E. M., Benedict, M. Q. Fluorescent markers rhodamine B and uranine for Anopheles gambiae adults and matings. Malaria Journal. 19 (1), 236(2020).
- Johnson, B. J., et al. Use of rhodamine B to mark the body and seminal fluid of male Aedes aegypti for mark-release-recapture experiments and estimating efficacy of sterile male releases. PLoS Neglected Tropical Diseases. 11 (9), 0005902(2017).
- Fisher, P. Review of using rhodamine B as a marker for wildlife studies. Wildlife Society Bulletin. 27 (2), 318-329 (1999).
- Blanco, C. A., Perera, O., Ray, J. D., Taliercio, E., Williams, L. Incorporation of rhodamine B into male tobacco budworm moths Heliothis virescens to use as a marker for mating studies. Journal of Insect Science. 6, 5(2006).
- Mascari, T. M., Foil, L. D. Laboratory evaluation of the efficacy of fluorescent biomarkers for sugar-feeding sand flies (Diptera: Psychodidae). Journal of Medical Entomology. 47 (4), 664-669 (2014).
- Sarkar, D., Muthukrishnan, S., Sarkar, M. Fluorescent marked mosquito offer a method for tracking and study mosquito behaviour. International Journal of Mosquito Research. 4, 5-9 (2017).
- South, A., Sota, T., Abe, N., Yuma, M., Lewis, S. M. The production and transfer of spermatophores in three Asian species of Luciola fireflies. Journal of Insect Physiology. 54 (5), 861-866 (2008).
- Üner, O., Geçgel, Ü, Kolancilar, H., Bayrak, Y. Adsorptive removal of rhodamine B with activated carbon obtained from okra wastes. Chemical Engineering Communications. 204 (7), 772-783 (2017).
- Hagler, J. R., Jackson, C. G. Methods for marking insects: current techniques and future prospects. Annual Review of Entomology. 46, 511-543 (2001).
- Scolari, F., et al. Fluorescent sperm marking to improve the fight against the pest insect Ceratitis capitata (Wiedemann; Diptera: Tephritidae). New Biotechnology. 25 (1), 76-84 (2008).
- Ahmed, H. M. M., Hildebrand, L., Wimmer, E. A. Improvement and use of CRISPR/Cas9 to engineer a sperm-marking strain for the invasive fruit pest Drosophila suzukii. BMC Biotechnology. 19 (1), 85(2019).
- Botteon, V., Costa, M. L. Z., Kovaleski, A., Martinelli, L. A., Mastrangelo, T. Can stable isotope markers be used to distinguish wild and mass-reared Anastrepha fraterculus flies. PloS One. 13 (12), 0209921(2018).
- Hood-Nowotny, R., Mayr, L., Islam, A., Robinson, A., Caceres, C. Routine isotope marking for the Mediterranean fruit fly (Diptera: Tephritidae). Journal of Economic Entomology. 102 (3), 941-947 (2009).
- Schroeder, W. J., Mitchell, W. C. Marking Tephritidae fruit fly adults in Hawaii for release-recovery studies. Proceedings of the Hawaiian Entomological Society. 23 (3), 437-440 (1981).
- Akter, H., Taylor, P. W., Crisp, P. Visibility and persistence of fluorescent dyes, and impacts on emergence, quality, and survival of sterile Queensland fruit fly Bactrocera tryoni (Diptera: Tephritidae). Journal of Economic Entomology. 113 (6), 2800-2807 (2020).
- Oliva, C. F., Damiens, D., Benedict, M. Q. Male reproductive biology of Aedes mosquitoes. Acta Tropica. 132, Suppl 12-19 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。