Method Article
Utilisation du colorant fluorescent, Rhodamine B, pour étudier la compétitivité de l’accouplement chez les moustiques mâles Aedes aegypti
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons ici un protocole pour étudier la compétitivité d’accouplement du mâle Aedes aegypti en utilisant un colorant fluorescent comme marqueur. Les moustiques femelles sont exposées à des mâles marqués et non marqués pour la copulation. Après l’accouplement, leurs spermathèques sont examinées au microscope à fluorescence pour déterminer leur partenaire d’accouplement.
Résumé
Le succès des programmes de suppression des populations stériles ou incompatibles basés sur la technique des insectes dépend de la capacité des mâles relâchés à rivaliser pour les femelles de type sauvage et à induire la stérilité dans la population cible. Par conséquent, l’évaluation en laboratoire de la compétitivité de l’accouplement des mâles est essentielle pour évaluer l’aptitude de la souche de libération avant la libération sur le terrain. Classiquement, un tel test est effectué en déterminant la proportion d’œufs viables produits par les femelles après avoir été exposés simultanément à deux ensembles de mâles (souches de type sauvage et de libération) pour la copulation. Cependant, ce processus prend du temps et est laborieux en raison de la nécessité de nourrir d’abord les femelles par le sang pour la production d’œufs, puis d’éclore et de dénombrer les œufs éclos pour déterminer la viabilité des œufs.
De plus, cette méthode ne peut pas discerner le degré de compétitivité entre deux lignées de moustiques stériles ou infectées par Wolbachia,car les moustiques femelles de type sauvage ne produiront des œufs non viables qu’après l’accouplement avec les deux. Pour contourner ces limitations, cet article décrit une méthode plus directe de mesure de la compétitivité de l’accouplement des moustiques mâles en laboratoire en utilisant le colorant fluorescent, la rhodamine B (RhB), qui peut être utilisé pour marquer les mâles en les nourrissant dans une solution de saccharose contenant du RhB. Après le test d’accouplement, la présence de spermatozoïdes fluorescents dans les spermathèques d’une femelle peut être utilisée pour déterminer son partenaire d’accouplement. Cette méthode est rentable, réduit le temps expérimental de 90% et permet de comparer l’aptitude à l’accouplement entre deux lignées stériles ou infectées par Wolbachia.
Introduction
L’élevage et la libération de mâles stériles ou incompatibles pour la suppression des populations de moustiques Aedes sont actuellement évalués sur le terrain en tant que nouvel outil pour prévenir les épidémies de dengue et d’autres maladies transmises par Aedes1. Les stratégies de suppression des rejets mâles qui font actuellement l’objet d’essais sur le terrain comprennent l’utilisation de la méthode génétique2,l’irradiation (technique de l’insecte stérile, SIT)3,la bactérie endosymbiotique Wolbachia (technique incompatible avec l’insecte, IIT)4, ou une combinaison des deux dernières techniques5,6. Le succès de ces approches dépend en grande partie de la capacité des mâles relâchés à surpasser les mâles de type sauvage et à rechercher des femelles pour assurer la copulation. Sinon, la stérilité ne peut pas être induite dans la population cible.
Dans un programme SIT classique, par exemple, l’aptitude à l’accouplement des mâles peut être affectée par des facteurs tels que la dosed’irradiation7,8,9, le protocole d’élevage de masse et l’étendue de la consanguinité dans la colonie10,11,12,13,14. En outre, des études sur la compétitivité de l’accouplement peuvent fournir des connaissances importantes sur le comportement d’accouplement des moustiques qui pourraient être utilisées pour éclairer les stratégies de lutte antivectorielle.
Dans sit sit et iit, la compétitivité d’accouplement des moustiques mâles est généralement évaluée en permettant à la fois aux souches de type sauvage et de relâchement de rivaliser pour les femelles de type sauvage dans une cage8,11,15,16. Les femelles sont ensuite nourries au sang et leurs œufs éclos pour déterminer la viabilité. Les femelles qui pondent des œufs non viables ou des œufs à faible taux d’éclosion sont supposées s’être accouplées avec des mâles de souche de libération, tandis que les femelles qui produisent des œufs viables sont supposées s’être accouplées avec des mâles de type sauvage. La compétitivité de l’accouplement est ensuite calculée avec l’indice de Fried17. Malheureusement, cette méthode est gourmande en ressources et prend beaucoup de temps, et l’indice de fried global peut être influencé par des facteurs de confusion externes affectant la viabilité des œufs, tels qu’une mauvaise manipulation des œufs et une dessiccation excessive, ce qui peut entraîner un faible taux d’éclosion dans le croisement de compatibilité, ce qui peut alors conduire à un indice de friture artificiellement bas.
De plus, cette méthode ne permet pas de comparer directement la compétitivité d’accouplement entre les moustiques Aedes qui sont infectés par différentes souches de Wolbachia ou qui sont exposés à différentes doses d’irradiation. Par conséquent, une méthode plus directe est nécessaire pour relever ces défis. Des études récentes18,19 ont démontré l’efficacité de l’utilisation du colorant fluorescent, RhB, pour marquer le liquide séminal des moustiques mâles. Le liquide séminal marqué est transféré et stocké dans les spermathèques des moustiques femelles lors d’un accouplement réussi, ce qui permet de mesurer directement l’interaction d’accouplement des femelles avec les mâles marqués. La rhodamine B est un colorant fluoré réactif au thiol couramment utilisé comme biomarqueur pour les études de recherche écologique et comportementale chez les animaux, y compris les insectes20. Pour les études sur les moustiques, le RhB est introduit en se nourrissant avec du sucre ou de l’eau de miel contenant de la poudre de RhB dissoute18,19,21 , 22,23,24. Lors de l’absorption, le colorant RhB se lie aux protéines, colorant les tissus du corps avec une tache rose rougeâtre qui fluorescent orange vif sous une source de lumière fluorescente.
Le fort signal de fluorescence et la stabilité du marquage, associés à sa capacité à tacher les liquides séminaux des insectes, permettent de surveiller le transfert du liquide séminal marqué du mâle marqué vers les organes de stockage du sperme de l’insecte femelle pour les étudesd’accouplement18,19,21,24. L’utilisation de RhB dans un test de compétitivité d’accouplement mâle permet non seulement de mesurer directement l’interaction d’accouplement des femelles avec des mâles marqués et non marqués, mais les résultats peuvent également être obtenus dans les 24 heures car ils évitent le processus de détermination de la viabilité des œufs, qui nécessite généralement environ 10 à 14 jours. De plus, cette méthode surmonte la perte potentielle de données lorsque les moustiques femelles ne se nourrissent pas de sang ou meurent avant la ponte. Ceci est particulièrement crucial car dans les essais semi-champs, où les moustiques femelles sont sujets aux dommages et à la mort lors de la collecte post-accouplement à l’aide d’un sac à dos ou d’un aspirateur mécanique. Pour répondre aux limites actuelles de l’utilisation de la fertilité féminine, nous présentons une méthode alternative qui utilise la coloration RhB pour mesurer directement la compétitivité de l’accouplement des moustiques mâles. La méthode simplifie le flux de travail, raccourcit le temps expérimental d’environ deux semaines à un jour, ce qui permet d’effectuer davantage de réplications expérimentales et permet de comparer deux souches de libération. Ce protocole conviendra aux laboratoires qui se lancent dans des programmes de suppression des populations de moustiques basés sur la libération de mâles et pourra être utilisé pour le contrôle de la qualité de routine et l’évaluation des souches.
Protocole
1. Élevage des moustiques
- Effectuer tous les tests d’élevage de moustiques et de compétitivité d’accouplement mâle dans des conditions d’insectes standard de 27 ± 1 °C et 75-80% d’humidité relative, avec une photopériode de 12 h:12 h lumière: cycles sombres.
- Désignez les deux groupes d’hommes concurrents comme l’ensemble A et l’ensemble B pour une référence facile dans la méthodologie décrite dans le présent document. Élevez les moustiques dans des conditions normalisées pour assurer une comparaison équitable de leur condition physique pendant le test. Élevez les moustiques à une densité larvaire de 500 larves dans 2 L d’eau et nourrissez-les avec de la poudre de nourriture pour poissons moulus ad libitum.
NOTE: Pour la génération des résultats représentatifs, les ensembles A et B étaient les mâles consanguins et croisés de l’Ae infecté par Wolbachia. Aegypti, respectivement. - Sex mâles et femelles moustiques au stade nymphal, et les contiennent séparément dans des cages (voir le Tableau des matériaux)de dimensions L 32,5 cm x P 32,5 cm x H 32,5 cm, avec maillage de 150 x 150 et 160 μm d’ouverture. Maintenir tous les moustiques adultes avec une solution de saccharose à 10%.
2. Préparation des moustiques mâles et femelles
- Sexe des moustiques mâles et femelles au stade nymphal en fonction de leurs différences de taille (les nymphes mâles étant plus petites que les nymphes femelles) (Figure 1).
- Pour chaque ensemble de moustiques (ensemble A ou série B), transférer 100 nymphes mâles chacune dans une cage prémarquée pour l’alimentation en saccharose ou en saccharose RhB.
- Placez les nymphes femelles en petits lots de 40 à 50 par cage. À l’émergence des imagoes, vérifiez la présence de moustiques mâles dans les cages.
REMARQUE: Les moustiques mâles adultes sont plus petits que les femelles et ont des antennes plus touffues et plus velues (Figure 2). Utilisez uniquement des moustiques femelles vierges pour les tests de compétitivité d’accouplement. L’utilisation de femelles pré-inséminées rendra toutes les données résultantes invalides. Ainsi, des précautions extrêmes doivent être prises lors du sexage au stade des nymphes. N’utilisez pas les moustiques femelles d’une cage qui a été contaminée par des moustiques mâles. Des cages supplémentaires de femelles doivent être préparées.
3. Préparation d’une solution de saccharose à 0,2% de RhB
REMARQUE: RhB est une poudre verte sous forme sèche et rose rougeâtre en solution. L’équipement de protection individuelle standard (EPI: blouse de protection de laboratoire, gants en nitrile et protection oculaire) doit être porté lors de la manipulation de ce produit chimique. Pour éviter l’inhalation, peser la poudre de RhB dans une hotte.
- Pour préparer une solution de saccharose RhB à 0,2 % p/v, dissoudre 200 mg de poudre de RhB pour chaque 100 mL de solution de saccharose à 10 % p/v.. Bien mélanger pour s’assurer que toute la poudre est dissoute.
REMARQUE: Comme le RhB est sensible à la lumière, utilisez des bouteilles ambrées ou enveloppez complètement les bouteilles transparentes avec du papier d’aluminium.
4. Alimentation des moustiques mâles
REMARQUE : Les données relatives à l’optimisation de l’alimentation en rhB-saccharose sont présentées dans la section 1 du matériel supplémentaire.
- Préparez 20 bouteilles d’alimentation en sucre avec une mèche. Ajouter 10 mL de saccharose à 10 % dans 10 biberons et 10 mL de solution de rhB-saccharose à 0,2 % dans les 10 autres flacons d’alimentation (utilisez des bouteilles ambrées ou enveloppez les bouteilles dans du papier d’aluminium).
- Placer les biberons dans les cages mâles respectives (5 bouteilles par cage) préparées aux étapes 2.2 et 2.3. Laissez les moustiques mâles se nourrir pendant trois jours avant l’expérience d’accouplement.
5. Vérification de la fluorescence RhB chez les moustiques mâles
- Aspirez les moustiques mâles nourris au saccharose RhB et observez-les au stéréomicroscope à fluorescence pour vous assurer que tous les moustiques mâles nourris au saccharose RhB ont été marqués avec succès avec RhB.
- Allumez la lampe à brûleur au mercure et le stéréomicroscope. Laissez la source lumineuse de la lampe à brûleur au mercure se stabiliser pendant 10 min. Réglez les filtres de fluorescence pour la protéine de fluorescence rouge 1 (RFP1) (longueur d’onde d’excitation 540 nm, longueur d’onde d’émission 625 nm).
- Aspirez un petit nombre de moustiques (quatre ou cinq) à la fois dans le tube de verre de l’aspirateur oral. À travers le tube de verre, observez le corps des moustiques mâles sous le stéréomicroscope à fluorescence. Exclure les moustiques mâles non marqués avec RhB de l’expérience.
REMARQUE : L’abdomen des moustiques mâles marqués de RhB apparaîtra rose sous une lumière blanche(Figure 3A)et brillera en orange vif sous une lumière fluorescente(Figure 3B). - Transférer les moustiques mâles dans 12 gobelets en papier sécurisés par un filet (maillage 150 x 150, ouverture de 160 μm); 6 tasses chacune avec 10 moustiques mâles nourris au saccharose et les 6 autres tasses chacune avec 10 moustiques mâles nourris au saccharose RhB. Répétez cette étape pour définir les moustiques mâles B.
6. Test de compétitivité d’accouplement
- Installez des cages de 12 L 60 cm x P 60 cm x H 60 cm avec maillage 44 x 32, ouverture de 650 μm pour le test d’accouplement. Dans chacune des six cages, comprennent 10 moustiques mâles de l’ensemble A (marqués RhB), 10 moustiques mâles de l’ensemble B (non marqués) et 10 moustiques femelles vierges de type sauvage. Dans les six autres cages, on compte 10 moustiques mâles de l’ensemble A (non marqués), 10 moustiques mâles de l’ensemble B (marqués RhB) et 10 moustiques femelles vierges de type sauvage. Étiquetez ces cages pour distinguer clairement les deux combinaisons d’accouplement.
REMARQUE: D’après l’expérience, une cage de 60 cm x 60 cm x 60 cm a été utilisée pour le test d’accouplement, car une cage plus petite peut encourager l’accouplement mixte. - Placer les tasses respectives des mâles préparés à l’étape 5.4 dans les cages d’accouplement conformément à l’étiquette de l’étape 6.1. Retirez le filet et tapotez doucement la tasse pour bousculer les mâles hors de la tasse. Retirez soigneusement le gobelet en papier et le filet de la cage pour vous assurer qu’aucun moustique ne s’échappe de la cage. Laissez les moustiques mâles s’acclimater dans la cage d’accouplement pendant au moins une heure.
- À l’aide d’un aspirateur oral, transférez les moustiques femelles vierges de type sauvage dans 12 gobelets en papier, chaque tasse contenant 10 moustiques.
- Après la période d’acclimatation pour les moustiques mâles, transférez une tasse de femelles dans chaque cage d’accouplement et retirez le filet. Bousculez doucement la tasse pour encourager les moustiques femelles restants à sortir de la tasse. Retirez soigneusement le gobelet en papier et le filet de la cage pour vous assurer qu’aucun moustique ne s’échappe de la cage.
- Laisser l’accouplement avoir lieu pendant 3 h.
NOTE: La durée d’accouplement recommandée a été déterminée par des observations antérieures d’Ae. aegyptide type sauvage. Dans les expériences impliquant 10 femelles et 20 mâles détenus dans une cage de 60 cm x 60 cm x 60 cm, 90% de l’insémination féminine a été réalisée en 3 h (Matériel supplémentaire, section 2). Ne dérangez pas la cage pendant cette période car l’agitation pourrait entraîner un accouplement interrompu et mixte. L’accouplement mixte (où la femelle s’est accouplée avec des mâles marqués et non marqués) entraîne un biais en faveur des mâles marqués RhB car il est difficile de distinguer les spermatozoïdes non marqués des spermatozoïdes marqués RhB sous un microscope à fluorescence. - Pour mettre fin à l’expérience d’accouplement, retirez tous les moustiques de chaque cage à l’aide d’un aspirateur mécanique. Anesthésier à froid les moustiques sur la glace pendant au moins 5 min. Lorsque les moustiques sont complètement anesthésiés, ramassez doucement les moustiques femelles et rangez-les dans un gobelet en papier séparé fixé avec un filet (maillage 150 x 150, ouverture de 160 μm). Étiquetez le gobelet en papier en transférant l’étiquette correspondante de la cage d’accouplement sur le gobelet en papier.
REMARQUE: Il est possible de suspendre l’expérience à ce stade et de maintenir les femelles avec une solution de saccharose à 10%. Le liquide séminal marqué RhB restera stable à l’intérieur des spermathèques femelles pendant au moins une semaine. Il est préférable de garder les femelles en vie avant la dissection, car les spécimens morts et desséchés sont difficiles à disséquer. - Pour marquer les spermathèques femelles, anesthésier à froid les moustiques femelles sur la glace pendant au moins 5 min avant la dissection au stéréomicroscope (Vidéo 1). Examiner les spermathèques au microscope optique composé (grossissement de 100x) pour déterminer leur état d’insémination(Figure 4). Pour les personnes inséminées, déterminez si les spermathèques contiennent du liquide séminal marqué RhB en les examinant au stéréomicroscope à fluorescence équipé d’un filtre RFP1 et d’un système d’imagerie par caméra.
REMARQUE: Lors de l’utilisation d’un stéréomicroscope à fluorescence avec un système d’imagerie attaché, il est recommandé d’utiliser un temps d’exposition prolongé (5 s) pour augmenter la sensibilité de détection. Si le moustique femelle s’est accouplé avec un mâle marqué, ses spermathèques fluorescent orange vif(Figure 5A). Cependant, si le moustique femelle s’est accouplé avec un mâle non marqué, ses spermathèques inséminées ne fluoresceront pas(Figure 5B).
7. Élimination des déchets RhB
- Traiter les déchets aqueux de RhB avec du charbonactif 25 avant de les rejeter sous forme d’eaux usées générales. Éliminer les déchets solides de RhB (moustiques marqués de RhB, serviettes en papier et mèches imbibées de RhB) comme déchets chimiques. Enfilez un EPI standard lorsque vous manipulez des déchets RhB.
Résultats
w AlbB-SG est une lignée localisée (Singapour) d’Ae. aegypti infectée de manière stable par la souche wAlbB de Wolbachia. En utilisant le protocole décrit dans cet article, nous avons évalué la compétitivité d’accouplement mâle d’un consanguin et d’une lignée croisée de wAlbB-SG pour déterminer si la consanguinité entraîne une perte de la capacité d’accouplement des mâles. La lignée consanguine avait été maintenue pendant 11 générations dans l’insectaire, tandis que la ligne croisée était générée en croisant les femelles avec des Ae mâles de type sauvage. aegypti. Les mâles des lignées consanguines et croisées étaient en compétition les uns contre les autres pour l’accouplement avec la femelle de type sauvage de type sauvage Ae. aegypti. Le test de compétitivité de l’accouplement a été réalisé en trois exemplaires.
Les résultats ont indiqué que le RhB n’a pas affecté l’aptitude des mâles car les données pour l’insémination femelle n’étaient pas biaisées en faveur ou contre l’accouplement avec des mâles nourris au saccharose RhB (Tableau 1 et Figure 6) Comme le RhB n’affecte pas l’aptitude à l’accouplement des mâles, nous procédons à l’analyse des données en fonction du pourcentage de femelles inséminées accouplées par la lignée consanguine ou croisée (Tableau 2 et Figure 7). Les résultats dans l’ensemble des triplicates expérimentaux étaient cohérents; il y avait un pourcentage significativement plus élevé de femelles accouplées avec les mâles croisés qu’avec les mâles consanguins dans les trois répliques (P ≤ 0,05, mann-Whitney U-test). Ces résultats suggèrent une perte potentielle de la condition physique d’accouplement des mâles après plusieurs générations de consanguinité en laboratoire.

Figure 1: Vue latérale des pupes Aedes aegypti mâle (à gauche) et femelle (à droite). Dans les mêmes conditions d’élevage, Ae. aegypti peut être sexé au stade nymphal en fonction de la taille; les mâles sont significativement plus petits que les femelles. Veuillez cliquer ici pour voir une version agrandie de cette figure.
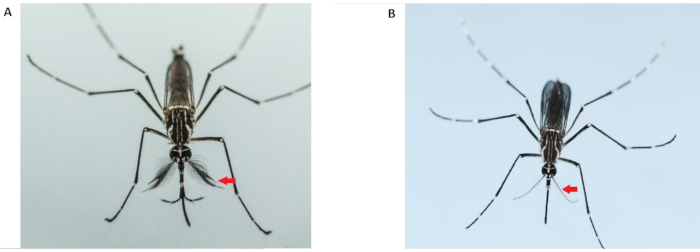
Figure 2: Différenciation des adultes Aedes aegypti mâles (à gauche) et femelles (à droite). Les moustiques mâles adultes (à gauche) ont des antennes plus touffues et plus velues que la femelle adulte; les flèches rouges indiquent les antennes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
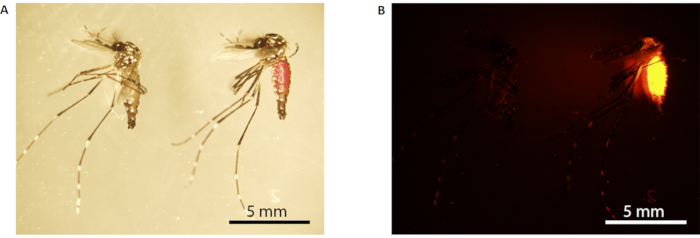
Figure 3: Marquage à la rhodamine B du moustique mâle. (A) Microscopie optique; (B) microscopie à fluorescence. Le moustique de gauche n’est pas marqué (nourri avec 10% p/v de saccharose), tandis que celui de droite est marqué (nourri avec 0,2% de saccharose RhB). Les moustiques marqués ont un abdomen rose visible sous une lumière blanche (le moustique à droite en A),qui fluorescent orange vif sous microscopie à fluorescence (B). Barres d’échelle = 5 mm. Abréviation: RhB = Rhodamine B. Veuillez cliquer ici pour voir une version plus grande de cette figure.
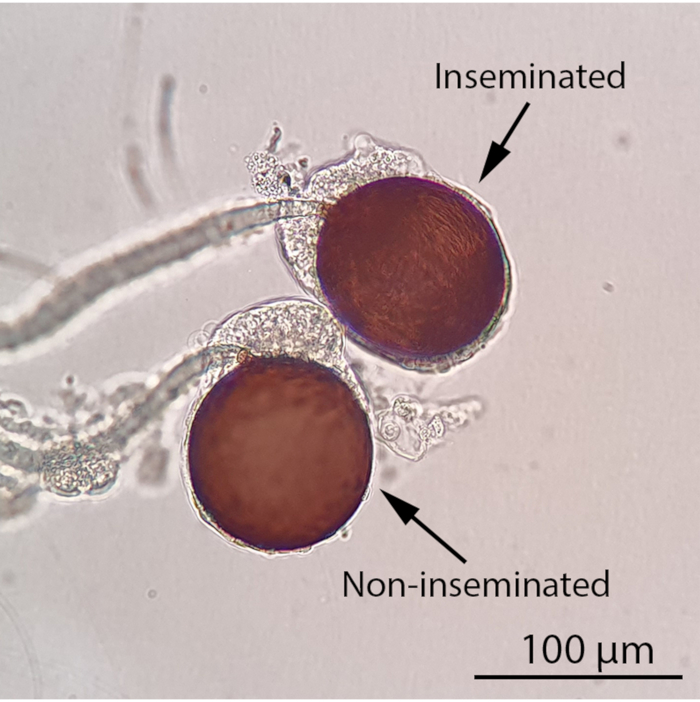
Figure 4: Spermathèques femelles inséminées et non inséminées sous un microscope à lumière composée (grossissement 100x). L’état d’insémination d’un moustique femelle peut être déterminé en observant ses spermathèques au microscope optique composé. Un moustique femelle inséminé contiendra au moins une spermathèque remplie tandis que les trois spermathèques d’un moustique femelle non inséminé seront vides. Les spermatozoïdes mobiles en forme de fil seront visibles dans une spermathèque remplie sous un microscope à lumière composée. Barre d’échelle = 100 μm. Veuillez cliquer ici pour afficher une version agrandie de cette figure.

Figure 5: Les spermathèques de moustiques femelles inséminées avec des liquides séminaux sous un stéréomicroscope à fluorescence. (A) les spermathèques marquées RhB et (B) non marquées inséminées avec des liquides séminaux marqués RhB vont fluorescence orange vif sous microscopie à fluorescence. Barres d’échelle = 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
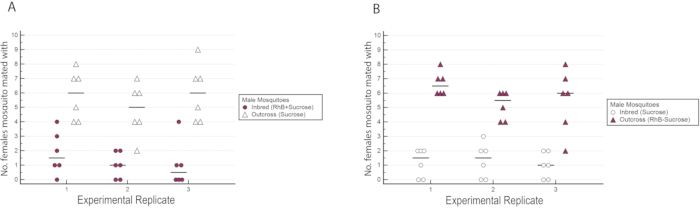
Figure 6: Nombre de femelles de type sauvage inséminées par les mâles consanguins ou croisés dans les triplicates expérimentaux avec marquage réciproque. (A) Les mâles consanguins ont été marqués avec RhB tandis que les mâles croisés n’étaient pas marqués. (B) Les mâles croisés étaient marqués avec RhB tandis que les mâles consanguins n’étaient pas marqués. On a observé qu’un plus grand nombre de femelles s’étaient accouplées avec des mâles croisés, quel que soit leur statut de marquage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
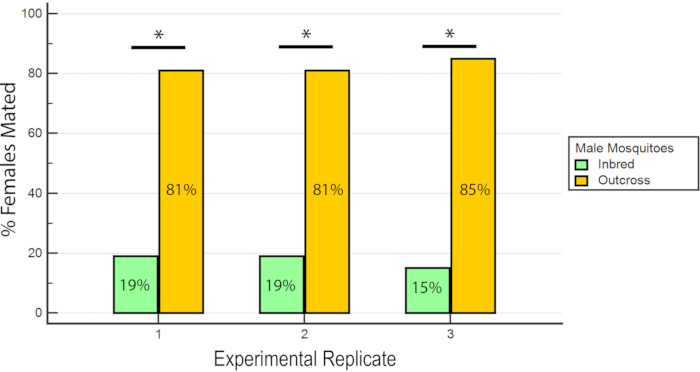
Figure 7: Proportion de femelles inséminées accouplées avec des mâles consanguins ou croisés dans les 3 répliques expérimentales. Pour chaque réplique expérimentale, il y a un pourcentage significativement plus élevé de femelles accouplées avec les mâles croisés (P ≤ 0,05, mann-Whitney U-test). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo 1: Dissection d’Aedes aegypti femelle pour les spermathèques sous un stéréomicroscope léger. Veuillez cliquer ici pour télécharger cette vidéo.
| ♀ x Consanguin (RhB) ♂ un | ♀ x Outcross (non marqué) ♂ b | ♀ x Consanguin (non marqué) ♂ c | ♀ x Outcross (RhB) ♂ d | Taux global d’insémination (a+b+c+d/120) | |
| Répliquer 1 | 11 | 35 | 7 | 40 | 77.5% (93/120) |
| Répliquer 2 | 6 | 29 | 8 | 31 | 61.7% (74/120) |
| Répliquer 3 | 6 | 36 | 6 | 33 | 67.5% (81/120) |
Tableau 1 : Nombre de femelles accouplées avec des mâles consanguins et croisés marqués rhB et non marqués avecAlbB-Sg Aedes aegypti. Un nombre total de 120 femelles ont été utilisées dans chaque réplique.
| Pourcentage de femmes inséminées | ||
| Mâles consanguins | Croisement des mâles | |
| Répliquer 1 | 19% (18/93) | 81% (75/93) |
| Répliquer 2 | 19% (14/74) | 81% (60/74) |
| Répliquer 3 | 15% (12/81) | 85% (69/81) |
Tableau 2 : Pourcentage de femelles inséminées accouplées avec des mâles consanguins et croisés AlbB-Sg Aedes aegypti.
Figure supplémentaire S1 : Comparaison du flux de travail pour le test de compétitivité d’accouplement conventionnel et à base de RhB. Par rapport au test de compétitivité d’accouplement conventionnel, le flux de travail simplifié et raccourci pour le test de compétitivité d’accouplement basé sur RhB réduit considérablement la durée expérimentale. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire S2: Courbes de survie de Kaplan Meier d’Aedes aegypti adulte mâle pendant et après l’alimentation avec 0,2% et 0,4% de rhodamine B-alimentationen saccharose. Pourcentage de survie de (A) mâle de type sauvage et (B) wAlbB-Sg Ae. aegypti pendant et après trois jours d’alimentation avec 0,2% et 0,4% de rhB-saccharose, par rapport aux témoins qui ont été nourris avec du saccharose seulement. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire S1 : Taux d’insémination des femelles dans une cage L 60 cm x P 60 cm x H 60 cm (rapport de 10 femelles pour 20 mâles) à des points de temps de 1, 2 et 3 h. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Le marquage est couramment utilisé dans la recherche entomologique pour étudier la dynamique des populations d’insectes, la dispersion, le comportement et la biologie de l’accouplement26. Dans les programmes SIT et IIT, le marquage est effectué pour différencier la souche de libération de la population de terrain afin d’étudier leur dispersion et d’optimiser le rapport de libération. Les méthodes de marquage utilisées comprennent le marquage génétique27,28, l’incorporation d’isotopes dans les aliments larvaires29,30, la poussière fluorescente31et le colorant32. Pour la suppression des populations de moustiques à l’aide de SIT ou d’IIT, où la capacité d’accouplement des mâles est un composant essentiel, des colorants fluorescents ont été utilisés comme marqueurs pour étudier la biologie de l’accouplement des moustiques18,19.
Classiquement, l’évaluation de la compétitivité de l’accouplement mâle de la souche de libération a été évaluée à l’aide de tests de fertilité femelle. Cependant, ce test prend beaucoup de temps et de main-d’œuvre en raison des processus expérimentaux en aval post-accouplement(figure supplémentaire S1). Ces processus comprennent l’alimentation sanguine des femelles, la collecte des œufs, l’éclosion des œufs et le dénombrement de la proportion d’œufs éclos pour déterminer la viabilité des œufs. En moyenne, ce test nécessite 30 heures de travail et deux semaines de travail expérimental (à partir de la mise en place des cages d’essai de compétitivité) jusqu’à la détermination finale de la compétitivité de l’accouplement des mâles.
son article présente l’utilisation d’un colorant fluorescent, rhB, (nourri sous forme de 0,2 % de RhB-saccharose aux moustiques, figure supplémentaire S2)pour mesurer directement les interactions d’accouplement entre les femelles et les mâles marqués RhB. Bien que ce protocole nécessite un stéréomicroscope à fluorescence, il évite d’avoir à effectuer les procédures expérimentales fastidieuses mentionnées ci-dessus. En moyenne, ce test basé sur rhB nécessite environ 10 heures de travail et environ une journée pour obtenir des données équivalentes à ceux des tests de fertilité féminine. Ce gain de temps >90% permet aux chercheurs d’effectuer plusieurs répétitions expérimentales, offrant une validation plus robuste de la capacité d’accouplement des mâles. En outre, ce test peut être utilisé pour comparer la compétitivité d’accouplement entre deux lignées de moustiques stériles ou infectées par Wolbachia.
Ce type de comparaison n’est pas possible avec les tests de fertilité femelles conventionnels, car les femelles produiraient des œufs non viables lors de l’accouplement avec ces deux lignées. Néanmoins, tout accouplement mixte dans l’expérience entraînera un biais en faveur de la population marquée, car il est difficile d’identifier les spermatozoïdes non marqués chez les spermathèques femelles qui contiennent du liquide séminal provenant de mâles marqués et non marqués. Une conclusion similaire a été faite dans une étude évaluant la compétitivité d’accouplement d’Anopheles gambiae en utilisant RhB18, dans laquelle une plus grande proportion de femelles dans le test d’accouplement s’est avérée être accouplée par des mâles marqués. Comme la polyandrie est plus susceptible de se produire chez les femelles qui s’étaient précédemment engagées dans un accouplement interrompu33, la probabilité que cela se produise a été réduite dans cette étude en utilisant moins de moustiques (20 mâles à 10 femelles) dans un plus grand volume de cage (0,216 m3)dans ces expériences.
Les résultats n’ont montré aucun biais en faveur de la population marquée RhB, ce qui indique que l’accouplement mixte était limité. En résumé, l’incorporation de RhB pour marquer les mâles dans un test de compétitivité d’accouplement est un moyen économique et rapide d’évaluer l’aptitude à l’accouplement des mâles. Cette méthode permet également de comparer directement la compétitivité de l’accouplement entre les mâles exposés à différentes doses d’irradiation, élevés dans différents régimes d’élevage, ou ceux infectés par différentes souches de Wolbachia,ce qui en fait un outil précieux pour l’évaluation de l’aptitude à l’accouplement des mâles pour tout programme de suppression de la population de moustiques basé sur la libération des mâles.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents.
Remerciements
Cette étude a été financée par la National Environment Agency (NEA) de Singapour. Nous remercions M. Chew Ming Fai, directeur général adjoint (santé publique), NEA, pour son approbation de publier l’étude, et A/Prof Ng Lee Ching, directeur de groupe (Environmental Health Institute Group), NEA, pour son soutien dans cette étude. Nous remercions également le Dr Shuzhen Sim et le Dr Denise Tan d’avoir relu le manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| Compound light microscope | Olympus | CX23 | To score for spermathecae insemination |
| Dissection forceps | Bioquip | Rubis forceps (4524) | |
| Fluorescence stereo-light microscope with RFP1 filter | Olympus | SZX16 | To check for Rhodamine B fluorescence signal |
| Mosquito cages | Bugdorm | 4F3030 | W 32.5 cm x D 32.5 cm x H 32.5 cm; mesh size of 150 x 150; 160 µm aperture For holding of male and female adult mosquitoes prior to mating assay |
| 6M610 | W 60 cm x D 60 cm x H 60 cm; mesh size of 44 x 32; 650 µm aperture For mating competitiveness assay | ||
| Mosquito netting | 150 x 150, 160 µm aperture | ||
| Rhodamine B | Sigma Aldrich | R6626 | ≥95% (HPLC) |
| Stereo-light microscope | Olympus | SZ61 | For spermathecae dissection |
| Sucrose | MP Biomedicals | SKU 029047138 | Food grade |
| TetraMin tropical flakes | Tetra | 77101 | Fish food for feeding larvae |
Références
- Achee, N. L., et al. A critical assessment of vector control for dengue prevention. PLoS Neglected Tropical Diseases. 9 (5), 0003655(2015).
- Carvalho, D. O., et al. Suppression of a field population of Aedes aegypti in Brazil by sustained release of transgenic male mosquitoes. PLoS Neglected Tropical Diseases. 9 (7), 0003964(2015).
- Lees, R. S., Gilles, J. R. L., Hendrichs, J., Vreysen, M. J. B., Bourtzis, K. Back to the future: the sterile insect technique against mosquito disease vectors. Current Opinion in Insect Science. 10, 156-162 (2015).
- Bourtzis, K., et al. Harnessing mosquito-Wolbachia symbiosis for vector and disease control. Acta Tropica. 132, 150-163 (2014).
- Zhang, D., Lees, R. S., Xi, Z., Gilles, J. R. L., Bourtzis, K. Combining the sterile insect technique with Wolbachia-based approaches: II--A safer approach to Aedes albopictus population suppression programmes, designed to minimize the consequences of inadvertent female release. PloS One. 10 (8), 0135194(2015).
- Zheng, X., et al. Incompatible and sterile insect techniques combined eliminate mosquitoes. Nature. 572 (7767), 56-61 (2019).
- Balestrino, F., et al. Gamma ray dosimetry and mating capacity studies in the laboratory on Aedes albopictus males. Journal of Medical Entomology. 47 (4), 581-591 (2010).
- Bellini, R., et al. Mating competitiveness of Aedes albopictus radio-sterilized males in large enclosures exposed to natural conditions. Journal of Medical Entomology. 50 (1), 94-102 (2013).
- Helinski, M. E., Parker, A. G., Knols, B. G. Radiation biology of mosquitoes. Malaria Journal. 8, Suppl 2 6(2009).
- Aldersley, A., et al. Too "sexy" for the field? Paired measures of laboratory and semi-field performance highlight variability in the apparent mating fitness of Aedes aegypti transgenic strains. Parasites & Vectors. 12 (1), 357(2019).
- Axford, J. K., Ross, P. A., Yeap, H. L., Callahan, A. G., Hoffmann, A. A. Fitness of wAlbB Wolbachia infection in Aedes aegypti: parameter estimates in an outcrossed background and potential for population invasion. The American Journal of Tropical Medicine and Hygiene. 94 (3), 507-516 (2016).
- Benedict, M. Q., et al. Colonisation and mass rearing: learning from others. Malaria Journal. 8 (2), 4(2009).
- Ross, P. A., Axford, J. K., Richardson, K. M., Endersby-Harshman, N. M., Hoffmann, A. A. Maintaining Aedes aegypti mosquitoes infected with Wolbachia. Journal of Visualized Experiments: JoVE. (126), e56124(2017).
- Ross, P. A., Endersby-Harshman, N. M., Hoffmann, A. A. A comprehensive assessment of inbreeding and laboratory adaptation in Aedes aegypti mosquitoes. Evolutionary Applications. 12 (3), 572-586 (2019).
- Segoli, M., Hoffmann, A. A., Lloyd, J., Omodei, G. J., Ritchie, S. A. The effect of virus-blocking Wolbachia on male competitiveness of the dengue vector mosquito, Aedes aegypti. PLoS Neglected Tropical Diseases. 8 (12), 3294(2014).
- Zhang, D., Lees, R. S., Xi, Z., Bourtzis, K., Gilles, J. R. Combining the sterile insect technique with the incompatible insect technique: III-Robust mating competitiveness of irradiated triple Wolbachia-infected Aedes albopictus males under semi-field conditions. PloS One. 11 (3), 0151864(2016).
- Fried, M. Determination of sterile-insect competitiveness. Journal of Economic Entomology. 64 (4), 869-872 (1971).
- Aviles, E. I., Rotenberry, R. D., Collins, C. M., Dotson, E. M., Benedict, M. Q. Fluorescent markers rhodamine B and uranine for Anopheles gambiae adults and matings. Malaria Journal. 19 (1), 236(2020).
- Johnson, B. J., et al. Use of rhodamine B to mark the body and seminal fluid of male Aedes aegypti for mark-release-recapture experiments and estimating efficacy of sterile male releases. PLoS Neglected Tropical Diseases. 11 (9), 0005902(2017).
- Fisher, P. Review of using rhodamine B as a marker for wildlife studies. Wildlife Society Bulletin. 27 (2), 318-329 (1999).
- Blanco, C. A., Perera, O., Ray, J. D., Taliercio, E., Williams, L. Incorporation of rhodamine B into male tobacco budworm moths Heliothis virescens to use as a marker for mating studies. Journal of Insect Science. 6, 5(2006).
- Mascari, T. M., Foil, L. D. Laboratory evaluation of the efficacy of fluorescent biomarkers for sugar-feeding sand flies (Diptera: Psychodidae). Journal of Medical Entomology. 47 (4), 664-669 (2014).
- Sarkar, D., Muthukrishnan, S., Sarkar, M. Fluorescent marked mosquito offer a method for tracking and study mosquito behaviour. International Journal of Mosquito Research. 4, 5-9 (2017).
- South, A., Sota, T., Abe, N., Yuma, M., Lewis, S. M. The production and transfer of spermatophores in three Asian species of Luciola fireflies. Journal of Insect Physiology. 54 (5), 861-866 (2008).
- Üner, O., Geçgel, Ü, Kolancilar, H., Bayrak, Y. Adsorptive removal of rhodamine B with activated carbon obtained from okra wastes. Chemical Engineering Communications. 204 (7), 772-783 (2017).
- Hagler, J. R., Jackson, C. G. Methods for marking insects: current techniques and future prospects. Annual Review of Entomology. 46, 511-543 (2001).
- Scolari, F., et al. Fluorescent sperm marking to improve the fight against the pest insect Ceratitis capitata (Wiedemann; Diptera: Tephritidae). New Biotechnology. 25 (1), 76-84 (2008).
- Ahmed, H. M. M., Hildebrand, L., Wimmer, E. A. Improvement and use of CRISPR/Cas9 to engineer a sperm-marking strain for the invasive fruit pest Drosophila suzukii. BMC Biotechnology. 19 (1), 85(2019).
- Botteon, V., Costa, M. L. Z., Kovaleski, A., Martinelli, L. A., Mastrangelo, T. Can stable isotope markers be used to distinguish wild and mass-reared Anastrepha fraterculus flies. PloS One. 13 (12), 0209921(2018).
- Hood-Nowotny, R., Mayr, L., Islam, A., Robinson, A., Caceres, C. Routine isotope marking for the Mediterranean fruit fly (Diptera: Tephritidae). Journal of Economic Entomology. 102 (3), 941-947 (2009).
- Schroeder, W. J., Mitchell, W. C. Marking Tephritidae fruit fly adults in Hawaii for release-recovery studies. Proceedings of the Hawaiian Entomological Society. 23 (3), 437-440 (1981).
- Akter, H., Taylor, P. W., Crisp, P. Visibility and persistence of fluorescent dyes, and impacts on emergence, quality, and survival of sterile Queensland fruit fly Bactrocera tryoni (Diptera: Tephritidae). Journal of Economic Entomology. 113 (6), 2800-2807 (2020).
- Oliva, C. F., Damiens, D., Benedict, M. Q. Male reproductive biology of Aedes mosquitoes. Acta Tropica. 132, Suppl 12-19 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon