Method Article
Usando o Corante Fluorescente, Rhodamine B, para estudar competitividade do acasalamento em mosquitos Aedes aegypti masculinos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para estudar a competitividade do Aedes aegypti masculino utilizando corante fluorescente como marcador. Mosquitos fêmeas são expostos a machos marcados e não marcados para cópula. Após o acasalamento, seus espermatozoides são examinados sob um microscópio de fluorescência para determinar seu parceiro de acasalamento.
Resumo
O sucesso de programas de supressão populacional estéril ou incompatível baseados em técnicas de insetos depende da capacidade dos machos soltos de competir por fêmeas do tipo selvagem e induzir a esterilidade na população-alvo. Assim, a avaliação laboratorial da competitividade do acasalamento masculino é essencial para avaliar a aptidão da cepa de liberação antes da liberação do campo. Convencionalmente, tal ensaio é realizado determinando a proporção de ovos viáveis produzidos pelas fêmeas após serem simultaneamente expostos a dois conjuntos de machos (tipo selvagem e cepas de liberação) para cópula. No entanto, esse processo é demorado e trabalhoso devido à necessidade de primeiro alimentar as fêmeas para a produção de ovos e, em seguida, eclodir e enumerar os ovos eclodidos para determinar a viabilidade dos ovos.
Além disso, este método não pode discernir o grau de competitividade entre duas linhas de mosquitos estéreis ou infectadas por Wolbachia,uma vez que mosquitos fêmeas do tipo selvagem só produzirão ovos não viáveis após o acasalamento com ambos. Para contornar essas limitações, este artigo descreve um método mais direto de medir a competitividade do acasalamento de mosquitos machos em ambientes laboratoriais usando o corante fluorescente, rhodamina B (RhB), que pode ser usado para marcar os machos alimentando-os em solução de sacarose contendo RhB. Após o ensaio de acasalamento, a presença de espermatozoides fluorescing na espermatozoide de uma fêmea pode ser usada para determinar seu parceiro de acasalamento. Este método é econômico, reduz o tempo experimental em 90% e permite a comparação da aptidão de acasalamento entre duas linhas estéreis ou infectadas por Wolbachia.
Introdução
A criação e liberação de machos estéreis ou incompatíveis para supressão de populações de mosquitos Aedes está sendo avaliada no campo como uma nova ferramenta para prevenir surtos de dengue e outras doenças transmitidas pelo Aedes1. As estratégias de supressão de liberação masculina que estão atualmente em ensaios de campo incluem o uso do método genético2, irradiação (Técnica de Insetos Estéreis, SIT)3, bactérias endossembióticas Wolbachia (Técnica Incompatível de Insetos, IIT)4, ou uma combinação das duas últimas técnicas5,6. O sucesso dessas abordagens depende em grande parte da capacidade dos machos soltos de superar os machos selvagens e procurar fêmeas para garantir a cópula. Caso contrário, a esterilidade não pode ser induzida na população-alvo.
Em um programa clássico de SIT, por exemplo, o aptidão para o acasalamento masculino pode ser afetado por fatores como a dose de irradiação7,8,9, protocolo de criação em massa e a extensão da endogamia na colônia10,11,12,13,14. Além disso, estudos sobre a competitividade do acasalamento podem fornecer conhecimentos importantes sobre o comportamento do acasalamento de mosquitos que poderiam ser usados para informar estratégias de controle de vetores.
No SIT e IIT, a competitividade do acasalamento dos mosquitos machos é tipicamente avaliada, permitindo que tanto o tipo selvagem quanto a cepa de liberação competem por fêmeas do tipo selvagem em uma gaiola8,11,15,16. As fêmeas são então alimentadas com sangue e seus ovos eclodiram para determinar a viabilidade. Acredita-se que fêmeas que colocam ovos ou ovos não viáveis com baixa taxa de escotilha tenham acasalado com machos de cepa de liberação, enquanto as fêmeas que produzem ovos viáveis são consideradas acasaladas com machos do tipo selvagem. A competitividade do acasalamento é então calculada com o Índice Frito17. Infelizmente, este método é intensivo em recursos e demorado, e o Índice Frito global pode ser influenciado por fatores de confusão externos que afetam a viabilidade dos ovos, como o mau manuseio de ovos e a dessecação excessiva podem resultar em uma baixa taxa de escotilha na cruz de compatibilidade que pode, então, levar a um índice frito artificialmente baixo.
Além disso, este método não permite a comparação direta da competitividade do acasalamento entre mosquitos Aedes que são infectados com diferentes cepas de Wolbachia ou que estão expostos a diferentes doses de irradiação. Por isso, é necessário um método mais direto para enfrentar esses desafios. Estudos recentes18,19 demonstraram a eficácia do uso do corante fluorescente, RhB, para marcar o fluido seminal dos mosquitos machos. O fluido seminal marcado é transferido e armazenado no espermatozoide do mosquito fêmea após o sucesso do acasalamento, permitindo a medição direta da interação de acasalamento feminino com machos marcados. Rhodamine B é um corante de fluorone reativa de tiool comumente usado como biomarcador para estudos de pesquisa ecológica e comportamental em animais, incluindo insetos20. Para estudos de mosquitos, o RhB é introduzido pela alimentação com água de açúcar ou mel contendo pó de RhB dissolvido18,19,21,22,23,24. Após a absorção, o corante RhB se liga a proteínas, manchando o tecido corporal com uma mancha rosa-avermelhada que fluoresce laranja brilhante sob uma fonte de luz fluorescente.
O forte sinal de fluorescência e estabilidade da marcação, juntamente com sua capacidade de manchar fluidos seminal de insetos, permite o monitoramento da transferência de fluido seminal marcado do macho rotulado para os órgãos de armazenamento de esperma do inseto feminino para estudos de acasalamento18,19,21,24. O uso de RhB em um ensaio de competitividade de acasalamento masculino não só permite a medição direta da interação de acasalamento de fêmeas com machos marcados e não marcados, mas os resultados também podem ser obtidos dentro de 24h, pois evita o processo de determinação da viabilidade do ovo, que normalmente requer cerca de 10 a 14 dias. Além disso, esse método supera a perda potencial de dados quando os mosquitos fêmeas não se alimentam ou morrem antes da oposição. Isso é particularmente crucial porque em ensaios semi-campo, onde mosquitos fêmeas são propensos a danos e morte durante a coleta pós-acasalamento usando uma mochila ou aspirador mecânico. Para abordar as limitações atuais do uso da fertilidade feminina, apresentamos um método alternativo que usa a coloração do RhB para medir diretamente a competitividade do acasalamento de mosquitos machos. O método simplifica o fluxo de trabalho, encurta o tempo experimental de cerca de duas semanas para um dia, permitindo que mais réplicas experimentais sejam realizadas e permite a comparação entre duas cepas de liberação. Este protocolo será adequado para laboratórios que estão embarcando em programas de supressão populacional de mosquitos baseados em liberação masculina, e pode ser usado para controle de qualidade de rotina e avaliação de tensão.
Protocolo
1. Criação de mosquitos
- Realizar toda a criação de mosquitos e a competitividade do acasalamento masculino ensaio sob condições insetívidas padrão de 27 ± 1 °C e 75-80% de umidade relativa, com um fotoperfeito de 12 h:12 h de luz: ciclos escuros.
- Designe os dois conjuntos de machos concorrentes como Conjunto A e Conjunto B para fácil referência na metodologia descrita neste artigo. Criar os mosquitos em condições padronizadas para garantir uma comparação justa de sua aptidão durante o ensaio. Crie os mosquitos a uma densidade larval de 500 larvas em 2 L de água e alimente-os com alimentos de peixe moído em pó ad libitum.
NOTA: Para a geração dos resultados representativos, o Conjunto A e o Conjunto B foram os machos de raça e outcross do Ae infectado por Wolbachia. Aegypti,respectivamente. - Sexo macho e fêmea mosquitos na fase pupal, e contê-los separadamente em gaiolas (ver a Tabela de Materiais) das dimensões W 32,5 cm x D 32,5 cm x H 32,5 cm, com tamanho de malha de 150 x 150 e 160 μm de abertura. Mantenha todos os mosquitos adultos com solução de sacarose de 10%.
2. Preparação de mosquitos machos e fêmeas
- Sexo os mosquitos machos e fêmeas na fase pupal de acordo com suas diferenças de tamanho (pupas machos sendo menores que pupas fêmeas) (Figura 1).
- Para cada conjunto de mosquitos (Conjunto A ou Conjunto B), transfira 100 pupas machos cada um em uma gaiola pré-rotulada para alimentação de sacarose ou alimentação de sacarose.
- Coloque a pupa fêmea em pequenos lotes de 40-50 por gaiola. Após o surgimento dos imagoes, verifique as gaiolas para a presença de mosquitos machos.
NOTA: Os mosquitos machos adultos são menores que as fêmeas e possuem antenas mais espessas e peluquenas(Figura 2). Use apenas mosquitos fêmeas virgens para os ensaios de competitividade de acasalamento. O uso de fêmeas pré-inseminadas tornará todos os dados resultantes inválidos. Assim, deve-se tomar cuidado extremo durante o sexing na fase pupa. Não use os mosquitos fêmeas de uma gaiola que foi contaminada com mosquitos machos. Gaiolas extras de fêmeas devem ser preparadas.
3. Preparação de 0,2% RhB - solução de sacarose
NOTA: RhB é um pó verde em forma seca e rosa-avermelhado em solução. Os equipamentos de proteção individual padrão (EPI: vestido de proteção laboratorial, luvas de nitríile e proteção ocular) devem ser usados ao manusear este produto químico. Para evitar a inalação, pese o pó rhb em um capô de fumaça.
- Para preparar uma solução de 0,2% c/v RhB-sacarose, dissolva 200 mg de pó de RhB para cada 100 mL de solução de 10% c/v/ sacarose. Misture bem para garantir que todo o pó seja dissolvido.
NOTA: Como o RhB é sensível à luz, use garrafas âmbar ou enrole garrafas claras completamente com papel alumínio.
4. Alimentação de mosquitos machos
NOTA: Os dados da otimização da alimentação de rhb-sacarose são apresentados em Material Suplementar, seção 1.
- Prepare 20 garrafas de alimentador de açúcar com um pavio. Adicione 10 mL de sacarose de 10% em 10 garrafas alimentadores e 10 mL de solução de 0,2% de rhb-sacarose nas outras 10 garrafas alimentadoras (use garrafas âmbar ou enrole as garrafas em papel alumínio).
- Coloque as garrafas alimentador nas respectivas gaiolas masculinas (5 garrafas por gaiola) preparadas nas etapas 2.2 e 2.3. Permita que os mosquitos machos se alimentem por três dias antes do experimento de acasalamento.
5. Verificando a fluorescência de RhB em mosquitos machos
- Aspirar mosquitos machos alimentados com rhb-sacarose, e observá-los sob um microscópio estéreo de fluorescência para garantir que todos os mosquitos machos alimentados com sacarose de RhB tenham sido marcados com sucesso com o RhB.
- Ligue a lâmpada do queimador de mercúrio e o microscópio estéreo. Deixe que a fonte de luz da lâmpada queimador de mercúrio estabilize por 10 minutos. Defina os filtros de fluorescência para proteína de fluorescência vermelha 1 (RFP1) (comprimento de onda de excitação 540 nm, comprimento de onda de emissão 625 nm).
- Aspire um pequeno número de mosquitos (quatro ou cinco) de cada vez no tubo de vidro do aspirador oral. Através do tubo de vidro, observe o corpo dos mosquitos machos sob o microscópio estéreo de fluorescência. Exclua mosquitos machos não marcados com RhB do experimento.
NOTA: O abdômen de mosquitos machos marcados com RhB aparecerá rosa sob luz branca(Figura 3A) e brilhará laranja brilhante sob luz fluorescente(Figura 3B). - Conjunto de transferência Um mosquito macho em 12 xícaras de papel presas com rede (tamanho de malha 150 x 150, 160 μm de abertura); 6 xícaras cada uma com 10 mosquitos machos alimentados com sacarose e as outras 6 xícaras cada uma com 10 mosquitos machos alimentados com sacarose. Repita este passo para os mosquitos machos do Conjunto B.
6. Ensaio de competitividade de acasalamento
- Configure 12 W 60 cm x D 60 cm x H 60 cm gaiolas com tamanho de malha 44 x 32, abertura de 650 μm para o ensaio de acasalamento. Em cada uma das seis gaiolas, incluem 10 mosquitos machos do Conjunto A (marcado por RhB), 10 mosquitos machos do Conjunto B (não marcado) e 10 mosquitos fêmeas fêmeas virgens. Nas outras seis gaiolas, incluem 10 mosquitos machos do Conjunto A (não marcado), 10 mosquitos machos do Conjunto B (marcado por RhB) e 10 mosquitos fêmeas fêmeas do tipo selvagem virgem. Rotule essas gaiolas para distinguir claramente entre as duas combinações de acasalamento.
NOTA: Com base na experiência, uma gaiola de 60 cm x 60 cm x 60 cm foi usada para o ensaio de acasalamento, pois uma gaiola menor pode incentivar o acasalamento misto. - Coloque as respectivas xícaras de machos preparadas na etapa 5.4 para as gaiolas de acasalamento de acordo com o rótulo da etapa 6.1. Retire a rede e bata suavemente no copo para tirar os machos da xícara. Remova cuidadosamente o copo de papel e a rede da gaiola para garantir que nenhum mosquito escape da gaiola. Permita que os mosquitos machos se aclimatar na gaiola de acasalamento por pelo menos uma hora.
- Usando um aspirador oral, transfira mosquitos fêmeas virgens em 12 xícaras de papel, com cada xícara contendo 10 mosquitos.
- Após o período de aclimatação para os mosquitos machos, transfira uma xícara de fêmeas para cada gaiola de acasalamento e remova a rede. Levemente sacudir o copo para encorajar qualquer mosquito fêmea restante para fora do copo. Remova cuidadosamente o copo de papel e a rede da gaiola para garantir que nenhum mosquito escape da gaiola.
- Permitir que o acasalamento ocorra por 3 h.
NOTA: A duração recomendada do acasalamento foi determinada através de observações prévias do tipo selvagem Ae. aegypti. Em experimentos envolvendo 10 fêmeas e 20 machos sendo realizados em uma gaiola de 60 cm x 60 cm x 60 cm, 90% de inseminação feminina foi alcançada em 3h (Material Suplementar, seção 2). Não perturbe a gaiola durante este período, pois a agitação pode levar ao acasalamento interrompido e misto. O acasalamento misto (onde a fêmea acasalou com machos marcados e não marcados) resulta em um viés em relação aos machos marcados por RhB, pois é difícil distinguir espermatozoides não marcados de espermas marcados por RhB sob um microscópio de fluorescência. - Para terminar o experimento de acasalamento, remova todos os mosquitos de cada gaiola usando um aspirador mecânico. Anestesia fria os mosquitos no gelo por pelo menos 5 minutos. Quando os mosquitos estiverem totalmente anestesiados, pegue delicadamente os mosquitos fêmeas e abriga-os em um copo de papel separado protegido com rede (tamanho de malha 150 x 150, 160 μm de abertura). Rotule o copo de papel transferindo o respectivo rótulo da gaiola de acasalamento para o copo de papel.
NOTA: É possível pausar o experimento neste momento e manter as fêmeas com solução de 10% de sacarose. O fluido seminal marcado por RhB permanecerá estável dentro da pasta feminina por pelo menos uma semana. É melhor manter as fêmeas vivas antes da dissecação, pois espécimes mortos e dessecados são difíceis de dissecar. - Para pontuar a fêmea espermatozoide, anestesia fria as fêmeas mosquitos no gelo por pelo menos 5 minutos antes da dissecação sob um microscópio estéreo(Vídeo 1). Examine a pasta de esperma sob um microscópio de luz composto (ampliação 100x) para seu status de inseminação(Figura 4). Para indivíduos inseminados, determine se a pasta de esperma contém fluido seminal marcado por RhB examinando-os sob o microscópio estéreo de fluorescência equipado com um filtro RFP1 e um sistema de imagem de câmera.
NOTA: Ao usar um microscópio estéreo de fluorescência com um sistema de imagem conectado, recomenda-se utilizar um tempo de exposição prolongada (5 s) para aumentar a sensibilidade à detecção. Se a fêmea do mosquito tiver acasalado com um macho marcado, sua espermatozoides fluorescerá laranja brilhante(Figura 5A). No entanto, se a fêmea do mosquito tiver acasalado com um macho não marcado, sua espermatozoide inseminada não fluoresce(Figura 5B).
7. Eliminação de resíduos de RhB
- Trate os resíduos aquosos de RhB com carbono ativado25 antes de descarregá-lo como águas residuais gerais. Descarte resíduos sólidos de RhB (mosquitos marcados com RhB, toalhas de papel e mechas encharcadas com RhB) como resíduos químicos. Don EPI padrão ao manusear resíduos de RhB.
Resultados
w AlbB-SG é uma linha localizada (Cingapura) Ae. aegypti infectada com a cepa wAlbB de Wolbachia. Utilizando o protocolo descrito neste artigo, avaliamos a competitividade do acasalamento masculino de uma linha de raça e uma linha outcrossed de wAlbB-SG para determinar se a endogamia resulta em uma perda na aptidão de acasalamento masculino. A linha de raça foi mantida por 11 gerações no inseto, enquanto a linha atravessada foi gerada por backcrossing das fêmeas com ae macho selvagem. aegypti. Machos das linhas de raça e saída foram competidos uns contra os outros por acasalamento com fêmea selvagem tipo selvagem Ae. aegypti. O ensaio de competitividade de acasalamento foi realizado em triplicado.
Os resultados indicaram que o RhB não afetou a aptidão dos machos, pois os dados de inseminação feminina não foram tendenciosos para ou contra o acasalamento com machos alimentados com rhb -sacarose(Tabela 1 e Figura 6) Como o RhB não afeta a aptidão de acasalamento dos machos, procedemos a analisar os dados com base na porcentagem de fêmeas inseminadas acasaladas pela linha inexerida ou outcross (Tabela 2 e Figura 7). O resultado em todos os triplicados experimentais foi consistente; houve uma porcentagem significativamente maior de fêmeas acasaladas com os machos outcross do que com os machos de raça nas três réplicas (P ≤ 0,05, Mann-Whitney U-teste). Esses resultados sugerem uma perda potencial no condicionamento físico do acasalamento masculino após várias gerações de endogamia em laboratório.

Figura 1: Visão lateral do macho (esquerda) e feminino (direita) Pupae Aedes aegypti. Sob as mesmas condições de criação, o Ae. aegypti pode ser sexado na fase pupal de acordo com o tamanho; os machos são significativamente menores que as fêmeas. Clique aqui para ver uma versão maior desta figura.
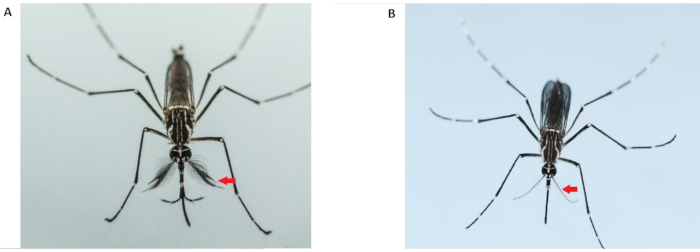
Figura 2: Diferenciação dos adultos do Aedes aegypti masculino (esquerda) e feminino (direita). Mosquitos machos adultos (à esquerda) têm antenas mais espessas e peluqueas que a fêmea adulta; as setas vermelhas indicam as antenas. Clique aqui para ver uma versão maior desta figura.
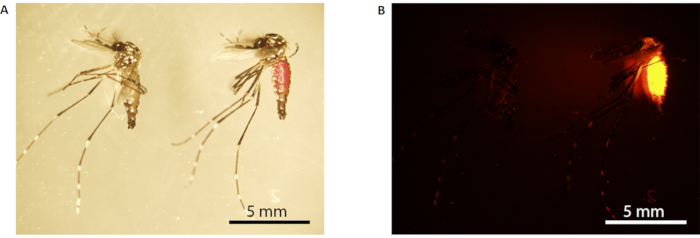
Figura 3: Marcação rhodamina B do mosquito macho. (A) Microscopia leve; (B) microscopia de fluorescência. O mosquito à esquerda não é identificado (alimentado com 10% de surose), enquanto o da direita está marcado (alimentado com 0,2% de rhb-sacarose). Mosquitos marcados têm um abdômen rosa visível sob luz branca (o mosquito à direita em A),que fluoresce laranja brilhante sob microscopia de fluorescência(B). Barras de escala = 5 mm. Abreviação: RhB = Rhodamine B. Clique aqui para ver uma versão maior desta figura.
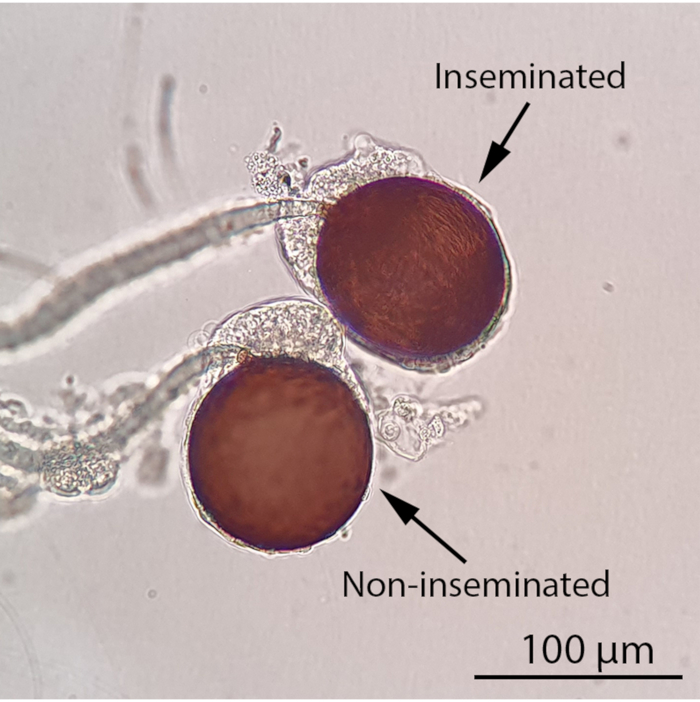
Figura 4: Espermatozoides fêmeas inseminadas e não inseminadas sob um microscópio de luz composto (ampliação de 100x). O status de inseminação de um mosquito fêmea pode ser determinado observando seu espermatozoide sob um microscópio de luz composto. Um mosquito fêmea inseminado conterá pelo menos uma espermatozoide preenchida, enquanto todos os três espermatozoides de um mosquito fêmea não inseminado estarão vazios. O esperma moído em forma de rosca será visível em uma espermatozoide preenchida sob um microscópio de luz composto. Barra de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.

Figura 5: Fêmea do mosquito espermatozoide inseminada com fluidos seminais sob um microscópio estéreo fluorescência. (A) Marcado por RhB e (B) espermatozoides não marcados inseminadas com fluidos seminal marcados por RhB fluorescem laranja brilhante sob microscopia de fluorescência. Barras de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
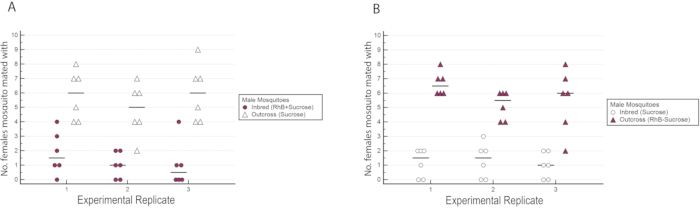
Figura 6: Número de fêmeas do tipo selvagem inseminadas pelos machos de raça ou outcross nos triplicados experimentais com marcação recíproca. (A) Os machos de raça foram marcados com RhB enquanto os machos de salto foram não marcados. (B) Os machos de outcross foram marcados com RhB, enquanto os machos de raça não foram marcados. Observou-se que um maior número de fêmeas acasalou com machos de cross, independentemente de seu status de marcação. Clique aqui para ver uma versão maior desta figura.
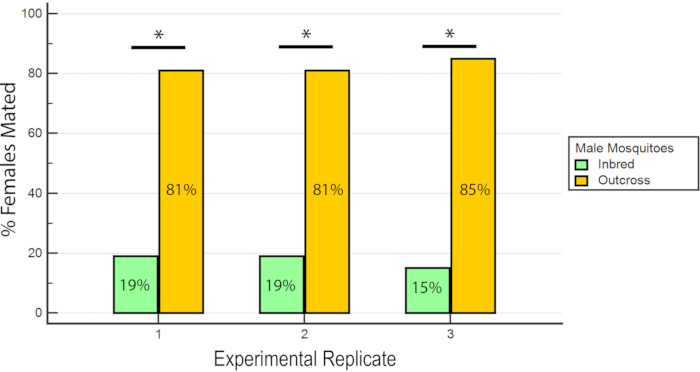
Figura 7: Proporção de fêmeas inseminadas acasaladas com machos de raça ou outcross nas 3 réplicas experimentais. Para cada réplica experimental, há uma porcentagem significativamente maior de fêmeas acasaladas com os machos outcross (P ≤ 0,05, Mann-Whitney U-test). Clique aqui para ver uma versão maior desta figura.
Vídeo 1: Dissecção do Aedes aegypti feminino para espermatozoides sob um microscópio estéreo leve. Clique aqui para baixar este vídeo.
| ♀ x Inbred (RhB) ♂ um | ♀ x Outcross (sem marcação) ♂ b | ♀ x Inbred (sem marcação) ♂ c | ♀ x Outcross (RhB) ♂ d | Taxa global de inseminação (a+b+c+d/120) | |
| Replicar 1 | 11 | 35 | 7 | 40 | 77.5% (93/120) |
| Replicar 2 | 6 | 29 | 8 | 31 | 61.7% (74/120) |
| Replicar 3 | 6 | 36 | 6 | 33 | 67.5% (81/120) |
Tabela 1: Número de fêmeas acasaladas com rhb-marcado e não marcado wAlbB-Sg Aedes aegypti inbred e outcross machos. Foram utilizadas 120 fêmeas em cada réplica.
| Por cento de fêmeas inseminadas | ||
| Machos de raça | Machos de outcross | |
| Replicar 1 | 19% (18/93) | 81% (75/93) |
| Replicar 2 | 19% (14/74) | 81% (60/74) |
| Replicar 3 | 15% (12/81) | 85% (69/81) |
Tabela 2: Percentual de fêmeas inseminadas acasaladas com wAlbB-Sg Aedes aegypti inbred e outcross machos.
Figura Suplementar S1: Comparação do fluxo de trabalho para o ensaio de competitividade de acasalamento baseado em RhB e convencional. Em comparação com o ensaio convencional de competitividade do acasalamento, o fluxo de trabalho simplificado e encurtado para o ensaio de competitividade de acasalamento baseado em RhB reduz significativamente a duração experimental. Clique aqui para baixar este Arquivo.
Figura Suplementar S2: Kaplan Meier curvas de sobrevivência do adulto masculino Aedes aegypti durante e após a alimentação com 0,2% e 0,4% rhodamina B-alimentaçãode sacarose. Por cento de sobrevida do (A)tipo selvagem masculino e (B) wAlbB-Sg Ae. aegypti durante e após três dias de alimentação em 0,2% e 0,4% RhB-sacarose, em comparação com os controles que foram alimentados apenas com sacarose. Clique aqui para baixar este Arquivo.
Tabela suplementar S1: Taxa de inseminação de fêmeas em uma gaiola W 60 cm x D 60 cm x H 60 cm (razão de 10 fêmeas a 20 machos) em 1-, 2-, e 3h pontos de tempo. Clique aqui para baixar esta Tabela.
Discussão
A marcação é comumente usada em pesquisas entomológicas para estudar a dinâmica populacional de insetos, dispersão, comportamento e biologia do acasalamento26. Nos programas SIT e IIT, a marcação é realizada para diferenciar a cepa de liberação da população de campo para estudar sua dispersão e otimizar a razão de liberação. Os métodos de marcação utilizados incluem marcação genética27,28, incorporação de isótopos em alimentos larvais29,30, pó fluorescente31e corante32. Para a supressão de populações de mosquitos que utilizam SIT ou IIT, onde o acoplamento masculino é um componente crítico, corantes fluorescentes têm sido usados como marcadores para estudar a biologia do acasalamento de mosquitos18,19.
Convencionalmente, a avaliação da competitividade do acasalamento masculino da cepa de liberação tem sido avaliada utilizando ensaios de fertilidade feminina. No entanto, este ensaio é demorado e intensivo em mão-de-obra devido aos processos experimentais a jusante pós-acasalamento(Figura Suplementar S1). Esses processos incluem alimentação sanguínea das fêmeas, coleta de ovos, eclosão dos ovos e enumeração da proporção de ovos eclodidos para determinar a viabilidade dos ovos. Em média, este ensaio requer 30 horas-homem e duas semanas de trabalho experimental (a partir da criação das gaiolas de ensaio de competitividade) até a determinação final da competitividade do acasalamento masculino.
seu artigo apresenta o uso de um corante fluorescente, RhB, (alimentado como 0,2% rhb-sacarose para os mosquitos, Figura Suplementar S2) para medir diretamente as interações de acasalamento entre fêmeas e machos marcados por RhB. Embora este protocolo exija um microscópio estéreo de fluorescência, ele evita a necessidade de realizar os procedimentos experimentais demorados mencionados acima. Em média, este ensaio baseado em RhB requer aproximadamente 10 horas-homem e cerca de um dia para obter dados equivalentes aos de ensaios de fertilidade feminina. Isso > 90% de economia de tempo permite que pesquisadores realizem múltiplas réplicas experimentais, proporcionando uma validação mais robusta do aptidão masculina de acasalamento. Além disso, este ensaio pode ser usado para comparar a competitividade do acasalamento entre duas linhas de mosquitos estéreis ou infectados por Wolbachia.
Esse tipo de comparação não é possível com os ensaios convencionais de fertilidade feminina, pois as fêmeas produziriam ovos não viáveis ao acasalar com ambas as linhas. Não obstante, qualquer acasalamento misto no experimento resultará em viés em relação à população marcada, pois é difícil identificar espermatozoides não marcados em espermatozoides fêmeas que contêm fluido seminal tanto de machos marcados por RhB quanto não marcados. Uma conclusão semelhante foi feita em estudo que avaliou a competitividade do acasalamento de Anopheles gambiae utilizando RhB18, pelo qual uma maior proporção de fêmeas no ensaio de acasalamento foi encontrada acasalada por machos marcados. Como a poliandria é mais provável de ocorrer em fêmeas que anteriormente haviam se envolvido em um acasalamento interrompido33, a probabilidade de isso ocorrer foi reduzida neste estudo por meio do uso de menos mosquitos (20 machos a 10 fêmeas) em um volume maior de gaiola (0,216 m3) nesses experimentos.
Os resultados não mostraram viés em relação à população marcada por RhB, indicando que o acasalamento misto era limitado. Em resumo, a incorporação do RhB para marcar os machos em um ensaio de competitividade de acasalamento é uma maneira econômica e rápida de avaliar o condicionamento físico do acasalamento masculino. Este método também permite a comparação direta da competitividade do acasalamento entre machos expostos a diferentes doses de irradiação, criados em diferentes regimes de criação, ou aqueles infectados com diferentes cepas de Wolbachia,tornando-se uma ferramenta valiosa para a avaliação da aptidão de acasalamento masculino para qualquer programa de supressão populacional de mosquitos baseado em liberação masculina.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Este estudo foi financiado pela Agência Nacional do Meio Ambiente (NEA), em Cingapura. Agradecemos ao sr. Chew Ming Fai, Vice-Diretor Executivo (Saúde Pública), NEA, por sua aprovação para publicar o estudo, e A/Prof Ng Lee Ching, Diretor do Grupo (Environmental Health Institute Group), NEA, por seu apoio neste estudo. Agradecemos também ao Dr. Shuzhen Sim e à Dra Denise Tan por revisarem o manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Compound light microscope | Olympus | CX23 | To score for spermathecae insemination |
| Dissection forceps | Bioquip | Rubis forceps (4524) | |
| Fluorescence stereo-light microscope with RFP1 filter | Olympus | SZX16 | To check for Rhodamine B fluorescence signal |
| Mosquito cages | Bugdorm | 4F3030 | W 32.5 cm x D 32.5 cm x H 32.5 cm; mesh size of 150 x 150; 160 µm aperture For holding of male and female adult mosquitoes prior to mating assay |
| 6M610 | W 60 cm x D 60 cm x H 60 cm; mesh size of 44 x 32; 650 µm aperture For mating competitiveness assay | ||
| Mosquito netting | 150 x 150, 160 µm aperture | ||
| Rhodamine B | Sigma Aldrich | R6626 | ≥95% (HPLC) |
| Stereo-light microscope | Olympus | SZ61 | For spermathecae dissection |
| Sucrose | MP Biomedicals | SKU 029047138 | Food grade |
| TetraMin tropical flakes | Tetra | 77101 | Fish food for feeding larvae |
Referências
- Achee, N. L., et al. A critical assessment of vector control for dengue prevention. PLoS Neglected Tropical Diseases. 9 (5), 0003655(2015).
- Carvalho, D. O., et al. Suppression of a field population of Aedes aegypti in Brazil by sustained release of transgenic male mosquitoes. PLoS Neglected Tropical Diseases. 9 (7), 0003964(2015).
- Lees, R. S., Gilles, J. R. L., Hendrichs, J., Vreysen, M. J. B., Bourtzis, K. Back to the future: the sterile insect technique against mosquito disease vectors. Current Opinion in Insect Science. 10, 156-162 (2015).
- Bourtzis, K., et al. Harnessing mosquito-Wolbachia symbiosis for vector and disease control. Acta Tropica. 132, 150-163 (2014).
- Zhang, D., Lees, R. S., Xi, Z., Gilles, J. R. L., Bourtzis, K. Combining the sterile insect technique with Wolbachia-based approaches: II--A safer approach to Aedes albopictus population suppression programmes, designed to minimize the consequences of inadvertent female release. PloS One. 10 (8), 0135194(2015).
- Zheng, X., et al. Incompatible and sterile insect techniques combined eliminate mosquitoes. Nature. 572 (7767), 56-61 (2019).
- Balestrino, F., et al. Gamma ray dosimetry and mating capacity studies in the laboratory on Aedes albopictus males. Journal of Medical Entomology. 47 (4), 581-591 (2010).
- Bellini, R., et al. Mating competitiveness of Aedes albopictus radio-sterilized males in large enclosures exposed to natural conditions. Journal of Medical Entomology. 50 (1), 94-102 (2013).
- Helinski, M. E., Parker, A. G., Knols, B. G. Radiation biology of mosquitoes. Malaria Journal. 8, Suppl 2 6(2009).
- Aldersley, A., et al. Too "sexy" for the field? Paired measures of laboratory and semi-field performance highlight variability in the apparent mating fitness of Aedes aegypti transgenic strains. Parasites & Vectors. 12 (1), 357(2019).
- Axford, J. K., Ross, P. A., Yeap, H. L., Callahan, A. G., Hoffmann, A. A. Fitness of wAlbB Wolbachia infection in Aedes aegypti: parameter estimates in an outcrossed background and potential for population invasion. The American Journal of Tropical Medicine and Hygiene. 94 (3), 507-516 (2016).
- Benedict, M. Q., et al. Colonisation and mass rearing: learning from others. Malaria Journal. 8 (2), 4(2009).
- Ross, P. A., Axford, J. K., Richardson, K. M., Endersby-Harshman, N. M., Hoffmann, A. A. Maintaining Aedes aegypti mosquitoes infected with Wolbachia. Journal of Visualized Experiments: JoVE. (126), e56124(2017).
- Ross, P. A., Endersby-Harshman, N. M., Hoffmann, A. A. A comprehensive assessment of inbreeding and laboratory adaptation in Aedes aegypti mosquitoes. Evolutionary Applications. 12 (3), 572-586 (2019).
- Segoli, M., Hoffmann, A. A., Lloyd, J., Omodei, G. J., Ritchie, S. A. The effect of virus-blocking Wolbachia on male competitiveness of the dengue vector mosquito, Aedes aegypti. PLoS Neglected Tropical Diseases. 8 (12), 3294(2014).
- Zhang, D., Lees, R. S., Xi, Z., Bourtzis, K., Gilles, J. R. Combining the sterile insect technique with the incompatible insect technique: III-Robust mating competitiveness of irradiated triple Wolbachia-infected Aedes albopictus males under semi-field conditions. PloS One. 11 (3), 0151864(2016).
- Fried, M. Determination of sterile-insect competitiveness. Journal of Economic Entomology. 64 (4), 869-872 (1971).
- Aviles, E. I., Rotenberry, R. D., Collins, C. M., Dotson, E. M., Benedict, M. Q. Fluorescent markers rhodamine B and uranine for Anopheles gambiae adults and matings. Malaria Journal. 19 (1), 236(2020).
- Johnson, B. J., et al. Use of rhodamine B to mark the body and seminal fluid of male Aedes aegypti for mark-release-recapture experiments and estimating efficacy of sterile male releases. PLoS Neglected Tropical Diseases. 11 (9), 0005902(2017).
- Fisher, P. Review of using rhodamine B as a marker for wildlife studies. Wildlife Society Bulletin. 27 (2), 318-329 (1999).
- Blanco, C. A., Perera, O., Ray, J. D., Taliercio, E., Williams, L. Incorporation of rhodamine B into male tobacco budworm moths Heliothis virescens to use as a marker for mating studies. Journal of Insect Science. 6, 5(2006).
- Mascari, T. M., Foil, L. D. Laboratory evaluation of the efficacy of fluorescent biomarkers for sugar-feeding sand flies (Diptera: Psychodidae). Journal of Medical Entomology. 47 (4), 664-669 (2014).
- Sarkar, D., Muthukrishnan, S., Sarkar, M. Fluorescent marked mosquito offer a method for tracking and study mosquito behaviour. International Journal of Mosquito Research. 4, 5-9 (2017).
- South, A., Sota, T., Abe, N., Yuma, M., Lewis, S. M. The production and transfer of spermatophores in three Asian species of Luciola fireflies. Journal of Insect Physiology. 54 (5), 861-866 (2008).
- Üner, O., Geçgel, Ü, Kolancilar, H., Bayrak, Y. Adsorptive removal of rhodamine B with activated carbon obtained from okra wastes. Chemical Engineering Communications. 204 (7), 772-783 (2017).
- Hagler, J. R., Jackson, C. G. Methods for marking insects: current techniques and future prospects. Annual Review of Entomology. 46, 511-543 (2001).
- Scolari, F., et al. Fluorescent sperm marking to improve the fight against the pest insect Ceratitis capitata (Wiedemann; Diptera: Tephritidae). New Biotechnology. 25 (1), 76-84 (2008).
- Ahmed, H. M. M., Hildebrand, L., Wimmer, E. A. Improvement and use of CRISPR/Cas9 to engineer a sperm-marking strain for the invasive fruit pest Drosophila suzukii. BMC Biotechnology. 19 (1), 85(2019).
- Botteon, V., Costa, M. L. Z., Kovaleski, A., Martinelli, L. A., Mastrangelo, T. Can stable isotope markers be used to distinguish wild and mass-reared Anastrepha fraterculus flies. PloS One. 13 (12), 0209921(2018).
- Hood-Nowotny, R., Mayr, L., Islam, A., Robinson, A., Caceres, C. Routine isotope marking for the Mediterranean fruit fly (Diptera: Tephritidae). Journal of Economic Entomology. 102 (3), 941-947 (2009).
- Schroeder, W. J., Mitchell, W. C. Marking Tephritidae fruit fly adults in Hawaii for release-recovery studies. Proceedings of the Hawaiian Entomological Society. 23 (3), 437-440 (1981).
- Akter, H., Taylor, P. W., Crisp, P. Visibility and persistence of fluorescent dyes, and impacts on emergence, quality, and survival of sterile Queensland fruit fly Bactrocera tryoni (Diptera: Tephritidae). Journal of Economic Entomology. 113 (6), 2800-2807 (2020).
- Oliva, C. F., Damiens, D., Benedict, M. Q. Male reproductive biology of Aedes mosquitoes. Acta Tropica. 132, Suppl 12-19 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados