Method Article
Использование флуоресцентного красителя Родамин B для изучения конкурентоспособности спаривания у самцов комаров Aedes aegypti
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем протокол изучения конкурентоспособности спаривания самцов Aedes aegypti с использованием флуоресцентного красителя в качестве маркера. Самки комаров подвергаются воздействию как маркированных, так и немаркированных самцов для совокупления. После спаривания их сперматеки исследуются под флуоресцентным микроскопом, чтобы определить их партнера по спариванию.
Аннотация
Успех программ подавления популяций, основанных на методах стерильных или несовместимых насекомых, зависит от способности выпущенных самцов конкурировать за самок дикого типа и вызывать бесплодие в целевой популяции. Следовательно, лабораторная оценка конкурентоспособности самцов в спаривании имеет важное значение для оценки пригодности штамма высвобождения до выхода в поле. Обычно такой анализ выполняется путем определения доли жизнеспособных яиц, произведенных самками после одновременного воздействия двух наборов самцов (штаммов дикого типа и высвобождения) для совокупления. Однако этот процесс является трудоемким и трудоемким из-за необходимости сначала кормить кровью самок для производства яиц, а затем высиживать и перечислять вылупившиеся яйца для определения жизнеспособности яиц.
Кроме того, этот метод не может определить степень конкурентоспособности между двумя стерильными или зараженными Wolbachiaлиниями комаров, поскольку самки комаров дикого типа будут производить нежидкие яйца только при спаривании с обоими. Чтобы обойти эти ограничения, в этой статье описывается более прямой метод измерения конкурентоспособности спаривания самцов комаров в лабораторных условиях с использованием флуоресцентного красителя родамин B (RhB), который можно использовать для маркировки самцов путем кормления их раствором сахарозы, содержащим RhB. После брачного анализа наличие флуоресцентных сперматозоидов в сперматеках самки может быть использовано для определения ее партнера по спаривательству. Этот метод является экономически эффективным, сокращает время эксперимента на 90% и позволяет сравнивать брачную пригодность между двумя стерильными или Wolbachia-инфицированнымилиниями.
Введение
Выращивание и выпуск стерильных или несовместимых самцов для подавления популяций комаров Aedes в настоящее время оценивается в полевых условиях в качестве нового инструмента для предотвращения вспышек лихорадки денге и других заболеваний, переносимых Aedes1. Стратегии подавления высвобождения мужчин, которые в настоящее время находятся в полевых испытаниях, включают использование генетического метода2,облучение (Sterile Insect Technique, SIT)3,эндосимбиотических бактерий Wolbachia (Insect Incompatible Technique, IIT)4или комбинацию последних двух методов5,6. Успех этих подходов во многом зависит от способности освобожденных самцов превзойти самцов дикого типа и искать самок для обеспечения совокупления. В противном случае бесплодие не может быть вызвано в целевой популяции.
В классической программе SIT, например, на брачную пригодность самцов могут влиять такиефакторы,как доза облучения7,8,9,протокол массового выращивания и степень инбридинга в колонии10,11,12,13,14. Кроме того, исследования конкурентоспособности спаривания могут дать важные знания о брачном поведении комаров, которые могут быть использованы для информирования о стратегиях борьбы с переносчиками.
В SIT и IIT конкурентоспособность самцов комаров обычно оценивается, позволяя как диким, так и высвобождающим штаммам конкурировать за самок дикого типа в клетке8,11,15,16. Затем самок кормят кровью, а их яйца вылупляются для определения жизнеспособности. Предполагается, что самки, которые откладывают нежизрелые яйца или яйца с низкой скоростью вылупления, спаривались с самцами штамма высвобождения, в то время как самки, которые производят жизнеспособные яйца, предположительно спаривались с самцами дикого типа. Затем конкурентоспособность спаривания рассчитывается с помощью индекса Жары17. К сожалению, этот метод является ресурсоемким и трудоемким, и на общий индекс Жары может влиять внешние смешанные факторы, влияющие на жизнеспособность яиц, такие как плохая обработка яиц и чрезмерное высыхание, что может привести к низкой скорости вылупления в кроссе совместимости, что может привести к искусственно заниженному индексу Жареного.
Кроме того, этот метод не позволяет проводить прямое сравнение конкурентоспособности спаривания между комарами Aedes, которые заражены различными штаммами Wolbachia или подвергаются различным дозам облучения. Следовательно, для решения этих проблем требуется более прямой метод. Недавние исследования18,19 продемонстрировали эффективность использования флуоресцентного красителя RhB для маркировки семенной жидкости самцов комаров. Маркированная семенная жидкость переносится и хранится в сперматеках самок комаров после успешного спаривания, что позволяет напрямую измерять брачное взаимодействие самок с отмеченными самцами. Родамин B является тиол-реактивным фтороновым красителем, обычно используемым в качестве биомаркера для экологических и поведенческих исследований на животных, включая насекомых20. Для исследований комаров RhB вводят путем кормления сахаром или медовой водой, содержащей растворенный порошок RhB18,19,21,22,23,24. При поглощении rhB-краситель связывается с белками, окрашивая ткани тела красновато-розовым пятном, которое флуоресцирует ярко-оранжевым под флуоресцентным источником света.
Сильный флуоресцентный сигнал и стабильность маркировки в сочетании с ее способностью окрашивать семенные жидкости насекомых позволяют осуществлять мониторинг переноса выраженной семенной жидкости от меченого самца к органам хранения спермы самки насекомого для брачных исследований18,19,21,24. Использование RhB в анализе конкурентоспособности спаривания самцов не только позволяет напрямую измерить брачное взаимодействие самок с отмеченными и немаркированными самцами, но результаты также могут быть получены в течение 24 ч, поскольку это устраняет процесс определения жизнеспособности яйца, который обычно занимает от 10 до 14 дней. Кроме того, этот метод преодолевает потенциальную потерю данных, когда самки комаров не питаются кровью или умирают до яйцекладки. Это особенно важно, потому что в полуполовых испытаниях, где самки комаров склонны к повреждениям и смерти во время сбора после спаривания с использованием рюкзака или механического аспиратора. Чтобы устранить существующие ограничения использования женской фертильности, мы представляем альтернативный метод, который использует окрашивание RhB для непосредственного измерения конкурентоспособности спаривания самцов комаров. Метод упрощает рабочий процесс, сокращает время эксперимента примерно с двух недель до одного дня, что позволяет проводить больше экспериментальных реплик и позволяет сравнивать два штамма высвобождения. Этот протокол будет подходить для лабораторий, которые приступают к программам подавления популяции комаров на основе высвобождения самцов, и может использоваться для рутинного контроля качества и оценки штаммов.
протокол
1. Выращивание комаров
- Проводят все виды комаров и спаривания самцов в стандартных инсектарных условиях 27 ± 1 °C и относительной влажности 75-80%, с фотопериодом 12 ч:12 ч света: темные циклы.
- Обозначьте две группы конкурирующих самцов как Set A и Set B для удобства использования в методологии, описанной в этой статье. Выращиваете комаров в стандартизированных условиях, чтобы обеспечить справедливое сравнение их пригодности во время анализа. Выращивайте комаров при плотности личинок 500 личинок в 2 л воды и кормите их порошком корма для молотой рыбы ad libitum.
ПРИМЕЧАНИЕ: Для получения репрезентативных результатов Набор А и Набор В были инбредными и ауткроссными самцами Вольбахии,инфицированными Ae. Аегипти,соответственно. - Половые самцы и самки комаров на стадии куколки, и содержат их отдельно в клетках (см. Таблицу материалов)размерами Ш 32,5 см х Г 32,5 см х В 32,5 см, с размером ячеек 150 х 150 и диафрагмой 160 мкм. Поддерживайте всех взрослых комаров 10% раствором сахарозы.
2. Подготовка самцов и самок комаров
- Пол самцов и самок комаров на стадии куколки в соответствии с их различиями в размерах (самцы куколок меньше самок)(рисунок 1).
- Для каждого набора комаров (Set A или Set B) перенесите по 100 куколок мужского пола в предварительно маркированную клетку для кормления сахарозой или rhB-сахарозы.
- Поместите куколок самок небольшими партиями по 40-50 штук в клетку. При появлении имаго проверьте клетки на наличие самцов комаров.
ПРИМЕЧАНИЕ: Взрослые самцы комаров меньше самок и имеют более кустистые и волосатые усики(рисунок 2). Используйте только девственных самок комаров для анализа конкурентоспособности спаривания. Использование предварительно оплодотворенных самок сделает все полученные данные недействительными. Таким образом, необходимо проявлять крайнюю осторожность во время сексинга на стадии куколок. Не используйте самок комаров из клетки, которая была загрязнена самцами комаров. Дополнительные клетки самок должны быть подготовлены.
3. Приготовление 0,2% RhB - раствора сахарозы
ПРИМЕЧАНИЕ: RhB представляет собой зеленый порошок в сухом виде и красновато-розовый в растворе. При обращении с этим химическим веществом следует носить стандартные средства индивидуальной защиты (СИЗ: лабораторный защитный халат, нитриловые перчатки и средства защиты глаз). Чтобы избежать вдыхания, взвесьте порошок RhB в вытяжном капюшоне.
- Для приготовления 0,2% мас./об.раствора RhB-сахарозы растворяют 200 мг порошка RhB на каждые 100 мл 10% мас./об./раствор сахарозы. Хорошо перемешайте, чтобы весь порошок растворился.
ПРИМЕЧАНИЕ: Поскольку RhB светочувствительна, используйте янтарные бутылки или полностью оберните прозрачные бутылки алюминиевой фольгой.
4. Кормление самцов комаров
ПРИМЕЧАНИЕ: Данные оптимизации кормления RhB-сахарозы представлены в Дополнительном материале, раздел 1.
- Приготовьте 20 бутылочек для кормления сахаром с фитилем. Добавьте 10 мл 10% сахарозы в 10 бутылок для кормления и 10 мл 0,2% раствора RhB-сахарозы в другие 10 бутылок для кормления (используйте янтарные бутылки или заверните бутылки в алюминиевую фольгу).
- Поместите бутылочки для кормления в соответствующие мужские клетки (по 5 бутылок на клетку), приготовленные на этапах 2.2 и 2.3. Дайте самкам комаров кормиться в течение трех дней до брачного эксперимента.
5. Проверка флуоресценции RhB у самцов комаров
- Аспирировать самцов комаров, питаемых RhB-сахарозой, и наблюдать за ними под флуоресцентным стереомикроскопом, чтобы убедиться, что все самцы комаров, откормленные RhB-сахарозой, были успешно отмечены RhB.
- Включите ртутную лампу горелки и стереомикроскоп. Дайте источнику света ртутной горелки стабилизироваться в течение 10 минут. Установите флуоресцентные фильтры для красного флуоресцентного белка 1 (RFP1) (длина волны возбуждения 540 нм, длина волны излучения 625 нм).
- Аспирировать небольшое количество комаров (четыре или пять) за раз в стеклянную трубку перорального аспиратора. Через стеклянную трубку наблюдайте за телом самцов комаров под флуоресцентным стереомикроскопом. Исключите из эксперимента самцов комаров, не отмеченных RhB.
ПРИМЕЧАНИЕ: Брюшко самцов комаров, отмеченных RhB, будет выглядеть розовым при белом свете(рисунок 3A)и светиться ярко-оранжевым при флуоресцентном свете(рисунок 3B). - Перенос набора самцов комаров в 12 бумажных стаканчиков, закрепленных сеткой (размер сетки 150 х 150, диафрагма 160 мкм); 6 чашек каждая с 10 самцами комаров, вскармливаемых сахарозой, и остальные 6 чашек с 10 самцами комаров, вскармливаемых RhB-сахарозой. Повторите этот шаг для самцов комаров Set B.
6. Анализ конкурентоспособности спаривания
- Установите клетки 12 Вт 60 см x Г 60 см x В 60 см с размером ячеек 44 x 32, 650 мкм апертурой для брачного анализа. В каждую из шести клеток входят 10 самцов комаров Set A (с rhB-маркировкой), 10 самцов комаров Set B (без маркировки) и 10 девственных комаров дикого типа. В остальные шесть клеток входят 10 самцов комаров Set A (без маркировки), 10 самцов комаров Set B (с rhB-маркировкой) и 10 девственных комаров дикого типа. Маркировка этих клеток, чтобы четко различать две брачные комбинации.
ПРИМЕЧАНИЕ: Исходя из опыта, клетка размером 60 см х 60 см х 60 см использовалась для брачного анализа, поскольку меньшая клетка может способствовать смешанному спаривателью. - Поместите соответствующие чашки самцов, подготовленные на этапе 5.4, в клетки для спаривания в соответствии с этикеткой на этапе 6.1. Снимите сетку и осторожно постучите по чашке, чтобы вытолкнуть самцов из чашки. Осторожно извлеките бумажный стаканчик и сетку из клетки, чтобы комары не вырвались из клетки. Позвольте самцу комаров акклиматизироваться в брачной клетке не менее часа.
- Используя пероральный аспиратор, переведите девственных комаров дикого типа в 12 бумажных стаканчиков, каждая из которых содержит 10 комаров.
- После периода акклиматизации самцов комаров перенесите одну чашку самок в каждую брачный клетку и снимите сетку. Осторожно толкайте чашку, чтобы побудить всех оставшихся самок комаров выйти из чашки. Осторожно извлеките бумажный стаканчик и сетку из клетки, чтобы комары не вырвались из клетки.
- Дайте спариваться в течение 3 ч.
ПРИМЕЧАНИЕ: Рекомендуемая продолжительность спаривания была определена путем предварительных наблюдений за диким типом Ae. aegypti. В экспериментах с участием 10 самок и 20 самцов, удерживаемых в клетке 60 см х 60 см х 60 см, 90% женского оплодотведения было достигнуто за 3 ч(Дополнительный материал, раздел 2). Не беспокойте клетку в этот период, так как возбуждение может привести к прерванной и смешанной спариванию. Смешанное спаривание (когда самка спаривалась как с отмеченными, так и с немаркированными самцами) приводит к смещению в сторону самцов с маркировкой RhB, поскольку трудно отличить немаркированные сперматозоиды от сперматозоидов с rhB-маркировкой под флуоресцентным микроскопом. - Чтобы завершить брачный эксперимент, удалите всех комаров из каждой клетки с помощью механического аспиратора. Холодный обезболивает комаров на льду не менее 5 минут. Когда комары будут полностью обезболиваться, осторожно подберите самок комаров и поместите их в отдельный бумажный стаканчик, закрепленный сеткой (размер сетки 150 х 150, отверстие 160 мкм). Нанесите на бумажный стаканчик соответствующую этикетку из клетки для спаривания на бумажный стаканчик.
ПРИМЕЧАНИЕ: На этом этапе можно приостановить эксперимент и поддерживать самок 10% раствором сахарозы. Семенная жидкость с rhB-маркировкой будет оставаться стабильной внутри женских сперматозоидов в течение как минимум недели. Лучше всего поддерживать самок живыми до рассечения, так как мертвые и высохших экземпляры трудно рассечь. - Чтобы забить женские сперматозоиды, холодно обезболить самок комаров на льду не менее 5 минут перед рассечением под стереомикроскопом(Видео 1). Исследуйте сперматеки под составным световым микроскопом (увеличение 100x) на наличие у них статуса осеменения(рисунок 4). Для осемененных лиц определите, содержат ли сперматеки семенную жидкость с rhB-маркировкой, исследуя их под флуоресцентным стереомикроскопом, оснащенным фильтром RFP1 и системой визуализации камеры.
ПРИМЕЧАНИЕ: При использовании флуоресцентного стереомикроскопа с подключенной системой визуализации рекомендуется использовать длительное время экспозиции (5 с) для повышения чувствительности обнаружения. Если самка комара спарилась с отмеченным самцом, ее сперматеки будут флуоресцировать ярко-оранжевым цветом(рисунок 5А). Однако, если самка комара спарилась с немаркированным самцом, ее осемененные сперматозоиды не будут флуоресцировать(рисунок 5B).
7. Утилизация отходов RhB
- Обработайте водные отходы RhB активированным углем25 перед сбросом его в качестве общих сточных вод. Утилизируйте твердые отходы RhB (комары, помеченные RhB, бумажные полотенца и фитили, пропитанные RhB) в качестве химических отходов. Надевайте стандартные СИЗ при обращении с отходами RhB.
Результаты
ж AlbB-SG — локализованная (сингапурская) линия Ae. aegypti, стабильно инфицированная штаммом wAlbB Wolbachia. Используя протокол, описанный в этой статье, мы оценили конкурентоспособность самцов инбредного и ауткроссированного ряда wAlbB-SG, чтобы определить, приводит ли инбридинг к потере мужской брачной пригодности. Инбредная линия поддерживалась в течение 11 поколений в инсектарии, в то время как аутперешенная линия была получена путем обратного скрещивания самок с диким типом самцов Ae. aegypti. Самцы из инбредной и ауткроссированной линий соревновались друг с другом за спаривание с дикой самкой дикого типа Ae. aegypti. Анализ конкурентоспособности спаривания проводился в трех разах.
Результаты показали, что RhB не влиял на приспособленность самцов, поскольку данные о оплодотвении самок не были смещены в сторону или против спаривания с самцами, питаемыми RhB-сахарозой (Таблица 1 и Рисунок 6) Поскольку RhB не влияет на брачную пригодность самцов, мы переходим к анализу данных, основанных на проценте оплодотношенных самок, спаренных либо инбредной, либо аутсеченной линией(Таблица 2 и Рисунок 7). Результат по всем экспериментальным трипликатам был последовательным; во всех трех репликах наблюдался значительно более высокий процент самок, спариваемых с самцами ауткросса, чем с инбредными самцами (P ≤ 0,05, Mann-Whitney U-test). Эти результаты свидетельствуют о потенциальной потере мужской брачной пригодности после нескольких поколений инбридинга в лаборатории.

Рисунок 1:Боковой вид самца (слева) и самки (справа) куколок Aedes aegypti. При тех же условиях выращивания Ae. aegypti может быть половым на стадии куколки в соответствии с размером; самцы значительно меньше самок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
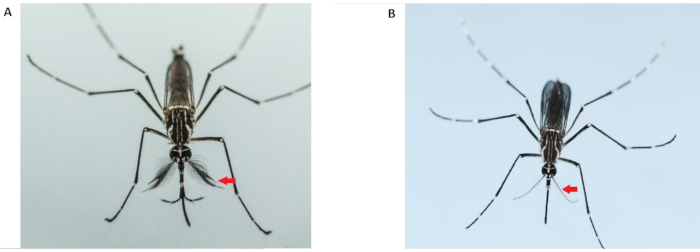
Рисунок 2:Дифференциация мужского (слева) и женского (справа) Aedes aegypti взрослых. Взрослые самцы комаров (слева) имеют более кустистые и волосатые усики, чем взрослая самка; красные стрелки указывают на антенны. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
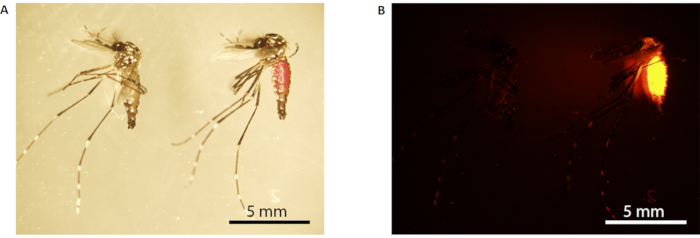
Рисунок 3:Маркировка родамина В самцов комаров. (А) Световая микроскопия; (B) флуоресцентная микроскопия. Комар слева не отмечен (питается 10% мас./v сахарозы), в то время как комар справа маркирован (питается 0,2% RhB-сахарозы). Отмеченные комары имеют видимое розовое брюшко под белым светом (комар справа в А),которое флуоресцирует ярко-оранжевым цветом при флуоресцентной микроскопии(В). Шкала стержней = 5 мм. Аббревиатура: RhB = Rhodamine B. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
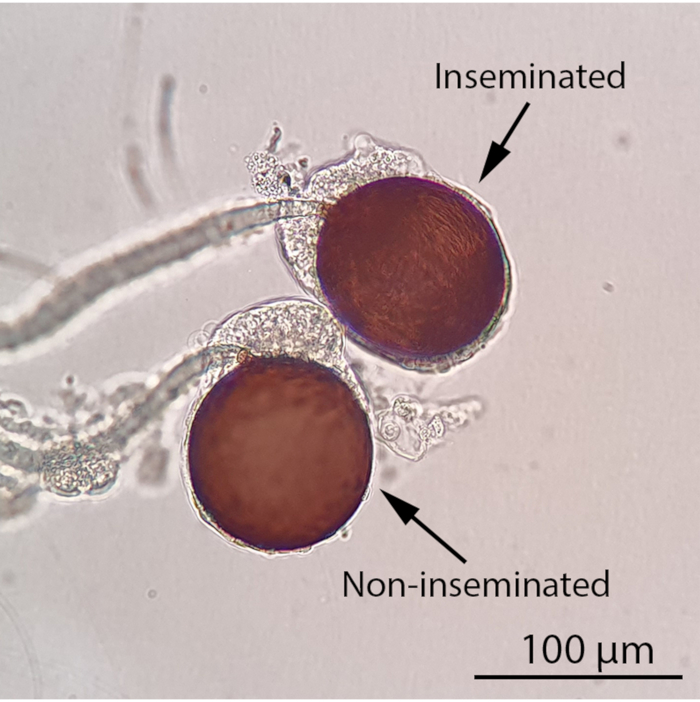
Рисунок 4:Осемененные и несемененные женские сперматозоиды под составным световым микроскопом (100-кратное увеличение). Статус осеменения самки комара можно определить, наблюдая за его сперматекой под составным световым микроскопом. Оплодотворенная самка комара будет содержать по крайней мере одну заполненную сперматеку, в то время как все три сперматеки неосемененной самки комара будут пустыми. Нитевидные, подвижные сперматозоиды будут видны в заполненной сперматеке под составным световым микроскопом. Шкала = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5:Сперматеки самок комаров, осемененные семенными жидкостями под флуоресцентным стереомикроскопом. (A)RhB-маркированные и(B)немаркированные сперматозоиды, осемененные семенными жидкостями с rhB-маркировкой, будут флуоресцентировать ярко-оранжевый цвет при флуоресцентной микроскопии. Шкала = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
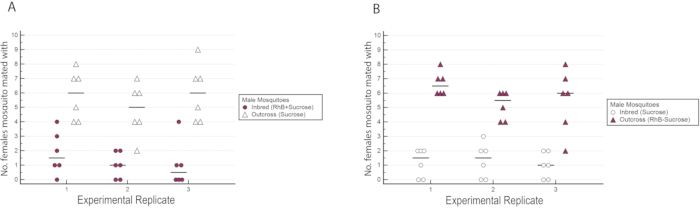
Рисунок 6:Количество самок дикого типа, осемененных либо инбредными, либо ауткроссированными самцами в экспериментальных тройных с взаимной маркировкой. (A) Инбредные самцы были отмечены RhB, в то время как ауткроссовые самцы не были отмечены. (B) Самцы ауткросса были отмечены RhB, в то время как инбредные самцы не были отмечены. Было замечено, что большее число самок спаривались с самцами ауткросса независимо от их статуса маркировки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
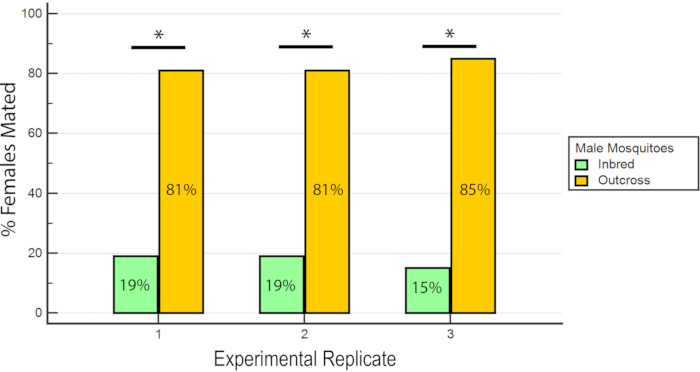
Рисунок 7:Доля оплодотноженных самок, спаренных с инбредными или ауткроссированными самцами в 3 экспериментальных репликах. Для каждой экспериментальной реплики наблюдается значительно более высокий процент самок, спаривающихся с ауткроссными самцами (P ≤ 0,05, Mann-Whitney U-test). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Видео 1: Вскрытие самки Aedes aegypti на сперматеки под световым стереомикроскопом. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
| ♀ x Инбред (RhB) ♂ a | ♀ x Ауткросс (без пометок) ♂ b | ♀ x Инбредная (без маркировки) ♂ c | ♀ x Ауткросс (RhB) ♂ d | Общая скорость оплодотвения (a+b+c+d/120) | |
| Репликация 1 | 11 | 35 | 7 | 40 | 77.5% (93/120) |
| Репликация 2 | 6 | 29 | 8 | 31 | 61.7% (74/120) |
| Реплика 3 | 6 | 36 | 6 | 33 | 67.5% (81/120) |
Таблица 1: Количество самок, спаренных с RhB-маркированными и немаркированными wAlbB-Sg Aedes aegypti инбредными и ауткроссными самцами. В каждой реплике было использовано в общей сложности 120 самок.
| Процент оплодотноносанных самок | ||
| Инбредные самцы | Ауткросс самцов | |
| Репликация 1 | 19% (18/93) | 81% (75/93) |
| Репликация 2 | 19% (14/74) | 81% (60/74) |
| Реплика 3 | 15% (12/81) | 85% (69/81) |
Таблица 2: Процент оплодотворенных самок, спаренных с самцами инбредными и ауткроссированными самцами albB-Sg Aedes aegypti.
Дополнительный рисунок S1: Сравнение рабочего процесса для анализа конкурентоспособности на основе RhB и обычного спаривания. По сравнению с обычным анализом конкурентоспособности спаривания, упрощенный и сокращенный рабочий процесс для анализа конкурентоспособности спаривания на основе RhB значительно сокращает продолжительность эксперимента. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S2: Кривые выживаемости Каплана Мейера самцов взрослого Aedes aegypti во время и после кормления с 0,2% и 0,4% кормлением родамином B-сахарозой. Процент выживаемости самцов(A)дикого типа и(B) wAlbB-Sg Ae. aegypti во время и после трех дней кормления на 0,2% и 0,4% RhB-сахарозы по сравнению с контрольной контролем, которую кормили только сахарозой. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительная таблица S1: Скорость оплодотворения самок в клетке W 60 см x D 60 см x H 60 см (соотношение 10 самок к 20 кобелям) в 1-, 2- и 3-часовых временных точках. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Маркировка обычно используется в энтомологических исследованиях для изучения динамики популяции насекомых, рассеивания, поведения и биологии спаривания26. В программах SIT и IIT маркировка проводится для дифференциации штамма высвобождения от полевой популяции для изучения их рассеивания и оптимизации коэффициента высвобождения. Используемые методы маркировки включают генетическую маркировку27,28,включающую изотопы в личиночную пищу29,30,флуоресцентную пыль31и краситель32. Для подавления популяций комаров с использованием SIT или IIT, где мужская брачная пригодность является критическим компонентом, флуоресцентные красители использовались в качестве маркеров для изучения биологии спаривания комаров18,19.
Традиционно оценка конкурентоспособности самцов по спаривательной зависимости штамма была оценена с использованием анализов на фертильность самок. Тем не менее, этот анализ является трудоемким и трудоемким из-за последующих экспериментальных процессов после спаривания(дополнительный рисунок S1). Эти процессы включают кровоспитку самок, сбор яиц, вылупление яиц и перечисление доли инкубационных яиц для определения жизнеспособности яиц. В среднем этот анализ требует 30 человеко-часов и двух недель экспериментальной работы (начиная от настройки клеток для анализа конкурентоспособности) до окончательного определения конкурентоспособности самцов.
в его статье представлено использование флуоресцентного красителя RhB (подаваемого комарам в виде 0,2% RhB-сахарозы, дополнительный рисунок S2)для непосредственного измерения брачных взаимодействий между самками и самцами с rhB-маркировкой. Хотя этот протокол требует флуоресцентного стереомикроскопа, он устраняет необходимость выполнения трудоемких экспериментальных процедур, упомянутых выше. В среднем, этот анализ на основе RhB требует примерно 10 человеко-часов и около дня для получения данных, эквивалентных данным из анализов женской фертильности. Это >90% экономии времени позволяет исследователям выполнять несколько экспериментальных реплик, обеспечивая более надежную проверку мужской брачной пригодности. Кроме того, этот анализ может быть использован для сравнения конкурентоспособности спаривания между двумя стерильными или зараженными Wolbachia линиями комаров.
Этот тип сравнения невозможен с обычными анализами плодовитости самок, так как самки будут давать нежизненные яйца при спаривании с обеими такими линиями. Несмотря на это, любое смешанное спаривание в эксперименте приведет к смещению в сторону отмеченной популяции, поскольку трудно идентифицировать немаркированные сперматозоиды в женских сперматеках, которые содержат семенную жидкость как от RhB-маркированных, так и от немаркированных самцов. Аналогичный вывод был сделан в исследовании, оценивавшем конкурентоспособность спаривания Anopheles gambiae с использованием RhB18,в результате которого было обнаружено, что большая доля самок в брачном анализе спаривалась с отмеченными самцами. Поскольку полиандрия чаще встречается у самок, которые ранее участвовали в прерванномспаривании 33,вероятность этого была снижена в этом исследовании за счет использования меньшего количества комаров (20 самцов на 10 самок) в большем объеме клетки (0,216м3)в этих экспериментах.
Результаты не показали предвзятости в сторону популяции с rhB-маркировкой, что указывает на то, что смешанное спаривание было ограничено. Таким образом, включение RhB для обозначения самцов в анализе конкурентоспособности спаривания является экономичным и быстрым способом оценки брачной пригодности самцов. Этот метод также позволяет напрямую сравнивать конкурентоспособность спаривания между самцами, подвергающимися различным дозам облучения, выращенными в разных режимах выращивания, или инфицированными различными штаммами Wolbachia,что делает его ценным инструментом для оценки брачной пригодности самцов для любой программы подавления популяции комаров на основе высвобождения самцов.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Это исследование финансировалось Национальным агентством по окружающей среде (NEA), Сингапур. Мы благодарим г-на Чу Мин Фая, заместителя главного исполнительного директора (общественное здравоохранение), NEA, за его одобрение опубликовать исследование, и A/Prof Ng Lee Ching, директора группы (Группа Института гигиены окружающей среды), NEA, за ее поддержку в этом исследовании. Мы также благодарим д-ра Шучжэнь Сима и д-ра Дениз Тан за корректуру рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| Compound light microscope | Olympus | CX23 | To score for spermathecae insemination |
| Dissection forceps | Bioquip | Rubis forceps (4524) | |
| Fluorescence stereo-light microscope with RFP1 filter | Olympus | SZX16 | To check for Rhodamine B fluorescence signal |
| Mosquito cages | Bugdorm | 4F3030 | W 32.5 cm x D 32.5 cm x H 32.5 cm; mesh size of 150 x 150; 160 µm aperture For holding of male and female adult mosquitoes prior to mating assay |
| 6M610 | W 60 cm x D 60 cm x H 60 cm; mesh size of 44 x 32; 650 µm aperture For mating competitiveness assay | ||
| Mosquito netting | 150 x 150, 160 µm aperture | ||
| Rhodamine B | Sigma Aldrich | R6626 | ≥95% (HPLC) |
| Stereo-light microscope | Olympus | SZ61 | For spermathecae dissection |
| Sucrose | MP Biomedicals | SKU 029047138 | Food grade |
| TetraMin tropical flakes | Tetra | 77101 | Fish food for feeding larvae |
Ссылки
- Achee, N. L., et al. A critical assessment of vector control for dengue prevention. PLoS Neglected Tropical Diseases. 9 (5), 0003655(2015).
- Carvalho, D. O., et al. Suppression of a field population of Aedes aegypti in Brazil by sustained release of transgenic male mosquitoes. PLoS Neglected Tropical Diseases. 9 (7), 0003964(2015).
- Lees, R. S., Gilles, J. R. L., Hendrichs, J., Vreysen, M. J. B., Bourtzis, K. Back to the future: the sterile insect technique against mosquito disease vectors. Current Opinion in Insect Science. 10, 156-162 (2015).
- Bourtzis, K., et al. Harnessing mosquito-Wolbachia symbiosis for vector and disease control. Acta Tropica. 132, 150-163 (2014).
- Zhang, D., Lees, R. S., Xi, Z., Gilles, J. R. L., Bourtzis, K. Combining the sterile insect technique with Wolbachia-based approaches: II--A safer approach to Aedes albopictus population suppression programmes, designed to minimize the consequences of inadvertent female release. PloS One. 10 (8), 0135194(2015).
- Zheng, X., et al. Incompatible and sterile insect techniques combined eliminate mosquitoes. Nature. 572 (7767), 56-61 (2019).
- Balestrino, F., et al. Gamma ray dosimetry and mating capacity studies in the laboratory on Aedes albopictus males. Journal of Medical Entomology. 47 (4), 581-591 (2010).
- Bellini, R., et al. Mating competitiveness of Aedes albopictus radio-sterilized males in large enclosures exposed to natural conditions. Journal of Medical Entomology. 50 (1), 94-102 (2013).
- Helinski, M. E., Parker, A. G., Knols, B. G. Radiation biology of mosquitoes. Malaria Journal. 8, Suppl 2 6(2009).
- Aldersley, A., et al. Too "sexy" for the field? Paired measures of laboratory and semi-field performance highlight variability in the apparent mating fitness of Aedes aegypti transgenic strains. Parasites & Vectors. 12 (1), 357(2019).
- Axford, J. K., Ross, P. A., Yeap, H. L., Callahan, A. G., Hoffmann, A. A. Fitness of wAlbB Wolbachia infection in Aedes aegypti: parameter estimates in an outcrossed background and potential for population invasion. The American Journal of Tropical Medicine and Hygiene. 94 (3), 507-516 (2016).
- Benedict, M. Q., et al. Colonisation and mass rearing: learning from others. Malaria Journal. 8 (2), 4(2009).
- Ross, P. A., Axford, J. K., Richardson, K. M., Endersby-Harshman, N. M., Hoffmann, A. A. Maintaining Aedes aegypti mosquitoes infected with Wolbachia. Journal of Visualized Experiments: JoVE. (126), e56124(2017).
- Ross, P. A., Endersby-Harshman, N. M., Hoffmann, A. A. A comprehensive assessment of inbreeding and laboratory adaptation in Aedes aegypti mosquitoes. Evolutionary Applications. 12 (3), 572-586 (2019).
- Segoli, M., Hoffmann, A. A., Lloyd, J., Omodei, G. J., Ritchie, S. A. The effect of virus-blocking Wolbachia on male competitiveness of the dengue vector mosquito, Aedes aegypti. PLoS Neglected Tropical Diseases. 8 (12), 3294(2014).
- Zhang, D., Lees, R. S., Xi, Z., Bourtzis, K., Gilles, J. R. Combining the sterile insect technique with the incompatible insect technique: III-Robust mating competitiveness of irradiated triple Wolbachia-infected Aedes albopictus males under semi-field conditions. PloS One. 11 (3), 0151864(2016).
- Fried, M. Determination of sterile-insect competitiveness. Journal of Economic Entomology. 64 (4), 869-872 (1971).
- Aviles, E. I., Rotenberry, R. D., Collins, C. M., Dotson, E. M., Benedict, M. Q. Fluorescent markers rhodamine B and uranine for Anopheles gambiae adults and matings. Malaria Journal. 19 (1), 236(2020).
- Johnson, B. J., et al. Use of rhodamine B to mark the body and seminal fluid of male Aedes aegypti for mark-release-recapture experiments and estimating efficacy of sterile male releases. PLoS Neglected Tropical Diseases. 11 (9), 0005902(2017).
- Fisher, P. Review of using rhodamine B as a marker for wildlife studies. Wildlife Society Bulletin. 27 (2), 318-329 (1999).
- Blanco, C. A., Perera, O., Ray, J. D., Taliercio, E., Williams, L. Incorporation of rhodamine B into male tobacco budworm moths Heliothis virescens to use as a marker for mating studies. Journal of Insect Science. 6, 5(2006).
- Mascari, T. M., Foil, L. D. Laboratory evaluation of the efficacy of fluorescent biomarkers for sugar-feeding sand flies (Diptera: Psychodidae). Journal of Medical Entomology. 47 (4), 664-669 (2014).
- Sarkar, D., Muthukrishnan, S., Sarkar, M. Fluorescent marked mosquito offer a method for tracking and study mosquito behaviour. International Journal of Mosquito Research. 4, 5-9 (2017).
- South, A., Sota, T., Abe, N., Yuma, M., Lewis, S. M. The production and transfer of spermatophores in three Asian species of Luciola fireflies. Journal of Insect Physiology. 54 (5), 861-866 (2008).
- Üner, O., Geçgel, Ü, Kolancilar, H., Bayrak, Y. Adsorptive removal of rhodamine B with activated carbon obtained from okra wastes. Chemical Engineering Communications. 204 (7), 772-783 (2017).
- Hagler, J. R., Jackson, C. G. Methods for marking insects: current techniques and future prospects. Annual Review of Entomology. 46, 511-543 (2001).
- Scolari, F., et al. Fluorescent sperm marking to improve the fight against the pest insect Ceratitis capitata (Wiedemann; Diptera: Tephritidae). New Biotechnology. 25 (1), 76-84 (2008).
- Ahmed, H. M. M., Hildebrand, L., Wimmer, E. A. Improvement and use of CRISPR/Cas9 to engineer a sperm-marking strain for the invasive fruit pest Drosophila suzukii. BMC Biotechnology. 19 (1), 85(2019).
- Botteon, V., Costa, M. L. Z., Kovaleski, A., Martinelli, L. A., Mastrangelo, T. Can stable isotope markers be used to distinguish wild and mass-reared Anastrepha fraterculus flies. PloS One. 13 (12), 0209921(2018).
- Hood-Nowotny, R., Mayr, L., Islam, A., Robinson, A., Caceres, C. Routine isotope marking for the Mediterranean fruit fly (Diptera: Tephritidae). Journal of Economic Entomology. 102 (3), 941-947 (2009).
- Schroeder, W. J., Mitchell, W. C. Marking Tephritidae fruit fly adults in Hawaii for release-recovery studies. Proceedings of the Hawaiian Entomological Society. 23 (3), 437-440 (1981).
- Akter, H., Taylor, P. W., Crisp, P. Visibility and persistence of fluorescent dyes, and impacts on emergence, quality, and survival of sterile Queensland fruit fly Bactrocera tryoni (Diptera: Tephritidae). Journal of Economic Entomology. 113 (6), 2800-2807 (2020).
- Oliva, C. F., Damiens, D., Benedict, M. Q. Male reproductive biology of Aedes mosquitoes. Acta Tropica. 132, Suppl 12-19 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены