Method Article
Utilizzo del colorante fluorescente, Rhodamine B, per studiare la competitività dell'accoppiamento nelle zanzare Aedes aegypti maschili
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per studiare la competitività dell'accoppiamento di Aedes aegypti maschi usando il colorante fluorescente come marcatore. Le zanzare femmine sono esposte a maschi sia marcati che non contrassegnati per la copulazione. Dopo l'accoppiamento, le loro spermatece vengono esaminate al microscopio a fluorescenza per determinare il loro partner di accoppiamento.
Abstract
Il successo dei programmi di soppressione della popolazione basati sulla tecnica degli insetti sterili o incompatibili dipende dalla capacità dei maschi rilasciati di competere per le femmine selvatiche e indurre sterilità nella popolazione target. Quindi, la valutazione di laboratorio della competitività dell'accoppiamento maschile è essenziale per valutare l'idoneità del ceppo di rilascio prima del rilascio sul campo. Convenzionalmente, tale test viene eseguito determinando la proporzione di uova vitali prodotte dalle femmine dopo essere state esposte simultaneamente a due gruppi di maschi (ceppi selvatici e di rilascio) per l'accoppiamento. Tuttavia, questo processo richiede molto tempo e laborioso a causa della necessità di nutrire prima le femmine per la produzione di uova e quindi schiudere ed enumerare le uova covate per determinare la vitalità delle uova.
Inoltre, questo metodo non è in grado di discernere il grado di competitività tra due linee di zanzare sterili o infette da Wolbachiapoiché le zanzare femmine selvatiche produrranno uova non vitali solo dopo l'accoppiamento con entrambe. Per aggirare queste limitazioni, questo documento descrive un metodo più diretto per misurare la competitività dell'accoppiamento delle zanzare maschili in ambienti di laboratorio utilizzando il colorante fluorescente, la rodamina B (RhB), che può essere utilizzato per contrassegnare i maschi alimentandoli in soluzione di saccarosio contenente RhB. Dopo il test di accoppiamento, la presenza di spermatozoi fluorescenti nelle spermatece di una femmina può essere utilizzata per determinare il suo partner di accoppiamento. Questo metodo è conveniente, riduce il tempo sperimentale del 90% e consente il confronto dell'idoneità all'accoppiamento tra due linee sterili o infette da Wolbachia.
Introduzione
L'allevamento e il rilascio di maschi sterili o incompatibili per la soppressione delle popolazioni di zanzare Aedes è attualmente in fase di valutazione sul campo come nuovo strumento per prevenire focolai di dengue e altre malattie trasmesse da Aedes1. Le strategie di soppressione del rilascio maschile che sono attualmente in fase di sperimentazione sul campo includono l'uso del metodo genetico2,irradiazione (Sterile Insect Technique, SIT)3,batteri endosimbiotici Wolbachia (Insect Incompatible Technique, IIT)4,o una combinazione delle ultime due tecniche5,6. Il successo di questi approcci dipende in gran parte dalla capacità dei maschi rilasciati di superare i maschi selvatici e cercare femmine per garantire la copulazione. In caso contrario, la sterilità non può essere indotta nella popolazione target.
In un programma SIT classico, ad esempio, l'idoneità all'accoppiamento maschile può essere influenzata da fattori come la dose di irradiazione7,8,9,il protocollo di allevamento di massa e l'entità della consanguineità nella colonia10,11, 12,13,14. Inoltre, gli studi sulla competitività dell'accoppiamento possono fornire importanti conoscenze sul comportamento di accoppiamento delle zanzare che potrebbero essere utilizzate per informare le strategie di controllo dei vettori.
In SIT e IIT, la competitività di accoppiamento delle zanzare maschio è tipicamente valutata consentendo sia al ceppo selvatico che a quello di rilascio di competere per le femmine selvatiche in una gabbia8,11,15,16. Le femmine vengono quindi alimentate con sangue e le loro uova si schiudono per determinare la vitalità. Si presume che le femmine che depongono uova non vitali o uova con un basso tasso di schiusa si siano accoppiate con maschi di ceppo di rilascio, mentre le femmine che producono uova vitali si presume si siano accoppiate con maschi selvatici. La competitività di accoppiamento viene quindi calcolata con l'indice fritto17. Sfortunatamente, questo metodo richiede molte risorse e molto tempo, e l'indice fritto complessivo può essere influenzato da fattori confondenti esterni che influenzano la vitalità delle uova come la scarsa manipolazione delle uova e l'eccessiva essiccazione possono comportare un basso tasso di schiusa nella croce di compatibilità che può quindi portare a un indice di fried artificialmente basso.
Inoltre, questo metodo non consente il confronto diretto della competitività di accoppiamento tra zanzare Aedes che sono infettate da diversi ceppi di Wolbachia o che sono esposte a diverse dosi di irradiazione. Pertanto, è necessario un metodo più diretto per affrontare queste sfide. Recenti studi18,19 hanno dimostrato l'efficacia dell'uso del colorante fluorescente, RhB, per contrassegnare il liquido seminale delle zanzare maschili. Il liquido seminale marcato viene trasferito e immagazzinato nelle spermatece delle zanzare femmine dopo l'accoppiamento riuscito, consentendo la misurazione diretta dell'interazione dell'accoppiamento femminile con i maschi marcati. Rhodamine B è un colorante fluoronico tiolica-reattivo comunemente usato come biomarcatore per studi di ricerca ecologica e comportamentale su animali tra cui insetti20. Per gli studi sulle zanzare, RhB viene introdotto alimentandosi con acqua di zucchero o miele contenente rhB in polvere disciolta18,19,21,22,23,24. Al momento dell'assorbimento, il colorante RhB si lega alle proteine, macchiando il tessuto corporeo con una macchia rosa-rossastra che fluoresce di colore arancione brillante sotto una fonte di luce fluorescente.
Il forte segnale di fluorescenza e la stabilità della marcatura, unita alla sua capacità di macchiare i fluidi seminali degli insetti, consente il monitoraggio del trasferimento del liquido seminale marcato dal maschio marcato agli organi di stoccaggio dello sperma dell'insetto femminile per gli studi di accoppiamento18,19,21,24. L'uso di RhB in un test di competitività dell'accoppiamento maschile non solo consente la misurazione diretta dell'interazione di accoppiamento delle femmine con maschi marcati e non marcati, ma i risultati possono anche essere ottenuti entro 24 ore in quanto evita il processo di determinazione della vitalità dell'uovo, che in genere richiede circa 10-14 giorni. Inoltre, questo metodo supera la potenziale perdita di dati quando le zanzare femmine non si nutrono di sangue o muoiono prima dell'ovodeposizione. Ciò è particolarmente cruciale perché nelle prove semi-campo, dove le zanzare femmine sono soggette a danni e morte durante la raccolta post-accoppiamento utilizzando uno zaino o un aspiratore meccanico. Per affrontare le attuali limitazioni dell'uso della fertilità femminile, presentiamo un metodo alternativo che utilizza la colorazione RhB per misurare direttamente la competitività dell'accoppiamento delle zanzare maschili. Il metodo semplifica il flusso di lavoro, accorciando il tempo sperimentale da circa due settimane a un giorno, consentendo di eseguire più repliche sperimentali e consente il confronto tra due ceppi di rilascio. Questo protocollo sarà adatto per i laboratori che si stanno imbarcando in programmi di soppressione della popolazione di zanzare basati sul rilascio maschile e può essere utilizzato per il controllo di qualità di routine e la valutazione del ceppo.
Protocollo
1. Allevamento di zanzare
- Condurre tutto l'allevamento delle zanzare e il saggio di competitività dell'accoppiamento maschile in condizioni insetticide standard di 27 ± 1 °C e 75-80% di umidità relativa, con un fotoperiodo di 12 h: 12 h luce: cicli scuri.
- Designare i due gruppi di maschi concorrenti come Set A e Set B per un facile riferimento nella metodologia descritta in questo articolo. Allevare le zanzare in condizioni standardizzate per garantire un equo confronto della loro forma fisica durante il test. Allevare le zanzare ad una densità larvale di 500 larve in 2 L di acqua e nutrirle con polvere di pesce macinato ad libitum.
NOTA: Per la generazione dei risultati rappresentativi, i set A e B erano i maschi consanguinei e incrociati dell'Ae infetto da Wolbachia. Aegypti, rispettivamente. - Sesso maschio e femmina zanzare allo stadio pupale, e le contengono separatamente in gabbie (vedi tabella dei materiali)di dimensioni L 32,5 cm x P 32,5 cm x H 32,5 cm, con dimensioni delle maglie di 150 x 150 e 160 μm di apertura. Mantenere tutte le zanzare adulte con una soluzione di saccarosio al 10%.
2. Preparazione di zanzare maschio e femmina
- Sesso le zanzare maschio e femmina allo stadio pupale in base alle loro differenze di dimensioni (le pupe maschili sono più piccole delle pupe femminili) (Figura 1).
- Per ogni serie di zanzare (Set A o Set B), trasferire 100 pupe maschi ciascuna in una gabbia premarcata per l'alimentazione con saccarosio o RhB-saccarosio.
- Posizionare le pupe femminili in piccoli lotti di 40-50 per gabbia. All'emergere degli imago, controllare le gabbie per la presenza di zanzare maschio.
NOTA: le zanzare maschio adulte sono più piccole delle femmine e hanno antenne più folte e pelose (Figura 2). Utilizzare solo zanzare femmine vergini per i saggi di competitività dell'accoppiamento. L'uso di femmine pre-inseminate renderà invalidi tutti i dati risultanti. Pertanto, è necessario prestare estrema attenzione durante il sesso nella fase delle pupe. Non usare le zanzare femmine da una gabbia che è stata contaminata da zanzare maschio. Dovrebbero essere preparate gabbie extra di femmine.
3. Preparazione di soluzione di saccarosio al 0,2% di RhB
NOTA: RhB è una polvere verde in forma secca e rosa-rossastra in soluzione. I dispositivi di protezione individuale standard (DPI: camice di protezione da laboratorio, guanti in nitrile e protezione per gli occhi) devono essere indossati durante la manipolazione di questa sostanza chimica. Per evitare l'inalazione, pesare la polvere RhB in una cappa aspirante.
- Per preparare una soluzione di RhB-saccarosio allo 0,2% p/v, sciogliere 200 mg di RhB in polvere per ogni 100 ml di soluzione di saccarosio al 10% p/v/ Mescolare bene per assicurarsi che tutta la polvere sia sciolta.
NOTA: poiché RhB è sensibile alla luce, utilizzare bottiglie ambrate o avvolgere completamente le bottiglie trasparenti con un foglio di alluminio.
4. Alimentazione di zanzare maschio
NOTA: i dati dell'ottimizzazione dell'alimentazione RhB-saccarosio sono presentati in Materiale supplementare, sezione 1.
- Preparare 20 bottiglie di alimentazione dello zucchero con uno stoppino. Aggiungere 10 ml di saccarosio al 10% in 10 flaconi di alimentazione e 10 ml di soluzione di RhB-saccarosio allo 0,2% negli altri 10 flaconi di alimentazione (utilizzare flaconi ambrati o avvolgere i flaconi in un foglio di alluminio).
- Posizionare i flaconi di alimentazione nelle rispettive gabbie maschili (5 bottiglie per gabbia) preparate nei passaggi 2.2 e 2.3. Lascia che le zanzare maschio si nutrano per tre giorni prima dell'esperimento di accoppiamento.
5. Verifica della fluorescenza RhB nelle zanzare maschi
- Aspirare le zanzare maschio alimentate con RhB-saccarosio e osservarle al microscopio stereo a fluorescenza per assicurarsi che tutte le zanzare maschili alimentate con RhB-saccarosio siano state contrassegnate con successo con RhB.
- Accendere la lampada del bruciatore a mercurio e lo stereomicroscopio. Lasciare stabilizzare la sorgente luminosa della lampada del bruciatore a mercurio per 10 minuti. Impostare i filtri di fluorescenza per la proteina di fluorescenza rossa 1 (RFP1) (lunghezza d'onda di eccitazione 540 nm, lunghezza d'onda di emissione 625 nm).
- Aspirare un piccolo numero di zanzare (quattro o cinque) alla volta nel tubo di vetro dell'aspiratore orale. Attraverso il tubo di vetro, osservare il corpo delle zanzare maschio sotto lo stereomicroscopio a fluorescenza. Escludere le zanzare maschio non contrassegnate con RhB dall'esperimento.
NOTA: L'addome delle zanzare maschio contrassegnate con RhB apparirà rosa sotto la luce bianca (Figura 3A) e illuminerà arancione brillante sotto la luce fluorescente (Figura 3B). - Set di trasferimento Un maschio di zanzare in 12 bicchieri di carta fissati con rete (dimensioni della maglia 150 x 150, apertura 160 μm); 6 tazze ciascuna con 10 zanzare maschio nutrite con saccarosio e le altre 6 tazze ciascuna con 10 zanzare maschio alimentate con saccarosio RhB. Ripeti questo passaggio per le zanzare maschio del set B.
6. Test di competitività dell'accoppiamento
- Impostare 12 gabbie L 60 cm x P 60 cm x H 60 cm con dimensioni della maglia 44 x 32, apertura 650 μm per il test di accoppiamento. In ciascuna delle sei gabbie, includono 10 zanzare maschio del set A (marcato rhB), 10 zanzare maschio del set B (non contrassegnate) e 10 zanzare femmine vergini di tipo selvatico. Nelle altre sei gabbie, includono 10 zanzare maschio set A (non contrassegnate), 10 zanzare maschio set B (marcate RhB) e 10 zanzare femmine vergini di tipo selvatico. Etichettare queste gabbie per distinguere chiaramente tra le due combinazioni di accoppiamento.
NOTA: Sulla base dell'esperienza, per il test di accoppiamento è stata utilizzata una gabbia di 60 cm x 60 cm x 60 cm poiché una gabbia più piccola può incoraggiare l'accoppiamento misto. - Posizionare le rispettive tazze di maschi preparate al punto 5.4 nelle gabbie di accoppiamento secondo l'etichetta al punto 6.1. Rimuovere la rete e picchiettare delicatamente la tazza per spingere i maschi fuori dalla tazza. Rimuovere con attenzione il bicchiere di carta e la rete dalla gabbia per assicurarsi che nessuna zanzara fuoriesca dalla gabbia. Lascia che le zanzare maschio si acclimatino nella gabbia di accoppiamento per almeno un'ora.
- Usando un aspiratore orale, trasferisci le zanzare femmine vergini selvatiche in 12 bicchieri di carta, con ogni tazza contenente 10 zanzare.
- Dopo il periodo di acclimatazione per le zanzare maschio, trasferire una tazza di femmine in ogni gabbia di accoppiamento e rimuovere la rete. Spingere delicatamente la tazza per incoraggiare eventuali zanzare femmine rimanenti fuori dalla tazza. Rimuovere con attenzione il bicchiere di carta e la rete dalla gabbia per assicurarsi che nessuna zanzara fuoriesca dalla gabbia.
- Consentire l'accoppiamento per 3 ore.
NOTA: la durata raccomandata dell'accoppiamento è stata determinata attraverso precedenti osservazioni di Ae. aegyptidi tipo selvatico. Negli esperimenti che hanno coinvolto 10 femmine e 20 maschi tenuti in una gabbia di 60 cm x 60 cm x 60 cm, l'inseminazione femminile al 90% è stata raggiunta in 3 ore (Materiale supplementare, sezione 2). Non disturbare la gabbia durante questo periodo poiché l'agitazione potrebbe portare ad accoppiamenti interrotti e misti. L'accoppiamento misto (in cui la femmina si è accoppiata con maschi marcati e non marcati) provoca una propensione verso i maschi marcati rhB in quanto è difficile distinguere gli spermatozoi non marcati dagli spermatozoi marcati RhB al microscopio a fluorescenza. - Per terminare l'esperimento di accoppiamento, rimuovere tutte le zanzare da ogni gabbia usando un aspiratore meccanico. Anestetizzare a freddo le zanzare sul ghiaccio per almeno 5 min. Quando le zanzare sono completamente anestetizzate, raccogliere delicatamente le zanzare femmine e sistemarle in un bicchiere di carta separato fissato con rete (dimensioni della maglia 150 x 150, apertura 160 μm). Etichettare il bicchiere di carta trasferendo la rispettiva etichetta dalla gabbia di accoppiamento al bicchiere di carta.
NOTA: È possibile mettere in pausa l'esperimento a questo punto e mantenere le femmine con una soluzione di saccarosio al 10%. Il liquido seminale marcato rhB rimarrà stabile all'interno delle spermatece femmine per almeno una settimana. È meglio mantenere in vita le femmine prima della dissezione poiché gli esemplari morti e essiccati sono difficili da sezionare. - Per segnare le spermatece femmine, anestetizzare a freddo le zanzare femmine sul ghiaccio per almeno 5 minuti prima della dissezione al microscopio stereo (Video 1). Esaminare le spermatece al microscopio ottico composto (ingrandimento 100x) per il loro stato di inseminazione (Figura 4). Per gli individui inseminati, determinare se le spermatece contengono liquido seminale marcato RhB esaminandole sotto lo stereomicroscopio a fluorescenza dotato di un filtro RFP1 e di un sistema di imaging della telecamera.
NOTA: quando si utilizza uno stereomicroscopio a fluorescenza con un sistema di imaging collegato, si consiglia di utilizzare un tempo di esposizione prolungato (5 s) per aumentare la sensibilità di rilevamento. Se la zanzara femmina si è accoppiata con un maschio marcato, le sue spermatece fluoresceranno di colore arancione brillante (Figura 5A). Tuttavia, se la zanzara femmina si è accoppiata con un maschio non contrassegnato, le sue spermatece inseminate non fluoresceranno (Figura 5B).
7. Smaltimento dei rifiuti RhB
- Trattare i rifiuti acquosi rhB con carbone attivo25 prima di scaricarlo come acque reflue generali. Smaltire i rifiuti solidi RhB (zanzare contrassegnate con RhB, asciugamani di carta e stoppini imbevuti di RhB) come rifiuti chimici. Dona DPI standard quando maneggi i rifiuti RhB.
Risultati
w AlbB-SG è una linea Ae. aegypti localizzata (Singapore) stabilmente infettata dal ceppo wAlbB di Wolbachia. Utilizzando il protocollo descritto in questo articolo, abbiamo valutato la competitività dell'accoppiamento maschile di un inbred e una linea superata di wAlbB-SG per determinare se la consanguineità si traduce in una perdita nella forma fisica dell'accoppiamento maschile. La linea inbred era stata mantenuta per 11 generazioni nell'insetto, mentre la linea superata era generata incrociando le femmine con Ae maschio selvatico. aegypti. I maschi delle linee inbred e outcrossed sono stati gareggiati l'uno contro l'altro per l'accoppiamento con la femmina wild-type Ae. aegypti. Il test di competitività dell'accoppiamento è stato condotto in triplice copia.
I risultati hanno indicato che rhB non ha influenzato l'idoneità dei maschi in quanto i dati per l'inseminazione femminile non erano sbilanciati verso o contro l'accoppiamento con maschi nutriti con RhB -saccarosio (Tabella 1 e Figura 6) Poiché RhB non influisce sull'idoneità all'accoppiamento dei maschi, procediamo ad analizzare i dati in base alla percentuale di femmine inseminate accoppiate dalla linea inbred o outcrossed (Tabella 2 e Figura 7). Il risultato tra i triplicati sperimentali è stato coerente; c'era una percentuale significativamente più alta di femmine accoppiate con i maschi outcross rispetto ai maschi consanguinei in tutte e tre le repliche (P ≤ 0,05, Mann-Whitney U-test). Questi risultati suggeriscono una potenziale perdita nella forma fisica dell'accoppiamento maschile dopo diverse generazioni di consanguineità in laboratorio.

Figura 1: Vista laterale delle pupe maschili (a sinistra) e femminili (a destra) Aedes aegypti. Nelle stesse condizioni di allevamento, Ae. aegypti può essere sessuato allo stadio pupale in base alle dimensioni; i maschi sono significativamente più piccoli delle femmine. Fare clic qui per visualizzare una versione più grande di questa figura.
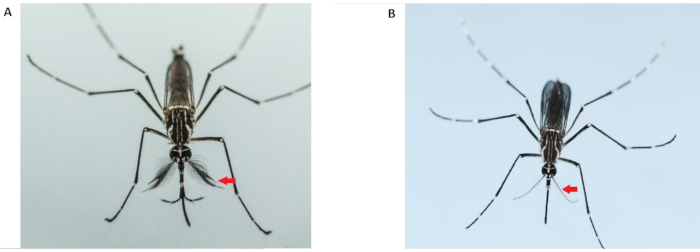
Figura 2: Differenziazione degli adulti Aedes aegypti maschi (a sinistra) e femminili (a destra). Le zanzare maschio adulte (a sinistra) hanno antenne più folte e pelose rispetto alla femmina adulta; le frecce rosse indicano le antenne. Fare clic qui per visualizzare una versione più grande di questa figura.
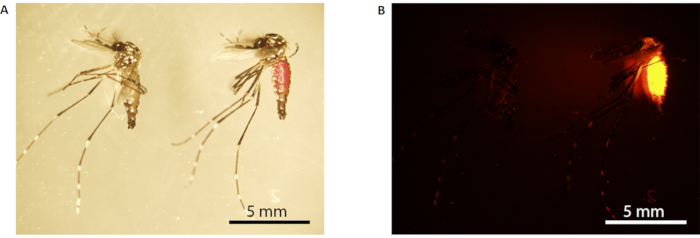
Figura 3: Marcatura rhodamine B della zanzara maschio. (A) Microscopia ottica; (B) microscopia a fluorescenza. La zanzara a sinistra non è marcata (alimentata con il 10% p/v di saccarosio), mentre quella a destra è marcata (alimentata con lo 0,2% di RhB-saccarosio). Le zanzare marcate hanno un addome rosa visibile sotto la luce bianca (la zanzara a destra in A), che fluoresce di arancione brillante sotto microscopia a fluorescenza (B). Barre di scala = 5 mm. Abbreviazione: RhB = Rhodamine B. Fare clic qui per visualizzare una versione più grande di questa figura.
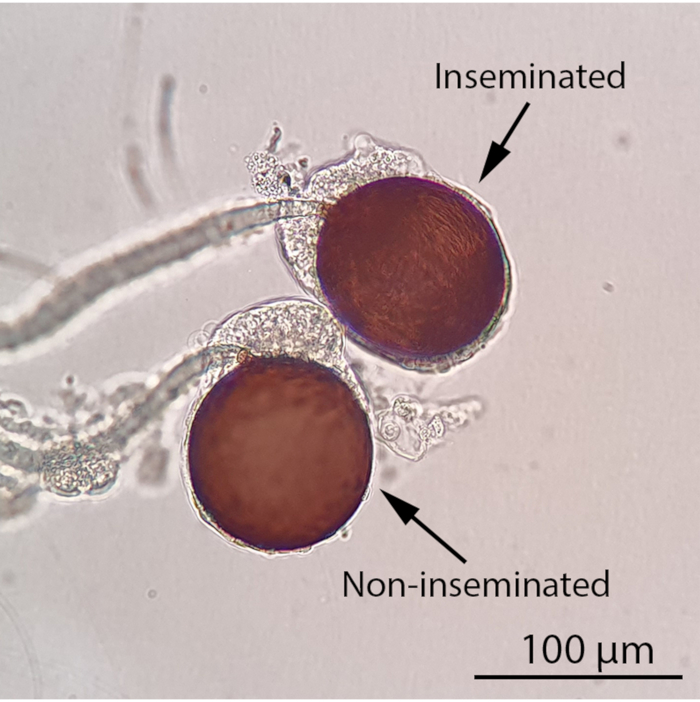
Figura 4: Spermatece femmine inseminate e non inseminate al microscopio ottico composto (ingrandimento 100x). Lo stato di inseminazione di una zanzara femmina può essere determinato osservando le sue spermatece al microscopio ottico composto. Una zanzara femmina inseminata conterrà almeno una spermateca piena mentre tutte e tre le spermatece di una zanzara femmina non inseminata saranno vuote. Lo sperma filifero e mobile sarà visibile in una spermateca riempita sotto un microscopio ottico composto. Barra della scala = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Spermatece femmine di zanzara inseminate con fluidi seminali al microscopio stereo a fluorescenza. (A) Spermatece di zanzara marcata rhB e (B) non marcata inseminata con fluidi seminali marcati RhB fluorescerà arancione brillante sotto microscopia a fluorescenza. Barre di scala = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
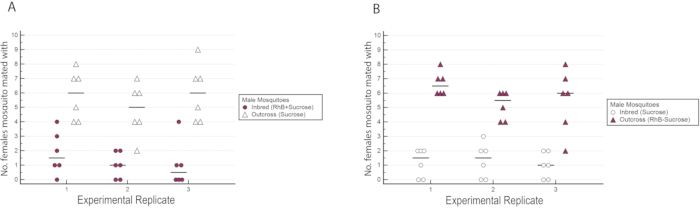
Figura 6: Numero di femmine selvatiche inseminate dai maschi consanguinei o incrociati nei triplicati sperimentali con marcatura reciproca. (A) I maschi consanguinei erano contrassegnati con RhB mentre i maschi outcross non erano marcati. (B) I maschi outcross erano contrassegnati con RhB mentre i maschi consanguinei non erano marcati. Un numero maggiore di femmine è stato osservato per accoppiarsi con maschi outcross indipendentemente dal loro stato di marcatura. Fare clic qui per visualizzare una versione più grande di questa figura.
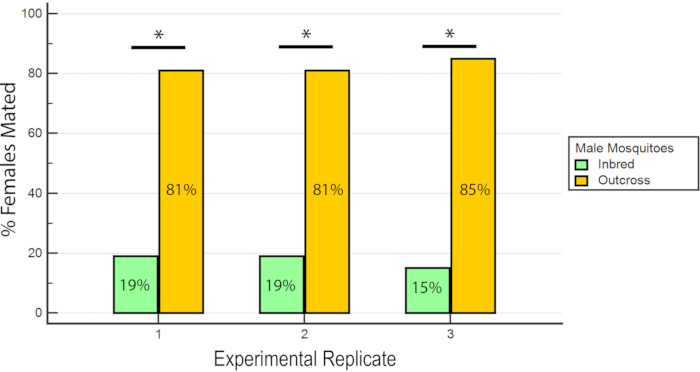
Figura 7: Percentuale di femmine inseminate accoppiate con maschi consanguinei o incrociati nelle 3 repliche sperimentali. Per ogni replica sperimentale, c'è una percentuale significativamente più alta di femmine accoppiate con i maschi outcross (P ≤ 0,05, Mann-Whitney U-test). Fare clic qui per visualizzare una versione più grande di questa figura.
Video 1: Dissezione di Aedes aegypti femmina per spermathecae sotto un microscopio stereo chiaro. Clicca qui per scaricare questo video.
| ♀ x Inbred (RhB) ♂ un | ♀ x Outcross (non contrassegnato) ♂ b | ♀ x Inbred (non contrassegnato) ♂ c | ♀ x Outcross (RhB) ♂ d | Tasso complessivo di inseminazione (a+b+c+d/120) | |
| Replica 1 | 11 | 35 | 7 | 40 | 77.5% (93/120) |
| Replica 2 | 6 | 29 | 8 | 31 | 61.7% (74/120) |
| Replica 3 | 6 | 36 | 6 | 33 | 67.5% (81/120) |
Tabella 1: Numero di femmine accoppiate con maschi consanguinei e non marcati con AlbB-Sg Aedes inbred e outcross. Un numero totale di 120 femmine sono state utilizzate in ogni replica.
| Percentuale di femmine inseminate | ||
| Maschi consanguinei | Maschi outcross | |
| Replica 1 | 19% (18/93) | 81% (75/93) |
| Replica 2 | 19% (14/74) | 81% (60/74) |
| Replica 3 | 15% (12/81) | 85% (69/81) |
Tabella 2: Percentuale di femmine inseminate accoppiate con maschiconsanguinei e maschi incrociati diAlbB-Sg Aedes.
Figura supplementare S1: Confronto del flusso di lavoro per il saggio di competitività dell'accoppiamento basato su RhB e convenzionale. Rispetto al saggio di competitività dell'accoppiamento convenzionale, il flusso di lavoro semplificato e abbreviato per il saggio di competitività dell'accoppiamento basato su RhB riduce significativamente la durata sperimentale. Fare clic qui per scaricare questo file.
Figura supplementare S2: Curve di sopravvivenza di Kaplan Meier di Aedes aegypti adulto maschio durante e dopo l'alimentazione con 0,2% e 0,4% di rodamina B-alimentazione con saccarosio. Percentuale di sopravvivenza di (A) maschio selvatico e (B) wAlbB-Sg Ae. aegypti durante e dopo tre giorni di alimentazione con 0,2% e 0,4% RhB-saccarosio, rispetto ai controlli che sono stati alimentati solo con saccarosio. Fare clic qui per scaricare questo file.
Tabella supplementare S1: Tasso di inseminazione delle femmine in una gabbia W 60 cm x P 60 cm x H 60 cm (rapporto tra 10 femmine e 20 maschi) a 1, 2 e 3 ore di tempo. Fare clic qui per scaricare questa tabella.
Discussione
La marcatura è comunemente usata nella ricerca entomologica per studiare la dinamica della popolazione di insetti, la dispersione, il comportamento e la biologia dell'accoppiamento26. Nei programmi SIT e IIT, la marcatura viene effettuata per differenziare il ceppo di rilascio dalla popolazione di campo per studiarne la dispersione e ottimizzare il rapporto di rilascio. I metodi di marcatura utilizzati includono la marcatura genetica27,28, incorporando isotopi negli alimenti larvali29,30, polvere fluorescente31e colorante32. Per la soppressione delle popolazioni di zanzare utilizzando SIT o IIT, dove l'idoneità all'accoppiamento maschile è una componente critica, i coloranti fluorescenti sono stati utilizzati come marcatori per studiare la biologia dell'accoppiamento delle zanzare18,19.
Convenzionalmente, la valutazione della competitività dell'accoppiamento maschile del ceppo di rilascio è stata valutata utilizzando saggi di fertilità femminile. Tuttavia, questo test richiede molto tempo e manodopera a causa dei processi sperimentali a valle post-accoppiamento (Figura supplementare S1). Questi processi includono l'alimentazione delle femmine, la raccolta delle uova, la schiusa delle uova e l'enumerazione della proporzione di uova schiuse per determinare la vitalità delle uova. In media, questo test richiede 30 ore-uomo e due settimane di lavoro sperimentale (a partire dalla creazione delle gabbie per il saggio di competitività) fino alla determinazione finale della competitività dell'accoppiamento maschile.
il suo articolo presenta l'uso di un colorante fluorescente, RhB, (alimentato allo 0,2% di RhB-saccarosio alle zanzare, Figura supplementare S2) per misurare direttamente le interazioni di accoppiamento tra femmine e maschi marcati rhB. Mentre questo protocollo richiede uno stereomicroscopio a fluorescenza, evita la necessità di eseguire le lunghe procedure sperimentali sopra menzionate. In media, questo test basato su RhB richiede circa 10 ore-uomo e circa un giorno per ottenere dati equivalenti a quello dei test di fertilità femminile. Questo >90% di risparmio di tempo consente ai ricercatori ricercatori di eseguire più repliche sperimentali, fornendo una convalida più robusta della forma fisica dell'accoppiamento maschile. Inoltre, questo test può essere utilizzato per confrontare la competitività dell'accoppiamento tra due linee di zanzare sterili o infette da Wolbachia.
Questo tipo di confronto non è possibile con i test di fertilità femminile convenzionali, poiché le femmine produrrebbero uova non vitali all'accoppiamento con entrambe le linee. Ciononostante, qualsiasi accoppiamento misto nell'esperimento comporterà una distorsione verso la popolazione marcata in quanto è difficile identificare spermatozoi non marcati nelle spermatece femminili che contengono liquido seminale da maschi marcati con RhB e non marcati. Una conclusione simile è stata fatta in uno studio che valuta la competitività dell'accoppiamento di Anopheles gambiae usando RhB18, per cui una percentuale maggiore di femmine nel test di accoppiamento è risultata essere accoppiata da maschi marcati. Poiché la poliandria è più probabile che si verifichi nelle femmine che in precedenza si erano impegnate in un accoppiamento interrotto33, la probabilità che ciò si verifichi è stata ridotta in questo studio utilizzando meno zanzare (da 20 maschi a 10 femmine) in un volume di gabbia più grande (0,216 m3) in questi esperimenti.
I risultati non hanno mostrato alcun pregiudizio verso la popolazione marcata RhB, indicando che l'accoppiamento misto era limitato. In sintesi, l'incorporazione di RhB per contrassegnare i maschi in un test di competitività dell'accoppiamento è un modo economico e rapido per valutare l'idoneità dell'accoppiamento maschile. Questo metodo consente anche il confronto diretto della competitività dell'accoppiamento tra maschi esposti a diverse dosi di irradiazione, allevati in diversi regimi di allevamento, o quelli infetti da diversi ceppi di Wolbachia, rendendolo uno strumento prezioso per la valutazione dell'idoneità all'accoppiamento maschile per qualsiasi programma di soppressione della popolazione di zanzare basato sul rilascio maschile.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Questo studio è stato finanziato dalla National Environment Agency (NEA), Singapore. Ringraziamo Il signor Chew Ming Fai, vice amministratore delegato (salute pubblica), NEA, per la sua approvazione a pubblicare lo studio, e A / Prof Ng Lee Ching, direttore del gruppo (Environmental Health Institute Group), NEA, per il suo supporto in questo studio. Ringraziamo anche il dottor Shuzhen Sim e la dottoressa Denise Tan per aver corretto il manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| Compound light microscope | Olympus | CX23 | To score for spermathecae insemination |
| Dissection forceps | Bioquip | Rubis forceps (4524) | |
| Fluorescence stereo-light microscope with RFP1 filter | Olympus | SZX16 | To check for Rhodamine B fluorescence signal |
| Mosquito cages | Bugdorm | 4F3030 | W 32.5 cm x D 32.5 cm x H 32.5 cm; mesh size of 150 x 150; 160 µm aperture For holding of male and female adult mosquitoes prior to mating assay |
| 6M610 | W 60 cm x D 60 cm x H 60 cm; mesh size of 44 x 32; 650 µm aperture For mating competitiveness assay | ||
| Mosquito netting | 150 x 150, 160 µm aperture | ||
| Rhodamine B | Sigma Aldrich | R6626 | ≥95% (HPLC) |
| Stereo-light microscope | Olympus | SZ61 | For spermathecae dissection |
| Sucrose | MP Biomedicals | SKU 029047138 | Food grade |
| TetraMin tropical flakes | Tetra | 77101 | Fish food for feeding larvae |
Riferimenti
- Achee, N. L., et al. A critical assessment of vector control for dengue prevention. PLoS Neglected Tropical Diseases. 9 (5), 0003655(2015).
- Carvalho, D. O., et al. Suppression of a field population of Aedes aegypti in Brazil by sustained release of transgenic male mosquitoes. PLoS Neglected Tropical Diseases. 9 (7), 0003964(2015).
- Lees, R. S., Gilles, J. R. L., Hendrichs, J., Vreysen, M. J. B., Bourtzis, K. Back to the future: the sterile insect technique against mosquito disease vectors. Current Opinion in Insect Science. 10, 156-162 (2015).
- Bourtzis, K., et al. Harnessing mosquito-Wolbachia symbiosis for vector and disease control. Acta Tropica. 132, 150-163 (2014).
- Zhang, D., Lees, R. S., Xi, Z., Gilles, J. R. L., Bourtzis, K. Combining the sterile insect technique with Wolbachia-based approaches: II--A safer approach to Aedes albopictus population suppression programmes, designed to minimize the consequences of inadvertent female release. PloS One. 10 (8), 0135194(2015).
- Zheng, X., et al. Incompatible and sterile insect techniques combined eliminate mosquitoes. Nature. 572 (7767), 56-61 (2019).
- Balestrino, F., et al. Gamma ray dosimetry and mating capacity studies in the laboratory on Aedes albopictus males. Journal of Medical Entomology. 47 (4), 581-591 (2010).
- Bellini, R., et al. Mating competitiveness of Aedes albopictus radio-sterilized males in large enclosures exposed to natural conditions. Journal of Medical Entomology. 50 (1), 94-102 (2013).
- Helinski, M. E., Parker, A. G., Knols, B. G. Radiation biology of mosquitoes. Malaria Journal. 8, Suppl 2 6(2009).
- Aldersley, A., et al. Too "sexy" for the field? Paired measures of laboratory and semi-field performance highlight variability in the apparent mating fitness of Aedes aegypti transgenic strains. Parasites & Vectors. 12 (1), 357(2019).
- Axford, J. K., Ross, P. A., Yeap, H. L., Callahan, A. G., Hoffmann, A. A. Fitness of wAlbB Wolbachia infection in Aedes aegypti: parameter estimates in an outcrossed background and potential for population invasion. The American Journal of Tropical Medicine and Hygiene. 94 (3), 507-516 (2016).
- Benedict, M. Q., et al. Colonisation and mass rearing: learning from others. Malaria Journal. 8 (2), 4(2009).
- Ross, P. A., Axford, J. K., Richardson, K. M., Endersby-Harshman, N. M., Hoffmann, A. A. Maintaining Aedes aegypti mosquitoes infected with Wolbachia. Journal of Visualized Experiments: JoVE. (126), e56124(2017).
- Ross, P. A., Endersby-Harshman, N. M., Hoffmann, A. A. A comprehensive assessment of inbreeding and laboratory adaptation in Aedes aegypti mosquitoes. Evolutionary Applications. 12 (3), 572-586 (2019).
- Segoli, M., Hoffmann, A. A., Lloyd, J., Omodei, G. J., Ritchie, S. A. The effect of virus-blocking Wolbachia on male competitiveness of the dengue vector mosquito, Aedes aegypti. PLoS Neglected Tropical Diseases. 8 (12), 3294(2014).
- Zhang, D., Lees, R. S., Xi, Z., Bourtzis, K., Gilles, J. R. Combining the sterile insect technique with the incompatible insect technique: III-Robust mating competitiveness of irradiated triple Wolbachia-infected Aedes albopictus males under semi-field conditions. PloS One. 11 (3), 0151864(2016).
- Fried, M. Determination of sterile-insect competitiveness. Journal of Economic Entomology. 64 (4), 869-872 (1971).
- Aviles, E. I., Rotenberry, R. D., Collins, C. M., Dotson, E. M., Benedict, M. Q. Fluorescent markers rhodamine B and uranine for Anopheles gambiae adults and matings. Malaria Journal. 19 (1), 236(2020).
- Johnson, B. J., et al. Use of rhodamine B to mark the body and seminal fluid of male Aedes aegypti for mark-release-recapture experiments and estimating efficacy of sterile male releases. PLoS Neglected Tropical Diseases. 11 (9), 0005902(2017).
- Fisher, P. Review of using rhodamine B as a marker for wildlife studies. Wildlife Society Bulletin. 27 (2), 318-329 (1999).
- Blanco, C. A., Perera, O., Ray, J. D., Taliercio, E., Williams, L. Incorporation of rhodamine B into male tobacco budworm moths Heliothis virescens to use as a marker for mating studies. Journal of Insect Science. 6, 5(2006).
- Mascari, T. M., Foil, L. D. Laboratory evaluation of the efficacy of fluorescent biomarkers for sugar-feeding sand flies (Diptera: Psychodidae). Journal of Medical Entomology. 47 (4), 664-669 (2014).
- Sarkar, D., Muthukrishnan, S., Sarkar, M. Fluorescent marked mosquito offer a method for tracking and study mosquito behaviour. International Journal of Mosquito Research. 4, 5-9 (2017).
- South, A., Sota, T., Abe, N., Yuma, M., Lewis, S. M. The production and transfer of spermatophores in three Asian species of Luciola fireflies. Journal of Insect Physiology. 54 (5), 861-866 (2008).
- Üner, O., Geçgel, Ü, Kolancilar, H., Bayrak, Y. Adsorptive removal of rhodamine B with activated carbon obtained from okra wastes. Chemical Engineering Communications. 204 (7), 772-783 (2017).
- Hagler, J. R., Jackson, C. G. Methods for marking insects: current techniques and future prospects. Annual Review of Entomology. 46, 511-543 (2001).
- Scolari, F., et al. Fluorescent sperm marking to improve the fight against the pest insect Ceratitis capitata (Wiedemann; Diptera: Tephritidae). New Biotechnology. 25 (1), 76-84 (2008).
- Ahmed, H. M. M., Hildebrand, L., Wimmer, E. A. Improvement and use of CRISPR/Cas9 to engineer a sperm-marking strain for the invasive fruit pest Drosophila suzukii. BMC Biotechnology. 19 (1), 85(2019).
- Botteon, V., Costa, M. L. Z., Kovaleski, A., Martinelli, L. A., Mastrangelo, T. Can stable isotope markers be used to distinguish wild and mass-reared Anastrepha fraterculus flies. PloS One. 13 (12), 0209921(2018).
- Hood-Nowotny, R., Mayr, L., Islam, A., Robinson, A., Caceres, C. Routine isotope marking for the Mediterranean fruit fly (Diptera: Tephritidae). Journal of Economic Entomology. 102 (3), 941-947 (2009).
- Schroeder, W. J., Mitchell, W. C. Marking Tephritidae fruit fly adults in Hawaii for release-recovery studies. Proceedings of the Hawaiian Entomological Society. 23 (3), 437-440 (1981).
- Akter, H., Taylor, P. W., Crisp, P. Visibility and persistence of fluorescent dyes, and impacts on emergence, quality, and survival of sterile Queensland fruit fly Bactrocera tryoni (Diptera: Tephritidae). Journal of Economic Entomology. 113 (6), 2800-2807 (2020).
- Oliva, C. F., Damiens, D., Benedict, M. Q. Male reproductive biology of Aedes mosquitoes. Acta Tropica. 132, Suppl 12-19 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon