Method Article
用于慢性病大型哺乳动物心脏模型对比增强显影显微计算机断层扫描的组织制备技术
摘要
在这里,我们提出了一种方案,以获得健康和病理性的大型哺乳动物全心的高分辨率微计算机断层扫描图像,并具有胶原选择性对比度增强。
摘要
结构重塑是施加在心脏上的慢性病理压力的常见后果。了解患病组织的结构和组成特性对于确定它们与心律失常行为的相互作用至关重要。低于临床分辨率的微尺度组织重塑正在成为致死性心律失常的重要来源,在年轻人中患病率很高。在足够微尺度分辨率下为临床前模型(例如大型哺乳动物全心)获得高成像对比度仍然存在挑战。此外,仍然缺乏用于三维高分辨率成像的组织组成选择性对比度增强。使用显微计算机断层扫描的非破坏性成像显示出高分辨率成像的前景。目的是减轻大型生物样品中X射线对衰减的影响。从健康猪(N = 2)和绵羊(N = 2)中提取心脏,这些猪诱导慢性心肌梗塞和纤维化瘢痕形成或诱导慢性心房颤动。切除的心脏灌注:补充钙离子猝灭剂和血管扩张剂的盐水溶液,连续脱水的乙醇和真空下的六甲基二硅烷。后者在风干1周期间加强了心脏结构。胶原显性组织被X射线造影剂磷酸钼酸选择性地结合。组织构象在空气中稳定,允许长时间的微算断层扫描采集以获得高分辨率(各向同性20.7μm)图像。 通过弥散获得最佳造影剂上样量显示健康猪心室中上皮层和心内膜下浦肯野纤维的选择性造影剂增强。心房颤动(AF)心脏在心房的后壁和附属物中显示出增强的造影剂积聚,归因于更高的胶原蛋白含量。心肌梗死心脏在心脏纤维化区域选择性地显示对比度增加,这使得能够识别交织的幸存心肌纤维。造影剂增强的风干组织制剂能够对完整的大型哺乳动物心脏进行微尺度成像,并对潜在疾病成分进行选择性造影增强。
引言
结构性心脏病占全世界心脏相关死亡率的大多数1.心脏结构的重塑会影响心肌环境和间质空间。由于心脏电和机械功能都依赖于肌细胞组织,因此破坏可导致无法忍受的心律失常,血液泵送作用受损和心力衰竭2,3,4,5,6,7,8,9。结构性心脏病治愈疗法的发展远远超过疾病流行率2,5。因此,越来越多的结构性心脏病临床前模型正在出现,以更好地了解心律失常的解剖学形态特征和由此产生的发病机制10,11,12,13,14,15,16,17,18,19,20,21,22,23.在整个结构疾病谱中观察到的是间质纤维化的上调,并且在缺血相关病例中更常见的是纤维化和脂肪组织的心肌替代18。对病理细胞外成分的形态学理解可以识别心律失常的潜在底物。该病的分布和程度为致心律失常风险提供了强有力的指标。然而,通过在完整心脏中整合宏观和微观尺度来全面成像疾病概况仍然存在挑战。
基于X射线的显微计算机断层扫描(microCT)正在成为使用造影剂询问软生物组织微观结构的强大工具。已经获得了来自小型啮齿动物心脏的高度详细的解剖图24,25,26 和来自大型哺乳动物心脏的小型解剖样本27,28。然而,大型哺乳动物心脏的整个器官水平的成像呈现过长的路径长度,使用常规组织制备技术可以衰减X射线光子。这涉及在采集期间对组织进行造影剂加载并将样品浸入造影剂溶剂中。增加样本数量和分辨率会延长总采集时间。因此,组织稳定性对于可用的图像重建至关重要,这意味着必须防止干燥引起的组织变形。然而,使用浸没液有缺点:(i)整体背景信号强度变得不可忽视,并且(ii)促进组织结合的对比分子的稀释。这两个因素都有助于降低图像对比度。
这项研究详细介绍了一种新的组织处理管道,以减轻背景光子衰减并优化对比度增强剂提供的动态范围。建议使用组织风干方法与化学组织加固以限制组织变形29。因此,组织样品可以在空气中保持稳定,以便长时间采集,并省略浸没液的背景贡献。该方法管道提供:(i)使用整猪心脏优化的综合组织处理和成像方案;(ii)对造影剂浓度和负荷技术的评估,以及(iii)该管道在羊心房颤动和心肌梗死的两种不同慢性疾病模型中的应用。开发慢性病模型的病症模型已在别处描述过每种慢性心脏病模型、经皮冠状动脉栓塞13 诱导的心肌梗死和自我维持性心房颤动30。
研究方案
所有实验均按照欧洲议会关于保护用于科学目的的动物的指令2010/63 / EU的指南进行。动物协议由波尔多大学当地伦理委员会(CEEA50)批准。心脏来自三种大型哺乳动物模型,包括(i)健康的大型白猪(N = 2,2个月大);(ii)绵羊(N = 1,2岁)诱发心肌梗死13 和(iii)绵羊(N = 1,7岁)诱发心房颤动30。
1. 溶液制备:
- 心脏不理溶液:准备3升蒸馏水,加入氯化钠(110mM),氯化钾(16mM),碳酸氢钠(10mM),D-(+)-葡萄糖(9mM),氯化钙溶液(1.2mM)和氯化镁溶液(16mM)。最后,加入500μL / L肝素钠。将此溶液保存在4°C。
- 磷酸盐缓冲盐水 - EDTA溶液(PBS-EDTA)。
- 首先,将乙二胺四乙酸(EDTA)加入1升蒸馏水中,最终浓度为10mM。使用氢氧化钠溶液(1 M)增加并保持溶液pH值为12以溶解EDTA。
- 一旦EDTA完全溶解,使用盐酸将pH值降低至7.4。加入一个磷酸盐缓冲盐水的铝箔袋,得到0.01M(氯化钠,0.138 M;氯化钾,0.0027M)和pH 7.4的溶液。在室温 (RT) 下保存此溶液。
- 乙醇 - 磷钼酸(PMA)造影剂溶液:制备1L无水乙醇并加入PMA以获得1%浓度的溶液。在 RT 保存此解决方案。
2. 组织来源
- 对动物实施安乐死,并根据当地的道德准则提取心脏。快速将心脏浸入冷的心律溶液中,轻轻按摩心室进行初次冲洗。
- 确保切开主动脉弓下方的主动脉,并使用针座夹住动脉壁的两侧。
- 通过针座悬挂心脏,将主动脉套管插入主动脉根部,注意不要与主动脉瓣接触或突出。将0号缝合线缠绕在套管水平的主动脉弓上,并将套管牢固地绑在适当的位置。
- 使用50 mL注射器,注射200 mL冷(4°C)心律失常溶液。通过将心脏的后侧倾斜以通过肺静脉引流来去除腔内多余的血液淤积。
- 浸入冲洗的心脏,并保存在冰上储存的冷心律溶液中,直到准备解剖。
3. 组织制备:
- 准备一个1 L的储液槽,支撑在解剖盘上方80厘米处。将长度为 80 cm、内径为 3.2 mm、外径为 4.8 mm 的热塑性塑料管连接到储液槽的排水口。
- 将三向丝锥固定在排水管上,并将进一步的热塑性管(20 cm、1.6 mm 内径和 3.2 mm 外径)耦合到三向水龙头上的每个自由端口。将双向水龙头固定在管道的收费端。
- 用补充肝素(2500单位)的心脏不理溶液填充储液槽。打开水龙头,让心律解压溶液排出并清除所有气泡,然后关闭双向水龙头。
- 使用聚四氟乙烯(PTFE)管(内径1毫米,外径2毫米)为左右冠状动脉口准备插管。
- 切下5厘米的管子,通过将尖端放在明火旁边加热一端。一旦尖端的1毫米开始熔化并变得半透明,将尖端压在坚硬的耐热表面上,在套管尖端处形成脊,以防止套管滑出容器。
- 将每个套管的非加热端插入1厘米到排水管的排水管的两端。
- 切除主动脉插管。在冷心律解压溶液下,定位冠状动脉的左右口。
- 使用尖剪刀,小心地将主动脉根部与冠状动脉口上方和下方的周围组织分开,以便在冠状动脉血管下穿线0 G丝缝线。
- 打开双向水龙头,将插管尖端插入冠状动脉口。当套管尖端延伸到口中1-2厘米并超出缝合线位置时,系上套管。
- 冲洗心脏,同时轻轻按摩心室15分钟,直到心脏清除血液。
- 冲洗后,关闭双向水龙头,然后将其与三向水龙头断开连接。将心脏转移到含有500 mL PBS-EDTA溶液的1L塑料耐化学容器中。
- 使用具有两个通道的蠕动泵在通风橱下的热塑性管中再循环PBS-EDTA溶液。对泵管进行注固,直到管子没有气泡,然后通过以80 mL / min在室温下再循环2小时来灌注每个冠状动脉插管。
- 确保通风柜正常运行。停止泵,从容器中排出溶液,并用福尔马林(10%)代替,以80 mL / min在室温下固定1小时。
- 用PBS替换福尔马林溶液,以80 mL / min冲洗固定剂三次,每次15分钟。
4.组织脱水和干燥:
注意:使用相同的灌注速率(80 mL / min),并让组织始终保持在RT状态。
- 用20%的乙醇代替PBS溶液,在超纯水中稀释,并浸泡至少3小时。
- 使用一系列递增的乙醇浓度灌注心脏。
- 首先用稀释至30%的乙醇代替20%乙醇溶液并浸泡2小时。
- 通过在每次迭代时将乙醇浓度增加至40%,50%,60%,65%,70%,75%,80%,95%,90%,95%,99%和100%,重复灌注,每个步骤(浓度)的最短持续时间为1小时。
注意:如果该浓度的最小灌注量为15分钟,则心脏样品可以在任何乙醇稀释下静置,没有灌注流量过夜。
- 可选:如果通过灌注应用造影剂,则用100%乙醇(补充造影剂PMA)灌注心脏,1%持续48小时。用100%乙醇灌注冲洗造影剂2小时。
- 为了在空气干燥之前加强心脏组织,将乙醇和六甲基二硅氮烷(HMDS)的50:50混合物再循环10分钟。接着100%HMDS再持续2小时。
注意:HMDS是一种剧毒和有毒物质。与空气接触时会释放出强烈的氨气味。此外,HMDS的液体形式具有高挥发性,并由含碘剂催化。 - 断开套管与导管的连接,并将心脏悬挂在通风室内的主动脉缝合线上。
- 小心地将拉链袋滑过心脏,并在缝合线上关闭袋子密封,以减少心脏暴露于循环空气。让心脏通过蒸发干燥1周。
- 可选:对于扩散负荷造影剂,在搅拌时用100%乙醇清洗心脏15分钟。将心脏浸入100%乙醇中,补充PMA,1%,在真空下48小时。重复步骤 4.6。
5. 微粒细胞计数:
注:台式X射线microCT系统用于猪心脏成像。
- 将风干的心放在合适的样品架上。使用固定在样品架上的夹子防止X射线microCT测量期间的任何移动,并通过干燥和刚性主动脉固定心脏。
- 沿其纵轴将心脏样本的中心与成像视场的中心一丝不苟地对齐,以旋转0°和90°。为了在所有方向上实现这一点,通过固定在样品支架上的主动脉夹将心脏悬挂在空气中。
- 打开软件并启动X射线microCT系统后,将X射线滤光片铝,1 mm,X射线源电压施加到60 kV,电流到120μA。将图像尺寸设置为2016 x 1344像素,像素大小设置为20μm。
- 将样品架缩回视野之外,并通过获得平场校正来校准背景图像和X射线曝光时间。确保平均背景X射线透射率大于80%。
- 侦察兵X射线沿支撑物的长度传输图像,以确定心脏纵轴上的整体成像场。对于扫描,请使用 0.18° 的旋转步长、5 的帧平均和 180° 的样本旋转。选择偏移扫描模式以成像样品支撑的整个宽度。
注意:本节中指示的采集参数已被选中,以优化整体心脏成分的图像质量。 - 扫描完成后,使用该软件对各向同性三维图像体积进行层析成像重建。对于NRecon软件的应用,请使用与采集相关的伪像校正,包括10%的光束硬化效果和8%的环形伪影减少。
- 要优化数据存储限制,请应用包含特定于心脏的图像体素的最小感兴趣矩形区域。以 8 位位图格式将图像导出为图像堆栈。
- 使用 DataViewer 软件可视化重建的数据堆栈。在图像边界内对样品进行数字定向,以将样品的长轴和短轴与图像体积的三个主轴重新对齐。
- 在所有三个轴上裁剪图像体积以删除图像的外部背景层,以最大程度地减小图像总大小。
结果
使用脱水和风干方法制备大型哺乳动物心脏可去除样品中的所有水分含量。在HMDS装载过程中可以观察到乙醇补充水不足的证据(参见协议,步骤4.4)。HMDS下水的存在会产生从组织中升起的气泡。在水位过高的情况下,浸泡液的温度可能会升高。在初始HMDS加载期间保持浸入室被冰包围可以减少组织加热的不良影响。在没有造影剂的情况下对心脏进行风干后,样品将呈现白色(参见实验方案,步骤4.6)。外表面通常在壁内层之前干燥且结构稳定。在造影剂加载之前在乙醇中冲洗除去白色沉积物(参见协议,步骤4.7)。使用锋利的刀片切开组织,在宏观上显示具有明显分离的单个肌肉纤维。通过将心脏样品浸入造影剂介质中来加载对比度,在样品的厚而高肌肉的区域中遭受扩散极限伪影的影响。真空下的扩散造影剂加载在肌肉中提供了更均匀的着色(心脏样本#1,造影剂加载时间见 表1 )。从宏观上看,表面造影剂分布显示心肌和主要由细胞外成分组成的区域之间的染色不均匀,特别是脂肪和结缔组织。在造影剂上样之前或之后,风干组织样品保持了稳定的结构完整性。
使用上述扫描参数和1700 ms的曝光时间在microCT下以20μm分辨率扫描样品全宽所需的时间为6小时34分钟。根据扫描仪龙门轴上样品的大小,该持续时间乘以捕获样品全长所需的位置数。对于本研究中的猪和羊心,使用了三到四个位置。NRecon软件平铺了多位置和偏移扫描,为X射线源和探测器的每个旋转步骤形成单个X射线投影图像。总共有 1000 个投影存储为 16 位图像,生成 30-40 GB 的数据。重建的体积图像为52-70 GB。
主要的解剖标志,包括心室腔,室间隔和心室的自由壁,很容易通过弥散负荷用造影剂染色的空气干燥猪心脏的X射线透射成像来识别(图1A)。此外,由于敏感的X射线衰减/透射,还观察到指示微观结构组织的高度纹理区域,例如心肌纤维取向(图1B)。三维图像体积的断层重建显示,在心外膜和内皮边界处,组织和背景之间存在明显的分离(图1D)。在脑内,在整个组织的厚透壁区域观察到低对比度和体素强度扩散梯度。尽管如此,由裂解平面分开的脉管系统和心肌纤维仍然很容易识别。在心外膜最高层和点状心内膜下区域观察到第二个更高强度的造影剂带宽。对比增强在细胞外成分积累的部位最大,特别是心外结缔组织,心外脂肪和浦肯野纤维网络的结缔组织鞘。体素信号强度分布显示与零强度背景(空气)和低对比度和高对比度组织的两个优势群体的高度分离(图1D)。
为了验证microCT图像重建的对比度增强和对心脏样品胶原区室的选择性,采用了组织学,明场显微镜和荧光显微镜(图2)。制备了来自风干心脏的心室组织的透壁阻滞,无需事先造影剂负荷,用于石蜡包埋和切片。安装在显微镜载玻片上的相邻组织切片通过Mason的三色染色处理,不处理或48小时的PMA(1%)。浸入载玻片上的组织切片消除了在整个心脏样品中观察到的染色过程的扩散梯度效应。Mason的三色染色显示上皮层和内皮层的胶原阳性染色,在心外膜外组织中的血管周围,以及围绕突出到左心室腔中的自由运行的浦肯野纤维的结缔组织鞘(图2A)。PMA染色后,明场照明在胶原结构中显示出较深的颜色,支持PMA的优先积累(图2B,C)。此外,PMA处理先前已被证明可以淬灭胶原蛋白大分子复合物31的自发荧光。心室组织切片的荧光图像具有PMA诱导的胶原位点荧光丧失(图2D 与 2E, 图2D'与 2E' 和 图2D''与 2E'')。在明场和荧光成像中,PMA处理未改变细胞区室,并且胶原蛋白具有PMA染色和自发荧光淬火的选择性积累。
心脏样品#2在空气干燥之前通过灌注用造影剂染色。图像重建显示心肌室内高度斑片状染色(图3A)。对比增强似乎对组织组成没有选择性,在心外膜或心内膜下区域的信号强度没有进一步增强。此外,低对比度组织与背景强度的分离效果较差(图3B)。
心室纤维化是由心肌梗死和慢性缺血引起的(心脏样本#3)。前顶瘢痕是通过将肌细胞替换为血管栓塞部位下游组织中的纤维脂肪沉积物而形成的。心脏样本#3从覆盖左心室前室,室间隔和右心室游离壁的解剖心室楔块制备和成像。该心室楔块构型的制备在前面32中已有描述,并且详细回顾了楔块在心脏成像中的应用33。瘢痕形态为透壁性但异质性(图 4)。中心致密的纤维化病变被松散和异质的边界区域包围(图4A)。通过扩散加载后空气干燥和真空对心室制剂进行染色。图4B-E显示了在组织边界和瘢痕区域重建的microCT图像体积的最大信号强度。造影剂染色不良的健康心肌,但保留了微观结构造影剂(图4C')。在边界区域,疤痕组织散布着幸存的心肌(图4D')。致密纤维化出现透壁但质地,表明成分存在差异(图4E')。通过与Mason的三色染色进行比较,使用风干和PMA染色组织制剂的透壁左心室区域的组织切片来验证PMA对病理组织中胶原蛋白的选择性(图4F)。PMA染色对胶原(心包膜下和心内膜亚)具有选择性,在幸存的心肌区域不存在(图4G)。
心脏样本#4诱导的持续性心房颤动被风干,同时保持心房腔的天然形状。未观察到心耳塌陷。主要的解剖学标志物可以从重建的图像(房间隔,果胶肌,冠状窦,肺静脉口,腔静脉和终疙薇)中从形态学上识别出来。真空下的弥散染色导致主动脉根部和房室瓣以及工作心肌的离散区域的对比度增强。肌肉染色增强局限于左心房和右心房的心耳和后壁(图5)。
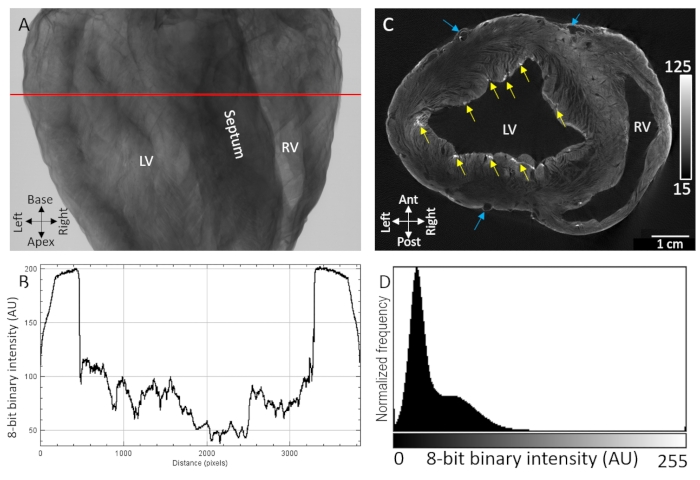
图1:通过真空扩散对用PMA造影剂处理的风干猪心脏的MicroCT成像。(B)从A的红线中提取的透射曲线(C)从断层重建的三维体积中取出的心室短轴切片。黄色箭头表示归因于心内膜下浦肯野纤维的点状对比区域。蓝色箭头表示脉管系统。(D)重建图像切片的信号强度分布,如C.LV:左心室和RV:右心室所示。请点击此处查看此图的大图。
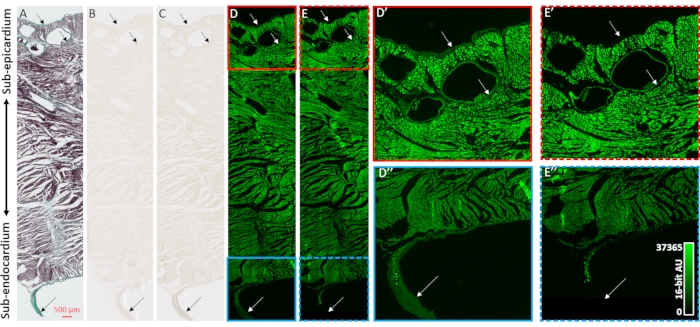
图2:胶原蛋白PMA选择性的验证。 (A)Masson从风干心脏的心室对透壁组织切片进行三色染色。心肌染成红色,胶原蛋白呈绿色。用明场照明对相邻组织切片(B)没有染色或(C)用PMA染色(1%)进行成像,以评估着色的均匀性。(D)通过荧光显微镜对没有染色或(E)PMA染色的组织切片进行成像。面板 D' (实心红色框)和 E' (虚线红色框)是未染色和PMA染色部分的亚表皮堤的放大视图。面板 D'' (实心蓝色框)和 E'' (虚线蓝色框)是心内膜下和自由运行的浦肯野纤维的相应放大视图。箭头表示胶原蛋白含量的部位。 请点击此处查看此图的大图。
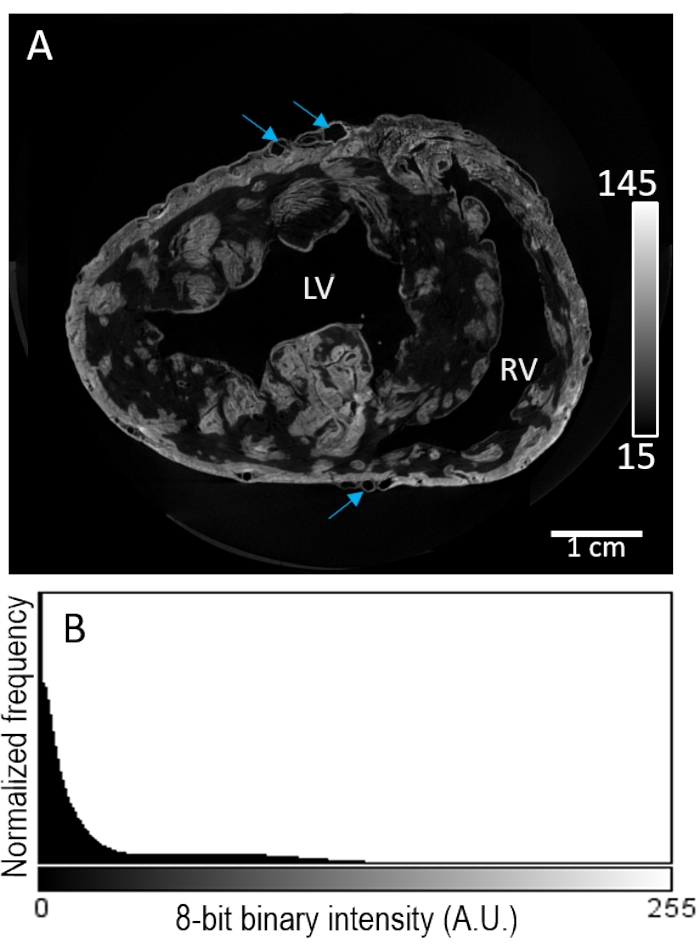
图3:风干和MicroCT成像前PMA的灌注负荷。 (A)来自猪心脏的心室重建图像体积的短轴切片。蓝色箭头表示脉管系统。(B)从面板 A的图像切片的信号强度分布。左心室:左心室,左心室:右心室。 请点击此处查看此图的大图。
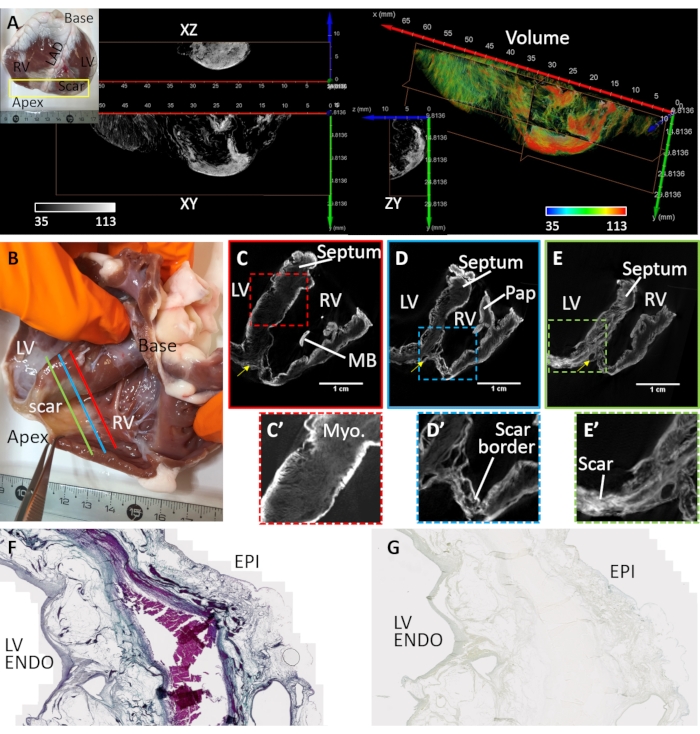
图4:患有慢性心肌梗塞的羊心的MicroCT成像。(A)在顶端区域形成致密的疤痕(见插图)。从心内膜角度对顶端区域进行体积渲染,根据图像强度(红色对应于瘢痕组织和绿色心肌)分配着色。灰度强度的正交切片显示致密的瘢痕分布和边缘幸存的心肌。纤维化组织和心肌之间的分离对应于脂肪组织的区域。(B)一张风干心室楔形准备的照片,该照片来自一只心肌梗死后有顶端瘢痕形成的绵羊。重建的microCT图像体积的斜片穿过基底和顶点之间的中层和近端的心室,到达(C)血管闭塞部位(图B中的C-红线),(D)与致密瘢痕和健康心肌接壤的周围梗死区域(图B中的D-蓝线)和(E)致密纤维化区域(图B中的E -绿线)。(C')隔膜区域的展开视图,由 C 中的红色虚线框勾勒。(D')右心室顶端梗死区域的扩展视图(图 D 中的蓝色虚线框)。(E')左心室顶点梗死区域的扩展视图(图 E 中的绿色虚线框)。左心室:左心室腔;RV:右心室腔;MB:慢人频段;巴氏:状肌。黄色箭头表示左前下动脉。(F)Masson对从PMA染色的风干左心室切割的组织学切片的三色染色。胶原蛋白被染成蓝色,心肌被染成粉红色/紫色。(G)PMA染色分布的相应组织切片。请点击此处查看此图的大图。
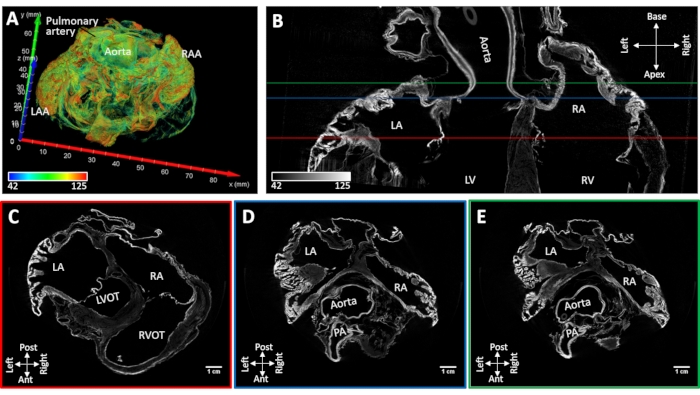
图5:慢性诱发心房颤动后羊心的MicroCT图像。(A)心房的体积渲染,其颜色如图4A所示。(B)心脏长轴的双心房microCT图像切片。在(C)房室瓣(图B中的C-红线),(D)主动脉根(图B中的D-蓝线)和(E)左心房顶(E-绿色线在面板B)的水平上提取短轴切片。洛杉矶:左心房;RA:右心房;LAA:左心耳;RAA:右心耳;左心室:左心室;房车:右心室;左心室泌尿管:左心室流出道;RVOT:右心室流出道和 PA:肺动脉。请点击此处查看此图的大图。
| 样本# | 1 | 2 | 3 | 4 |
| 物种 | 猪 | 猪 | 羊 | 羊 |
| 体重(公斤) | 32.4 | 31.2 | 47.2 | 53.4 |
| 心脏重量(g) | 191.2 | 186.2 | 202.4 | 207.6 |
| 病理学 | - | - | 慢性心肌梗死 | 慢性心房颤动 |
| 样品制备 | 全心全意 | 全心全意 | 前心脏楔形 | 全心全意 |
| 对比度加载模式 | 扩散 | 灌注 | 扩散 | 扩散 |
| 造影剂暴露(h) | 48 | 24 | 48 | 48 |
表1:心脏样本和造影剂治疗。
讨论
使用来自大型哺乳动物的全心脏进行大组织制备的详细方案,以进行随后的高分辨率结构成像。风干方法消除了背景X射线衰减的影响,并最大限度地优化了组织:背景对比度29。使用这种方法,在直径达7.2 cm的样品上实现了20μm范围内的各向同性分辨率,用于体积成像。然而,软组织的MicroCT通常依赖于使用非特异性造影剂来改善microCT系统的X射线吸收和灵敏度34。尽管X射线造影剂可改善整体X射线衰减和软组织成像增强,但基于生化成分的组织成分分离仍然具有挑战性。然而,观察到在实验室环境中使用风干心脏与常见的X射线造影剂PMA组合,选择性染色细胞外成分。与慢性病中健康心肌和病理结构重塑相关的结缔组织得到增强。
空气干燥生物组织的过程需要干预来抵抗样品的变形。用于电子显微镜的样品制备也有类似的要求。通常,采用临界点干燥方法,其使用组织浸泡介质,温度和压力的平衡来消除组织液体含量的表面张力,其在蒸发时在分子水平上引起变形35。这种方法需要用液态二氧化碳均匀地替换样品的含水量,这在小而容易扩散的样品中更可靠。或者,可以改善组织的结构完整性并进行空气干燥,即,蒸发相可以在更长的时间内施加以减少整体变形。分子HMDS经历硅烷化以形成硅氧烷基支架,以增强和稳定组织样品36的分子组织。通过限制来自环境的循环气流,进一步延长蒸发时间,同时避免不均匀蒸发,特别是在样品表面和壁内层之间。
许多造影剂以前已被用于软组织的microCT成像。最常见的是碘,磷钨酸(PTA)和PMA。碘特别被使用, 因为更高的扩散速率34,37,38.然而,碘充当HMDS试剂36的硅烷化的催化剂。催化反应具有侵蚀性和放热性,如果由于样品不完全干燥而残留HMDS仍然存在,则具有很高的试样破坏风险和安全风险。溶解在乙醇中的PTA和PMA都可以安全地与HMDS结合使用。PTA和PMA已被证明与碘染色相比,在非矿化椎间盘中提供更大的分辨能力38。在哺乳动物样品的microCT成像中,PTA和PMA已用于染色小鼠胚胎39,小鼠心血管系统37,兔肌肉和大脑40以及猪静脉41。PTA在溶液中具有比PMA更高的分子质量和密度。这部分是由于钨的原子质量较高(原子序数为74 g / mol),这是PTA中的主要衰减元素。相比之下,PMA中最重的元素钼的原子序数为42 g / mol。原子质量和样品密度都是X射线衰减的基础,此外还有样品厚度42。通过增加样本量来增加X射线路径长度,X射线衰减对增加的样品密度变得更加敏感。因此,选择较低密度的PMA造影剂,以降低过度衰减的风险,并优化人形尺度心脏的图像对比度的动态范围。进一步的证据表明,PMA的扩散负荷比心脏组织中较大的分子PTA提供更均匀的染色43。
造影剂递送的方法会影响心脏组织中造影剂分布的均匀性(图3)。由于血管阻力可变,乙醇脱水心脏中造影剂的灌注显示 PMA 的背景染色水平斑片状。在风干的心脏中,通过样品干燥过程强调肌肉层流结构,增加肌肉层流分离。这最终改善了基于扩散的造影剂上样的组织的整体通透性。因此,空气干燥促进了组织:层流和层内水平的空气对比(图4)。此外,通过在真空下施用可以进一步促进扩散加载。已经进一步表明,非干燥样品的组织收缩率取决于造影剂浓度40。然而,通过空气干燥对标本进行先前的形态学稳定抑制了组织收缩效应29。
整个器官的高分辨率microCT图像本身会产生大量数据。层析成像技术的本质是可以逐片进行可视化和图像处理,从而减轻了计算机处理和内存负担。但是,为了可视化三维图像堆栈,例如,以三维表示形式呈现标本体积,建议的最低计算机规格为128 GB RAM和3 GHz的处理器速度。
心脏领域microCT成像的出现为转化研究和临床验证提供了许多优势。其三维和显微成像的优势已经显示出在确定ST段抬高型心肌缺血患者的血栓负荷中的应用44,45。绘制结构性心脏病患者心律失常的潜在来源在很大程度上取决于确定纤维化瘢痕组织的分布和定位幸存心肌的交织轨迹。诊断室性心律失常的二线方法利用磁共振成像46.它可以稳健地定位致密纤维化,但仅限于低分辨率形态学表征,并且对纤维化病变的微观结构重塑和弥漫性分布提供有限的见解47。瘢痕分布和表征的高分辨率检查对于提高我们对心脏结构重塑和发生心力衰竭风险的理解具有巨大的潜力。特别是,基础研究或验尸研究将受益于用于心律失常电图谱的确凿结构图像。
总之,通过HMDS治疗和风干强化的心脏随后可以用X射线造影剂染色,以增强细胞外成分的X射线衰减。具体而言,在健康的心肌中,PMA积累发生在上皮,瓣膜组织和由结缔组织鞘的心室传导系统的室室,导致X射线衰减增强。此外,在结构病变的心肌中,增强的造影剂对纤维化具有进一步的选择性。
披露声明
没有
致谢
作为国家研究机构(ANR)管理的"未来投资"计划的一部分,该研究得到了法国政府的财政支持,赠款参考号ANR-10-IAHU-04和Leducq基金会(RHYTHM网络),以及赠款参考号ANR-17-CE14-0029-01 [UNMASC],来自欧洲心血管疾病研究区(ERA-CVD)的资金,赠款参考号H2020-HCO-2015_680969[MultiFib]和法国新阿基坦地区的资金, 授权参考号 2016 - 1R 30113 0000 7550/2016-1R 30113 0000 7553 和 ANR-19-ECVD-0006-01。
材料
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Diapath | F0043 | |
| Calcium chloride solution | Honeywell | 21114 | |
| Canulation Tubing PTFE | VWR | DENE3400102 | |
| Constant Head 1L Reservoir | Harvard Apparatus | 50-0496 | |
| D-(+)-Glucose | Sigma | G5767 | |
| Ethanol absolute | VWR | 20821.330 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | 796881 | |
| Heparin sodium (5000 U/mL) | Panpharma | 3400891287301. | |
| Hexamethyldisilazane (HMDS) | Sigma | 440191-1L | |
| Hydrochloric acid, ACS reagent, 37% | Sigma | 258148 | |
| Magnesium chloride solution | Honeywell | 63020 | |
| Phosphate buffered saline (PBS) | Sigma | P5368 | |
| Phosphomolybdic acid hydrate | Fisher Scientific | 417895000 | |
| Potassium Chloride | Sigma | P5405 | |
| Pump Tubing, 3-Stop | Ismatec | FV-96328-48 | |
| SkyScan, 1276 | Bruker | micro CT | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium Chloride | Sigma | S3014 | |
| Sodium hydroxide solution 50% in H2O | Sigma | 415413 | |
| Tube Connector Kits | Harvard Apparatus | 72-1407 | |
| Tubing pump | Ismatec | ISM 1089 | |
| Tubing Tygon R-3603 1.6 mm 3.2 mm 0.8 mm | VWR | 228-1279 | |
| Tubing Tygon R-3603 3.2 mm 4.8 mm 0.8 mm | VWR | 228-1283 | |
| Two-part single-use syringes 50 mL | Norm-Ject | 4850001000 | Pyrogen-free, PVC-free |
参考文献
- Srinivasan, N. T., Schilling, R. J. Sudden cardiac death and arrhythmias. Arrhythmia & Electrophysiology Review. 7 (2), 111-117 (2018).
- Szumowski, L., et al. Mapping and ablation of polymorphic ventricular tachycardia after myocardial infarction. Journal of the American College of Cardiology. 44 (8), 1700-1706 (2004).
- Bode, K., et al. Ablation of polymorphic ventricular tachycardias in patients with structural heart disease. PACE - Pacing and Clinical Electrophysiology. 31 (12), 1585-1591 (2008).
- Enjoji, Y., et al. Catheter ablation of fatal ventricular tachyarrhythmias storm in acute coronary syndrome-role of Purkinje fiber network. Journal of Interventional Cardiac Electrophysiology. 26 (3), 207-215 (2009).
- Sinha, A. M., et al. Role of left ventricular scar and purkinje-like potentials during mapping and ablation of ventricular fibrillation in dilated cardiomyopathy. PACE - Pacing and Clinical Electrophysiology. 32 (3), 286-290 (2009).
- Peichl, P., Čihák, R., Koželuhová, M., Wichterle, D., Vančura, V., Kautzner, J. Catheter ablation of arrhythmic storm triggered by monomorphic ectopic beats in patients with coronary artery disease. Journal of Interventional Cardiac Electrophysiology. 27 (1), 51-59 (2010).
- Marrouche, N. F., et al. Mode of initiation and ablation of ventricular fibrillation storms in patients with ischemic cardiomyopathy. Journal of the American College of Cardiology. 43 (9), 1715-1720 (2004).
- Bänsch, D., et al. Successful catheter ablation of electrical storm after myocardial infarction. Circulation. 108 (24), 3011-3016 (2003).
- Yokoshiki, H., Mitsuyama, H., Watanabe, M., Mizukami, K., Tsutsui, H. Suppression of ventricular fibrillation by electrical modification of the Purkinje system in hypertrophic cardiomyopathy. Heart and Vessels. 29 (5), 709-717 (2014).
- Agress, C. M., Rosenberg, M. J., Jacobs, H. I., Binder, M. J., Schneiderman, A., Clark, W. G. Protracted shock in the closed-chest dog following coronary embolization with graded microspheres. The American journal of physiology. 170 (3), 536-549 (1952).
- Bolukoglu, H., Liedtke, A. J., Nellis, S. H., Eggleston, A. M., Subramanian, R., Renstrom, B. An animal model of chronic coronary stenosis resulting in hibernating myocardium. American Journal of Physiology - Heart and Circulatory Physiology. 263, 20-29 (1992).
- Capone, R. J., Most, A. S., Sydlik, P. A. Precordial ST segment mapping. A sensitive technique for the evaluation of myocardial injury. CHEST. 67 (5), 577-582 (1975).
- Dib, N., Diethrich, E. B., Campbell, A., Gahremanpour, A., McGarry, M., Opie, S. R. A percutaneous swine model of myocardial infarction. Journal of Pharmacological and Toxicological Methods. 53 (3), 256-263 (2006).
- Dogné, J. M., et al. Characterization of an original model of myocardial infarction provoked by coronary artery thrombosis induced by ferric chloride in pig. Thrombosis Research. 116 (5), 431-442 (2005).
- Eldar, M., Ohad, D., Bor, A., Varda-Bloom, N., Swanson, D. K., Battler, A. A closed-chest pig model of sustained ventricular tachycardia. Pacing and Clinical Electrophysiology. 17 (10), 1603-1609 (1994).
- Elzinga, W. E. Ameroid constrictor: uniform closure rates and a calibration procedure. Journal of applied physiology. 27 (3), 419-421 (1969).
- Hughes, G. C., Post, M. J., Simons, M., Annex, B. H. Translational physiology: Porcine models of human coronary artery disease: Implications for preclinical trials of therapeutic angiogenesis. Journal of Applied Physiology. 94 (5), 1689-1701 (2003).
- Lichtig, C., Brooks, H., Chassagne, G., Glagov, S., Wissler, R. W. Basic fuchsin picric acid method to detect acute myocardial ischemia. An experimental study in swine. Archives of Pathology and Laboratory Medicine. 99 (3), 158-161 (1975).
- Näslund, U., Häggmark, S., Johansson, G., Pennert, K., Reiz, S., Marklund, S. L. Effects of reperfusion and superoxide dismutase on myocardial infarct size in a closed chest pig model. Cardiovascular Research. 26 (2), 170-178 (1992).
- Reffelmann, T., et al. A novel minimal-invasive model of chronic myocardial infarction in swine. Coronary Artery Disease. 15 (1), 7-12 (2004).
- Reimer, K. A., Lowe, J. E., Rasmussen, M. M., Jennings, R. B. The wavefront phenomenon of ischemic cell death. 1. Myocardial infarct size vs duration of coronary occlusion in dogs. Circulation. 56 (5), 786-794 (1977).
- Salazar, A. E. Experimental myocardial infarction. Induction of coronary thrombosis in the intact closed-chest dog. Circulation research. 9, 1351-1356 (1961).
- Takahashi, M., et al. Effects of angiotensin I-converting enzyme inhibitor and angiotensin II type 1 receptor blocker on the right ventricular sarcoglycans and dystrophin after left coronary artery ligation. European Journal of Pharmacology. 522 (1-3), 84-93 (2005).
- Gonzalez-Tendero, A., et al. Whole heart detailed and quantitative anatomy,myofibre structure and vasculature from X-ray phase-contrast synchrotron radiation-basedmicro computed tomography. European Heart Journal Cardiovascular Imaging. 18 (7), 732-741 (2017).
- Teh, I., et al. Resolving fine cardiac structures in rats with high-resolution diffusion tensor imaging. Scientific Reports. 6, 30573 (2016).
- Teh, I., et al. Validation of diffusion tensor MRI measurements of cardiac microstructure with structure tensor synchrotron radiation imaging. Journal of Cardiovascular Magnetic Resonance. 19 (1), 31 (2017).
- Abouezzeddine, O., et al. Relevance of endocavitary structures in ablation procedures for ventricular tachycardia. Journal of Cardiovascular Electrophysiology. 21 (3), 245-254 (2010).
- Pambrun, T., et al. Epicardial course of the septopulmonary bundle: Anatomical considerations and clinical implications for roof line completion. Heart Rhythm. 18 (3), 349-357 (2021).
- Pallares-Lupon, N., et al. Optimizing large organ scale micro computed tomography imaging in pig and human hearts using a novel air-drying technique. bioRxiv. , (2021).
- Martins, R. P., et al. Dominant frequency increase rate predicts transition from paroxysmal to long-term persistent atrial fibrillation. Circulation. 129 (14), 1472-1482 (2014).
- Puchtler, H., Waldrop, F. S., Valentine, L. S. Fluorescence microscopic distinction between elastin and collagen. Histochemie. 35 (1), 17-30 (1973).
- Walton, R. D., et al. Compartmentalized Structure of the Moderator Band Provides a Unique Substrate for Macroreentrant Ventricular Tachycardia. Circulation: Arrhythmia and Electrophysiology. 11 (8), 005913 (2018).
- Di Diego, J. M., Sicouri, S., Myles, R. C., Burton, F. L., Smith, G. L., Antzelevitch, C. Optical and electrical recordings from isolated coronary-perfused ventricular wedge preparations. Journal of Molecular and Cellular Cardiology. 54, 53-64 (2013).
- Pauwels, E., Van Loo, D., Cornillie, P., Brabant, L., Van Hoorebeke, L. An exploratory study of contrast agents for soft tissue visualization by means of high resolution X-ray computed tomography imaging. Journal of Microscopy. 250 (1), 21-31 (2013).
- Mulet, A. Book Review: Modern Drying Technology, Volume 3: Product Quality and Formulation , edited by E. Tsotsas and A. S. Mujumdar. Drying Technology. 32 (2), 244-245 (2014).
- Karimi, B., Golshani, B. Mild and highly efficient method for the silylation of alcohols using hexamethyldisilazane catalyzed by iodine under nearly neutral reaction conditions. Journal of Organic Chemistry. 65 (21), 7228-7230 (2000).
- Dunmore-Buyze, P. J., et al. Three-dimensional imaging of the mouse heart and vasculature using micro-CT and whole-body perfusion of iodine or phosphotungstic acid. Contrast Media and Molecular Imaging. 9 (5), 383-390 (2014).
- Disney, C. M., Madi, K., Bodey, A. J., Lee, P. D., Hoyland, J. A., Sherratt, M. J. Visualising the 3D microstructure of stained and native intervertebral discs using X-ray microtomography. Scientific Reports. 7 (1), 16279 (2017).
- Descamps, E., Sochacka, A., de Kegel, B., Van Loo, D., Hoorebeke, L., Adriaens, D. Soft tissue discrimination with contrast agents using micro-ct scanning. Belgian Journal of Zoology. 144 (1), (2014).
- Buytaert, J., Goyens, J., De Greef, D., Aerts, P., Dirckx, J. Volume shrinkage of bone, brain and muscle tissue in sample preparation for micro-CT and light sheet fluorescence microscopy (LSFM). Microscopy and Microanalysis. 20 (4), 1208-1217 (2014).
- Nierenberger, M., Rémond, Y., Ahzi, S., Choquet, P. Assessing the three-dimensional collagen network in soft tissues using contrast agents and high resolution micro-CT: Application to porcine iliac veins. Comptes Rendus - Biologies. 338 (7), 425-433 (2015).
- Speck, U. . General principles of x-ray contrast media. X-Ray Contrast Media. , (2018).
- Rajasekar, A., Trew, M. L., Sands, G. B. . Understanding and enhancing the use of micro-computed tomography in soft tissue. , (2015).
- Karagiannidis, E., et al. Micro-CT-based quantification of extracted thrombus burden characteristics and association with angiographic outcomes in patients with ST-elevation myocardial infarction: The QUEST-STEMI Study. Frontiers in Cardiovascular Medicine. 8, 646064 (2021).
- Karagiannidis, E., et al. Serum ceramides as prognostic biomarkers of large thrombus burden in patients with stemi: A micro-computed tomography study. Journal of Personalized Medicine. 11 (2), 89 (2021).
- Hennig, A., et al. High-resolution three-dimensional late gadolinium-enhanced cardiac magnetic resonance imaging to identify the underlying substrate of ventricular arrhythmia. Europace : European Pacing, Arrhythmias, and Cardiac Electrophysiology: Journal of the Working Groups on Cardiac Pacing, Arrhythmias, and Cardiac Cellular Electrophysiology of the European Society of Cardiology. 20, 179-191 (2018).
- Lorgis, L., et al. Relationship between fragmented QRS and no-reflow, infarct size, and peri-infarct zone assessed using cardiac magnetic resonance in patients with myocardial infarction. Canadian Journal of Cardiology. 30 (2), 204-210 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。