Method Article
Técnicas de preparação de tecidos para imagens de tomografia microcomputante aprimorada de contraste de grandes modelos cardíacos de mamíferos com doença crônica
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para obter imagens de tomografia micro computada de alta resolução de corações integrais saudáveis e patológicos de grandes mamíferos com aprimoramento de contraste seletivo de colágeno.
Resumo
A remodelagem estrutural é uma consequência comum das tensões patológicas crônicas impostas ao coração. Compreender as propriedades arquitetônicas e composicionais do tecido doente é fundamental para determinar suas interações com comportamento arrítmico. A remodelagem de tecidos em microescala, abaixo da resolução clínica, está emergindo como uma importante fonte de arritmia letal, com alta prevalência em adultos jovens. Os desafios permanecem na obtenção de alto contraste de imagem em resolução de microescala suficiente para modelos pré-clínicos, como grandes corações inteiros de mamíferos. Além disso, ainda falta um aprimoramento de contraste seletivo para a composição de tecidos para imagens tridimensionais de alta resolução. Imagens não destrutivas usando tomografia microcomputnada mostram promessa para imagens de alta resolução. O objetivo era aliviar a sumência do raio-X sobre atenuação em grandes amostras biológicas. Os corações foram extraídos de suínos saudáveis (N = 2) e ovelhas (N = 2) com infarto crônico induzido do miocárdio e formação de cicatrizes fibrosas ou fibrilação atrial crônica induzida. Corações excisados foram perfundidos com: uma solução salina suplementada com um agente de saciação de íons de cálcio e um vasodilatador, etanol em desidratação serial e hexaametildisilizano sob vácuo. Este último reforçou a estrutura cardíaca durante a secagem do ar por 1 semana. O tecido dominante do colágeno foi seletivamente ligado por um agente de aumento de contraste de raios-X, ácido fosfomólico. A conformação tecidual foi estável no ar, permitindo aquisições de tomografia microcomputada de longa duração para obter imagens de alta resolução (isotrópica de 20,7 μm). O carregamento ideal do agente de contraste por difusão mostrou o aprimoramento seletivo do contraste da camada epitelial e das fibras purkinje sub-endocárdicos em ventrículos de porco saudáveis. Os corações de fibrilação atrial (AF) apresentaram maior acúmulo de contraste nas paredes posteriores e apêndices da átrida, atribuídos a maior teor de colágeno. Os corações de infarto do miocárdio apresentaram maior contraste seletivamente em regiões de fibrose cardíaca, o que possibilitou a identificação de fibras musculares do miocárdio sobreviventes. Preparações de tecido seco a ar reforçadas pelo contraste permitiram imagens em microescala do coração grande mamífero intacto e o aprimoramento seletivo do contraste dos constituintes da doença subjacente.
Introdução
Doenças cardíacas estruturais são responsáveis pela maioria da mortalidade cardíacaem todo o mundo. A remodelação da estrutura cardíaca influencia o ambiente miocárdio e o espaço intersticial. Como tanto a função elétrica e mecânica cardíaca depende da organização do miócito, a interrupção pode levar a arritmia cardíaca intolerável, ações de bombeamento sanguíneo prejudicadas e insuficiência cardíaca 2,3,4,5,6,7,8,9. A evolução das terapias curativas para doenças cardíacas estruturais é muito superior à prevalência da doença 2,5. Como tal, um número crescente de modelos pré-clínicos de doenças cardíacas estruturais estão surgindo para entender melhor os perfis anatomo-morfológicos e a patogêmia resultante das arritmias cardíacas 10,11,12,13,14,15,16,17,18,19,20, 21,22,23. Observada em todo o espectro de doenças estruturais está a regulação da fibrose intersticiais e, mais comumente em casos relacionados à isquemia, substituição do miocárdio por fibrose e tecido adiposo18. A compreensão morfológica dos componentes extracelulares patológicos pode permitir a identificação de substratos potenciais de arritmia. A distribuição e extensão da doença fornecem fortes indicadores de risco arritmogênico. No entanto, os desafios permanecem para a imagem abrangente de perfis de doenças, integrando macro e microescalas no coração intacto.
A tomografia microcomputada (microCT), baseada em raios-X, está emergindo como uma poderosa ferramenta para interrogar a microestrutura de tecido biológico mole usando agentes de contraste. Mapas anatômicos altamente detalhados foram obtidos para corações de pequenos roedores 24,25,26 e pequenas amostras dissecadas de grandes corações mamíferos27,28. No entanto, imagens em todo o nível de órgãos de grandes corações mamíferos apresentam comprimentos excessivos de caminho sobre os quais fótons de raios-X são atenuados usando técnicas convencionais de preparação de tecidos. Isso envolve o carregamento do tecido em contraste e a imersão da amostra em um agente de contraste solvente durante a aquisição. O aumento do tamanho e resolução da amostra impõe um prolongamento do tempo total de aquisição. Portanto, a estabilidade tecidual torna-se crucial para a reconstrução de imagem útil, o que significa que a deformação tecidual resultante da secagem deve ser evitada. O uso de um fluido de imersão, no entanto, tem desvantagens: (i) a intensidade geral do sinal de fundo torna-se não desprezível e (ii) promove a diluição de moléculas de contraste ligadas ao tecido. Ambos os fatores contribuem para a redução do contraste da imagem.
Este estudo detalha um novo pipeline de processamento de tecidos para aliviar a atenuação de fótons de fundo e otimizar o alcance dinâmico proporcionado por agentes de aprimoramento de contraste. Sugere-se o uso de uma abordagem de secagem de ar de tecido com reforço de tecido químico para limitar a deformação tecidual29. Portanto, as amostras de tecido podem permanecer estáveis no ar para aquisições longas e omitir contribuições de fundo de fluidos de imersão. Este pipeline de metodologia fornece: (i) um protocolo abrangente de processamento de tecidos e imagem otimizado utilizando corações inteiros de suínos; (ii) uma avaliação das técnicas de concentração e carregamento de contraste e, (iii) aplicação deste gasoduto em dois modelos distintos de doenças crônicas de fibrilação atrial e infarto do miocárdio em corações de ovinos. O desenvolvimento dos modelos de doenças crônicas tem sido descrito em outros lugares para cada modelo de doença cardíaca crônica, infarto do miocárdio induzido pela embolização da artéria coronária percutânea13 e fibrilação atrial autossustentável30.
Protocolo
Todos os experimentos foram realizados seguindo as diretrizes da Diretiva 2010/63/UE do Parlamento Europeu sobre a proteção de animais utilizados para fins científicos. Os protocolos animais foram aprovados pelo Comitê de Ética local (CEEA50) da Universidade de Bordeaux. Os corações foram originados de três grandes modelos de mamíferos, incluindo (i) porcos brancos grandes saudáveis (N = 2, 2 meses de idade); (ii) Ovelha (N = 1, 2 anos) com infarto induzido do miocárdio13 e (iii) Ovelha (N = 1, 7 anos) com fibrilação atrial induzida30.
1. Preparação da solução:
- Solução cardioplégica: Preparar 3 L de água destilada e adicionar cloreto de sódio (110 mM), cloreto de potássio (16 mM), bicarbonato de sódio (10 mM), D-(+)-Glicose (9 mM), solução de cloreto de cálcio (1,2 mM) e solução de cloreto de magnésio (16 mM). No final, adicione 500 μL/L de sódio de heparina. Conservar esta solução a 4 °C.
- Soro fisiológico tamponado fosfato - solução EDTA (PBS-EDTA).
- Primeiro, adicione ácido etilenodiaminatotraacético (EDTA) a 1 L de água destilada para uma concentração final de 10 mM. Aumente e mantenha uma solução de pH de 12 utilizando solução de hidróxido de sódio (1 M) para dissolver o EDTA.
- Uma vez que o EDTA esteja totalmente dissolvido, abaixe o pH para 7,4 usando ácido clorídrico. Adicione uma bolsa de papel alumínio de soro fisiológico tamponado para obter uma solução a 0,01 M (cloreto de sódio, 0,138 M; cloreto de potássio, 0,0027 M) e pH 7,4. Conservar esta solução à temperatura ambiente (RT).
- Etanol - solução de agente de contraste do ácido fosfomlídico (PMA): Preparar 1 L de etanol absoluto e adicionar o PMA para obter uma solução a 1% da concentração. Conservar esta solução na RT.
2. Fonte de tecido
- Eutanize o animal e extraia o coração de acordo com as diretrizes éticas locais. Imerque rapidamente o coração em solução cardioplégica fria e massageie suavemente os ventrículos para lavagem inicial.
- Certifique-se de cortar a aorta abaixo do arco aórtico e fixar dois lados da parede arterial usando suportes de agulha.
- Suspendendo o coração pelos suportes de agulha, insira uma cânula aórtica na raiz aórtica, tomando cuidado para não fazer contato ou protuberar através das válvulas aórticas. Enrole uma sutura de calibre 0 ao redor do arco aórtico ao nível da cânula e amarre firmemente a cânula no lugar.
- Utilizando seringas de 50 mL, injete 200 mL de solução cardioplégica fria (4 °C). Remova o excesso de sangue acumulado nas cavidades derrubando o coração no lado posterior para drenar através das veias pulmonares.
- Mergulhe o coração enxaguado e mantenha em solução cardioplégica fria armazenada no gelo até estar pronto para dissecção.
3. Preparação tecidual:
- Prepare um reservatório de 1 L suportado 80 cm acima de um prato de dissecção. Acoplamento de tubo termoplástico de 80 cm de comprimento e 3,2 mm de diâmetro interno e 4,8 mm de diâmetro externo a uma porta de drenagem do reservatório.
- Fixar uma torneira de três vias na tubulação de drenagem e acoplamento mais termoplástico (20 cm, 1,6 mm de diâmetro interno e 3,2 mm de diâmetro externo) a cada porta livre na torneira de três vias. Corrija as torneiras bidireis nas extremidades da taxa da tubulação.
- Encha o reservatório com a solução cardioplégica suplementada com heparina (2500 unidades). Abra as torneiras para permitir que a solução cardioplégica escorra e remova todas as bolhas de ar e feche as torneiras bidireis.
- Prepare a cânula para osstia coronária esquerda e direita usando tubos de Politetrafluoroetileno (PTFE) (1 mm de diâmetro interno e 2 mm de diâmetro externo).
- Corte 5 cm de tubulação e aqueça uma extremidade colocando a ponta ao lado de uma chama nua. Uma vez que 1 mm da ponta começa a derreter e se torna translúcido, pressione a ponta contra uma superfície resistente ao calor duro para moldar um cume na ponta da cânula para evitar que a cânula escorregue para fora dos vasos.
- Insira 1 cm da extremidade não aquecida de cada cânula nas duas extremidades da tubulação de drenagem do reservatório de drenagem.
- Remova a cânula aórtica. Sob solução cardioplégica fria, localize a ostia esquerda e direita das artérias coronárias.
- Utilizando uma tesoura pontiaguda, separe cuidadosamente a raiz aórtica do tecido circundante acima e abaixo da ostia coronária para permitir a rosca de uma sutura de seda de 0 G sob o vaso coronário.
- Abra as torneiras bidirecional e insira as pontas de cânula na ostia coronária. Com as pontas da cânula estendendo-se de 1-2 cm para a ostia e além da colocação da sutura, amarre a cânula.
- Enxágüe o coração enquanto massageia suavemente os ventrículos por 15 minutos até que o coração esteja limpo de sangue.
- Depois de enxaguar, feche as torneiras bidireis e desconecte-as da torneira de três vias. Transfira o coração para um recipiente resistente a produtos químicos de plástico 1 L contendo 500 mL de solução PBS-EDTA.
- Recircular a solução PBS-EDTA no tubo termoplástico sob um capô de fumaça usando uma bomba peristáltica com dois canais. Prime a tubulação da bomba até que o tubo esteja ausente de bolhas de ar, em seguida, perfunde cada cannulato da artéria coronária por recirculação em RT por 2 h a 80 mL/min.
- Certifique-se de que o capô da fumaça está operacional. Pare a bomba, escorra a solução do recipiente e substitua-a por formalina (10%) para fixação por 1h na RT a 80 mL/min.
- Substitua a solução de formalina por PBS para enxaguar o fixador três vezes por 15 minutos cada a 80 mL/min.
4. Desidratação e secagem de tecidos:
NOTA: Use a mesma taxa de perfusão (80 mL/min) e deixe o tecido permanecer em RT durante todo o tempo.
- Substitua a solução PBS por etanol a 20%, diluída em água ultra-pura e perfuse por um mínimo de 3h.
- Perfunda o coração usando uma série de concentrações de etanol incrementando.
- Comece substituindo a solução de 20% de etanol por etanol diluído para 30% e perfuse por 2h.
- Repetir a perfusão aumentando a concentração de etanol em cada iteração para 40%, 50%, 60%, 65%, 70%, 75%, 80%, 95%, 90%, 95%, 99% e 100% para uma duração mínima de 1h a cada etapa (concentração).
NOTA: As amostras cardíacas podem descansar sem fluxo de perfusão durante a noite em qualquer diluição de etanol se ocorreu a perfusão mínima de 15 min para essa concentração.
- OPCIONAL: Se aplicar agentes de contraste via perfusão, perfunda o coração com 100% de etanol complementado com o agente de contraste PMA, 1% para 48h. Enxágüe o agente de contraste por perfusão com 100% de etanol por 2h.
- Para reforçar o tecido cardíaco antes da secagem do ar, recircular uma mistura de 50:50 de etanol e hexametiletiladisilazane (HMDS) por 10 minutos. Siga isso por 100% HMDS por mais 2 h.
ATENÇÃO: O HMDS é uma substância altamente tóxica e nociva. Um forte odor de amônia é liberado em contato com o ar. Além disso, a forma líquida de HMDS é altamente volátil e catalisada por agentes contendo iodo. - Desconecte a cânula da tubulação e suspenda o coração de uma sutura aórtica dentro do capô da fumaça.
- Deslize cuidadosamente um saco zip-lock sobre o coração e feche o selo do saco sobre a sutura para reduzir a exposição do coração ao ar circulante. Deixe o coração secar durante a evaporação por 1 semana.
- OPCIONAL: Para agentes de contraste de carregamento de difusão, lave o coração em 100% etanol por 15 minutos enquanto agita. Mergulhe o coração em 100% etanol suplementado com PMA, 1%, para 48 h sob vácuo. Repita o passo 4.6.
5. MicroCT:
NOTA: Um sistema microCT de raios-X de desktop foi usado para a imagem de corações de porco.
- Monte o coração seco ao ar em um suporte de amostra apropriado. Evite qualquer movimento durante as medições de microC de raios-X usando um grampo ancorado no suporte da amostra e fixe o coração através da aorta seca e rígida.
- Alinhe meticulosamente o centro da amostra cardíaca ao longo de seu eixo longitudinal com o centro do campo de visão de imagem para ângulos de rotação de 0° e 90°. Para conseguir isso em todas as orientações, suspenda o coração no ar através de um grampo aórtico fixado ao suporte da amostra.
- Depois de abrir o software e iniciar o sistema microCT de raios-X, aplique o filtro de raios-X de alumínio, 1 mm, tensão de fonte de raios-X a 60 kV e corrente para 120 μA. Defina as dimensões da imagem para 2016 x 1344 pixels e tamanho do pixel até 20 μm.
- Retire o suporte amostral do campo de visão e calibrar a imagem de fundo e o tempo de exposição de raios-X obtendo uma correção de campo plano. Certifique-se de que a transmissão média de raios-X de fundo seja superior a 80%.
- Imagens de transmissão de raios-X scout ao longo do comprimento do suporte para determinar o campo de imagem geral no eixo longitudinal do coração. Para digitalização, use uma etapa de rotação de 0,18°, uma média de quadro de 5 e uma rotação amostral de 180°. Selecione o modo de varredura offset para imagem da largura total do suporte à amostra.
NOTA: Os parâmetros de aquisição indicados nesta seção foram selecionados para otimizar a qualidade da imagem da composição cardíaca do conjunto. - Após a varredura, use o software para reconstrução tomográfica de um volume de imagem tridimensional isotrópica. Para a aplicação do software NRecon, use correção de artefatos relacionados à aquisição, incluindo efeitos de endurecimento de feixe de 10% e redução de artefato de anel de 8.
- Para otimizar as limitações de armazenamento de dados, aplique a região retangular mínima de interesse que engloba voxels de imagem específicos do coração. Exporte as imagens em um formato bitmap de 8 bits como uma pilha de imagens.
- Visualize a pilha de dados reconstruída usando o software DataViewer. Oriente digitalmente a amostra dentro dos limites da imagem para realinhar os eixos longos e curtos da amostra com os três eixos principais do volume de imagem.
- Corte o volume de imagem em todos os três eixos para remover camadas externas de fundo da imagem, para reduzir ao máximo o tamanho total da imagem.
Resultados
A preparação de grandes corações mamíferos usando o método de desidratação e secagem do ar remove todo o teor de água da amostra. Podem ser observadas evidências de reposição insuficiente de água por etanol durante o carregamento do HMDS (ver Protocolo, etapa 4.4). A presença de água sob HMDS criará bolhas saindo do tecido. No caso do excesso de níveis de água, pode ocorrer um aumento na temperatura do fluido de imersão. Manter a câmara de imersão cercada por gelo durante o carregamento inicial de HMDS pode reduzir os efeitos nocivos do aquecimento tecidual. Após a secagem do ar na ausência de agentes de contraste, a amostra aparecerá em cor branca (ver Protocolo, passo 4.6). A superfície externa era frequentemente seca e estruturalmente estável antes das camadas intramuros. Enxaguar no etanol antes do carregamento do agente de contraste removeu o depósito branco (ver Protocolo, etapa 4.7). Cortar através do tecido usando uma lâmina afiada revela fibras musculares macroscopicamente individuais com separação clara. O carregamento de contraste por meio de agente de contraste sofria de artefatos de limite de difusão em regiões espessas e altamente musculares da amostra. O carregamento de contraste de difusão sob vácuo proporcionou uma coloração mais homogênea no músculo (amostra cardíaca #1, ver Tabela 1 para tempos de carregamento de agente de contraste). Macroscopicamente, a distribuição do agente de contraste superficial mostrou coloração ingêneo entre o músculo cardíaco e regiões compostas principalmente de componentes extracelulares, notadamente gordura e tecido conjuntivo. Amostras de tecido seco a ar, antes ou depois do carregamento do agente de contraste, mantiveram a integridade estrutural estável.
O tempo necessário para escanear a largura total da amostra em resolução de 20 μm sob microCT utilizando os parâmetros de varredura acima mencionados e um tempo de exposição de 1700 ms foi de 6 h 34 min. Dependendo do tamanho da amostra no eixo de pórtico do scanner, essa duração foi multiplicada pelo número de posições necessárias para capturar toda a extensão do espécime. Para os corações de suínos e ovinos neste estudo, foram utilizadas três a quatro posições. O software NRecon ladrilhou as varreduras multi-posição e offset para formar uma única imagem de projeção de raios-X para cada etapa de rotação da fonte e detector de raios-X. No total, 1000 projeções são armazenadas como imagens de 16 bits, gerando 30-40 GB de dados. As imagens volumosas reconstruídas foram de 52-70 GB.
Os principais marcos anatômicos, incluindo as cavidades ventriculares, o septo e as paredes livres dos ventrículos, eram facilmente identificáveis a partir de imagens de transmissão de raios-X de corações de porco secos manchados com agente de contraste por carregamento de difusão (Figura 1A). Além disso, regiões altamente texturizadas que indicavam organização microestrutural, como orientação de fibras miocárdias, também foram observadas devido à atenuação/transmissão sensível de raios-X (Figura 1B). Reconstruções tomográficas de volumes de imagem tridimensional mostraram separação distinta entre tecido e fundo nas fronteiras epicárida e endotelial (Figura 1D). Nadáricamente, o gradiente de difusão de baixo contraste e intensidade de voxel foi observado em regiões transmurais espessas do tecido. Apesar disso, vasculatura e fibras miocárdias separadas por planos de decote ainda eram facilmente identificáveis. Uma segunda largura de banda de maior intensidade de contraste foi observada na camada epicárida mais e em regiões sub-endocárdicas pontuais. O aprimoramento do contraste foi maior em locais onde os componentes extracelulares foram acumulados, particularmente tecido conjuntivo epicárcutal, gordura epicárcutal e a bainha de tecido conjuntivo da rede de fibras Purkinje. As distribuições de intensidade de sinal voxel mostraram alta separação do fundo de intensidade zero (ar) e duas populações dominantes de tecido de baixo e alto contraste (Figura 1D).
Para validar o aprimoramento do contraste das reconstruções de imagens microCT e a seletividade aos compartimentos colágenos das amostras cardíacas, foram empregadas microscopia de campo brilhante e microscopia fluorescente (Figura 2). Um bloco transmural de tecido ventricular de um coração seco ao ar sem carga prévia de agente de contraste foi preparado para incorporação e secção de parafina. As fatias de tecido adjacentes montadas em lâminas de microscópio foram tratadas pela coloração tricrática de Masson, sem tratamento, ou 48h de PMA (1%). A imersão de seções de tecido montada em slides eliminou efeitos gradientes de difusão do processo de coloração que foi observado em amostras cardíacas inteiras. A coloração tricrática de Mason mostrou coloração positiva de colágeno nas camadas epiteliais e endoteliais, perivascularmente no tecido sub-epicardial, e uma bainha de tecido conjuntivo em torno de uma fibra purkinje livre surgindo na cavidade ventricular esquerda (Figura 2A). A iluminação de campo brilhante mostrou coloração mais escura em estruturas colágenos após a coloração do PMA, suportando o acúmulo preferencial de PMA (Figuras 2B,C). Além disso, o tratamento pma já foi demonstrado anteriormente para saciar a autofluorescência dos complexos macromoleculares de colágeno31. Imagens fluorescentes de seções de tecido ventricular tiveram perda de fluorescência induzida pelo PMA em locais de colágeno (Figura 2D vs. 2E, Figura 2D' vs. 2E' e Figura 2D'' vs. 2E''). Tanto no campo brilhante quanto na imagem fluorescente, os compartimentos celulares não foram alterados pelo tratamento pma, e o colágeno teve um acúmulo seletivo de manchas pma e sacieçação da autofluorescência.
A amostra cardíaca nº 2 foi manchada com um agente de contraste via perfusão antes da secagem do ar. A reconstrução da imagem revelou manchas altamente irregulares dentro do compartimento do miocárdio (Figura 3A). O aprimoramento do contraste apareceu inseletivo da composição tecidual, sem maior aumento da intensidade do sinal nas regiões epicáridas ou sub-endocárdias. Além disso, o tecido de baixo contraste mostrou má separação da intensidade de fundo (Figura 3B).
A fibrose ventricular foi induzida por infarto do miocárdio e isquemia crônica (amostra de coração #3). Uma cicatriz antero-apical foi formada pela substituição de miócitos por depósitos fibro-gordurosos no tecido rio abaixo até o local da embolização vascular. A amostra cardíaca nº 3 foi preparada e imagem de uma cunha ventricular dissecada cobrindo o ventrículo esquerdo anterior, septo e parede livre ventricular direita. A preparação desta configuração de cunha ventricular foi descrita anteriormente32 e a aplicação de cunhas para imagem cardíaca foi revisada no detalhe33. A morfologia da cicatriz era transmural, mas heterogênea (Figura 4). Uma lesão fibrosa central densa foi cercada por uma zona de fronteira solta e heterogênea (Figura 4A). A preparação ventricular foi manchada pela secagem pós-ar de difusão e no vácuo. A Figura 4B-E mostra as maiores intensidades de sinal de volumes de imagem microCT reconstruídos nas fronteiras teciduais e regiões cicatrizadas. Agentes de contraste mal manchados miocárdio saudável, mas o contraste microestrutural foi mantido (Figura 4C'). Na zona de fronteira, o tecido cicatricial foi intercalado com o miocárdio sobrevivente (Figura 4D). A fibrose densa apareceu transmural, mas texturizada, indicando variâncias na composição (Figura 4E'). Seções de tecido de uma região ventricular esquerda transmural da preparação de tecido seco e manchado de PMA foram utilizadas para validar a seletividade pma para colágeno no tecido patológico, comparando-se com a coloração tricrômica de Masson (Figura 4F). A coloração pma foi seletiva para colágeno (sub-epicardium e sub-endocardium) e ausente em regiões de miocárdio sobrevivente (Figura 4G).
A amostra cardíaca #4 com fibrilação atrial persistente induzida foi seca ao ar enquanto conservava a forma nativa da cavidade atrial. O colapso do apêndice atrial não foi observado. Os principais marcos anatômicos poderiam ser identificados morfologicamente a partir de imagens reconstruídas (o septo atrial, músculos pectinados, seios coronários, ostia da veia pulmonar, vena cava e cristae terminalis). A mancha de difusão sob vácuo resultou em aprimoramento de contraste na raiz aórtica e válvulas atrioventriculares e regiões discretas do miocárdio de trabalho. O aprimoramento da coloração muscular foi restrito aos apêndices atrial e paredes posteriores tanto da ária esquerda quanto da direita (Figura 5).
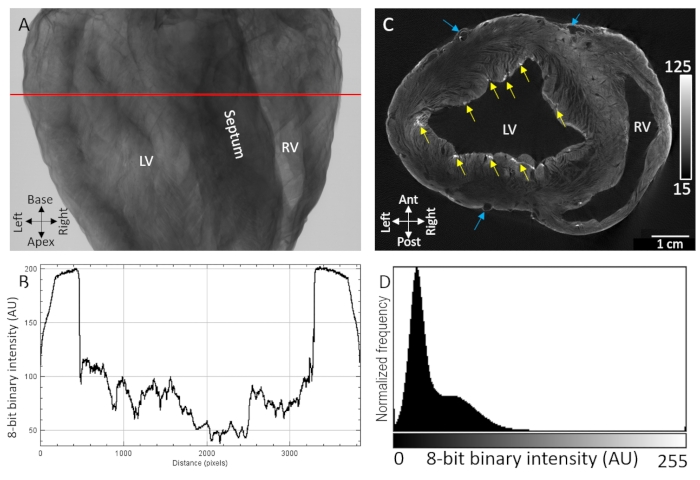
Figura 1: Imagem microCT de um coração de porco seco tratado com agente de contraste PMA por difusão sob vácuo. (A) imagem de projeção de raios-X. (B) Um perfil de transmissão extraído da linha vermelha em A. (C) Fatia de eixo curto dos ventrículos a partir de um volume tridimensional reconstruído tomograficamente. As setas amarelas indicam regiões pontuais de contraste atribuídas às fibras purkinje sub-endocárdias. Setas azuis indicam vasculatura. (D) Distribuição da intensidade do sinal da fatia de imagem reconstruída mostrada em C. LV: ventrículo esquerdo e RV: ventrículo direito. Clique aqui para ver uma versão maior desta figura.
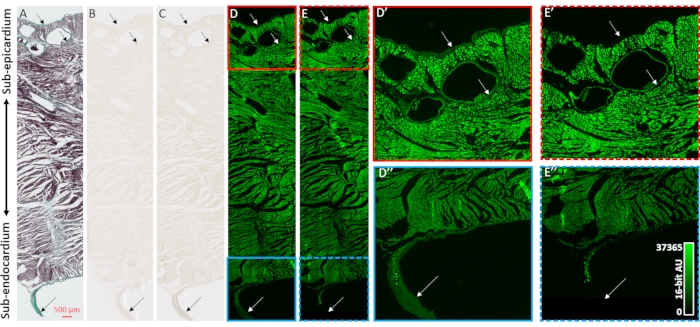
Figura 2: Validação da seletividade pma para colágeno. (A) Mancha tricrática de Masson de uma seção de tecido transmural a partir dos ventrículos de um coração seco a ar. O miocárdio é manchado em vermelho e o colágeno é mostrado com coloração verde. As seções de tecido adjacente (B) ausentes da coloração ou (C) manchadas com PMA (1%) foram imagens com iluminação de campo brilhante para avaliar a uniformidade da coloração. (D) As seções de tecido ausentes da coloração ou (E) manchadas pelo PMA foram imagens por microscopia fluorescente. Os painéis D' (caixa vermelha sólida) e E' (caixa vermelha tracejada) são vistas ampliadas do sub-epicárdio para seções manchadas e manchadas de PMA. Os painéis D'' (caixa azul sólido) e E'' (caixa azul tracejada) são as vistas ampliadas correspondentes do subdôcárdio e uma fibra Purkinje de corrida livre. Setas indicam sites de conteúdo de colágeno. Clique aqui para ver uma versão maior desta figura.
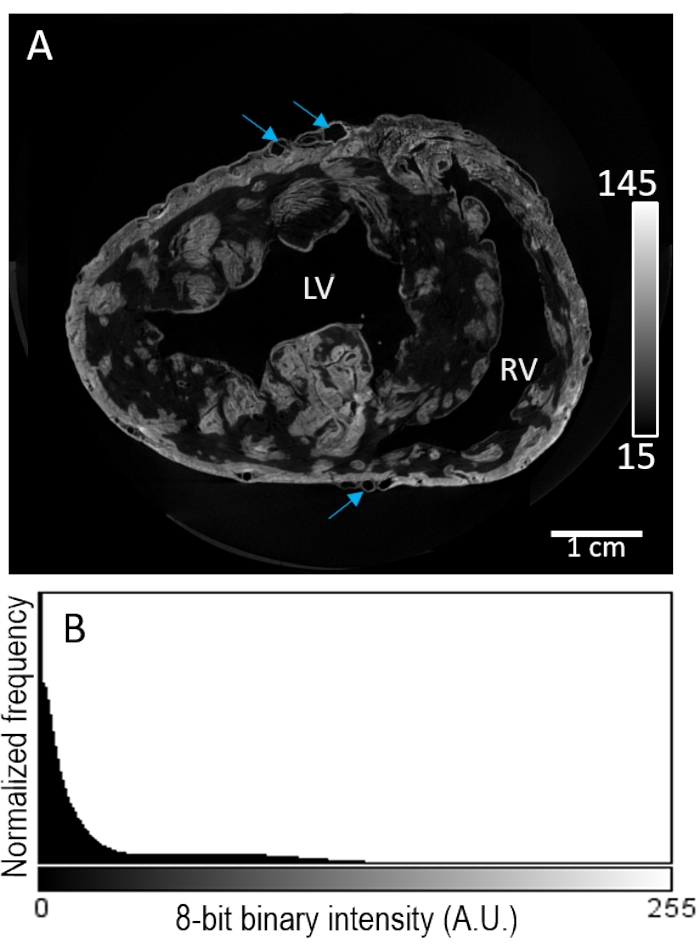
Figura 3: Carregamento de perfusão de PMA antes da secagem de ar e imagem MicroCT. (A) Uma fatia de eixo curto de um volume de imagem reconstruído dos ventrículos de um coração de porco. Setas azuis indicam vasculatura. (B) A distribuição da intensidade do sinal da fatia de imagem do painel A. LV: ventrículo esquerdo e RV: ventrículo direito. Clique aqui para ver uma versão maior desta figura.
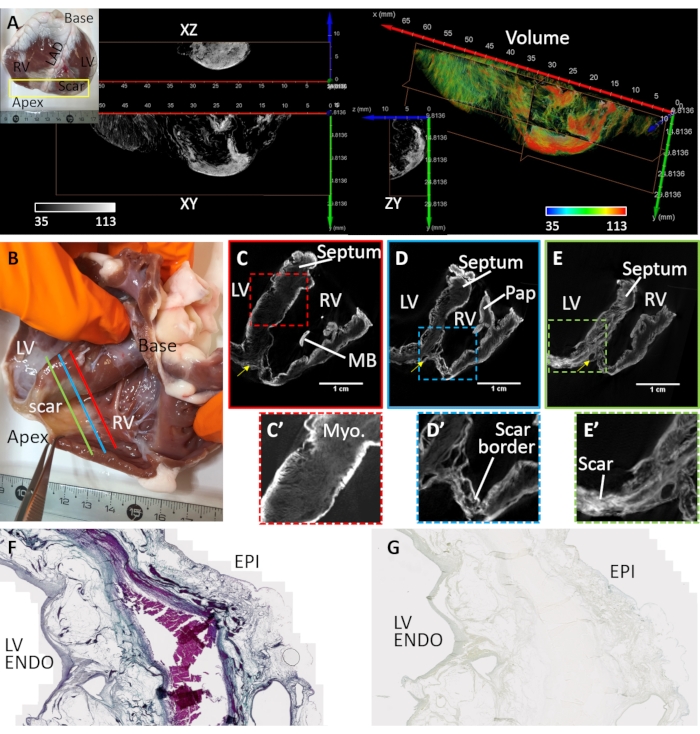
Figura 4: Imagem microCT de um coração de ovelha sofrendo um infarto crônico do miocárdio. (A) Uma cicatriz densa foi formada na região apical (ver fotografia inset). Uma renderização de volume da região apical a partir de uma perspectiva endárdica foi atribuída coloração com base na intensidade da imagem (vermelho correspondente ao tecido cicatricial e miocárdio em verde). As fatias ortogonais da intensidade de escala de cinza mostram a densa distribuição de cicatrizes e beirando o miocárdio sobrevivente. A separação entre tecido fibroso e miocárdio corresponde a regiões de tecido adiposo. (B) Uma fotografia de uma preparação de cunha ventricular seca a ar de uma ovelha com cicatrizes apical após o infarto do miocárdio. As fatias oblíquas do volume de imagem microCT reconstruída atravessam os ventrículos no nível médio entre a base e o ápice e proximal até o local da oclusão vascular (C- linha vermelha no painel B), (D) a região peri-infarto que beira a densa cicatriz e miocárdio saudável (linha azul D no painel B) e (E) uma região de fibrose densa (E - linha verde no painel B). (C') Uma visão ampliada da região septal delineada por uma caixa vermelha tracejada em C. (D') Uma visão expandida da região do infarto no ápice ventricular direito (caixa de traço azul no painel D). (E') Uma visão ampliada da região do infarto no ápice ventricular esquerdo (caixa verde tracejada no painel E). LV: Cavidade ventricular esquerda; RV: cavidade ventricular direita; MB: banda moderadora; Pap: músculo papilar. A seta amarela indica artéria descendente anterior esquerda. (F) A coloração tricrômica de Masson de uma seção histológica cortada do ventrículo esquerdo manchado de ar manchado de PMA. O colágeno é manchado de azul e o miocárdio está manchado de rosa/violeta. (G) Uma seção de tecido correspondente da distribuição de manchas de PMA. Clique aqui para ver uma versão maior desta figura.
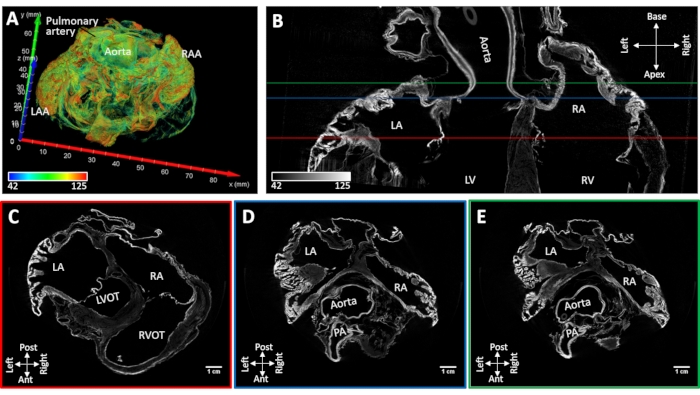
Figura 5: Imagem microCT de um coração de ovelha após fibrilação atrial induzida crônica. (A) Uma renderização de volume da ária com coloração atribuída como na Figura 4A. (B) Fatia de imagem microCT bi-atrial no eixo longo do coração. As fatias de eixo curto foram extraídas ao nível das válvulas atrioventriculares (C) (linha vermelha C no painel B), (D) raiz aórtica (D- linha azul no painel B) e (E) teto atrial esquerdo (E- linha verde no painel B). LA: atria esquerda; RA: atria direita; LAA: apêndice atrial esquerdo; RAA: apêndice atrial direito; LV: ventrículo esquerdo; RV: ventrículo direito; LVOT: trato de saída ventricular esquerdo; RVOT: trato de saída ventricular direito e PA: artéria pulmonar. Clique aqui para ver uma versão maior desta figura.
| Amostra # | 1 | 2 | 3 | 4 |
| Espécie | Porco | Porco | Ovelha | Ovelha |
| Peso corporal (kg) | 32.4 | 31.2 | 47.2 | 53.4 |
| Peso cardíaco (g) | 191.2 | 186.2 | 202.4 | 207.6 |
| Patologia | - | - | MI crônico | AF crônica |
| Preparação da amostra | Coração inteiro | Coração inteiro | Cunha do coração anterior | Coração inteiro |
| Modo de carregamento de contraste | Difusão | Perfusão | Difusão | Difusão |
| Exposição ao agente de contraste (h) | 48 | 24 | 48 | 48 |
Tabela 1: Amostras de coração e tratamento de agente de contraste.
Discussão
Um protocolo detalhado para grandes preparações teciduais é estabelecido usando corações inteiros de grandes mamíferos para imagens estruturais de alta resolução subsequentes. Uma abordagem de secagem de ar removeu influências da atenuação de raios-X de fundo e da otimização máxima do tecido: contraste de fundo29. Utilizando esta abordagem, foi alcançada uma resolução isotropica na faixa de 20 μm para imagem volumosa em amostras de até 7,2 cm de diâmetro. O MicroCT de tecido mole, no entanto, depende normalmente do uso de agentes de contraste não específicos para amenizar a absorção de raios-X e a sensibilidade dos sistemas microCT34. Embora os agentes de contraste de raios-X melhorem a atenuação geral de raios-X e o aprimoramento da imagem de tecido mole, a separação dos constituintes teciduais com base na composição bioquímica permanece desafiadora. No entanto, observou-se que o uso de corações secos a ar em combinação com um agente comum de contraste de raios-X no ambiente de laboratório, PMA, reproduziu seletivamente componentes extracelulares. O tecido conjuntivo associado ao miocárdio saudável e à remodelação estrutural patológica em doenças crônicas foram aprimorados.
O processo de secagem do ar do tecido biológico exige uma intervenção para resistir à deformação da amostra. A preparação da amostra para microscopia eletrônica tem requisitos semelhantes. Normalmente, é utilizado um método de secagem de pontos críticos, que usa um equilíbrio de meio de imersão tecidual, temperatura e pressão para eliminar a tensão superficial do conteúdo líquido do tecido, o que causa deformação no nível molecular após a evaporação35. Esta abordagem requer a substituição uniforme do conteúdo de água da amostra por dióxido de carbono líquido, que é mais confiável em amostras pequenas e facilmente difusíveis. Alternativamente, a integridade estrutural do tecido pode ser melhorada e a secagem do ar, ou seja, a fase de evaporação pode ser aplicada por um período mais longo para reduzir a deformação geral. A molécula HMDS sofre silylation para formar um andaime à base de silicone para reforçar e estabilizar a organização molecular da amostra de tecido36. A evaporação é ainda maior, limitando as correntes de ar circulantes do ambiente, também para evitar a evaporação inhomogênea, particularmente entre a superfície da amostra e camadas intramuros.
Numerosos agentes de contraste já foram usados para imagens microCT de tecidos moles. Os mais comuns são iodo, ácido fosfotungstic (PTA) e PMA. O iodo tem sido particularmente empregado devido a uma taxa de difusão mais elevada 34,37,38. No entanto, o iodo atua como um catalisador para a silicação do reagente HMDS36. A reação catalisada é agressiva e exotérmica, com alto risco de destruição da amostra e risco de segurança se o HMDS residual permanecer devido à dessecação incompleta da amostra. Tanto o PTA quanto o PMA dissolvidos no etanol podem ser usados com segurança em conjunto com o HMDS. PtA e PMA têm mostrado proporcionar maior poder de resolução de estruturas finas em discos intervertebrais não mineralizados quando comparados com a coloração de iodo38. Em imagens microCT de amostras de mamíferos, PTA e PMA têm sido usados para coloração de embriões de camundongos39, sistema cardiovascular de camundongos37, músculo coelho e cérebro40, e veiassuínas 41. PtA tem uma massa molecular e densidade molecular maior em solução do que pma. Isso se deve, em parte, a uma maior massa atômica de tungstênio (número atômico é de 74 g/mol), o principal elemento atenuante em PTA. Em comparação, o elemento mais pesado em PMA, molbdenum, tem um número atômico de 42 g/mol. Tanto a massa atômica quanto a densidade amostral estão por trás da atenuação do raio-X, além da espessura da amostra42. Aumentando o comprimento do caminho do raio-X aumentando o tamanho da amostra, a atenuação do raio-X torna-se mais sensível ao aumento da densidade amostral. Por isso, o agente de contraste pma de menor densidade foi selecionado para reduzir o risco de atenuação excessiva e otimizar o alcance dinâmico do contraste de imagem para corações de escala humana. Outras evidências mostraram que o carregamento de difusão de PMA dá uma coloração mais homogênea do que para a molécula maior PTA no tecido cardíaco43.
O método de entrega do agente de contraste impacta a uniformidade da distribuição de agentes de contraste no tecido cardíaco (Figura 3). A perfusão de agentes de contraste no coração desidratado com etanol mostrou níveis irregulares de coloração de fundo de PMA devido à resistência vascular variável. No coração seco ao ar, a estrutura muscular laminar é enfatizada pelo processo de dessacação da amostra, aumentando a separação muscular laminar. Isso melhorou, em última análise, a permeabilidade geral do tecido para o carregamento de agente de contraste baseado em difusão. Consequentemente, a secagem do ar facilitou o tecido: contraste de ar nos níveis laminar e intra-laminar (Figura 4). Além disso, o carregamento de difusão pode ser facilitado ainda mais pela aplicação sob um vácuo. Mostrou-se ainda que o encolhimento tecidual de amostras não secas depende da concentração de agentes de contraste40. No entanto, a estabilização morfológica prévia da amostra por secagem do ar inibe os efeitos de encolhimento tecidual29.
Imagens microCT de alta resolução de órgãos inteiros produzem inerentemente grandes volumes de dados. A natureza das técnicas de imagem tomográfica permite a visualização e o manuseio de imagens em uma base fatiada fatia, o que facilita o processamento do computador e a carga de memória. No entanto, para visualizar pilhas de imagens tridimensionais, por exemplo, para renderizar volumes de amostras em representações tridimensionais, as especificações mínimas recomendadas do computador são de 128 GB de RAM e uma velocidade de processador de 3 GHz. Os discos rígidos de estado sólido também melhoraram muito a transferência de dados.
O surgimento de imagens microCT no campo cardíaco proporciona inúmeras vantagens para estudos translacionais e validação clínica. As vantagens de sua imagem tridimensional e micrométrica já mostraram aplicações na determinação da carga tromótica dos pacientes com isquemia miocárdica de elevação st44,45. Mapear potenciais fontes de arritmia em pacientes com doenças cardíacas estruturais depende em grande parte da determinação da distribuição do tecido cicatricial fibroso e da localização de trilhas entrelaçadas do miocárdio sobrevivente. Abordagens de segunda linha para diagnóstico de arritmias ventriculares utilizam ressonância magnética46. Pode localizar robustamente a fibrose densa, mas limita-se à caracterização morfológica de baixa resolução e oferece uma visão limitada sobre remodelagem microestrutural e distribuições difusas de lesões fibrosas47. O exame de alta resolução da distribuição e caracterização da cicatriz tem grande potencial para melhorar nossa compreensão da remodelagem estrutural cardíaca e o risco de desenvolver insuficiência cardíaca. Particularmente, estudos fundamentais de pesquisa ou investigações pós-morte se beneficiarão de imagens estruturais corroborativas para mapeamento elétrico de arritmia cardíaca.
Em conclusão, os corações reforçados com tratamento HMDS e secagem de ar podem posteriormente ser manchados com um agente de contraste de raios-X para melhorar a atenuação do raio-X de componentes extracelulares. Especificamente, no miocárdio saudável, o acúmulo de PMA ocorre no epitélio, tecido valvular e compartimentos do sistema de condução ventricular embainhado pelo tecido conjuntivo resultou em atenuação aprimorada de raios-X. Além disso, no miocárdio estruturalmente doente, o contraste aprimorado foi ainda mais seletivo para a fibrose.
Divulgações
Nenhum
Agradecimentos
Este estudo recebeu apoio financeiro do Governo francês como parte do programa "Investimentos do Futuro" gerenciado pela Agência Nacional de Pesquisa (ANR), referência de subvenção ANR-10-IAHU-04, e a Fundação Leducq (rede RHYTHM), bem como a referência de subvenção ANR-17-CE14-0029-01 [UNMASC], financiamento da Área Europeia de Pesquisa em Doenças Cardiovasculares (ERA-CVD), referência de concessão H2020-HCO-2015_680969 [MultiFib] e financiamento da Região Francesa Nouvelle Aquitaine, referências de concessão 2016 - 1R 30113 0000 7550/2016-1R 30113 0000 7553 e ANR-19-ECVD-0006-01.
Materiais
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Diapath | F0043 | |
| Calcium chloride solution | Honeywell | 21114 | |
| Canulation Tubing PTFE | VWR | DENE3400102 | |
| Constant Head 1L Reservoir | Harvard Apparatus | 50-0496 | |
| D-(+)-Glucose | Sigma | G5767 | |
| Ethanol absolute | VWR | 20821.330 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | 796881 | |
| Heparin sodium (5000 U/mL) | Panpharma | 3400891287301. | |
| Hexamethyldisilazane (HMDS) | Sigma | 440191-1L | |
| Hydrochloric acid, ACS reagent, 37% | Sigma | 258148 | |
| Magnesium chloride solution | Honeywell | 63020 | |
| Phosphate buffered saline (PBS) | Sigma | P5368 | |
| Phosphomolybdic acid hydrate | Fisher Scientific | 417895000 | |
| Potassium Chloride | Sigma | P5405 | |
| Pump Tubing, 3-Stop | Ismatec | FV-96328-48 | |
| SkyScan, 1276 | Bruker | micro CT | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium Chloride | Sigma | S3014 | |
| Sodium hydroxide solution 50% in H2O | Sigma | 415413 | |
| Tube Connector Kits | Harvard Apparatus | 72-1407 | |
| Tubing pump | Ismatec | ISM 1089 | |
| Tubing Tygon R-3603 1.6 mm 3.2 mm 0.8 mm | VWR | 228-1279 | |
| Tubing Tygon R-3603 3.2 mm 4.8 mm 0.8 mm | VWR | 228-1283 | |
| Two-part single-use syringes 50 mL | Norm-Ject | 4850001000 | Pyrogen-free, PVC-free |
Referências
- Srinivasan, N. T., Schilling, R. J. Sudden cardiac death and arrhythmias. Arrhythmia & Electrophysiology Review. 7 (2), 111-117 (2018).
- Szumowski, L., et al. Mapping and ablation of polymorphic ventricular tachycardia after myocardial infarction. Journal of the American College of Cardiology. 44 (8), 1700-1706 (2004).
- Bode, K., et al. Ablation of polymorphic ventricular tachycardias in patients with structural heart disease. PACE - Pacing and Clinical Electrophysiology. 31 (12), 1585-1591 (2008).
- Enjoji, Y., et al. Catheter ablation of fatal ventricular tachyarrhythmias storm in acute coronary syndrome-role of Purkinje fiber network. Journal of Interventional Cardiac Electrophysiology. 26 (3), 207-215 (2009).
- Sinha, A. M., et al. Role of left ventricular scar and purkinje-like potentials during mapping and ablation of ventricular fibrillation in dilated cardiomyopathy. PACE - Pacing and Clinical Electrophysiology. 32 (3), 286-290 (2009).
- Peichl, P., Čihák, R., Koželuhová, M., Wichterle, D., Vančura, V., Kautzner, J. Catheter ablation of arrhythmic storm triggered by monomorphic ectopic beats in patients with coronary artery disease. Journal of Interventional Cardiac Electrophysiology. 27 (1), 51-59 (2010).
- Marrouche, N. F., et al. Mode of initiation and ablation of ventricular fibrillation storms in patients with ischemic cardiomyopathy. Journal of the American College of Cardiology. 43 (9), 1715-1720 (2004).
- Bänsch, D., et al. Successful catheter ablation of electrical storm after myocardial infarction. Circulation. 108 (24), 3011-3016 (2003).
- Yokoshiki, H., Mitsuyama, H., Watanabe, M., Mizukami, K., Tsutsui, H. Suppression of ventricular fibrillation by electrical modification of the Purkinje system in hypertrophic cardiomyopathy. Heart and Vessels. 29 (5), 709-717 (2014).
- Agress, C. M., Rosenberg, M. J., Jacobs, H. I., Binder, M. J., Schneiderman, A., Clark, W. G. Protracted shock in the closed-chest dog following coronary embolization with graded microspheres. The American journal of physiology. 170 (3), 536-549 (1952).
- Bolukoglu, H., Liedtke, A. J., Nellis, S. H., Eggleston, A. M., Subramanian, R., Renstrom, B. An animal model of chronic coronary stenosis resulting in hibernating myocardium. American Journal of Physiology - Heart and Circulatory Physiology. 263, 20-29 (1992).
- Capone, R. J., Most, A. S., Sydlik, P. A. Precordial ST segment mapping. A sensitive technique for the evaluation of myocardial injury. CHEST. 67 (5), 577-582 (1975).
- Dib, N., Diethrich, E. B., Campbell, A., Gahremanpour, A., McGarry, M., Opie, S. R. A percutaneous swine model of myocardial infarction. Journal of Pharmacological and Toxicological Methods. 53 (3), 256-263 (2006).
- Dogné, J. M., et al. Characterization of an original model of myocardial infarction provoked by coronary artery thrombosis induced by ferric chloride in pig. Thrombosis Research. 116 (5), 431-442 (2005).
- Eldar, M., Ohad, D., Bor, A., Varda-Bloom, N., Swanson, D. K., Battler, A. A closed-chest pig model of sustained ventricular tachycardia. Pacing and Clinical Electrophysiology. 17 (10), 1603-1609 (1994).
- Elzinga, W. E. Ameroid constrictor: uniform closure rates and a calibration procedure. Journal of applied physiology. 27 (3), 419-421 (1969).
- Hughes, G. C., Post, M. J., Simons, M., Annex, B. H. Translational physiology: Porcine models of human coronary artery disease: Implications for preclinical trials of therapeutic angiogenesis. Journal of Applied Physiology. 94 (5), 1689-1701 (2003).
- Lichtig, C., Brooks, H., Chassagne, G., Glagov, S., Wissler, R. W. Basic fuchsin picric acid method to detect acute myocardial ischemia. An experimental study in swine. Archives of Pathology and Laboratory Medicine. 99 (3), 158-161 (1975).
- Näslund, U., Häggmark, S., Johansson, G., Pennert, K., Reiz, S., Marklund, S. L. Effects of reperfusion and superoxide dismutase on myocardial infarct size in a closed chest pig model. Cardiovascular Research. 26 (2), 170-178 (1992).
- Reffelmann, T., et al. A novel minimal-invasive model of chronic myocardial infarction in swine. Coronary Artery Disease. 15 (1), 7-12 (2004).
- Reimer, K. A., Lowe, J. E., Rasmussen, M. M., Jennings, R. B. The wavefront phenomenon of ischemic cell death. 1. Myocardial infarct size vs duration of coronary occlusion in dogs. Circulation. 56 (5), 786-794 (1977).
- Salazar, A. E. Experimental myocardial infarction. Induction of coronary thrombosis in the intact closed-chest dog. Circulation research. 9, 1351-1356 (1961).
- Takahashi, M., et al. Effects of angiotensin I-converting enzyme inhibitor and angiotensin II type 1 receptor blocker on the right ventricular sarcoglycans and dystrophin after left coronary artery ligation. European Journal of Pharmacology. 522 (1-3), 84-93 (2005).
- Gonzalez-Tendero, A., et al. Whole heart detailed and quantitative anatomy,myofibre structure and vasculature from X-ray phase-contrast synchrotron radiation-basedmicro computed tomography. European Heart Journal Cardiovascular Imaging. 18 (7), 732-741 (2017).
- Teh, I., et al. Resolving fine cardiac structures in rats with high-resolution diffusion tensor imaging. Scientific Reports. 6, 30573 (2016).
- Teh, I., et al. Validation of diffusion tensor MRI measurements of cardiac microstructure with structure tensor synchrotron radiation imaging. Journal of Cardiovascular Magnetic Resonance. 19 (1), 31 (2017).
- Abouezzeddine, O., et al. Relevance of endocavitary structures in ablation procedures for ventricular tachycardia. Journal of Cardiovascular Electrophysiology. 21 (3), 245-254 (2010).
- Pambrun, T., et al. Epicardial course of the septopulmonary bundle: Anatomical considerations and clinical implications for roof line completion. Heart Rhythm. 18 (3), 349-357 (2021).
- Pallares-Lupon, N., et al. Optimizing large organ scale micro computed tomography imaging in pig and human hearts using a novel air-drying technique. bioRxiv. , (2021).
- Martins, R. P., et al. Dominant frequency increase rate predicts transition from paroxysmal to long-term persistent atrial fibrillation. Circulation. 129 (14), 1472-1482 (2014).
- Puchtler, H., Waldrop, F. S., Valentine, L. S. Fluorescence microscopic distinction between elastin and collagen. Histochemie. 35 (1), 17-30 (1973).
- Walton, R. D., et al. Compartmentalized Structure of the Moderator Band Provides a Unique Substrate for Macroreentrant Ventricular Tachycardia. Circulation: Arrhythmia and Electrophysiology. 11 (8), 005913 (2018).
- Di Diego, J. M., Sicouri, S., Myles, R. C., Burton, F. L., Smith, G. L., Antzelevitch, C. Optical and electrical recordings from isolated coronary-perfused ventricular wedge preparations. Journal of Molecular and Cellular Cardiology. 54, 53-64 (2013).
- Pauwels, E., Van Loo, D., Cornillie, P., Brabant, L., Van Hoorebeke, L. An exploratory study of contrast agents for soft tissue visualization by means of high resolution X-ray computed tomography imaging. Journal of Microscopy. 250 (1), 21-31 (2013).
- Mulet, A. Book Review: Modern Drying Technology, Volume 3: Product Quality and Formulation , edited by E. Tsotsas and A. S. Mujumdar. Drying Technology. 32 (2), 244-245 (2014).
- Karimi, B., Golshani, B. Mild and highly efficient method for the silylation of alcohols using hexamethyldisilazane catalyzed by iodine under nearly neutral reaction conditions. Journal of Organic Chemistry. 65 (21), 7228-7230 (2000).
- Dunmore-Buyze, P. J., et al. Three-dimensional imaging of the mouse heart and vasculature using micro-CT and whole-body perfusion of iodine or phosphotungstic acid. Contrast Media and Molecular Imaging. 9 (5), 383-390 (2014).
- Disney, C. M., Madi, K., Bodey, A. J., Lee, P. D., Hoyland, J. A., Sherratt, M. J. Visualising the 3D microstructure of stained and native intervertebral discs using X-ray microtomography. Scientific Reports. 7 (1), 16279 (2017).
- Descamps, E., Sochacka, A., de Kegel, B., Van Loo, D., Hoorebeke, L., Adriaens, D. Soft tissue discrimination with contrast agents using micro-ct scanning. Belgian Journal of Zoology. 144 (1), (2014).
- Buytaert, J., Goyens, J., De Greef, D., Aerts, P., Dirckx, J. Volume shrinkage of bone, brain and muscle tissue in sample preparation for micro-CT and light sheet fluorescence microscopy (LSFM). Microscopy and Microanalysis. 20 (4), 1208-1217 (2014).
- Nierenberger, M., Rémond, Y., Ahzi, S., Choquet, P. Assessing the three-dimensional collagen network in soft tissues using contrast agents and high resolution micro-CT: Application to porcine iliac veins. Comptes Rendus - Biologies. 338 (7), 425-433 (2015).
- Speck, U. . General principles of x-ray contrast media. X-Ray Contrast Media. , (2018).
- Rajasekar, A., Trew, M. L., Sands, G. B. . Understanding and enhancing the use of micro-computed tomography in soft tissue. , (2015).
- Karagiannidis, E., et al. Micro-CT-based quantification of extracted thrombus burden characteristics and association with angiographic outcomes in patients with ST-elevation myocardial infarction: The QUEST-STEMI Study. Frontiers in Cardiovascular Medicine. 8, 646064 (2021).
- Karagiannidis, E., et al. Serum ceramides as prognostic biomarkers of large thrombus burden in patients with stemi: A micro-computed tomography study. Journal of Personalized Medicine. 11 (2), 89 (2021).
- Hennig, A., et al. High-resolution three-dimensional late gadolinium-enhanced cardiac magnetic resonance imaging to identify the underlying substrate of ventricular arrhythmia. Europace : European Pacing, Arrhythmias, and Cardiac Electrophysiology: Journal of the Working Groups on Cardiac Pacing, Arrhythmias, and Cardiac Cellular Electrophysiology of the European Society of Cardiology. 20, 179-191 (2018).
- Lorgis, L., et al. Relationship between fragmented QRS and no-reflow, infarct size, and peri-infarct zone assessed using cardiac magnetic resonance in patients with myocardial infarction. Canadian Journal of Cardiology. 30 (2), 204-210 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados