Method Article
Tecniche di preparazione dei tessuti per l'imaging micromografico computerizzato con contrasto di modelli cardiaci di mammiferi di grandi dimensioni con malattia cronica
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per ottenere immagini di micro tomografia computerizzata ad alta risoluzione di cuori interi di mammiferi sani e patologici con miglioramento del contrasto selettivo del collagene.
Abstract
Il rimodellamento strutturale è una conseguenza comune degli stress patologici cronici imposti al cuore. Comprendere le proprietà architettoniche e compositive del tessuto malato è fondamentale per determinare le loro interazioni con il comportamento aritmico. Il rimodellamento tissutale su microscala, al di sotto della risoluzione clinica, sta emergendo come un'importante fonte di aritmia letale, con alta prevalenza nei giovani adulti. Rimangono sfide nell'ottenere un elevato contrasto di imaging a una risoluzione sufficiente su microscala per i modelli preclinici, come i grandi cuori interi dei mammiferi. Inoltre, manca ancora il miglioramento selettivo del contrasto della composizione tissutale per l'imaging tridimensionale ad alta risoluzione. L'imaging non distruttivo che utilizza la tomografia micro-computerizzata è promettente per l'imaging ad alta risoluzione. L'obiettivo era quello di alleviare la sofferenza da raggi X rispetto all'attenuazione in grandi campioni biologici. I cuori sono stati estratti da suini sani (N = 2) e pecore (N = 2) con infarto miocardico cronico indotto e formazione di cicatrici fibrotiche o fibrillazione atriale cronica indotta. I cuori asportati sono stati perfusi con: una soluzione salina integrata con un agente dissetante di ioni calcio e un vasodilatatore, etanolo nella disidratazione seriale e esametildilisilizane sotto vuoto. Quest'ultimo ha rinforzato la struttura del cuore durante l'essiccazione all'aria per 1 settimana. Il tessuto dominante del collagene è stato selettivamente legato da un agente di contrasto a raggi X, l'acido fosfomolibdico. La conformazione tissutale era stabile nell'aria, consentendo acquisizioni di tomografia microcalcografica di lunga durata per ottenere immagini ad alta risoluzione (isotrope 20,7 μm). Il carico ottimale dell'agente di contrasto per diffusione ha mostrato un miglioramento selettivo del contrasto dello strato epiteliale e delle fibre di Purkinje sub-endocardiche nei ventricoli di maiale sani. I cuori di fibrillazione atriale (AF) hanno mostrato un maggiore accumulo di contrasto nelle pareti posteriori e nelle appendici degli atri, attribuito a un maggiore contenuto di collagene. I cuori da infarto miocardico hanno mostrato un aumento selettivo del contrasto nelle regioni della fibrosi cardiaca, che ha permesso l'identificazione delle fibre muscolari miocardiche sopravvissute intrecciate. I preparati di tessuto essiccato all'aria con contrasto hanno consentito l'imaging su microscala del cuore di mammifero di grandi dimensioni intatto e il miglioramento selettivo del contrasto dei costituenti della malattia di base.
Introduzione
Le malattie cardiache strutturali rappresentano la maggior parte della mortalità correlata al cuore in tutto il mondo1. Il rimodellamento della struttura cardiaca influenza l'ambiente miocardico e lo spazio interstiziale. Poiché sia la funzione elettrica che meccanica cardiaca dipendono dall'organizzazione dei miociti, l'interruzione può portare ad aritmia cardiaca intollerabile, azioni di pompaggio del sangue compromesse e insufficienza cardiaca 2,3,4,5,6,7,8,9. Gli sviluppi delle terapie curative per le malattie cardiache strutturali sono di gran lunga superati dalla prevalenza della malattia 2,5. Pertanto, sta emergendo un numero crescente di modelli preclinici di malattie cardiache strutturali per comprendere meglio i profili anatomo-morfologici e la conseguente patogenesi delle aritmie cardiache 10,11,12,13,14,15,16,17,18,19,20, 21,22,23. Osservata in tutto lo spettro delle malattie strutturali è la sovraregolazione della fibrosi interstiziale e, più comunemente nei casi correlati all'ischemia, la sostituzione miocardica con fibrosi e tessuto adiposo18. La comprensione morfologica dei componenti extracellulari patologici può consentire l'identificazione di potenziali substrati di aritmia. La distribuzione e l'estensione della malattia forniscono forti indicatori di rischio aritmogeno. Tuttavia, rimangono sfide per l'immagine completa dei profili di malattia integrando macro e microscale nel cuore intatto.
La tomografia micro-computerizzata (microCT), basata sui raggi X, sta emergendo come un potente strumento per interrogare la microstruttura dei tessuti biologici molli utilizzando agenti di contrasto. Sono state ottenute mappe anatomiche altamente dettagliate per cuori di piccoli roditori 24,25,26 e piccoli campioni sezionati da grandi cuori di mammiferi 27,28. Tuttavia, l'imaging a livello di intero organo di grandi cuori di mammiferi presenta lunghezze di percorso eccessive su cui i fotoni a raggi X vengono attenuati utilizzando tecniche convenzionali di preparazione dei tessuti. Ciò comporta il caricamento del tessuto a contrasto e l'immersione del campione in un solvente mezzo di contrasto durante l'acquisizione. L'aumento della dimensione e della risoluzione del campione impone un prolungamento del tempo totale di acquisizione. Pertanto, la stabilità dei tessuti diventa cruciale per la ricostruzione dell'immagine utilizzabile, il che significa che la deformazione dei tessuti derivante dall'essiccazione deve essere prevenuta. L'uso di un fluido ad immersione, tuttavia, presenta degli svantaggi: (i) l'intensità complessiva del segnale di fondo diventa non trascurabile e (ii) promuove la diluizione delle molecole di contrasto legate ai tessuti. Entrambi questi fattori contribuiscono a ridurre il contrasto dell'immagine.
Questo studio descrive in dettaglio una nuova pipeline di elaborazione dei tessuti per alleviare l'attenuazione dei fotoni di fondo e ottimizzare la gamma dinamica offerta dagli agenti di miglioramento del contrasto. Si consiglia di utilizzare un approccio di essiccazione all'aria dei tessuti con rinforzo chimico del tessuto per limitare la deformazione del tessuto29. Pertanto i campioni di tessuto possono rimanere stabili nell'aria per lunghe acquisizioni e omettere contributi di fondo dai fluidi ad immersione. Questa pipeline metodologica fornisce: (i) un protocollo completo di elaborazione e imaging dei tessuti ottimizzato utilizzando cuori di maiale interi; (ii) una valutazione della concentrazione di contrasto e delle tecniche di carico e, (iii) l'applicazione di questa pipeline in due distinti modelli di malattia cronica di fibrillazione atriale e infarto miocardico nei cuori di pecora. Lo sviluppo dei modelli di malattia cronica è stato descritto altrove per ciascun modello di malattia cardiaca cronica, infarto miocardico indotto da embolizzazione coronarica percutanea13 e fibrillazione atriale autosufficiente30.
Protocollo
Tutti gli esperimenti sono stati condotti seguendo le linee guida della direttiva 2010/63/UE del Parlamento europeo sulla protezione degli animali utilizzati a fini scientifici. I protocolli sugli animali sono stati approvati dal comitato etico locale (CEEA50) dell'Università di Bordeaux. I cuori provenivano da tre grandi modelli di mammiferi, tra cui (i) maiali bianchi sani di grandi dimensioni (N = 2, 2 mesi di età); (ii) Ovini (N = 1, 2 anni) con infarto miocardico indotto13 e (iii) Pecore (N = 1, 7 anni) con fibrillazione atriale indotta30.
1. Preparazione della soluzione:
- Soluzione cardioplegica: Preparare 3 L di acqua distillata e aggiungere cloruro di sodio (110 mM), cloruro di potassio (16 mM), bicarbonato di sodio (10 mM), D-(+)-Glucosio (9 mM), soluzione di cloruro di calcio (1,2 mM) e soluzione di cloruro di magnesio (16 mM). Alla fine, aggiungere 500 μL/L di eparina sodica. Conservare questa soluzione a 4 °C.
- Soluzione salina tamponata con fosfato - EDTA (PBS-EDTA).
- In primo luogo, aggiungere acido etilendiamminotetraacetico (EDTA) a 1 L di acqua distillata per una concentrazione finale di 10 mM. Aumentare e mantenere un pH della soluzione di 12 utilizzando una soluzione di idrossido di sodio (1 M) per sciogliere l'EDTA.
- Una volta che l'EDTA è completamente disciolto, abbassare il pH a 7,4 usando acido cloridrico. Aggiungere un sacchetto di alluminio di soluzione salina tamponata con fosfato per ottenere una soluzione a 0,01 M (cloruro di sodio, 0,138 M; cloruro di potassio, 0,0027 M) e pH 7,4. Conservare questa soluzione a temperatura ambiente (RT).
- Etanolo - soluzione di mezzo di contrasto acido fosfomolibdico (PMA): Preparare 1 L di etanolo assoluto e aggiungere il PMA per ottenere una soluzione all'1% di concentrazione. Conserva questa soluzione in RT.
2. Fonte del tessuto
- Eutanasizzare l'animale ed estrarre il cuore secondo le linee guida etiche locali. Immergere rapidamente il cuore in una soluzione cardioplegica fredda e massaggiare delicatamente i ventricoli per il risciacquo iniziale.
- Assicurarsi di tagliare l'aorta sotto l'arco aortico e bloccare due lati della parete arteriosa utilizzando portaago.
- Sospendendo il cuore dai portaaghi, inserire una cannula aortica nella radice aortica, facendo attenzione a non entrare in contatto o sporgere attraverso le valvole aortiche. Avvolgere una sutura di calibro 0 attorno all'arco aortico a livello della cannula e legare saldamente la cannula in posizione.
- Utilizzando siringhe da 50 mL, iniettare 200 mL di soluzione cardioplegica fredda (4 °C). Rimuovere il raggruppamento di sangue in eccesso nelle cavità rovesciando il cuore sul lato posteriore per drenare attraverso le vene polmonari.
- Immergere il cuore risciacquato e conservare in soluzione cardioplegica fredda conservata sul ghiaccio fino al momento della dissezione.
3. Preparazione dei tessuti:
- Preparare un serbatoio da 1 L supportato 80 cm sopra un piatto di dissezione. Accoppiare un tubo termoplastico di 80 cm di lunghezza e 3,2 mm di diametro interno e 4,8 mm di diametro esterno a una porta di scarico del serbatoio.
- Fissare un rubinetto a tre vie al tubo di drenaggio e accoppiare ulteriori tubi termoplastici (20 cm, 1,6 mm di diametro interno e 3,2 mm di diametro esterno) a ciascuna porta libera sul rubinetto a tre vie. Fissare i rubinetti bidirezionali alle estremità della tariffa del tubo.
- Riempire il serbatoio con la soluzione cardioplegica integrata con eparina (2500 unità). Aprire i rubinetti per consentire alla soluzione cardioplegica di drenare e rimuovere tutte le bolle d'aria, quindi chiudere i rubinetti bidirezionali.
- Preparare le cannule per l'ostia coronarica sinistra e destra utilizzando tubi in politetrafluoroetilene (PTFE) (diametro interno di 1 mm e diametro esterno di 2 mm).
- Tagliare 5 cm di tubo e riscaldare un'estremità posizionando la punta accanto a una fiamma nuda. Una volta che 1 mm della punta inizia a sciogliersi e diventa traslucida, premere la punta contro una superficie dura resistente al calore per modellare una cresta sulla punta delle cannule per evitare che le cannule scivolino fuori dai vasi.
- Inserire 1 cm dell'estremità non riscaldata di ciascuna cannula alle due estremità del tubo di drenaggio del serbatoio di scarico.
- Rimuovere la cannula aortica. Sotto soluzione cardioplegica fredda, localizzare l'ostia sinistra e destra delle arterie coronarie.
- Usando forbici appuntite, separare con cura la radice aortica dal tessuto circostante sopra e sotto l'ostia coronarica per consentire la filettatura di una sutura di seta 0 G sotto il vaso coronarico.
- Aprire i rubinetti bidirezionali e inserire le punte delle cannule nell'ostia coronarica. Con le punte delle cannule che si estendono per 1-2 cm nell'ostia e oltre il posizionamento della sutura, legare le cannule.
- Risciacquare il cuore massaggiando delicatamente i ventricoli per 15 minuti fino a quando il cuore non viene ripulito dal sangue.
- Dopo il risciacquo, chiudere i rubinetti bidirezionali e scollegarli dal rubinetto a tre vie. Trasferire il cuore in un contenitore di plastica resistente agli agenti chimici da 1 L contenente 500 ml di soluzione PBS-EDTA.
- Ricircolare la soluzione PBS-EDTA nel tubo termoplastico sotto una cappa aspirante utilizzando una pompa peristaltica a due canali. Innescare il tubo della pompa fino a quando il tubo non è privo di bolle d'aria, quindi perfondere ogni cannula dell'arteria coronaria mediante ricircolo a RT per 2 ore a 80 ml / min.
- Assicurarsi che la cappa aspirante sia operativa. Arrestare la pompa, scaricare la soluzione dal contenitore e sostituirla con formalina (10%) per il fissaggio per 1 ora a RT a 80 ml/min.
- Sostituire la soluzione di formalina con PBS per risciacquare il fissativo tre volte per 15 minuti ciascuno a 80 ml/min.
4. Disidratazione e asciugatura dei tessuti:
NOTA: Utilizzare la stessa velocità di perfusione (80 ml/min) e lasciare che il tessuto rimanga a RT per tutto il tempo.
- Sostituire la soluzione PBS con etanolo al 20%, diluito in acqua ultrapura, e perfusare per un minimo di 3 ore.
- Perfondere il cuore utilizzando una serie di concentrazioni di etanolo in aumento.
- Iniziare sostituendo la soluzione di etanolo al 20% con etanolo diluito al 30% e perfondere per 2 ore.
- Ripetere la perfusione incrementando la concentrazione di etanolo ad ogni iterazione attraverso il 40%, 50%, 60%, 65%, 70%, 75%, 80%, 95%, 90%, 95%, 99% e 100% per una durata minima di 1 ora ad ogni fase (concentrazione).
NOTA: i campioni di cuore possono riposare senza flusso di perfusione durante la notte in qualsiasi diluizione di etanolo se si è verificata una perfusione minima di 15 minuti per tale concentrazione.
- FACOLTATIVO: Se si applicano mezzi di contrasto tramite perfusione, perfondere il cuore con etanolo al 100% integrato con il mezzo di contrasto PMA, 1% per 48 ore. Risciacquare il mezzo di contrasto per perfusione con etanolo al 100% per 2 ore.
- Per rinforzare il tessuto cardiaco prima dell'essiccazione all'aria, ricircolare una miscela 50:50 di etanolo ed esametildilisilazano (HMDS) per 10 minuti. Segui questo da 100% HMDS per ulteriori 2 ore.
ATTENZIONE: HMDS è una sostanza altamente tossica e nociva. Un forte odore di ammoniaca viene rilasciato a contatto con l'aria. Inoltre, la forma liquida di HMDS è altamente volatile e catalizzata da agenti contenenti iodio. - Scollegare le cannule dal tubo e sospendere il cuore da una sutura aortica all'interno della cappa aspirante.
- Far scorrere con attenzione un sacchetto con chiusura a zip sul cuore e chiudere il sigillo del sacchetto sopra la sutura per ridurre l'esposizione del cuore all'aria circolante. Lasciare asciugare il cuore attraverso l'evaporazione per 1 settimana.
- OPZIONALE: Per gli agenti di contrasto a caricamento per diffusione, lavare il cuore in etanolo al 100% per 15 minuti durante l'agitazione. Immergere il cuore in etanolo al 100% integrato con PMA, 1%, per 48 ore sotto vuoto. Ripetere il passaggio 4.6.
5. MicroCT:
NOTA: un sistema microCT a raggi X desktop è stato utilizzato per l'imaging di cuori di maiale.
- Montare il cuore essiccato all'aria su un apposito portacampioni. Prevenire qualsiasi movimento durante le misurazioni microCT a raggi X utilizzando un morsetto ancorato al portacampioni e fissare il cuore tramite l'aorta secca e rigida.
- Allineare meticolosamente il centro del campione cardiaco lungo il suo asse longitudinale con il centro del campo visivo di imaging per angoli di rotazione di 0° e 90°. Per ottenere questo risultato in tutti gli orientamenti, sospendere il cuore nell'aria tramite un morsetto aortico fissato al supporto del campione.
- Dopo aver aperto il software e avviato il sistema microCT a raggi X, applicare il filtro a raggi X in alluminio, 1 mm, tensione sorgente a raggi X a 60 kV e corrente a 120 μA. Impostare le dimensioni dell'immagine su 2016 x 1344 pixel e la dimensione dei pixel su 20 μm.
- Ritrarre il supporto del campione dal campo visivo e calibrare l'immagine di sfondo e il tempo di esposizione ai raggi X ottenendo una correzione a campo piatto. Assicurarsi che la trasmissione media dei raggi X di fondo sia superiore all'80%.
- Esplora le immagini di trasmissione a raggi X lungo la lunghezza del supporto per determinare il campo di imaging complessivo nell'asse longitudinale del cuore. Per la scansione, utilizzare un passo di rotazione di 0,18°, una media di fotogrammi di 5° e una rotazione del campione di 180°. Selezionare la modalità di scansione offset per visualizzare l'intera larghezza del supporto di esempio.
NOTA: I parametri di acquisizione indicati in questa sezione sono stati selezionati per ottimizzare la qualità dell'immagine della composizione del cuore dell'insieme. - Dopo la scansione, utilizzare il software per la ricostruzione tomografica di un volume di immagine tridimensionale isotropo. Per l'applicazione del software NRecon, utilizzare la correzione degli artefatti correlata all'acquisizione, inclusi gli effetti di tempra del fascio del 10% e la riduzione dell'artefatto dell'anello dell'8.
- Per ottimizzare le limitazioni di archiviazione dei dati, applicare la regione rettangolare minima di interesse che comprende i voxel di immagine specifici del cuore. Esportare le immagini in un formato bitmap a 8 bit come stack di immagini.
- Visualizza lo stack di dati ricostruito utilizzando il software DataViewer. Orientare digitalmente il campione all'interno dei limiti dell'immagine per riallineare gli assi lunghi e corti del campione con i tre assi principali del volume dell'immagine.
- Ritaglia il volume dell'immagine in tutti e tre gli assi per rimuovere i livelli di sfondo esterni dell'immagine, per ridurre al massimo le dimensioni totali dell'immagine.
Risultati
La preparazione di grandi cuori di mammiferi utilizzando il metodo di disidratazione e asciugatura all'aria rimuove tutto il contenuto di acqua dal campione. Prove di insufficiente sostituzione dell'acqua con etanolo possono essere osservate durante il caricamento di HMDS (vedere Protocollo, punto 4.4). La presenza di acqua sotto HMDS creerà bolle che salgono dal tessuto. In caso di livelli eccessivi di acqua, può verificarsi un aumento della temperatura del fluido di immersione. Mantenere la camera di immersione circondata dal ghiaccio durante il caricamento iniziale di HMDS può ridurre gli effetti negativi del riscaldamento dei tessuti. Dopo aver asciugato i cuori all'aria in assenza di mezzi di contrasto, il campione apparirà di colore bianco (vedere Protocollo, punto 4.6). La superficie esterna era spesso secca e strutturalmente stabile prima degli strati intramurali. Il risciacquo in etanolo prima del carico del mezzo di contrasto ha rimosso il deposito bianco (vedere Protocollo, punto 4.7). Affettare il tessuto usando una lama affilata rivela macroscopicamente singole fibre muscolari con una chiara separazione. Il carico di contrasto mediante immersione di campioni cardiaci in mezzo mezzo al mezzo di contrasto ha sofferto di artefatti limite di diffusione in regioni spesse e altamente muscolari del campione. Il carico di contrasto a diffusione sotto vuoto ha fornito una colorazione più omogenea nel muscolo (campione cardiaco n. 1, vedere Tabella 1 per i tempi di caricamento del mezzo di contrasto). Macroscopicamente, la distribuzione del mezzo di contrasto superficiale ha mostrato una colorazione in-omogenea tra il muscolo cardiaco e le regioni composte principalmente da componenti extracellulari, in particolare grasso e tessuto connettivo. I campioni di tessuto essiccati all'aria, prima o dopo il carico del mezzo di contrasto, hanno mantenuto un'integrità strutturale stabile.
Il tempo necessario per scansionare l'intera larghezza del campione a una risoluzione di 20 μm in microCT utilizzando i parametri di scansione sopra menzionati e un tempo di esposizione di 1700 ms è stato di 6 h 34 min. A seconda delle dimensioni del campione nell'asse a portale dello scanner, questa durata è stata moltiplicata per il numero di posizioni necessarie per catturare l'intera lunghezza del campione. Per i cuori di maiale e pecora in questo studio, sono state utilizzate da tre a quattro posizioni. Il software NRecon ha affiancato le scansioni multi-posizione e offset per formare una singola immagine di proiezione a raggi X per ogni fase di rotazione della sorgente e del rivelatore a raggi X. In totale, 1000 proiezioni vengono memorizzate come immagini a 16 bit, generando 30-40 GB di dati. Le immagini volumetriche ricostruite erano 52-70 GB.
I principali punti di riferimento anatomici, tra cui le cavità ventricolari, il setto e le pareti libere dei ventricoli, erano facilmente identificabili dall'imaging della trasmissione a raggi X di cuori di maiale essiccati all'aria macchiati con mezzo di contrasto mediante carico di diffusione (Figura 1A). Inoltre, sono state osservate anche regioni altamente strutturate che indicano l'organizzazione microstrutturale, come l'orientamento delle fibre miocardiche, a causa dell'attenuazione / trasmissione sensibile dei raggi X (Figura 1B). Le ricostruzioni tomografiche di volumi di immagini tridimensionali hanno mostrato una netta separazione tra tessuto e sfondo sia ai confini epicardici che endoteliali (Figura 1D). Per via intramurale, è stato osservato un basso contrasto e un gradiente di diffusione dell'intensità voxel in tutte le regioni transmurali spesse del tessuto. Nonostante ciò, la vascolarizzazione e le fibre miocardiche separate da piani di scissione erano ancora facilmente identificabili. Una seconda larghezza di banda di contrasto ad alta intensità è stata osservata allo strato più epicardico e nelle regioni sub-endocardiche punteggiate. Il miglioramento del contrasto è stato maggiore nei siti in cui sono stati accumulati componenti extracellulari, in particolare il tessuto connettivo epicardico, il grasso epicardico e la guaina del tessuto connettivo della rete di fibre di Purkinje. Le distribuzioni di intensità del segnale Voxel hanno mostrato un'elevata separazione dallo sfondo a intensità zero (aria) e da due popolazioni dominanti di tessuto a basso e alto contrasto (Figura 1D).
Per convalidare il miglioramento del contrasto delle ricostruzioni di immagini microCT e la selettività ai compartimenti collagenosi dei campioni cardiaci, sono stati impiegati istologia, microscopia a campo luminoso e microscopia fluorescente (Figura 2). Un blocco transmurale di tessuto ventricolare da un cuore essiccato all'aria senza precedente carico di mezzo di contrasto è stato preparato per l'incorporamento e il sezionamento della paraffina. Le fette di tessuto adiacenti montate su vetrini del microscopio sono state trattate con la colorazione tricroma di Masson, nessun trattamento o 48 ore di PMA (1%). L'immersione di sezioni di tessuto montate su vetrino ha eliminato gli effetti del gradiente di diffusione del processo di colorazione osservato in campioni di cuore intero. La colorazione tricroma di Mason ha mostrato una colorazione collagen-positiva agli strati epiteliale ed endoteliale, perivascolarmente nel tessuto sub-epicardico, e una guaina di tessuto connettivo che circonda una fibra di Purkinje a corsa libera che sporge nella cavità ventricolare sinistra (Figura 2A). L'illuminazione del campo luminoso ha mostrato una colorazione più scura nelle strutture collagenose dopo la colorazione PMA, supportando l'accumulo preferenziale di PMA (Figure 2B, C). Inoltre, il trattamento con PMA ha precedentemente dimostrato di estinguere l'autofluorescenza dei complessi macromolecolari di collagene31. Le immagini fluorescenti delle sezioni di tessuto ventricolare avevano una perdita di fluorescenza indotta da PMA nei siti di collagene (Figura 2D vs 2E, Figura 2D' vs 2E' e Figura 2D'' vs. 2E''). Sia nel campo luminoso che nell'imaging fluorescente, i compartimenti cellulari non sono stati alterati dal trattamento con PMA e il collagene ha avuto un accumulo selettivo di colorazione PMA e spegnimento dell'autofluorescenza.
Il campione di cuore #2 è stato colorato con un mezzo di contrasto tramite perfusione prima dell'essiccazione all'aria. La ricostruzione dell'immagine ha rivelato una colorazione altamente irregolare all'interno del compartimento miocardico (Figura 3A). Il miglioramento del contrasto è apparso non selettivo della composizione tissutale, senza ulteriore miglioramento dell'intensità del segnale nelle regioni epicardica o sub-endocardica. Inoltre, il tessuto a basso contrasto ha mostrato una scarsa separazione dall'intensità di fondo (Figura 3B).
La fibrosi ventricolare è stata indotta da infarto miocardico e ischemia cronica (campione cardiaco #3). Una cicatrice antero-apicale si è formata sostituendo i miociti con depositi di fibro-grasso nel tessuto a valle del sito di embolizzazione vascolare. Il campione di cuore #3 è stato preparato e ripreso da un cuneo ventricolare sezionato che copre il ventricolo anteriore sinistro, il setto e la parete libera ventricolare destra. La preparazione di questa configurazione del cuneo ventricolare è stata descritta in precedenza32 e l'applicazione di cunei per l'imaging cardiaco è stata esaminata in dettaglio33. La morfologia della cicatrice era transmurale ma eterogenea (Figura 4). Una lesione fibrotica densa centrale era circondata da una zona di confine sciolta ed eterogenea (Figura 4A). La preparazione ventricolare è stata macchiata mediante essiccazione post-aria a caricamento di diffusione e nel vuoto. La Figura 4B-E mostra le maggiori intensità di segnale dei volumi di immagini microCT ricostruite ai confini dei tessuti e alle regioni cicatriziali. I mezzi di contrasto hanno macchiato male il miocardio sano, ma il contrasto microstrutturale è stato mantenuto (Figura 4C'). Nella zona di confine, il tessuto cicatriziale era intervallato da miocardio sopravvissuto (Figura 4D'). La fibrosi densa appariva transmurale ma strutturata, indicando variazioni nella composizione (Figura 4E'). Le sezioni di tessuto di una regione ventricolare sinistra transmurale della preparazione tissutale essiccata all'aria e macchiata di PMA sono state utilizzate per convalidare la selettività della PMA per il collagene nel tessuto patologico confrontandola con la colorazione tricroma di Masson (Figura 4F). La colorazione della PMA era selettiva per il collagene (sub-epicardio e sub-endocardio) e assente nelle regioni del miocardio sopravvissuto (Figura 4G).
Il campione di cuore #4 con fibrillazione atriale persistente indotta è stato essiccato all'aria conservando la forma nativa della cavità atriale. Il collasso dell'appendice atriale non è stato osservato. I principali punti di riferimento anatomici potrebbero essere identificati morfologicamente da immagini ricostruite (setto atriale, muscoli pectinati, seno coronarico, ostia venosa polmonare, vena cava e cristae terminalis). La colorazione per diffusione sotto vuoto ha provocato un miglioramento del contrasto nella radice aortica e nelle valvole atrioventricolari e nelle regioni discrete del miocardio funzionante. Il potenziamento della colorazione muscolare è stato limitato alle appendici atriali e alle pareti posteriori degli atri sinistro e destro (Figura 5).
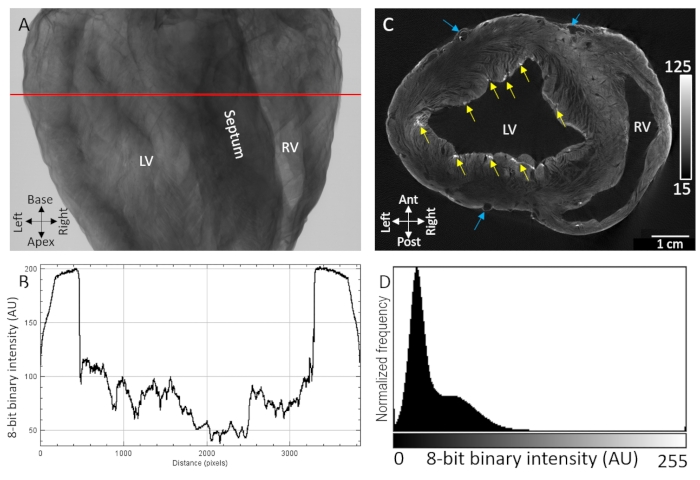
Figura 1: Imaging MicroCT di un cuore di maiale essiccato all'aria trattato con mezzo di contrasto PMA per diffusione sotto vuoto. (A) Immagine di proiezione a raggi X. (B) Un profilo di trasmissione estratto dalla linea rossa in A. (C) Fetta ad asse corto dei ventricoli da un volume tridimensionale ricostruito tomograficamente. Le frecce gialle indicano regioni puntiche di contrasto attribuite alle fibre di Purkinje sub-endocardiche. Le frecce blu indicano la vascolarizzazione. (D) Distribuzione dell'intensità del segnale della fetta di immagine ricostruita mostrata in C. LV: ventricolo sinistro e RV: ventricolo destro. Fare clic qui per visualizzare una versione più grande di questa figura.
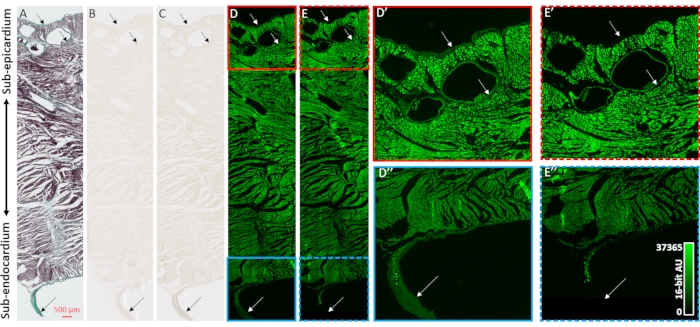
Figura 2: Validazione della selettività della PMA per il collagene. (A) Colorazione tricroma di Masson di una sezione di tessuto transmurale dai ventricoli di un cuore essiccato all'aria. Il miocardio è colorato di rosso e il collagene è mostrato con colorazione verde. Le sezioni di tessuto adiacenti (B) assenti di colorazione o (C) macchiate con PMA (1%) sono state fotografate con illuminazione a campo luminoso per valutare l'uniformità della colorazione. (D) Le sezioni di tessuto assenti di colorazione o (E) macchiate da PMA sono state riprese al microscopio fluorescente. I pannelli D' (scatola rossa solida) ed E' (riquadro rosso tratteggiato) sono viste ingrandite del sub-epicardio per sezioni non macchiate e macchiate di PMA. I pannelli D'' (scatola blu solida) ed E'' (scatola blu tratteggiata) sono corrispondenti viste ingrandite del sub-endocardio e di una fibra di Purkinje a corsa libera. Le frecce indicano i siti di contenuto di collagene. Fare clic qui per visualizzare una versione più grande di questa figura.
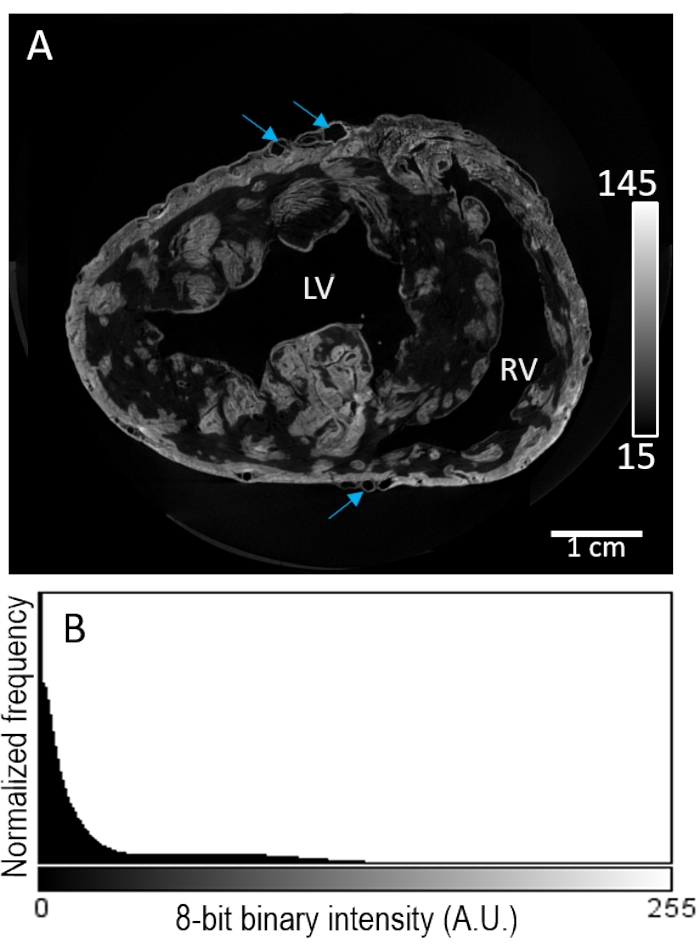
Figura 3: Carico di perfusione di PMA prima dell'essiccazione all'aria e dell'imaging MicroCT. (A) Una fetta ad asse corto di un volume di immagine ricostruito dei ventricoli da un cuore di maiale. Le frecce blu indicano la vascolarizzazione. (B) La distribuzione dell'intensità del segnale della fetta di immagine dal pannello A. LV: ventricolo sinistro e RV: ventricolo destro. Fare clic qui per visualizzare una versione più grande di questa figura.
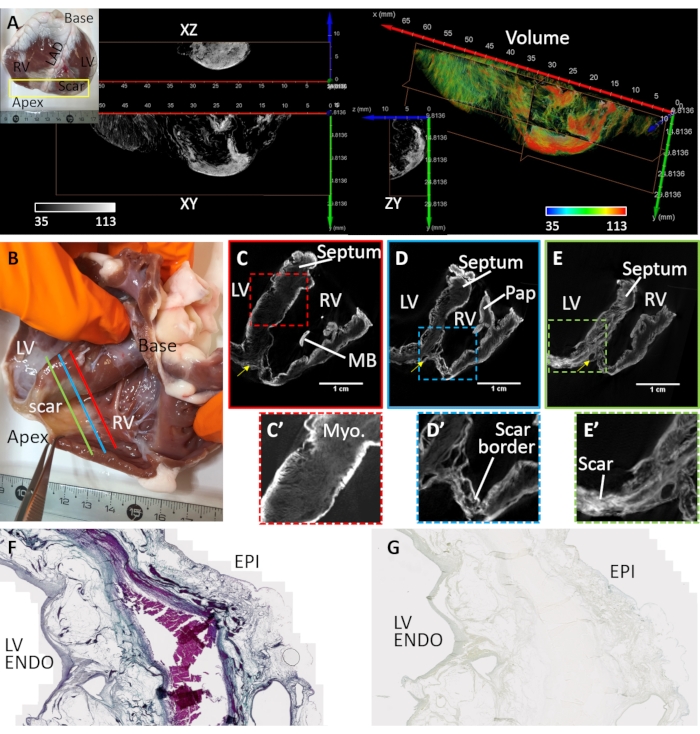
Figura 4: Imaging MicroCT di un cuore di pecora che soffre di un infarto miocardico cronico. (A) Si è formata una cicatrice densa nella regione apicale (vedi fotografia inserita). Una resa volumetrica della regione apicale da una prospettiva endocardica è stata assegnata alla colorazione in base all'intensità dell'immagine (rosso corrispondente al tessuto cicatriziale e al miocardio in verde). Le fette ortogonali dell'intensità della scala di grigi mostrano la distribuzione densa della cicatrice e il miocardio sopravvissuto confinante. La separazione tra tessuto fibrotico e miocardio corrisponde alle regioni del tessuto adiposo. (B) Una fotografia di una preparazione a cuneo ventricolare essiccata all'aria da una pecora con cicatrici apicali a seguito di infarto miocardico. Fette oblique del volume dell'immagine microCT ricostruita attraversano i ventricoli a livello medio tra base e apice e prossimali al sito di (C) occlusione vascolare (C- linea rossa nel pannello B), (D) la regione peri-infartuale confinante con cicatrice densa e miocardio sano (D- linea blu nel pannello B) e (E) una regione di fibrosi densa (E - linea verde nel pannello B). (C') Una vista espansa della regione del setto delineata da una casella tratteggiata rossa in C. (D') Una vista espansa della regione dell'infarto nell'apice ventricolare destro (riquadro tratteggiato blu nel pannello D). (E') Una vista espansa della regione dell'infarto nell'apice ventricolare sinistro (riquadro tratteggiato verde nel pannello E). LV: Cavità ventricolare sinistra; RV: cavità ventricolare destra; MB: banda di moderatori; Pap: muscolo papillare. La freccia gialla indica l'arteria discendente anteriore sinistra. (F) La colorazione tricroma di Masson di una sezione istologica tagliata dal ventricolo sinistro essiccato all'aria macchiato di PMA. Il collagene è macchiato di blu e il miocardio è macchiato di rosa / viola. (G) Una sezione tissutale corrispondente della distribuzione della colorazione PMA. Fare clic qui per visualizzare una versione più grande di questa figura.
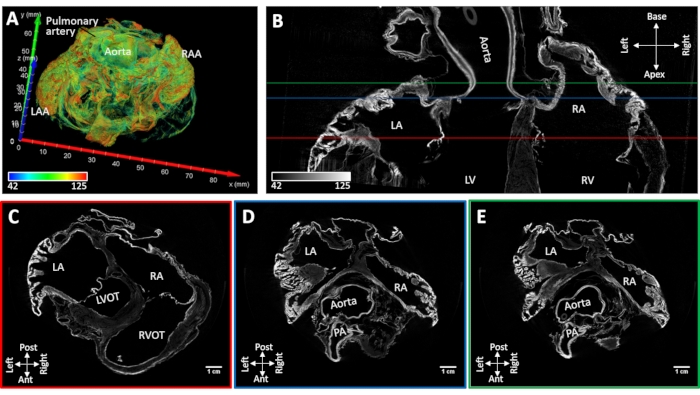
Figura 5: Immagine MicroCT di un cuore di pecora a seguito di fibrillazione atriale cronica indotta. (A) Una resa volumetrica degli atri con colorazione assegnata come nella Figura 4A. (B) Porzione di immagine microCT bi-atriale nell'asse lungo del cuore. Le fette ad asse corto sono state estratte a livello delle valvole atrioventricolari (C) (linea rossa C nel pannello B), (D) radice aortica (D- linea blu nel pannello B) e (E) tetto atriale sinistro (E- linea verde inpanel B). LA: atri di sinistra; RA: atri a destra; LAA: appendice atriale sinistra; RAA: appendice atriale destra; LV: ventricolo sinistro; RV: ventricolo destro; LVOT: tratto di deflusso ventricolare sinistro; RVOT: tratto di efflusso ventricolare destro e PA: arteria polmonare. Fare clic qui per visualizzare una versione più grande di questa figura.
| Campione # | 1 | 2 | 3 | 4 |
| Specie | Maiale | Maiale | Pecora | Pecora |
| Peso corporeo (kg) | 32.4 | 31.2 | 47.2 | 53.4 |
| Peso del cuore (g) | 191.2 | 186.2 | 202.4 | 207.6 |
| Patologia | - | - | Infarto miocardico cronico | Fibrillazione atriale cronica |
| Preparazione del campione | Tutto il cuore | Tutto il cuore | Cuneo del cuore anteriore | Tutto il cuore |
| Modalità di caricamento a contrasto | Diffusione | Perfusione | Diffusione | Diffusione |
| Esposizione al mezzo di contrasto (h) | 48 | 24 | 48 | 48 |
Tabella 1: Campioni di cuore e trattamento con mezzo di contrasto.
Discussione
Un protocollo dettagliato per le preparazioni di tessuti di grandi dimensioni viene definito utilizzando cuori interi di grandi mammiferi per la successiva imaging strutturale ad alta risoluzione. Un approccio di essiccazione all'aria ha rimosso le influenze dell'attenuazione dei raggi X di fondo e ha ottimizzato al massimo il tessuto: contrasto di fondo29. Utilizzando questo approccio, è stata raggiunta una risoluzione isotropa nell'intervallo di 20 μm per l'imaging volumetrico su campioni fino a 7,2 cm di diametro. La microCT dei tessuti molli, tuttavia, si basa tipicamente sull'uso di agenti di contrasto non specifici per migliorare l'assorbimento dei raggi X e la sensibilità dei sistemi microCT34. Sebbene gli agenti di contrasto a raggi X migliorino l'attenuazione complessiva dei raggi X e il miglioramento dell'imaging dei tessuti molli, la separazione dei costituenti tissutali in base alla composizione biochimica rimane difficile. Tuttavia, è stato osservato che l'uso di cuori essiccati all'aria in combinazione con un comune agente di contrasto a raggi X in laboratorio, PMA, ha colorato selettivamente i componenti extracellulari. Il tessuto connettivo associato a miocardio sano e rimodellamento strutturale patologico nelle malattie croniche è stato migliorato.
Il processo di essiccazione all'aria del tessuto biologico richiede un intervento per resistere alla deformazione del campione. La preparazione del campione per la microscopia elettronica ha requisiti simili. Tipicamente, viene utilizzato un metodo di essiccazione del punto critico, che utilizza un equilibrio di mezzo di immersione tissutale, temperatura e pressione per eliminare la tensione superficiale del contenuto liquido del tessuto, che causa la deformazione a livello molecolare dopo l'evaporazione35. Questo approccio richiede una sostituzione uniforme del contenuto di acqua del campione con anidride carbonica liquida, che è più affidabile in campioni piccoli e facilmente diffusibili. In alternativa, l'integrità strutturale del tessuto può essere migliorata e l'essiccazione all'aria, cioè la fase di evaporazione può essere applicata su un periodo più lungo per ridurre la deformazione complessiva. La molecola HMDS subisce la sililazione per formare uno scaffold a base di silicone per rafforzare e stabilizzare l'organizzazione molecolare del campione di tessuto36. L'evaporazione viene ulteriormente prolungata limitando le correnti d'aria circolanti dall'ambiente, anche per evitare l'evaporazione disomogenea, in particolare tra la superficie del campione e gli strati intramurali.
Numerosi agenti di contrasto sono stati precedentemente utilizzati per l'imaging microCT dei tessuti molli. I più comuni sono iodio, acido fosfotungstico (PTA) e PMA. Lo iodio in particolare è stato impiegato a causa di un più alto tasso di diffusione 34,37,38. Tuttavia, lo iodio agisce come catalizzatore per la sililazione del reagente HMDS36. La reazione catalizzata è aggressiva ed esotermica, con un alto rischio di distruzione del campione e rischio per la sicurezza se l'HMDS residuo rimane a causa di un'essiccazione incompleta del campione. Sia il PTA che il PMA disciolti in etanolo possono essere tranquillamente utilizzati in combinazione con HMDS. PTA e PMA hanno dimostrato di fornire un maggiore potere risolutivo delle strutture fini nei dischi intervertebrali non mineralizzati rispetto alla colorazione dello iodio38. Nell'imaging microCT di campioni di mammiferi, PTA e PMA sono stati utilizzati per la colorazione di embrioni di topo39, sistema cardiovascolare di topo37, muscolo di coniglio e cervello40 e vene suine41. Il PTA ha una massa molecolare e una densità in soluzione più elevate rispetto alla PMA. Ciò è in parte dovuto a una maggiore massa atomica di tungsteno (il numero atomico è 74 g / mol), il principale elemento attenuante nel PTA. In confronto, l'elemento più pesante in PMA, il molibdeno, ha un numero atomico di 42 g / mol. Sia la massa atomica che la densità del campione sono alla base dell'attenuazione dei raggi X, oltre allo spessore del campione42. Aumentando la lunghezza del percorso dei raggi X aumentando le dimensioni del campione, l'attenuazione dei raggi X diventa più sensibile all'aumento della densità del campione. Pertanto, l'agente di contrasto PMA a densità inferiore è stato selezionato per ridurre il rischio di eccessiva attenuazione e per ottimizzare la gamma dinamica del contrasto dell'immagine per i cuori di scala umana. Ulteriori prove hanno dimostrato che il carico di diffusione della PMA fornisce una colorazione più omogenea rispetto alla molecola più grande PTA nel tessuto cardiaco43.
Il metodo di somministrazione dell'agente di contrasto influisce sull'uniformità della distribuzione dell'agente di contrasto nel tessuto cardiaco (Figura 3). La perfusione di agenti di contrasto nel cuore disidratato con etanolo ha mostrato livelli di colorazione di fondo irregolare di PMA a causa della resistenza vascolare variabile. Nel cuore essiccato all'aria, la struttura laminare muscolare è enfatizzata dal processo di essiccazione del campione, aumentando la separazione laminare muscolare. Ciò alla fine ha migliorato la permeabilità complessiva del tessuto per il carico di agenti di contrasto basati sulla diffusione. Di conseguenza, l'essiccazione all'aria ha facilitato il tessuto: contrasto dell'aria a livello laminare e intralaminare (Figura 4). Inoltre, il carico di diffusione può essere ulteriormente facilitato dall'applicazione sotto vuoto. È stato inoltre dimostrato che il restringimento tissutale dei campioni non essiccati dipende dalla concentrazione di mezzo di contrasto40. Tuttavia, la precedente stabilizzazione morfologica del campione mediante essiccazione all'aria inibisce gli effetti di restringimento dei tessuti29.
Le immagini microCT ad alta risoluzione di interi organi producono intrinsecamente grandi volumi di dati. La natura delle tecniche di imaging tomografico consente la visualizzazione e la gestione delle immagini su base slice-by-slice, il che facilita l'elaborazione del computer e il carico di memoria. Tuttavia, per visualizzare stack di immagini tridimensionali, ad esempio per eseguire il rendering di volumi di campioni in rappresentazioni tridimensionali, le specifiche minime consigliate per il computer sono 128 GB di RAM e una velocità del processore di 3 GHz. Anche i dischi rigidi a stato solido hanno notevolmente migliorato il trasferimento dei dati.
L'emergere dell'imaging microCT in campo cardiaco offre numerosi vantaggi per gli studi traslazionali e la convalida clinica. I vantaggi della sua imaging tridimensionale e micrometrico hanno già mostrato applicazioni nel determinare il carico trombotico dei pazienti con ischemia miocardica con elevazione ST 44,45. La mappatura delle potenziali fonti di aritmia nei pazienti con cardiopatia strutturale dipende in gran parte dalla determinazione della distribuzione del tessuto cicatriziale fibrotico e dalla localizzazione delle tracce intrecciate del miocardio sopravvissuto. Gli approcci di seconda linea per la diagnosi delle aritmie ventricolari utilizzano la risonanza magnetica46. Può localizzare in modo robusto la fibrosi densa, ma è limitato alla caratterizzazione morfologica a bassa risoluzione e offre una visione limitata del rimodellamento microstrutturale e delle distribuzioni diffuse delle lesioni fibrotiche47. L'esame ad alta risoluzione della distribuzione e della caratterizzazione delle cicatrici ha un vasto potenziale per migliorare la nostra comprensione del rimodellamento strutturale cardiaco e del rischio di sviluppare insufficienza cardiaca. In particolare, studi di ricerca fondamentale o indagini post-mortem trarranno beneficio da immagini strutturali corroboranti per la mappatura elettrica dell'aritmia cardiaca.
In conclusione, i cuori rinforzati con trattamento HMDS e asciugatura all'aria possono successivamente essere colorati con un mezzo di contrasto a raggi X per migliorare l'attenuazione a raggi X dei componenti extracellulari. In particolare, nel miocardio sano, l'accumulo di PMA si verifica nell'epitelio, nel tessuto valvolare e nei compartimenti del sistema di conduzione ventricolare rivestiti dal tessuto connettivo con conseguente attenuazione dei raggi X migliorata. Inoltre, nel miocardio strutturalmente malato, il contrasto migliorato era ulteriormente selettivo per la fibrosi.
Divulgazioni
Nessuno
Riconoscimenti
Questo studio ha ricevuto un sostegno finanziario dal governo francese nell'ambito del programma "Investimenti del futuro" gestito dall'Agenzia nazionale per la ricerca (ANR), dal riferimento di sovvenzione ANR-10-IAHU-04 e dalla Fondazione Leducq (rete RHYTHM), nonché dal riferimento di sovvenzione ANR-17-CE14-0029-01 [UNMASC], finanziamenti dello Spazio europeo della ricerca sulle malattie cardiovascolari (ERA-CVD), riferimento di sovvenzione H2020-HCO-2015_680969 [MultiFib] e finanziamenti della regione francese Nouvelle Aquitaine, riferimenti di sovvenzione 2016 - 1R 30113 0000 7550/2016-1R 30113 0000 7553 e ANR-19-ECVD-0006-01.
Materiali
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Diapath | F0043 | |
| Calcium chloride solution | Honeywell | 21114 | |
| Canulation Tubing PTFE | VWR | DENE3400102 | |
| Constant Head 1L Reservoir | Harvard Apparatus | 50-0496 | |
| D-(+)-Glucose | Sigma | G5767 | |
| Ethanol absolute | VWR | 20821.330 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | 796881 | |
| Heparin sodium (5000 U/mL) | Panpharma | 3400891287301. | |
| Hexamethyldisilazane (HMDS) | Sigma | 440191-1L | |
| Hydrochloric acid, ACS reagent, 37% | Sigma | 258148 | |
| Magnesium chloride solution | Honeywell | 63020 | |
| Phosphate buffered saline (PBS) | Sigma | P5368 | |
| Phosphomolybdic acid hydrate | Fisher Scientific | 417895000 | |
| Potassium Chloride | Sigma | P5405 | |
| Pump Tubing, 3-Stop | Ismatec | FV-96328-48 | |
| SkyScan, 1276 | Bruker | micro CT | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium Chloride | Sigma | S3014 | |
| Sodium hydroxide solution 50% in H2O | Sigma | 415413 | |
| Tube Connector Kits | Harvard Apparatus | 72-1407 | |
| Tubing pump | Ismatec | ISM 1089 | |
| Tubing Tygon R-3603 1.6 mm 3.2 mm 0.8 mm | VWR | 228-1279 | |
| Tubing Tygon R-3603 3.2 mm 4.8 mm 0.8 mm | VWR | 228-1283 | |
| Two-part single-use syringes 50 mL | Norm-Ject | 4850001000 | Pyrogen-free, PVC-free |
Riferimenti
- Srinivasan, N. T., Schilling, R. J. Sudden cardiac death and arrhythmias. Arrhythmia & Electrophysiology Review. 7 (2), 111-117 (2018).
- Szumowski, L., et al. Mapping and ablation of polymorphic ventricular tachycardia after myocardial infarction. Journal of the American College of Cardiology. 44 (8), 1700-1706 (2004).
- Bode, K., et al. Ablation of polymorphic ventricular tachycardias in patients with structural heart disease. PACE - Pacing and Clinical Electrophysiology. 31 (12), 1585-1591 (2008).
- Enjoji, Y., et al. Catheter ablation of fatal ventricular tachyarrhythmias storm in acute coronary syndrome-role of Purkinje fiber network. Journal of Interventional Cardiac Electrophysiology. 26 (3), 207-215 (2009).
- Sinha, A. M., et al. Role of left ventricular scar and purkinje-like potentials during mapping and ablation of ventricular fibrillation in dilated cardiomyopathy. PACE - Pacing and Clinical Electrophysiology. 32 (3), 286-290 (2009).
- Peichl, P., Čihák, R., Koželuhová, M., Wichterle, D., Vančura, V., Kautzner, J. Catheter ablation of arrhythmic storm triggered by monomorphic ectopic beats in patients with coronary artery disease. Journal of Interventional Cardiac Electrophysiology. 27 (1), 51-59 (2010).
- Marrouche, N. F., et al. Mode of initiation and ablation of ventricular fibrillation storms in patients with ischemic cardiomyopathy. Journal of the American College of Cardiology. 43 (9), 1715-1720 (2004).
- Bänsch, D., et al. Successful catheter ablation of electrical storm after myocardial infarction. Circulation. 108 (24), 3011-3016 (2003).
- Yokoshiki, H., Mitsuyama, H., Watanabe, M., Mizukami, K., Tsutsui, H. Suppression of ventricular fibrillation by electrical modification of the Purkinje system in hypertrophic cardiomyopathy. Heart and Vessels. 29 (5), 709-717 (2014).
- Agress, C. M., Rosenberg, M. J., Jacobs, H. I., Binder, M. J., Schneiderman, A., Clark, W. G. Protracted shock in the closed-chest dog following coronary embolization with graded microspheres. The American journal of physiology. 170 (3), 536-549 (1952).
- Bolukoglu, H., Liedtke, A. J., Nellis, S. H., Eggleston, A. M., Subramanian, R., Renstrom, B. An animal model of chronic coronary stenosis resulting in hibernating myocardium. American Journal of Physiology - Heart and Circulatory Physiology. 263, 20-29 (1992).
- Capone, R. J., Most, A. S., Sydlik, P. A. Precordial ST segment mapping. A sensitive technique for the evaluation of myocardial injury. CHEST. 67 (5), 577-582 (1975).
- Dib, N., Diethrich, E. B., Campbell, A., Gahremanpour, A., McGarry, M., Opie, S. R. A percutaneous swine model of myocardial infarction. Journal of Pharmacological and Toxicological Methods. 53 (3), 256-263 (2006).
- Dogné, J. M., et al. Characterization of an original model of myocardial infarction provoked by coronary artery thrombosis induced by ferric chloride in pig. Thrombosis Research. 116 (5), 431-442 (2005).
- Eldar, M., Ohad, D., Bor, A., Varda-Bloom, N., Swanson, D. K., Battler, A. A closed-chest pig model of sustained ventricular tachycardia. Pacing and Clinical Electrophysiology. 17 (10), 1603-1609 (1994).
- Elzinga, W. E. Ameroid constrictor: uniform closure rates and a calibration procedure. Journal of applied physiology. 27 (3), 419-421 (1969).
- Hughes, G. C., Post, M. J., Simons, M., Annex, B. H. Translational physiology: Porcine models of human coronary artery disease: Implications for preclinical trials of therapeutic angiogenesis. Journal of Applied Physiology. 94 (5), 1689-1701 (2003).
- Lichtig, C., Brooks, H., Chassagne, G., Glagov, S., Wissler, R. W. Basic fuchsin picric acid method to detect acute myocardial ischemia. An experimental study in swine. Archives of Pathology and Laboratory Medicine. 99 (3), 158-161 (1975).
- Näslund, U., Häggmark, S., Johansson, G., Pennert, K., Reiz, S., Marklund, S. L. Effects of reperfusion and superoxide dismutase on myocardial infarct size in a closed chest pig model. Cardiovascular Research. 26 (2), 170-178 (1992).
- Reffelmann, T., et al. A novel minimal-invasive model of chronic myocardial infarction in swine. Coronary Artery Disease. 15 (1), 7-12 (2004).
- Reimer, K. A., Lowe, J. E., Rasmussen, M. M., Jennings, R. B. The wavefront phenomenon of ischemic cell death. 1. Myocardial infarct size vs duration of coronary occlusion in dogs. Circulation. 56 (5), 786-794 (1977).
- Salazar, A. E. Experimental myocardial infarction. Induction of coronary thrombosis in the intact closed-chest dog. Circulation research. 9, 1351-1356 (1961).
- Takahashi, M., et al. Effects of angiotensin I-converting enzyme inhibitor and angiotensin II type 1 receptor blocker on the right ventricular sarcoglycans and dystrophin after left coronary artery ligation. European Journal of Pharmacology. 522 (1-3), 84-93 (2005).
- Gonzalez-Tendero, A., et al. Whole heart detailed and quantitative anatomy,myofibre structure and vasculature from X-ray phase-contrast synchrotron radiation-basedmicro computed tomography. European Heart Journal Cardiovascular Imaging. 18 (7), 732-741 (2017).
- Teh, I., et al. Resolving fine cardiac structures in rats with high-resolution diffusion tensor imaging. Scientific Reports. 6, 30573 (2016).
- Teh, I., et al. Validation of diffusion tensor MRI measurements of cardiac microstructure with structure tensor synchrotron radiation imaging. Journal of Cardiovascular Magnetic Resonance. 19 (1), 31 (2017).
- Abouezzeddine, O., et al. Relevance of endocavitary structures in ablation procedures for ventricular tachycardia. Journal of Cardiovascular Electrophysiology. 21 (3), 245-254 (2010).
- Pambrun, T., et al. Epicardial course of the septopulmonary bundle: Anatomical considerations and clinical implications for roof line completion. Heart Rhythm. 18 (3), 349-357 (2021).
- Pallares-Lupon, N., et al. Optimizing large organ scale micro computed tomography imaging in pig and human hearts using a novel air-drying technique. bioRxiv. , (2021).
- Martins, R. P., et al. Dominant frequency increase rate predicts transition from paroxysmal to long-term persistent atrial fibrillation. Circulation. 129 (14), 1472-1482 (2014).
- Puchtler, H., Waldrop, F. S., Valentine, L. S. Fluorescence microscopic distinction between elastin and collagen. Histochemie. 35 (1), 17-30 (1973).
- Walton, R. D., et al. Compartmentalized Structure of the Moderator Band Provides a Unique Substrate for Macroreentrant Ventricular Tachycardia. Circulation: Arrhythmia and Electrophysiology. 11 (8), 005913 (2018).
- Di Diego, J. M., Sicouri, S., Myles, R. C., Burton, F. L., Smith, G. L., Antzelevitch, C. Optical and electrical recordings from isolated coronary-perfused ventricular wedge preparations. Journal of Molecular and Cellular Cardiology. 54, 53-64 (2013).
- Pauwels, E., Van Loo, D., Cornillie, P., Brabant, L., Van Hoorebeke, L. An exploratory study of contrast agents for soft tissue visualization by means of high resolution X-ray computed tomography imaging. Journal of Microscopy. 250 (1), 21-31 (2013).
- Mulet, A. Book Review: Modern Drying Technology, Volume 3: Product Quality and Formulation , edited by E. Tsotsas and A. S. Mujumdar. Drying Technology. 32 (2), 244-245 (2014).
- Karimi, B., Golshani, B. Mild and highly efficient method for the silylation of alcohols using hexamethyldisilazane catalyzed by iodine under nearly neutral reaction conditions. Journal of Organic Chemistry. 65 (21), 7228-7230 (2000).
- Dunmore-Buyze, P. J., et al. Three-dimensional imaging of the mouse heart and vasculature using micro-CT and whole-body perfusion of iodine or phosphotungstic acid. Contrast Media and Molecular Imaging. 9 (5), 383-390 (2014).
- Disney, C. M., Madi, K., Bodey, A. J., Lee, P. D., Hoyland, J. A., Sherratt, M. J. Visualising the 3D microstructure of stained and native intervertebral discs using X-ray microtomography. Scientific Reports. 7 (1), 16279 (2017).
- Descamps, E., Sochacka, A., de Kegel, B., Van Loo, D., Hoorebeke, L., Adriaens, D. Soft tissue discrimination with contrast agents using micro-ct scanning. Belgian Journal of Zoology. 144 (1), (2014).
- Buytaert, J., Goyens, J., De Greef, D., Aerts, P., Dirckx, J. Volume shrinkage of bone, brain and muscle tissue in sample preparation for micro-CT and light sheet fluorescence microscopy (LSFM). Microscopy and Microanalysis. 20 (4), 1208-1217 (2014).
- Nierenberger, M., Rémond, Y., Ahzi, S., Choquet, P. Assessing the three-dimensional collagen network in soft tissues using contrast agents and high resolution micro-CT: Application to porcine iliac veins. Comptes Rendus - Biologies. 338 (7), 425-433 (2015).
- Speck, U. . General principles of x-ray contrast media. X-Ray Contrast Media. , (2018).
- Rajasekar, A., Trew, M. L., Sands, G. B. . Understanding and enhancing the use of micro-computed tomography in soft tissue. , (2015).
- Karagiannidis, E., et al. Micro-CT-based quantification of extracted thrombus burden characteristics and association with angiographic outcomes in patients with ST-elevation myocardial infarction: The QUEST-STEMI Study. Frontiers in Cardiovascular Medicine. 8, 646064 (2021).
- Karagiannidis, E., et al. Serum ceramides as prognostic biomarkers of large thrombus burden in patients with stemi: A micro-computed tomography study. Journal of Personalized Medicine. 11 (2), 89 (2021).
- Hennig, A., et al. High-resolution three-dimensional late gadolinium-enhanced cardiac magnetic resonance imaging to identify the underlying substrate of ventricular arrhythmia. Europace : European Pacing, Arrhythmias, and Cardiac Electrophysiology: Journal of the Working Groups on Cardiac Pacing, Arrhythmias, and Cardiac Cellular Electrophysiology of the European Society of Cardiology. 20, 179-191 (2018).
- Lorgis, L., et al. Relationship between fragmented QRS and no-reflow, infarct size, and peri-infarct zone assessed using cardiac magnetic resonance in patients with myocardial infarction. Canadian Journal of Cardiology. 30 (2), 204-210 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon