Method Article
慢性疾患を有する大型哺乳類心臓モデルのコントラスト増強マイクロコンピュータ断層撮影イメージングのための組織調製技術
要約
ここでは、コラーゲン選択的コントラスト増強を有する健康で病理学的な大型哺乳類心臓全体の高解像度マイクロコンピュータ断層撮影画像を得るためのプロトコルを提示する。
要約
構造リモデリングは、心臓に課せられた慢性的な病理学的ストレスの一般的な結果である。罹患組織の建築的および構成的特性を理解することは、不整脈行動との相互作用を決定するために重要である。臨床分解能を下回るマイクロスケールの組織リモデリングは、致死的不整脈の重要な原因として浮上しており、若年成人において高い有病率を有する。大型哺乳類の心臓全体などの前臨床モデルに対して十分なマイクロスケール解像度で高い画像コントラストを得ることには、課題が残っています。さらに、3次元高解像度画像化のための組織組成選択的コントラスト増強は依然として欠けている。マイクロコンピュータ断層撮影法を用いた非破壊イメージングは、高解像度イメージングに有望であることを示しています。その目的は、大規模な生物学的サンプルにおけるX線過減衰の苦しみを緩和することでした。心臓は、健康なブタ(N = 2)、およびヒツジ(N = 2)から抽出され、慢性心筋梗塞および線維性瘢痕形成を誘発するか、または慢性心房細動を誘発した。摘出した心臓を、カルシウムイオン消光剤および血管拡張剤を添加した生理食塩水、段階的脱水中のエタノール、および真空下でのヘキサメチルジシリザンで灌流した。後者は、1週間の風乾中に心臓構造を強化した。コラーゲン優勢組織は、X線造影増強剤、リンモリブデン酸によって選択的に結合した。組織立体構造は空気中で安定しており、長期間のマイクロコンピュータ断層撮影で高解像度(等方性20.7μm)画像を得ることができました。 拡散による最適な造影剤装填は、健康なブタ心室における上皮層および心内膜下プルキンエ線維の選択的コントラスト増強を示した。心房細動(AF)心臓は、心房の後壁および付属器における増強されたコントラスト蓄積を示し、コラーゲン含有量の増加に起因する。心筋梗塞心臓は、心臓線維症の領域において選択的にコントラストの増加を示し、これは、織り交ぜられた生き残った心筋筋線維の同定を可能にした。コントラスト増強空気乾燥組織調製物は、無傷の大型哺乳動物心臓のマイクロスケールイメージングおよび基礎疾患成分の選択的コントラスト増強を可能にした。
概要
構造的心疾患は、世界中の心臓関連死亡率の大部分を占めています1.心臓構造のリモデリングは、心筋環境および間質空間に影響を及ぼす。心臓の電気的および機械的機能の両方が筋細胞組織に依存するので、破壊は耐え難い心臓不整脈、血液ポンプ作用の障害、および心不全2,3,4,5,6,7,8,9をもたらし得る。構造的心臓病に対する治癒的治療法の開発は、疾患の有病率をはるかに上回っています2,5。このように、構造的心臓疾患の前臨床モデルの数の増加は、心臓不整脈の解剖学的形態学的プロファイルおよび結果として生じる病因をよりよく理解するために出現している10、11、12、13、14、15、16、17、18、19、20、21,22,23。構造疾患スペクトル全体にわたって観察されるのは、間質性線維症の上方制御であり、より一般的には虚血関連症例において、線維症および脂肪組織による心筋置換である18。病理学的細胞外成分の形態学的理解は、不整脈の潜在的な基質の同定を可能にすることができる。この疾患の分布および程度は、不整脈誘発リスクの強力な指標を提供する。しかし、無傷の心臓にマクロスケールとマイクロスケールを統合することによって疾患プロファイルを包括的に画像化するには、依然として課題が残っています。
X線に基づくマイクロコンピュータ断層撮影(microCT)は、造影剤を使用して軟部生体組織の微細構造を調査するための強力なツールとして浮上している。非常に詳細な解剖学的地図は、小型げっ歯類24、25、26および大型哺乳類の心臓からの小型解剖サンプル27、28から得られた。しかし、大型哺乳類の心臓の全器官レベルでのイメージングは、従来の組織調製技術を用いてX線光子が減衰する過剰な経路長を提示する。これには、組織にコントラスト負荷をかけ、取得中にサンプルを造影剤溶媒に浸漬することが含まれます。サンプルサイズと分解能を大きくすると、合計集録時間が長くなります。したがって、組織の安定性は、使用可能な画像再構成にとって極めて重要となり、乾燥に起因する組織の変形を防止しなければならないことを意味する。しかしながら、浸漬流体の使用には、(i)全体的なバックグラウンドシグナル強度が無視できない程度になり、(ii)組織結合コントラスト分子の希釈を促進するという欠点がある。これらの要因の両方が、画像のコントラストを低下させる原因となります。
この研究は、バックグラウンド光子減衰を緩和し、コントラスト増強剤によってもたらされるダイナミックレンジを最適化するための新規組織処理パイプラインを詳述する。組織変形を制限するために化学組織補強を伴う組織空気乾燥アプローチを使用することが示唆される29。したがって、組織サンプルは、長時間の取得のために空気中で安定に保たれ、浸漬流体からのバックグラウンドの寄与を省略することができます。この方法論パイプラインは、(i)ブタの心臓全体を使用して最適化された包括的な組織処理およびイメージングプロトコルを提供する。(ii)コントラスト濃度および負荷技術の評価、ならびに(iii)羊の心臓における心房細動および心筋梗塞の2つの異なる慢性疾患モデルにおけるこのパイプラインの適用。慢性疾患モデルの開発は、各慢性心疾患モデルについて他の場所で記載されており、経皮的冠動脈塞栓術13 および自立性心房細動30により誘導される心筋梗塞。
プロトコル
すべての実験は、科学的目的で使用される動物の保護に関する欧州議会の指令2010/63/EUのガイドラインに従って実施されました。動物のプロトコルは、ボルドー大学の地元の倫理委員会(CEEA50)によって承認されました。心臓は、(i)健康な大型白色ブタ(N = 2、生後2ヶ月)を含む3つの大型哺乳類モデルから供給された。(ii)心筋梗塞を誘発したヒツジ(N=1、2歳)13 および(iii)心房細動を誘発したヒツジ(N=1、7歳)30。
1.溶液調製:
- 心臓麻痺溶液:蒸留水3Lを調製し、塩化ナトリウム(110mM)、塩化カリウム(16mM)、炭酸水素ナトリウム(10mM)、D-(+)-グルコース(9mM)、塩化カルシウム溶液(1.2mM)および塩化マグネシウム溶液(16mM)を加える。最後に、500 μL/Lのヘパリンナトリウムを加える。この溶液を4°Cで保存する。
- リン酸緩衝生理食塩水-EDTA溶液(PBS-EDTA)。
- まず、エチレンジアミン四酢酸(EDTA)を1Lの蒸留水に終濃度10mMで加える。EDTAを溶解するために水酸化ナトリウム溶液(1M)を用いて溶液pHを12に増加および維持する。
- EDTAが完全に溶解したら、塩酸を使用してpHを7.4に下げます。リン酸緩衝生理食塩水のホイルパウチを1つ加えて、0.01M(塩化ナトリウム、0.138M;塩化カリウム、0.0027M)およびpH7.4の溶液を得た。この溶液を室温(RT)で保存します。
- エタノール-リンモリブデン酸(PMA)造影剤溶液:無水エタノール1Lを調製し、PMAを添加し、1%濃度の溶液を得た。RTでこのソリューションを保存します。
2. 組織の供給源
- 動物を安楽死させ、地元の倫理ガイドラインに従って心臓を抽出します。心臓を冷たい心麻痺溶液に素早く浸し、最初のすすぎのために心室を優しくマッサージします。
- 大動脈弓の下の大動脈を切断し、針ホルダーを使用して動脈壁の両側をクランプしてください。
- 針ホルダーで心臓を吊り下げ、大動脈カニューレを大動脈根に挿入し、大動脈弁と接触したり突出したりしないように注意してください。カニューレの高さで大動脈弓の周りに0ゲージの縫合糸を巻き付け、カニューレを所定の位置にしっかりと結び付けます。
- 50mLシリンジを用いて、200mLの冷たい(4°C)心麻痺溶液を注入する。肺静脈を介して排出するために、その後側の心臓を傾けることによって、空洞に溜まった余分な血液を除去します。
- すすぎた心臓を浸し、解剖の準備が整うまで氷上に保存した冷たい心麻痺溶液に保管してください。
3.組織調製:
- 解剖皿の上方80cmに支持された1Lの貯留部を作製する。長さ80cm、内径3.2mm、外径4.8mmの熱可塑性チューブを貯水池の排水口に結合する。
- 3 方向タップを排水チューブに固定し、さらに熱可塑性チューブ (20 cm、内径 1.6 mm、外径 3.2 mm) を 3 方向タップの各空きポートに結合します。チューブの料金端に双方向タップを固定します。
- ヘパリン(2500単位)を添加した心麻痺溶液でリザーバを満たします。タップを開いて、心麻痺溶液がすべての気泡を排出して除去できるようにしてから、双方向タップを閉じます。
- ポリテトラフルオロエチレン(PTFE)チューブ(内径1mm、外径2mm)を用いて左右の冠状動脈骨用のカニューレを作製する。
- 5cmのチューブを切り、先端を裸の炎の隣に置いて一端を加熱します。先端の1mmが溶け始めて半透明になったら、先端を硬い耐熱面に押し付けてカニューレ先端に隆起を形成し、カニューレが容器から滑り落ちるのを防ぎます。
- 各カニューレの非加熱端部の1cmを排水リザーバ排水チューブの両端に挿入する。
- 大動脈カニューレを除去します。冷たい心麻痺溶液の下で、冠状動脈の左右の骨を局在化させる。
- 尖ったはさみを使用して、冠状動脈骨の上下の周囲の組織から大動脈根を慎重に分離し、冠状動脈血管の下に0Gシルク縫合糸を通すことを可能にする。
- 双方向タップを開き、カニューレの先端を冠状動脈骨に挿入します。カニューレの先端が骨に1〜2cm伸び、縫合糸の配置を超えて伸びている状態で、カニューレを結びます。
- 心臓の血液がなくなるまで心室を15分間優しくマッサージしながら、心臓をすすぎます。
- すすぎ後、双方向タップを閉じ、3方向タップから外します。500mLのPBS-EDTA溶液を含む1Lプラスチック耐薬品性容器に心臓を移す。
- PBS-EDTA溶液をヒュームフードの下の熱可塑性チューブに再循環させ、2つのチャネルを備えたペリスタルティックポンプを使用します。チューブに気泡がなくなるまでポンプチューブをプライミングし、RTで80mL/minで2時間再循環することによって各冠状動脈カニューレを灌流する。
- ヒュームフードが動作していることを確認します。ポンプを停止し、容器から溶液を排出し、ホルマリン(10%)と交換して、RTで80mL/minで1時間固定する。
- ホルマリン溶液をPBSと交換し、固定液を80mL/minでそれぞれ15分間3回すすいでください。
4.組織の脱水および乾燥:
注:同じ灌流速度(80mL/分)を使用し、組織をRTにとどめてください。
- PBS溶液をエタノールで20%交換し、超純水で希釈し、最低3時間灌流する。
- 一連の増分エタノール濃度を使用して心臓を灌流する。
- 20%エタノール溶液を30%に希釈したエタノールで交換することから始めて、2時間灌流する。
- 各反復でエタノール濃度を40%、50%、60%、65%、70%、75%、80%、95%、90%、95%、99%、および100%まで増分して、各ステップ(濃度)で1時間の最小持続時間にわたって灌流を繰り返す。
注:心臓サンプルは、その濃度に対して15分の最小灌流が行われた場合、エタノール希釈で一晩灌流流なしで休止することができる。
- オプション:灌流を介して造影剤を適用する場合は、造影剤PMAを添加した100%エタノールで心臓を灌流し、1%を48時間灌流する。造影剤を100%エタノールで2時間灌流してすすいでください。
- 風乾前に心臓組織を強化するために、エタノールとヘキサメチルジシラザン(HMDS)の50:50混合物を10分間再循環させる。これを100%HMDSでさらに2時間追跡してください。
注意: HMDS は非常に有毒で有害な物質です。アンモニアの強い臭いが空気と接触して放出される。さらに、HMDSの液体形態は揮発性が高く、ヨウ素含有剤によって触媒される。 - カニューレをチューブから外し、ヒュームフード内の大動脈縫合糸から心臓を吊り下げます。
- ジップロックバッグを心臓の上に慎重にスライドさせ、縫合糸の上のバッグシールを閉じて、循環空気への心臓の暴露を減らします。心臓を1週間蒸発させて乾燥させます。
- オプション:拡散負荷造影剤の場合は、攪拌しながら100%エタノールで15分間心臓を洗ってください。PMAを1%補充した100%エタノールに心臓を浸し、真空下で48時間浸す。手順 4.6 を繰り返します。
5. マイクロCT:
注:ブタの心臓のイメージングには、デスクトップX線マイクロCTシステムが使用されました。
- 風乾した心臓を適切なサンプルホルダーに取り付けます。サンプルホルダーに固定されたクランプを使用してX線マイクロCT測定中の動きを防ぎ、乾燥して硬い大動脈を介して心臓を固定します。
- 心臓サンプルの中心をその長手方向軸に沿って、0°および90°の回転角度でイメージング視野の中心に細心の注意を払って位置合わせします。すべての向きでこれを達成するために、サンプル支持体に固定された大動脈クランプを介して心臓を空気中に懸濁させる。
- ソフトウェアを開き、X線マイクロCTシステムを起動した後、X線フィルタアルミニウム、1mm、X線源電圧を60kV、電流を120μAに印加し、画像寸法を2016 x 1344ピクセル、ピクセルサイズを20μmに設定します。
- サンプルホルダーを視野から引き込み、平坦な視野補正を得ることによって背景画像とX線露光時間を較正する。平均バックグラウンドX線透過率が80%を超えていることを確認してください。
- 支持体の長さに沿ってX線透過画像をスカウトし、心臓の縦軸における全体的な画像化野を決定する。スキャンには、0.18°の回転ステップ、5のフレーム平均、および180°のサンプル回転を使用します。オフセットスキャンモードを選択して、サンプルサポートの全幅を画像化します。
注:このセクションに示されている取得パラメータは、アンサンブル心臓組成物の画質を最適化するために選択されています。 - スキャン後、等方性3次元画像ボリュームの断層再構成にソフトウェアを使用します。NReconソフトウェアの適用には、10%のビーム硬化効果と8のリングアーチファクト低減を含む、集録関連のアーチファクト補正を使用します。
- データストレージの制限を最適化するには、心臓固有の画像ボクセルを含む最小の長方形の関心領域を適用します。イメージを 8 ビット ビットマップ形式でイメージ スタックとしてエクスポートします。
- DataViewer ソフトウェアを使用して再構築されたデータ スタックを視覚化します。サンプルを画像境界内でデジタルで方向付けて、サンプルの長軸と短軸を画像ボリュームの 3 つの主軸に再配置します。
- 3 つの軸すべてでイメージボリュームをトリミングして、イメージの外側の背景レイヤーを削除し、イメージの合計サイズを最大限小さくします。
結果
脱水および風乾法を用いた大型哺乳類の心臓の調製は、試料からすべての含水量を除去する。エタノールによる不十分な水置換の証拠は、HMDSロード中に観察することができる(プロトコル、ステップ4.4を参照)。HMDSの下に水が存在すると、組織から泡が立ち上がります。過剰な水位の場合、浸漬流体の温度の上昇が起こり得る。最初のHMDS負荷中に浸漬チャンバを氷で囲んだままにしておくと、組織加熱の悪影響を減らすことができます。造影剤の非存在下で心臓を空気乾燥させた後、サンプルは白色に見える(プロトコル、ステップ4.6を参照)。外表面はしばしば乾燥し、壁内層の前に構造的に安定であった。造影剤装填前にエタノール中ですすぎ、白色沈着物を除去した(プロトコル、ステップ4.7参照)。鋭い刃を用いて組織をスライスすると、巨視的に個々の筋線維が明瞭に分離して明らかになる。心臓サンプルを造影剤培地に浸漬することによるコントラスト負荷は、サンプルの厚くかつ高度に筋肉領域における拡散限界アーチファクトに苦しんだ。真空下での拡散コントラストローディングは、筋肉においてより均質な着色をもたらした(心臓サンプル#1、造影剤ローディング時間については 表1 を参照のこと)。巨視的には、表面造影剤分布は、心筋と、主に細胞外成分、特に脂肪および結合組織からなる領域との間の均質な染色を示した。空気乾燥組織サンプルは、造影剤装填の前または後のいずれかで、安定した構造的完全性を維持した。
上記の走査パラメータを用いてマイクロCT下で試料の全幅を20μmの分解能で走査するのに必要な時間及び1700msの露光時間は、6時間34分であった。スキャナーのガントリ軸におけるサンプルのサイズに応じて、この持続時間にサンプルの全長をキャプチャするために必要な位置の数を掛けました。この研究におけるブタおよびヒツジの心臓について、3〜4個の位置が使用された。NReconソフトウェアは、マルチポジションスキャンとオフセットスキャンをタイリングして、X線源と検出器の回転ステップごとに単一のX線投影画像を形成しました。合計で、1000 個の投影が 16 ビット イメージとして格納され、30 ~ 40 GB のデータが生成されます。再構成された体積画像は52〜70GBであった。
心室腔、中隔、および心室の自由壁を含む主要な解剖学的ランドマークは、拡散負荷によって造影剤で染色された空気乾燥ブタ心臓のX線透過画像から容易に同定できた(図1A)。さらに、心筋線維配向などの微細構造組織を示す高度にテクスチャー化された領域も、敏感なX線減衰/透過のために観察された(図1B)。3次元画像ボリュームの断層撮影再構成は、心外膜境界と内皮境界の両方で組織と背景の間に明確な分離を示した(図1D)。壁内、低コントラストおよびボクセル強度拡散勾配が、組織の厚い経壁領域全体にわたって観察された。それにもかかわらず、切断面によって分離された血管系および心筋線維は依然として容易に同定可能であった。対照の2番目のより高い強度帯域幅が、心外膜最層および点状亜心内膜領域で観察された。コントラスト増強は、細胞外成分が蓄積された部位、特に心外膜結合組織、心外膜脂肪およびプルキンエ線維ネットワークの結合組織鞘において最も大きかった。ボクセル信号強度分布は、ゼロ強度バックグラウンド(空気)および低および高コントラスト組織の2つの優勢集団からの高い分離を示した(図1D)。
マイクロCT画像再構成のコントラスト増強および心臓サンプルのコラーゲン性区画に対する選択性を検証するために、組織学、明視野顕微鏡、および蛍光顕微鏡が採用された(図2)。事前の造影剤装填なしの空気乾燥心臓からの心室組織の経壁ブロックを、パラフィン包埋および切片化のために調製した。顕微鏡スライドに取り付けられた隣接する組織スライスは、マッソンのトリクローム染色、無処理、または48時間のPMAのいずれかによって処理された(1%)。スライド装着組織切片の浸漬は、心臓サンプル全体で観察された染色プロセスの拡散勾配効果を排除した。メイソンのトリクローム染色は、上皮層および内皮層、心外膜下組織の血管周囲、および左心室腔に突出した自由走行プルキンエ線維を囲む結合組織鞘におけるコラーゲン陽性染色を示した(図2A)。明視野照明は、PMA染色後のコラーゲン構造においてより暗い着色を示し、PMAの優先的蓄積を支持した(図2B、C)。また、PMA処理は、コラーゲン高分子複合体31の自家蛍光を消光することが以前に示されている。心室組織切片の蛍光画像は、コラーゲンの部位においてPMA誘発性の蛍光損失を有していた(図2D対2E、図2D'対2E'および図2D'対2E'')。 明視野および蛍光イメージングの両方において、細胞区画はPMA処理によって変化せず、コラーゲンはPMA染色の選択的蓄積および自己蛍光の消光を有した。
心臓サンプル#2は、風乾前に灌流を介して造影剤で染色した。画像再構成は、心筋区画内の非常に斑状の染色を明らかにした(図3A)。コントラスト増強は、組織組成の非選択的に現れ、心外膜または心内膜下領域におけるシグナル強度のさらなる増強はなかった。また、低コントラスト組織は、バックグラウンド強度からの分離不良を示した(図3B)。
心室線維症は、心筋梗塞および慢性虚血によって誘導された(心臓サンプル#3)。前頭頂瘢痕は、血管塞栓術部位の下流の組織における筋細胞を線維脂肪沈着物で置き換えることによって形成された。心臓サンプル#3を調製し、前左心室、中隔、および右心室自由壁を覆う解剖した心室くさびから画像化した。この心室楔構成の調製は、以前に32 に記載されており、心臓画像化のための楔の適用は、詳細に検討された33。瘢痕の形態は経壁的であったが、異質であった(図4)。中央の高密度線維性病変は、緩く不均一な境界ゾーンに囲まれていた(図4A)。心室製剤を、空気乾燥後および真空中での拡散・負荷によって染色した。 図4B−E は、組織境界および瘢痕領域における再構成されたマイクロCT画像体積の最大の信号強度を示す。造影剤は健康な心筋をほとんど染色せず、しかも微細構造コントラストは保持されなかった(図4C ́)。境界ゾーンでは、瘢痕組織に生存中の心筋が散在していた(図4D ́)。緻密な線維症は、テクスチャーを帯びながらも壁画的に現れ、組成の分散を示す(図4E ́)。風乾およびPMA染色組織調製物の経壁左心室領域の組織切片を用いて、Massonのトリクローム染色と比較することによって病理学的組織中のコラーゲンに対するPMA選択性を検証した(図4F)。PMA染色はコラーゲン(心外膜下および心内膜下)に対して選択的であり、生存している心筋の領域には存在しなかった(図4G)。
持続的な心房細動を誘導した心臓試料#4は、心房腔の天然形状を保存しながら風乾した。心房付属器虚脱は認められなかった。主要な解剖学的ランドマークは、再構成された画像(心房中隔、ペクチン酸筋、冠状動脈洞、肺静脈骨、大静脈およびクリステ終末)から形態学的に同定することができる。真空下での拡散染色は、大動脈根および房室弁および作業心筋の離散領域におけるコントラスト増強をもたらした。筋肉染色増強は、左右の心房付属器および後壁に拘束された(図5)。
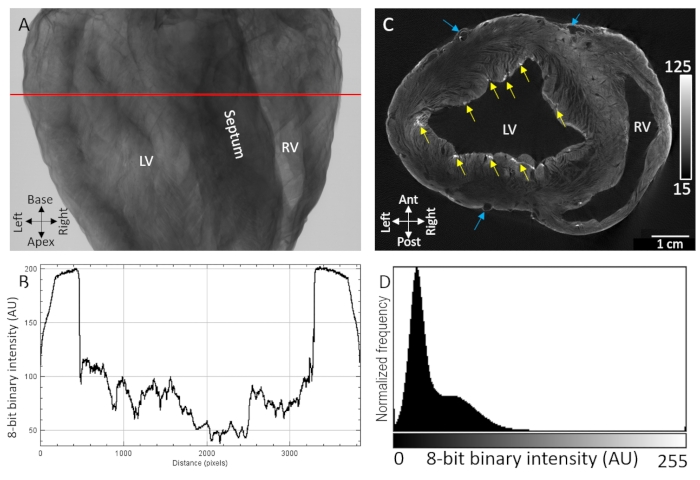
図1:PMA造影剤で処理した空気乾燥ブタ心臓のマイクロCT撮影を真空下で拡散させた。(B)A.(C)断層的に再構成された3次元体積からの心室の短軸スライスの赤い線から抽出された透過プロファイル。黄色の矢印は、心内膜下プルキンエ線維に起因するコントラストの点状領域を示す。青い矢印は血管系を示す。(d)再構成画像スライスの信号強度分布をCに示すLV:左心室およびRV:右心室。この図の拡大版を表示するには、ここをクリックしてください。
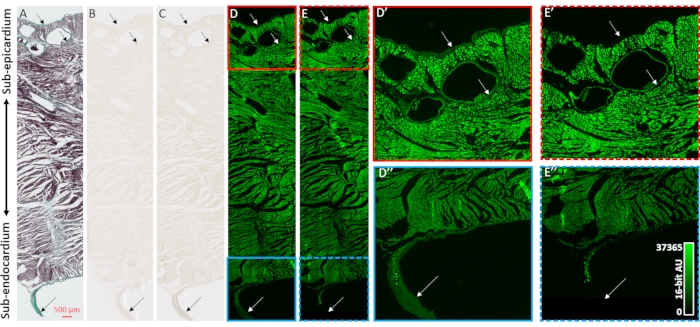
図2:コラーゲンに対するPMA選択性の検証 。(A)空気乾燥心臓の心室からの経壁組織切片のマッソンによるトリクローム染色。心筋は赤色に染色され、コラーゲンは緑色に着色して示される。隣接する組織切片を(B)染色の不在または(C)PMA(1%)で染色し、明視野照明で画像化し、着色の均一性を評価した。(D)PMAによる染色または(E)染色の存在しない組織切片を蛍光顕微鏡により画像化した。パネルD'(赤色 の 実線のボックス)および E' (破線の赤いボックス)は、染色されていない切片およびPMA染色された切片の心骨下部の拡大図である。パネル D ''(実線の青色のボックス)および E'' (破線の青色のボックス)は、対応する副心内膜および自由走行プルキンエ繊維の拡大図である。矢印はコラーゲン含有量の部位を示す。 この図の拡大版を表示するには、ここをクリックしてください。
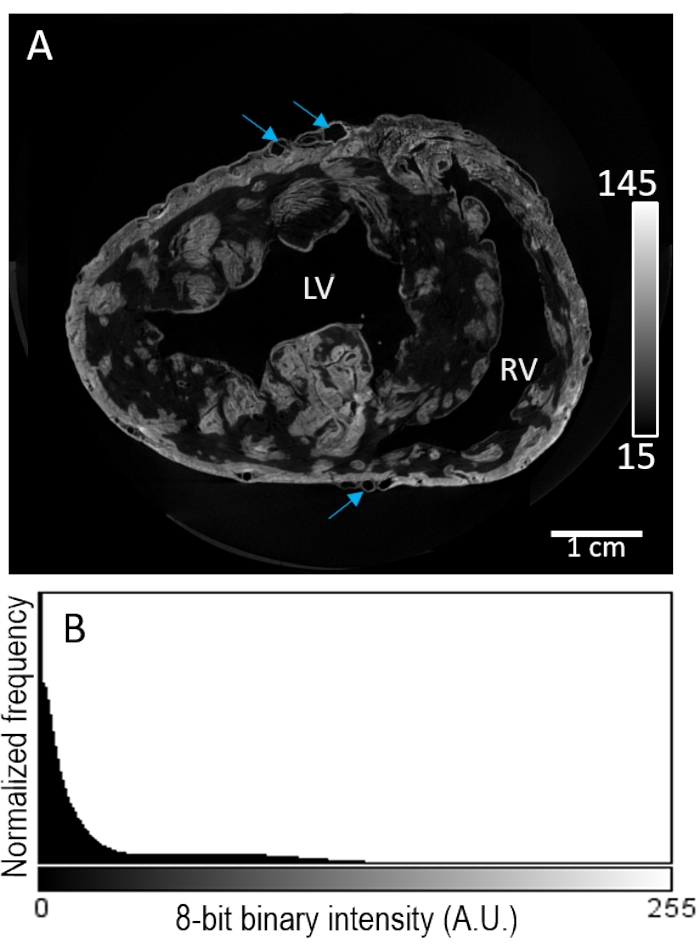
図3:空気乾燥およびMicroCTイメージング前のPMAの灌流負荷。 (A)ブタの心臓からの心室の再構成画像体積の短軸スライス。青い矢印は血管系を示す。(B)パネル Aからの画像スライスの信号強度分布。LV:左心室およびRV:右心室。 この図の拡大版を表示するには、ここをクリックしてください。
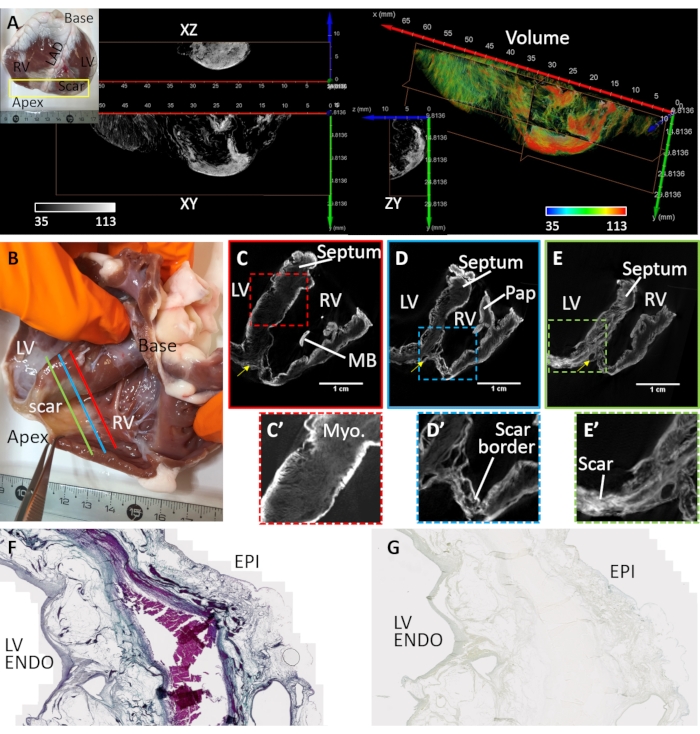
図4:慢性心筋梗塞に罹患しているヒツジの心臓のマイクロCT画像化(A)頂端領域に緻密な瘢痕が形成された(差し込み写真参照)。心内膜の観点から頂端領域の体積レンダリングを、画像強度に基づいて着色を割り当てた(赤色、緑色で瘢痕組織および心筋に対応する)。グレースケール強度の直交スライスは、緻密な瘢痕分布および隣接する生存心筋を示す。線維性組織と心筋との間の分離は、脂肪組織の領域に対応する。(b)心筋梗塞後の頂端瘢痕を有する羊からの風乾性心室くさび製剤の写真。再構成されたマイクロCT画像ボリュームの斜めスライスは、(C)血管閉塞の部位(パネルBにおけるC−赤色線)、(D)緻密な瘢痕と健康な心筋に接する梗塞周囲領域(パネルBにおけるD−青色線)および(E)高密度線維症の領域(E−パネルBにおける緑色線)の部位の基部と頂点との間の中間レベルで心室を横断する。(C')C の赤い破線のボックスで囲まれた中隔領域の拡大図。(D')右心室頂点における梗塞領域の拡大図(パネルDの青色破線ボックス)。(E')左心室頂部における梗塞領域の拡大図(パネルEの緑色の破線ボックス)。LV:左心室腔;RV:右心室腔;MB: モデレーターバンド;パップ:乳頭筋。黄色矢印は左前下行動脈を示す。(f)PMA染色された風乾性左心室から切り出した組織学的切片のマッソンのトリクローム染色。コラーゲンは青色に染色され、心筋はピンク/バイオレットに染色される。(g)PMA染色分布の対応する組織切片。この図の拡大版を表示するには、ここをクリックしてください。
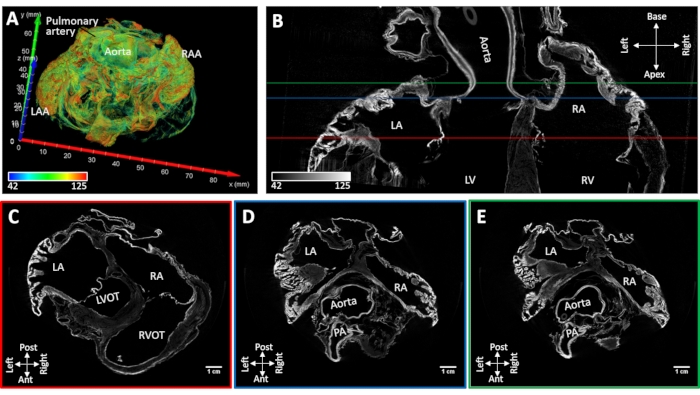
図5:慢性誘発性心房細動後の羊の心臓のMicroCT画像。 (A)図4Aのように着色が割り当てられた心房の体積レンダリング。(b)心臓の長軸にスライスした二房マイクロCT画像。短軸スライスを、(C)房室弁(パネルBのC−赤色線)、(D)大動脈根(パネルBのD−青色線)および(E)左心房屋根(パネルBのE−緑色線)のレベルで抽出した。LA:左心房;RA: 右心房;LAA:左心房付属器;RAA:右心房付属器;LV:左心室;RV:右心室;LVOT:左心室流出管;RVOT:右心室流出管およびPA:肺動脈。この図の拡大版を表示するには、ここをクリックしてください。
| 見本# | 1 | 2 | 3 | 4 |
| 種 | 豚 | 豚 | 羊 | 羊 |
| 体重(キログラム) | 32.4 | 31.2 | 47.2 | 53.4 |
| 心臓重量(g) | 191.2 | 186.2 | 202.4 | 207.6 |
| 病理学 | - | - | 慢性MI | 慢性AF |
| サンプル調製 | 心の底から | 心の底から | 前心臓のくさび | 心の底から |
| コントラストローディングのモード | 拡散 | 灌 流 | 拡散 | 拡散 |
| 造影剤曝露(h) | 48 | 24 | 48 | 48 |
表1:心臓サンプルおよび造影剤処理。
ディスカッション
大型組織調製のための詳細なプロトコールは、その後の高解像度構造イメージングのために大型哺乳類の心臓全体を使用して設定されています。空気乾燥アプローチは、バックグラウンドX線減衰の影響を除去し、組織を最大限に最適化する:バックグラウンドコントラスト29。このアプローチを使用して、直径7.2cmまでのサンプルにわたる体積イメージングのために20μmの範囲の等方性分解能が達成された。しかしながら軟部組織のMicroCTは、典型的には、microCTシステム34のX線吸収および感度を改善するために非特異的造影剤の使用に依存する。X線造影剤は全体的なX線減衰および軟部組織イメージングの増強を改善するが、生化学的組成に基づく組織構成成分の分離は依然として困難である。しかし、実験室の設定で一般的なX線造影剤と組み合わせて空気乾燥心臓を使用して、PMAは、細胞外成分を選択的に染色することが観察された。慢性疾患における健康な心筋および病理学的構造リモデリングに関連する結合組織が増強された。
生物学的組織を風乾するプロセスには、サンプルの変形に抵抗するための介入が必要です。電子顕微鏡用のサンプル調製にも同様の要件があります。典型的には、臨界点乾燥法が採用され、これは、組織浸漬媒体、温度、および圧力のバランスを使用して、蒸発時に分子レベルでの変形を引き起こす組織の液体含有量の表面張力を排除する35。このアプローチでは、サンプルの含水量を液体二酸化炭素で均一に置換する必要があり、小型で拡散しやすいサンプルでより信頼性が高くなります。あるいは、組織の構造的完全性を改善し、風乾することができ、すなわち、蒸発相をより長い期間にわたって適用して、全体的な変形を低減することができる。分子HMDSはシリル化を受けてシリコーンベースの足場を形成し、組織試料36の分子組織を補強および安定化する。蒸発は、環境からの循環気流を制限することによってさらに延長され、また、特に試料表面と壁内層との間の不均一な蒸発を回避する。
多数の造影剤が、軟部組織のマイクロCT画像化のために以前に使用されてきた。最も一般的なのはヨウ素、リンタングステン酸(PTA)およびPMAである。ヨウ素は特に、より高い拡散速度34、37、38のために採用されている。それにもかかわらず、ヨウ素はHMDS試薬36のシリル化のための触媒として作用する。触媒反応は攻撃的で発熱性であり、試料の破壊のリスクが高く、試料の不完全な乾燥のために残留HMDSが残存する場合、安全性のリスクが高い。エタノールに溶解したPTAとPMAの両方をHMDSと組み合わせて安全に使用することができます。PTAおよびPMAは、ヨウ素染色と比較して、非石灰化椎間板における微細構造のより大きな分解能を提供することが示されている38。哺乳動物試料のマイクロCT画像化において、PTAおよびPMAは、マウス胚39、マウス心血管系37、ウサギの筋肉および脳40、およびブタ静脈41の染色に用いられてきた。PTAはPMAよりも溶液中の分子量および密度が高い。これは、PTAの主要な減衰元素であるタングステン(原子番号は74g / mol)の原子質量が高いことが一因です。対照的に、PMAの中で最も重い元素であるモリブデンは、42g / molの原子番号を有する。原子質量および試料密度の両方が、試料厚さ42に加えて、X線減衰の根底にある。サンプルサイズを大きくしてX線パス長を長くすると、X線減衰はサンプル密度の増加に対してより敏感になります。したがって、低密度PMA造影剤は、過減衰のリスクを低減し、ヒトのようなスケールの心臓の画像コントラストのダイナミックレンジを最適化するために選択された。さらなる証拠は、PMAの拡散負荷が心臓組織におけるより大きな分子PTAに対するよりも均質な染色を与えることを示している43。
造影剤送達の方法は、心臓組織における造影剤分布の均一性に影響を及ぼす(図3)。エタノール脱水心臓における造影剤の灌流は、可変血管抵抗に起因するPMAの斑状バックグラウンド染色レベルを示した。風乾性心臓では、試料乾燥プロセスによって筋層状構造が強調され、筋層間分離が増加する。これは最終的に、拡散ベースの造影剤装填のための組織の全体的な透過性を改善した。その結果、空気乾燥が容易な組織:層流レベルおよび層内レベルでの空気コントラスト(図4)。さらに、拡散負荷は、真空下での適用によってさらに促進することができる。さらに、非乾燥サンプルの組織収縮が造影剤濃度40に依存することが示されている。しかしながら、風乾による標本の事前形態安定化は、組織収縮を抑制する効果29である。
臓器全体の高解像度マイクロCT画像は、本質的に大量のデータを生成します。断層イメージング技術の性質上、スライス単位での可視化と画像処理が可能となり、コンピュータ処理やメモリの負担が軽減されます。しかし、3次元画像スタックを視覚化する場合、例えば試料体積を3次元表現でレンダリングする場合、推奨される最小コンピュータ仕様は128 GB RAMと3GHzのプロセッサ速度です。ソリッドステートハードドライブはデータ転送も大幅に改善されました。
心臓分野におけるマイクロCTイメージングの出現は、トランスレーショナル研究および臨床検証に多くの利点をもたらします。その三次元およびマイクロメトリック画像化の利点は、ST上昇心筋虚血患者44、45の血栓性負担を決定する際の用途を既に示している。構造的心疾患患者における不整脈の潜在的な原因のマッピングは、線維性瘢痕組織の分布を決定し、生存している心筋の織り交ぜられた痕跡を局在化させることに大きく依存する。心室性不整脈の診断のための第2のアプローチは、磁気共鳴画像化46を利用する。これは、緻密な線維症を頑健に局在化することができるが、低分解能の形態学的特徴付けに限定され、線維性病変の微細構造リモデリングおよびびまん性分布に関する限られた洞察を提供する47。瘢痕分布と特性評価の高解像度検査は、心臓構造リモデリングと心不全発症リスクの理解を向上させる大きな可能性を秘めています。特に、基礎調査研究または死後調査は、心臓不整脈の電気的マッピングのための補強構造画像の恩恵を受けるであろう。
結論として、HMDS処理および空気乾燥で強化された心臓は、その後、細胞外成分のX線減衰を高めるためにX線造影剤で染色することができる。具体的には、健康な心筋において、PMA蓄積は、結合組織によって覆われた上皮、弁組織、および心室伝導系の区画で起こり、X線減衰の増強をもたらした。さらに、構造的に罹患した心筋において、増強されたコントラストは線維症に対してさらに選択的であった。
開示事項
何一つ
謝辞
本研究は、国立研究機関(ANR)、グラントリファレンスANR-10-IAHU-04、およびLeducq財団(RHYTHMネットワーク)が管理する「未来への投資」プログラムの一環として、フランス政府から資金援助を受け、グラントリファレンスANR-17-CE14-0029-01 [UNMASC]、欧州心血管疾患研究領域(ERA-CVD)、グラントリファレンスH2020-HCO-2015_680969 [MultiFib]およびフランス地域ヌーベルアキテーヌからの資金提供を受け、 助成金参照 2016 - 1R 30113 0000 7550/2016-1R 30113 0000 7553 および ANR-19-ECVD-0006-01.
資料
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Diapath | F0043 | |
| Calcium chloride solution | Honeywell | 21114 | |
| Canulation Tubing PTFE | VWR | DENE3400102 | |
| Constant Head 1L Reservoir | Harvard Apparatus | 50-0496 | |
| D-(+)-Glucose | Sigma | G5767 | |
| Ethanol absolute | VWR | 20821.330 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | 796881 | |
| Heparin sodium (5000 U/mL) | Panpharma | 3400891287301. | |
| Hexamethyldisilazane (HMDS) | Sigma | 440191-1L | |
| Hydrochloric acid, ACS reagent, 37% | Sigma | 258148 | |
| Magnesium chloride solution | Honeywell | 63020 | |
| Phosphate buffered saline (PBS) | Sigma | P5368 | |
| Phosphomolybdic acid hydrate | Fisher Scientific | 417895000 | |
| Potassium Chloride | Sigma | P5405 | |
| Pump Tubing, 3-Stop | Ismatec | FV-96328-48 | |
| SkyScan, 1276 | Bruker | micro CT | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium Chloride | Sigma | S3014 | |
| Sodium hydroxide solution 50% in H2O | Sigma | 415413 | |
| Tube Connector Kits | Harvard Apparatus | 72-1407 | |
| Tubing pump | Ismatec | ISM 1089 | |
| Tubing Tygon R-3603 1.6 mm 3.2 mm 0.8 mm | VWR | 228-1279 | |
| Tubing Tygon R-3603 3.2 mm 4.8 mm 0.8 mm | VWR | 228-1283 | |
| Two-part single-use syringes 50 mL | Norm-Ject | 4850001000 | Pyrogen-free, PVC-free |
参考文献
- Srinivasan, N. T., Schilling, R. J. Sudden cardiac death and arrhythmias. Arrhythmia & Electrophysiology Review. 7 (2), 111-117 (2018).
- Szumowski, L., et al. Mapping and ablation of polymorphic ventricular tachycardia after myocardial infarction. Journal of the American College of Cardiology. 44 (8), 1700-1706 (2004).
- Bode, K., et al. Ablation of polymorphic ventricular tachycardias in patients with structural heart disease. PACE - Pacing and Clinical Electrophysiology. 31 (12), 1585-1591 (2008).
- Enjoji, Y., et al. Catheter ablation of fatal ventricular tachyarrhythmias storm in acute coronary syndrome-role of Purkinje fiber network. Journal of Interventional Cardiac Electrophysiology. 26 (3), 207-215 (2009).
- Sinha, A. M., et al. Role of left ventricular scar and purkinje-like potentials during mapping and ablation of ventricular fibrillation in dilated cardiomyopathy. PACE - Pacing and Clinical Electrophysiology. 32 (3), 286-290 (2009).
- Peichl, P., Čihák, R., Koželuhová, M., Wichterle, D., Vančura, V., Kautzner, J. Catheter ablation of arrhythmic storm triggered by monomorphic ectopic beats in patients with coronary artery disease. Journal of Interventional Cardiac Electrophysiology. 27 (1), 51-59 (2010).
- Marrouche, N. F., et al. Mode of initiation and ablation of ventricular fibrillation storms in patients with ischemic cardiomyopathy. Journal of the American College of Cardiology. 43 (9), 1715-1720 (2004).
- Bänsch, D., et al. Successful catheter ablation of electrical storm after myocardial infarction. Circulation. 108 (24), 3011-3016 (2003).
- Yokoshiki, H., Mitsuyama, H., Watanabe, M., Mizukami, K., Tsutsui, H. Suppression of ventricular fibrillation by electrical modification of the Purkinje system in hypertrophic cardiomyopathy. Heart and Vessels. 29 (5), 709-717 (2014).
- Agress, C. M., Rosenberg, M. J., Jacobs, H. I., Binder, M. J., Schneiderman, A., Clark, W. G. Protracted shock in the closed-chest dog following coronary embolization with graded microspheres. The American journal of physiology. 170 (3), 536-549 (1952).
- Bolukoglu, H., Liedtke, A. J., Nellis, S. H., Eggleston, A. M., Subramanian, R., Renstrom, B. An animal model of chronic coronary stenosis resulting in hibernating myocardium. American Journal of Physiology - Heart and Circulatory Physiology. 263, 20-29 (1992).
- Capone, R. J., Most, A. S., Sydlik, P. A. Precordial ST segment mapping. A sensitive technique for the evaluation of myocardial injury. CHEST. 67 (5), 577-582 (1975).
- Dib, N., Diethrich, E. B., Campbell, A., Gahremanpour, A., McGarry, M., Opie, S. R. A percutaneous swine model of myocardial infarction. Journal of Pharmacological and Toxicological Methods. 53 (3), 256-263 (2006).
- Dogné, J. M., et al. Characterization of an original model of myocardial infarction provoked by coronary artery thrombosis induced by ferric chloride in pig. Thrombosis Research. 116 (5), 431-442 (2005).
- Eldar, M., Ohad, D., Bor, A., Varda-Bloom, N., Swanson, D. K., Battler, A. A closed-chest pig model of sustained ventricular tachycardia. Pacing and Clinical Electrophysiology. 17 (10), 1603-1609 (1994).
- Elzinga, W. E. Ameroid constrictor: uniform closure rates and a calibration procedure. Journal of applied physiology. 27 (3), 419-421 (1969).
- Hughes, G. C., Post, M. J., Simons, M., Annex, B. H. Translational physiology: Porcine models of human coronary artery disease: Implications for preclinical trials of therapeutic angiogenesis. Journal of Applied Physiology. 94 (5), 1689-1701 (2003).
- Lichtig, C., Brooks, H., Chassagne, G., Glagov, S., Wissler, R. W. Basic fuchsin picric acid method to detect acute myocardial ischemia. An experimental study in swine. Archives of Pathology and Laboratory Medicine. 99 (3), 158-161 (1975).
- Näslund, U., Häggmark, S., Johansson, G., Pennert, K., Reiz, S., Marklund, S. L. Effects of reperfusion and superoxide dismutase on myocardial infarct size in a closed chest pig model. Cardiovascular Research. 26 (2), 170-178 (1992).
- Reffelmann, T., et al. A novel minimal-invasive model of chronic myocardial infarction in swine. Coronary Artery Disease. 15 (1), 7-12 (2004).
- Reimer, K. A., Lowe, J. E., Rasmussen, M. M., Jennings, R. B. The wavefront phenomenon of ischemic cell death. 1. Myocardial infarct size vs duration of coronary occlusion in dogs. Circulation. 56 (5), 786-794 (1977).
- Salazar, A. E. Experimental myocardial infarction. Induction of coronary thrombosis in the intact closed-chest dog. Circulation research. 9, 1351-1356 (1961).
- Takahashi, M., et al. Effects of angiotensin I-converting enzyme inhibitor and angiotensin II type 1 receptor blocker on the right ventricular sarcoglycans and dystrophin after left coronary artery ligation. European Journal of Pharmacology. 522 (1-3), 84-93 (2005).
- Gonzalez-Tendero, A., et al. Whole heart detailed and quantitative anatomy,myofibre structure and vasculature from X-ray phase-contrast synchrotron radiation-basedmicro computed tomography. European Heart Journal Cardiovascular Imaging. 18 (7), 732-741 (2017).
- Teh, I., et al. Resolving fine cardiac structures in rats with high-resolution diffusion tensor imaging. Scientific Reports. 6, 30573 (2016).
- Teh, I., et al. Validation of diffusion tensor MRI measurements of cardiac microstructure with structure tensor synchrotron radiation imaging. Journal of Cardiovascular Magnetic Resonance. 19 (1), 31 (2017).
- Abouezzeddine, O., et al. Relevance of endocavitary structures in ablation procedures for ventricular tachycardia. Journal of Cardiovascular Electrophysiology. 21 (3), 245-254 (2010).
- Pambrun, T., et al. Epicardial course of the septopulmonary bundle: Anatomical considerations and clinical implications for roof line completion. Heart Rhythm. 18 (3), 349-357 (2021).
- Pallares-Lupon, N., et al. Optimizing large organ scale micro computed tomography imaging in pig and human hearts using a novel air-drying technique. bioRxiv. , (2021).
- Martins, R. P., et al. Dominant frequency increase rate predicts transition from paroxysmal to long-term persistent atrial fibrillation. Circulation. 129 (14), 1472-1482 (2014).
- Puchtler, H., Waldrop, F. S., Valentine, L. S. Fluorescence microscopic distinction between elastin and collagen. Histochemie. 35 (1), 17-30 (1973).
- Walton, R. D., et al. Compartmentalized Structure of the Moderator Band Provides a Unique Substrate for Macroreentrant Ventricular Tachycardia. Circulation: Arrhythmia and Electrophysiology. 11 (8), 005913 (2018).
- Di Diego, J. M., Sicouri, S., Myles, R. C., Burton, F. L., Smith, G. L., Antzelevitch, C. Optical and electrical recordings from isolated coronary-perfused ventricular wedge preparations. Journal of Molecular and Cellular Cardiology. 54, 53-64 (2013).
- Pauwels, E., Van Loo, D., Cornillie, P., Brabant, L., Van Hoorebeke, L. An exploratory study of contrast agents for soft tissue visualization by means of high resolution X-ray computed tomography imaging. Journal of Microscopy. 250 (1), 21-31 (2013).
- Mulet, A. Book Review: Modern Drying Technology, Volume 3: Product Quality and Formulation , edited by E. Tsotsas and A. S. Mujumdar. Drying Technology. 32 (2), 244-245 (2014).
- Karimi, B., Golshani, B. Mild and highly efficient method for the silylation of alcohols using hexamethyldisilazane catalyzed by iodine under nearly neutral reaction conditions. Journal of Organic Chemistry. 65 (21), 7228-7230 (2000).
- Dunmore-Buyze, P. J., et al. Three-dimensional imaging of the mouse heart and vasculature using micro-CT and whole-body perfusion of iodine or phosphotungstic acid. Contrast Media and Molecular Imaging. 9 (5), 383-390 (2014).
- Disney, C. M., Madi, K., Bodey, A. J., Lee, P. D., Hoyland, J. A., Sherratt, M. J. Visualising the 3D microstructure of stained and native intervertebral discs using X-ray microtomography. Scientific Reports. 7 (1), 16279 (2017).
- Descamps, E., Sochacka, A., de Kegel, B., Van Loo, D., Hoorebeke, L., Adriaens, D. Soft tissue discrimination with contrast agents using micro-ct scanning. Belgian Journal of Zoology. 144 (1), (2014).
- Buytaert, J., Goyens, J., De Greef, D., Aerts, P., Dirckx, J. Volume shrinkage of bone, brain and muscle tissue in sample preparation for micro-CT and light sheet fluorescence microscopy (LSFM). Microscopy and Microanalysis. 20 (4), 1208-1217 (2014).
- Nierenberger, M., Rémond, Y., Ahzi, S., Choquet, P. Assessing the three-dimensional collagen network in soft tissues using contrast agents and high resolution micro-CT: Application to porcine iliac veins. Comptes Rendus - Biologies. 338 (7), 425-433 (2015).
- Speck, U. . General principles of x-ray contrast media. X-Ray Contrast Media. , (2018).
- Rajasekar, A., Trew, M. L., Sands, G. B. . Understanding and enhancing the use of micro-computed tomography in soft tissue. , (2015).
- Karagiannidis, E., et al. Micro-CT-based quantification of extracted thrombus burden characteristics and association with angiographic outcomes in patients with ST-elevation myocardial infarction: The QUEST-STEMI Study. Frontiers in Cardiovascular Medicine. 8, 646064 (2021).
- Karagiannidis, E., et al. Serum ceramides as prognostic biomarkers of large thrombus burden in patients with stemi: A micro-computed tomography study. Journal of Personalized Medicine. 11 (2), 89 (2021).
- Hennig, A., et al. High-resolution three-dimensional late gadolinium-enhanced cardiac magnetic resonance imaging to identify the underlying substrate of ventricular arrhythmia. Europace : European Pacing, Arrhythmias, and Cardiac Electrophysiology: Journal of the Working Groups on Cardiac Pacing, Arrhythmias, and Cardiac Cellular Electrophysiology of the European Society of Cardiology. 20, 179-191 (2018).
- Lorgis, L., et al. Relationship between fragmented QRS and no-reflow, infarct size, and peri-infarct zone assessed using cardiac magnetic resonance in patients with myocardial infarction. Canadian Journal of Cardiology. 30 (2), 204-210 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved