Method Article
Методы подготовки тканей для контрастно-усиленной микрокомпьютерной томографии моделей сердца крупных млекопитающих с хроническими заболеваниями
В этой статье
Резюме
Здесь мы представляем протокол получения микрокомпьютерных томографических изображений высокого разрешения здоровых и патологических целых сердец крупных млекопитающих с коллаген-селективным контрастным усилением.
Аннотация
Структурное ремоделирование является распространенным следствием хронических патологических нагрузок, налагаемых на сердце. Понимание архитектурных и композиционных свойств пораженных тканей имеет решающее значение для определения их взаимодействия с аритмическим поведением. Микромасштабное ремоделирование тканей, ниже клинического разрешения, становится важным источником летальной аритмии с высокой распространенностью у молодых людей. Сохраняются проблемы с получением высокой контрастности изображения при достаточном микромасштабном разрешении для доклинических моделей, таких как целые сердца крупных млекопитающих. Кроме того, селективное контрастное усиление состава тканей для трехмерной визуализации с высоким разрешением по-прежнему отсутствует. Неразрушающая визуализация с использованием микрокомпьютерной томографии показывает перспективность для визуализации с высоким разрешением. Цель состояла в том, чтобы облегчить страдания от чрезмерного затухания рентгеновского излучения в больших биологических образцах. Сердца были извлечены из здоровых свиней (N = 2) и овец (N = 2) с либо индуцированным хроническим инфарктом миокарда и образованием фиброзных рубцов, либо с индуцированной хронической фибрилляцией предсердий. Иссеченные сердца перфузировали: солевым раствором, дополненным закалывающим агентом и ионами кальция и сосудорасширяющим средством, этанолом при серийном обезвоживании и гексаметилдисилизаном в вакууме. Последний укреплял структуру сердца во время воздушной сушки в течение 1 недели. Коллаген-доминантная ткань была избирательно связана рентгеновским контрастным агентом, фосфомолибдовой кислотой. Конформация тканей была стабильной в воздухе, что позволяло проводить длительные микрокомпьютерные томографии для получения изображений с высоким разрешением (изотропные 20,7 мкм). Оптимальная нагрузка контрастного вещества диффузией показала селективное контрастное усиление эпителиального слоя и субэндокардиальных волокон Пуркинье в здоровых желудочках свиней. Фибрилляция предсердий (ФП) сердца показала усиленное накопление контраста в задних стенках и придатках предсердий, что объясняется большим содержанием коллагена. Инфаркт миокарда сердца показал повышенный контраст избирательно в областях сердечного фиброза, что позволило идентифицировать переплетение выживших мышечных волокон миокарда. Контрастно-усиленные препараты для высушенных на воздухе тканей позволили получить микромасштабную визуализацию неповрежденного сердца крупного млекопитающего и селективное контрастное усиление основных компонентов заболевания.
Введение
Структурные заболевания сердца составляют большую часть смертности, связанной с сердцем, во всем мире1. Ремоделирование структуры сердца влияет на среду миокарда и интерстициальное пространство. Поскольку как электрическая, так и механическая функция сердца зависит от организации миоцитов, нарушение может привести к невыносимой сердечной аритмии, нарушению перекачивания крови исердечной недостаточности 2,3,4,5,6,7,8,9. Развитие лечебной терапии структурных заболеваний сердца намного перевешивает распространенность заболевания 2,5. Таким образом, появляется все большее число доклинических моделей структурных сердечных заболеваний, чтобы лучше понять анатомо-морфологические профили и результирующий патогенез сердечных аритмий 10,11,12,13,14,15,16,17,18,19,20, 21,22,23. По всему спектру структурных заболеваний наблюдается повышение регуляции интерстициального фиброза и, чаще в случаях, связанных с ишемией, замещение миокарда фиброзом и жировойтканью 18. Морфологическое понимание патологических внеклеточных компонентов может позволить выявить потенциальные субстраты аритмии. Распространение и степень заболевания обеспечивают сильные показатели аритмогенного риска. Тем не менее, остаются проблемы для всестороннего изображения профилей заболеваний путем интеграции макро- и микромасштабов в интактном сердце.
Микрокомпьютерная томография (микроКТ), основанная на рентгеновских лучах, становится мощным инструментом для исследования микроструктуры мягких биологических тканей с использованием контрастных веществ. Получены высокодетализированные анатомические карты для сердец мелких грызунов 24,25,26 и небольших рассеченных образцов из сердец крупных млекопитающих 27,28. Тем не менее, визуализация на уровне всего органа крупных сердец млекопитающих представляет чрезмерную длину пути, по которой рентгеновские фотоны ослабляются с использованием обычных методов подготовки тканей. Это включает в себя контрастную загрузку ткани и погружение образца в растворитель контрастного вещества во время приобретения. Увеличение размера выборки и разрешения приводит к увеличению общего времени сбора. Поэтому стабильность тканей становится решающей для реконструкции полезного изображения, а это означает, что деформация ткани в результате высыхания должна быть предотвращена. Использование погружной жидкости, однако, имеет недостатки: (i) общая интенсивность фонового сигнала становится незначимой и (ii) способствует разбавлению связанных с тканью контрастных молекул. Оба эти фактора способствуют снижению контрастности изображения.
В этом исследовании подробно описывается новый конвейер обработки тканей для облегчения фонового ослабления фотонов и оптимизации динамического диапазона, обеспечиваемого контрастными агентами. Предлагается использовать подход воздушной сушки тканей с химическим подкреплением тканей для ограничения деформациитканей 29. Поэтому образцы тканей могут оставаться стабильными в воздухе для длительных приобретений и опускать фоновые вклады от погружных жидкостей. Этот методологический конвейер обеспечивает: i) комплексный протокол обработки и визуализации тканей, оптимизированный с использованием целых свиных сердец; (ii) оценка методов концентрации контраста и нагрузки и (iii) применение этого конвейера в двух различных моделях хронических заболеваний фибрилляции предсердий и инфаркта миокарда в сердцах овец. Разработка моделей хронических заболеваний была описана в другом месте для каждой модели хронического сердечного заболевания, инфаркта миокарда, индуцированного чрескожной эмболизацией коронарной артерии13 и самоподдерживающейся фибрилляции предсердий30.
протокол
Все эксперименты проводились в соответствии с руководящими принципами Директивы 2010/63/ЕС Европейского парламента о защите животных, используемых в научных целях. Протоколы для животных были одобрены местным этическим комитетом (CEEA50) в Университете Бордо. Сердца были получены из трех моделей крупных млекопитающих, включая (i) здоровых крупных белых свиней (N = 2, 2 месяца); (ii) Овцы (N = 1, 2 года) с индуцированным инфарктом миокарда13 и (iii) Овцы (N = 1, 7 лет) с индуцированной фибрилляцией предсердий30.
1. Приготовление раствора:
- Кардиоплегический раствор: Приготовить 3 л дистиллированной воды и добавить хлорид натрия (110 мМ), хлорид калия (16 мМ), бикарбонат натрия (10 мМ), D-(+)-глюкозу (9 мМ), раствор хлорида кальция (1,2 мМ) и раствор хлорида магния (16 мМ). В конце добавляют 500 мкл/л гепарина натрия. Сохраняют этот раствор при 4 °C.
- Фосфатно-буферный физиологический раствор - раствор ЭДТА (PBS-EDTA).
- Сначала добавляют этилендиаминтетрауксусную кислоту (ЭДТА) к 1 л дистиллированной воды для конечной концентрации 10 мМ. Увеличивают и поддерживают рН раствора 12 с помощью раствора гидроксида натрия (1 М) для растворения ЭДТА.
- Как только ЭДТА полностью растворится, понизьте рН до 7,4 с помощью соляной кислоты. Добавьте один фольгированный мешочек с фосфатно-буферным физиологическим раствором для получения раствора при 0,01 М (хлорид натрия, 0,138 М; калия хлорид, 0,0027 М) и рН 7,4. Сохраняют этот раствор при комнатной температуре (RT).
- Этанол - раствор контрастного вещества фосфомолибдовой кислоты (PMA): Готовят 1 л абсолютного этанола и добавляют PMA для получения раствора в 1% концентрации. Сохраните это решение в RT.
2. Источник ткани
- Усыплите животное и извлеките сердце в соответствии с местными этическими принципами. Быстро погружайте сердце в холодный кардиоплегический раствор и нежно массируйте желудочки для первоначального полоскания.
- Убедитесь, что аорта разрезается ниже дуги аорты и зажимается две стороны артериальной стенки с помощью держателей игл.
- Подвешивая сердце держателями игл, вставьте канюлю аорты в корень аорты, заботясь о том, чтобы не вступать в контакт или выступать через аортальные клапаны. Оберните швом 0 калибра вокруг дуги аорты на уровне канюли и прочно завяжите канюлю на месте.
- Используя шприцы 50 мл, вводят 200 мл холодного (4 °C) кардиоплегического раствора. Удалите избыток крови, скапливающейся в полостях, опрокинув сердце на заднюю сторону, чтобы слиться через легочные вены.
- Погрузить промытое сердце и держать в холодном кардиоплегическом растворе, хранящемся на льду до готовности к рассечению.
3. Тканевая подготовка:
- Приготовьте резервуар объемом 1 л, поддерживаемый на 80 см выше тарелки для рассечения. Соедините термопластичную трубку длиной 80 см и внутренним диаметром 3,2 мм и внешним диаметром 4,8 мм с дренажным отверстием резервуара.
- Прикрепите трехсторонний кран к дренажной трубке и соедините дополнительные термопластичные трубки (20 см, внутренний диаметр 1,6 мм и внешний диаметр 3,2 мм) с каждым свободным портом на трехстороннем кране. Закрепите двухходовые краны на платных концах трубки.
- Заполните резервуар кардиоплегическим раствором, дополненным гепарином (2500 ЕД). Откройте краны, чтобы позволить кардиоплегическому раствору стечь и удалить все пузырьки воздуха, затем закройте двухсторонние краны.
- Подготовьте канюли для левой и правой коронарной остии с использованием трубки из политетрафторэтилена (PTFE) (внутренний диаметр 1 мм и наружный диаметр 2 мм).
- Отрежьте 5 см трубки и нагрейте один конец, поместив наконечник рядом с голым пламенем. Как только 1 мм наконечника начнет плавиться и станет полупрозрачным, прижмите наконечник к твердой термостойкой поверхности, чтобы сформировать гребень на кончике канюли, чтобы предотвратить выскальзывание канюль из сосудов.
- Вставьте 1 см ненагретого конца каждой канюли в два конца дренажной трубки дренажного резервуара.
- Удалить канюлю аорты. Под холодным кардиоплегическим раствором локализуют левую и правую остии коронарных артерий.
- Используя заостренные ножницы, тщательно отделите корень аорты от окружающих тканей выше и ниже коронарной остии, чтобы обеспечить резьбу шелкового шва 0 г под коронарным сосудом.
- Откройте двухсторонние краны и вставьте кончики канюль в коронарную остию. Кончиками канюль, простирающимися на 1-2 см в остию и за пределы размещения шва, завяжите канюли.
- Промывайте сердце, нежно массируя желудочки в течение 15 минут, пока сердце не очистится от крови.
- После полоскания закройте двухсторонние краны и отсоедините их от трехстороннего крана. Переложите сердце в пластиковый химически стойкий контейнер объемом 1 л, содержащий 500 мл раствора PBS-EDTA.
- Рециркулируют раствор PBS-EDTA в термопластичной трубке под вытяжной вытяжкой с помощью перистальтического насоса с двумя каналами. Загрунтуйте насосную трубку до тех пор, пока в трубке не отсутствуют пузырьки воздуха, затем перфьюируйте каждую канюлю коронарной артерии путем рециркуляции при РТ в течение 2 ч при 80 мл/мин.
- Убедитесь, что вытяжной шкаф работоспособен. Остановите насос, слейте раствор из емкости и замените его формалином (10%) для фиксации на 1 ч при РТ при 80 мл/мин.
- Замените раствор формалина PBS, чтобы промыть фиксатор три раза в течение 15 мин каждый при 80 мл/мин.
4. Обезвоживание и сушка тканей:
ПРИМЕЧАНИЕ: Используйте ту же скорость перфузии (80 мл / мин) и дайте ткани оставаться на RT на протяжении всего времени.
- Заменить раствор PBS этанолом на 20%, разбавленным в сверхчистой воде, и перфузить в течение минимум 3 ч.
- Перфузируйте сердце, используя серию увеличивающихся концентраций этанола.
- Начинают с замены 20% раствора этанола на этанол, разбавленный до 30% и перфузируют в течение 2 ч.
- Повторите перфузию путем увеличения концентрации этанола на каждой итерации через 40%, 50%, 60%, 65%, 70%, 75%, 80%, 95%, 90%, 95%, 99% и 100% в течение минимальной продолжительности 1 ч на каждой стадии (концентрация).
ПРИМЕЧАНИЕ: Образцы сердца могут отдыхать без перфузионного потока в течение ночи при любом разбавлении этанола, если для этой концентрации произошла минимальная перфузия в течение 15 минут.
- НЕОБЯЗАТЕЛЬНО: При применении контрастных веществ посредством перфузии перфузии нанесите на сердце 100% этанол, дополненный контрастным веществом PMA, 1% в течение 48 ч. Промыть контрастное вещество перфузией 100% этанолом в течение 2 ч.
- Чтобы укрепить сердечную ткань перед высыханием на воздухе, рециркулируйте смесь этанола и гексаметилдисилазана (HMDS) 50:50 в течение 10 минут. Следуйте этому 100% HMDS в течение еще 2 ч.
ВНИМАНИЕ: HMDS является высокотоксичным и вредным веществом. Сильный запах аммиака выделяется при контакте с воздухом. Кроме того, жидкая форма HMDS является высоколетучей и катализируется йодсодержащими агентами. - Отсоедините канюли от трубки и подвешивайте сердце от аортального шва внутри вытяжного капюшона.
- Осторожно проведите пакетом-молнией над сердцем и закройте уплотнитель пакета поверх шва, чтобы уменьшить воздействие циркулирующего воздуха на сердце. Дайте сердцу высохнуть путем испарения в течение 1 недели.
- ДОПОЛНИТЕЛЬНО: Для диффузионно-нагружающих контрастных веществ промывайте сердце 100% этанолом в течение 15 минут во время перемешивания. Погрузите сердце в 100% этанол, дополненный ПМА, 1%, в течение 48 ч под вакуумом. Повторите шаг 4.6.
5. МикроКТ:
ПРИМЕЧАНИЕ: Настольная рентгеновская система микроКТ использовалась для визуализации сердец свиней.
- Установите высушенное на воздухе сердце на соответствующий держатель для образцов. Предотвратите любое движение во время рентгеновских измерений микроКТ с помощью зажима, закрепленного на держателе образца, и закрепите сердце через высушенную и жесткую аорту.
- Тщательно выровняйте центр образца сердца вдоль его продольной оси с центром поля зрения изображения для углов поворота 0° и 90°. Чтобы достичь этого во всех направлениях, подвешивайте сердце в воздухе с помощью аортального зажима, закрепленного на опоре образца.
- После открытия программного обеспечения и запуска системы X-ray microCT примените рентгеновский фильтр алюминий, 1 мм, напряжение источника рентгеновского излучения до 60 кВ и ток до 120 мкА. Установите размеры изображения на 2016 x 1344 пикселей и размер пикселя на 20 мкм.
- Вытащите держатель образца из поля зрения и откалибруйте фоновое изображение и время экспозиции рентгеновского излучения, получив коррекцию плоского поля. Убедитесь, что средняя фоновая рентгеновская передача превышает 80%.
- Разведчик рентгеновских снимков пропускания по длине опоры для определения общего поля визуализации в продольной оси сердца. Для сканирования используйте шаг поворота 0,18°, среднее значение кадра 5 и поворот образца на 180°. Выберите режим сканирования со смещением, чтобы получить изображение полной ширины поддержки образца.
ПРИМЕЧАНИЕ: Параметры получения, указанные в этом разделе, были выбраны для оптимизации качества изображения ансамблевой композиции сердца. - После сканирования используйте программное обеспечение для томографической реконструкции изотропного трехмерного объема изображения. Для применения программного обеспечения NRecon используйте коррекцию артефактов, связанную с приобретением, включая эффекты упрочнения луча на 10% и уменьшение кольцевых артефактов 8.
- Чтобы оптимизировать ограничения хранения данных, примените минимальную интересующую прямоугольную область, которая включает в себя вокселы изображений для конкретного сердца. Экспортируйте изображения в 8-битном растровом формате в виде стека изображений.
- Визуализируйте реконструированный стек данных с помощью программного обеспечения DataViewer. Цифровая ориентация образца в границах изображения, чтобы выровнять длинную и короткую оси образца с тремя основными осями объема изображения.
- Обрежьте объем изображения по всем трем осям, чтобы удалить внешние фоновые слои изображения, чтобы максимально уменьшить общий размер изображения.
Результаты
Приготовление сердец крупных млекопитающих методом обезвоживания и воздушной сушки удаляет все содержание воды из образца. Признаки недостаточного замещения воды этанолом могут наблюдаться во время загрузки HMDS (см. Протокол, этап 4.4). Наличие воды под HMDS создаст пузырьки, поднимающиеся из ткани. В случае чрезмерного уровня воды может произойти повышение температуры погружной жидкости. Сохранение погружной камеры в окружении льда во время первоначальной загрузки HMDS может уменьшить вредные последствия нагрева тканей. После воздушной сушки сердечек при отсутствии контрастных веществ образец будет выглядеть белого цвета (см. Протокол, шаг 4.6). Внешняя поверхность часто высушивалась и структурно стабилизировалась перед внутренними слоями. Промывка этанолом перед загрузкой контрастного вещества удаляет белый осадок (см. Протокол, этап 4.7). Разрезание ткани с помощью острого лезвия выявляет макроскопически отдельные мышечные волокна с четким разделением. Контрастная нагрузка путем погружения образцов сердца в контрастное вещество страдала от диффузионных предельных артефактов в толстых и сильно мускулистых областях образца. Диффузионная контрастная нагрузка в вакууме обеспечивала более однородную окраску в мышцах (образец сердца No1, см. Таблицу 1 о времени загрузки контрастных веществ). Макроскопически распределение поверхностного контрастного вещества показало однородное окрашивание между сердечной мышцей и областями, состоящими в основном из внеклеточных компонентов, особенно жира и соединительной ткани. Высушенные на воздухе образцы тканей, либо до, либо после загрузки контрастного вещества, сохраняли стабильную структурную целостность.
Время, необходимое для сканирования полной ширины образца с разрешением 20 мкм при микроКТ с использованием вышеуказанных параметров сканирования, и время экспозиции 1700 мс составило 6 ч 34 мин. В зависимости от размера образца в козловой оси сканера эта продолжительность умножалась на количество позиций, необходимых для захвата полной длины образца. Для свиных и овечьих сердец в этом исследовании использовались три-четыре положения. Программное обеспечение NRecon разбило многопозиционное и смещенное сканирование, чтобы сформировать одно рентгеновское проекционное изображение для каждого шага вращения источника рентгеновского излучения и детектора. Всего 1000 проекций хранятся в виде 16-битных изображений, генерирующих 30-40 ГБ данных. Реконструированные объемные изображения составили 52-70 ГБ.
Основные анатомические ориентиры, включая желудочковые полости, перегородку и свободные стенки желудочков, были легко идентифицированы с помощью рентгеновской визуализации высушенных на воздухе сердец свиней, окрашенных контрастным веществом диффузионной нагрузкой (рисунок 1A). Кроме того, высокотекстурированные области, указывающие на микроструктурную организацию, такие как ориентация волокон миокарда, также наблюдались из-за чувствительного затухания /передачи рентгеновского излучения (рисунок 1B). Томографические реконструкции объемов трехмерного изображения показали отчетливое разделение между тканью и фоном как на эпикардиальных, так и на эндотелиальных границах (рисунок 1D). Внутримурально, низкий контраст и градиент диффузии интенсивности воксела наблюдались во всех толстых трансмуральных областях ткани. Несмотря на это, сосудистые и миокардиальные волокна, разделенные плоскостями расщепления, все еще были легко идентифицируемы. Вторая полоса контраста более высокой интенсивности наблюдалась в самом эпикардиальном слое и в пунктатных субэндокардиальных областях. Контрастное усиление было наибольшим в местах, где накапливались внеклеточные компоненты, особенно эпикардиальная соединительная ткань, эпикардиальный жир и соединительнотканная оболочка волоконной сети Пуркинье. Распределение интенсивности сигнала вокселя показало высокое отделение от фона нулевой интенсивности (воздуха) и двух доминирующих популяций ткани с низкой и высокой контрастностью (рисунок 1D).
Для подтверждения контрастного усиления реконструкций микроКТ-изображений и селективности к коллагеновым компартментам образцов сердца использовались гистология, ярко-полевая микроскопия и флуоресцентная микроскопия (рисунок 2). Трансмуральный блок желудочковой ткани из высушенного воздухом сердца без предварительной загрузки контрастным веществом готовили для встраивания и разрезания парафина. Соседние срезы тканей, установленные на предметных стеклах микроскопа, обрабатывали либо трихромным окрашиванием Массона, без обработки, либо 48 ч PMA (1%). Погружение в скользящие участки тканей устранило диффузионные градиентные эффекты процесса окрашивания, которые наблюдались в образцах всего сердца. Трихромное окрашивание Мейсона показало коллаген-положительное окрашивание в эпителиальном и эндотелиальном слоях, периваскулярно в субэпикардиальной ткани, и соединительнотканную оболочку, окружающую свободно работающее волокно Пуркинье, выступающее в полость левого желудочка (рисунок 2A). Яркое полевое освещение показало более темную окраску в коллагеновых структурах после PMA-окрашивания, поддерживая преимущественное накопление PMA (рис. 2B, C). Кроме того, ранее было показано, что лечение ПМА гасит автофлуоресценцию макромолекулярных комплексовколлагена 31. Флуоресцентные изображения участков желудочковой ткани имели вызванную PMA потерю флуоресценции в местах коллагена (рисунок 2D против 2E, рисунок 2D' против 2E' и рисунок 2D'' против 2E''). Как в ярком поле, так и в флуоресцентной визуализации клеточные компартменты не были изменены обработкой PMA, а коллаген имел избирательное накопление окрашивания PMA и гашение автофлуоресценции.
Образец сердца No2 окрашивали контрастным веществом посредством перфузии перед сушкой на воздухе. Реконструкция изображения выявила сильно пятнистое окрашивание в отсеке миокарда (рисунок 3А). Контрастное усиление оказалось неселективным по составу тканей, без дальнейшего повышения интенсивности сигнала в эпикардиальной или субэндокардиальной областях. Кроме того, низкая контрастность тканей показала плохое отделение от интенсивности фона (рисунок 3B).
Желудочковый фиброз был вызван инфарктом миокарда и хронической ишемией (образец сердца No3). Переднеапикальный рубец образовался путем замены миоцитов фиброзно-жировыми отложениями в ткани вниз по течению к месту эмболизации сосудов. Образец сердца No 3 был подготовлен и сфотографирован из рассеченного желудочкового клина, покрывающего передний левый желудочек, перегородку и свободную стенку правого желудочка. Подготовка этой конфигурации желудочкового клина была описана ранее32 и применение клиньев для визуализации сердца было подробно рассмотрено33. Морфология рубцов была трансмуральной, но неоднородной (рисунок 4). Центральное плотное фиброзное поражение было окружено рыхлой и гетерогенной пограничной зоной (рисунок 4А). Желудочковый препарат окрашивали диффузионно-нагрузочным поствоздушной сушкой и в вакууме. На рисунке 4В-Е показана наибольшая интенсивность сигнала реконструированных объемов микроКТ-изображений на границах тканей и рубцовых областях. Контрастные вещества плохо окрашивали здоровый миокард, но микроструктурный контраст сохранялся (рисунок 4С'). В пограничной зоне рубцовая ткань перемежалась с уцелевшим миокардом (рисунок 4D'). Плотный фиброз оказался трансмуральным, но текстурированным, что указывает на дисперсии в составе (рисунок 4E'). Тканевые участки трансмуральной левой желудочковой области высушенного на воздухе и окрашенного PMA препарата ткани использовали для проверки селективности PMA для коллагена в патологической ткани путем сравнения с трихромным окрашиванием Массона (рисунок 4F). Окрашивание PMA было селективным для коллагена (субэпикард и субэндокард) и отсутствовало в областях выжившего миокарда (рисунок 4G).
Образец сердца No4 с индуцированной стойкой фибрилляцией предсердий сушили на воздухе, сохраняя при этом нативную форму полости предсердий. Коллапса придатков предсердий не наблюдалось. Основные анатомические ориентиры могут быть идентифицированы морфологически по реконструированным изображениям (межпредсердная перегородка, пектинные мышцы, коронарный синус, остия легочной вены, полая вена и cristae terminalis). Диффузионно-окрашивание под вакуумом приводило к усилению контраста в корене аорты и атриовентрикулярных клапанах и дискретных областях рабочего миокарда. Усиление окрашивания мышц было ограничено придатками предсердий и задними стенками как левого, так и правого предсердий (рисунок 5).
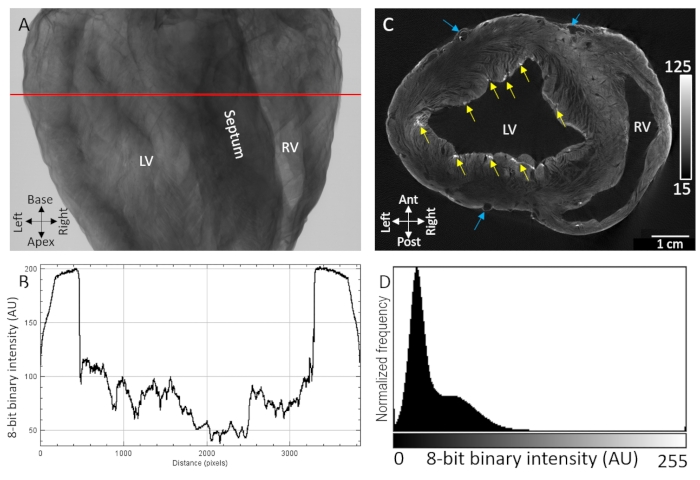
Рисунок 1: МикроКТ-визуализация высушенного на воздухе сердца свиньи, обработанного контрастным веществом PMA путем диффузии под вакуумом. (A) Рентгеновское проекционное изображение. (B) Профиль передачи, извлеченный из красной линии в A. (C) Короткоосевой срез желудочков из томографически реконструированного трехмерного объема. Желтыми стрелками обозначены пунктатные области контраста, приписываемые субэндокардиальным волокнам Пуркинье. Синие стрелки указывают на сосудистую систему. (D) Распределение интенсивности сигнала реконструированного среза изображения, показанного в C. LV: левый желудочек и RV: правый желудочек. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
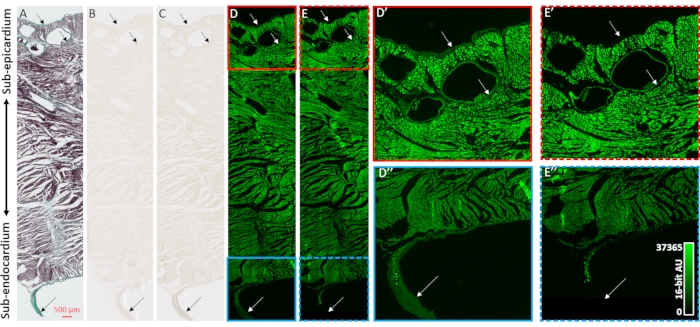
Рисунок 2: Валидация PMA-селективности для коллагена. (A) Трихромное окрашивание Массоном трансмурального участка ткани из желудочков высушенного на воздухе сердца. Миокард окрашен в красный цвет, а коллаген показан зеленой окраской. Соседние участки ткани (B), отсутствующие при окрашивании или (C), окрашенные PMA (1%), были сфотографированы ярким полевым освещением для оценки однородности окраски. (D) Участки тканей, отсутствующие в окрашивании или (E) окрашенные PMA, были визуализированы флуоресцентной микроскопией. Панели D' (сплошная красная коробка) и E' (пунктирная красная коробка) представляют собой увеличенные виды субэпикарда для неокрашенных и окрашенных PMA секций. Панели D'' (сплошная синяя рамка) и E'' (пунктирная синяя рамка) представляют собой соответствующие увеличенные виды субэндокарда и свободно работающего волокна Пуркинье. Стрелки обозначают участки содержания коллагена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
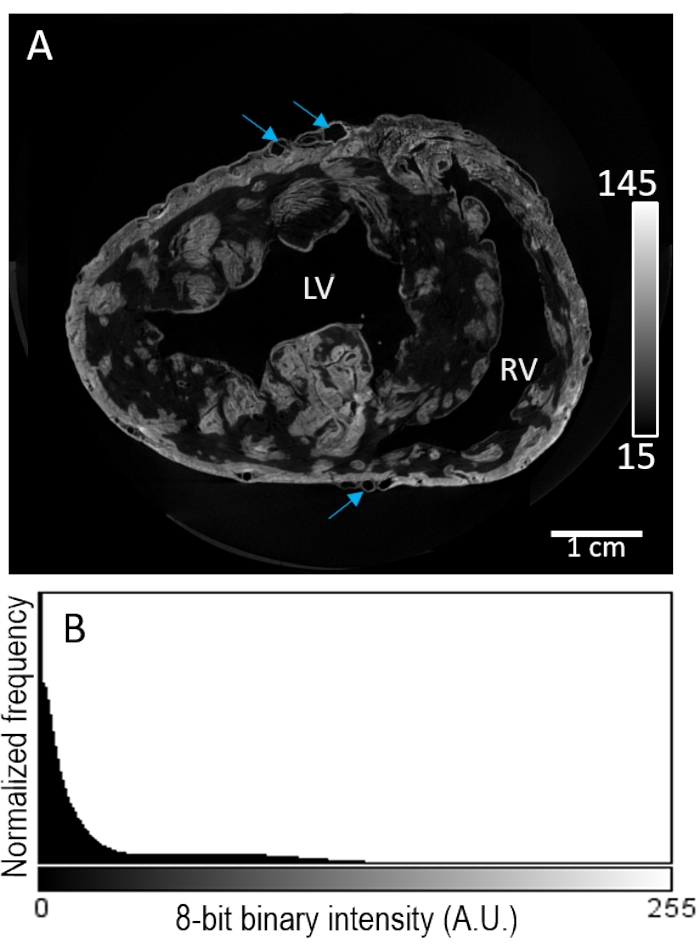
Рисунок 3: Перфузионная загрузка PMA перед воздушной сушкой и микроКТ-визуализацией. (A) Короткий срез реконструированного объема изображения желудочков из сердца свиньи. Синие стрелки указывают на сосудистую систему. (B) Распределение интенсивности сигнала фрагмента изображения с панели A. LV: левый желудочек и RV: правый желудочек. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
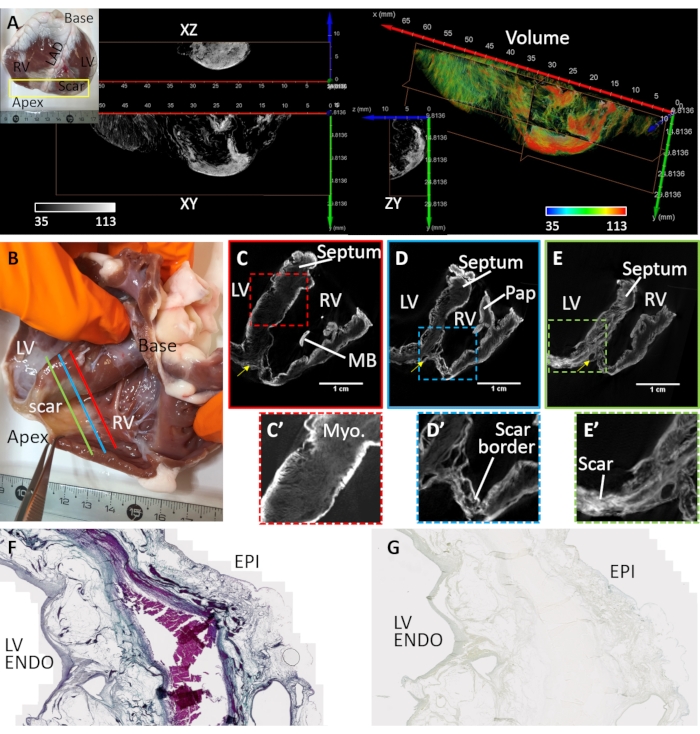
Рисунок 4: МикроКТ-визуализация сердца овцы, страдающей хроническим инфарктом миокарда. (А) В апикальной области образовался плотный рубец (см. фотографию вставки). Объемному рендерингу апикальной области с точки зрения эндокарда была присвоена окраска на основе интенсивности изображения (красный цвет соответствует рубцовой ткани и миокарду зеленым). Ортогональные срезы интенсивности оттенков серого показывают плотное распределение рубцов и окаймление уцелевшего миокарда. Разделение между фиброзной тканью и миокардом соответствует областям жировой ткани. (B) Фотография высушенного на воздухе препарата желудочкового клина от овцы с апикальным рубцеванием после инфаркта миокарда. Косые срезы реконструированного объема микроКТ-изображения пересекают желудочки на среднем уровне между основанием и вершиной и проксимально к месту (С) сосудистой окклюзии (С-красная линия на панели B), (D) периинфарктной области, граничащей с плотным рубцом и здоровым миокардом (D-синяя линия на панели B) и (E) областью плотного фиброза (E - зеленая линия на панели B). (С') Расширенный вид области перегородки, очерченный красным пунктирным прямоугольником в C. (Д') Расширенный вид области инфаркта в вершине правого желудочка (синяя пунктирная рамка на панели D). (Э') Расширенный вид области инфаркта в вершине левого желудочка (зеленая пунктирная рамка на панели E). LV: Полость левого желудочка; RV: полость правого желудочка; MB: группа модераторов; Пап: сосочковая мышца. Желтая стрелка указывает на левую переднюю нисходящую артерию. (F) Трихромовое окрашивание Массоном гистологического сечения, вырезанного из окрашенного PMA высушенного на воздухе левого желудочка. Коллаген окрашивается в синий цвет, а миокард окрашивается в розовый/фиолетовый цвет. (G) Соответствующий участок ткани распределения окрашивания PMA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
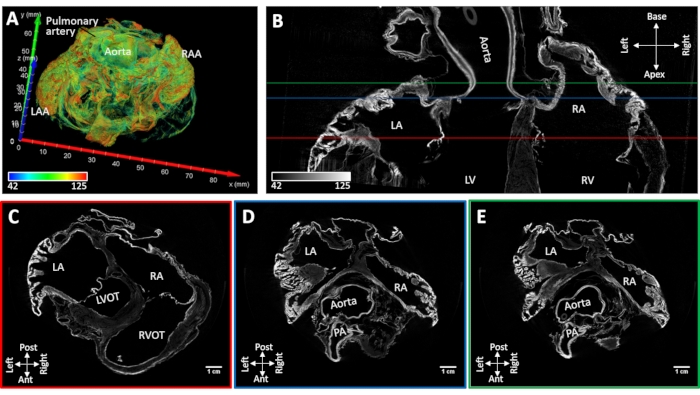
Рисунок 5: МикроКТ-изображение овечьего сердца после хронической индуцированной фибрилляции предсердий. (A) Объемный рендеринг предсердий с окраской, назначенной как на рисунке 4A. (B) Бипредсердное микроCT изображение среза в длинной оси сердца. Короткоосевые срезы извлекали на уровне (C) атриовентрикулярных клапанов (C-красная линия на панели B), (D) корня аорты (D-синяя линия на панели B) и (E) левой предсердной крыши (E-зеленая линия inpanel B). LA: левые предсердия; РА: правые предсердия; LAA: придаток левого предсердия; RAA: придаток правого предсердия; LV: левый желудочек; RV: правый желудочек; LVOT: отток левого желудочка; РВОТ: отток правого желудочка и ПА: легочная артерия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Образец # | 1 | 2 | 3 | 4 |
| Вид | Свинья | Свинья | Овца | Овца |
| Масса тела (кг) | 32.4 | 31.2 | 47.2 | 53.4 |
| Масса сердца (г) | 191.2 | 186.2 | 202.4 | 207.6 |
| Патология | - | - | Хронический ИМ | Хроническая ФП |
| Пробоподготовка | Всем сердцем | Всем сердцем | Клин переднего сердца | Всем сердцем |
| Режим контрастной нагрузки | Диффузия | Перфузия | Диффузия | Диффузия |
| Воздействие контрастных веществ (h) | 48 | 24 | 48 | 48 |
Таблица 1: Обработка образцами сердца и контрастными веществами.
Обсуждение
Подробный протокол для крупных тканевых препаратов изложен с использованием целых сердец крупных млекопитающих для последующей структурной визуализации с высоким разрешением. Подход воздушной сушки устранил влияние фонового затухания рентгеновского излучения и максимально оптимизировал ткани: фоновый контраст29. Используя этот подход, было достигнуто изотропное разрешение в диапазоне 20 мкм для объемной визуализации образцов диаметром до 7,2 см. МикроКТ мягких тканей, однако, обычно полагается на использование неспецифических контрастных веществ для улучшения поглощения рентгеновских лучей и чувствительности системмикроКТ 34. Хотя рентгеноконтрастные вещества улучшают общее ослабление рентгеновского излучения и улучшение визуализации мягких тканей, разделение компонентов тканей на основе биохимического состава остается сложной задачей. Однако было замечено, что при использовании высушенных на воздухе сердец в сочетании с обычным рентгеноконтрастным веществом в лабораторных условиях ПМА избирательно окрашивают внеклеточные компоненты. Соединительная ткань, связанная со здоровым миокардом и патологическим структурным ремоделированием при хронических заболеваниях, была усилена.
Процесс воздушной сушки биологической ткани требует вмешательства, чтобы противостоять деформации образца. Пробоподготовка для электронной микроскопии имеет аналогичные требования. Как правило, используется метод сушки с критической точкой, который использует баланс тканевой иммерсионной среды, температуры и давления для устранения поверхностного натяжения жидкого содержимого ткани, что вызывает деформацию на молекулярном уровне при испарении35. Такой подход требует равномерной замены содержания воды в образце жидким углекислым газом, который более надежен в небольших и легко диффузируемых образцах. Альтернативно, структурная целостность ткани может быть улучшена и воздушная сушка, т.е. фаза испарения может быть применена в течение более длительного периода для уменьшения общей деформации. Молекула HMDS подвергается силилированию с образованием каркаса на основе силикона для укрепления и стабилизации молекулярной организации образцаткани 36. Испарение дополнительно продлевается за счет ограничения циркулирующих воздушных потоков из окружающей среды, а также во избежание неоднородного испарения, особенно между поверхностью образца и внутренними слоями.
Многочисленные контрастные вещества ранее использовались для микроКТ-визуализации мягких тканей. Наиболее распространенными являются йод, фосфовольфрамовая кислота (PTA) и PMA. Йод, в частности, был использован из-за более высокой скорости диффузии 34,37,38. Тем не менее, йод действует как катализатор силилирования реагента HMDS36. Катализируемая реакция является агрессивной и экзотермической, с высоким риском разрушения образца и риском безопасности, если остаточная HMDS остается из-за неполного высыхания образца. Как PTA, так и PMA, растворенные в этаноле, можно безопасно использовать в сочетании с HMDS. Было показано, что PTA и PMA обеспечивают большую разрешающую способность тонких структур в неминерализованных межпозвоночных дисках по сравнению с окрашиванием йодом38. В микроКТ-визуализации образцов млекопитающих PTA и PMA использовались для окрашивания эмбрионов мыши39, сердечно-сосудистой системы мыши37, мышцы и мозга кролика40 и свиных вен41. PTA имеет более высокую молекулярную массу и плотность в растворе, чем PMA. Отчасти это связано с более высокой атомной массой вольфрама (атомный номер 74 г/моль), основного ослабляющего элемента в ПТА. Для сравнения, самый тяжелый элемент в PMA, молибден, имеет атомный номер 42 г/ моль. Как атомная масса, так и плотность образца лежат в основе затухания рентгеновского излучения, в дополнение к толщине образца42. Увеличивая длину рентгеновского пути за счет увеличения размеров выборки, затухание рентгеновского излучения становится более чувствительным к увеличению плотности образца. Поэтому контрастное вещество PMA более низкой плотности было выбрано для снижения риска чрезмерного затухания и оптимизации динамического диапазона контрастности изображения для сердец человеческого масштаба. Дополнительные данные показали, что диффузионная нагрузка PMA дает более однородное окрашивание, чем для более крупной молекулы PTA в сердечной ткани43.
Способ доставки контрастного вещества влияет на равномерность распределения контрастного вещества в сердечной ткани (рисунок 3). Перфузия контрастных веществ в обезвоженном этанолом сердце показала пятнистые фоновые уровни окрашивания PMA из-за переменного сосудистого сопротивления. В высушенном воздухом сердце мышечная ламинарная структура подчеркивается процессом высыхания образца, увеличивая ламинарное разделение мышц. Это в конечном итоге улучшило общую проницаемость ткани для диффузионной нагрузки контрастных веществ. Следовательно, воздушная сушка облегчает ткани: воздушный контраст на ламинарном и внутриламинарном уровнях (рисунок 4). Кроме того, диффузионное нагружение может быть дополнительно облегчено применением под вакуумом. Далее было показано, что усадка тканей невысушенных образцов зависит от концентрации контрастного вещества40. Однако предшествующая морфологическая стабилизация образца путем воздушной сушки ингибирует эффекты усадкитканей 29.
МикроКТ-изображения целых органов с высоким разрешением по своей сути создают большие объемы данных. Характер методов томографической визуализации позволяет визуализировать и обрабатывать изображения посрезов, что облегчает компьютерную обработку и нагрузку на память. Однако для визуализации стеков трехмерных изображений, например, для рендеринга томов образцов в трехмерных представлениях, рекомендуемыми минимальными характеристиками компьютера являются 128 ГБ ОЗУ и скорость процессора 3 ГГц. Твердотельные жесткие диски также значительно улучшили передачу данных.
Появление микроКТ-визуализации в сердечной области дает многочисленные преимущества для трансляционных исследований и клинической валидации. Преимущества его трехмерной и микрометрической визуализации уже показали применения при определении тромботической нагрузки на ST-повышение уровня ишемии миокардау больных 44,45. Картирование потенциальных источников аритмии у пациентов со структурными заболеваниями сердца во многом зависит от определения распределения фиброзной рубцовой ткани и локализации переплетения следов выжившего миокарда. Подходы второй линии для диагностики желудочковых аритмий используют магнитно-резонансную томографию46. Он может надежно локализовать плотный фиброз, но ограничен морфологической характеристикой низкого разрешения и дает ограниченное представление о микроструктурном ремоделировании и диффузном распределении фиброзных поражений47. Исследование распределения и характеристики рубцов с высоким разрешением имеет огромный потенциал для улучшения нашего понимания структурного ремоделирования сердца и риска развития сердечной недостаточности. В частности, фундаментальные исследования или посмертные исследования выиграют от подтверждающих структурных изображений для электрического картирования сердечной аритмии.
В заключение, сердца, усиленные обработкой HMDS и сушкой на воздухе, могут быть впоследствии окрашены рентгеновским контрастным веществом для усиления рентгеновского ослабления внеклеточных компонентов. В частности, в здоровом миокарде накопление ПМА происходит в эпителии, клапанной ткани и компартментах желудочковой проводящей системы, обшитой соединительной тканью, что приводит к усиленному ослаблению рентгеновского затухания. Кроме того, в структурно больном миокарде усиленный контраст был дополнительно селективным для фиброза.
Раскрытие информации
Никакой
Благодарности
Это исследование получило финансовую поддержку от правительства Франции в рамках программы «Инвестиции будущего», управляемой Национальным исследовательским агентством (ANR), грантовой ссылкой ANR-10-IAHU-04 и Фондом Leducq (сеть RHYTHM), а также грантовую ссылку ANR-17-CE14-0029-01 [UNMASC], финансирование от Европейского исследовательского центра в области сердечно-сосудистых заболеваний (ERA-CVD), ссылку на грант H2020-HCO-2015_680969 [MultiFib] и финансирование из французского региона Новая Аквитания, рекомендации гранта 2016 - 1R 30113 0000 7550/2016-1R 30113 0000 7553 и ANR-19-ECVD-0006-01.
Материалы
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Diapath | F0043 | |
| Calcium chloride solution | Honeywell | 21114 | |
| Canulation Tubing PTFE | VWR | DENE3400102 | |
| Constant Head 1L Reservoir | Harvard Apparatus | 50-0496 | |
| D-(+)-Glucose | Sigma | G5767 | |
| Ethanol absolute | VWR | 20821.330 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | 796881 | |
| Heparin sodium (5000 U/mL) | Panpharma | 3400891287301. | |
| Hexamethyldisilazane (HMDS) | Sigma | 440191-1L | |
| Hydrochloric acid, ACS reagent, 37% | Sigma | 258148 | |
| Magnesium chloride solution | Honeywell | 63020 | |
| Phosphate buffered saline (PBS) | Sigma | P5368 | |
| Phosphomolybdic acid hydrate | Fisher Scientific | 417895000 | |
| Potassium Chloride | Sigma | P5405 | |
| Pump Tubing, 3-Stop | Ismatec | FV-96328-48 | |
| SkyScan, 1276 | Bruker | micro CT | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium Chloride | Sigma | S3014 | |
| Sodium hydroxide solution 50% in H2O | Sigma | 415413 | |
| Tube Connector Kits | Harvard Apparatus | 72-1407 | |
| Tubing pump | Ismatec | ISM 1089 | |
| Tubing Tygon R-3603 1.6 mm 3.2 mm 0.8 mm | VWR | 228-1279 | |
| Tubing Tygon R-3603 3.2 mm 4.8 mm 0.8 mm | VWR | 228-1283 | |
| Two-part single-use syringes 50 mL | Norm-Ject | 4850001000 | Pyrogen-free, PVC-free |
Ссылки
- Srinivasan, N. T., Schilling, R. J. Sudden cardiac death and arrhythmias. Arrhythmia & Electrophysiology Review. 7 (2), 111-117 (2018).
- Szumowski, L., et al. Mapping and ablation of polymorphic ventricular tachycardia after myocardial infarction. Journal of the American College of Cardiology. 44 (8), 1700-1706 (2004).
- Bode, K., et al. Ablation of polymorphic ventricular tachycardias in patients with structural heart disease. PACE - Pacing and Clinical Electrophysiology. 31 (12), 1585-1591 (2008).
- Enjoji, Y., et al. Catheter ablation of fatal ventricular tachyarrhythmias storm in acute coronary syndrome-role of Purkinje fiber network. Journal of Interventional Cardiac Electrophysiology. 26 (3), 207-215 (2009).
- Sinha, A. M., et al. Role of left ventricular scar and purkinje-like potentials during mapping and ablation of ventricular fibrillation in dilated cardiomyopathy. PACE - Pacing and Clinical Electrophysiology. 32 (3), 286-290 (2009).
- Peichl, P., Čihák, R., Koželuhová, M., Wichterle, D., Vančura, V., Kautzner, J. Catheter ablation of arrhythmic storm triggered by monomorphic ectopic beats in patients with coronary artery disease. Journal of Interventional Cardiac Electrophysiology. 27 (1), 51-59 (2010).
- Marrouche, N. F., et al. Mode of initiation and ablation of ventricular fibrillation storms in patients with ischemic cardiomyopathy. Journal of the American College of Cardiology. 43 (9), 1715-1720 (2004).
- Bänsch, D., et al. Successful catheter ablation of electrical storm after myocardial infarction. Circulation. 108 (24), 3011-3016 (2003).
- Yokoshiki, H., Mitsuyama, H., Watanabe, M., Mizukami, K., Tsutsui, H. Suppression of ventricular fibrillation by electrical modification of the Purkinje system in hypertrophic cardiomyopathy. Heart and Vessels. 29 (5), 709-717 (2014).
- Agress, C. M., Rosenberg, M. J., Jacobs, H. I., Binder, M. J., Schneiderman, A., Clark, W. G. Protracted shock in the closed-chest dog following coronary embolization with graded microspheres. The American journal of physiology. 170 (3), 536-549 (1952).
- Bolukoglu, H., Liedtke, A. J., Nellis, S. H., Eggleston, A. M., Subramanian, R., Renstrom, B. An animal model of chronic coronary stenosis resulting in hibernating myocardium. American Journal of Physiology - Heart and Circulatory Physiology. 263, 20-29 (1992).
- Capone, R. J., Most, A. S., Sydlik, P. A. Precordial ST segment mapping. A sensitive technique for the evaluation of myocardial injury. CHEST. 67 (5), 577-582 (1975).
- Dib, N., Diethrich, E. B., Campbell, A., Gahremanpour, A., McGarry, M., Opie, S. R. A percutaneous swine model of myocardial infarction. Journal of Pharmacological and Toxicological Methods. 53 (3), 256-263 (2006).
- Dogné, J. M., et al. Characterization of an original model of myocardial infarction provoked by coronary artery thrombosis induced by ferric chloride in pig. Thrombosis Research. 116 (5), 431-442 (2005).
- Eldar, M., Ohad, D., Bor, A., Varda-Bloom, N., Swanson, D. K., Battler, A. A closed-chest pig model of sustained ventricular tachycardia. Pacing and Clinical Electrophysiology. 17 (10), 1603-1609 (1994).
- Elzinga, W. E. Ameroid constrictor: uniform closure rates and a calibration procedure. Journal of applied physiology. 27 (3), 419-421 (1969).
- Hughes, G. C., Post, M. J., Simons, M., Annex, B. H. Translational physiology: Porcine models of human coronary artery disease: Implications for preclinical trials of therapeutic angiogenesis. Journal of Applied Physiology. 94 (5), 1689-1701 (2003).
- Lichtig, C., Brooks, H., Chassagne, G., Glagov, S., Wissler, R. W. Basic fuchsin picric acid method to detect acute myocardial ischemia. An experimental study in swine. Archives of Pathology and Laboratory Medicine. 99 (3), 158-161 (1975).
- Näslund, U., Häggmark, S., Johansson, G., Pennert, K., Reiz, S., Marklund, S. L. Effects of reperfusion and superoxide dismutase on myocardial infarct size in a closed chest pig model. Cardiovascular Research. 26 (2), 170-178 (1992).
- Reffelmann, T., et al. A novel minimal-invasive model of chronic myocardial infarction in swine. Coronary Artery Disease. 15 (1), 7-12 (2004).
- Reimer, K. A., Lowe, J. E., Rasmussen, M. M., Jennings, R. B. The wavefront phenomenon of ischemic cell death. 1. Myocardial infarct size vs duration of coronary occlusion in dogs. Circulation. 56 (5), 786-794 (1977).
- Salazar, A. E. Experimental myocardial infarction. Induction of coronary thrombosis in the intact closed-chest dog. Circulation research. 9, 1351-1356 (1961).
- Takahashi, M., et al. Effects of angiotensin I-converting enzyme inhibitor and angiotensin II type 1 receptor blocker on the right ventricular sarcoglycans and dystrophin after left coronary artery ligation. European Journal of Pharmacology. 522 (1-3), 84-93 (2005).
- Gonzalez-Tendero, A., et al. Whole heart detailed and quantitative anatomy,myofibre structure and vasculature from X-ray phase-contrast synchrotron radiation-basedmicro computed tomography. European Heart Journal Cardiovascular Imaging. 18 (7), 732-741 (2017).
- Teh, I., et al. Resolving fine cardiac structures in rats with high-resolution diffusion tensor imaging. Scientific Reports. 6, 30573 (2016).
- Teh, I., et al. Validation of diffusion tensor MRI measurements of cardiac microstructure with structure tensor synchrotron radiation imaging. Journal of Cardiovascular Magnetic Resonance. 19 (1), 31 (2017).
- Abouezzeddine, O., et al. Relevance of endocavitary structures in ablation procedures for ventricular tachycardia. Journal of Cardiovascular Electrophysiology. 21 (3), 245-254 (2010).
- Pambrun, T., et al. Epicardial course of the septopulmonary bundle: Anatomical considerations and clinical implications for roof line completion. Heart Rhythm. 18 (3), 349-357 (2021).
- Pallares-Lupon, N., et al. Optimizing large organ scale micro computed tomography imaging in pig and human hearts using a novel air-drying technique. bioRxiv. , (2021).
- Martins, R. P., et al. Dominant frequency increase rate predicts transition from paroxysmal to long-term persistent atrial fibrillation. Circulation. 129 (14), 1472-1482 (2014).
- Puchtler, H., Waldrop, F. S., Valentine, L. S. Fluorescence microscopic distinction between elastin and collagen. Histochemie. 35 (1), 17-30 (1973).
- Walton, R. D., et al. Compartmentalized Structure of the Moderator Band Provides a Unique Substrate for Macroreentrant Ventricular Tachycardia. Circulation: Arrhythmia and Electrophysiology. 11 (8), 005913 (2018).
- Di Diego, J. M., Sicouri, S., Myles, R. C., Burton, F. L., Smith, G. L., Antzelevitch, C. Optical and electrical recordings from isolated coronary-perfused ventricular wedge preparations. Journal of Molecular and Cellular Cardiology. 54, 53-64 (2013).
- Pauwels, E., Van Loo, D., Cornillie, P., Brabant, L., Van Hoorebeke, L. An exploratory study of contrast agents for soft tissue visualization by means of high resolution X-ray computed tomography imaging. Journal of Microscopy. 250 (1), 21-31 (2013).
- Mulet, A. Book Review: Modern Drying Technology, Volume 3: Product Quality and Formulation , edited by E. Tsotsas and A. S. Mujumdar. Drying Technology. 32 (2), 244-245 (2014).
- Karimi, B., Golshani, B. Mild and highly efficient method for the silylation of alcohols using hexamethyldisilazane catalyzed by iodine under nearly neutral reaction conditions. Journal of Organic Chemistry. 65 (21), 7228-7230 (2000).
- Dunmore-Buyze, P. J., et al. Three-dimensional imaging of the mouse heart and vasculature using micro-CT and whole-body perfusion of iodine or phosphotungstic acid. Contrast Media and Molecular Imaging. 9 (5), 383-390 (2014).
- Disney, C. M., Madi, K., Bodey, A. J., Lee, P. D., Hoyland, J. A., Sherratt, M. J. Visualising the 3D microstructure of stained and native intervertebral discs using X-ray microtomography. Scientific Reports. 7 (1), 16279 (2017).
- Descamps, E., Sochacka, A., de Kegel, B., Van Loo, D., Hoorebeke, L., Adriaens, D. Soft tissue discrimination with contrast agents using micro-ct scanning. Belgian Journal of Zoology. 144 (1), (2014).
- Buytaert, J., Goyens, J., De Greef, D., Aerts, P., Dirckx, J. Volume shrinkage of bone, brain and muscle tissue in sample preparation for micro-CT and light sheet fluorescence microscopy (LSFM). Microscopy and Microanalysis. 20 (4), 1208-1217 (2014).
- Nierenberger, M., Rémond, Y., Ahzi, S., Choquet, P. Assessing the three-dimensional collagen network in soft tissues using contrast agents and high resolution micro-CT: Application to porcine iliac veins. Comptes Rendus - Biologies. 338 (7), 425-433 (2015).
- Speck, U. . General principles of x-ray contrast media. X-Ray Contrast Media. , (2018).
- Rajasekar, A., Trew, M. L., Sands, G. B. . Understanding and enhancing the use of micro-computed tomography in soft tissue. , (2015).
- Karagiannidis, E., et al. Micro-CT-based quantification of extracted thrombus burden characteristics and association with angiographic outcomes in patients with ST-elevation myocardial infarction: The QUEST-STEMI Study. Frontiers in Cardiovascular Medicine. 8, 646064 (2021).
- Karagiannidis, E., et al. Serum ceramides as prognostic biomarkers of large thrombus burden in patients with stemi: A micro-computed tomography study. Journal of Personalized Medicine. 11 (2), 89 (2021).
- Hennig, A., et al. High-resolution three-dimensional late gadolinium-enhanced cardiac magnetic resonance imaging to identify the underlying substrate of ventricular arrhythmia. Europace : European Pacing, Arrhythmias, and Cardiac Electrophysiology: Journal of the Working Groups on Cardiac Pacing, Arrhythmias, and Cardiac Cellular Electrophysiology of the European Society of Cardiology. 20, 179-191 (2018).
- Lorgis, L., et al. Relationship between fragmented QRS and no-reflow, infarct size, and peri-infarct zone assessed using cardiac magnetic resonance in patients with myocardial infarction. Canadian Journal of Cardiology. 30 (2), 204-210 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены