Method Article
Técnicas de preparación de tejidos para imágenes de microtomografía computarizada mejoradas con contraste de modelos cardíacos de mamíferos grandes con enfermedades crónicas
En este artículo
Resumen
Aquí, presentamos un protocolo para obtener imágenes de micro tomografía computarizada de alta resolución de corazones enteros de mamíferos grandes sanos y patológicos con mejora de contraste selectivo de colágeno.
Resumen
La remodelación estructural es una consecuencia común de las tensiones patológicas crónicas impuestas al corazón. Comprender las propiedades arquitectónicas y compositivas del tejido enfermo es fundamental para determinar sus interacciones con el comportamiento arrítmico. La remodelación tisular a microescala, por debajo de la resolución clínica, está emergiendo como una fuente importante de arritmia letal, con alta prevalencia en adultos jóvenes. Siguen existiendo desafíos para obtener un alto contraste de imágenes a una resolución de microescala suficiente para modelos preclínicos, como grandes corazones enteros de mamíferos. Además, todavía falta la mejora selectiva del contraste de la composición del tejido para imágenes tridimensionales de alta resolución. Las imágenes no destructivas que utilizan tomografía microcomputarizada son prometedoras para las imágenes de alta resolución. El objetivo era aliviar el sufrimiento de la sobretenuación de rayos X en grandes muestras biológicas. Los corazones se extrajeron de cerdos sanos (N = 2) y ovejas (N = 2) con infarto de miocardio crónico inducido y formación de cicatrices fibróticas o fibrilación auricular crónica inducida. Los corazones extirpados fueron perfundidos con: una solución salina suplementada con un agente calmante de iones de calcio y un vasodilatador, etanol en deshidratación en serie y hexametildisilizano al vacío. Este último reforzó la estructura del corazón durante el secado al aire durante 1 semana. El tejido dominante de colágeno se unió selectivamente por un agente potenciador del contraste de rayos X, el ácido fosfomolíbdico. La conformación tisular fue estable en el aire, lo que permitió adquisiciones de tomografía microinformática de larga duración para obtener imágenes de alta resolución (isotrópicos 20,7 μm). La carga óptima del agente de contraste por difusión mostró una mejora selectiva del contraste de la capa epitelial y las fibras subendocárdicas de Purkinje en ventrículos de cerdo sanos. Los corazones de fibrilación auricular (FA) mostraron una mayor acumulación de contraste en las paredes posteriores y los apéndices de las aurículas, atribuida a un mayor contenido de colágeno. Los corazones de infarto de miocardio mostraron un aumento selectivo del contraste en las regiones de fibrosis cardíaca, lo que permitió la identificación de las fibras musculares miocárdicas supervivientes entrelazadas. Las preparaciones de tejido secado al aire mejoradas con contraste permitieron obtener imágenes a microescala del corazón intacto de mamíferos grandes y una mejora selectiva del contraste de los componentes de la enfermedad subyacente.
Introducción
La cardiopatía estructural representa la mayor parte de la mortalidad relacionada con el corazón en todo el mundo1. La remodelación de la estructura cardíaca influye en el ambiente miocárdico y en el espacio intersticial. Dado que tanto la función eléctrica como la mecánica cardíaca dependen de la organización de los miocitos, la interrupción puede conducir a una arritmia cardíaca intolerable, acciones deterioradas de bombeo de sangre e insuficiencia cardíaca 2,3,4,5,6,7,8,9. Los desarrollos de terapias curativas para las enfermedades cardíacas estructurales son superados con creces por la prevalencia de la enfermedad 2,5. Como tal, están surgiendo un número creciente de modelos preclínicos de enfermedades cardíacas estructurales para comprender mejor los perfiles anatomomorfológicos y la patogénesis resultante de las arritmias cardíacas 10,11,12,13,14,15,16,17,18,19,20, 21,22,23. Se observa en todo el espectro de enfermedades estructurales la regulación al alza de la fibrosis intersticial y, más comúnmente en casos relacionados con la isquemia, el reemplazo miocárdico por fibrosis y tejido graso18. La comprensión morfológica de los componentes extracelulares patológicos puede permitir la identificación de sustratos potenciales de arritmia. La distribución y el alcance de la enfermedad proporcionan fuertes indicadores de riesgo arritmogénico. Sin embargo, siguen existiendo desafíos para obtener una imagen integral de los perfiles de enfermedades mediante la integración de macro y microescalas en el corazón intacto.
La microtomografía computarizada (microCT), basada en rayos X, está emergiendo como una poderosa herramienta para interrogar la microestructura de tejidos biológicos blandos utilizando agentes de contraste. Se han obtenido mapas anatómicos altamente detallados para corazones de pequeños roedores 24,25,26 y pequeñas muestras diseccionadas de grandes corazones de mamíferos 27,28. Sin embargo, las imágenes a nivel de todo el órgano de los grandes corazones de mamíferos presentan longitudes de trayectoria excesivas sobre las cuales los fotones de rayos X se atenúan utilizando técnicas convencionales de preparación de tejidos. Esto implica la carga de contraste del tejido y la inmersión de la muestra en un disolvente agente de contraste durante la adquisición. El aumento del tamaño y la resolución de la muestra impone una prolongación del tiempo total de adquisición. Por lo tanto, la estabilidad del tejido se vuelve crucial para la reconstrucción de imágenes utilizables, lo que significa que se debe prevenir la deformación del tejido resultante del secado. El uso de un fluido de inmersión, sin embargo, tiene inconvenientes: (i) la intensidad general de la señal de fondo se vuelve no despreciable y (ii) promueve la dilución de las moléculas de contraste unidas al tejido. Ambos factores contribuyen a reducir el contraste de la imagen.
Este estudio detalla una nueva línea de procesamiento de tejidos para aliviar la atenuación de los fotones de fondo y optimizar el rango dinámico que ofrecen los agentes de mejora del contraste. Se sugiere utilizar un enfoque de secado al aire de tejidos con refuerzo químico de tejidos para limitar la deformación de tejidos29. Por lo tanto, las muestras de tejido pueden permanecer estables en el aire durante largas adquisiciones y omitir las contribuciones de fondo de los fluidos de inmersión. Esta línea de metodología proporciona: (i) un protocolo integral de procesamiento de tejidos e imágenes optimizado utilizando corazones de cerdo enteros; (ii) una evaluación de las técnicas de concentración y carga de contraste y, (iii) la aplicación de esta tubería en dos modelos distintos de enfermedades crónicas de fibrilación auricular e infarto de miocardio en corazones de oveja. El desarrollo de los modelos de enfermedad crónica se ha descrito en otros lugares para cada modelo de enfermedad cardíaca crónica, infarto de miocardio inducido por embolización percutánea de la arteria coronaria13 y fibrilación auricular autosostenible30.
Protocolo
Todos los experimentos se realizaron siguiendo las directrices de la Directiva 2010/63/UE del Parlamento Europeo sobre la protección de los animales utilizados con fines científicos. Los protocolos animales fueron aprobados por el comité ético local (CEEA50) de la Universidad de Burdeos. Los corazones se obtuvieron de tres modelos de mamíferos grandes, incluidos (i) cerdos blancos grandes sanos (N = 2, 2 meses de edad); (ii) Ovejas (N = 1, 2 años de edad) con infarto de miocardio inducido13 y (iii) Ovejas (N = 1, 7 años de edad) con fibrilación auricular inducida30.
1. Preparación de la solución:
- Solución cardiopléjica: Preparar 3 L de agua destilada y añadir cloruro de sodio (110 mM), cloruro de potasio (16 mM), bicarbonato de sodio (10 mM), D-(+)-Glucosa (9 mM), solución de cloruro de calcio (1,2 mM) y solución de cloruro de magnesio (16 mM). Al final, añadir 500 μL/L de heparina sódica. Conservar esta solución a 4 °C.
- Solución salina tamponada con fosfato - solución de EDTA (PBS-EDTA).
- Primero, agregue ácido etilendiaminotetraacético (EDTA) a 1 L de agua destilada para una concentración final de 10 mM. Aumente y mantenga un pH de la solución de 12 utilizando una solución de hidróxido de sodio (1 M) para disolver el EDTA.
- Una vez que el EDTA esté completamente disuelto, reduzca el pH a 7.4 usando ácido clorhídrico. Agregue una bolsa de lámina de solución salina tamponada con fosfato para obtener una solución a 0,01 M (cloruro de sodio, 0,138 M; cloruro de potasio, 0,0027 M) y pH 7,4. Conserve esta solución a temperatura ambiente (RT).
- Etanol - solución de agente de contraste de ácido fosfomolíbdico (PMA): Prepare 1 L de etanol absoluto y agregue el PMA para obtener una solución al 1% de la concentración. Conserve esta solución en RT.
2. Fuente de tejido
- Sacrificar al animal y extraer el corazón de acuerdo con las pautas éticas locales. Sumerja rápidamente el corazón en una solución cardiopléjica fría y masajee suavemente los ventrículos para el enjuague inicial.
- Asegúrese de cortar la aorta debajo del arco aórtico y sujete dos lados de la pared arterial con soportes de agujas.
- Suspendiendo el corazón por los soportes de la aguja, inserte una cánula aórtica en la raíz aórtica, teniendo cuidado de no hacer contacto o sobresalir a través de las válvulas aórticas. Envuelva una sutura de calibre 0 alrededor del arco aórtico al nivel de la cánula y ate firmemente la cánula en su lugar.
- Usando jeringas de 50 ml, inyecte 200 ml de solución cardiopléjica fría (4 °C). Elimine el exceso de acumulación de sangre en las cavidades inclinando el corazón hacia su lado posterior para drenar a través de las venas pulmonares.
- Sumerja el corazón enjuagado y manténgalo en una solución cardiopléjica fría almacenada en hielo hasta que esté lista para la disección.
3. Preparación del tejido:
- Prepare un depósito de 1 L apoyado a 80 cm sobre un plato de disección. Acopla un tubo termoplástico de 80 cm de longitud y 3,2 mm de diámetro interno y 4,8 mm de diámetro externo a un puerto de drenaje del depósito.
- Fije un grifo de tres vías al tubo de drenaje y acople más tubos termoplásticos (20 cm, 1,6 mm de diámetro interno y 3,2 mm de diámetro externo) a cada puerto libre en el grifo de tres vías. Fije los grifos bidireccionales en los extremos de la tarifa del tubo.
- Llene el reservorio con la solución cardiopléjica suplementada con heparina (2500 unidades). Abra los grifos para permitir que la solución cardiopléjica drene y elimine todas las burbujas de aire, luego cierre los grifos bidireccionales.
- Preparar cánulas para la ostia coronaria izquierda y derecha utilizando tubos de politetrafluoroetileno (PTFE) (1 mm de diámetro interno y 2 mm de diámetro exterior).
- Cortar 5 cm de tubo y calentar un extremo colocando la punta junto a una llama desnuda. Una vez que 1 mm de la punta comience a derretirse y se vuelva translúcida, presione la punta contra una superficie dura resistente al calor para dar forma a una cresta en la punta de las cánulas para evitar que las cánulas se deslicen de los vasos.
- Inserte 1 cm del extremo no calentado de cada cánula en los dos extremos del tubo de drenaje del depósito de drenaje.
- Retire la cánula aórtica. Bajo solución cardiopléjica fría, localice la ostia izquierda y derecha de las arterias coronarias.
- Usando tijeras puntiagudas, separe cuidadosamente la raíz aórtica del tejido circundante por encima y por debajo de la ostia coronaria para permitir el enhebrado de una sutura de seda de 0 G debajo del vaso coronario.
- Abra los grifos bidireccionales e inserte las puntas de las cánulas en la ostia coronaria. Con las puntas de las cánulas que se extienden 1-2 cm en la ostia y más allá de la colocación de la sutura, ate las cánulas.
- Enjuague el corazón mientras masajea suavemente los ventrículos durante 15 minutos hasta que el corazón se limpie de sangre.
- Después de enjuagar, cierre los grifos bidireccionales y desconéctelos del grifo de tres vías. Transfiera el corazón a un recipiente de plástico resistente a productos químicos de 1 L que contenga 500 ml de solución de PBS-EDTA.
- Recircule la solución de PBS-EDTA en el tubo termoplástico bajo una campana extractora de humos utilizando una bomba peristáltica con dos canales. Prepare el tubo de la bomba hasta que el tubo esté ausente de burbujas de aire, luego perfunda cada cánula de la arteria coronaria mediante recirculación en RT durante 2 h a 80 ml / min.
- Asegúrese de que la campana extractora de humos esté operativa. Detenga la bomba, drene la solución del recipiente y reemplácela con formalina (10%) para la fijación durante 1 h a RT a 80 ml / min.
- Reemplace la solución de formalina con PBS para enjuagar el fijador tres veces durante 15 minutos cada una a 80 ml / min.
4. Deshidratación y secado de tejidos:
NOTA: Use la misma tasa de perfusión (80 ml / min) y deje que el tejido permanezca en RT durante todo el tiempo.
- Reemplace la solución de PBS con etanol al 20%, diluido en agua ultrapura y perfunda durante un mínimo de 3 h.
- Perfundir el corazón utilizando una serie de concentraciones incrementales de etanol.
- Comience reemplazando la solución de etanol al 20% con etanol diluido al 30% y perfunda durante 2 h.
- Repita la perfusión aumentando la concentración de etanol en cada iteración a través de 40%, 50%, 60%, 65%, 70%, 75%, 80%, 95%, 90%, 95%, 99% y 100% durante una duración mínima de 1 h en cada paso (concentración).
NOTA: Las muestras de corazón pueden descansar sin flujo de perfusión durante la noche en cualquier dilución de etanol si se ha producido una perfusión mínima de 15 minutos para esa concentración.
- OPCIONAL: Si se aplican agentes de contraste mediante perfusión, perfundir el corazón con etanol 100% suplementado con el agente de contraste PMA, 1% durante 48 h. Enjuague el agente de contraste por perfusión con etanol al 100% durante 2 h.
- Para reforzar el tejido cardíaco antes del secado al aire, recircule una mezcla 50:50 de etanol y hexametildisilazano (HMDS) durante 10 min. Siga esto por 100% HMDS durante otras 2 h.
PRECAUCIÓN: HMDS es una sustancia altamente tóxica y nociva. Un fuerte olor a amoníaco se libera en contacto con el aire. Además, la forma líquida de HMDS es altamente volátil y catalizada por agentes que contienen yodo. - Desconecte las cánulas del tubo y suspenda el corazón de una sutura aórtica dentro de la campana extractora.
- Deslice cuidadosamente una bolsa con cierre hermético sobre el corazón y cierre el sello de la bolsa sobre la sutura para reducir la exposición del corazón al aire circulante. Deje que el corazón se seque a través de la evaporación durante 1 semana.
- OPCIONAL: Para los agentes de contraste de carga por difusión, lave el corazón en etanol al 100% durante 15 minutos mientras agita. Sumergir el corazón en etanol 100% suplementado con PMA, 1%, durante 48 h al vacío. Repita el paso 4.6.
5. MicroCT:
NOTA: Se utilizó un sistema de microCT de rayos X de escritorio para obtener imágenes de corazones de cerdo.
- Monte el corazón secado al aire en un soporte de muestra apropiado. Evite cualquier movimiento durante las mediciones de microCT de rayos X utilizando una abrazadera anclada al soporte de la muestra y asegure el corazón a través de la aorta seca y rígida.
- Alinee meticulosamente el centro de la muestra del corazón a lo largo de su eje longitudinal con el centro del campo de visión de la imagen para ángulos de rotación de 0 ° y 90 °. Para lograr esto en todas las orientaciones, suspenda el corazón en el aire a través de una abrazadera aórtica fijada al soporte de la muestra.
- Después de abrir el software e iniciar el sistema de microCT de rayos X, aplique el filtro de rayos X de aluminio, 1 mm, voltaje de la fuente de rayos X a 60 kV y corriente a 120 μA. Establezca las dimensiones de la imagen en 2016 x 1344 píxeles y el tamaño del píxel en 20 μm.
- Retraiga el soporte de muestra fuera del campo de visión y calibre la imagen de fondo y el tiempo de exposición de rayos X obteniendo una corrección de campo plano. Asegúrese de que la transmisión promedio de rayos X de fondo sea superior al 80%.
- Explore imágenes de transmisión de rayos X a lo largo de la longitud del soporte para determinar el campo general de imágenes en el eje longitudinal del corazón. Para el escaneo, use un paso de rotación de 0.18 °, un marco promedio de 5 y una rotación de muestra de 180 °. Seleccione el modo de escaneo de desvío para obtener una imagen de todo el ancho del soporte de muestra.
NOTA: Los parámetros de adquisición indicados en esta sección han sido seleccionados para optimizar la calidad de imagen de la composición del corazón del conjunto. - Después de escanear, use el software para la reconstrucción tomográfica de un volumen de imagen tridimensional isotrópica. Para la aplicación del software NRecon, utilice la corrección de artefactos relacionada con la adquisición, incluidos los efectos de endurecimiento del haz del 10% y la reducción del artefacto del anillo del 8.
- Para optimizar las limitaciones de almacenamiento de datos, aplique la región rectangular mínima de interés que abarca vóxeles de imagen específicos del corazón. Exporte las imágenes en un formato de mapa de bits de 8 bits como una pila de imágenes.
- Visualice la pila de datos reconstruida utilizando el software DataViewer. Orientar digitalmente la muestra dentro de los límites de la imagen para realinear los ejes largo y corto de la muestra con los tres ejes principales del volumen de la imagen.
- Recorte el volumen de la imagen en los tres ejes para eliminar las capas de fondo externas de la imagen, para reducir al máximo el tamaño total de la imagen.
Resultados
La preparación de grandes corazones de mamíferos utilizando el método de deshidratación y secado al aire elimina todo el contenido de agua de la muestra. Se puede observar evidencia de reemplazo insuficiente de agua por etanol durante la carga de HMDS (ver Protocolo, paso 4.4). La presencia de agua bajo HMDS creará burbujas que se elevarán desde el tejido. En el caso de niveles excesivos de agua, puede ocurrir un aumento en la temperatura del fluido de inmersión. Mantener la cámara de inmersión rodeada de hielo durante la carga inicial de HMDS puede reducir los efectos nocivos del calentamiento de los tejidos. Después de secar los corazones al aire en ausencia de agentes de contraste, la muestra aparecerá de color blanco (ver Protocolo, paso 4.6). La superficie exterior a menudo estaba seca y estructuralmente estable antes de las capas intramuros. El enjuague con etanol antes de la carga del agente de contraste eliminó el depósito blanco (ver Protocolo, paso 4.7). El corte a través del tejido con una cuchilla afilada revela macroscópicamente las fibras musculares individuales con una separación clara. La carga de contraste al sumergir muestras de corazón en medio agente de contraste sufrió artefactos de límite de difusión en regiones gruesas y altamente musculares de la muestra. La carga de contraste de difusión bajo vacío proporcionó una coloración más homogénea en el músculo (muestra de corazón # 1, consulte la Tabla 1 para los tiempos de carga del agente de contraste). Macroscópicamente, la distribución del agente de contraste superficial mostró una tinción homogénea entre el músculo cardíaco y las regiones compuestas principalmente de componentes extracelulares, especialmente grasa y tejido conectivo. Las muestras de tejido secado al aire, ya sea antes o después de la carga del agente de contraste, mantuvieron una integridad estructural estable.
El tiempo necesario para escanear todo el ancho de la muestra a una resolución de 20 μm bajo microCT utilizando los parámetros de escaneo mencionados anteriormente y un tiempo de exposición de 1700 ms fue de 6 h 34 min. Dependiendo del tamaño de la muestra en el eje del pórtico del escáner, esta duración se multiplicó por el número de posiciones necesarias para capturar toda la longitud de la muestra. Para los corazones de cerdo y oveja en este estudio, se utilizaron de tres a cuatro posiciones. El software NRecon mosaicó los escaneos de múltiples posiciones y desplazamientos para formar una sola imagen de proyección de rayos X para cada paso de rotación de la fuente de rayos X y el detector. En total, 1000 proyecciones se almacenan como imágenes de 16 bits, generando 30-40 GB de datos. Las imágenes volumétricas reconstruidas fueron de 52-70 GB.
Los principales puntos de referencia anatómicos, incluidas las cavidades ventriculares, el tabique y las paredes libres de los ventrículos, fueron fácilmente identificables a partir de imágenes de transmisión de rayos X de corazones de cerdo secados al aire teñidos con agente de contraste por carga de difusión (Figura 1A). Además, también se observaron regiones altamente texturizadas que indican la organización microestructural, como la orientación de la fibra miocárdica, debido a la atenuación/ transmisión sensible de rayos X (Figura 1B). Las reconstrucciones tomográficas de volúmenes de imágenes tridimensionales mostraron una clara separación entre el tejido y el fondo en los límites epicárdico y endotelial (Figura 1D). Intramuralmente, se observó un gradiente de difusión de bajo contraste e intensidad de vóxel en todas las regiones transmurales gruesas del tejido. A pesar de eso, la vasculatura y las fibras miocárdicas separadas por planos de escisión todavía eran fácilmente identificables. Se observó un segundo ancho de banda de contraste de mayor intensidad en la capa más epicárdica y en las regiones subendocárdicas punteadas. La mejora del contraste fue mayor en los sitios donde se acumularon componentes extracelulares, particularmente el tejido conectivo epicárdico, la grasa epicárdica y la vaina del tejido conectivo de la red de fibra de Purkinje. Las distribuciones de intensidad de la señal de vóxel mostraron una alta separación del fondo de intensidad cero (aire) y dos poblaciones dominantes de tejido de bajo y alto contraste (Figura 1D).
Para validar la mejora del contraste de las reconstrucciones de imágenes microCT y la selectividad a los compartimentos colágenos de las muestras de corazón, se empleó histología, microscopía de campo brillante y microscopía fluorescente (Figura 2). Se preparó un bloqueo transmural de tejido ventricular de un corazón secado al aire sin carga previa de agente de contraste para la incrustación y seccionamiento de parafina. Las rebanadas de tejido adyacentes montadas en portaobjetos de microscopio se trataron con tinción tricrómica de Masson, sin tratamiento o 48 h de PMA (1%). La inmersión de secciones de tejido montadas en diapositivas eliminó los efectos del gradiente de difusión del proceso de tinción que se observó en muestras de corazón entero. La tinción tricrómica de Mason mostró tinción positiva de colágeno en las capas epitelial y endotelial, perivascularmente en el tejido subepistárdico y una vaina de tejido conectivo que rodea una fibra de Purkinje de carrera libre que sobresale en la cavidad ventricular izquierda (Figura 2A). La iluminación de campo brillante mostró una coloración más oscura en las estructuras colágenas después de la tinción de PMA, lo que respalda la acumulación preferencial de PMA (Figuras 2B, C). Además, se ha demostrado previamente que el tratamiento con PMA apaga la autofluorescencia de los complejos macromoleculares de colágeno31. Las imágenes fluorescentes de las secciones de tejido ventricular tuvieron pérdida de fluorescencia inducida por PMA en los sitios de colágeno (Figura 2D vs. 2E, Figura 2D' vs. 2E' y Figura 2D'' vs. 2E''). Tanto en el campo brillante como en las imágenes fluorescentes, los compartimentos celulares no fueron alterados por el tratamiento con PMA, y el colágeno tuvo una acumulación selectiva de tinción de PMA y enfriamiento de la autofluorescencia.
La muestra de corazón # 2 se tiñó con un agente de contraste a través de la perfusión antes del secado al aire. La reconstrucción de la imagen reveló una tinción altamente irregular dentro del compartimento miocárdico (Figura 3A). El realce de contraste no pareció selectivo de la composición del tejido, sin una mayor mejora de la intensidad de la señal en las regiones epicárdica o subendocárdica. Además, el tejido de bajo contraste mostró una separación deficiente de la intensidad de fondo (Figura 3B).
La fibrosis ventricular fue inducida por infarto de miocardio e isquemia crónica (Muestra de corazón #3). Se formó una cicatriz antero-apical al reemplazar los miocitos con depósitos fibrograsos en el tejido aguas abajo hasta el sitio de embolización vascular. La muestra de corazón # 3 se preparó y se tomaron imágenes de una cuña ventricular diseccionada que cubre el ventrículo izquierdo anterior, el tabique y la pared libre del ventrículo derecho. La preparación de esta configuración de cuña ventricular se ha descrito previamente32 y se revisó en detalle la aplicación de cuñas para la imagen cardíaca33. La morfología cicatricial fue transmural pero heterogénea (Figura 4). Una lesión fibrótica densa central estaba rodeada por una zona de borde suelta y heterogénea (Figura 4A). La preparación ventricular se tiñó por difusión-carga post-secado al aire y en vacío. La Figura 4B-E muestra las mayores intensidades de señal de los volúmenes de imágenes microCT reconstruidas en los límites del tejido y las regiones cicatriciales. Los agentes de contraste tiñeron mal el miocardio sano, sin embargo, se conservó el contraste microestructural (Figura 4C'). En la zona fronteriza, el tejido cicatricial se intercaló con el miocardio sobreviviente (Figura 4D'). La fibrosis densa apareció transmural pero texturizada, lo que indica variaciones en la composición (Figura 4E'). Se utilizaron secciones de tejido de una región transmural del ventrículo izquierdo de la preparación de tejido secado al aire y teñido con PMA para validar la selectividad de PMA para el colágeno en el tejido patológico mediante la comparación con la tinción tricrómica de Masson (Figura 4F). La tinción de PMA fue selectiva para el colágeno (subepicardio y subendocardio) y ausente en las regiones de miocardio sobreviviente (Figura 4G).
La muestra de corazón # 4 con fibrilación auricular persistente inducida se secó al aire mientras conservaba la forma nativa de la cavidad auricular. No se observó colapso del apéndice auricular. Los principales hitos anatómicos podrían identificarse morfológicamente a partir de imágenes reconstruidas (el tabique auricular, los músculos pectinatos, el seno coronario, la ostia de la vena pulmonar, la vena cava y la cristae terminalis). La tinción por difusión al vacío dio lugar a una mejora del contraste en la raíz aórtica y las válvulas auriculoventriculares y las regiones discretas del miocardio de trabajo. La mejora de la tinción muscular se limitó a los apéndices auriculares y las paredes posteriores de las aurículas izquierda y derecha (Figura 5).
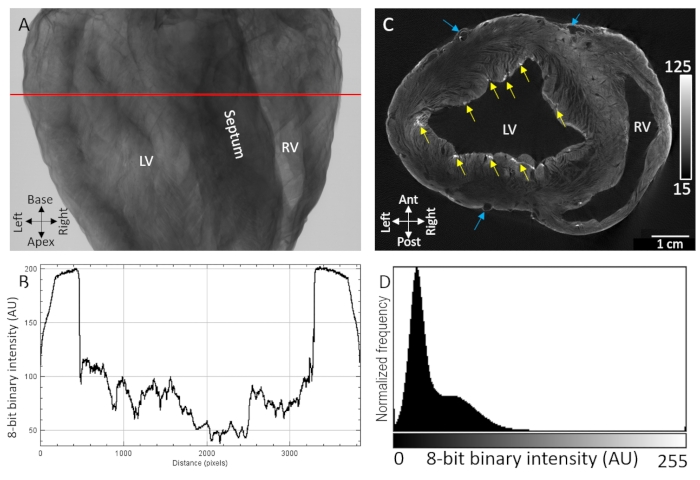
Figura 1: Imágenes microCT de un corazón de cerdo secado al aire tratado con agente de contraste PMA por difusión al vacío. (A) Imagen de proyección de rayos X. (B) Un perfil de transmisión extraído de la línea roja en A. (C) Rebanada de eje corto de los ventrículos a partir de un volumen tridimensional reconstruido tomográficamente. Las flechas amarillas indican regiones punteadas de contraste atribuidas a fibras de Purkinje subendocárdicas. Las flechas azules indican vasculatura. (D) Distribución de la intensidad de la señal del segmento de imagen reconstruido que se muestra en C. LV: ventrículo izquierdo y RV: ventrículo derecho. Haga clic aquí para ver una versión más grande de esta figura.
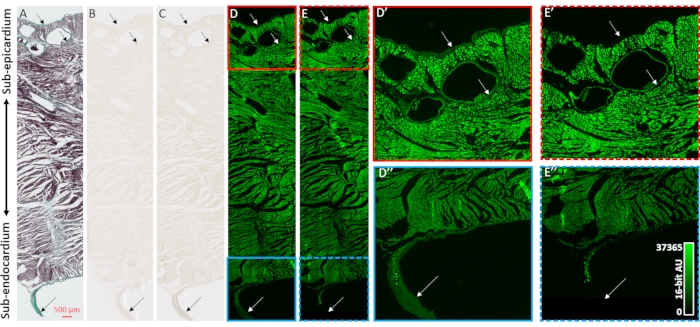
Figura 2: Validación de la selectividad de PMA para el colágeno. (A) Tinción tricrómica de Masson de una sección de tejido transmural de los ventrículos de un corazón secado al aire. El miocardio se tiñe de rojo y el colágeno se muestra con coloración verde. Las secciones de tejido adyacentes (B) ausentes de tinción o (C) teñidas con PMA (1%) se tomaron imágenes con iluminación de campo brillante para evaluar la uniformidad de la coloración. (D) Las secciones de tejido ausentes de tinción o (E) teñidas por PMA fueron fotografiadas por microscopía fluorescente. Los paneles D' (caja roja sólida) y E' (caja roja discontinua) son vistas ampliadas del subepepcardio para secciones no manchadas y teñidas de PMA. Los paneles D'' (caja azul sólido) y E'' (caja azul discontinua) son vistas ampliadas correspondientes del subendocardio y una fibra purkinje de funcionamiento libre. Las flechas indican sitios de contenido de colágeno. Haga clic aquí para ver una versión más grande de esta figura.
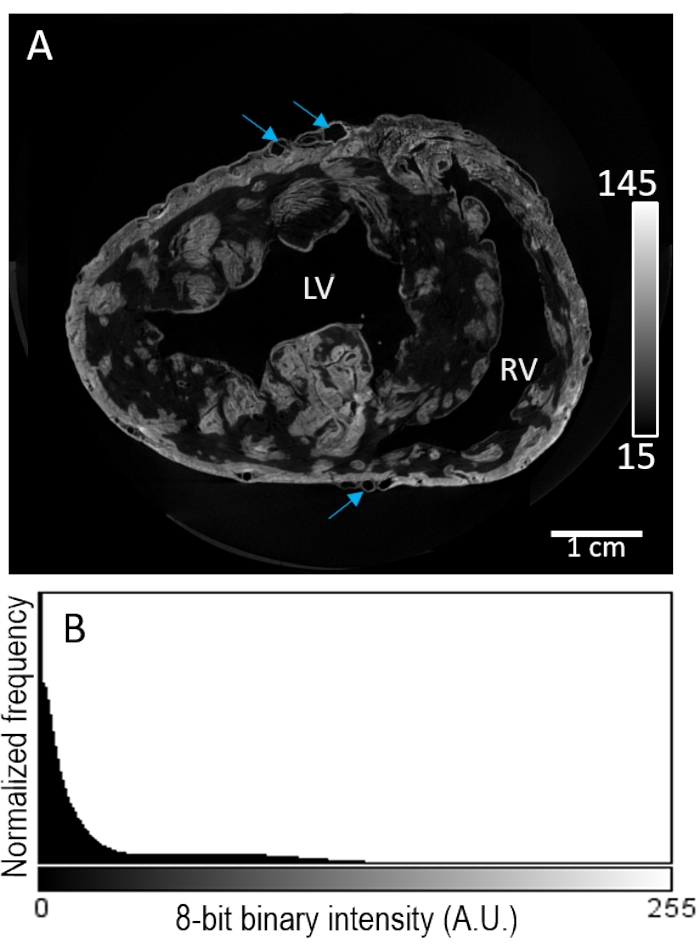
Figura 3: Carga de perfusión de PMA antes del secado al aire e imágenes de MicroCT. (A) Una rebanada de eje corto de un volumen de imagen reconstruido de los ventrículos de un corazón de cerdo. Las flechas azules indican vasculatura. (B) La distribución de la intensidad de la señal del segmento de imagen del panel A. VI: ventrículo izquierdo y RV: ventrículo derecho. Haga clic aquí para ver una versión más grande de esta figura.
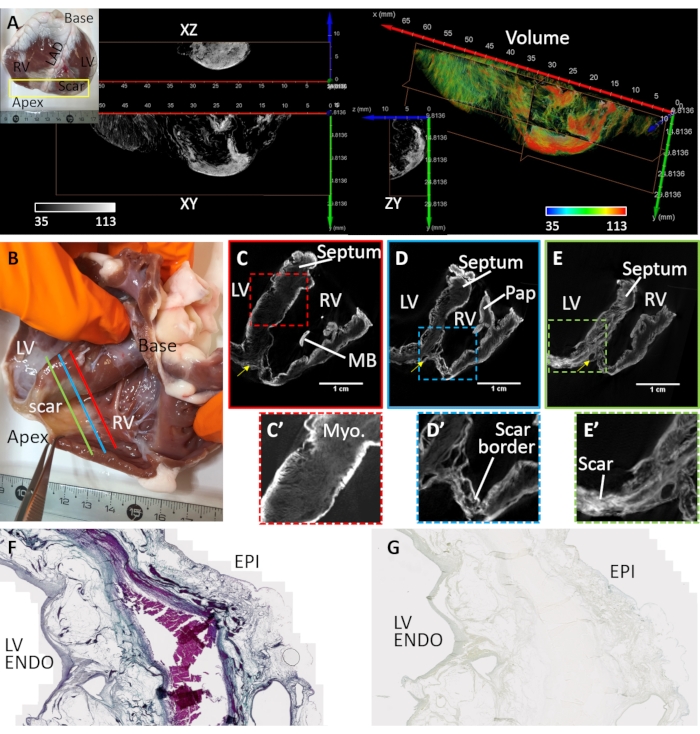
Figura 4: Imágenes microCT de un corazón de oveja que sufre un infarto de miocardio crónico. (A) Se formó una cicatriz densa en la región apical (ver fotografía insertada). Se asignó una croción volumétrica de la región apical desde una perspectiva endocárdica en función de la intensidad de la imagen (rojo correspondiente al tejido cicatricial y miocardio en verde). Las rebanadas ortogonales de la intensidad de la escala de grises muestran la densa distribución de la cicatriz y el miocardio que bordea la supervivencia. La separación entre el tejido fibrótico y el miocardio corresponde a regiones del tejido adiposo. (B) Una fotografía de una preparación de cuña ventricular seca al aire de una oveja con cicatrización apical después de un infarto de miocardio. Las rebanadas oblicuas del volumen de la imagen microCT reconstruida atraviesan los ventrículos en el nivel medio entre la base y el ápice y proximales al sitio de (C) oclusión vascular (línea C-roja en el panel B), (D) la región periinfarto que bordea la cicatriz densa y el miocardio sano (línea D-azul en el panel B) y (E) una región de fibrosis densa (E - línea verde en el panel B). (C') Una vista ampliada de la región septal delineada por un cuadro discontinuo rojo en C. (D') Una vista ampliada de la región del infarto en el ápice ventricular derecho (cuadro discontinuo azul en el panel D). (E') Una vista ampliada de la región del infarto en el ápice ventricular izquierdo (cuadro discontinuo verde en el panel E). VI: Cavidad ventricular izquierda; RV: cavidad ventricular derecha; MB: banda moderadora; Papanicolaou: músculo papilar. La flecha amarilla indica la arteria descendente anterior izquierda. (F) Tinción tricrómica de Masson de una sección histológica cortada del ventrículo izquierdo teñido al aire teñido con PMA. El colágeno se tiñe de azul y el miocardio se tiñe de rosa / violeta. (G) Una sección tisular correspondiente de la distribución de tinción de PMA. Haga clic aquí para ver una versión más grande de esta figura.
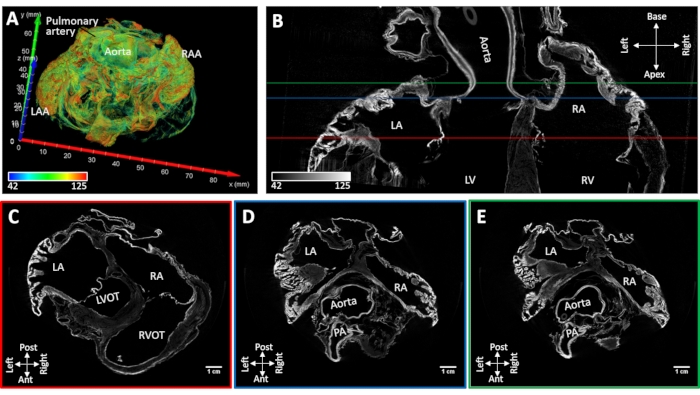
Figura 5: Imagen microCT de un corazón de oveja después de una fibrilación auricular inducida crónica. (A) Representación del volumen de las aurículas con coloración asignada como en la Figura 4A. (B) Corte de imagen microCT biauricular en el eje largo del corazón. Se extrajeron cortes de eje corto a nivel de las válvulas auriculoventriculares (C) (línea roja C en el panel B), (D) raíz aórtica (línea D- azul en el panel B) y (E) techo auricular izquierdo (E- línea verde inpanel B). LA: aurículas izquierdas; RA: aurículas derechas; LAA: apéndice auricular izquierdo; RAA: apéndice auricular derecho; VI: ventrículo izquierdo; RV: ventrículo derecho; LVOT: tracto de salida del ventrículo izquierdo; RVOT: tracto de salida del ventrículo derecho y PA: arteria pulmonar. Haga clic aquí para ver una versión más grande de esta figura.
| Muestra # | 1 | 2 | 3 | 4 |
| Especie | Cerdo | Cerdo | Oveja | Oveja |
| Peso corporal (kg) | 32.4 | 31.2 | 47.2 | 53.4 |
| Peso del corazón (g) | 191.2 | 186.2 | 202.4 | 207.6 |
| Patología | - | - | IM crónico | FA crónica |
| Preparación de muestras | Todo el corazón | Todo el corazón | Cuña del corazón anterior | Todo el corazón |
| Modo de carga de contraste | Difusión | Perfusión | Difusión | Difusión |
| Exposición al agente de contraste (h) | 48 | 24 | 48 | 48 |
Tabla 1: Muestras de corazón y tratamiento con agentes de contraste.
Discusión
Se establece un protocolo detallado para preparaciones de tejidos grandes utilizando corazones enteros de grandes mamíferos para imágenes estructurales posteriores de alta resolución. Un enfoque de secado al aire eliminó las influencias de la atenuación de los rayos X de fondo y optimizó al máximo el tejido: contraste de fondo29. Utilizando este enfoque, se logró una resolución isotrópica en el rango de 20 μm para imágenes volumétricas en muestras de hasta 7,2 cm de diámetro. Sin embargo, la microTC de los tejidos blandos normalmente se basa en el uso de agentes de contraste no específicos para mejorar la absorción y la sensibilidad de los rayos X de los sistemas de microCT34. Aunque los agentes de contraste de rayos X mejoran la atenuación general de los rayos X y la mejora de las imágenes de tejidos blandos, la separación de los constituyentes de los tejidos en función de la composición bioquímica sigue siendo un desafío. Sin embargo, se observó que el uso de corazones secados al aire en combinación con un agente de contraste de rayos X común en el entorno de laboratorio, PMA, tiñó selectivamente los componentes extracelulares. Se mejoró el tejido conectivo asociado con miocardio sano y la remodelación estructural patológica en enfermedades crónicas.
El proceso de secado al aire del tejido biológico exige una intervención para resistir la deformación de la muestra. La preparación de muestras para microscopía electrónica tiene requisitos similares. Por lo general, se emplea un método de secado de punto crítico, que utiliza un equilibrio de medio de inmersión tisular, temperatura y presión para eliminar la tensión superficial del contenido líquido del tejido, lo que causa deformación a nivel molecular al evaporarse35. Este enfoque requiere un reemplazo uniforme del contenido de agua de la muestra con dióxido de carbono líquido, que es más confiable en muestras pequeñas y fácilmente difusibles. Alternativamente, se puede mejorar la integridad estructural del tejido y se puede aplicar el secado al aire, es decir, la fase de evaporación durante un período más largo para reducir la deformación general. La molécula HMDS se somete a una sililación para formar un andamio a base de silicona para reforzar y estabilizar la organización molecular de la muestra de tejido36. La evaporación se prolonga aún más al limitar las corrientes de aire circulantes del medio ambiente, también para evitar la evaporación no homogénea, particularmente entre la superficie de la muestra y las capas intramuros.
Numerosos agentes de contraste se han utilizado previamente para imágenes microCT de tejidos blandos. Los más comunes son el yodo, el ácido fosfotúngstico (PTA) y el PMA. El yodo en particular se ha empleado debido a una mayor tasa de difusión 34,37,38. Sin embargo, el yodo actúa como catalizador para la sililación del reactivo HMDS36. La reacción catalizada es agresiva y exotérmica, con un alto riesgo de destrucción de la muestra y riesgo de seguridad si el HMDS residual permanece debido a una desecación incompleta de la muestra. Tanto el PTA como el PMA disueltos en etanol se pueden usar de forma segura junto con HMDS. Se ha demostrado que PTA y PMA proporcionan un mayor poder de resolución de estructuras finas en discos intervertebrales no mineralizados en comparación con la tinción de yodo38. En imágenes microCT de muestras de mamíferos, se han utilizado PTA y PMA para teñir embrionesde ratón 39, sistema cardiovascularde ratón 37, músculo y cerebrode conejo 40, y venas porcinas41. PTA tiene una mayor masa molecular y densidad en solución que PMA. Esto se debe en parte a una mayor masa atómica de tungsteno (el número atómico es de 74 g / mol), el principal elemento atenuante en PTA. En comparación, el elemento más pesado en PMA, el molibdeno, tiene un número atómico de 42 g / mol. Tanto la masa atómica como la densidad de la muestra subyacen a la atenuación de los rayos X, además del espesor de la muestra42. Al aumentar la longitud de la trayectoria de los rayos X al aumentar el tamaño de la muestra, la atenuación de los rayos X se vuelve más sensible al aumento de la densidad de la muestra. Por lo tanto, se seleccionó el agente de contraste PMA de menor densidad para reducir el riesgo de sobretenuación y optimizar el rango dinámico de contraste de imagen para corazones de escala humana. Otra evidencia ha demostrado que la carga de difusión de PMA da una tinción más homogénea que para la molécula más grande PTA en el tejido cardíaco43.
El método de administración del agente de contraste afecta la uniformidad de la distribución del agente de contraste en el tejido cardíaco (Figura 3). La perfusión de agentes de contraste en el corazón deshidratado con etanol mostró niveles irregulares de tinción de fondo de PMA debido a la resistencia vascular variable. En el corazón secado al aire, la estructura laminar muscular se enfatiza mediante el proceso de desecación de la muestra, aumentando la separación laminar muscular. En última instancia, esto mejoró la permeabilidad general del tejido para la carga del agente de contraste basado en la difusión. En consecuencia, el secado al aire facilitó el tejido: contraste de aire a nivel laminar e intralaminar (Figura 4). Además, la carga de difusión puede facilitarse aún más mediante la aplicación bajo vacío. Además, se ha demostrado que la contracción tisular de muestras no secas depende de la concentración del agente de contraste40. Sin embargo, la estabilización morfológica previa de la muestra por secado al aire inhibe los efectos de contracción tisular29.
Las imágenes microCT de alta resolución de órganos enteros producen inherentemente grandes volúmenes de datos. La naturaleza de las técnicas de imagen tomográfica permite la visualización y el manejo de imágenes corte por segmento, lo que facilita el procesamiento de la computadora y la carga de memoria. Sin embargo, para visualizar pilas de imágenes tridimensionales, por ejemplo, para representar volúmenes de muestras en representaciones tridimensionales, las especificaciones mínimas recomendadas de la computadora son 128 GB de RAM y una velocidad de procesador de 3 GHz. Los discos duros de estado sólido también mejoraron en gran medida la transferencia de datos.
La aparición de imágenes microCT en el campo cardíaco ofrece numerosas ventajas para los estudios traslacionales y la validación clínica. Las ventajas de su imagen tridimensional y micrométrica ya han mostrado aplicaciones en la determinación de la carga trombótica de los pacientes con isquemia miocárdica con elevación del ST44,45. El mapeo de las fuentes potenciales de arritmia en pacientes con enfermedad cardíaca estructural depende en gran medida de determinar la distribución del tejido cicatricial fibrótico y localizar las huellas entrelazadas del miocardio sobreviviente. Los enfoques de segunda línea para el diagnóstico de arritmias ventriculares utilizan imágenes por resonancia magnética46. Puede localizar robustamente la fibrosis densa, pero se limita a la caracterización morfológica de baja resolución y ofrece una visión limitada de la remodelación microestructural y las distribuciones difusas de las lesiones fibróticas47. El examen de alta resolución de la distribución y caracterización de la cicatriz tiene un gran potencial para mejorar nuestra comprensión de la remodelación estructural cardíaca y el riesgo de desarrollar insuficiencia cardíaca. En particular, los estudios de investigación fundamental o las investigaciones post mortem se beneficiarán de imágenes estructurales corroborativas para el mapeo eléctrico de la arritmia cardíaca.
En conclusión, los corazones reforzados con el tratamiento HMDS y el secado al aire se pueden teñir posteriormente con un agente de contraste de rayos X para mejorar la atenuación de rayos X de los componentes extracelulares. Específicamente, en el miocardio sano, la acumulación de PMA ocurre en el epitelio, el tejido valvular y los compartimentos del sistema de conducción ventricular revestidos por el tejido conectivo que resultaron en una mayor atenuación de los rayos X. Además, en el miocardio estructuralmente enfermo, el contraste mejorado fue aún más selectivo para la fibrosis.
Divulgaciones
Ninguno
Agradecimientos
Este estudio recibió apoyo financiero del Gobierno francés como parte del programa "Inversiones del Futuro" gestionado por la Agencia Nacional de Investigación (ANR), referencia de subvención ANR-10-IAHU-04 y la Fundación Leducq (red RHYTHM), así como la referencia de subvención ANR-17-CE14-0029-01 [UNMASC], financiación del Espacio Europeo de Investigación en Enfermedades Cardiovasculares (ERA-CVD), referencia de subvención H2020-HCO-2015_680969 [MultiFib] y financiación de la región francesa de Nueva Aquitania, referencias de subvención 2016 - 1R 30113 0000 7550/2016-1R 30113 0000 7553 y ANR-19-ECVD-0006-01.
Materiales
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Diapath | F0043 | |
| Calcium chloride solution | Honeywell | 21114 | |
| Canulation Tubing PTFE | VWR | DENE3400102 | |
| Constant Head 1L Reservoir | Harvard Apparatus | 50-0496 | |
| D-(+)-Glucose | Sigma | G5767 | |
| Ethanol absolute | VWR | 20821.330 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | 796881 | |
| Heparin sodium (5000 U/mL) | Panpharma | 3400891287301. | |
| Hexamethyldisilazane (HMDS) | Sigma | 440191-1L | |
| Hydrochloric acid, ACS reagent, 37% | Sigma | 258148 | |
| Magnesium chloride solution | Honeywell | 63020 | |
| Phosphate buffered saline (PBS) | Sigma | P5368 | |
| Phosphomolybdic acid hydrate | Fisher Scientific | 417895000 | |
| Potassium Chloride | Sigma | P5405 | |
| Pump Tubing, 3-Stop | Ismatec | FV-96328-48 | |
| SkyScan, 1276 | Bruker | micro CT | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium Chloride | Sigma | S3014 | |
| Sodium hydroxide solution 50% in H2O | Sigma | 415413 | |
| Tube Connector Kits | Harvard Apparatus | 72-1407 | |
| Tubing pump | Ismatec | ISM 1089 | |
| Tubing Tygon R-3603 1.6 mm 3.2 mm 0.8 mm | VWR | 228-1279 | |
| Tubing Tygon R-3603 3.2 mm 4.8 mm 0.8 mm | VWR | 228-1283 | |
| Two-part single-use syringes 50 mL | Norm-Ject | 4850001000 | Pyrogen-free, PVC-free |
Referencias
- Srinivasan, N. T., Schilling, R. J. Sudden cardiac death and arrhythmias. Arrhythmia & Electrophysiology Review. 7 (2), 111-117 (2018).
- Szumowski, L., et al. Mapping and ablation of polymorphic ventricular tachycardia after myocardial infarction. Journal of the American College of Cardiology. 44 (8), 1700-1706 (2004).
- Bode, K., et al. Ablation of polymorphic ventricular tachycardias in patients with structural heart disease. PACE - Pacing and Clinical Electrophysiology. 31 (12), 1585-1591 (2008).
- Enjoji, Y., et al. Catheter ablation of fatal ventricular tachyarrhythmias storm in acute coronary syndrome-role of Purkinje fiber network. Journal of Interventional Cardiac Electrophysiology. 26 (3), 207-215 (2009).
- Sinha, A. M., et al. Role of left ventricular scar and purkinje-like potentials during mapping and ablation of ventricular fibrillation in dilated cardiomyopathy. PACE - Pacing and Clinical Electrophysiology. 32 (3), 286-290 (2009).
- Peichl, P., Čihák, R., Koželuhová, M., Wichterle, D., Vančura, V., Kautzner, J. Catheter ablation of arrhythmic storm triggered by monomorphic ectopic beats in patients with coronary artery disease. Journal of Interventional Cardiac Electrophysiology. 27 (1), 51-59 (2010).
- Marrouche, N. F., et al. Mode of initiation and ablation of ventricular fibrillation storms in patients with ischemic cardiomyopathy. Journal of the American College of Cardiology. 43 (9), 1715-1720 (2004).
- Bänsch, D., et al. Successful catheter ablation of electrical storm after myocardial infarction. Circulation. 108 (24), 3011-3016 (2003).
- Yokoshiki, H., Mitsuyama, H., Watanabe, M., Mizukami, K., Tsutsui, H. Suppression of ventricular fibrillation by electrical modification of the Purkinje system in hypertrophic cardiomyopathy. Heart and Vessels. 29 (5), 709-717 (2014).
- Agress, C. M., Rosenberg, M. J., Jacobs, H. I., Binder, M. J., Schneiderman, A., Clark, W. G. Protracted shock in the closed-chest dog following coronary embolization with graded microspheres. The American journal of physiology. 170 (3), 536-549 (1952).
- Bolukoglu, H., Liedtke, A. J., Nellis, S. H., Eggleston, A. M., Subramanian, R., Renstrom, B. An animal model of chronic coronary stenosis resulting in hibernating myocardium. American Journal of Physiology - Heart and Circulatory Physiology. 263, 20-29 (1992).
- Capone, R. J., Most, A. S., Sydlik, P. A. Precordial ST segment mapping. A sensitive technique for the evaluation of myocardial injury. CHEST. 67 (5), 577-582 (1975).
- Dib, N., Diethrich, E. B., Campbell, A., Gahremanpour, A., McGarry, M., Opie, S. R. A percutaneous swine model of myocardial infarction. Journal of Pharmacological and Toxicological Methods. 53 (3), 256-263 (2006).
- Dogné, J. M., et al. Characterization of an original model of myocardial infarction provoked by coronary artery thrombosis induced by ferric chloride in pig. Thrombosis Research. 116 (5), 431-442 (2005).
- Eldar, M., Ohad, D., Bor, A., Varda-Bloom, N., Swanson, D. K., Battler, A. A closed-chest pig model of sustained ventricular tachycardia. Pacing and Clinical Electrophysiology. 17 (10), 1603-1609 (1994).
- Elzinga, W. E. Ameroid constrictor: uniform closure rates and a calibration procedure. Journal of applied physiology. 27 (3), 419-421 (1969).
- Hughes, G. C., Post, M. J., Simons, M., Annex, B. H. Translational physiology: Porcine models of human coronary artery disease: Implications for preclinical trials of therapeutic angiogenesis. Journal of Applied Physiology. 94 (5), 1689-1701 (2003).
- Lichtig, C., Brooks, H., Chassagne, G., Glagov, S., Wissler, R. W. Basic fuchsin picric acid method to detect acute myocardial ischemia. An experimental study in swine. Archives of Pathology and Laboratory Medicine. 99 (3), 158-161 (1975).
- Näslund, U., Häggmark, S., Johansson, G., Pennert, K., Reiz, S., Marklund, S. L. Effects of reperfusion and superoxide dismutase on myocardial infarct size in a closed chest pig model. Cardiovascular Research. 26 (2), 170-178 (1992).
- Reffelmann, T., et al. A novel minimal-invasive model of chronic myocardial infarction in swine. Coronary Artery Disease. 15 (1), 7-12 (2004).
- Reimer, K. A., Lowe, J. E., Rasmussen, M. M., Jennings, R. B. The wavefront phenomenon of ischemic cell death. 1. Myocardial infarct size vs duration of coronary occlusion in dogs. Circulation. 56 (5), 786-794 (1977).
- Salazar, A. E. Experimental myocardial infarction. Induction of coronary thrombosis in the intact closed-chest dog. Circulation research. 9, 1351-1356 (1961).
- Takahashi, M., et al. Effects of angiotensin I-converting enzyme inhibitor and angiotensin II type 1 receptor blocker on the right ventricular sarcoglycans and dystrophin after left coronary artery ligation. European Journal of Pharmacology. 522 (1-3), 84-93 (2005).
- Gonzalez-Tendero, A., et al. Whole heart detailed and quantitative anatomy,myofibre structure and vasculature from X-ray phase-contrast synchrotron radiation-basedmicro computed tomography. European Heart Journal Cardiovascular Imaging. 18 (7), 732-741 (2017).
- Teh, I., et al. Resolving fine cardiac structures in rats with high-resolution diffusion tensor imaging. Scientific Reports. 6, 30573 (2016).
- Teh, I., et al. Validation of diffusion tensor MRI measurements of cardiac microstructure with structure tensor synchrotron radiation imaging. Journal of Cardiovascular Magnetic Resonance. 19 (1), 31 (2017).
- Abouezzeddine, O., et al. Relevance of endocavitary structures in ablation procedures for ventricular tachycardia. Journal of Cardiovascular Electrophysiology. 21 (3), 245-254 (2010).
- Pambrun, T., et al. Epicardial course of the septopulmonary bundle: Anatomical considerations and clinical implications for roof line completion. Heart Rhythm. 18 (3), 349-357 (2021).
- Pallares-Lupon, N., et al. Optimizing large organ scale micro computed tomography imaging in pig and human hearts using a novel air-drying technique. bioRxiv. , (2021).
- Martins, R. P., et al. Dominant frequency increase rate predicts transition from paroxysmal to long-term persistent atrial fibrillation. Circulation. 129 (14), 1472-1482 (2014).
- Puchtler, H., Waldrop, F. S., Valentine, L. S. Fluorescence microscopic distinction between elastin and collagen. Histochemie. 35 (1), 17-30 (1973).
- Walton, R. D., et al. Compartmentalized Structure of the Moderator Band Provides a Unique Substrate for Macroreentrant Ventricular Tachycardia. Circulation: Arrhythmia and Electrophysiology. 11 (8), 005913 (2018).
- Di Diego, J. M., Sicouri, S., Myles, R. C., Burton, F. L., Smith, G. L., Antzelevitch, C. Optical and electrical recordings from isolated coronary-perfused ventricular wedge preparations. Journal of Molecular and Cellular Cardiology. 54, 53-64 (2013).
- Pauwels, E., Van Loo, D., Cornillie, P., Brabant, L., Van Hoorebeke, L. An exploratory study of contrast agents for soft tissue visualization by means of high resolution X-ray computed tomography imaging. Journal of Microscopy. 250 (1), 21-31 (2013).
- Mulet, A. Book Review: Modern Drying Technology, Volume 3: Product Quality and Formulation , edited by E. Tsotsas and A. S. Mujumdar. Drying Technology. 32 (2), 244-245 (2014).
- Karimi, B., Golshani, B. Mild and highly efficient method for the silylation of alcohols using hexamethyldisilazane catalyzed by iodine under nearly neutral reaction conditions. Journal of Organic Chemistry. 65 (21), 7228-7230 (2000).
- Dunmore-Buyze, P. J., et al. Three-dimensional imaging of the mouse heart and vasculature using micro-CT and whole-body perfusion of iodine or phosphotungstic acid. Contrast Media and Molecular Imaging. 9 (5), 383-390 (2014).
- Disney, C. M., Madi, K., Bodey, A. J., Lee, P. D., Hoyland, J. A., Sherratt, M. J. Visualising the 3D microstructure of stained and native intervertebral discs using X-ray microtomography. Scientific Reports. 7 (1), 16279 (2017).
- Descamps, E., Sochacka, A., de Kegel, B., Van Loo, D., Hoorebeke, L., Adriaens, D. Soft tissue discrimination with contrast agents using micro-ct scanning. Belgian Journal of Zoology. 144 (1), (2014).
- Buytaert, J., Goyens, J., De Greef, D., Aerts, P., Dirckx, J. Volume shrinkage of bone, brain and muscle tissue in sample preparation for micro-CT and light sheet fluorescence microscopy (LSFM). Microscopy and Microanalysis. 20 (4), 1208-1217 (2014).
- Nierenberger, M., Rémond, Y., Ahzi, S., Choquet, P. Assessing the three-dimensional collagen network in soft tissues using contrast agents and high resolution micro-CT: Application to porcine iliac veins. Comptes Rendus - Biologies. 338 (7), 425-433 (2015).
- Speck, U. . General principles of x-ray contrast media. X-Ray Contrast Media. , (2018).
- Rajasekar, A., Trew, M. L., Sands, G. B. . Understanding and enhancing the use of micro-computed tomography in soft tissue. , (2015).
- Karagiannidis, E., et al. Micro-CT-based quantification of extracted thrombus burden characteristics and association with angiographic outcomes in patients with ST-elevation myocardial infarction: The QUEST-STEMI Study. Frontiers in Cardiovascular Medicine. 8, 646064 (2021).
- Karagiannidis, E., et al. Serum ceramides as prognostic biomarkers of large thrombus burden in patients with stemi: A micro-computed tomography study. Journal of Personalized Medicine. 11 (2), 89 (2021).
- Hennig, A., et al. High-resolution three-dimensional late gadolinium-enhanced cardiac magnetic resonance imaging to identify the underlying substrate of ventricular arrhythmia. Europace : European Pacing, Arrhythmias, and Cardiac Electrophysiology: Journal of the Working Groups on Cardiac Pacing, Arrhythmias, and Cardiac Cellular Electrophysiology of the European Society of Cardiology. 20, 179-191 (2018).
- Lorgis, L., et al. Relationship between fragmented QRS and no-reflow, infarct size, and peri-infarct zone assessed using cardiac magnetic resonance in patients with myocardial infarction. Canadian Journal of Cardiology. 30 (2), 204-210 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados