Method Article
Gewebepräparationstechniken für die kontrastverstärkte Mikro-Computertomographie-Bildgebung von Herzmodellen großer Säugetiere mit chronischen Erkrankungen
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll vor, um hochauflösende Mikrocomputertomographie-Bilder von gesunden und pathologischen großen Säugetier-Vollherzen mit kollagenselektiver Kontrastverstärkung zu erhalten.
Zusammenfassung
Der strukturelle Umbau ist eine häufige Folge chronischer pathologischer Belastungen, die dem Herzen auferlegt werden. Das Verständnis der architektonischen und zusammengesetzten Eigenschaften von erkranktem Gewebe ist entscheidend, um ihre Wechselwirkungen mit arrhythmischem Verhalten zu bestimmen. Der mikroskalige Gewebeumbau unterhalb der klinischen Auflösung entwickelt sich zu einer wichtigen Quelle für tödliche Arrhythmie mit hoher Prävalenz bei jungen Erwachsenen. Es besteht nach wie vor die Herausforderung, einen hohen Bildkontrast bei ausreichender Auflösung im Mikromaßstab für präklinische Modelle, wie z. B. große Säugetier-Ganzherzen, zu erzielen. Darüber hinaus fehlt es noch an einer selektiven Kontrastverstärkung der Gewebezusammensetzung für die dreidimensionale hochauflösende Bildgebung. Zerstörungsfreie Bildgebung mit Mikro-Computertomographie ist vielversprechend für hochauflösende Bildgebung. Ziel war es, das Leiden durch Röntgen über Dämpfung in großen biologischen Proben zu lindern. Die Herzen wurden von gesunden Schweinen (N = 2) und Schafen (N = 2) mit entweder induziertem chronischem Myokardinfarkt und fibrotischer Narbenbildung oder induziertem chronischem Vorhofflimmern extrahiert. Ausgeschnittene Herzen wurden durchblutet mit: einer Kochsalzlösung, die mit einem Calciumionen-Abschreckmittel und einem Vasodilatator, Ethanol in serieller Dehydratisierung und Hexamethyldisilizan unter Vakuum ergänzt wurde. Letzteres verstärkte die Herzstruktur während der Lufttrocknung für 1 Woche. Kollagen-dominantes Gewebe wurde selektiv durch ein Röntgenkontrastmittel gebunden, die Phosphomolybdsäure. Die Gewebekonformation war in der Luft stabil, so dass langzeitige Mikrocomputertomographie-Aufnahmen hochauflösende (isotrope 20,7 μm) Bilder erhalten konnten. Eine optimale Kontrastmittelbeladung durch Diffusion zeigte eine selektive Kontrastverstärkung der Epithelschicht und subendokardialen Purkinje-Fasern in gesunden Schweineventrikeln. Vorhofflimmern (AF) Herzen zeigten eine erhöhte Kontrastansammlung in den hinteren Wänden und Anhängseln der Vorhöfe, die auf einen höheren Kollagengehalt zurückzuführen ist. Myokardinfarktherzen zeigten selektiv einen erhöhten Kontrast in Regionen der Herzfibrose, was die Identifizierung von verwebten überlebenden Myokardmuskelfasern ermöglichte. Kontrastverstärkte luftgetrocknete Gewebepräparate ermöglichten eine mikroskalige Bildgebung des intakten großen Säugetierherzens und eine selektive Kontrastverstärkung der zugrunde liegenden Krankheitsbestandteile.
Einleitung
Strukturelle Herzerkrankungen machen weltweit den Großteil der kardialen Mortalität aus1. Der Umbau der Herzstruktur beeinflusst die myokardiale Umgebung und den interstitiellen Raum. Da sowohl die elektrische als auch die mechanische Herzfunktion von der Organisation der Myozyten abhängt, kann eine Störung zu unerträglichen Herzrhythmusstörungen, beeinträchtigten blutpumpenden Aktionen und Herzinsuffizienzführen 2,3,4,5,6,7,8,9. Die Entwicklung kurativer Therapien für strukturelle Herzerkrankungen wird durch die Krankheitsprävalenz 2,5 bei weitem aufgewogen. Daher entstehen immer mehr präklinische Modelle struktureller Herzerkrankungen, um die anatomomorphologischen Profile und die daraus resultierende Pathogenese von Herzrhythmusstörungen 10,11,12,13,14,15,16,17,18,19,20 besser zu verstehen. 21,22,23 Beobachtet im gesamten strukturellen Krankheitsspektrum ist die Hochregulierung der interstitiellen Fibrose und, häufiger in ischämiebedingten Fällen, der Myokardersatz durch Fibrose und Fettgewebe18. Das morphologische Verständnis pathologischer extrazellulärer Komponenten kann die Identifizierung potenzieller Substrate von Arrhythmien ermöglichen. Die Verteilung und das Ausmaß der Krankheit liefern starke Indikatoren für ein arrhythmogenes Risiko. Es besteht jedoch nach wie vor die Herausforderung, Krankheitsprofile durch die Integration von Makro- und Mikroskalen in das intakte Herz umfassend abzubilden.
Die Mikro-Computertomographie (Mikro-CT), basierend auf Röntgenstrahlen, entwickelt sich zu einem leistungsfähigen Werkzeug, um die Mikrostruktur des weichen biologischen Gewebes mit Kontrastmitteln zu untersuchen. Hochdetaillierte anatomische Karten wurden für Herzen von kleinen Nagetieren 24,25,26 und kleine sezierte Proben von großen Säugetierherzen 27,28 erhalten. Die Bildgebung auf der gesamten Organebene großer Säugetierherzen weist jedoch übermäßige Weglängen auf, über die Röntgenphotonen mit herkömmlichen Gewebepräparationstechniken abgeschwächt werden. Dies beinhaltet das Kontrastladen des Gewebes und das Eintauchen der Probe in ein Kontrastmittellösungsmittel während der Beschaffung. Die Erhöhung der Stichprobengröße und -auflösung führt zu einer Verlängerung der Gesamterfassungszeit. Daher wird die Gewebestabilität entscheidend für eine brauchbare Bildrekonstruktion, was bedeutet, dass Gewebeverformungen durch Austrocknung verhindert werden müssen. Die Verwendung einer Tauchflüssigkeit hat jedoch Nachteile: (i) die Gesamtintensität des Hintergrundsignals wird nicht zu vernachlässigen und (ii) fördert die Verdünnung von gewebegebundenen Kontrastmolekülen. Beide Faktoren tragen dazu bei, den Bildkontrast zu verringern.
Diese Studie beschreibt eine neuartige Gewebeverarbeitungspipeline zur Linderung der Photonendämpfung im Hintergrund und zur Optimierung des Dynamikumfangs von Kontrastverstärkungsmitteln. Es wird empfohlen, einen Gewebelufttrocknungsansatz mit chemischer Gewebeverstärkung zu verwenden, um die Gewebeverformungzu begrenzen 29. Daher können Gewebeproben für lange Aufnahmen in der Luft stabil bleiben und Hintergrundbeiträge von Tauchflüssigkeiten weglassen. Diese methodische Pipeline bietet: (i) ein umfassendes Gewebeverarbeitungs- und Bildgebungsprotokoll, das mit ganzen Schweineherzen optimiert ist; (ii) eine Bewertung der Kontrastkonzentrations- und Belastungstechniken und (iii) die Anwendung dieser Pipeline in zwei verschiedenen chronischen Krankheitsmodellen von Vorhofflimmern und Myokardinfarkt bei Schafsherzen. Die Entwicklung der chronischen Krankheitsmodelle wurde an anderer Stelle für jedes Modell der chronischen Herzerkrankung, den durch perkutane Koronararterienembolisation induzierten Myokardinfarkt13 und das selbsterhaltende Vorhofflimmern30 beschrieben.
Protokoll
Alle Versuche wurden nach den Richtlinien der Richtlinie 2010/63/EU des Europäischen Parlaments zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere durchgeführt. Tierprotokolle wurden vom lokalen Ethikkomitee (CEEA50) der Universität Bordeaux genehmigt. Die Herzen wurden von drei großen Säugetiermodellen bezogen, darunter (i) gesunde große weiße Schweine (N = 2, 2 Monate alt); (ii) Schafe (N = 1, 2 Jahre alt) mit induziertem Myokardinfarkt13 und (iii) Schafe (N = 1, 7 Jahre alt) mit induziertem Vorhofflimmern30.
1. Lösungsvorbereitung:
- Herz-Kreislauf-Lösung: Bereiten Sie 3 L destilliertes Wasser vor und fügen Sie Natriumchlorid (110 mM), Kaliumchlorid (16 mM), Natriumbicarbonat (10 mM), D-(+)-Glucose (9 mM), Calciumchloridlösung (1,2 mM) und Magnesiumchloridlösung (16 mM) hinzu. Am Ende 500 μL/L Heparin-Natrium hinzufügen. Bewahren Sie diese Lösung bei 4 °C auf.
- Phosphatgepufferte Kochsalzlösung - EDTA-Lösung (PBS-EDTA).
- Zuerst fügen Sie Ethylendiamintetraessigsäure (EDTA) zu 1 l destilliertem Wasser für eine Endkonzentration von 10 mM hinzu. Erhöhen und halten Sie einen Lösungs-pH-Wert von 12 mit Natriumhydroxidlösung (1 M), um die EDTA aufzulösen.
- Sobald das EDTA vollständig gelöst ist, senken Sie den pH-Wert mit Salzsäure auf 7,4. Fügen Sie einen Folienbeutel mit phosphatgepufferter Kochsalzlösung hinzu, um eine Lösung bei 0,01 M (Natriumchlorid, 0,138 M; Kaliumchlorid, 0,0027 M) und pH 7,4 zu erhalten. Bewahren Sie diese Lösung bei Raumtemperatur (RT) auf.
- Ethanol - Phosphomolybdsäure (PMA) Kontrastmittellösung: Bereiten Sie 1 L absolutes Ethanol vor und fügen Sie die PMA hinzu, um eine Lösung in 1% der Konzentration zu erhalten. Bewahren Sie diese Lösung bei RT.
2. Quelle des Gewebes
- Euthanasieren Sie das Tier und extrahieren Sie das Herz gemäß den lokalen ethischen Richtlinien. Tauchen Sie das Herz schnell in eine kalte kardioplegikerische Lösung ein und massieren Sie die Ventrikel sanft zum anfänglichen Spülen.
- Achten Sie darauf, die Aorta unterhalb des Aortenbogens zu schneiden und zwei Seiten der Arterienwand mit Nadelhaltern zu klemmen.
- Wenn Sie das Herz an den Nadelhaltern aufhängen, führen Sie eine Aortenkanüle in die Aortenwurzel ein und achten Sie darauf, dass Sie die Aortenklappen nicht berühren oder durch sie hindurchragen. Wickeln Sie eine 0-Gauge-Naht auf Höhe der Kanüle um den Aortenbogen und binden Sie die Kanüle fest an Ort und Stelle.
- Injizieren Sie mit 50-ml-Spritzen 200 ml kalte (4 °C) kardioplegiöse Lösung. Entfernen Sie überschüssiges Blut, das sich in den Hohlräumen ansammelt, indem Sie das Herz auf die hintere Seite kippen, um über die Lungenvenen abfließen zu können.
- Tauchen Sie das gespülte Herz ein und bewahren Sie es in kalter kardioplegischer Lösung auf, die auf Eis aufbewahrt wird, bis sie zur Dissektion bereit sind.
3. Gewebepräparation:
- Bereiten Sie einen 1-Liter-Behälter vor, der 80 cm über einer Sezierschale getragen wird. Koppeln Sie ein thermoplastisches Rohr mit einer Länge von 80 cm und einem Innendurchmesser von 3,2 mm und einem Außendurchmesser von 4,8 mm an einen Abflussanschluss des Reservoirs.
- Befestigen Sie einen Drei-Wege-Wasserhahn am Entwässerungsschlauch und koppeln Sie weitere thermoplastische Schläuche (20 cm, 1,6 mm Innendurchmesser und 3,2 mm Außendurchmesser) an jeden freien Anschluss am Drei-Wege-Wasserhahn. Befestigen Sie Zwei-Wege-Wasserhähne an den Gebührenenden des Schlauchs.
- Füllen Sie das Reservoir mit der kardioplegikerischen Lösung, die mit Heparin (2500 Einheiten) ergänzt wird. Öffnen Sie die Wasserhähne, damit die kardioplegiöse Lösung abtropfen und alle Luftblasen entfernen kann, und schließen Sie dann die Zwei-Wege-Wasserhähne.
- Kanülen für linke und rechte Koronarostien mit Polytetrafluorethylen (PTFE) -Schläuchen (1 mm Innendurchmesser und 2 mm Außendurchmesser) vorbereiten.
- Schneiden Sie 5 cm Schlauch und erhitzen Sie ein Ende, indem Sie die Spitze neben eine offene Flamme legen. Sobald 1 mm der Spitze zu schmelzen beginnt und durchscheinend wird, drücken Sie die Spitze gegen eine harte, hitzebeständige Oberfläche, um einen Grat an der Kanülenspitze zu formen, um zu verhindern, dass Kanülen aus den Gefäßen rutschen.
- Führen Sie 1 cm des nicht beheizten Endes jeder Kanüle in die beiden Enden des Abflussbehälter-Entwässerungsschlauchs ein.
- Entfernen Sie die Aortenkanüle. Unter kalter kardioplegischer Lösung lokalisieren Sie die linke und rechte Ostie der Koronararterien.
- Trennen Sie mit einer spitzen Schere vorsichtig die Aortenwurzel vom umgebenden Gewebe oberhalb und unterhalb der Koronarostia, um das Einfädeln einer 0 G Seidennaht unter dem Koronargefäß zu ermöglichen.
- Öffnen Sie die Zwei-Wege-Hähne und führen Sie die Kanülenspitzen in die koronare Ostia ein. Wenn sich die Kanülenspitzen 1-2 cm in die Ostia und über die Nahtplatzierung hinaus erstrecken, binden Sie die Kanülen ab.
- Spülen Sie das Herz, während Sie die Ventrikel 15 Minuten lang sanft massieren, bis das Herz von Blut befreit ist.
- Schließen Sie nach dem Spülen die Zwei-Wege-Wasserhähne und trennen Sie sie vom Drei-Wege-Wasserhahn. Überführen Sie das Herz in einen chemikalienbeständigen 1-Liter-Kunststoffbehälter, der 500 ml PBS-EDTA-Lösung enthält.
- Rezirkulieren Sie PBS-EDTA-Lösung im thermoplastischen Schlauch unter einem Abzug mit einer Peristaltikpumpe mit zwei Kanälen. Grundieren Sie den Pumpenschlauch, bis der Schlauch keine Luftblasen aufweist, und durchbluten Sie dann jede Koronararterienkanüle durch Rezirkulation bei RT für 2 h bei 80 ml / min.
- Stellen Sie sicher, dass der Abzug betriebsbereit ist. Stoppen Sie die Pumpe, lassen Sie die Lösung aus dem Behälter ab und ersetzen Sie sie durch Formalin (10%) zur Fixierung für 1 h bei RT bei 80 ml/min.
- Ersetzen Sie die Formalinlösung durch PBS, um das Fixiermittel dreimal für jeweils 15 min bei 80 ml/min zu spülen.
4. Gewebeaustrocknung und -trocknung:
HINWEIS: Verwenden Sie die gleiche Perfusionsrate (80 ml/min) und lassen Sie das Gewebe durchgehend bei RT verbleiben.
- Ersetzen Sie PBS-Lösung durch Ethanol bei 20%, verdünnt in Reinstwasser und Perfuse für mindestens 3 h.
- Durchbluten Sie das Herz mit einer Reihe von zunehmenden Ethanolkonzentrationen.
- Beginnen Sie mit dem Ersetzen der 20% igen Ethanollösung durch Ethanol, das auf 30% verdünnt ist, und perfusionieren Sie für 2 h.
- Wiederholen Sie die Perfusion, indem Sie die Ethanolkonzentration bei jeder Iteration um 40%, 50%, 60%, 65%, 70%, 75%, 80%, 95%, 90%, 95%, 99% und 100% für eine Mindestdauer von 1 h bei jedem Schritt (Konzentration) erhöhen.
HINWEIS: Herzproben können bei jeder Ethanolverdünnung über Nacht ohne Perfusionsfluss ruhen, wenn für diese Konzentration eine Mindestperfusion von 15 min stattgefunden hat.
- OPTIONAL: Wenn Sie Kontrastmittel über Perfusion anwenden, perfusionieren Sie das Herz mit 100% Ethanol, ergänzt mit dem Kontrastmittel PMA, 1% für 48 h. Spülen Sie das Kontrastmittel durch Perfusion mit 100% Ethanol für 2 h.
- Um das Herzgewebe vor der Lufttrocknung zu stärken, rezirkulieren Sie eine 50:50-Mischung aus Ethanol und Hexamethyldisilazan (HMDS) für 10 min. Folgen Sie diesem durch 100% HMDS für weitere 2 h.
ACHTUNG: HMDS ist eine hochgiftige und schädliche Substanz. Ein starker Geruch von Ammoniak wird in Kontakt mit Luft freigesetzt. Darüber hinaus ist die flüssige Form von HMDS sehr flüchtig und wird durch jodhaltige Mittel katalysiert. - Trennen Sie die Kanülen vom Schlauch und hängen Sie das Herz an einer Aortennaht im Abzug.
- Schieben Sie vorsichtig einen Reißverschlussbeutel über das Herz und schließen Sie die Beuteldichtung über der Naht, um die Exposition des Herzens gegenüber zirkulierender Luft zu reduzieren. Lassen Sie das Herz 1 Woche lang durch Verdunstung trocknen.
- OPTIONAL: Für diffusionsbelastende Kontrastmittel waschen Sie das Herz in 100% Ethanol für 15 Minuten während des Rührens. Tauchen Sie das Herz in 100% Ethanol, ergänzt mit PMA, 1%, für 48 h unter Vakuum. Wiederholen Sie Schritt 4.6.
5. Mikro-CT:
HINWEIS: Ein Desktop-Röntgen-MikroCT-System wurde für die Bildgebung von Schweineherzen verwendet.
- Montieren Sie das luftgetrocknete Herz auf einen geeigneten Probenhalter. Verhindern Sie jede Bewegung während der Röntgen-MikroCT-Messungen mit einer Klemme, die am Probenhalter verankert ist, und sichern Sie das Herz über die getrocknete und starre Aorta.
- Richten Sie das Zentrum der Herzprobe entlang ihrer Längsachse akribisch mit dem Zentrum des Bildfeldes für 0°- und 90°-Drehwinkel aus. Um dies in allen Ausrichtungen zu erreichen, hängen Sie das Herz über eine an der Probenstütze befestigte Aortenklemme in der Luft auf.
- Nach dem Öffnen der Software und dem Initiieren des RöntgenmikroCT-Systems legen Sie den Röntgenfilter Aluminium, 1 mm, Röntgenquellenspannung auf 60 kV und Strom auf 120 μA an. Stellen Sie die Bildabmessungen auf 2016 x 1344 Pixel und die Pixelgröße auf 20 μm ein.
- Ziehen Sie den Probenhalter aus dem Sichtfeld zurück und kalibrieren Sie das Hintergrundbild und die Röntgenbelichtungszeit, indem Sie eine Flachfeldkorrektur erhalten. Stellen Sie sicher, dass die durchschnittliche Röntgenübertragung im Hintergrund mehr als 80 % beträgt.
- Scouten Sie Röntgenübertragungsbilder entlang der Länge der Unterstützung, um das gesamte Bildgebungsfeld in der Längsachse des Herzens zu bestimmen. Verwenden Sie für das Scannen einen Drehschritt von 0,18°, einen Frame-Mittelwert von 5 und eine Sample-Drehung von 180°. Wählen Sie den Offset-Scanmodus aus, um die volle Breite der Beispielunterstützung abzubilden.
HINWEIS: Die in diesem Abschnitt angegebenen Erfassungsparameter wurden ausgewählt, um die Bildqualität der Herzkomposition des Ensembles zu optimieren. - Verwenden Sie nach dem Scannen die Software zur tomographischen Rekonstruktion eines isotropen dreidimensionalen Bildvolumens. Verwenden Sie für die Anwendung der NRecon-Software eine erfassungsbezogene Artefaktkorrektur, einschließlich Strahlhärtungseffekten von 10% und Ringartefaktreduktion von 8.
- Um die Einschränkungen der Datenspeicherung zu optimieren, wenden Sie den minimalen rechteckigen Bereich von Interesse an, der herzspezifische Bildvoxel umfasst. Exportieren Sie die Bilder in einem 8-Bitmap-Format als Bildstapel.
- Visualisieren Sie den rekonstruierten Datenstapel mit der DataViewer-Software. Richten Sie die Probe innerhalb der Bildgrenzen digital aus, um die langen und kurzen Achsen der Probe mit den drei Hauptachsen des Bildvolumens neu auszurichten.
- Schneiden Sie das Bildvolumen in allen drei Achsen zu, um äußere Hintergrundebenen des Bildes zu entfernen und die Gesamtbildgröße maximal zu reduzieren.
Ergebnisse
Die Herstellung von großen Säugetierherzen mit der Dehydratisierungs- und Lufttrocknungsmethode entfernt den gesamten Wassergehalt aus der Probe. Hinweise auf einen unzureichenden Wasserersatz durch Ethanol können während der HMDS-Belastung beobachtet werden (siehe Protokoll, Schritt 4.4). Das Vorhandensein von Wasser unter HMDS erzeugt Blasen, die aus dem Gewebe aufsteigen. Bei zu hohen Wasserständen kann es zu einem Temperaturanstieg der Tauchflüssigkeit kommen. Wenn die Tauchkammer während der anfänglichen HMDS-Belastung von Eis umgeben bleibt, können die negativen Auswirkungen der Gewebeerwärmung verringert werden. Nach dem Lufttrocknen der Herzen in Abwesenheit von Kontrastmitteln erscheint die Probe weiß (siehe Protokoll, Schritt 4.6). Die äußere Oberfläche war oft getrocknet und strukturstabil vor intramuralen Schichten. Durch das Einspülen in Ethanol vor dem Einbringen von Kontrastmitteln wurde die weiße Ablagerung entfernt (siehe Protokoll, Schritt 4.7). Das Durchschneiden von Gewebe mit einer scharfen Klinge zeigt makroskopisch einzelne Muskelfasern mit klarer Trennung. Die Kontrastbelastung durch Eintauchen von Herzproben in Kontrastmittelmedium litt unter Diffusionsgrenzartefakten in dicken und stark muskulösen Regionen der Probe. Die Diffusionskontrastbelastung unter Vakuum sorgte für eine homogenere Färbung des Muskels (Herzprobe #1, siehe Tabelle 1 für Kontrastmittelladezeiten). Makroskopisch zeigte die Verteilung des Oberflächenkontrastmittels eine inhomogene Färbung zwischen Herzmuskel und Regionen, die hauptsächlich aus extrazellulären Komponenten, insbesondere Fett und Bindegewebe, bestanden. Luftgetrocknete Gewebeproben, entweder vor oder nach dem Laden von Kontrastmitteln, behielten eine stabile strukturelle Integrität bei.
Die Zeit, die benötigt wurde, um die volle Breite der Probe mit einer Auflösung von 20 μm unter MikroCT unter Verwendung der oben genannten Scanparameter und einer Belichtungszeit von 1700 ms zu scannen, betrug 6 h 34 min. Abhängig von der Größe der Probe in der Portalachse des Scanners wurde diese Dauer mit der Anzahl der Positionen multipliziert, die benötigt wurden, um die gesamte Länge der Probe zu erfassen. Für Schweine- und Schafherzen wurden in dieser Studie drei bis vier Positionen verwendet. Die NRecon-Software kachelte die Multipositions- und Offset-Scans zu einem einzigen Röntgenprojektionsbild für jeden Rotationsschritt der Röntgenquelle und des Detektors. Insgesamt werden 1000 Projektionen als 16-Bit-Bilder gespeichert und erzeugen 30-40 GB Daten. Rekonstruierte volumetrische Bilder waren 52-70 GB.
Wichtige anatomische Orientierungspunkte, einschließlich der Ventrikelhohlräume, des Septums und der freien Wände der Ventrikel, waren leicht aus der Röntgenübertragungsbildgebung von luftgetrockneten Schweineherzen zu erkennen, die durch Diffusionsbelastung mit Kontrastmittel gefärbt waren (Abbildung 1A). Darüber hinaus wurden auch stark texturierte Regionen beobachtet, die auf eine mikrostrukturelle Organisation hinweisen, wie z. B. die Orientierung der Myokardfaser, aufgrund der empfindlichen Röntgendämpfung/-transmission (Abbildung 1B). Tomographische Rekonstruktionen dreidimensionaler Bildvolumina zeigten eine deutliche Trennung zwischen Gewebe und Hintergrund sowohl an epikardialen als auch an endothelialen Grenzen (Abbildung 1D). Intramural wurden ein diffusionsgradienter mit niedrigem Kontrast und Voxelintensität in dicken transmuralen Regionen des Gewebes beobachtet. Trotzdem waren Gefäß- und Myokardfasern, die durch Spaltebenen getrennt waren, immer noch leicht zu identifizieren. Eine zweite höhere Intensitätsbandbreite des Kontrastes wurde an der epikardialsten Schicht und in punktierenden subendokardialen Regionen beobachtet. Die Kontrastverstärkung war an Stellen am größten, an denen sich extrazelluläre Komponenten angesammelt hatten, insbesondere epikardiales Bindegewebe, Epikardfett und die Bindegewebsscheide des Purkinje-Fasernetzwerks. Voxel-Signalintensitätsverteilungen zeigten eine hohe Trennung vom Nullintensitätshintergrund (Luft) und zwei dominanten Populationen von Gewebe mit niedrigem und hohem Kontrast (Abbildung 1D).
Um die Kontrastverstärkung von MikroCT-Bildrekonstruktionen und die Selektivität zu kollagenen Kompartimenten der Herzproben zu validieren, wurden Histologie, Hellfeldmikroskopie und Fluoreszenzmikroskopie eingesetzt (Abbildung 2). Ein transmuraler Block ventrikulären Gewebes aus einem luftgetrockneten Herzen ohne vorherige Kontrastmittelbelastung wurde für die Paraffineinbettung und -schnitte vorbereitet. Benachbarte Gewebeschnitte, die auf Objektträgern montiert waren, wurden entweder durch Massons trichrome Färbung, keine Behandlung, oder 48 h PMA (1%) behandelt. Das Eintauchen von auf Objektträgern montierten Gewebeschnitten eliminierte Diffusionsgradienteneffekte des Färbeprozesses, der in ganzen Herzproben beobachtet wurde. Masons trichrome Färbung zeigte eine kollagenpositive Färbung an den Epithel- und Endothelschichten, perivaskulär im subepikardialen Gewebe und eine Bindegewebsscheide, die eine frei laufende Purkinje-Faser umgibt, die in die linke Ventrikelhöhle ragt (Abbildung 2A). Die Hellfeldbeleuchtung zeigte nach der PMA-Färbung eine dunklere Färbung in kollagenen Strukturen, was die bevorzugte Akkumulation von PMA unterstützt (Abbildungen 2B,C). Darüber hinaus wurde bisher gezeigt, dass die PMA-Behandlung die Autofluoreszenz von kollagenmakromolekularen Komplexenstillt 31. Fluoreszierende Bilder von ventrikulären Gewebeschnitten wiesen einen PMA-induzierten Fluoreszenzverlust an Kollagenstellen auf (Abbildung 2D vs. 2E, Abbildung 2D' vs. 2E' und Abbildung 2D'' vs. 2E''). Sowohl in der Hellfeld- als auch in der Fluoreszenzbildgebung wurden die zellulären Kompartimente durch die PMA-Behandlung nicht verändert, und Kollagen hatte eine selektive Ansammlung von PMA-Färbung und Abschreckung der Autofluoreszenz.
Herzprobe #2 wurde vor der Lufttrocknung durch Perfusion mit einem Kontrastmittel gefärbt. Die Bildrekonstruktion zeigte eine stark lückenhafte Färbung innerhalb des Myokardkompartiments (Abbildung 3A). Die Kontrastverstärkung schien in Bezug auf die Gewebezusammensetzung unselektiv zu sein, ohne dass die Signalintensität in den epikardialen oder subendokardialen Regionen weiter erhöht wurde. Darüber hinaus zeigte kontrastarmes Gewebe eine schlechte Trennung von der Hintergrundintensität (Abbildung 3B).
Ventrikuläre Fibrose wurde durch Myokardinfarkt und chronische Ischämie induziert (Herzprobe #3). Eine anteroapikale Narbe wurde gebildet, indem Myozyten durch fibro-fettige Ablagerungen im Gewebe stromabwärts zum Ort der vaskulären Embolisation ersetzt wurden. Herzprobe #3 wurde von einem sezierten Ventrikelkeil vorbereitet und abgebildet, der den vorderen linken Ventrikel, das Septum und die rechte ventrikuläre freie Wand bedeckte. Die Vorbereitung dieser ventrikulären Keilkonfiguration wurde zuvorbeschrieben 32 und die Anwendung von Keilen für die kardiale Bildgebung wurde im Detail überprüft33. Die Narbenmorphologie war transmural, aber heterogen (Abbildung 4). Eine zentrale dichte fibrotische Läsion war von einer lockeren und heterogenen Grenzzone umgeben (Abbildung 4A). Die ventrikuläre Zubereitung wurde durch Diffusionsbelastung nach der Lufttrocknung und im Vakuum gefärbt. Abbildung 4B-E zeigt die größten Signalintensitäten rekonstruierter MikroCT-Bildvolumina an den Gewebegrenzen und Narbenregionen. Kontrastmittel färbten gesundes Myokard schlecht an, aber der mikrostrukturelle Kontrast blieb erhalten (Abbildung 4C'). In der Grenzzone wurde Narbengewebe mit überlebendem Myokard durchsetzt (Abbildung 4D'). Die dichte Fibrose erschien transmural, aber strukturiert, was auf Varianzen in der Zusammensetzung hinweist (Abbildung 4E'). Gewebeschnitte einer transmuralen linksventrikulären Region des luftgetrockneten und PMA-gefärbten Gewebepräparats wurden verwendet, um die PMA-Selektivität für Kollagen in pathologischem Gewebe zu validieren, indem sie mit der trichromen Färbung von Masson verglichen wurden (Abbildung 4F). Die PMA-Färbung war selektiv für Kollagen (Subepikard und Subendokard) und fehlte in Regionen des überlebenden Myokards (Abbildung 4G).
Herzprobe #4 mit induziertem persistierendem Vorhofflimmern wurde luftgetrocknet, wobei die native Form der Vorhofhöhle erhalten blieb. Ein Kollaps des Vorhofanhangs wurde nicht beobachtet. Die wichtigsten anatomischen Landmarken konnten morphologisch anhand rekonstruierter Bilder identifiziert werden (Vorhofseptum, Pektinamuskulatur, Koronarsinus, Lungenvenenostia, Hohlvene und Cristae terminalis). Die Diffusionsfärbung unter Vakuum führte zu einer Kontrastverstärkung in den Aortenwurzel- und atrioventrikulären Klappen und diskreten Bereichen des arbeitenden Myokards. Die Verbesserung der Muskelverfärbung war auf die Vorhofanhängsel und die hinteren Wände der linken und rechten Vorhöfe beschränkt (Abbildung 5).
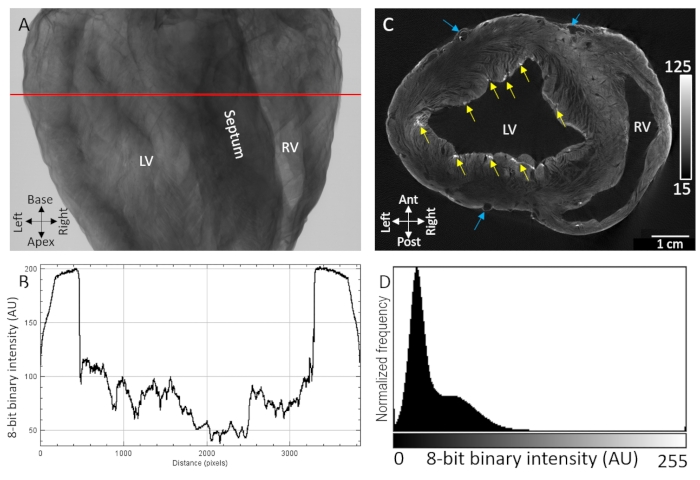
Abbildung 1: MikroCT-Bildgebung eines luftgetrockneten Schweineherzens, das mit PMA-Kontrastmittel durch Diffusion unter Vakuum behandelt wurde . (A) Röntgenprojektionsbild. (B) Ein Transmissionsprofil, das aus der roten Linie in A extrahiert wird. (C) Kurzachsige Scheibe der Ventrikel aus einem tomographisch rekonstruierten dreidimensionalen Volumen. Gelbe Pfeile zeigen punktförmige Kontrastregionen an, die subendokardialen Purkinje-Fasern zugeschrieben werden. Blaue Pfeile zeigen das Gefäßsystem an. (D) Signalintensitätsverteilung des rekonstruierten Bildschnitts in C. LV: linker Ventrikel und RV: rechter Ventrikel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
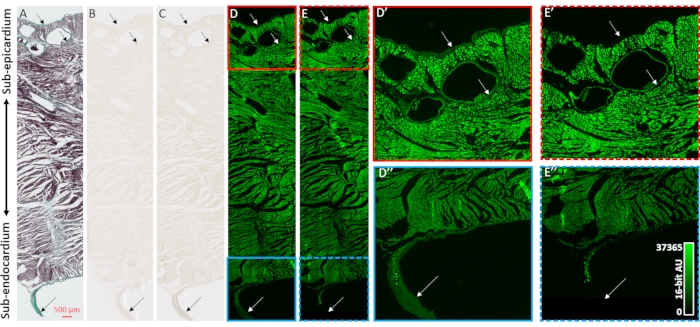
Abbildung 2: Validierung der PMA-Selektivität für Kollagen . (A) Massons trichrome Färbung eines transmuralen Gewebeschnitts aus den Ventrikeln eines luftgetrockneten Herzens. Myokard ist rot gefärbt und Kollagen wird mit grüner Färbung gezeigt. Benachbarte Gewebeabschnitte (B) ohne Färbung oder (C) mit PMA (1%) wurden mit heller Feldbeleuchtung abgebildet, um die Gleichmäßigkeit der Färbung zu beurteilen. (D) Gewebeschnitte, die keine Färbung aufweisen oder (E) durch PMA gefärbt wurden, wurden mittels Fluoreszenzmikroskopie abgebildet. Die Paneele D' ( durchgehend roter Kasten) und E' (gestrichelter roter Kasten) sind vergrößerte Ansichten des Subepikards für ungefärbte und PMA-gefärbte Abschnitte. Die Paneele D '' (durchgehend blaue Box) und E'' (gestrichelte blaue Box) sind entsprechende vergrößerte Ansichten des Subendokards und einer freilaufenden Purkinje-Faser. Pfeile zeigen Websites mit Kollagengehalt an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
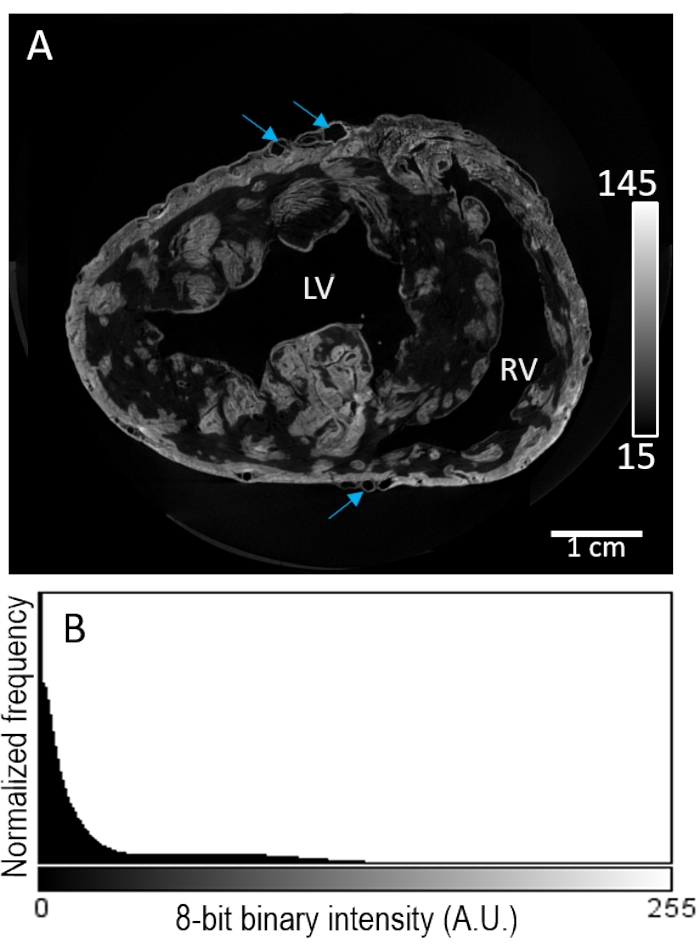
Abbildung 3: Perfusionsbelastung von PMA vor der Lufttrocknung und MikroCT-Bildgebung . (A) Eine kurzachsige Scheibe eines rekonstruierten Bildvolumens der Ventrikel von einem Schweineherz. Blaue Pfeile zeigen das Gefäßsystem an. (B) Die Signalintensitätsverteilung der Bildscheibe aus Panel A. LV: linker Ventrikel und RV: rechter Ventrikel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
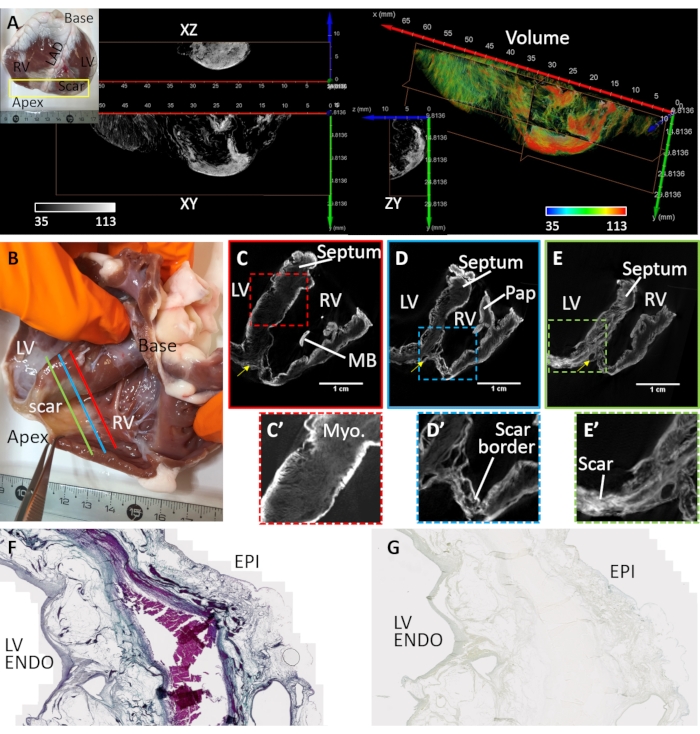
Abbildung 4: MikroCT-Bildgebung eines Schafherzens, das an einem chronischen Myokardinfarkt leidet. (A) In der apikalen Region bildete sich eine dichte Narbe (siehe Inset-Foto). Einem Volumen-Rendering des apikalen Bereichs aus endokardialer Perspektive wurde eine Färbung basierend auf der Bildintensität zugewiesen (Rot entspricht Narbengewebe und Myokard in Grün). Orthogonale Scheiben der Graustufenintensität zeigen die dichte Narbenverteilung und das angrenzende überlebende Myokard. Die Trennung zwischen fibrotischem Gewebe und Myokard entspricht Regionen des Fettgewebes. (B) Foto einer luftgetrockneten Ventrikelkeilzubereitung von einem Schaf mit apikaler Narbenbildung nach Myokardinfarkt. Schräge Scheiben des rekonstruierten MikroCT-Bildvolumens durchqueren die Ventrikel auf der mittleren Ebene zwischen Basis und Spitze und proximal zum Ort des (C) Gefäßverschlusses (C- rote Linie in Panel B), (D) der periinfarkten Region, die an dichte Narben und gesundes Myokard grenzt (D- blaue Linie in Panel B) und (E) eine Region der dichten Fibrose (E - grüne Linie in Panel B). (C') Eine erweiterte Ansicht der Septumregion, die durch einen rot gestrichelten Kasten in C umrissen wird. (D') Eine erweiterte Ansicht der Infarktregion in der rechten ventrikulären Spitze (blau gestrichelter Kasten in Panel D). (E') Eine erweiterte Ansicht der Infarktregion in der linksventrikulären Spitze (grün gestrichelter Kasten in Panel E). LV: Linke Ventrikelhöhle; RV: rechter Ventrikelraum; MB: Moderatorenband; Pap: papillärer Muskel. Der gelbe Pfeil zeigt die linke vordere absteigende Arterie an. (F) Massons trichrome Färbung eines histologischen Abschnitts, der aus dem PMA-gefärbten, luftgetrockneten linken Ventrikel geschnitten wurde. Kollagen ist blau gefärbt und Myokard ist rosa / violett gefärbt. (G) Ein entsprechender Gewebeschnitt der PMA-Färbeverteilung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
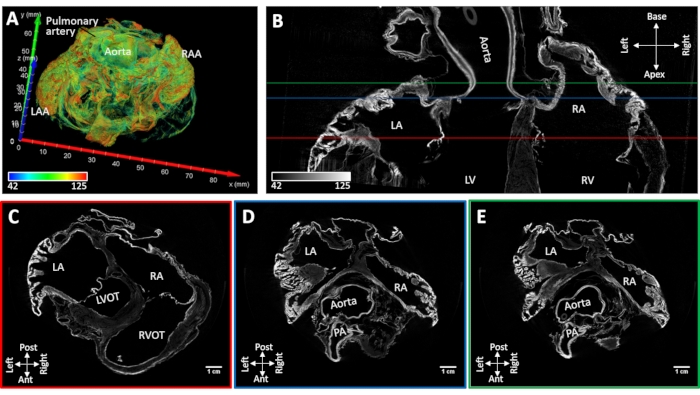
Abbildung 5: MikroCT-Aufnahme eines Schafherzes nach chronisch induziertem Vorhofflimmern. (A) Eine Volumenwiedergabe der Vorhöfe mit zugeordneter Färbung wie in Abbildung 4A. (B) Bi-atriale MikroCT-Bildschnitte in der Längsachse des Herzens. Kurzachsige Scheiben wurden auf Höhe der (C) atrioventrikulären Ventile (C- rote Linie in Panel B), (D) Aortenwurzel (D- blaue Linie in Panel B) und (E) linkes Vorhofdach (E- grüne Linie in Panel B) extrahiert. LA: linke Vorhöfe; RA: rechte Vorhöfe; LAA: linkes Vorhofanhängsel; RAA: rechtes Vorhofanhängsel; LV: linker Ventrikel; RV: rechter Ventrikel; LVOT: linksventrikulärer Ausflusstrakt; RVOT: rechtsventrikulärer Ausflusstrakt und PA: Lungenarterie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Probe # | 1 | 2 | 3 | 4 |
| Spezies | Schwein | Schwein | Schaf | Schaf |
| Körpergewicht (kg) | 32.4 | 31.2 | 47.2 | 53.4 |
| Herzgewicht (g) | 191.2 | 186.2 | 202.4 | 207.6 |
| Pathologie | - | - | Chronische MI | Chronischer Vorhofflimmern |
| Probenvorbereitung | Ganzes Herz | Ganzes Herz | Keil des vorderen Herzens | Ganzes Herz |
| Modus der Kontrastbelastung | Verbreitung | Perfusion | Verbreitung | Verbreitung |
| Kontrastmittelexposition (h) | 48 | 24 | 48 | 48 |
Tabelle 1: Herzproben und Kontrastmittelbehandlung.
Diskussion
Ein detailliertes Protokoll für große Gewebepräparate wird unter Verwendung von ganzen Herzen von großen Säugetieren für die anschließende hochauflösende Strukturbildgebung erstellt. Ein lufttrocknender Ansatz beseitigte Einflüsse der Hintergrund-Röntgendämpfung und maximale Optimierung des Gewebes: Hintergrundkontrast29. Mit diesem Ansatz wurde eine isotrope Auflösung im Bereich von 20 μm für die volumetrische Bildgebung über Proben bis zu einem Durchmesser von 7,2 cm erreicht. Die MikroCT von Weichgewebe beruht jedoch typischerweise auf der Verwendung unspezifischer Kontrastmittel zur Verbesserung der Röntgenabsorption und -empfindlichkeit von MikroCT-Systemen34. Obwohl Röntgenkontrastmittel die allgemeine Röntgendämpfung und die Verbesserung der Weichteilbildgebung verbessern, bleibt die Trennung von Gewebebestandteilen auf der Grundlage der biochemischen Zusammensetzung eine Herausforderung. Es wurde jedoch beobachtet, dass die Verwendung von luftgetrockneten Herzen in Kombination mit einem im Labor üblichen Röntgenkontrastmittel, PMA, selektiv extrazelluläre Komponenten färbte. Bindegewebe, das mit gesundem Myokard und pathologischem Strukturumbau bei chronischen Krankheiten assoziiert ist, wurde verbessert.
Der Prozess der Lufttrocknung von biologischem Gewebe erfordert einen Eingriff, um der Verformung der Probe zu widerstehen. Die Probenvorbereitung für die Elektronenmikroskopie hat ähnliche Anforderungen. Typischerweise wird eine kritische Punkttrocknungsmethode verwendet, bei der ein Gleichgewicht zwischen Gewebeeinzugsmedium, Temperatur und Druck verwendet wird, um die Oberflächenspannung des Flüssigkeitsgehalts des Gewebes zu beseitigen, die bei der Verdampfung eine Verformung auf molekularer Ebene verursacht35. Dieser Ansatz erfordert einen gleichmäßigen Ersatz des Wassergehalts der Probe durch flüssiges Kohlendioxid, das in kleinen und leicht diffusierbaren Proben zuverlässiger ist. Alternativ kann die strukturelle Integrität des Gewebes verbessert und an der Luft getrocknet werden, d.h. die Verdunstungsphase kann über einen längeren Zeitraum angewendet werden, um die Gesamtverformung zu reduzieren. Das Molekül HMDS wird silyliert, um ein Gerüst auf Silikonbasis zu bilden, um die molekulare Organisation der Gewebeprobe zu verstärken und zu stabilisieren36. Die Verdunstung wird weiter verlängert, indem die Umluftströme aus der Umgebung begrenzt werden, auch um eine inhomogene Verdunstung, insbesondere zwischen der Probenoberfläche und den intramuralen Schichten, zu vermeiden.
Zahlreiche Kontrastmittel wurden bisher für die MikroCT-Bildgebung von Weichteilen eingesetzt. Die häufigsten sind Jod, Phosphowolframsäure (PTA) und PMA. Insbesondere Jod wurde aufgrund einer höheren Diffusionsrate34,37,38 eingesetzt. Dennoch wirkt Jod als Katalysator für die Silylierung des HMDS-Reagenzes36. Die katalysierte Reaktion ist aggressiv und exotherm, mit einem hohen Risiko der Zerstörung der Probe und einem Sicherheitsrisiko, wenn ein Rest-HMDS aufgrund einer unvollständigen Austrocknung der Probe verbleibt. Sowohl PTA als auch PMA, die in Ethanol gelöst sind, können in Verbindung mit HMDS sicher verwendet werden. Es wurde gezeigt, dass PTA und PMA im Vergleich zur Jodfärbung38 ein höheres Auflösungsvermögen von feinen Strukturen in nicht mineralisierten Bandscheiben bieten. In der MikroCT-Bildgebung von Säugetierproben wurden PTA und PMA zur Färbung von Mausembryonen39, Maus-Herz-Kreislauf-System37, Kaninchenmuskel und Gehirn40 und Schweinevenen41 verwendet. PTA hat eine höhere Molekularmasse und Dichte in Lösung als PMA. Dies ist zum Teil auf eine höhere Atommasse von Wolfram (Ordnungszahl ist 74 g / mol), dem wichtigsten dämpfenden Element in PTA, zurückzuführen. Zum Vergleich: Das schwerste Element in PMA, Molybdän, hat eine Ordnungszahl von 42 g/mol. Sowohl die Atommasse als auch die Probendichte liegen neben der Probendicke42 der Röntgendämpfung zugrunde. Durch die Erhöhung der Röntgenweglänge durch Erhöhung der Probengrößen wird die Röntgendämpfung empfindlicher gegenüber einer erhöhten Probendichte. Daher wurde das PMA-Kontrastmittel mit geringerer Dichte ausgewählt, um das Risiko einer Überdämpfung zu verringern und den Dynamikumfang des Bildkontrasts für Herzen von menschenähnlicher Skala zu optimieren. Weitere Beweise haben gezeigt, dass die Diffusionsbelastung von PMA zu einer homogeneren Färbung führt als bei dem größeren Molekül PTA im Herzgewebe43.
Die Methode der Kontrastmittelabgabe beeinflusst die Gleichmäßigkeit der Kontrastmittelverteilung im Herzgewebe (Abbildung 3). Die Perfusion von Kontrastmitteln im ethanoldehydrierten Herzen zeigte aufgrund des variablen Gefäßwiderstands fleckige Hintergrundfärbungswerte von PMA. Im luftgetrockneten Herzen wird die Muskellaminarstruktur durch den Probenaustrocknungsprozess betont, wodurch die laminare Trennung der Muskeln erhöht wird. Dies verbesserte letztendlich die Gesamtpermeabilität des Gewebes für diffusionsbasierte Kontrastmittelbelastung. Folglich erleichterte die Lufttrocknung das Gewebe: Luftkontrast auf laminarer und intralaminarer Ebene (Abbildung 4). Darüber hinaus kann die Diffusionsbelastung durch die Anwendung unter Vakuum weiter erleichtert werden. Es wurde ferner gezeigt, dass die Gewebeschrumpfung von nicht getrockneten Proben von der Kontrastmittelkonzentration40 abhängt. Eine vorherige morphologische Stabilisierung der Probe durch Lufttrocknung hemmt jedoch Gewebeschrumpfungseffekte29.
Hochauflösende MikroCT-Bilder ganzer Organe erzeugen von Natur aus große Datenmengen. Die Natur der tomographischen Bildgebungsverfahren ermöglicht die Visualisierung und Bildverarbeitung auf einer Slice-by-Slice-Basis, was die Computerverarbeitung und den Speicheraufwand verringert. Um jedoch dreidimensionale Bildstapel zu visualisieren, beispielsweise Probenvolumina in dreidimensionalen Darstellungen wiederzugeben, sind die empfohlenen Mindestanforderungen an den Computer 128 GB RAM und eine Prozessorgeschwindigkeit von 3 GHz. Solid-State-Festplatten verbesserten auch die Datenübertragung erheblich.
Das Aufkommen der MikroCT-Bildgebung im kardialen Bereich bietet zahlreiche Vorteile für translationale Studien und klinische Validierung. Die Vorteile seiner dreidimensionalen und mikrometrischen Bildgebung haben bereits Anwendungen bei der Bestimmung der thrombotischen Belastung von ST-Elevations-Myokardischämie-Patientengezeigt 44,45. Die Kartierung potenzieller Arrhythmiequellen bei Patienten mit strukturellen Herzerkrankungen hängt weitgehend von der Bestimmung der Verteilung des fibrotischen Narbengewebes und der Lokalisierung der miteinander verwobenen Spuren des überlebenden Myokards ab. Second-Line-Ansätze zur Diagnostik ventrikulärer Arrhythmien nutzen die Magnetresonanztomographie46. Es kann dichte Fibrose robust lokalisieren, ist aber auf eine niedrig aufgelöste morphologische Charakterisierung beschränkt und bietet nur begrenzte Einblicke in den mikrostrukturellen Umbau und die diffusen Verteilungen fibrotischer Läsionen47. Die hochauflösende Untersuchung der Narbenverteilung und -charakterisierung hat ein enormes Potenzial, unser Verständnis des kardialen Strukturumbaus und des Risikos, an Herzinsuffizienz zu erkranken, zu verbessern. Insbesondere Grundlagenforschung oder Obduktionen werden von bestätigenden Strukturbildern für die elektrische Kartierung von Herzrhythmusstörungen profitieren.
Zusammenfassend lässt sich sagen, dass Herzen, die mit HMDS-Behandlung und Lufttrocknung verstärkt sind, anschließend mit einem Röntgenkontrastmittel gefärbt werden können, um die Röntgendämpfung extrazellulärer Komponenten zu verbessern. Insbesondere bei gesundem Myokard tritt die PMA-Akkumulation am Epithel, am Klappengewebe und an Kompartimenten des ventrikulären Leitungssystems, die von Bindegewebe ummantelt sind, auf, was zu einer verstärkten Röntgendämpfung führte. Darüber hinaus war bei strukturell erkranktem Myokard der verstärkte Kontrast bei Fibrose weiter selektiv.
Offenlegungen
Nichts
Danksagungen
Diese Studie erhielt finanzielle Unterstützung von der französischen Regierung im Rahmen des Programms "Investments of the Future", das von der National Research Agency (ANR), der Grant-Referenz ANR-10-IAHU-04 und der Leducq Foundation (RHYTHM-Netzwerk) verwaltet wird, sowie die Grant-Referenz ANR-17-CE14-0029-01 [UNMASC], Mittel aus dem Europäischen Forschungsraum für Herz-Kreislauf-Erkrankungen (ERA-CVD), die Grant-Referenz H2020-HCO-2015_680969 [MultiFib] und Mittel der französischen Region Nouvelle Aquitaine, Finanzhilfereferenzen 2016 - 1R 30113 0000 7550/2016-1R 30113 0000 7553 und ANR-19-ECVD-0006-01.
Materialien
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Diapath | F0043 | |
| Calcium chloride solution | Honeywell | 21114 | |
| Canulation Tubing PTFE | VWR | DENE3400102 | |
| Constant Head 1L Reservoir | Harvard Apparatus | 50-0496 | |
| D-(+)-Glucose | Sigma | G5767 | |
| Ethanol absolute | VWR | 20821.330 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | 796881 | |
| Heparin sodium (5000 U/mL) | Panpharma | 3400891287301. | |
| Hexamethyldisilazane (HMDS) | Sigma | 440191-1L | |
| Hydrochloric acid, ACS reagent, 37% | Sigma | 258148 | |
| Magnesium chloride solution | Honeywell | 63020 | |
| Phosphate buffered saline (PBS) | Sigma | P5368 | |
| Phosphomolybdic acid hydrate | Fisher Scientific | 417895000 | |
| Potassium Chloride | Sigma | P5405 | |
| Pump Tubing, 3-Stop | Ismatec | FV-96328-48 | |
| SkyScan, 1276 | Bruker | micro CT | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sodium Chloride | Sigma | S3014 | |
| Sodium hydroxide solution 50% in H2O | Sigma | 415413 | |
| Tube Connector Kits | Harvard Apparatus | 72-1407 | |
| Tubing pump | Ismatec | ISM 1089 | |
| Tubing Tygon R-3603 1.6 mm 3.2 mm 0.8 mm | VWR | 228-1279 | |
| Tubing Tygon R-3603 3.2 mm 4.8 mm 0.8 mm | VWR | 228-1283 | |
| Two-part single-use syringes 50 mL | Norm-Ject | 4850001000 | Pyrogen-free, PVC-free |
Referenzen
- Srinivasan, N. T., Schilling, R. J. Sudden cardiac death and arrhythmias. Arrhythmia & Electrophysiology Review. 7 (2), 111-117 (2018).
- Szumowski, L., et al. Mapping and ablation of polymorphic ventricular tachycardia after myocardial infarction. Journal of the American College of Cardiology. 44 (8), 1700-1706 (2004).
- Bode, K., et al. Ablation of polymorphic ventricular tachycardias in patients with structural heart disease. PACE - Pacing and Clinical Electrophysiology. 31 (12), 1585-1591 (2008).
- Enjoji, Y., et al. Catheter ablation of fatal ventricular tachyarrhythmias storm in acute coronary syndrome-role of Purkinje fiber network. Journal of Interventional Cardiac Electrophysiology. 26 (3), 207-215 (2009).
- Sinha, A. M., et al. Role of left ventricular scar and purkinje-like potentials during mapping and ablation of ventricular fibrillation in dilated cardiomyopathy. PACE - Pacing and Clinical Electrophysiology. 32 (3), 286-290 (2009).
- Peichl, P., Čihák, R., Koželuhová, M., Wichterle, D., Vančura, V., Kautzner, J. Catheter ablation of arrhythmic storm triggered by monomorphic ectopic beats in patients with coronary artery disease. Journal of Interventional Cardiac Electrophysiology. 27 (1), 51-59 (2010).
- Marrouche, N. F., et al. Mode of initiation and ablation of ventricular fibrillation storms in patients with ischemic cardiomyopathy. Journal of the American College of Cardiology. 43 (9), 1715-1720 (2004).
- Bänsch, D., et al. Successful catheter ablation of electrical storm after myocardial infarction. Circulation. 108 (24), 3011-3016 (2003).
- Yokoshiki, H., Mitsuyama, H., Watanabe, M., Mizukami, K., Tsutsui, H. Suppression of ventricular fibrillation by electrical modification of the Purkinje system in hypertrophic cardiomyopathy. Heart and Vessels. 29 (5), 709-717 (2014).
- Agress, C. M., Rosenberg, M. J., Jacobs, H. I., Binder, M. J., Schneiderman, A., Clark, W. G. Protracted shock in the closed-chest dog following coronary embolization with graded microspheres. The American journal of physiology. 170 (3), 536-549 (1952).
- Bolukoglu, H., Liedtke, A. J., Nellis, S. H., Eggleston, A. M., Subramanian, R., Renstrom, B. An animal model of chronic coronary stenosis resulting in hibernating myocardium. American Journal of Physiology - Heart and Circulatory Physiology. 263, 20-29 (1992).
- Capone, R. J., Most, A. S., Sydlik, P. A. Precordial ST segment mapping. A sensitive technique for the evaluation of myocardial injury. CHEST. 67 (5), 577-582 (1975).
- Dib, N., Diethrich, E. B., Campbell, A., Gahremanpour, A., McGarry, M., Opie, S. R. A percutaneous swine model of myocardial infarction. Journal of Pharmacological and Toxicological Methods. 53 (3), 256-263 (2006).
- Dogné, J. M., et al. Characterization of an original model of myocardial infarction provoked by coronary artery thrombosis induced by ferric chloride in pig. Thrombosis Research. 116 (5), 431-442 (2005).
- Eldar, M., Ohad, D., Bor, A., Varda-Bloom, N., Swanson, D. K., Battler, A. A closed-chest pig model of sustained ventricular tachycardia. Pacing and Clinical Electrophysiology. 17 (10), 1603-1609 (1994).
- Elzinga, W. E. Ameroid constrictor: uniform closure rates and a calibration procedure. Journal of applied physiology. 27 (3), 419-421 (1969).
- Hughes, G. C., Post, M. J., Simons, M., Annex, B. H. Translational physiology: Porcine models of human coronary artery disease: Implications for preclinical trials of therapeutic angiogenesis. Journal of Applied Physiology. 94 (5), 1689-1701 (2003).
- Lichtig, C., Brooks, H., Chassagne, G., Glagov, S., Wissler, R. W. Basic fuchsin picric acid method to detect acute myocardial ischemia. An experimental study in swine. Archives of Pathology and Laboratory Medicine. 99 (3), 158-161 (1975).
- Näslund, U., Häggmark, S., Johansson, G., Pennert, K., Reiz, S., Marklund, S. L. Effects of reperfusion and superoxide dismutase on myocardial infarct size in a closed chest pig model. Cardiovascular Research. 26 (2), 170-178 (1992).
- Reffelmann, T., et al. A novel minimal-invasive model of chronic myocardial infarction in swine. Coronary Artery Disease. 15 (1), 7-12 (2004).
- Reimer, K. A., Lowe, J. E., Rasmussen, M. M., Jennings, R. B. The wavefront phenomenon of ischemic cell death. 1. Myocardial infarct size vs duration of coronary occlusion in dogs. Circulation. 56 (5), 786-794 (1977).
- Salazar, A. E. Experimental myocardial infarction. Induction of coronary thrombosis in the intact closed-chest dog. Circulation research. 9, 1351-1356 (1961).
- Takahashi, M., et al. Effects of angiotensin I-converting enzyme inhibitor and angiotensin II type 1 receptor blocker on the right ventricular sarcoglycans and dystrophin after left coronary artery ligation. European Journal of Pharmacology. 522 (1-3), 84-93 (2005).
- Gonzalez-Tendero, A., et al. Whole heart detailed and quantitative anatomy,myofibre structure and vasculature from X-ray phase-contrast synchrotron radiation-basedmicro computed tomography. European Heart Journal Cardiovascular Imaging. 18 (7), 732-741 (2017).
- Teh, I., et al. Resolving fine cardiac structures in rats with high-resolution diffusion tensor imaging. Scientific Reports. 6, 30573 (2016).
- Teh, I., et al. Validation of diffusion tensor MRI measurements of cardiac microstructure with structure tensor synchrotron radiation imaging. Journal of Cardiovascular Magnetic Resonance. 19 (1), 31 (2017).
- Abouezzeddine, O., et al. Relevance of endocavitary structures in ablation procedures for ventricular tachycardia. Journal of Cardiovascular Electrophysiology. 21 (3), 245-254 (2010).
- Pambrun, T., et al. Epicardial course of the septopulmonary bundle: Anatomical considerations and clinical implications for roof line completion. Heart Rhythm. 18 (3), 349-357 (2021).
- Pallares-Lupon, N., et al. Optimizing large organ scale micro computed tomography imaging in pig and human hearts using a novel air-drying technique. bioRxiv. , (2021).
- Martins, R. P., et al. Dominant frequency increase rate predicts transition from paroxysmal to long-term persistent atrial fibrillation. Circulation. 129 (14), 1472-1482 (2014).
- Puchtler, H., Waldrop, F. S., Valentine, L. S. Fluorescence microscopic distinction between elastin and collagen. Histochemie. 35 (1), 17-30 (1973).
- Walton, R. D., et al. Compartmentalized Structure of the Moderator Band Provides a Unique Substrate for Macroreentrant Ventricular Tachycardia. Circulation: Arrhythmia and Electrophysiology. 11 (8), 005913 (2018).
- Di Diego, J. M., Sicouri, S., Myles, R. C., Burton, F. L., Smith, G. L., Antzelevitch, C. Optical and electrical recordings from isolated coronary-perfused ventricular wedge preparations. Journal of Molecular and Cellular Cardiology. 54, 53-64 (2013).
- Pauwels, E., Van Loo, D., Cornillie, P., Brabant, L., Van Hoorebeke, L. An exploratory study of contrast agents for soft tissue visualization by means of high resolution X-ray computed tomography imaging. Journal of Microscopy. 250 (1), 21-31 (2013).
- Mulet, A. Book Review: Modern Drying Technology, Volume 3: Product Quality and Formulation , edited by E. Tsotsas and A. S. Mujumdar. Drying Technology. 32 (2), 244-245 (2014).
- Karimi, B., Golshani, B. Mild and highly efficient method for the silylation of alcohols using hexamethyldisilazane catalyzed by iodine under nearly neutral reaction conditions. Journal of Organic Chemistry. 65 (21), 7228-7230 (2000).
- Dunmore-Buyze, P. J., et al. Three-dimensional imaging of the mouse heart and vasculature using micro-CT and whole-body perfusion of iodine or phosphotungstic acid. Contrast Media and Molecular Imaging. 9 (5), 383-390 (2014).
- Disney, C. M., Madi, K., Bodey, A. J., Lee, P. D., Hoyland, J. A., Sherratt, M. J. Visualising the 3D microstructure of stained and native intervertebral discs using X-ray microtomography. Scientific Reports. 7 (1), 16279 (2017).
- Descamps, E., Sochacka, A., de Kegel, B., Van Loo, D., Hoorebeke, L., Adriaens, D. Soft tissue discrimination with contrast agents using micro-ct scanning. Belgian Journal of Zoology. 144 (1), (2014).
- Buytaert, J., Goyens, J., De Greef, D., Aerts, P., Dirckx, J. Volume shrinkage of bone, brain and muscle tissue in sample preparation for micro-CT and light sheet fluorescence microscopy (LSFM). Microscopy and Microanalysis. 20 (4), 1208-1217 (2014).
- Nierenberger, M., Rémond, Y., Ahzi, S., Choquet, P. Assessing the three-dimensional collagen network in soft tissues using contrast agents and high resolution micro-CT: Application to porcine iliac veins. Comptes Rendus - Biologies. 338 (7), 425-433 (2015).
- Speck, U. . General principles of x-ray contrast media. X-Ray Contrast Media. , (2018).
- Rajasekar, A., Trew, M. L., Sands, G. B. . Understanding and enhancing the use of micro-computed tomography in soft tissue. , (2015).
- Karagiannidis, E., et al. Micro-CT-based quantification of extracted thrombus burden characteristics and association with angiographic outcomes in patients with ST-elevation myocardial infarction: The QUEST-STEMI Study. Frontiers in Cardiovascular Medicine. 8, 646064 (2021).
- Karagiannidis, E., et al. Serum ceramides as prognostic biomarkers of large thrombus burden in patients with stemi: A micro-computed tomography study. Journal of Personalized Medicine. 11 (2), 89 (2021).
- Hennig, A., et al. High-resolution three-dimensional late gadolinium-enhanced cardiac magnetic resonance imaging to identify the underlying substrate of ventricular arrhythmia. Europace : European Pacing, Arrhythmias, and Cardiac Electrophysiology: Journal of the Working Groups on Cardiac Pacing, Arrhythmias, and Cardiac Cellular Electrophysiology of the European Society of Cardiology. 20, 179-191 (2018).
- Lorgis, L., et al. Relationship between fragmented QRS and no-reflow, infarct size, and peri-infarct zone assessed using cardiac magnetic resonance in patients with myocardial infarction. Canadian Journal of Cardiology. 30 (2), 204-210 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten