Method Article
使用多功能系统对人类癌症和正常细胞中Yes相关蛋白的全光学机械生物学询问
* 这些作者具有相同的贡献
摘要
本文介绍了如何利用集成的多功能和用户可编程系统的详细逐步方案,该系统可实现自动多通道成像和机械生物学分析,以阐明Yes相关蛋白(YAP)的机械灵敏度。
摘要
活细胞的长期多功能成像和分析需要各种硬件和软件平台的简化功能协调。然而,手动控制不同制造商生产的各种设备是劳动密集型和耗时的,可能会降低所获取数据的准确性、可重复性和质量。因此,一个多合一和用户可编程的系统,能够实现自动,多功能和长期的图像采集,并与大多数荧光显微镜平台兼容,可以使科学界受益。本文介绍了利用新型集成软件系统的完整操作规程,该系统由(1)一个自制的软件程序组成,称为"自动多功能集成程序(AMFIP)",可实现自动多通道成像采集,以及(2)一套定量成像分析和细胞牵引计算包。
该集成系统用于揭示CRISPR / Cas9工程人类正常细胞(B2B)和肺癌细胞(PC9)中机械敏感Yes相关蛋白(YAP)的时空分布与细胞力学(包括细胞扩散和牵引)之间以前未知的关系。利用该系统的多通道控制和读出能力,结果表明:(1)B2B正常细胞和PC9癌细胞在细胞扩散和迁移过程中显示出YAP表达,牵引和细胞动力学之间的明显关系;(2)PC9癌细胞在底物上施加明显的核周力。总之,本文提出了一个详细的逐步方案,说明如何利用集成的用户可编程系统,该系统能够实现自动多功能成像和分析,以阐明YAP机械灵敏度。这些工具为在细胞生理学和病理学背景下详细探索多方面的信号传导动力学开辟了可能性。
引言
该方法的总体目标是实现活细胞的全光学多功能成像和分析。一体化成像程序可实现多功能光电器件的自动协调,将减少劳动密集型和容易出错的手动操作,对于研究人员进行长期活细胞成像至关重要1,2,3,4。然而,生物医学研究界现有的大多数公共项目要么仅适用于有限的光电子器件,要么需要额外的硬件来协调不同的设备5,6,7,8,9。最近,开发了一个基于软件的开源程序,名为"自动多功能集成程序(AMFIP)",可实现多通道和延时成像。AMFIP基于Java语言和μManager11,12的应用程序编程接口(API),被开发为μManager中的一个插件,该插件执行定制的Java脚本,以完成多个光电硬件和软件平台(包括但不限于尼康平台)的基于软件的通信。AMFIP的建立为细胞行为的可编程和多功能询问开辟了可能性。本文建立了一种集成的实验和计算系统,将AMFIP与数字成像分析和细胞牵引力显微镜相结合。该系统能够阐明CRISPR / Cas9工程的人类正常B2B(图1)和肺癌PC9(图2)细胞系中不同的YAP机制生物学。该系统为科学界提供了一个全面的解决方案,避免了购买可能不适用于和/或与每个成像系统不兼容的额外控制设备的需求。
本文提出的方案介绍了如何(1)应用AMFIP对表达mNEonGreen2标记YAP的CRISPR / Cas9工程细胞系进行自动长期成像;(2)结合斐济ImageJ,MATLAB和Origin,根据其荧光强度(图3和图4),细胞位移场(图1C和图2C)和细胞牵引场(图1D和图2D)对YAP核/细胞质(N / C)比率进行定量分析).结果表明,(1)在具有生理相关机械刚度的底物上细胞扩散的前10小时内13,14,15,16,17,18,单个B2B细胞的YAP N / C比比与单个PC9细胞相比显示出更明显的时间依赖性变化和波动(图5和图6);(2)PC9癌细胞在其核周区域产生明显的牵引力(图7)。该协议中描述的集成系统和方法超越了特定类型的细胞和光遗传学分子。研究人员可以应用这些方案来定制其特定的活细胞询问实验,并在细胞生理学和病理学的背景下阐明多方面的信号传导动力学。
研究方案
1. 生成稳定的CRISPR/Cas9编辑的人肺癌细胞系(PC9)和人支气管上皮细胞系(Beas2B),内源性表达mNeonGreen21-10/11标记的YAP蛋白
- 使用高保真DNA聚合酶进行聚合酶链反应(PCR)以扩增编码荧光蛋白第 11链mNeonGreen2的DNA序列(见 材料表)。
- 使用CRISPR-Cas9基因编辑系统将扩增的DNA序列敲入PC9和B2B细胞系的YAP基因组位点。
注意:该DNA序列补充了mNeonGreen2的1-10条链以发出荧光。YAP-mNeonGreen21-10/11 的基因组序列图如图 S1所示。该图谱包含标记的基因组,供体和mNeonGreen2序列。 - 使用落射荧光显微镜检查CRISPR / Cas9工程的mNeonGreen2表达(见 材料表)。由于每当细胞在其天然基因调控网络中表达YAP时,mNeonGreen2都被标记为YAP,因此请检查CRISPR / Cas9工程细胞中荧光强度的存在,并将其与亲本细胞(对照)中的荧光强度进行比较。
注意:要遵循此协议,请使用(1)488 nm激光器(47.5 mW / mm2)进行激发,(2)40x物镜(数值孔径(NA)= 0.95)和带通发射滤光片(ET525 / 50 nm)进行荧光测量,以及(3)ImageJ软件来测量,量化和比较荧光强度。 - 通过从CRISPR / Cas9编辑的细胞系中提取基因组DNA来确认mNeonGreen211的正确整合;使用引物在基因组插入和测序两侧进行PCR,以确认在正确的基因组位点19,20的插入。
- 使用CRISPR/ Cas9基因编辑系统敲低mNeonGreen211,并使用步骤1.3中描述的相同显微镜系统和成像参数检查细胞中的荧光强度降低。
注意:此步骤通过比较荧光强度来确认mNeonGreen211的正确积分。 没有敲低细胞的CRISPR / Cas9工程细胞和亲本细胞被用作对照。 - 通过荧光激活细胞分选(FACS)分选收集具有目标标记蛋白质的细胞。
- 为了准备用于FACS分选的细胞,胰蛋白酶消化并将它们重悬于磷酸盐缓冲盐水(PBS)中。
- 在两轮丰富的FACS分选中收集高于亲本细胞系背景水平的mNeonGreen2荧光的细胞。
注意:这里描述的生成CRISPR / Cas9编辑的细胞系的时间轴大约为1-2个月。所有细胞系均根据要求公开提供,因此其他研究实验室可以重现结果。
2. PC9和B2B电池的维护
- 将两个细胞系维持在37°C下具有5%CO 2 的加湿组织培养箱中。
- 在75 cm2烧瓶中培养106个内源性标记的PC9和Beas2B细胞,其中12mL RPMI-1640培养基补充10%胎牛血清和100μg/ mL青霉素链霉素。当细胞汇合度达到〜80%时,两种细胞系的传代培养。
- 使用支原体检测试剂盒每3个月测试两种细胞系的支原体,严格遵循所有制造商推荐的协议。
- 将细胞系储存在-80°C冰箱中。
- 使用从解冻中<20代的细胞系进行所有实验。
3. 硬件和软件环境的设置
- 实验的硬件环境设置
- 将共聚焦控制器和倒置显微镜连接到计算机(见 材料表)。
- 安装软件平台(材料表)。
- 打开共聚焦控制器和倒置显微镜。接下来,启动 Elements。
- 在 Elements 中打开共聚焦显微镜、激光显微镜和倒置显微镜的控制面板。接下来,通过测试电动载物台的运动,显微镜物镜的切换以及激光线的空间扫描来检查三个面板是否正常工作。
- AMFIP的软件环境设置
- 在计算机上安装 IntelliJ、Java Development Kit 14.0、μManager version 2.0 gamma 和 Fiji ImageJ。
- 在IntelliJ中打开从GitHub下载的AMFIP项目(链接:https://github.com/njheadshotz/AMFIP)。
- 单击 "设置|编译器|注释处理器并 选中 启用注释处理。
- 单击"项目结构|工件并创建 JAR 文件。将输出目录设置为 μManager 目录下的 mmplugins。
- 单击"项目结构|库,并在μManager目录下添加mmplugins和插件。
- 单击"运行"下拉菜单下的"添加配置",然后创建应用程序。
- 输入 ij。图像J 进入 主类。
- 在 VM 选项中输入 -Xmx3000m -Dforce.annotation.index=true。
- 将 μManager 目录设置为 工作目录。
- 单击" 运行 "以使用 AMFIP 插件激活 μManager。
- 将μManager与倒置显微镜连接。
- 将倒置显微镜21 的自适应驱动程序添加到 μManager 目录中。
- 打开 μManager。单击 "设备|硬件配置向导 并创建新配置。
- 在 "可用设备"下添加 Ti2 驱动程序。
- 选择所有外围设备并保存新的配置文件。
- 重新启动μManager,并在 微管理器启动配置的步骤3.2.4中选择配置文件。
4. 凝胶制备
- 在室温(24°C)下用3-氨基丙基色甲氧基硅烷处理玻璃盖玻片7分钟。
- 使用去离子(DI)水冲洗玻璃盖玻片,并在160°C下干燥盖玻片20分钟。
- 用0.5%戊二醛处理玻璃盖玻片30分钟,然后用DI水冲洗。
- 混合丙烯酰胺溶液, N,N′-亚甲基双丙烯酰胺(双)溶液和悬浮在10mM HEPES缓冲盐水中的荧光珠。使用10%(w / v)过硫酸铵溶液和 N,N,N′,N′-四甲基乙二胺(TEMED)作为聚合的引发剂。按照前面描述的既定方案,改变每种组分的百分比,以实现聚丙烯酰胺(PAA)水凝胶所需的机械刚度13,14。
注意:在该协议中,2 kPa凝胶:丙烯酰胺= 12.5%,双丙烯酰胺= 6.5%;5 kPa凝胶:丙烯酰胺= 12.5%,双丙烯酰胺= 21.5%;和40 kPa凝胶:丙烯酰胺= 12.5%,双丙烯酰胺= 31.5%。列出的所有 % 都是卷百分比。 - 35分钟后,从固化的PAA水凝胶中剥离玻璃盖玻片,并用50mM HEPES缓冲盐水洗涤水凝胶两次(每次5分钟)。
- 用水合肼溶液处理水凝胶表面6小时。
- 用乙酸冲洗水凝胶30分钟。除去乙酸,用PBS冲洗30分钟。
- 用高碘酸钠氧化纤连蛋白溶液(PBS中的50μg/ mL)30分钟。
- 用氧化的纤连蛋白溶液涂覆水凝胶表面并等待35分钟。
- 加入PBS浸入水凝胶并储存在4°C。 用铝箔覆盖所有含有水凝胶的培养皿,以避免任何光照射到水凝胶上。
5. 细胞培养
注意:使用无菌技术进行细胞培养。
- 将带有PAA水凝胶的玻璃盖玻片粘合到35 mm玻璃底培养皿上,以避免在细胞接种和成像过程中凝胶的物理漂移。
- 使用无菌的清洁镊子,从含有制备的凝胶的培养皿中提起盖玻片(顶部有PAA水凝胶)。
- 使用干抹布清洁玻璃盖玻片底面上的水滴。
- 使用灭菌的镊子固定玻璃盖玻片。
- 将小液滴(1-5μL)氰基丙烯酸酯胶水放在底面的两个对角线上。
- 使用灭菌湿巾去除多余的胶水。
- 使用灭菌的镊子替换玻璃底培养皿中的盖玻片。轻轻按压盖玻片的边角,以确保胶滴与培养皿表面完全接触。
- 将盖子放回培养皿上,以尽量减少PAA水凝胶中PBS的蒸发。等待3分钟,让胶水在培养皿中固化并干燥。
- 在培养皿中加入 4 毫升 PBS。
- 对用于成像的培养皿中的剩余PAA水凝胶样品重复上述步骤5.1.1-5.1.8。
- 使用75%乙醇对所有培养皿的外表面进行灭菌,并将其转移到组织培养生物安全柜中。打开紫外线5分钟,并对样品进行消毒。
- 将细胞接种到凝胶的顶面上。
- 关闭紫外线。将烧瓶(含有B2B / PC9细胞)从37°C培养箱中取出到生物安全柜中。使用连接到真空泵的移液器吸出所有培养基,并加入5mL PBS以洗涤烧瓶。
- 加入2mL 0.05%胰蛋白酶,将细胞从烧瓶底部分离。
- 将烧瓶放入培养箱中。等待5分钟。
- 将烧瓶转移到生物安全柜。将8mL新鲜培养基加入烧瓶中,上下移液几次以均匀悬浮细胞。
- 将所有10mL细胞悬浮液转移到15mL管中,并以300× g 离心5分钟。
- 检查管底部的细胞沉淀。缓慢水平倾斜管,并使用吸气移液管从管中除去所有培养基,而不接触细胞沉淀。接下来,加入8mL新鲜培养基,上下移液几次,直到所有细胞与培养基均匀混合。
- 将100μL细胞悬浮液(150个细胞/ μL)沉积到凝胶表面并等待5分钟。接下来,缓慢加入4毫升新鲜培养基到培养皿中;避免将新鲜培养基直接添加到凝胶上。
- 将培养皿置于37°C培养箱中。等待让细胞附着在凝胶表面(B2B:0.5-1小时;PC9:4-5小时)。
6. 细胞成像
注:AMFIP通过与不同的硬件和软件系统协调,可实现自动、多通道和长期成像:(1)AMFIP操纵μManager自动将Ti2-E显微镜的电动载物台移动到多个视场(FOV),并通过单色相机获取明场图像(材料表);(2) AMFIP 使用定制的 Java 脚本激活 Elements 内部的多个宏文件,以完成共聚焦 z-stack 成像和不同激光通道(405 nm 和 488 nm)切换的自动操作。
- 为长期映像设置环境。
- 将环境室放在倒置显微镜的电动载物台上。将 CO2 流速设置为 160 mL/min 并调整腔室的温度(顶部:44 °C;浴槽:42 °C;阶段:40 °C)。接下来,将40毫升纯净水加入腔室的浴池中。
- 从培养箱中取出装有细胞的玻璃底培养皿,并将其放入环境室中。
- 打开共聚焦控制器和倒置显微镜。将光路向右切换,并使用μManager观察附着的细胞。如果有足够的细胞附着在凝胶上,将培养皿转回培养箱。如果没有足够的细胞附着在凝胶上,则继续将细胞孵育30分钟用于B2B,对于PC9细胞再孵育60分钟。
- 切下两小块胶带,将它们贴在圆孔周围的腔室上。接下来,在胶带上涂上一点胶水(仅在培养皿将覆盖的区域)。
- 从培养箱中取出培养皿。接下来,慢慢地将培养皿放入腔室中,让培养皿的底部与胶水接触。
- 按压培养皿的盖子1分钟,让胶水与培养皿完全接触并固化。接下来,轻轻水平推动培养皿,以确认培养皿在腔室中不可移动。
- 合上膛室的盖子。
- 设置明场成像的图像采集参数。
- 打开 IntelliJ 并在文件Elements_script.java的第 93 行中设置参数 T1(例如,120 秒)。确保此值大于用于一个视场 (FOV) 共聚焦成像的元素中宏的运行时间。单击"运行"按钮以启动 AMFIP IntelliJ 项目。
- 单击 μManager 主界面上的实时和多 D Acq. 按钮。接下来,将倒置显微镜的光路向右切换以进行明场成像,切换到10倍物镜,然后打开发光二极管(LED)光(用于明场成像的光源;强度:5%)。
- 单击 "元件 Ti2 面板"中的光路、显微镜物镜和 LED 灯按钮,或手动按下显微镜上的相应按钮。
- 调整 XY 操纵杆和 Z 平面旋钮,以在培养皿上找到凝胶的正确位置和聚焦平面。使用10倍物镜找到附着在凝胶上的多个单细胞的适当FOV。
- 选中多维采集窗口中的多个位置 (XY) 框。单击"编辑位置列表..."按钮,然后观察弹出的"阶段位置列表"窗口。接下来,将物镜更改为40x,将LED灯的强度增加到15%,重新调整XY电动载物台以定位FOV,并通过单击"舞台位置列表"窗口中的"标记"按钮记录坐标。
- 记录 67 个所需的 FOV。单击"舞台位置列表"窗口中的"另存为..."按钮以记录坐标。将T1(例如,步骤6.2.1中定义的参数120 s)输入到"多维采集"窗口的"时间点"部分中的成像采集时间间隔中。
- 为 2D-YAP 和珠状图像设置图像采集。
- 打开 元件,将光路向右更改为共聚焦成像,然后关闭 LED 灯。接下来,单击" 删除联锁 "按钮,然后通过选中 FITC 框打开 FITC 激光通道(用于 YAP 成像)。
- 通过单击 1/2 按钮并将扫描速度调整为每 2 秒 1 帧,然后旋转 Z 平面的旋钮以快速找到所连接单元格的 Z 位置。记录 Z 堆栈的下限和上限。
- 单击顶部功能区上的"宏",选择"宏"下拉菜单下的"宏编辑器",然后将步骤 6.3.2 中的值输入到宏文件中。
- 打开4',6-二氨基-2-苯基吲哚(DAPI)激光通道(用于磁珠成像),方法是选中 DAPI 框以查找并记录磁珠的聚焦Z位置。转到 宏编辑器 并将记录的值输入到宏文件中。
- 设置使用AMFIP移动电动载物台的任务。
- 转到μManager,然后单击插件|用于打开 AMFIP 的图形用户界面 (GUI) 的自动化。单击"添加点"或"删除点"按钮以获取所选视场的确切数量。将 FOV 的记录坐标输入到坐标面板中。
- 在"总实验时间"文本字段中定义总 实验时间 。
- 单击" 附加时间配置" 按钮,并定义将电动载物台移动到每个 FOV 的时间间隔 T2 (例如,30 分钟)。
- 最大化 Elements 的窗口大小,并将 AMFIP 的 GUI 拖动到屏幕右侧,以避免 GUI 干扰光标的自动操作。
- 点击 输入 按钮。第一个宏完成后,单击"多维采集"窗口中的"采集!"按钮。
- 图像采集后溶解细胞。
- 完成长期成像后,通过单击自动化插件窗口中的"暂停"按钮和"多维采集"窗口中的"停止"按钮来停止 AMFIP 任务。
- 打开"元素"并通过单击"ND 采集"窗口中的"顶部"和"底部"按钮来设置 Z 轴成像(将 Z 范围设置为大于磁珠的 Z 范围)。将光路向右切换并打开LED灯(强度:15%)。
- 缓慢而小心地取下腔室和培养皿的盖子。同时,监控视野中视场的任何漂移。
- 使用塑料移液器取出0.5mL十二烷基硫酸钠(SDS)溶液,小心地将塑料移液管保持在培养皿中培养基上方一点,并将1-2滴SDS溶液加入培养基中。
- 明场视图中的单元格溶解后,将光路切换到左侧,关闭LED灯,单击" 删除联锁 "按钮。
- 运行 Z 堆栈映像。保存图像堆栈并将其命名为 Reference_N (N 是每个 FOV 的序列号)。
- 单击"多维采集"窗口中的"多位置(XY)"按钮。接下来,选择下一个FOV,然后单击"转到"按钮将电动舞台移动到第二个FOV。
- 对每个 FOV 重复步骤 6.5.7。
7. YAP N/C 比的测量
- 使用斐济ImageJ软件执行图像分析以测量YAP N / C比(图4)。
- 打开 斐济图片J。导入μManager采集的所有FOV的明场图像堆栈。
- 打开 图像 下拉菜单,然后选择 堆栈|工具|切片守护者。接下来,导出每个 FOV 的明场图像堆栈。
- 导入 FITC 通道的荧光图像,并将其与相同 FOV 的明场图像叠加。为此,请选择荧光图像,然后选择" 叠加|添加图像... (要添加的图像:明场图像;X和Y位置取决于不同相机获取的明场图像的大小;不透明度:60-70)。
- 打开 分析 下拉菜单,然后选择 设置测量值... 选择 面积; 集成密度 和 平均灰度值。
- 单击 ImageJ 主界面上的 "手绘选择 "按钮。
- 绘制所需细胞体和细胞核的轮廓。接下来,单击" 分析|测量 或按键盘上的 M 按钮。
- 观察弹出的结果窗口。请注意,"面积"列下的值表示所选区域的面积 (μm2),IntDen 列下的值表示所选区域的荧光强度。
- 使用以下公式 (1)、(2) 和 (3) 计算 YAP N/C 比率:
 (1)
(1) (二)
(二) (3)
(3)
其中 Inuc 和 Icel 代表细胞核和细胞体的相对强度,Anuc 和 Acel 代表细胞核和细胞体的面积。R 是 YAP N/C 比率。 - 保存轮廓,以便将来计算偶极子牵引力和电池周围/核周围位移。为此,请单击" 分析|工具|保存 XY 坐标...
8. 牵引场测量
- 通过斐济ImageJ插件应用牵引力显微镜22,23。
- 打开 斐济图片J。
- 导入 FOV 的磁珠图像堆栈。
- 选择显示最清晰的珠子分布的切片,然后单击" 图像"将其提取|堆栈|工具|切片守护者。
- 导入同一 FOV 的参考的图像堆栈。
- 选择与步骤 8.1.3 中的切片具有相同亮度和对比度的切片。接下来,将其提取为参考图像。
- 选择 图像|堆栈|工具|连接 以组合步骤 8.1.3 和 8.1.5 中的两个切片(选择参考图像作为第一个切片)。
- 选择 插件|模板匹配|对齐堆栈中的切片 或 插件|图像稳定器 ,用于对齐两个切片。
- 选择 图像|堆栈|堆叠到图像。接下来,选择" 图像|查阅表格|绿色 可将第一个切片的颜色转换为绿色,然后选择" 图像|查阅表格|红色 ,将第二个切片的颜色转换为红色。
- 选择 图像|颜色|合并通道 以合并两个图像。
- 将图像与来自同一视场的明场图像重叠,并使用此重叠图像观察磁珠位移。
- 选择 插件|普维|迭代 PIV(基本).... 将讯问窗口大小设置为128/256;64/128;32/64(每个讯问窗口至少四颗珠子)。将相关阈值设置为 0.6。
- 单击 "确定"。计算完成后,将包含珠子置换原始数据的文本文件保存到用户创建的普通文件夹中。
- 选择 插件|FTTC |FTTC ,然后在步骤 8.1.9 中选择文本文件。
- 输入 像素大小 (μm), 凝胶的杨氏模量 (帕斯卡),以及基于实验和珠子图像的 绘图宽度和高度 。
- 单击 "确定" ,将包含牵引力原始数据的文本文件自动保存在与步骤 8.1.12 中的文本文件相同的目录中。
- 使用绘图软件(材料表)绘制多个电池的相同比例的牵引场(图1B,C 和 图2B,C)。
- 将包含牵引力原始数据的文本文件插入到电子表格中。
- 创建一个新工作表,将牵引力的 Y 坐标输入到第一行(从高值排列到低值),将 X 坐标输入到第一列(从低到高排列)。
- 从原始数据中向每个坐标输入牵引力值。
- 将步骤 8.2.2 中的工作表另存为 *.csv 文件。
- 开放 源。
- 单击 "文件|"在 步骤 8.2.4 中打开并导入 *.csv 文件。选择所有单元格,然后单击" 绘图|轮廓|轮廓 - 颜色填充。
- 在 "绘图: plotvm "窗口中,跨列选择"Y",以自动将 Y 值设置为第一行,将 X 值设置为第一列。接下来,命名标题,然后单击 "确定"。
- 在弹出的图形窗口中,双击 热图。
- 单击"色彩映射表/轮廓"窗口中的"色阶"。接下来,将比例级别更改为合理的范围(在此分析中为 0300),然后单击"确定"。
- 单击" 行",取消选中 "仅在主要级别上显示",然后选中 "全部隐藏"。接下来,单击" 确定"。
- 右键单击图形,然后选择" 导出图形..." 将图像保存到指定的路径。
- 使用 MATLAB 计算偶极子电池牵引力。
- 将牵引原始数据文本文件(从步骤 8.1.12 开始)和感兴趣单元格边界区域 (ROI) 坐标文件(从步骤 7.1.9)保存在步骤 8.1.12 中定义的同一文件夹中。将 AMFIP 包中的所有 MATLAB 文件传输到此文件夹中。
- 打开 MATLAB。打开步骤8.1.12中定义的文件夹,打开偶极子牵引计算函数文件 abdippole.m 转移到步骤8.3.1中的此文件夹中。
- 将步骤 8.3.1 中的两个文本/csv 文件读取到 MATLAB 工作空间中,并将矩阵分配给两个变量(例如, 牵引力 和 roi)。
- 运行该函数 abdiple(牵引力,roi)。
注:输出的第一列是以nN(纳米牛顿)为单位的偶极子牵引力。输出的第二列是偶极子牵引力相对于水平轴的角度。
结果
在细胞扩散过程中,CRISPR/Cas9工程PC9癌症和B2B正常细胞中独特的YAP分布和动态
图1A和图2A显示了2、5、40 kPa PAA凝胶和玻璃盖玻片上单个B2B和PC9细胞中YAP分布的代表性荧光图像。B2B细胞中YAP的核定位随着底物刚度的增加而增加(图1A),而PC9细胞在不同刚度的底物上的细胞核和细胞质中显示出相似的YAP浓度(图2A)。图1B和图2B分别显示了5 kPa水凝胶底物上单个,扩散的B2B和PC9细胞中YAP分布的代表性荧光图像(从细胞附着到底物后的第0小时到第10小时)。B2B细胞随着时间的推移单调增加扩散面积,同时YAP N / C比降低(图1B),而PC9细胞在整个10 h铺展过程中保持相对不变的细胞扩散面积,方向和YAP N / C比(图2B)。在早期扩散的10 h持续时间内,具有代表性的B2B细胞组成性地使底物表面变形,并在整个细胞区域应用时间演变的细胞牵引(图1C和图1D)。
相比之下,具有代表性的PC9电池仅在细胞体的两端产生位移和牵引,并且在7.5小时后其牵引力减弱(图2C和图2D)。补充图S2和补充图S3提供了B2B和PC9细胞在早期铺展阶段的更多延时图像和牵引测量值。还观察到PC9细胞动力学的其他模式(图6)。与这些不同的扩散特性并行,B2B和PC9细胞表现出不同的YAP分布和动力学(图3)。在5 kPa凝胶上,B2B细胞中的YAP在第0小时浓缩在细胞核中,并在第10小时更均匀地分布在细胞体中。然而,PC9细胞在整个扩散过程的10小时内在细胞核和细胞质中显示出更均匀的YAP分布。为了定量分析B2B和PC9细胞中的YAP活性和易位,使用图4中描述的算法计算YAP N / C比。
为了进一步研究不同的YAP动力学,比较了YAP N / C比值,细胞/细胞核面积以及多个单个B2B细胞(n = 10)和PC9细胞(n = 5)的牵引力的时间变化(图5)。结果表明, B2B细胞的平均YAP N/C比从2.54±0.22下降到1.79±0.21 (n = 10; p = 0.0022**; 图5A),而PC9电池的平均YAP N / C比从1.92±0.26变为1.57±0.07(n = 5; p = 0.187(不显着(ns)); 图 5A)。B2B电池的平均偶极子牵引力从256.17±123.69 nN变为287.44±99.79 nN(p = 0.7593(ns); 图 5B)。PC9电池的平均偶极子牵引力从141.19±33.62 nN变为168.52±73.01 nN(p = 0.7137(ns); 图 5B)。B2B细胞的平均细胞扩散面积从613.89±102.43 μm2 增加到942.51±226.71 μm2 (p = 0.0512(ns); 图 5C)。
PC9细胞的平均细胞扩散面积从495.78±97.04 μm2 变为563.95±89.92 μm2 (p = 0.5804(ns); 图 5C)。B2B细胞的平均细胞核扩散面积从181.55±36.18 μm2 增加到239.38±43.12 μm2 (p = 0.1217(ns); 图 5D)PC9细胞的平均细胞核扩散面积从133.31±30.05 μm2 变为151.93±22.49 μm2 (p = 0.5944(ns); 图 5D)。这些结果表明,(1)B2B细胞显示出构成性底物刚度依赖性YAP N / C比;(2)B2B电池的牵引力高于PC9电池;(3)与B2B细胞相比,PC9细胞在10 h扩散过程中细胞面积增加有限,YAP N / C比变化有限。
YAP分布和动态与B2B细胞迁移状态的相关性
比较了所有B2B(n=10)和PC9(n=5)细胞的YAP N/C比值和偶极子牵引率与细胞扩散面积和细胞核扩散面积的函数关系。PC9细胞的YAP N / C比值和偶极子牵引与其小细胞和细胞核扩散面积范围没有明显相关性(图6)。相比之下,B2B细胞的YAP N / C比和偶极子牵引似乎遵循两个不同的趋势(图6A和图6C),表明该实验中可能存在两组B2B细胞共存。在第一组中,YAP N / C比和偶极子牵引随着细胞扩散面积的扩大而增加,并在〜1000μm2处达到其最大值(图6C和图6D,由黄色虚线表示)。在第二组中,YAP N/ C比和偶极子牵引随着细胞扩散面积的扩大以较慢的速度增加,并在细胞扩散面积继续增加时保持接近恒定的值(图6C,D,由绿色虚线表示)。
PC9癌细胞在核周区域产生牵引力
单个扩散的PC9细胞从培养的第 6小时开始取代核周区域的底物(图7C)。为了可视化由细胞牵引引起的核周位移,我们重叠了在(红色)和之后(绿色)从底物中去除细胞之前和之后拍摄的荧光珠图像(有关详细信息,请参阅方案部分)。没有任何位移的珠子将在重叠的图像中显示为黄色,即添加红色和绿色。相反,由于细胞牵引而从其静止位置移位的珠子将显示分离的绿色和红色。
值得注意的是,在PC9(图7C,D)和B2B(图7E)细胞中,除了细胞边界的细胞外,还在细胞质和细胞核内观察到了磁珠置换。为了突出核周位移,使用线性弹性理论中的Boussinesq方程来预测由细胞边界处的假设偶极子力产生的二维理论位移( 图7B中的黑色虚线)24。将该理论曲线与沿同一轴线测量的实际基底位移( 图7D中的白色虚线)进行比较,发现原子核内的实际位移比理论值大1.5-8倍(图7B),表明在核周围区域存在牵引力。

图1:B2B正常细胞在不同刚度底物上和早期扩散期间的YAP表达/分布,底物置换场和牵引场的变化。 (A)从初始细胞 - 底物附着60小时后接种在2,5和40 kPa PAA凝胶和玻璃盖玻片上的B2B细胞的YAP表达。(B)将B2B细胞接种在5 kPa PAA凝胶上,并在初始细胞 - 底物附着后10小时内成像。YAP表达由绿色荧光强度表示。注意:细胞核内的YAP强度逐渐降低,但随着时间的推移仍然高于细胞质中的YAP强度。颜色条表示 (A) 和 (B) 中 YAP 表达式的级别(绿色 = 高表达式;黑色 = 低表达式)。(C)细胞位置的基底变形(与明场图像重叠)由每个时间点的位移场表示。位移方向和大小分别由箭头方向和颜色显示。随着细胞扩散面积的增加,B2B细胞体末端的位移变大。颜色条表示位移幅度(深红色 = 高幅度;黑色 = 低幅度)。(D)牵引场(与明场图像重叠)由位移场计算得出。牵引力集中在B2B细胞的边界上。白色和黄色的虚线轮廓分别描绘了细胞和细胞核的边界。颜色条表示牵引力幅度(深红色 = 高幅度;黑色 = 低幅度)。比例尺 = 20 μm。缩写: YAP = 是相关蛋白;PAA = 聚丙烯酰胺。 请点击此处查看此图的放大版本。
图2:PC9癌细胞在不同刚度底物和早期扩散期间YAP表达/分布,底物位移场和牵引场的变化。 (A)从初始细胞 - 底物附着65小时后接种在2,5和40 kPa PAA凝胶和玻璃盖玻片上的PC9细胞的YAP表达。(B)将PC9细胞接种在5 kPa PAA凝胶上,并在初始细胞 - 底物附着后10小时内成像。YAP表达由绿色荧光强度表示。注意:YAP强度从1.5小时开始趋于稳定。颜色条表示 (A)和(B) 中YAP表达的水平(绿色=高表达;黑色=低表达 ), (C)细胞位置的底物变形(与明场图像重叠)由每个时间点的荧光珠置换场表示。位移方向和大小分别由箭头方向和颜色显示。PC9电池引起的位移场小于B2B电池引起的位移场。在整个10小时的扩散过程中,PC9细胞的面积几乎保持不变。颜色条表示位移幅度(深红色 = 高幅度;黑色 = 低幅度)。(D)牵引场(与明场图像重叠)根据位移场计算。这个具有代表性的PC9电池产生的牵引力从第 6小时逐渐下降到第 10小时。白色和黄色的虚线轮廓分别描绘了细胞和细胞核的边界。颜色条表示牵引力幅度(深红色 = 高幅度;黑色 = 低幅度)。比例尺 = 20 μm。缩写: YAP = 是相关蛋白;PAA = 聚丙烯酰胺。 请点击此处查看此图的放大版本。

图3:早期扩散阶段B2B和PC9细胞中的YAP分布。 (A)在第0和第 10小时沿 指定的红色轴测量B2B细胞的YAP强度。(B)在第 0小时,YAP强度显示细胞核和细胞质之间的显着浓度差异。在第 10小时,YAP强度在整个细胞体中变得更加均匀。(C)在第0和第 10小时沿着 指定的蓝色轴测量PC9细胞的YAP强度,(D)在第 0小时,细胞核中的YAP强度似乎高于细胞质中的YAP强度,尽管差异不如B2B细胞显着。在第 10 h时,细胞核中的YAP强度仍略高于细胞质,其变化趋势与第 0 h时相似。比例尺 = 20 μm (A, C)。缩写:YAP = 是相关蛋白。 请点击此处查看此图的放大版本。

图 4:测量 YAP N/C 比率。 (1)应用斐济ImageJ绘制原子核的轮廓并测量其2D投影面积Anuc。(2)测量核内铠核内的荧光强度。(3)绘制细胞体的轮廓并测量其投影面积Acel。(4)测量细胞Icel内部的荧光强度。(5)计算YAP细胞核密度Dnuc、YAP细胞质密度D细胞,以及它们比值R:Dnuc=Inuc/Anuc;Dcyto=(Icel-Inuc)/(Acel-Anuc);R=Dnuc/Dcyto。颜色条指示 YAP 表达式的级别(绿色 = 高表达式;黑色 = 低表达式)。比例尺 = 20 μm。缩写: YAP = 是相关蛋白;N = 原子核;C = 细胞质。请点击此处查看此图的放大版本。
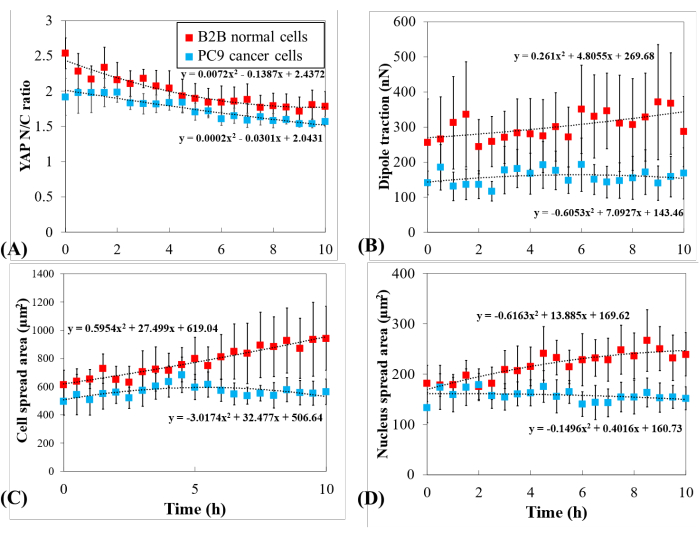
图5:PC9癌症和B2B正常细胞在细胞扩散过程中独特的YAP表达,细胞/细胞核形态和细胞牵引。 (A) YAP N/C 比值在单细胞扩散的前 10 小时内发生变化。B2B细胞的平均YAP N/C比率(红色列;n = 10)从2.54±0.22变为1.79±0.21(n = 10;p = 0.0022**),而PC9细胞的平均YAP N/C比率(蓝色列;n = 5)从1.92±0.26变为1.57±0.07(p = 0.187(ns))。(B)平均偶极子牵引作为时间的函数。B2B电池的平均偶极子牵引从256.17±123.69 nN变为287.44±99.79 nN(p = 0.7593(ns)),PC9电池的平均偶极子牵引从141.19±33.62 nN变为168.52±73.01 nN(p = 0.7137(ns))。(C) 平均细胞面积与时间的函数关系。B2B细胞的平均细胞扩散面积从613.89±102.43 μm2 增加到942.51±226.71 μm2 (p = 0.0512(ns)),PC9细胞的平均细胞扩散面积从495.78±97.04 μm2 变为563.95±89.92 μm2 (p = 0.5804(ns))。(D)平均原子核面积作为时间的函数。B2B细胞的平均细胞核扩散面积从181.55±36.18 μm2 增加到239.38±43.12 μm2 (p = 0.1217(ns)),PC9细胞的平均细胞核扩散面积从133.31±30.05 μm2 变为151.93±22.49 μm2 (p = 0.5944(ns))。缩写: YAP = 是相关蛋白;N = 原子核;C =细胞质;ns = 不显著。 请点击此处查看此图的放大版本。

图 6:YAP N/C 比值和偶极子牵引力与细胞和细胞核扩散面积的函数关系。B2B细胞(n=10)和PC9细胞(n=5)的YAP N/C比值和偶极子牵引从附着到底物后的第6 h~10 h计算。(A) YAP N/C比率作为细胞扩散面积的函数。B2B电池的YAP N/ C比值从1.16到2.53不等,而PC9细胞的YAP N/ C比值从1.27到1.88不等。B2B细胞的细胞扩散面积从391.94μm2到1986.40μm2不等。PC9细胞的细胞扩散面积范围为284.46μm2至830.12μm2。(B)YAP N/C比值作为原子核扩散面积的函数。B2B细胞的细胞核扩散面积从107.09μm2到514.28μm2不等。PC9细胞的细胞核扩散面积范围为58.03μm2至259.65μm2。B2B细胞的偶极子牵引是细胞扩散区(C)和细胞核扩散区(D)的函数。扩散和非迁移的B2B细胞显示出更高的牵引力(从47.50 nN到1051.48 nN),而细胞和细胞核面积较低。在扩散和迁移时,B2B细胞表现出较低的牵引力(从105.80 nN到310.28 nN),细胞和细胞核面积范围更大。缩写: YAP = 是相关蛋白;N = 原子核;C = 细胞质。请点击此处查看此图的放大版本。
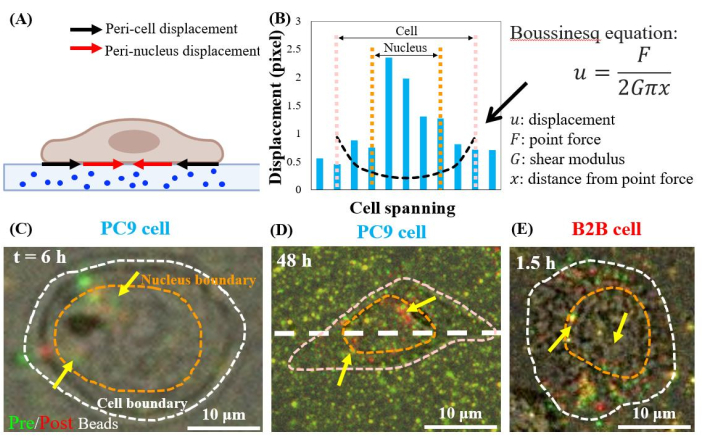
图7:正常B2B和癌PC9细胞中的核周位移。 (A)根据基板中的磁珠位移测量的核周和细胞周围位移的示意图侧视图。(B)沿细胞轴测量PC9电池下方的底物位移( 7D中的白色虚线)。由电池边界处的偶极子力产生的理论位移由Boussinesq方程(黑色虚线曲线)显示。(C)和(D)在连接后的第 6小时(俯视图)与PC9细胞的(红色)和不具有(绿色)细胞的重叠荧光珠图像。黄色(红色和绿色的精确重叠)珠子表示无位移。分开的绿色和红色珠子(黄色箭头指向)代表核周位移。黄色箭头表示这些收缩的核周斑点位于原子核的外围。(E)B2B细胞在细胞-底物附着后1.5小时 产生的核周位移。比例尺 = 10 μm (C–E)。 请点击此处查看此图的放大版本。
补充图S1:YAP-mNeonGreen21-10/11的基因组序列图。请点击此处下载此文件。
补充图S2:B2B正常细胞早期扩散期间YAP表达/分布、底物置换场和牵引场的变化。(A, D, G, J, M)将B2B细胞接种在5 kPa PAA凝胶上,并在初始细胞 - 底物附着后10小时内成像。YAP表达由绿色荧光强度表示。注意:细胞核内的YAP强度逐渐降低,但随着时间的推移仍然高于细胞质。颜色条表示 (A, D, G, J, M) 中 YAP 表达式的级别(绿色 = 高表达式;黑色 = 低表达式)。(B, E, H, K, N) 细胞位置的基底变形(与明场图像重叠)由每个时间点的位移场表示。位移方向和大小分别由箭头方向和颜色显示。随着细胞扩散面积的增加,B2B细胞体外围的位移变大。颜色条表示(B,E,H,K,N)中的位移幅度(深红色=高等;黑色=低星等)。 (C, F, I, L, O) 牵引场(与明场图像重叠)使用牵引力显微镜从位移场计算。牵引力集中在B2B细胞的外围。颜色条表示(C,F,I,L,O)中的牵引力幅度(深红色=高幅度;黑色=低幅度)。比例尺 = 20 μm。缩写: YAP = 是相关蛋白;PAA = 聚丙烯酰胺。请点击此处下载此文件。
补充图S3:PC9癌细胞早期扩散期间YAP表达/分布,底物置换场和牵引场的变化。(A, D, G, J) 将PC9细胞接种在5 kPa PAA凝胶上,并在初始细胞 - 底物附着后10小时内成像。YAP表达由绿色荧光强度表示。注意:细胞核内的YAP强度逐渐降低,但随着时间的推移仍然与细胞质中的YAP强度相似或略低。颜色条表示 (A, D, G, J) 中 YAP 表达式的级别(绿色 = 高表达式;黑色 = 低表达式)。(B, E, H, K) 细胞位置的基底变形(与明场图像重叠)由每个时间点的位移场表示。位移方向和大小分别由箭头方向和颜色显示。随着细胞扩散面积的增加,PC9细胞体外围的位移变变大。颜色条表示(B,E,H,K)中的位移幅度(深红色=高幅度;黑色=低等)。 (C, F, I, L)牵引场(与明场图像重叠)根据位移场计算。牵引力集中在PC9细胞的外围。颜色条表示(C,F,I,L)中的牵引力幅度(深红色=高幅度;黑色=低幅度)。比例尺 = 20 μm。缩写: YAP = 是相关蛋白;PAA = 聚丙烯酰胺。请点击此处下载此文件。
讨论
成像过程(步骤6.3)对于确保荧光图像具有足够好的质量以产生有效的定量结果至关重要。荧光蛋白或磁珠的z-stack图像应具有足够大的z范围,以包括样品跨越的所有Z位置的聚焦图像。另一个关键步骤是在溶解细胞后收集荧光珠的参考图像(步骤6.5)。由于参考图像需要在步骤6.3中的相同位置拍摄,因此不应在培养皿,环境室和显微镜之间引起相对位移。执行溶解步骤的调查人员必须小心地取下培养皿的盖子,并确保施加的机械扰动不足以改变培养皿在环境室中的位置。
下面提供了解决方案,以解决实验过程中可能发生的一些错误。如果在步骤 6.4 中单击 Enter 后未激活宏,则很可能是因为屏幕的左下角区域被非 Element 窗口占用。在这种情况下,需要清除窗口的左下角区域,以便在 Elements 中激活宏。另一个常见的错误是明场图像显示为黑色。这个问题是由获取荧光和明场图像之间的时间间隔不足引起的。荧光成像时间计数中的轻微延迟会随着时间的推移而累积,并导致相当大的延迟并干扰明场成像。一种解决方案是将所有位置的一个成像周期的持续时间调整为小于(不等于)连续运动开始之间的时间间隔。此操作将刷新时间计数,并消除每个映像周期开始时的累积误差。
这种全光学检测技术支持(1)广泛的硬件/软件,包括但不限于尼康,(2)不同类型的经过验证的水凝胶系统,包括明胶,PEG,基质凝胶和胶原蛋白I凝胶,以及(3)基于研究人员的不同需求的可编程定制。但是,如果商用显微镜无法提供任何底层控制功能,则使用AMFIP定制功能将变得具有挑战性。这种技术的另一个限制是样品在XY和焦点(Z)平面上的空间漂移。虽然在图像的后处理过程中可以克服这一限制,但必须改进自动对焦功能以校正样品的实时漂移。这种改进将提高成像过程的通量,并减少实验过程中漂移引起的潜在误差。
机电诊断器,如YAP,可以作为开发有前途的癌症疗法的新治疗靶点25,26,27。新出现的数据表明,YAP促进癌细胞的增殖和侵袭。力学诱导的YAP从细胞质到细胞核的易位激活了与细胞迁移,增殖,侵袭和凋亡相关的基因的转录,导致异常细胞行为28,29,30,31。这项工作旨在探索两种典型人肺癌和正常细胞系中YAP N / C比值与细胞力学的潜在相关性。在10小时细胞扩散期间,PC9细胞在细胞核和细胞质中显示出相似的YAP浓度(图3D和图5A)。B2B细胞在细胞核中显示出比细胞质中更高的YAP浓度(图3C和图5A)。在早期扩散阶段发现的这种关系与大多数已发表的研究结果不同,这些发现比较了正常细胞和癌细胞之间细胞核中的YAP浓度。虽然不一定处于早期扩散阶段,但大多数已发表的研究结果表明,YAP在癌细胞核中比在正常细胞核中更集中27,28。只有一项关于乳腺癌的研究报告了一个例外32,显示YAP更集中在细胞质中,这与我们目前在肺癌PC9细胞中的观察结果一致。据作者所知,这项工作是第一个在人类肺癌细胞系中显示较低的YAP N / C比率的工作。作者推测,PC9细胞中YAP N / C比率稳定的原因可能是由于细胞/细胞核扩散面积的低变化和PC9细胞在早期扩散阶段的牵引力。正在解剖PC9和B2B细胞中低YAP N / C比值的基础分子机制。
在铺展的前10小时内,这两个细胞系显示出YAP N / C比值,细胞牵引力和扩散面积之间的明显关系(图5)。对于B2B细胞,较高的YAP N / C比值与较高的细胞和细胞核扩散面积相关(图6A,B),这与其他正常细胞的报告数据一致33。有趣的是,尽管这种关系的发展趋势通常存在于所有记录的B2B细胞中,但发现了这种关系的两种不同程度(高和低)。同时扩散和迁移的B2B细胞表现出较低的牵引力和较高的细胞和细胞核扩散面积,YAP N / C比值较高(2.05±0.32)。对于扩散并保持在同一位置的B2B细胞,它们显示出更高的牵引力和较低的细胞和细胞核扩散面积,YAP N / C比值较低(1.74±0.21)。这两种度的关系在分叉的分散数据组中得到了证明(图6C,D)。如文献中报道的那样,静止的正常细胞,如胚胎成纤维细胞NIH 3T3细胞,具有比迁移细胞更高的牵引力34。本文报道的数据表明,扩散和非迁移的B2B细胞比扩散和迁移的B2B细胞具有更高的牵引力,可能表明非迁移细胞需要高牵引力才能在基质上稳定下来。
此外,这些数据表明,静止的正常B2B细胞产生更高的围核力,而其他研究人员之前的研究仅报告了在静止细胞外围产生的更高的细胞牵引力34,35,36,37。作者认为,实验中迁移的内在趋势的差异可能会导致这些矛盾的结果。在已发表的实验中,方形微图案被用来限制单个细胞的扩散并抑制迁移;细胞是否有迁移的倾向是未知的。由于迁移细胞通常在细胞的外围表现出高牵引力38,因此即使迁移受到限制,具有迁移倾向的细胞仍可能保持较高的外围牵引力。在本研究中,静止的细胞不受任何微模式的限制,但不迁移,这表明细胞倾向于维持其非迁移状态。另一种可能性是,由微图案定义的细胞形状可能会影响局灶粘附和牵引力的分布39。本研究的结果在没有任何限制性微图案的情况下产生,并代表了静止细胞在其原始形状中的力分布。
据作者所知,迄今为止只有一篇出版物专门报道了正常细胞(小鼠胚胎成纤维细胞)中围核力的发现,这可能是由横跨细胞核的肌动蛋白帽引起的40。YAP细胞质到细胞核的易位与核周力的增加相关40。对相关文献的彻底搜索没有发现任何报道癌细胞中围核力或肌动蛋白帽的出版物。一项关于黑色素瘤癌细胞的间接研究表明,肌动蛋白边缘(另一个位于细胞核周围但不覆盖细胞核的核周组织)降低了细胞迁移率41,间接表明存在核周力。然而,没有直接的实验数据报告。在这项研究中,作者发现PC9和B2B细胞都显示出核周位移和牵引力。核力量的产生机制及其影响仍然存在争议。据报道,在正常细胞中,肌动蛋白帽在调节细胞核形态和染色质组织42中起作用,通过核骨架和细胞骨架(LINC)复合物43的连接子将机械信号从局灶粘附传递到细胞核中,并调节细胞迁移44。层粘连蛋白A / C与肌动蛋白帽的形成和破坏有关40,41,42,43,44。然而,声称肌动蛋白帽产生围核力的报告并未考虑肌动蛋白边缘40的潜在作用。在癌细胞中,层粘连蛋白A的过表达促进肌动蛋白边缘的形成并限制癌细胞迁移。层粘连蛋白B的过表达会减少肌动蛋白边缘的形成并促进迁移。由于核周围肌动蛋白组织的存在和层粘连蛋白A的影响,围核力可能参与这一过程。然而,这项研究的结果没有显示任何测量的围核力或肌动蛋白帽行为的证据。因此,在本研究中发现PC9细胞中的围核力是第一份显示肺癌细胞中围核力和位移的报告。作者目前正在研究CRISPR / Cas9工程PC9和B2B细胞中围核力的分子机制和功能。
除了本文所展示的全光学机械生物学询问之外,集成的多功能系统还可以应用于光学探测生命系统中无数其他重要的生理和病理信号。例如,作者的实验室最近建立了多个稳定转导的人癌细胞系,共表达三种光响应膜蛋白:膜电压指示剂QuasAr2(激发:640nm;发射:660nm-740nm),膜电压去极化器CheRiff(激发:488nm)和膜电压超极化器eNpHR3(激发:590nm)。这三种功能蛋白可以通过光谱正交激光线以无串扰的方式激活,从而实现膜电生理学的全光双向信号通信(读出和控制)。使用集成的光电子系统和手动膜片钳,作者验证了单个人类癌细胞和多细胞肿瘤球体中膜电压(Vm)的全光学控制和读数。全光电生理学询问为详细探索癌细胞中以前无法获得的生物电提供了可能性,这可能有助于从新轴上推进肿瘤生物学。
披露声明
无需声明任何利益冲突。
致谢
该项目得到了UF健康癌症中心(X.T.和D.S.)的癌症试点奖和佳得乐奖启动包(X.T.)的财政支持。作者衷心感谢与Jonathan Licht博士(UFHCC),Rolf Renne博士(UFHCC),Ji-Hyun Lee博士(Biostatistics,UF),Hugh Fan博士(MAE,UF),Warren Dixon博士(MAE,UF),Ghatu Subhash博士(MAE,UF),Mark Sheplak博士(MAE和ECE,UF),Malisa Sarntinoranont博士(MAE,UF),Scott Banks博士(MAE,UF)的智力讨论和技术支持。 UF),Matthew Traum博士(MAE,UF),David Hahn博士(亚利桑那大学),王伟宏博士(甲骨文公司),Tan优华博士(香港理工大学)以及尼康的支持团队(Jose Serrano-Velez博士,Larry Kordon博士和Jon Ekman博士)。作者非常感谢Tang's,Siemann's和Guan研究实验室的所有成员以及MAE&ECE和物理与放射肿瘤科(UF)的所有工作人员的慷慨和有效的支持。
材料
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Sigma-aldrich | 440140 | |
| 0.05 % Trypsin | Corning | 25-051-CI | |
| 75 cm2 flask | Corning | 430641U | |
| 8 Benchtop Centrifuge | Thermo | 75007210 | |
| A1R confocal system | Nikon | HD25 | |
| Acetic acid | Sigma-aldrich | 695092 | glacial, ACS reagent, ≥99.7% |
| BEAS-2B (B2B) cells | Sigma-aldrich | 95102433 | human epithelial cells from lung tissue |
| Carboxylate-Modified Microspheres | Invitrogen | F8797 | |
| Culture medium (RPMI-1640) | Gibco | 11875093 | |
| Desktop Computer | Dell | 2018 | with Windows 10 operating system |
| Environmental chamber TIZB | Tokai Hit | TIZB | |
| Fetal bovine serum (FBS) | Gibco | 26140 | |
| Fibronectin Human Protein, Plasma | Gibco | 33016015 | |
| Fiji ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | 1.53k | |
| Glass-bottom petri dish | MatTek | P35G-1.5-14-C | |
| HEPES buffered saline | Sigma-aldrich | 51558 | |
| Hydrazine hydrate solution | Sigma-aldrich | 53847 | |
| IntelliJ IDEA | JetBrains | 2020 | Java development platform |
| Java Development Kit | Oracle | 14.0 | |
| Kimwipe | Kimtech Science | 3066-05 | |
| MATLAB | MathWorks | 2020b | |
| Monochrome Camera | FLIR | BFS-U3-70S7M-C | |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-218 | |
| N,N′-Methylenebisacrylamide solution | Sigma-aldrich | M1533 | |
| NIS-Elements software platform | Nikon | 4.50 | software platform |
| Origin | OriginLab | OriginPro 2017 (Learning Edition) | data analysis and graphing software |
| Penicillin-streptomycin | Gibco | 15140122 | |
| PC9 cells | Sigma-aldrich | 90071810 | human adenocarcinoma cells from lung tissue |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | F-553S | high-fidelity DNA polymerase |
| Scotch tape | Scotch | adhesive tape | |
| Sodium dodecyl sulfate solution | Sigma-aldrich | 05030 | |
| Super glue | Gorilla | cyanoacrylate glue | |
| Ti2-E inverted microscope | Nikon | MEA54000 | |
| TI2-S-SE-E Motorized Stage with Encoder | Nikon | MEC56120 | |
| μManager | version 2.0 gamma | open source microscopy software (https://micro-manager.org/) |
参考文献
- Werley, C., Boccardo, S., Rigamonti, A., Hansson, E., Cohen, A. Multiplexed optical sensors in arrayed islands of cells for multimodal recordings of cellular physiology. Nature Communications. 11 (1), 3881 (2020).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Saraswathibhatla, A., Galles, E. E., Notbohm, J. Spatiotemporal force and motion in collective cell migration. Scientific Data. 7 (1), 197 (2020).
- Saraswathibhatla, A., Henkes, S., Galles, E. E., Sknepnek, R., Notbohm, J. Coordinated tractions control the size of a collectively moving pack in a cell monolayer. Extreme Mechanics Letters. 48, 101438 (2021).
- Wang, W., Kim, C. K., Ting, A. Y. Molecular tools for imaging and recording neuronal activity. Nature Chemical Biology. 15 (2), 101-110 (2019).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature Methods. 9 (7), 697-710 (2012).
- Carpenter, A. E., Kamentsky, L., Eliceiri, K. W. A call for bioimaging software usability. Nature Methods. 9 (7), 666-670 (2012).
- Skylaki, S., Hilsenbeck, O., Schroeder, T. Challenges in long-term imaging and quantification of single-cell dynamics. Nature Biotechnology. 34 (11), 1137-1144 (2016).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Luo, Q., et al. Automatic multi-functional integration program (AMFIP) towards all-optical mechanobiology interrogation. bioRxiv. , (2021).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer control of microscopes using manager. Current Protocols in Molecular Biology. 92 (1), 14-20 (2010).
- Tulpule, A., et al. Kinase-mediated RAS signaling via membraneless cytoplasmic protein granules. Cell. 184 (10), 2649-2664 (2021).
- Tang, X., Tofangchi, A., Anand, S. V., Saif, T. A. A novel cell traction force microscopy to study multi-cellular system. PLOS Computational Biology. 10 (6), 1003631 (2014).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews Materials. 5, 351-370 (2020).
- Phelps, E. A., et al. Maleimide cross-linked bioactive PEG hydrogel exhibits improved reaction kinetics and cross-linking for cell encapsulation and in situ delivery. Advanced Materials. 24 (1), 64-70 (2012).
- Bajaj, P., Tang, X., Saif, T. A., Bashir, R. Stiffness of the substrate influences the phenotype of embryonic chicken cardiac myocytes. Journal of Biomedical Materials Research. Part A. 95 (4), 1261-1269 (2010).
- Temples, M. N., Adjei, I. M., Nimocks, P. M., Djeu, J., Sharma, B. Engineered three-dimensional tumor models to study natural killer cell suppression. ACS Biomaterials Science & Engineering. 6 (7), 4179-4199 (2020).
- Feng, S., et al. Improved split fluorescent proteins for endogenous protein labeling. Nature Communications. 8, 370 (2017).
- Guan, J., Liu, H., Shi, X., Feng, S., Huang, B. Tracking multiple genomic elements using correlative CRISPR imaging and sequential DNA FISH. Biophysical Journal. 112 (6), 1077-1084 (2017).
- . Micro-Manager Available from: https://micro-manager.org/wiki/NikonTi2 (2021)
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Martiel, J. L., et al. Measurement of cell traction forces with ImageJ. Methods in Cell Biology. 125, 269-287 (2015).
- Okumurai, I. A. On the generalization of Cerruti's problem in an elastic half-space. Doboku Gakkai Ronbunshu. 1995, 1-10 (1995).
- Piccolo, S., Dupont, S., Cordenonsi, M. The biology of YAP/TAZ: hippo signaling and beyond. Physiological Reviews. 94 (4), 1287-1312 (2014).
- Hong, W. W., Guan, K. L. The YAP and TAZ transcription co-activators: Key downstream effectors of the mammalian Hippo pathway. Seminars in Cell and Developmental Biology. 23 (7), 785-793 (2012).
- Zanconato, F., Cordenonsi, M., Piccolo, S. YAP/TAZ at the roots of cancer. Cancer Cell. 29 (6), 783-803 (2016).
- Wang, Y., et al. Overexpression of yes-associated protein contributes to progression and poor prognosis of non-small-cell lung cancer. Cancer Science. 101 (5), 1279-1285 (2010).
- Li, H., et al. Inhibition of YAP suppresses CML cell proliferation and enhances efficacy of imatinib in vitro and in vivo. Journal of Experimental & Clinical Cancer Research. 35 (1), 134 (2016).
- Tang, X., et al. A mechanically-induced colon cancer cell population shows increased metastatic potential. Molecular Cancer. 13, 131 (2014).
- Panciera, T., Azzolin, L., Cordenonsi, M., Piccolo, S. Mechanobiology of YAP and TAZ in physiology and disease. Nature Reviews Molecular Cell Biology. 18 (12), 758-770 (2017).
- Yuan, M., et al. Yes-associated protein (YAP) functions as a tumor suppressor in breast. Cell Death and Differentiation. 15 (11), 1752-1759 (2008).
- Koushki, N., et al. Lamin A redistribution mediated by nuclear deformation determines dynamic localization of YAP. bioRxiv. , (2020).
- Chang, S. S., Rape, A. D., Wong, S. A., Guo, W. H., Wang, Y. L. Migration regulates cellular mechanical states. Molecular Biology of the Cell. 30 (26), 3104-3111 (2019).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Geometric guidance of integrin mediated traction stress during stem cell differentiation. Biomaterials. 69, 174-183 (2015).
- Lee, J., Abdeen, A., Tang, X., Saif, T. A., Kilian, K. A. Matrix directed adipogenesis and neurogenesis of mesenchymal stem cells derived from adipose tissue and bone marrow. Acta Biomaterialia. 42, 46-55 (2016).
- Tang, X., Bajaj, P., Bashir, R., Saif, T. A. How far cardiac cells can see each other mechanically. Soft Matter. 7 (13), 6151-6158 (2011).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Rape, A., Guo, W. H., Wang, Y. L. The regulation of traction force in relation to cell shape and focal adhesions. Biomaterials. 32 (8), 2043-2051 (2011).
- Shiu, J. Y., Aires, L., Lin, Z., Vogel, V. Nanopillar force measurements reveal actin-cap-mediated YAP mechanotransduction. Nature Cell Biology. 20 (3), 262-271 (2018).
- Fracchia, A., Asraf, T., Salmon-Divon, M., Gerlitz, G. Increased lamin B1 levels promote cell migration by altering perinuclear actin organization. Cells. 9 (10), 2161 (2020).
- Ramdas, N. M., Shivashankar, G. V. Cytoskeletal control of nuclear morphology and chromatin o1rganization. Journal of Molecular Biology. 427 (3), 695-706 (2015).
- Khatau, S. B., et al. A perinuclear actin cap regulates nuclear shape. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19017-19022 (2009).
- Kim, D. H., Cho, S., Wirtz, D. Tight coupling between nucleus and cell migration through the perinuclear actin cap. Journal of Cell Science. 127 (11), 2528-2541 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。