Method Article
Rein optische Mechanobiologie Befragung von Yes-assoziiertem Protein in menschlichen Krebs- und normalen Zellen mit einem multifunktionalen System
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieser Artikel stellt ein detailliertes schrittweises Protokoll zur Verwendung eines integrierten multifunktionalen und benutzerprogrammierbaren Systems vor, das eine automatische Mehrkanalbildgebung und mechanobiologische Analyse ermöglicht, um die Mechanosensitivität des Yes-assoziierten Proteins (YAP) aufzuklären.
Zusammenfassung
Die langfristige multifunktionale Bildgebung und Analyse lebender Zellen erfordert eine optimierte, funktionale Koordination verschiedener Hard- und Softwareplattformen. Die manuelle Steuerung verschiedener Geräte verschiedener Hersteller ist jedoch arbeits- und zeitaufwändig, was die Genauigkeit, Reproduzierbarkeit und Qualität der erfassten Daten beeinträchtigen kann. Daher kann ein All-in-One- und benutzerprogrammierbares System, das eine automatische, multifunktionale und langfristige Bilderfassung ermöglicht und mit den meisten fluoreszierenden Mikroskopieplattformen kompatibel ist, der wissenschaftlichen Gemeinschaft zugute kommen. In diesem Dokument werden die vollständigen Betriebsprotokolle für die Verwendung eines neuartigen integrierten Softwaresystems vorgestellt, das aus (1) einem selbst entwickelten Softwareprogramm mit dem Titel "Automatic Multi-functional Integration Program (AMFIP)" besteht, das eine automatische Mehrkanal-Bildgebungserfassung ermöglicht, und (2) einer Reihe von quantitativen Bildgebungsanalyse- und Zelltraktionsberechnungspaketen.
Dieses integrierte System wird angewendet, um die bisher unbekannte Beziehung zwischen der räumlich-zeitlichen Verteilung des mechanosensitiven Yes-assoziierten Proteins (YAP) und der Zellmechanik, einschließlich Zellstreuung und Traktion, in CRISPR/Cas9-konstruierten menschlichen Normalzellen (B2B) und Lungenkrebszellen (PC9) aufzudecken. Durch die Nutzung der Fähigkeit dieses Systems zur Mehrkanalsteuerung und -auslesung zeigt das Ergebnis: (1) B2B-Normalzellen und PC9-Krebszellen zeigen eine deutliche Beziehung zwischen YAP-Expression, Traktion und Zelldynamik während der Zellausbreitung und Migrationsprozesse; und (2) PC9-Krebszellen üben spürbare perinukleäre Kräfte auf Substrate aus. Zusammenfassend stellt dieses Dokument ein detailliertes schrittweises Protokoll zur Verwendung eines integrierten benutzerprogrammierbaren Systems vor, das eine automatische multifunktionale Bildgebung und Analyse zur Aufklärung der YAP-Mechano-Empfindlichkeit ermöglicht. Diese Werkzeuge eröffnen die Möglichkeit für detaillierte Erkundungen vielfältiger Signaldynamiken im Kontext der Zellphysiologie und -pathologie.
Einleitung
Das übergeordnete Ziel dieser Methode ist es, eine rein optische multifunktionale Bildgebung und Analyse lebender Zellen zu ermöglichen. Ein All-in-One-Bildgebungsprogramm, das die automatische Koordination multifunktionaler optoelektronischer Geräte ermöglicht, reduziert arbeitsintensive und fehleranfällige manuelle Operationen und ist für Forscher unerlässlich, um eine langfristige Lebendzellbildgebung durchzuführen1,2,3,4. Die meisten bestehenden öffentlichen Programme in der biomedizinischen Forschungsgemeinschaft gelten jedoch entweder nur für begrenzte optoelektronische Geräte oder erfordern zusätzliche Hardware für die Koordination verschiedener Geräte5,6,7,8,9. Vor kurzem wurde ein Open-Source- und Software-basiertes Programm mit dem Titel "Automatic Multi-functional Integration Program (AMFIP)" entwickelt, das Multi-Channel- und Zeitraffer-Imaging ermöglicht. Basierend auf der Java-Sprache und der Anwendungsprogrammierschnittstelle (API) von μManager11,12 wurde AMFIP als Plugin in μManager entwickelt, das benutzerdefinierte Java-Skripte ausführt, um die softwarebasierte Kommunikation mehrerer optoelektronischer Hardware- und Softwareplattformen zu ermöglichen, einschließlich, aber nicht beschränkt auf die von Nikon. Die Etablierung von AMFIP eröffnet die Möglichkeit zur programmierbaren und multifunktionalen Abfrage von Zellverhalten. In dieser Arbeit wird ein integriertes experimentelles und computergestütztes System entwickelt, das AMFIP mit digitaler Bildgebungsanalyse und Zelltraktionskraftmikroskopie kombiniert. Das System ermöglicht die Aufklärung der ausgeprägten YAP-Mechanobiologie in CRISPR/Cas9-manipulierten normalen B2B- (Abbildung 1) und Lungenkrebs-PC9- (Abbildung 2) Zelllinien. Das System bietet der wissenschaftlichen Gemeinschaft eine umfassende Lösung, die die Notwendigkeit vermeidet, zusätzliche Kontrollgeräte zu kaufen, die möglicherweise nicht für jedes Bildgebungssystem verfügbar und / oder kompatibel sind.
Die in diesem Dokument vorgestellten Protokolle stellen vor, wie (1) AMFIP angewendet werden kann, um eine automatische Langzeitbildgebung für beide CRISPR/Cas9-Zelllinien durchzuführen, die mNEonGreen2-markiertes YAP exprimieren; und (2) Fidschi ImageJ, MATLAB und Origin für die quantitative Analyse des YAP-Kern-/Zytoplasma-Verhältnisses (N/C) basierend auf ihrer Fluoreszenzintensität (Abbildung 3 und Abbildung 4), dem zellulären Verschiebungsfeld (Abbildung 1C und Abbildung 2C) und dem zellulären Traktionsfeld (Abbildung 1D und Abbildung 2D) kombinieren ). Die Ergebnisse deuten darauf hin, dass (1) während der ersten 10 h der Zellausbreitung auf den Substraten mit physiologisch relevanter mechanischer Steifigkeit13,14,15,16,17,18 das YAP-N/C-Verhältnis einzelner B2B-Zellen im Vergleich zu einzelnen PC9-Zellen eine deutlichere zeitabhängige Variation und Fluktuation aufweist (Abbildung 5 und Abbildung 6 ); und (2) PC9-Krebszellen erzeugen eine spürbare Traktion in ihren perinukleären Regionen (Abbildung 7). Das integrierte System und die methoden, die in diesem Protokoll beschrieben werden, gehen über die spezifischen Zelltypen und optogenetischen Moleküle hinaus. Forscher können die Protokolle anwenden, um ihre spezifischen Live-Cell-Interrogationsexperimente anzupassen und facettenreiche Signaldynamiken im Kontext der Zellphysiologie und -pathologie aufzuklären.
Protokoll
1. Generierung einer stabilen CRISPR/Cas9-editierten menschlichen Lungenkrebszelllinie (PC9) und einer humanen bronchialen Epithelzelllinie (Beas2B), die endogen das mNeonGreen21-10/11-markierte YAP-Protein exprimieren
- Führen Sie eine Polymerase-Kettenreaktion (PCR) durch, um die DNA-Sequenz zu amplifizieren, die den 11. Strang des Fluoreszenzproteins mNeonGreen2 mit der High-Fidelity-DNA-Polymerase kodiert (siehe Materialtabelle).
- Knock-in die amplifizierte DNA-Sequenz in den YAP-Genomlocus der PC9- und B2B-Zelllinien mit dem CRISPR-Cas9-Gen-Editing-System.
HINWEIS: Diese DNA-Sequenz ergänzt die Stränge 1-10 von mNeonGreen2, um Fluoreszenz zu emittieren. Die genomische Sequenzkarte von YAP-mNeonGreen21-10/11 ist in der ergänzenden Abbildung S1 dargestellt. Die Karte enthält die beschrifteten genomischen, Donor- und mNeonGreen2-Sequenzen. - Überprüfen Sie die VON CRISPR/Cas9 entwickelte mNeonGreen2-Expression mit einem Epifluoreszenzmikroskop (siehe Materialtabelle). Da der mNeonGreen2 immer dann mit YAP markiert wird, wenn die Zellen YAP im Kontext seines nativen genregulatorischen Netzwerks exprimieren, überprüfen Sie das Vorhandensein der Fluoreszenzintensität in beiden CRISPR / Cas9-konstruierten Zellen und vergleichen Sie sie mit der in den Elternzellen (Kontrolle).
HINWEIS: Um diesem Protokoll zu folgen, verwenden Sie (1) einen 488-nm-Laser (47,5 mW/mm2) zur Anregung, (2) ein 40-faches Objektiv (numerische Apertur (NA) = 0,95) und einen Bandpass-Emissionsfilter (ET525/50 nm) für die Fluoreszenzmessung und (3) die ImageJ-Software zum Messen, Quantifizieren und Vergleichen der Fluoreszenzintensitäten. - Bestätigung der korrekten Integration von mNeonGreen211 durch Extraktion genomischer DNA aus den CRISPR/Cas9-editierten Zelllinien; PCR unter Verwendung von Primern, die das genomische Insert flankieren, und Sequenzierung durchführen, um die Insertion am richtigen genomischen Loci zu bestätigen19,20.
- Schlagen Sie den mNeonGreen211 mit dem CRISPR/Cas9-Gen-Editing-System nieder und überprüfen Sie die Verringerung der Fluoreszenzintensität in Zellen mit den gleichen Mikroskopsystemen und Bildgebungsparametern, die in Schritt 1.3 beschrieben sind.
HINWEIS: Dieser Schritt bestätigt die korrekte Integration von mNeonGreen211 durch den Vergleich der Fluoreszenzintensitäten. Die CRISPR/Cas9-konstruierten Zellen ohne Knock-Down- und Elternzellen werden als Kontrolle verwendet. - Sammeln Sie die Zellen mit dem markierten Protein von Interesse durch Fluoreszenz-aktivierte Zellsortierung (FACS).
- Um Zellen für die FACS-Sortierung vorzubereiten, trypsinisieren Sie sie und resuspendieren Sie sie in phosphatgepufferter Kochsalzlösung (PBS).
- Sammeln Sie Zellen mit mNeonGreen2-Fluoreszenz oberhalb des Hintergrundniveaus der Elternzelllinien in zwei anreichernden Runden der FACS-Sortierung.
HINWEIS: Die Zeitleiste zur Generierung der hier beschriebenen CRISPR/Cas9-editierten Zelllinien liegt in der Größenordnung von 1-2 Monaten. Alle Zelllinien werden auf Anfrage öffentlich zugänglich gemacht, damit andere Forschungslabore die Ergebnisse reproduzieren können.
2. Wartung von PC9- und B2B-Zellen
- Halten Sie beide Zelllinien in befeuchteten Gewebekultur-Inkubatoren mit 5% CO2 bei 37 °C.
- Kultur 106 endogen markierte PC9- und Beas2B-Zellen in 75 cm2-Kolben mit 12 ml RPMI-1640-Medium, ergänzt mit 10% fetalem Rinderserum und 100 μg/ml Penicillin-Streptomycin. Subkulturieren Sie beide Zelllinien, wenn die Zellkonfluenz ~ 80% erreicht.
- Testen Sie beide Zelllinien alle 3 Monate mit einem Mykoplasmen-Nachweiskit auf Mykoplasmen, wobei Sie alle vom Hersteller empfohlenen Protokolle strikt befolgen.
- Lagern Sie die Zelllinien in einem -80 °C Gefrierschrank.
- Verwenden Sie die Zelllinien, die <20 Passagen vom Tauwetter für alle Experimente sind.
3. Einrichtung der Hard- und Softwareumgebung
- Aufbau der Hardwareumgebung des Experiments
- Schließen Sie den konfokalen Controller und das inverse Mikroskop an den Computer an (siehe Materialtabelle).
- Installieren Sie die Softwareplattform (Tabelle der Materialien).
- Schalten Sie den konfokalen Controller und das inverse Mikroskop ein. Starten Sie als Nächstes Elements.
- Öffnen Sie die Bedienfelder des konfokalen, Laser- und inversen Mikroskops in Elements. Überprüfen Sie als Nächstes, ob die drei Panels ordnungsgemäß funktionieren, indem Sie die Bewegung der motorisierten Stufe, das Schalten der Mikroskopobjektive und das räumliche Scannen der Laserlinien testen.
- Einrichtung der Softwareumgebung von AMFIP
- Installieren Sie IntelliJ, Java Development Kit 14.0, μManager Version 2.0 gamma und Fiji ImageJ auf dem Computer.
- Öffnen Sie das von GitHub heruntergeladene AMFIP-Projekt (Link: https://github.com/njheadshotz/AMFIP) in IntelliJ.
- Klicken Sie auf Einstellungen | Compiler-| Anmerkungsprozessoren und aktivieren Sie Anmerkungsverarbeitung aktivieren.
- Klicken Sie auf Projektstruktur | Artefakte und erstellen Sie eine JAR-Datei. Setzen Sie das Ausgabeverzeichnis unter dem Verzeichnis μManager auf mmplugins.
- Klicken Sie auf Projektstruktur | Bibliotheken und fügen Sie mmplugins und Plugins im Verzeichnis μManager hinzu.
- Klicken Sie im Dropdown-Menü Ausführen auf Konfiguration hinzufügen und erstellen Sie eine Anwendung.
- Geben Sie ij ein. ImageJ in die Main-Klasse.
- Geben Sie -Xmx3000m -Dforce.annotation.index=true in die VM-Option ein.
- Legen Sie das Verzeichnis μManager auf das Verzeichnis Work fest.
- Klicken Sie auf Ausführen , um μManager mit dem AMFIP-Plugin zu aktivieren.
- Verbinden Sie den μManager mit dem inversen Mikroskop.
- Fügen Sie den adaptiven Treiber des inversen mikroskops21 zum Verzeichnis μManager hinzu.
- Öffnen Sie μManager. Klicken Sie auf Geräte | Hardwarekonfigurations-Assistent und erstellen Sie eine neue Konfiguration.
- Fügen Sie den Ti2-Treiber unter Verfügbare Geräte hinzu.
- Wählen Sie alle Peripheriegeräte aus und speichern Sie die neue Konfigurationsdatei.
- Starten Sie μManager neu und wählen Sie die Konfigurationsdatei in Schritt 3.2.4 unter Micro-Manager-Startkonfiguration aus.
4. Gel-Zubereitung
- Behandeln Sie den Glasdecker mit 3-Aminopropyltrymethoxysilan für 7 min bei Raumtemperatur (24 °C).
- Verwenden Sie entionisiertes (DI) Wasser, um den Glasdeckslip zu spülen und den Deckglas für 20 min bei 160 °C zu trocknen.
- Den Glasdecker 30 min mit 0,5% Glutaraldehyd behandeln und mit DI-Wasser abspülen.
- Mischen Sie Acrylamidlösung, N,N'-Methylenbisacrylamid (bis) -Lösung und fluoreszierende Kügelchen, die in 10 mM HEPES-gepufferter Kochsalzlösung suspendiert sind. Verwenden Sie 10% (w/v) Ammoniumpersulfatlösung und N,N,N′,N′-Tetramethylethylendiamin (TEMED) als Initiatoren der Polymerisation. Ändern Sie den Prozentsatz jeder Komponente, um die gewünschte mechanische Steifigkeit von Polyacrylamid (PAA)-Hydrogelen nach den zuvor beschriebenen etablierten Protokollen zu erreichen13,14.
ANMERKUNG: In diesem Protokoll 2 kPa Gel: Acrylamid = 12,5% und Bisacrylamid = 6,5%; 5 kPa Gel: Acrylamid = 12,5% und Bisacrylamid = 21,5%; und 40 kPa Gel: Acrylamid = 12,5% und Bis-Acrylamid = 31,5%. Alle aufgeführten % sind Volumenprozentsätze. - Nach 35 min den Glasdecker vom erstarrten PAA-Hydrogel schälen und das Hydrogel zweimal mit 50 mM HEPES-gepufferter Kochsalzlösung waschen (jeweils 5 min).
- Behandeln Sie die Hydrogeloberfläche mit einer Hydrazin-Hydrat-Lösung für 6 h.
- Spülen Sie das Hydrogel mit Essigsäure für 30 min. Die Essigsäure entfernen und mit PBS 30 min ausspülen.
- Oxidieren Sie die Fibronektinlösung (50 μg/ml in PBS) mit Natriumperilat für 30 min.
- Beschichten Sie die Hydrogeloberfläche mit der oxidierten Fibronektinlösung und warten Sie 35 min.
- Fügen Sie PBS hinzu, um das Hydrogel einzutauchen und bei 4 ° C zu lagern. Decken Sie alle Petrischalen, die die Hydrogele enthalten, mit Aluminiumfolie ab, um lichteinwirkung der Hydrogele zu vermeiden.
5. Zellkultur
HINWEIS: Führen Sie die Zellkultur mit aseptischer Technik durch.
- Verbinden Sie die Glasdeckgläser mit den PAA-Hydrogelen mit der 35 mm großen Glasboden-Petrischale, um ein physikalisches Driften von Gelen während der Zellsaat- und Bildgebungsprozesse zu vermeiden.
- Heben Sie mit einer sterilisierten, sauberen Pinzette den Deckglas (mit dem PAA-Hydrogel oben) aus der Petrischale mit den vorbereiteten Gelen.
- Verwenden Sie ein trockenes Tuch, um Wassertröpfchen auf der Unterseite des Glasdeckglases zu entfernen.
- Verwenden Sie die sterilisierte Pinzette, um den Glasdecker zu halten.
- Legen Sie kleine Tröpfchen (1-5 μL) Cyanacrylatkleber an den beiden diagonalen Ecken auf der Unterseite.
- Verwenden Sie sterilisierte Tücher, um überschüssigen Klebstoff zu entfernen.
- Verwenden Sie die sterilisierte Pinzette, um den Deckglas in der Petrischale mit Glasboden zu ersetzen. Drücken Sie die Ecken des Deckglases leicht an, um sicherzustellen, dass die Leimtröpfchen vollständig mit der Oberfläche der Petrischale in Kontakt kommen.
- Setzen Sie den Deckel wieder auf die Petrischale, um die Verdunstung von PBS in den PAA-Hydrogelen zu minimieren. Warten Sie 3 Minuten, damit der Kleber in der Petrischale erstarren und trocknen kann.
- Füllen Sie die Petrischale mit 4 ml PBS.
- Wiederholen Sie die obigen Schritte 5.1.1-5.1.8 für die verbleibenden PAA-Hydrogelproben in den Petrischalen, die für die Bildgebung verwendet werden.
- Verwenden Sie 75% Ethanol, um die äußere Oberfläche aller Petrischalen zu sterilisieren und sie in die Biosicherheitskammer der Gewebekultur zu übertragen. Schalten Sie das ultraviolette Licht für 5 minuten ein und sterilisieren Sie die Proben.
- Säen Sie die Zellen auf die Oberseite des Gels.
- Schalten Sie das ultraviolette Licht aus. Nehmen Sie den Kolben (mit B2B/PC9-Zellen) aus dem 37 °C-Inkubator in die Biosicherheitswerkbank. Verwenden Sie eine Pipette, die an eine Vakuumpumpe angeschlossen ist, um das gesamte Kulturmedium abzusaugen, und fügen Sie 5 ml PBS hinzu, um den Kolben zu waschen.
- Fügen Sie 2 ml 0,05% Trypsin hinzu, um die Zellen vom Boden des Kolbens zu lösen.
- Stellen Sie den Kolben in den Inkubator. Warten Sie 5 Min.
- Den Kolben in die Biosicherheitswerkbank überführen. 8 ml frisches Kulturmedium in den Kolben geben und mehrmals auf und ab pipettieren, um die Zellen homogen zu suspendieren.
- Alle 10 ml der Zellsuspension in ein 15-ml-Röhrchen geben und bei 300 × g für 5 min zentrifugieren.
- Überprüfen Sie das Zellpellet an der Unterseite des Röhrchens. Kippen Sie das Röhrchen langsam horizontal und entfernen Sie mit der Saugpipette das gesamte Kulturmedium aus dem Röhrchen, ohne das Zellpellet zu berühren. Als nächstes fügen Sie 8 ml frisches Kulturmedium hinzu und pipettieren Sie mehrmals auf und ab, bis alle Zellen homogen mit dem Medium gemischt sind.
- 100 μL der Zellsuspension (150 Zellen/μL) auf die Geloberfläche auftragen und 5 min warten. Als nächstes fügen Sie langsam 4 ml frisches Kulturmedium zu den Petrischalen hinzu; Vermeiden Sie es, das frische Medium direkt auf das Gel zu geben.
- Stellen Sie die Petrischale in den 37 °C Inkubator. Warten Sie, bis sich die Zellen an die Geloberfläche anlagern können (B2B: 0,5-1 h; PC9: 4-5 h).
6. Zellbildgebung
HINWEIS: AMFIP ermöglicht eine automatische, mehrkanalige und langfristige Bildgebung durch Koordination mit verschiedenen Hardware- und Softwaresystemen: (1) AMFIP manipuliert μManager, um die motorisierte Stufe des Ti2-E-Mikroskops automatisch in mehrere Sichtfelder (FOVs) zu bewegen und Hellfeldbilder über eine monochrome Kamera aufzunehmen (Materialtabelle); und (2) AMFIP aktiviert mehrere Makrodateien in Elements mit einem benutzerdefinierten Java-Skript, um automatische Operationen für die konfokale Z-Stack-Bildgebung und das Umschalten verschiedener Laserkanäle (405 nm und 488 nm) durchzuführen.
- Legen Sie die Umgebung für die Langzeitbildgebung fest.
- Stellen Sie die Umgebungskammer auf die motorisierte Bühne des inversen Mikroskops. Stellen Sie den CO2-Durchfluss auf 160 ml/min ein und stellen Sie die Temperatur der Kammer ein (oben: 44 °C; Bad: 42 °C; Stufe: 40 °C). Als nächstes fügen Sie 40 ml gereinigtes Wasser in das Bad der Kammer hinzu.
- Nehmen Sie die Glasboden-Petrischale mit Zellen aus dem Inkubator heraus und stellen Sie sie in die Umgebungskammer.
- Schalten Sie den konfokalen Controller und das inverse Mikroskop ein. Schalten Sie den Lichtweg nach rechts und beobachten Sie die Zellen, die sich mit μManager verbinden. Wenn genügend Zellen an das Gel gebunden sind, übertragen Sie die Petrischale zurück in den Inkubator. Wenn nicht genügend Zellen an das Gel gebunden sind, setzen Sie die Zellinkubation für weitere 30 minuten für B2B und 60 minuten für PC9-Zellen fort.
- Schneiden Sie zwei kleine Stücke Klebeband und kleben Sie sie auf die Kammer um das kreisförmige Loch. Als nächstes tragen Sie etwas Klebstoff auf das Klebeband auf (nur auf den Bereich, den die Petrischale abdecken wird).
- Nehmen Sie die Petrischale aus dem Inkubator heraus. Als nächstes legen Sie die Petrischale langsam in die Kammer und lassen Sie den Boden der Schale mit dem Klebstoff in Kontakt kommen.
- Drücken Sie den Deckel der Petrischale für 1 min, damit der Kleber vollen Kontakt mit der Petrischale aufnehmen und erstarren kann. Als nächstes drücken Sie die Petrischale vorsichtig horizontal, um zu bestätigen, dass die Petrischale in der Kammer unbeweglich ist.
- Schließen Sie den Deckel der Kammer.
- Legen Sie die Bildaufnahmeparameter für die Hellfeldbildgebung fest.
- Öffnen Sie IntelliJ und setzen Sie einen Parameter T1 (z. B. 120 s) in Zeile 93 der Datei Elements_script.java. Stellen Sie sicher, dass dieser Wert größer ist als die Laufzeit des Makros in Elements, die für die konfokale Abbildung eines Sichtfelds (FOV) verwendet werden. Klicken Sie auf die Schaltfläche Ausführen , um das AMFIP IntelliJ-Projekt zu starten.
- Klicken Sie auf der Hauptoberfläche von μManager auf die Schaltfläche Live und Multi-D Acq. Schalten Sie als Nächstes den Lichtweg des inversen Mikroskops für die Hellfeldbildgebung nach rechts, wechseln Sie zum 10-fachen Objektiv und öffnen Sie das Licht der Leuchtdiode (LED) (die Lichtquelle für die Hellfeldbildgebung; Intensität: 5%).
- Klicken Sie auf den Lichtweg, das Mikroskopobjektiv und die LED-Lampentaste im Elements Ti2 Panel oder drücken Sie manuell die entsprechenden Tasten am Mikroskop.
- Stellen Sie den XY-Joystick und den Knopf der Z-Ebene ein, um die richtige Position und die Fokusebene des Gels auf der Petrischale zu finden. Verwenden Sie ein 10-faches Objektiv, um die geeigneten FOVs von mehreren einzelnen Zellen zu finden, die an das Gel gebunden sind.
- Aktivieren Sie im Fenster Mehrdimensionale Erfassung das Kontrollkästchen Mehrere Positionen (XY). Klicken Sie auf die Schaltfläche Positionsliste bearbeiten... und beobachten Sie das Fenster Bühnenpositionsliste, das angezeigt wird. Als nächstes ändern Sie das Ziel auf 40x, erhöhen Sie die Intensität des LED-Lichts auf 15%, passen Sie die XY-motorisierte Bühne neu an, um die FOVs zu lokalisieren, und notieren Sie die Koordinaten, indem Sie auf die Schaltfläche Markieren im Fenster Bühnenpositionsliste klicken.
- Rekord 67 gewünschte FOVs. Klicken Sie im Fenster Bühnenpositionsliste auf die Schaltfläche Speichern unter..., um die Koordinaten aufzuzeichnen. Geben Sie T1 (der in Schritt 6.2.1 definierte Parameter, z. B. 120 s) in das Zeitintervall der Bilderfassung zu T1 im Abschnitt Zeitpunkte im Fenster Mehrdimensionale Erfassung ein.
- Stellen Sie die Bildaufnahme für 2D-YAP- und Perlenbilder ein.
- Öffnen Sie Elemente, ändern Sie den Lichtweg nach rechts für konfokale Bildgebung und schalten Sie das LED-Licht aus. Klicken Sie anschließend auf die Schaltfläche Interlock entfernen und schalten Sie den FITC-Laserkanal (für YAP-Bildgebung) ein, indem Sie das FITC-Kontrollkästchen aktivieren.
- Stellen Sie die Scangeschwindigkeit auf 1 Bild pro 2 s ein, indem Sie auf die 1/2-Taste klicken und den Knopf der Z-Ebene drehen, um die Z-Position der angeschlossenen Zellen schnell zu finden. Notieren Sie die unteren und oberen Grenzen für den Z-Stack.
- Klicken Sie im oberen Menüband auf Makro, wählen Sie im Dropdown-Menü Makro die Option Makro-Editor aus und geben Sie die Werte aus Schritt 6.3.2 in eine Makrodatei ein.
- Schalten Sie den 4′,6-Diamidino-2-phenylindol (DAPI)-Laserkanal (für die Perlenbildgebung) ein, indem Sie das DAPI-Kästchen aktivieren, um die fokussierte Z-Position der Perlen zu finden und aufzuzeichnen. Gehen Sie zum Makro-Editor und geben Sie die aufgezeichneten Werte in die Makrodatei ein.
- Stellen Sie die Aufgabe ein, die motorisierte Bühne mit AMFIP zu bewegen.
- Gehen Sie zu μManager und klicken Sie auf Plugins | Automatisierung zum Öffnen der grafischen Benutzeroberfläche (GUI) von AMFIP. Klicken Sie auf die Schaltflächen Punkt hinzufügen oder Punkt entfernen , um die genaue Anzahl der ausgewählten FOVs zu ermitteln. Geben Sie die aufgezeichneten Koordinaten von FOVs in das Koordinatenbedienfeld ein.
- Definieren Sie die Gesamtversuchszeit im Textfeld Gesamtversuchszeit .
- Klicken Sie auf die Schaltfläche Zusätzliche Zeitkonfiguration und definieren Sie das Zeitintervall T2 (z. B. 30 min) für die Bewegung der motorisierten Stufe zu jedem Sichtfeld.
- Maximieren Sie die Fenstergröße von Elements und ziehen Sie die GUI von AMFIP auf die rechte Seite des Bildschirms, um zu vermeiden, dass die GUI die automatischen Operationen des Cursors stört.
- Klicken Sie auf die Eingabetaste. Nachdem das erste Makro abgeschlossen ist, klicken Sie im Fenster Mehrdimensionale Erfassung auf die Schaltfläche Erwerben!.
- Lösen Sie die Zellen nach der Bildaufnahme auf.
- Nachdem Sie die Langzeitbildgebung abgeschlossen haben, stoppen Sie die AMFIP-Aufgabe, indem Sie im Fenster des Automatisierungs-Plugins auf die Schaltfläche Pause und im Fenster Multidimensionale Erfassung auf die Schaltfläche Stopp klicken.
- Öffnen Sie Elements und legen Sie die Z-Stack-Bildgebung fest, indem Sie im Fenster ND-Erfassung auf die Schaltflächen Oben und Unten klicken (legen Sie den Z-Bereich auf größer als den Z-Bereich der Perlen fest). Schalten Sie den Lichtweg nach rechts und öffnen Sie das LED-Licht (Intensität: 15%).
- Entfernen Sie langsam und vorsichtig die Deckel der Kammer und der Petrischale. Überwachen Sie in der Zwischenzeit die Hellfeldansicht auf jede Drift des Sichtfelds.
- Halten Sie die Kunststoffpipette vorsichtig ein wenig über dem Kulturmedium in der Petrischale, um 0,5 ml Natriumdodecylsulfat (SDS) -Lösung aufzunehmen, und geben Sie 1-2 Tröpfchen der SDS-Lösung in das Kulturmedium.
- Sobald die Zellen in der Hellfeldansicht aufgelöst sind, schalten Sie den Lichtweg nach links, schließen Sie das LED-Licht und klicken Sie auf die Schaltfläche Interlock entfernen .
- Führen Sie das Z-Stack-Imaging aus. Speichern Sie den Bildstapel und benennen Sie ihn als Reference_N (N ist die Sequenznummer jedes Sichtfelds).
- Klicken Sie im Fenster Mehrdimensionale Erfassung auf die Schaltfläche Mehrere Positionen (XY). Wählen Sie als Nächstes das nächste Sichtfeld aus und klicken Sie auf die Schaltfläche Gehe zu, um die motorisierte Stufe zum zweiten Sichtfeld zu verschieben.
- Wiederholen Sie Schritt 6.5.7 für jedes Sichtfeld.
7. Messung des YAP N/C Verhältnisses
- Führen Sie mit der Fiji ImageJ-Software eine Bildanalyse durch, um das YAP-N/C-Verhältnis zu messen (Abbildung 4).
- Öffnen Sie Fiji ImageJ. Importieren Sie den Hellfeld-Bildstapel für alle vom μManager erfassten FOVs.
- Öffnen Sie das Dropdown-Menü Bild und wählen Sie Stacks | Werkzeuge | Scheibenhalter. Exportieren Sie als Nächstes den Hellfeld-Bildstapel für jedes Sichtfeld.
- Importieren Sie das Fluoreszenzbild des FITC-Kanals und überlagern Sie es mit dem Hellfeldbild für dasselbe Sichtfeld. Wählen Sie dazu das Fluoreszenzbild aus und wählen Sie Overlay | Bild hinzufügen... (Bild zum Hinzufügen: das Hellfeldbild; Die X- und Y-Position hängt von der Größe des Von verschiedenen Kameras aufgenommenen Hellfeldbildes ab. Deckkraft: 60-70).
- Öffnen Sie das Dropdown-Menü Analysieren und wählen Sie Messungen festlegen.... Wählen Sie Bereich aus; Integrierte Dichte und mittlerer Grauwert.
- Klicken Sie auf die Schaltfläche Freihandauswahl auf der Hauptoberfläche von ImageJ.
- Zeichnen Sie den Umriss des Zellkörpers und des gewünschten Kerns. Klicken Sie anschließend auf analysieren | Messen oder drücken Sie die M-Taste auf der Tastatur.
- Beobachten Sie das Fenster Ergebnisse , das angezeigt wird. Beachten Sie, dass die Werte unter der Spalte Fläche die Fläche des ausgewählten Bereichs (μm2) und die Werte unter der Spalte IntDen die Fluoreszenzintensität des ausgewählten Bereichs darstellen.
- Berechnen Sie das YAP-N/C-Verhältnis mit den folgenden Formeln (1), (2) und (3):
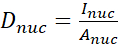 (1)
(1)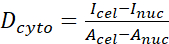 (2)
(2)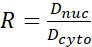 (3)
(3)
Wobei Inuc und Icel die relative Intensität des Zellkerns und des Zellkörpers darstellen und Anuc und Acel die Fläche des Kerns und des Zellkörpers darstellen. R ist das YAP-N/C-Verhältnis. - Speichern Sie die Umrisse für die zukünftige Berechnung der Dipol-Zugkraft und der Perizellen-/Perikernverschiebung. Klicken Sie dazu auf Analysieren | Werkzeuge | XY-Koordinaten speichern...
8. Messung des Traktionsfeldes
- Wenden Sie die Zugkraftmikroskopie über die Fiji ImageJ-Plugins an22,23.
- Öffnen Sie Fiji ImageJ.
- Importieren Sie den Bildstapel der Perlen für ein Sichtfeld.
- Wählen Sie das Segment aus, das die klarste Verteilung der Perlen zeigt, und extrahieren Sie es, indem Sie auf Bilder | Stapel | Werkzeuge | Scheibenhalter.
- Importieren Sie den Bildstapel der Referenz für dasselbe Sichtfeld.
- Wählen Sie das Slice mit der gleichen Helligkeit und dem gleichen Kontrast wie das Slice in Schritt 8.1.3 aus. Extrahieren Sie es als Nächstes als Referenzbild.
- Bilder auswählen | Stapel | Werkzeuge | Verketten Sie, um die beiden Slices aus den Schritten 8.1.3 und 8.1.5 zu kombinieren (wählen Sie das Referenzbild als erstes Slice aus).
- Plugins | auswählen | für die Vorlagenübereinstimmung Slices im Stack oder Plugins | ausrichten Bildstabilisator, um die beiden Slices auszurichten.
- Bild | auswählen Stapel | Stapeln Sie zu Bildern. Wählen Sie als Nächstes Bild | Nachschlagetabellen | Grün, um die Farbe des ersten Segments in Grün zu konvertieren, und wählen Sie Bild | Nachschlagetabellen | Rot, um die Farbe des zweiten Segments in Rot umzuwandeln.
- Bildauswahl | | Kanäle zusammenführen, um die beiden Bilder zusammenzuführen.
- Überlappen Sie das Bild mit dem Hellfeldbild aus demselben Sichtfeld und verwenden Sie dieses überlappende Bild, um die Perlenverschiebung zu beobachten.
- Plugins | auswählen PIV-| iterative PIV(Basic).... Legen Sie die Größe des Abfragefensters auf 128/256 fest. 64/128; 32/64 (mindestens vier Perlen pro Verhörfenster). Legen Sie den Korrelationsschwellenwert auf 0,6 fest.
- Klicken Sie auf OK. Nachdem die Berechnung abgeschlossen ist, speichern Sie die Textdatei mit den Rohdaten der Perlenverschiebung in einem gewöhnlichen Ordner, der vom Benutzer erstellt wurde.
- Plugins | auswählen FTTC-| FTTC und wählen Sie die Textdatei in Schritt 8.1.9.
- Geben Sie die Pixelgröße (μm), den Elastizitätsmodul des Gels (Pascal) und die Plotbreite und -höhe basierend auf dem Experiment und dem Bild der Perlen ein.
- Klicken Sie auf OK , um die Textdatei mit den Rohdaten der Zugkraft automatisch im selben Verzeichnis wie die Textdatei in Schritt 8.1.12 zu speichern.
- Verwenden Sie eine Grafiksoftware (Materialtabelle), um das Traktionsfeld mit der gleichen Skala für mehrere Zellen darzustellen (Abbildung 1B,C und Abbildung 2B,C).
- Fügen Sie die Textdatei, die die Rohdaten der Traktion enthält, in eine Tabelle ein.
- Erstellen Sie ein neues Blatt, geben Sie die Y-Koordinaten der Traktion in die erste Zeile ein (von hohen Werten zu niedrigen Werten anordnen) und die X-Koordinaten in die erste Spalte (von niedrig nach hoch anordnen).
- Geben Sie den Wert der Traktion für jede Koordinate aus den Rohdaten ein.
- Speichern Sie das Blatt in Schritt 8.2.2 als *.csv Datei.
- Offener Ursprung.
- Klicken Sie auf Datei | Öffnen und importieren Sie die *.csv-Datei in Schritt 8.2.4. Markieren Sie alle Zellen und klicken Sie auf Plot | Kontur| Kontur - Farbfüllung.
- Wählen Sie im Fenster Plotten: plotvm in den Spalten Y aus, um die Y-Werte automatisch auf die erste Zeile und die X-Werte auf die erste Spalte festzulegen. Benennen Sie als Nächstes den Titel und klicken Sie auf OK.
- Doppelklicken Sie im angezeigten Diagrammfenster auf die Heatmap.
- Klicken Sie im Fenster Colormap/Konturen auf Ebenen. Ändern Sie als Nächstes die Skalierungsebene in einen vernünftigen Bereich (0300 in dieser Analyse) und klicken Sie auf OK.
- Klicken Sie auf Linien, deaktivieren Sie Nur auf Hauptebenen anzeigen und aktivieren Sie Alle ausblenden. Klicken Sie anschließend auf OK.
- Klicken Sie mit der rechten Maustaste auf das Diagramm und wählen Sie Diagramme exportieren.... Speichern Sie das Bild im angegebenen Pfad.
- Verwenden Sie MATLAB, um die Traktion der Dipolzellen zu berechnen.
- Speichern Sie die Rohdatentextdatei für die Traktion (aus Schritt 8.1.12) und die Koordinatendatei für den Zellgrenzbereich von Interesse (aus Schritt 7.1.9) in demselben Ordner, der in Schritt 8.1.12 definiert wurde. Übertragen Sie alle MATLAB-Dateien, die im AMFIP-Paket vorhanden sind, in diesen Ordner.
- Öffnen Sie MATLAB. Öffnen Sie den in Schritt 8.1.12 definierten Ordner und öffnen Sie die Dipol-Traktionsberechnungsfunktionsdatei absdipole.m in Schritt 8.3.1 in diesen Ordner übertragen.
- Lesen Sie die beiden Text-/CSV-Dateien in Schritt 8.3.1 in den MATLAB-Arbeitsbereich ein und weisen Sie zwei Variablen (z. B. Traktion und ROI) eine Matrix zu.
- Führen Sie die Funktion absdiple (traction,roi) aus.
HINWEIS: Die erste Spalte der Ausgabe ist die Dipol-Zugkraft in nN (Nano-Newton). Die zweite Spalte des Ausgangs ist der Winkel der Dipol-Zugkraft in Bezug auf die horizontale Achse.
Ergebnisse
Ausgeprägte YAP-Verteilung und -Dynamik in CRISPR/Cas9-modifizierten PC9-Krebs- und B2B-Normalzellen während der Zellausbreitung
Repräsentative Fluoreszenzbilder der YAP-Verteilung in einzelnen B2B- und PC9-Zellen auf 2, 5, 40 kPa PAA-Gelen und Glasdeckglas sind in Abbildung 1A und Abbildung 2A dargestellt. Die Kernlokalisation von YAP in B2B-Zellen nahm mit zunehmender Substratsteifigkeit zu (Abbildung 1A), während PC9-Zellen eine ähnliche YAP-Konzentration im Zellkern und Zytoplasma auf Substraten unterschiedlicher Steifigkeit aufwiesen (Abbildung 2A). Repräsentative Fluoreszenzbilder der YAP-Verteilung in einzelnen, sich ausbreitenden B2B- und PC9-Zellen auf dem 5 kPa-Hydrogel-Substrat (vom 0. h bis zum 10. h nach den an die Substrate gebundenen Zellen) sind in Abbildung 1B bzw. Abbildung 2B dargestellt. Die B2B-Zelle vergrößerte monoton die Ausbreitungsfläche im Laufe der Zeit zusammen mit einer Abnahme des YAP-N/C-Verhältnisses (Abbildung 1B), während die PC9-Zelle während des gesamten 10-stündigen Spreizungsprozesses eine vergleichsweise unveränderliche Zellausbreitungsfläche, Orientierung und YAP-N/C-Verhältnis beibehielt (Abbildung 2B). Während der 10-stündigen Dauer der frühen Ausbreitung verformte die repräsentative B2B-Zelle konstitutiv die Substratoberfläche und wandte eine sich zeitentwickelnde Zelltraktion über den gesamten Zellbereich an (Abbildung 1C und Abbildung 1D).
Im Gegensatz dazu entwickelte die repräsentative PC9-Zelle erst an den beiden Enden des Zellkörpers Verschiebung und Traktion und ihre Traktion nahm nach 7,5 h ab (Abbildung 2C und Abbildung 2D). Weitere Zeitrafferbilder und Traktionsmessungen von B2B- und PC9-Zellen im frühen Ausbreitungsstadium finden Sie in Supplemental Figure S2 und Supplemental Figure S3. Andere Modi der PC9-Zelldynamik wurden ebenfalls beobachtet (Abbildung 6). Parallel zu diesen unterschiedlichen Ausbreitungseigenschaften zeigten B2B- und PC9-Zellen eine ausgeprägte YAP-Verteilung und -Dynamik (Abbildung 3). Auf einem 5 kPa Gel konzentrierte sich YAP in B2B-Zellen im Zellkern um das 0. h und verteilte sich im 10. h homogener über den Zellkörper. PC9-Zellen zeigten jedoch eine homogenere Verteilung von YAP im Zellkern und im Zytoplasma während der gesamten 10 h des Ausbreitungsprozesses. Um die YAP-Aktivität und Translokation in B2B- und PC9-Zellen quantitativ zu analysieren, wurde das YAP-N/C-Verhältnis mit dem in Abbildung 4 beschriebenen Algorithmus berechnet.
Um die ausgeprägte YAP-Dynamik weiter zu untersuchen, wurden zeitliche Veränderungen des YAP-N/C-Verhältnisses, der Zell-/Zellkernfläche und der Traktion mehrerer einzelner B2B-Zellen (n = 10) und PC9-Zellen (n = 5) verglichen (Abbildung 5). Es wurde festgestellt, dass das durchschnittliche YAP-N/C-Verhältnis von B2B-Zellen von 2,54 ± 0,22 auf 1,79 ± 0,21 (n = 10; p = 0,0022**; Abbildung 5A), während sich das durchschnittliche YAP-N/C-Verhältnis von PC9-Zellen von 1,92 ± 0,26 auf 1,57 ± 0,07 (n = 5; p = 0,187 (nicht signifikant (ns)) änderte; Abbildung 5A). Die durchschnittliche Dipoltraktion von B2B-Zellen veränderte sich von 256,17 ± 123,69 nN auf 287,44 ± 99,79 nN (p = 0,7593 (ns); Abbildung 5B). Die durchschnittliche Dipoltraktion von PC9-Zellen änderte sich von 141,19 ± 33,62 nN auf 168,52 ± 73,01 nN (p = 0,7137 (ns); Abbildung 5B). Die durchschnittliche Zellstreufläche von B2B-Zellen stieg von 613,89 ± 102,43 μm2 auf 942,51 ± 226,71 μm2 (p = 0,0512 (ns); Abbildung 5C).
Die durchschnittliche Zellausbreitungsfläche von PC9-Zellen veränderte sich von 495,78 ± 97,04 μm2 auf 563,95 ± 89,92 μm2 (p = 0,5804 (ns); Abbildung 5C). Die durchschnittliche Kernausbreitungsfläche von B2B-Zellen stieg von 181,55 ± 36,18 μm2 auf 239,38 ± 43,12 μm2 (p = 0,1217 (ns); Abbildung 5D) und die durchschnittliche Kernausbreitungsfläche von PC9-Zellen veränderte sich von 133,31 ± 30,05 μm2 auf 151,93 ± 22,49 μm2 (p = 0,5944 (ns); Abbildung 5D). Diese Ergebnisse deuten darauf hin, dass (1) B2B-Zellen ein konstitutiv substratsteifigkeitsabhängiges YAP-N/C-Verhältnis aufweisen; (2) die Traktion von B2B-Zellen ist höher als die von PC9-Zellen; und (3) im Gegensatz zu B2B-Zellen zeigen PC9-Zellen eine begrenzte Zunahme der Zellfläche und Veränderungen des YAP-N/C-Verhältnisses während des 10-stündigen Spreizungsprozesses.
Korrelation von YAP-Verteilung und -Dynamik zu den Migrationszuständen von B2B-Zellen
Das YAP-N/C-Verhältnis und die Dipoltraktion aller B2B- (n=10) und PC9- (n=5)-Zellen als Funktion der Zellausbreitungsfläche und der Zellkernausbreitungsfläche wurden verglichen. Das YAP-N/C-Verhältnis und die Dipoltraktion von PC9-Zellen korrelierten nicht eindeutig mit ihren kleinen Zell- und Zellkern-Ausbreitungsbereichsbereichen (Abbildung 6). Im Gegensatz dazu schienen das YAP-N/C-Verhältnis und die Dipoltraktion von B2B-Zellen zwei unterschiedlichen Trends zu folgen (Abbildung 6A und Abbildung 6C), was darauf hindeutet, dass es zwei Gruppen von B2B-Zellen geben könnte, die in diesem Experiment koexistieren. In der ersten Gruppe nehmen das YAP-N/C-Verhältnis und die Dipoltraktion zusammen mit der Vergrößerung der Zellausbreitungsfläche zu und erreichen ihre Maxima bei ~ 1000 μm2 (Abbildung 6C und Abbildung 6D, dargestellt durch die gelbe gestrichelte Linie). In der zweiten Gruppe nehmen das YAP-N/C-Verhältnis und die Dipoltraktion mit der Vergrößerung des Zellausbreitungsbereichs langsamer zu und halten nahezu konstante Werte aufrecht, wenn die Zellausbreitfläche weiter zunimmt (Abbildung 6C,D, dargestellt durch die grün gestrichelte Linie).
PC9-Krebszellen erzeugen Traktion in perinukleären Regionen
Einzelne, sich ausbreitende PC9-Zellen verdrängen die Substrate in den perinukleären Regionen ab dem 6. h der Kultur (Abbildung 7C). Um die perinukleäre Verschiebung zu visualisieren, die durch die Zelltraktion verursacht wird, überlappten wir die Bilder von fluoreszierenden Kügelchen, die vor (rot) und nach (grün) der Entfernung der Zellen von den Substraten aufgenommen wurden (siehe Protokollabschnitt für Details). Die Perlen, die keine Verschiebung haben, erscheinen gelb in den überlappenden Bildern, d.h. die Zugabe von roten und grünen Farben. Im Gegensatz dazu zeigen die Perlen, die aufgrund der Zelltraktion aus ihren Ruhepositionen verschoben werden, getrennte grüne und rote Farben.
Bemerkenswert ist, dass sowohl in PC9- (Abbildung 7C, D) als auch in B2B- (Abbildung 7E) Zellen zusätzlich zu denen an der Zellgrenze eine Perlenverschiebung im Zytoplasma und im Zellkern beobachtet wurde. Um die perinukleäre Verschiebung hervorzuheben, wird die Boussinesq-Gleichung aus der Linearelastizitätstheorie verwendet, um die theoretische 2D-Verschiebung vorherzusagen, die durch eine hypothetische Dipolkraft an der Zellgrenze erzeugt wird (schwarze gestrichelte Linie in Abbildung 7B)24. Vergleicht man diese theoretische Kurve mit der realen Substratverschiebung, die entlang derselben Achse gemessen wurde (weiße gestrichelte Linie in Abbildung 7D), so wurde festgestellt, dass die realen Verschiebungen innerhalb des Kerns 1,5-8-fach größer sind als der theoretische Wert (Abbildung 7B), was auf die Existenz von Zugkraft in den perinukleären Bereichen hinweist.

Abbildung 1: Änderungen der YAP-Expression/-Verteilung, des Substratverschiebungsfeldes und des Traktionsfeldes einer B2B-Normalzelle auf Substraten unterschiedlicher Steifigkeit und während der frühen Ausbreitung. (A) Die YAP-Expression einer B2B-Zelle, die auf 2, 5 und 40 kPa PAA-Gelen und einem Glasdeckglas nach 60 h nach der anfänglichen Zell-Substrat-Befestigung ausgesät wurde. (B) Die B2B-Zelle wurde auf einem 5 kPa PAA-Gel ausgesät und über 10 h nach der anfänglichen Zell-Substrat-Bindung abgebildet. Die YAP-Expression wird durch die Intensität der grünen Fluoreszenz dargestellt. Hinweis: Die YAP-Intensität im Zellkern nimmt allmählich ab, bleibt aber im Laufe der Zeit höher als die im Zytoplasma. Die Farbbalken zeigen die YaP-Ausdrucksebenen (grün = hoher Ausdruck; schwarz = niedriger Ausdruck) in (A) und (B) an. (C) Die Substratverformung (überlappt mit dem Hellfeldbild) an der Zellposition wird durch das Verschiebungsfeld zu jedem Zeitpunkt dargestellt. Verschiebungsrichtung und -stärke werden durch die Pfeilrichtung bzw. -farbe angezeigt. Die Verschiebung wird an den Enden des B2B-Zellkörpers größer, wenn die Zellausbreitungsfläche zunimmt. Der Farbbalken zeigt die Verschiebungsgröße an (karminrot = hohe Größe; schwarz = niedrige Größe). (D) Traktionsfeld (überlappt mit dem Hellfeldbild), berechnet aus dem Verschiebungsfeld. Die Traktion konzentriert sich auf die Grenze der B2B-Zellen. Die weiß und gelb gepunkteten Umrisse markieren die Grenzen der Zelle bzw. des Zellkerns. Der Farbbalken zeigt die Traktionsgröße an (karminrot = hohe Größe; schwarz = niedrige Größe). Maßstabsbalken = 20 μm. Abkürzungen: YAP = Yes-associated protein; PAA = Polyacrylamid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
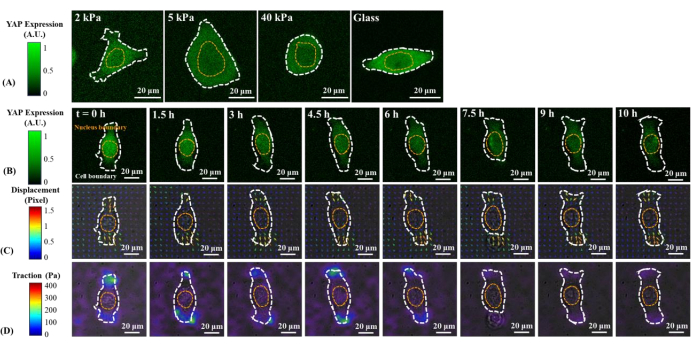
Abbildung 2: Veränderungen der YAP-Expression/-Verteilung, des Substratverschiebungsfeldes und des Traktionsfeldes einer PC9-Krebszelle auf Substraten unterschiedlicher Steifigkeit und während der frühen Ausbreitung. (A) Die YAP-Expression einer PC9-Zelle, die auf 2, 5 und 40 kPa PAA-Gelen und Glasdeckglas nach 65 h nach anfänglicher Zell-Substrat-Bindung gesät wurde. (B) Die PC9-Zelle wurde auf einem 5 kPa PAA-Gel ausgesät und über 10 h nach anfänglicher Zell-Substrat-Bindung abgebildet. Die YAP-Expression wird durch die Intensität der grünen Fluoreszenz dargestellt. Hinweis: Die YAP-Intensität erreicht ein Plateau ab 1,5 h. Die Farbbalken zeigen die Ebenen der YAP-Expression (grün = hohe Expression; schwarz = niedrige Expression) in (A) und (B) an. (C) Die Substratverformung (überlappt mit dem Hellfeldbild) an der Zellposition wird zu jedem Zeitpunkt durch ein fluoreszierendes Perlenverschiebungsfeld dargestellt. Verschiebungsrichtung und -stärke werden durch die Pfeilrichtung bzw. -farbe angezeigt. Das durch PC9-Zellen verursachte Verschiebungsfeld ist kleiner als das durch die B2B-Zelle verursachte. Während des gesamten 10-stündigen Streuprozesses bleibt die Fläche der PC9-Zellen nahezu konstant. Der Farbbalken zeigt die Verschiebungsgröße an (karminrot = hohe Größe; schwarz = niedrige Größe). (D) Traktionsfeld (überlappt mit dem Hellfeldbild), berechnet aus dem Verschiebungsfeld. Die von dieser repräsentativen PC9-Zelle erzeugte Traktion nimmt vom 6. h bis zum 10. h allmählich ab . Die weiß und gelb gepunkteten Umrisse markieren die Grenzen der Zelle bzw. des Zellkerns. Der Farbbalken zeigt die Traktionsgröße an (karminrot = hohe Größe; schwarz = niedrige Größe). Maßstabsbalken = 20 μm. Abkürzungen: YAP = Yes-associated protein; PAA = Polyacrylamid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: YAP-Verteilung in B2B- und PC9-Zellen im frühen Ausbreitungsstadium. (A) Die YAP-Intensität der B2B-Zelle wird entlang der zugewiesenen roten Achse am 0. und 10. h gemessen. (B) Im 0. h zeigt die YAP-Intensität dramatische Konzentrationsunterschiede zwischen dem Zellkern und dem Zytoplasma. Im 10. h wird die YAP-Intensität homogener über den gesamten Zellkörper. (C) Die YAP-Intensität der PC9-Zelle wird entlang der zugewiesenen blauen Achse am 0. und 10. h gemessen. (D) Im 0. h erscheint die YAP-Intensität im Zellkern höher als die im Zytoplasma, obwohl der Unterschied nicht so bemerkenswert ist wie bei B2B-Zellen. Im 10. h erscheint die YAP-Intensität im Zellkern immer noch etwas höher als im Zytoplasma, mit einem Variationstrend ähnlich dem des 0. h. Maßstabsbalken = 20 μm (A, C). Abkürzung: YAP = Yes-associated protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Messung des YAP-N/C-Verhältnisses. (1) Wenden Sie Fiji ImageJ an, um den Umriss des Kerns zu zeichnen und seine 2D-projizierte Fläche Anuc zu messen. (2) Messen Sie die Fluoreszenzintensität im Kern Inuc. (3) Zeichnen Sie den Umriss des Zellkörpers und messen Sie seine projizierte Fläche Acel. (4) Messen Sie die Fluoreszenzintensität in der Zelle Icel. (5) Berechnen Sie die YAP-Kerndichte Dnuc, die YAP-Zytoplasmadichte Dcyto und ihr Verhältnis R: Dnuc = Inuc / Anuc; Dcyto=(Icel-Inuc)/(Acel-Anuc); R=Dnuc/Dcyto. Der Farbbalken zeigt die Ebenen des YAP-Ausdrucks an (grün = hoher Ausdruck; schwarz = niedriger Ausdruck). Maßstabsleiste = 20 μm. Abkürzungen: YAP = Yes-associated protein; N = Kern; C = Zytoplasma. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
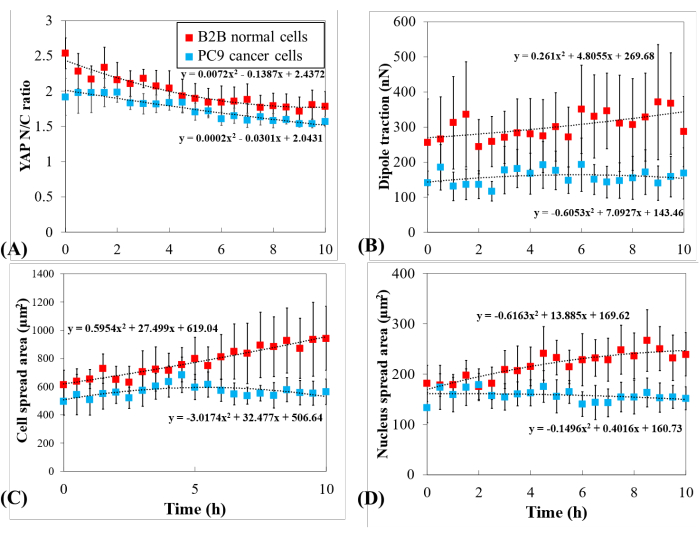
Abbildung 5: Ausgeprägte YAP-Expression, Zell-/Kernmorphologie und zelluläre Traktion in PC9-Krebs und normalen B2B-Zellen während der Zellausbreitung. (A) Änderung des YAP-N/C-Verhältnisses während der ersten 10 h der Einzelzellausbreitung. Das durchschnittliche YAP-N/C-Verhältnis der B2B-Zellen (rote Spalte; n = 10) änderte sich von 2,54 ± 0,22 auf 1,79 ± 0,21 (n = 10; p = 0,0022**), während sich das durchschnittliche YAP-N/C-Verhältnis der PC9-Zellen (blaue Spalte; n = 5) von 1,92 ± 0,26 auf 1,57 ± 0,07 (p = 0,187 (ns)) änderte. (B) Die durchschnittliche Dipoltraktion als Funktion der Zeit. Die durchschnittliche Dipoltraktion von B2B-Zellen änderte sich von 256,17 ± 123,69 nN auf 287,44 ± 99,79 nN (p = 0,7593 (ns)) und die durchschnittliche Dipoltraktion von PC9-Zellen von 141,19 ± 33,62 nN auf 168,52 ± 73,01 nN (p = 0,7137 (ns)). (C) Die durchschnittliche Zellfläche als Funktion der Zeit. Die durchschnittliche Zellausbreitfläche von B2B-Zellen stieg von 613,89 ± 102,43 μm2 auf 942,51 ± 226,71 μm2 (p = 0,0512 (ns)) und die durchschnittliche Zellausbreitungsfläche von PC9-Zellen von 495,78 ± 97,04 μm2 auf 563,95 ± 89,92 μm2 (p = 0,5804 (ns)). (D) Die mittlere Nucleusfläche als Funktion der Zeit. Die durchschnittliche Kernausbreitungsfläche von B2B-Zellen stieg von 181,55 ± 36,18 μm2 auf 239,38 ± 43,12 μm2 (p = 0,1217 (ns)) und die durchschnittliche Kernausbreitungsfläche von PC9-Zellen von 133,31 ± 30,05 μm2 auf 151,93 ± 22,49 μm2 (p = 0,5944 (ns)). Abkürzungen: YAP = Yes-associated protein; N = Kern; C = Zytoplasma; ns = nicht signifikant. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: YAP-N/C-Verhältnis und Dipol-Zugkraft als Funktion der Ausbreitungsfläche von Zelle und Zellkern. Das YAP-N/C-Verhältnis und die Dipoltraktion von B2B-Zellen (n=10) und PC9-Zellen (n=5) werden vom 6. h bis zum 10. h nach Dem Anbringen an das Substrat berechnet. (A) YAP-N/C-Verhältnis als Funktion der Zellausbreitungsfläche. Die YAP-N/C-Verhältnisse von B2B-Zellen variieren von 1,16 bis 2,53, während die YAP-N/C-Verhältnisse von PC9-Zellen von 1,27 bis 1,88 variieren. Die Zellausbreitungsfläche von B2B-Zellen variiert von 391,94 μm2 bis 1986,40 μm2. Die Zellstreufläche von PC9-Zellen reicht von 284,46 μm2 bis 830,12 μm2. (B) YAP-N/C-Verhältnis als Funktion der Nucleus-Ausbreitungsfläche. Die Zellkernausbreitungsfläche von B2B-Zellen variiert von 107,09 μm2 bis 514,28 μm2. Die Kernausbreitfläche von PC9-Zellen reicht von 58,03 μm2 bis 259,65 μm2. Dipoltraktion von B2B-Zellen in Abhängigkeit von der Zellausbreitungsfläche (C) und der Zellkernausbreitungsfläche (D). Sich ausbreitende und nicht migrierende B2B-Zellen zeigen eine höhere Traktion (von 47,50 nN bis 1051,48 nN) mit einer niedrigeren Zell- und Kernfläche. Während der Ausbreitung und Migration zeigen B2B-Zellen eine geringere Traktion (von 105,80 nN bis 310,28 nN) mit größeren Zell- und Zellkernbereichen. Abkürzungen: YAP = Yes-associated protein; N = Kern; C = Zytoplasma. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
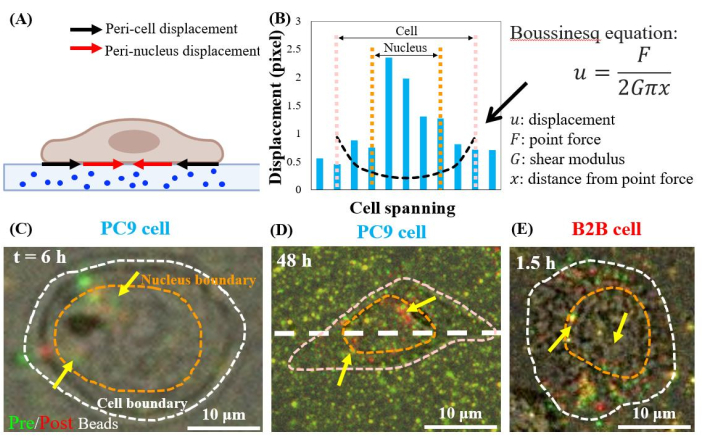
Abbildung 7: Perinukleäre Verschiebung in normalen B2B- und Krebs-PC9-Zellen. (A) Schematisches Seitenansichtsdiagramm der perinukleären und perizellförmigen Verschiebung, gemessen aus der Perlenverschiebung im Substrat. (B) Die Substratverschiebung unterhalb der PC9-Zelle wird entlang der Zellachse gemessen (weiße gestrichelte Linie in 7D). Die theoretische Verschiebung, die durch die Dipolkraft an der Zellgrenze erzeugt wird, wird durch die Boussinesq-Gleichung (schwarz gestrichelte Kurve) dargestellt. (C) und (D) Überlappende fluoreszierende Perlenbilder mit (roten) und ohne (grünen) Zellen für die PC9-Zellen am 6. h nach dem Anheften (Draufsicht). Gelbe (exakte Überlappung von roten und grünen Farben) Perlen zeigen keine Verschiebung an. Die getrennten grünen und roten Perlen (durch gelbe Pfeile spitze) stellen die perinukleare Verschiebung dar. Gelbe Pfeile zeigen diese kontrahierten Perikernflecken an, die sich an der Peripherie des Kerns befinden. (E) Perinukleäre Verschiebung, die von der B2B-Zelle bei 1,5 h nach zellsubstratbefestigung erzeugt wird. Maßstabsbalken = 10 μm (C–E). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung S1: Die genomische Sequenzkarte von YAP-mNeonGreen21-10/11. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung S2: Veränderungen der YAP-Expression/-Verteilung, des Substratverschiebungsfeldes und des Traktionsfeldes von B2B-Normalzellen während der frühen Ausbreitung. (A, D, G, J, M) Die B2B-Zelle wurde auf einem 5 kPa PAA-Gel ausgesät und über 10 h nach der anfänglichen Zell-Substrat-Bindung abgebildet. Die YAP-Expression wird durch die Intensität der grünen Fluoreszenz dargestellt. Hinweis: Die YAP-Intensität im Zellkern nimmt allmählich ab, bleibt aber im Laufe der Zeit höher als im Zytoplasma. Die Farbbalken zeigen die Ebenen des YAP-Ausdrucks (grün = hoher Ausdruck; schwarz = niedriger Ausdruck) in (A, D, G, J, M) an. (B, E, H, K, N) Die Substratverformung (überlappt mit dem Hellfeldbild) an der Zellposition wird durch das Verschiebungsfeld zu jedem Zeitpunkt dargestellt. Verschiebungsrichtung und -stärke werden durch die Pfeilrichtung bzw. -farbe angezeigt. Die Verschiebung wird an der Peripherie des B2B-Zellkörpers größer, wenn die Zellausbreitungsfläche zunimmt. Die Farbbalken zeigen die Verschiebungsgröße (karminrot = hohe Größe; schwarz = niedrige Größe) in (B, E, H, K, N) an. (C, F, I, L, O) Traktionsfeld (überlappt mit dem Hellfeldbild), berechnet aus dem Verschiebungsfeld mittels Zugkraftmikroskopie. Die Traktion konzentriert sich auf die Peripherie von B2B-Zellen. Die Farbbalken zeigen die Traktionsgröße (karminrot = hohe Größe; schwarz = niedrige Größe) in (C, F, I, L, O) an. Maßstabsbalken = 20 μm. Abkürzungen: YAP = Yes-associated protein; PAA = Polyacrylamid. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung S3: Veränderungen der YAP-Expression/-Verteilung, des Substratverschiebungsfeldes und des Traktionsfeldes von PC9-Krebszellen während der frühen Ausbreitung. (A, D, G, J) Die PC9-Zelle wurde auf einem 5 kPa PAA-Gel gesät und über 10 h nach der anfänglichen Zell-Substrat-Befestigung abgebildet. Die YAP-Expression wird durch die Intensität der grünen Fluoreszenz dargestellt. Hinweis: Die YAP-Intensität im Zellkern nimmt allmählich ab, bleibt aber im Laufe der Zeit ähnlich oder etwas niedriger als die im Zytoplasma. Die Farbbalken zeigen die Ebenen des YAP-Ausdrucks (grün = hoher Ausdruck; schwarz = niedriger Ausdruck) in (A, D, G, J) an. (B, E, H, K) Die Substratverformung (überlappt mit dem Hellfeldbild) an der Zellposition wird durch das Verschiebungsfeld zu jedem Zeitpunkt dargestellt. Verschiebungsrichtung und -stärke werden durch die Pfeilrichtung bzw. -farbe angezeigt. Die Verschiebung wird an der Peripherie des PC9-Zellkörpers größer, wenn die Zellausbreitungsfläche zunimmt. Die Farbbalken zeigen die Verschiebungsgröße (karminrot = hohe Größe; schwarz = niedrige Größe) in (B, E, H, K) an. (C, F, I, L) Traktionsfeld (überlappt mit dem Hellfeldbild), berechnet aus dem Verschiebungsfeld. Die Traktion konzentriert sich auf die Peripherie von PC9-Zellen. Die Farbbalken zeigen die Traktionsgröße (karminrot = hohe Größe; schwarz = niedrige Größe) in (C, F, I, L) an. Maßstabsbalken = 20 μm. Abkürzungen: YAP = Yes-associated protein; PAA = Polyacrylamid. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Der Bildgebungsprozess (Schritt 6.3) ist entscheidend, um sicherzustellen, dass die Fluoreszenzbilder von ausreichend guter Qualität sind, um gültige Quantifizierungsergebnisse zu liefern. Die Z-Stack-Bilder von fluoreszierenden Proteinen oder Perlen sollten einen z-Bereich haben, der groß genug ist, um die scharfen Bilder für alle Z-Positionen aufzunehmen, die die Probe umfasst. Ein weiterer kritischer Schritt ist das Sammeln der Referenzbilder von fluoreszierenden Kügelchen nach dem Auflösen der Zellen (Schritt 6.5). Da die Referenzbilder in Schritt 6.3 an den gleichen Positionen aufgenommen werden müssen, sollte keine relative Verschiebung zwischen Petrischale, Umgebungskammer und Mikroskop induziert werden. Die Forscher, die den Auflösschritt durchführen, müssen darauf achten, den Deckel der Petrischale zu entfernen und sicherzustellen, dass die angewendete mechanische Störung nicht groß genug ist, um die Position der Schale in der Umgebungskammer zu verändern.
Im Folgenden finden Sie Lösungen zum Beheben einiger Fehler, die während der Tests auftreten können. Wenn nach dem Klicken auf die Eingabetaste in Schritt 6.4 kein Makro aktiviert wird, liegt dies höchstwahrscheinlich daran, dass der linke untere Bereich des Bildschirms von einem Nicht-Element-Fenster besetzt ist. In einem solchen Fall muss der linke untere Bereich des Fensters gelöscht werden, damit Makros in Elements aktiviert werden können. Ein weiterer häufiger Fehler ist, dass die Hellfeldbilder schwarz erscheinen. Dieses Problem wird durch ein unzureichendes Zeitintervall zwischen den Aufnahmen von Fluoreszenz- und Hellfeldbildern verursacht. Leichte Verzögerungen bei der Fluoreszenzbildgebungszeitzählung können sich im Laufe der Zeit ansammeln und erhebliche Verzögerungen verursachen und die Hellfeldbildgebung stören. Eine Lösung besteht darin, die Dauer eines Bildgebungszyklus aller Positionen so einzustellen, dass sie kleiner (nicht gleich) dem Zeitintervall zwischen dem Beginn aufeinanderfolgender Bewegungen ist. Dieser Vorgang aktualisiert die Zeitzählung und eliminiert den kumulativen Fehler zu Beginn jedes Bildgebungszyklus.
Diese rein optische Abfragetechnologie unterstützt (1) eine breite Palette von Hardware / Software, einschließlich, aber nicht beschränkt auf Nikon, (2) verschiedene Arten von validierten Hydrogelsystemen, einschließlich Gelatine-, PEG-, Matrigel- und Kollagen-I-Gele, und (3) die programmierbare Anpassung basierend auf unterschiedlichen Bedürfnissen der Forscher. Wenn jedoch keine der Unteren-Level-Steuerungsfunktionen von einem kommerziellen Mikroskop verfügbar ist, wird die Anpassung der Funktionen mit AMFIP zu einer Herausforderung. Eine weitere Einschränkung dieser Technik ist die räumliche Drift der Probe sowohl in der XY- als auch in der Fokusebene (Z). Obwohl diese Einschränkung während der Nachbearbeitung der Bilder überwunden werden kann, ist es wichtig, die Autofokusfunktion zu verbessern, um die Echtzeitdrift der Proben zu korrigieren. Diese Verbesserung erhöht den Durchsatz des Bildgebungsprozesses und reduziert den potenziellen Fehler, der durch die Drift während der Experimente verursacht wird.
Mechanotransducer wie YAP können als neue therapeutische Ziele für die Entwicklung vielversprechender Krebstherapien dienen25,26,27. Neue Daten deuten darauf hin, dass YAP die Proliferation und Invasion von Krebszellen fördert. Die mechanisch induzierte YAP-Translokation vom Zytoplasma in den Zellkern aktiviert die Transkription von Genen im Zusammenhang mit Zellmigration, Proliferation, Invasion und Apoptose, was zu abweichendem Zellverhalten führt28,29,30,31. Diese Arbeit zielte darauf ab, die mögliche Korrelation des YAP-N/C-Verhältnisses und der Zellmechanik in zwei typischen menschlichen Lungenkrebs- und normalen Zelllinien zu untersuchen. Während der 10-stündigen Zellstreuung zeigen PC9-Zellen ähnliche YAP-Konzentrationen im Zellkern und zytoplasma (Abbildung 3D und Abbildung 5A). B2B-Zellen zeigen eine höhere YAP-Konzentration im Zellkern als im Zytoplasma (Abbildung 3C und Abbildung 5A). Diese Beziehung, die während des frühen Ausbreitungsstadiums gefunden wurde, unterscheidet sich von der Mehrheit der veröffentlichten Ergebnisse, die die YAP-Konzentration im Zellkern zwischen normalen und Krebszellen vergleichen. Obwohl nicht unbedingt im frühen Ausbreitungsstadium, zeigen die meisten veröffentlichten Ergebnisse, dass YAP im Kern von Krebszellen konzentrierter ist als im Kern normaler Zellen27,28. Nur eine Studie zu Brustkrebs berichtete über eine Ausnahme32, die zeigt, dass YAP stärker im Zytoplasma konzentriert ist, was mit unseren aktuellen Beobachtungen in Lungenkrebs-PC9-Zellen übereinstimmt. Nach bestem Wissen und Gewissen der Autoren ist diese Arbeit die erste, die ein niedrigeres YAP-N/C-Verhältnis in einer menschlichen Lungenkrebszelllinie zeigt. Die Autoren vermuten, dass der Grund für ein stabiles YAP-N/C-Verhältnis in PC9-Zellen auf die geringe Variation im Zell-/Zellkern-Ausbreitungsbereich und die Traktion in PC9-Zellen im frühen Ausbreitungsstadium zurückzuführen sein könnte. Die Dissektion der zugrunde liegenden molekularen Mechanismen des niedrigen YAP-N/C-Verhältnisses in PC9- und B2B-Zellen ist im Gange.
Während der ersten 10 h der Ausbreitung zeigen diese beiden Zelllinien eine deutliche Beziehung zwischen dem YAP-N/C-Verhältnis, der Zelltraktion und der Ausbreitungsfläche (Abbildung 5). Für B2B-Zellen korreliert ein höheres YAP-N/C-Verhältnis mit einer höheren Zell- und Zellkernausbreitungsfläche (Abbildung 6A,B), was mit den berichteten Daten anderer normaler Zellen übereinstimmt33. Interessanterweise werden, obwohl der Entwicklungstrend dieser Beziehung im Allgemeinen in allen aufgezeichneten B2B-Zellen zu finden ist, zwei verschiedene Grade (hoch und niedrig) dieser Beziehung gefunden. B2B-Zellen, die sich gleichzeitig ausbreiten und migrieren, zeigen eine geringere Traktion und eine höhere Zell- und Zellkernausbreitungsfläche mit einem höheren YAP-N/C-Verhältnis (2,05 ± 0,32). Für B2B-Zellen, die sich ausbreiten und am selben Ort verbleiben, zeigen sie eine höhere Traktion und eine geringere Zell- und Zellkernausbreitungsfläche mit einem niedrigeren YAP-N/C-Verhältnis (1,74 ± 0,21). Diese beiden Grade von Beziehungen werden in den gegabelten verstreuten Datengruppen demonstriert (Abbildung 6C,D). Wie in der Literatur berichtet, haben stationäre normale Zellen, wie embryonale Fibroblasten NIH 3T3-Zellen, eine höhere Traktion als wandernde Zellen34. Die in diesem Papier berichteten Daten deuten darauf hin, dass die sich ausbreitenden und nicht migrierenden B2B-Zellen eine höhere Traktion aufwiesen als sich ausbreitende und migrierende B2B-Zellen, was wahrscheinlich darauf hindeutet, dass eine hohe Traktion für nicht migrierende Zellen erforderlich ist, um sich auf dem Substrat zu stabilisieren.
Darüber hinaus zeigen diese Daten, dass stationäre normale B2B-Zellen eine höhere perinukleäre Kraft erzeugen, während frühere Forschungen anderer Forscher nur eine höhere Zelltraktion an der Peripherie stationärer Zellen berichteten34,35,36,37. Die Autoren glauben, dass der Unterschied in der intrinsischen Tendenz der Migration in den Experimenten diese widersprüchlichen Ergebnisse verursachen könnte. In den veröffentlichten Experimenten wurde quadratische Mikrostrukturierung verwendet, um einzelne Zellen von der Ausbreitung abzuhalten und die Migration zu hemmen; Ob die Zellen die Tendenz zur Migration hatten, ist unbekannt. Da wandernde Zellen oft eine hohe Zugkraft an der Peripherie der Zellen aufweisen38, ist es wahrscheinlich, dass Zellen mit der Neigung zur Migration immer noch eine hohe periphere Traktion beibehalten, obwohl ihre Migration begrenzt ist. In dieser vorliegenden Studie sind die stationären Zellen nicht durch ein Mikromuster eingeschränkt, wandern aber nicht, was darauf hindeutet, dass die Zellen dazu neigen, ihren nicht migrierenden Zustand beizubehalten. Eine andere Möglichkeit besteht darin, dass die durch das Mikromuster definierte Zellform die Verteilung der fokalen Adhäsionen und Zugkräfte beeinflussen kann39. Die Ergebnisse dieser Studie wurden ohne einschränkende Mikrostrukturierung generiert und stellen die Kraftverteilung stationärer Zellen in ihrer ursprünglichen Form dar.
Nach bestem Wissen der Autoren berichtete bisher nur eine Publikation speziell über den Nachweis perinukleärer Kräfte in normalen Zellen (embryonalen Fibroblasten der Maus), die möglicherweise durch die Aktinkappe verursacht werden, die sich über den Kern erstreckt40. Die YAP-Zytoplasma-zu-Kern-Translokation korreliert mit dem Anstieg der perinukleären Kraft40. Eine gründliche Recherche in der einschlägigen Literatur ergab keine Publikationen, die über eine perinukleäre Kraft oder die Aktinkappe in Krebszellen berichten. Eine indirekte Studie an Melanom-Krebszellen zeigte, dass der Aktinrand (eine weitere perinukleäre Aktinorganisation, die sich um den Kern herum befindet, aber nicht bedeckt) die Zellmigrationsraten41 reduziert, was indirekt auf die Existenz einer perinukleären Kraft hindeutet. Es werden jedoch keine direkten experimentellen Daten gemeldet. In dieser Studie fanden die Autoren heraus, dass sowohl PC9- als auch B2B-Zellen eine perinukleäre Verschiebung und Traktion aufweisen. Die Mechanismen der Erzeugung der perinuklearen Kräfte und ihre Auswirkungen bleiben umstritten. In normalen Zellen wurde berichtet, dass die Aktinkappe eine Rolle bei der Regulierung der Zellkernmorphologie und der Chromatinorganisation42 spielt, mechanische Signale von fokalen Adhäsionen in den Zellkern durch Linker von Nukleoskelett und Zytoskelettkomplex (LINC)43 überträgt und die Zellmigration44 reguliert. Lamin A/C steht im Zusammenhang mit der Bildung und Störung des Aktin cap40,41,42,43,44. Der Bericht, in dem behauptet wurde, dass die Aktinkappe eine perinukleare Kraft erzeugt, berücksichtigte jedoch nicht die mögliche Rolle des Aktinrandes40. In Krebszellen erleichtert die Überexpression von Lamin A die Bildung eines Aktinrandes und schränkt die Migration von Krebszellen ein. Die Überexpression von Lamin B reduziert die Aktinrandbildung und fördert die Migration. Die perinukleare Kraft könnte aufgrund der Existenz einer perinukleären Aktinorganisation und der Wirkung von Lamin A an diesem Prozess beteiligt sein. Die Ergebnisse dieser Studie zeigten jedoch keine Hinweise auf gemessene perinukleare Kräfte oder das Verhalten der Aktinkappe. Daher ist die Entdeckung von perinukleären Kräften in PC9-Zellen in dieser vorliegenden Studie der erste Bericht, der perinukleäre Kräfte und Verschiebungen in Lungenkrebszellen zeigt. Die Autoren untersuchen derzeit die molekularen Mechanismen und Funktionen perinukleärer Kräfte in CRISPR/Cas9-konstruierten PC9- und B2B-Zellen.
Über die rein optische mechanotische Abfrage hinaus, die in diesem Artikel demonstriert wird, kann das integrierte multifunktionale System angewendet werden, um eine Vielzahl anderer essentieller physiologischer und pathologischer Signale in lebenden Systemen optisch zu untersuchen. Zum Beispiel hat das Labor der Autoren kürzlich mehrere stabil transduzierte menschliche Krebszelllinien etabliert, die drei lichtempfindliche Membranproteine koexprimieren: Membranspannungsindikator QuasAr2 (Anregung: 640 nm; Emission: 660 nm-740 nm), Membranspannungsentpolarizer CheRiff (Anregung: 488 nm) und Membranspannungshyperpolarizer eNpHR3 (Anregung: 590 nm). Diese drei funktionellen Proteine können durch spektralorthogonale Laserlinien übersprechfrei aktiviert werden, was eine rein optische Zwei-Wege-Signalkommunikation (Auslesen und Steuern) der Membranelektrophysiologie ermöglicht. Mit einem integrierten optoelektronischen System und einer manuellen Patch-Clamp haben die Autoren die rein optische Kontrolle und Auslesung der Membranspannung (Vm) in einzelnen menschlichen Krebszellen und mehrzelligen Tumorsphäroiden validiert. Die rein optische elektrophysiologische Abfrage eröffnet die Möglichkeit für detaillierte Erkundungen der bisher unzugänglichen Bioelektrizität in Krebszellen, die dazu beitragen können, die Tumorbiologie von einer neuen Achse aus voranzutreiben.
Offenlegungen
Es gibt keine Interessenkonflikte zu erklären.
Danksagungen
Dieses Projekt wird durch den Cancer Pilot Award des UF Health Cancer Center (X. T. und D. S.) und das Gatorade Award Start-up Package (X. T.) finanziell unterstützt. Die Autoren schätzen die intellektuellen Diskussionen mit und die technische Unterstützung von Dr. Jonathan Licht (UFHCC), Dr. Rolf Renne (UFHCC), Dr. Ji-Hyun Lee (Biostatistik, UF), Dr. Hugh Fan (MAE, UF), Dr. Warren Dixon (MAE, UF), Dr. Ghatu Subhash (MAE, UF), Dr. Mark Sheplak (MAE & ECE, UF), Dr. Malisa Sarntinoranont (MAE, UF), Dr. Scott Banks (MAE, UF), Dr. Matthew Traum (MAE, UF), Dr. David Hahn (University of Arizona), Dr. Weihong Wang (Oracle Corporation), Dr. Youhua Tan (Hong Kong Polytechnic University) und das Support-Team von Nikon (Drs. Jose Serrano-Velez, Larry Kordon und Jon Ekman). Die Autoren sind zutiefst dankbar für die großzügige und effektive Unterstützung aller Mitglieder der Forschungslabors von Tang, Siemann und Guan sowie aller Mitarbeiter der ABTEILUNGEN MAE & ECE & Physik & Radioonkologie, UF.
Materialien
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Sigma-aldrich | 440140 | |
| 0.05 % Trypsin | Corning | 25-051-CI | |
| 75 cm2 flask | Corning | 430641U | |
| 8 Benchtop Centrifuge | Thermo | 75007210 | |
| A1R confocal system | Nikon | HD25 | |
| Acetic acid | Sigma-aldrich | 695092 | glacial, ACS reagent, ≥99.7% |
| BEAS-2B (B2B) cells | Sigma-aldrich | 95102433 | human epithelial cells from lung tissue |
| Carboxylate-Modified Microspheres | Invitrogen | F8797 | |
| Culture medium (RPMI-1640) | Gibco | 11875093 | |
| Desktop Computer | Dell | 2018 | with Windows 10 operating system |
| Environmental chamber TIZB | Tokai Hit | TIZB | |
| Fetal bovine serum (FBS) | Gibco | 26140 | |
| Fibronectin Human Protein, Plasma | Gibco | 33016015 | |
| Fiji ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | 1.53k | |
| Glass-bottom petri dish | MatTek | P35G-1.5-14-C | |
| HEPES buffered saline | Sigma-aldrich | 51558 | |
| Hydrazine hydrate solution | Sigma-aldrich | 53847 | |
| IntelliJ IDEA | JetBrains | 2020 | Java development platform |
| Java Development Kit | Oracle | 14.0 | |
| Kimwipe | Kimtech Science | 3066-05 | |
| MATLAB | MathWorks | 2020b | |
| Monochrome Camera | FLIR | BFS-U3-70S7M-C | |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-218 | |
| N,N′-Methylenebisacrylamide solution | Sigma-aldrich | M1533 | |
| NIS-Elements software platform | Nikon | 4.50 | software platform |
| Origin | OriginLab | OriginPro 2017 (Learning Edition) | data analysis and graphing software |
| Penicillin-streptomycin | Gibco | 15140122 | |
| PC9 cells | Sigma-aldrich | 90071810 | human adenocarcinoma cells from lung tissue |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | F-553S | high-fidelity DNA polymerase |
| Scotch tape | Scotch | adhesive tape | |
| Sodium dodecyl sulfate solution | Sigma-aldrich | 05030 | |
| Super glue | Gorilla | cyanoacrylate glue | |
| Ti2-E inverted microscope | Nikon | MEA54000 | |
| TI2-S-SE-E Motorized Stage with Encoder | Nikon | MEC56120 | |
| μManager | version 2.0 gamma | open source microscopy software (https://micro-manager.org/) |
Referenzen
- Werley, C., Boccardo, S., Rigamonti, A., Hansson, E., Cohen, A. Multiplexed optical sensors in arrayed islands of cells for multimodal recordings of cellular physiology. Nature Communications. 11 (1), 3881(2020).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Saraswathibhatla, A., Galles, E. E., Notbohm, J. Spatiotemporal force and motion in collective cell migration. Scientific Data. 7 (1), 197(2020).
- Saraswathibhatla, A., Henkes, S., Galles, E. E., Sknepnek, R., Notbohm, J. Coordinated tractions control the size of a collectively moving pack in a cell monolayer. Extreme Mechanics Letters. 48, 101438(2021).
- Wang, W., Kim, C. K., Ting, A. Y. Molecular tools for imaging and recording neuronal activity. Nature Chemical Biology. 15 (2), 101-110 (2019).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature Methods. 9 (7), 697-710 (2012).
- Carpenter, A. E., Kamentsky, L., Eliceiri, K. W. A call for bioimaging software usability. Nature Methods. 9 (7), 666-670 (2012).
- Skylaki, S., Hilsenbeck, O., Schroeder, T. Challenges in long-term imaging and quantification of single-cell dynamics. Nature Biotechnology. 34 (11), 1137-1144 (2016).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Luo, Q., et al. Automatic multi-functional integration program (AMFIP) towards all-optical mechanobiology interrogation. bioRxiv. , (2021).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer control of microscopes using manager. Current Protocols in Molecular Biology. 92 (1), 14-20 (2010).
- Tulpule, A., et al. Kinase-mediated RAS signaling via membraneless cytoplasmic protein granules. Cell. 184 (10), 2649-2664 (2021).
- Tang, X., Tofangchi, A., Anand, S. V., Saif, T. A. A novel cell traction force microscopy to study multi-cellular system. PLOS Computational Biology. 10 (6), 1003631(2014).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews Materials. 5, 351-370 (2020).
- Phelps, E. A., et al. Maleimide cross-linked bioactive PEG hydrogel exhibits improved reaction kinetics and cross-linking for cell encapsulation and in situ delivery. Advanced Materials. 24 (1), 64-70 (2012).
- Bajaj, P., Tang, X., Saif, T. A., Bashir, R. Stiffness of the substrate influences the phenotype of embryonic chicken cardiac myocytes. Journal of Biomedical Materials Research. Part A. 95 (4), 1261-1269 (2010).
- Temples, M. N., Adjei, I. M., Nimocks, P. M., Djeu, J., Sharma, B. Engineered three-dimensional tumor models to study natural killer cell suppression. ACS Biomaterials Science & Engineering. 6 (7), 4179-4199 (2020).
- Feng, S., et al. Improved split fluorescent proteins for endogenous protein labeling. Nature Communications. 8, 370(2017).
- Guan, J., Liu, H., Shi, X., Feng, S., Huang, B. Tracking multiple genomic elements using correlative CRISPR imaging and sequential DNA FISH. Biophysical Journal. 112 (6), 1077-1084 (2017).
- Micro-Manager. , Available from: https://micro-manager.org/wiki/NikonTi2 (2021).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Martiel, J. L., et al. Measurement of cell traction forces with ImageJ. Methods in Cell Biology. 125, 269-287 (2015).
- Okumurai, I. A. On the generalization of Cerruti's problem in an elastic half-space. Doboku Gakkai Ronbunshu. 1995, 1-10 (1995).
- Piccolo, S., Dupont, S., Cordenonsi, M. The biology of YAP/TAZ: hippo signaling and beyond. Physiological Reviews. 94 (4), 1287-1312 (2014).
- Hong, W. W., Guan, K. L. The YAP and TAZ transcription co-activators: Key downstream effectors of the mammalian Hippo pathway. Seminars in Cell and Developmental Biology. 23 (7), 785-793 (2012).
- Zanconato, F., Cordenonsi, M., Piccolo, S. YAP/TAZ at the roots of cancer. Cancer Cell. 29 (6), 783-803 (2016).
- Wang, Y., et al. Overexpression of yes-associated protein contributes to progression and poor prognosis of non-small-cell lung cancer. Cancer Science. 101 (5), 1279-1285 (2010).
- Li, H., et al. Inhibition of YAP suppresses CML cell proliferation and enhances efficacy of imatinib in vitro and in vivo. Journal of Experimental & Clinical Cancer Research. 35 (1), 134(2016).
- Tang, X., et al. A mechanically-induced colon cancer cell population shows increased metastatic potential. Molecular Cancer. 13, 131(2014).
- Panciera, T., Azzolin, L., Cordenonsi, M., Piccolo, S. Mechanobiology of YAP and TAZ in physiology and disease. Nature Reviews Molecular Cell Biology. 18 (12), 758-770 (2017).
- Yuan, M., et al. Yes-associated protein (YAP) functions as a tumor suppressor in breast. Cell Death and Differentiation. 15 (11), 1752-1759 (2008).
- Koushki, N., et al. Lamin A redistribution mediated by nuclear deformation determines dynamic localization of YAP. bioRxiv. , (2020).
- Chang, S. S., Rape, A. D., Wong, S. A., Guo, W. H., Wang, Y. L. Migration regulates cellular mechanical states. Molecular Biology of the Cell. 30 (26), 3104-3111 (2019).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Geometric guidance of integrin mediated traction stress during stem cell differentiation. Biomaterials. 69, 174-183 (2015).
- Lee, J., Abdeen, A., Tang, X., Saif, T. A., Kilian, K. A. Matrix directed adipogenesis and neurogenesis of mesenchymal stem cells derived from adipose tissue and bone marrow. Acta Biomaterialia. 42, 46-55 (2016).
- Tang, X., Bajaj, P., Bashir, R., Saif, T. A. How far cardiac cells can see each other mechanically. Soft Matter. 7 (13), 6151-6158 (2011).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Rape, A., Guo, W. H., Wang, Y. L. The regulation of traction force in relation to cell shape and focal adhesions. Biomaterials. 32 (8), 2043-2051 (2011).
- Shiu, J. Y., Aires, L., Lin, Z., Vogel, V. Nanopillar force measurements reveal actin-cap-mediated YAP mechanotransduction. Nature Cell Biology. 20 (3), 262-271 (2018).
- Fracchia, A., Asraf, T., Salmon-Divon, M., Gerlitz, G. Increased lamin B1 levels promote cell migration by altering perinuclear actin organization. Cells. 9 (10), 2161(2020).
- Ramdas, N. M., Shivashankar, G. V. Cytoskeletal control of nuclear morphology and chromatin o1rganization. Journal of Molecular Biology. 427 (3), 695-706 (2015).
- Khatau, S. B., et al. A perinuclear actin cap regulates nuclear shape. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19017-19022 (2009).
- Kim, D. H., Cho, S., Wirtz, D. Tight coupling between nucleus and cell migration through the perinuclear actin cap. Journal of Cell Science. 127 (11), 2528-2541 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten