Method Article
Çok Fonksiyonlu Bir Sistem Kullanarak İnsan Kanseri ve Normal Hücrelerde Evet İlişkili Proteinin Tamamen Optik Mekanobiyoloji Sorgulaması
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu makalede, Otomatik çok kanallı görüntüleme ve mekanobiyolojik analizin Evet ilişkili proteinin (YAP) mekano duyarlılığını aydınlatmasını sağlayan entegre çok fonksiyonlu ve kullanıcı tarafından programlanabilir bir sistemin nasıl kullanılabileceğine dair ayrıntılı bir adım adım protokol sunulmaktadır.
Özet
Canlı hücrelerin uzun süreli çok fonksiyonlu görüntüleme ve analizi, çeşitli donanım ve yazılım platformlarının kolaylaştırılmış, işlevsel koordinasyonunu gerektirir. Bununla birlikte, farklı üreticiler tarafından üretilen çeşitli ekipmanların manuel kontrolü emek yoğun ve zaman alıcıdır ve elde edilen verilerin doğruluğunu, tekrarlanabilirliğini ve kalitesini potansiyel olarak azaltır. Bu nedenle, otomatik, çok işlevli ve uzun süreli görüntü alımını sağlayan ve çoğu floresan mikroskopi platformuyla uyumlu, hepsi bir arada ve kullanıcı tarafından programlanabilir bir sistem bilim camiasına fayda sağlayabilir. Bu makale, (1) otomatik çok kanallı görüntüleme alımını sağlayan "Otomatik Çok fonksiyonlu Entegrasyon Programı (AMFIP)" başlıklı ev yapımı bir yazılım programından ve (2) nicel görüntüleme analizi ve hücre çekiş hesaplama paketlerinden oluşan yeni bir entegre yazılım sisteminin kullanılmasının tam çalışma protokollerini tanıtır.
Bu entegre sistem, CRISPR/Cas9 tarafından tasarlanmış insan normal hücrelerinde (B2B) ve akciğer kanseri hücrelerinde (PC9) mechano duyarlı Evet ilişkili proteinin (YAP) mekansal-zamansal dağılımı ile hücre yayılımı ve çekiş dahil hücre mekaniği arasındaki daha önce bilinmeyen ilişkiyi ortaya çıkarmak için uygulanmaktadır. Bu sistemin çok kanallı kontrol ve okuma yeteneğinden yararlanan sonuç şunları göstermektedir: (1) B2B normal hücreler ve PC9 kanser hücreleri, hücre yayma ve geçiş işlemleri sırasında YAP ekspresyonu, çekiş ve hücre dinamikleri arasında ayrı bir ilişki gösterir; ve (2) PC9 kanser hücreleri substratlara gözle görülür peri-nükleer kuvvetler uygular. Özetle, bu makale, YAP mekano duyarlılığını aydınlatmak için otomatik çok fonksiyonlu görüntüleme ve analiz sağlayan entegre bir kullanıcı programlanabilir sistemin nasıl kullanılabileceğine dair ayrıntılı bir adım adım protokol sürmektedir. Bu araçlar, hücre fizyolojisi ve patolojisi bağlamında çok yönlü sinyal dinamiklerinin ayrıntılı keşfine imkan açar.
Giriş
Bu yöntemin genel amacı, tüm optik çok fonksiyonlu görüntüleme ve canlı hücrelerin analizini sağlamaktır. Çok fonksiyonlu optoelektronik cihazların otomatik koordinasyonunu sağlayan hepsi bir arada görüntüleme programı, emek yoğun ve hataya açık manuel işlemleri azaltacaktır ve araştırmacıların uzun süreli canlı hücre görüntülemesi yapması için gereklidir1,2,3,4. Bununla birlikte, biyomedikal araştırma topluluğundaki mevcut kamu programlarının çoğu ya sadece sınırlı optoelektronik cihazlar için geçerlidir ya da farklı ekipmanların koordinasyonu için ek donanım gerektirir5,6,7,8,9. Son zamanlarda, çok kanallı ve hızlandırılmış görüntülemeyi mümkün kılacak "Otomatik Çok fonksiyonlu Entegrasyon Programı (AMFIP)" başlıklı açık kaynaklı ve yazılım tabanlı bir program geliştirilmiştir. Java diline ve μManager11,12'lik Uygulama Programlama Arabirimi'ne (API) dayanan AMFIP, Nikon'dan gelenler de dahil ancak bunlarla sınırlı olmamak üzere birden fazla optoelektronik donanım ve yazılım platformunun yazılım tabanlı iletişimlerini gerçekleştirmek için özelleştirilmiş Java komut dosyaları yürüten bir eklenti olarak geliştirilmiştir. AMFIP'nin kurulması, hücre davranışlarının programlanabilir ve çok fonksiyonlu sorgulanma olasılığını açar. Bu makalede entegre bir deneysel ve hesaplama sistemi geliştirilmiştir ve AMFIP ile dijital görüntüleme analizi ve hücre çekiş kuvveti mikroskopisini birleştirir. Sistem, CRISPR/Cas9 tarafından tasarlanmış insan normal B2B (Şekil 1) ve akciğer kanseri PC9 (Şekil 2) hücre hatlarında belirgin YAP mekanobiyolojisinin aydınlatıcısını sağlar. Sistem, bilim topluluğuna, her görüntüleme sistemi için mevcut olmayan ve/veya uyumlu olabilecek ek kontrol cihazları satın alma talebini önleyen kapsamlı bir çözüm sunar.
Bu makalede sunulan protokoller, (1) mNEonGreen2 etiketli YAP'ı ifade eden crispr/cas9 tarafından tasarlanmış hücre hatları için otomatik uzun süreli görüntüleme yapmak için AMFIP'nin nasıl uygulanacağını tanıtır; ve (2) Floresan yoğunluklarına (Şekil 3 ve Şekil 4), hücresel yer değiştirme alanına (Şekil 1C ve Şekil 2C) ve hücresel çekiş alanına (Şekil 1D ve Şekil 2D) göre YAP nükleer/sitoplazma (N/C) oranının nicel analizi için Fiji ImageJ, MATLAB ve Origin'i birleştirir. ). Sonuçlar, (1) fizyolojik olarak ilgili mekanik sertliğe sahip substratlara yayılan hücrenin ilk 10 h'si sırasında13,14,15,16,17,18, tek B2B hücrelerin YAP N/C oranının tek PC9 hücrelerine kıyasla daha belirgin zamana bağlı değişim ve dalgalanma gösterdiğini göstermektedir (Şekil 5 ve Şekil 6 ); ve (2) PC9 kanser hücreleri peri-nükleer bölgelerinde gözle görülür bir çekiş oluşturur (Şekil 7). Bu protokolde açıklanan entegre sistem ve metodolojiler, belirli hücre türlerini ve optogenetik molekülleri aşmaktadır. Araştırmacılar, özel canlı hücre sorgulama deneylerini özelleştirmek ve hücre fizyolojisi ve patolojisi bağlamında çok yönlü sinyal dinamiklerini aydınlatmak için protokolleri uygulayabilirler.
Protokol
1. mNeonGreen21-10/11 etiketli YAP proteinini endojen olarak ifade eden stabil CRISPR/ Cas9 düzenlemeli insan akciğer kanseri hücre hattı (PC9) ve insan bronşiyal epitel hücre hattının (Beas2B) üretimi
- Yüksek kaliteli DNA polimerazını kullanarak floresan proteininin 11. telini kodlayan DNA dizisini yükseltmek için polimeraz zincir reaksiyonu (PCR) gerçekleştirin mNeonGreen2 ( Bkz. Malzeme Tablosu).
- CRISPR-Cas9 gen düzenleme sistemini kullanarak PC9 ve B2B hücre hatlarının YAP genomik lokusuna güçlendirilmiş DNA dizisini vurun.
NOT: Bu DNA dizisi, floresan yaymak için mNeonGreen2'nin 1-10 iplikçiklerini tamamlar. YAP-mNeonGreen21-10/11'in genomik dizi haritası Ek Şekil S1'de gösterilmiştir. Harita, etiketli genomik, donör ve mNeonGreen2 dizilerini içerir. - Bir epifluoresans mikroskobu kullanarak CRISPR/Cas9 tarafından tasarlanmış mNeonGreen2 ifadesini kontrol edin ( Bkz. Malzeme Tablosu). mNeonGreen2, hücreler YAP'ı yerel gen düzenleyici ağı bağlamında ifade ettigezeni her ifade ettince YAP olarak etiketlendiği için, hem CRISPR/ Cas9 tarafından tasarlanmış hücrelerde floresan yoğunluğunun varlığını kontrol edin hem de ebeveyn hücrelerindeki (kontrol) bununla karşılaştırın.
NOT: Bu protokole uymak için (1) uyarılma için 488 nm lazer (47,5 mW/mm2) kullanın, (2) floresan ölçümü için 40x objektif (sayısal diyafram (NA) = 0,95) ve bant geçiş emisyon filtresi (ET525/50 nm) ve (3) Floresan yoğunluklarını ölçmek, ölçmek ve karşılaştırmak için ImageJ yazılımı. - CRISPR/Cas9 tarafından düzenlenen hücre çizgilerinden genomik DNA çıkararak mNeonGreen211'in doğru entegrasyonunu onaylayın; doğru genomik loci19,20'de yerleştirmeyi onaylamak için genomik kesici ucu ve dizilemeyi kuşatır astarlar kullanarak PCR gerçekleştirin.
- CRISPR/Cas9 gen düzenleme sistemini kullanarak mNeonGreen211'i çökertin ve 1.3 adımında açıklanan aynı mikroskop sistemlerini ve görüntüleme parametrelerini kullanarak hücrelerdeki floresan yoğunluğu azaltmayı kontrol edin.
NOT: Bu adım, floresan yoğunluklarının karşılaştırılmasıyla mNeonGreen211'in doğru entegrasyonunu doğrular. Crispr/Cas9 tarafından tasarlanmış, devirme ve ebeveyn hücreleri olmayan hücreler kontrol olarak kullanılır. - Floresan ile aktive edilmiş hücre sıralama (FACS) sıralama yoluyla ilgi etiketli protein ile hücreleri toplayın.
- Hücreleri FACS sıralamaya hazırlamak için, onları deneyin ve fosfat tamponlu salin (PBS) ile yeniden biriktirin.
- İki zenginleştirici FACS sıralama turunda ebeveyn hücre çizgilerinin arka plan düzeyinin üzerinde mNeonGreen2 floresanlı hücreleri toplayın.
NOT: Burada açıklanan CRISPR/Cas9 düzenlemeli hücre çizgilerini oluşturmak için zaman çizelgesi 1-2 ay arasında. Diğer araştırma laboratuvarlarının sonuçları yeniden üretebilmesi için tüm hücre hatları talep üzerine halka açık hale getirilir.
2. PC9 ve B2B hücrelerinin bakımı
- 37 °C'de %5 CO2 ile nemlendirilmiş doku kültürü inkübatörlerinde her iki hücre hattını da koruyun.
- Kültür 106 endojen olarak etiketlenmiş PC9 ve Beas2B hücreleri 75 cm2 matara ile 12 mL RPMI-1640 orta% 10 fetal sığır serumu ve 100 μg / mL penisilin-streptomisi ile desteklenmiştir. Hücre konfluensi ~%80'e ulaştığında her iki hücre satırını da alt kültüre edin.
- Her iki hücre hattını da her 3 ayda bir mikoplazma tespit kiti kullanarak, üreticinin önerdiği tüm protokolleri harfiyen izleyerek test edin.
- Hücre hatlarını -80 °C dondurucuda saklayın.
- Tüm deneyler için çözülmeden 20 < geçiş olan hücre çizgilerini kullanın.
3. Donanım ve yazılım ortamının kurulumu
- Denemenin donanım ortamı kurulumu
- Konfokal denetleyiciyi ve ters mikroskobu bilgisayara bağlayın ( Bkz. Malzeme Tablosu).
- Yazılım platformunu (Malzeme Tablosu) yükleyin.
- Konfokal denetleyiciyi ve ters mikroskobu açın. Ardından, Elements'ı başlatın.
- Konfokal, lazer ve ters mikroskobun kontrol panellerini Elementler'de açın. Ardından, motorlu aşamanın hareketini, mikroskop hedeflerinin değiştirilmesini ve lazer hatlarının mekansal taramasını test ederek üç panelin düzgün çalışıp çalışmadığını kontrol edin.
- AMFIP'nin yazılım ortamı kurulumu
- Bilgisayara IntelliJ, Java Development Kit 14.0, μManager sürüm 2.0 gama ve Fiji ImageJ'yi yükleyin.
- GitHub'dan indirilen AMFIP projesini (bağlantı: https://github.com/njheadshotz/AMFIP) IntelliJ'de açın.
- Ayarlar | tıklayın Derleyici | Ek Açıklama İşlemcileri'ni ve Ek açıklama işlemeyi etkinleştir'i denetleyin.
- Proje Yapısı | tıklayın Yapıtlar ve bir JAR dosyası oluşturun. Çıktı dizinini μManager dizininin altındaki mmplugins olarak ayarlayın.
- Proje Yapısı | tıklayın Kitaplıklar ve μManager dizininin altına mmplugins ve eklentiler ekleyin.
- Çalıştır açılan menüsünün altındaki Yapılandırma ekle'ye tıklayın ve bir uygulama oluşturun.
- ij girin. ImageJ ana sınıfa.
- VM seçeneğine -Xmx3000m -Dforce.annotation.index=true girin.
- μManager dizinini İş dizinine ayarlayın.
- AMFIP eklentisi ile μManager'ı etkinleştirmek için Çalıştır'a tıklayın.
- μManager'ı ters mikroskopla bağlayın.
- Ters mikroskop21'in uyarlanabilir sürücüsünü μManager dizinine ekleyin.
- μManager'ı açın. Cihazlar | tıklayın Donanım Yapılandırma Sihirbazı'nı kullanın ve yeni bir yapılandırma oluşturun.
- Ti2 sürücüsünü Kullanılabilir Aygıtlar'ın altına ekleyin.
- Tüm çevre birimi aygıtlarını seçin ve yeni yapılandırma dosyasını kaydedin.
- μManager'ı yeniden başlatın ve Micro-Manager Başlangıç Yapılandırması'ndaki 3.2.4 adımında yapılandırma dosyasını seçin.
4. Jel hazırlama
- Cam kapak kapağını 3-aminopropyltrymethoxysilane ile oda sıcaklığında (24 °C) 7 dakika boyunca tedavi edin.
- Cam kapak sapını durulamak ve kapak sapını 160 °C'de 20 dakika kurutmak için deiyonize (DI) su kullanın.
- Cam kapak sapını% 0.5 glutaraldehit ile 30 dakika boyunca tedavi edin ve DI suyu ile durulayın.
- N,N′-metilennebisacrylamide (bis) çözeltisi ve 10 mM HEPES tamponlu salin içinde asılı floresan boncukları karıştırın. Polimerizasyonun başlatıcıları olarak% 10 (w / v) amonyum persülfat çözeltisi ve N, N, N′, N′-tetrametililenediamin (TEMED) kullanın. Daha önce açıklanan belirlenmiş protokolleri izleyerek poliakrilamid (PAA) hidrojellerin istenen mekanik sertliğini elde etmek için her bileşenin yüzdesini değiştirin13,14.
NOT: Bu protokolde, 2 kPa jel: akrilamid = % 12.5 ve bis-akrilamid = % 6.5; 5 kPa jel: akrilamid = % 12.5 ve bis-akrilamid = % 21.5; ve 40 kPa jel: akrilamid = %12,5 ve bis-akrilamid = %31,5. Listelenen tüm % birim yüzdedir. - 35 dk sonra, cam kapak kapağını katılaşmış PAA hidrojelden soyun ve hidrojelleri 50 mM HEPES tamponlu salin ile iki kez (her seferinde 5 dk) yıkayın.
- Hidrojel yüzeyi 6 saat boyunca bir hidrazin-hidrat çözeltisi ile tedavi edin.
- Hidrojel 30 dakika boyunca asetik asit ile durulayın. Asetik asidi çıkarın ve PBS ile 30 dakika durulayın.
- Fibronektin çözeltisini (PBS'de 50 μg/mL) 30 dakika sodyum periyodik olacak şekilde oksitlenin.
- Hidrojel yüzeyini oksitlenmiş fibronektin çözeltisi ile kaplayın ve 35 dakika bekleyin.
- Hidrojel içine daldırmak ve 4 °C'de depolamak için PBS ekleyin. Hidrojellere ışık maruz kalmaması için hidrojelleri içeren tüm Petri kaplarını alüminyum folyo ile örtün.
5. Hücre kültürü
NOT: Aseptik tekniği kullanarak hücre kültürünü gerçekleştirin.
- Hücre tohumlama ve görüntüleme işlemleri sırasında jellerin fiziksel olarak sürüklenmesini önlemek için cam kapakları PAA hidrojelleri ile 35 mm cam tabanlı Petri kabına yapıştırın.
- Sterilize edilmiş temiz cımbız kullanarak, hazırlanan jelleri içeren Petri kabından kapak kapağını (üstte PAA hidrojel ile) kaldırın.
- Cam kapak kapağının alt yüzeyindeki su damlacıklarını temizlemek için kuru bir mendil kullanın.
- Cam örtü kapağını tutmak için sterilize edilmiş cımbızı kullanın.
- Alt yüzeydeki iki çapraz köşeye küçük damlacıklar (1-5 μL) siyanoakrilat tutkal yerleştirin.
- Fazla tutkal kaldırmak için sterilize edilmiş mendiller kullanın.
- Cam tabanlı Petri kabındaki örtüleri değiştirmek için sterilize edilmiş cımbızları kullanın. Tutkal damlacıklarının Petri kabının yüzeyiyle tam temas etmesini sağlamak için kapak ucunun köşelerine hafifçe bastırın.
- PAA hidrojellerinde PBS'nin buharlaşmasını en aza indirmek için kapağı tekrar Petri kabına yerleştirin. Yapıştırıcının Petri kabında katılaşmasına ve kurumasına izin vermek için 3 dakika bekleyin.
- Petri kabını 4 mL PBS ile doldurun.
- Görüntüleme için kullanılan Petri kaplarında kalan PAA hidrojel örnekleri için yukarıdaki 5.1.1-5.1.8 adımlarını tekrarlayın.
- Tüm Petri tabaklarının dış yüzeyini sterilize etmek ve doku kültürü biyogüvenlik kabinine aktarmak için% 75 etanol kullanın. Ultraviyole ışığını 5 dakika açın ve numuneleri sterilize edin.
- Hücreleri jelin üst yüzeyine tohumlayın.
- Ultraviyole ışığını kapatın. Şişeyi (B2B/PC9 hücrelerini içeren) 37 °C inkübatörden biyogüvenlik kabinine alın. Tüm kültür ortamını aspire etmek için vakum pompasına bağlı bir pipet kullanın ve şişeyi yıkamak için 5 mL PBS ekleyin.
- Hücreleri şişenin altından ayırmak için 2 mL% 0.05 tripsin ekleyin.
- Şişeyi inkübatöre yerleştirin. 5 dakika bekleyin.
- Şişeyi biyogüvenlik kabinine aktarın. Hücreleri homojen bir şekilde askıya almak için şişeye 8 mL taze kültür ortamı ekleyin ve pipet birkaç kez yukarı ve aşağı.
- Hücre süspansiyonunun tüm 10 mL'lik kısmını 5 dakika boyunca 300 × g'da 15 mL'lik bir tüpe ve santrifüje aktarın.
- Tüpün altındaki hücre peletini kontrol edin. Tüpü yavaşça yatay olarak eğin ve hücre peletine dokunmadan tüm kültür ortamını tüpten çıkarmak için aspirasyon pipetini kullanın. Daha sonra, 8 mL taze kültür ortamı ekleyin ve tüm hücreler ortamla homojen bir şekilde karışana kadar pipet birkaç kez yukarı ve aşağı ekleyin.
- Hücre süspansiyonunun 100 μL'yi (150 hücre/μL) jel yüzeyine yatırın ve 5 dakika bekleyin. Daha sonra, Petri yemeklerine yavaşça 4 mL taze kültür ortamı ekleyin; taze ortamı doğrudan jelin üzerine eklemekten kaçının.
- Petri kabını 37 °C inkübatöre yerleştirin. Hücrelerin jel yüzeyine bağlanmasına izin vermek için bekleyin (B2B: 0,5-1 saat; PC9: 4-5 saat).
6. Hücre görüntüleme
NOT: AMFIP, farklı donanım ve yazılım sistemleriyle koordine olarak otomatik, çok kanallı ve uzun süreli görüntüleme sağlar: (1) AMFIP, Ti2-E mikroskopunun motorlu aşamasını otomatik olarak birden fazla görüş alanına (FOV) taşımak ve tek renkli bir kamera (Malzeme Tablosu) aracılığıyla parlak alan görüntüleri elde etmek için μManager'ı manipüle eder; ve (2) AMFIP, konfokal z-stack görüntüleme ve farklı lazer kanallarının (405 nm ve 488 nm) değiştirilmesi için otomatik işlemleri gerçekleştirmek için özelleştirilmiş bir Java komut dosyası ile Elements içinde birden fazla makro dosyasını etkinleştirir.
- Ortamı uzun süreli görüntüleme için ayarlayın.
- Çevre odasını ters mikroskobun motorlu aşamasına yerleştirin. CO2 akış hızını 160 mL/dk olarak ayarlayın ve odanın sıcaklığını ayarlayın (üst: 44 °C; banyo: 42 °C; aşama: 40 °C). Daha sonra, odanın banyosuna 40 mL arıtılmış su ekleyin.
- Cam tabanlı Petri kabını inkübatörden hücrelerle dışarı çıkar ve çevre odasına yerleştirin.
- Konfokal denetleyiciyi ve ters mikroskobu açın. Işık yolunu sağa doğru geçirin ve μManager kullanarak takılan hücreleri gözlemleyin. Jel için yeterli hücre bağlıysa, Petri kabını inkübatöre geri aktarın. Jel için yeterli hücre bağlı değilse, B2B için 30 dakika ve PC9 hücreleri için 60 dakika daha hücre inkübasyonuna devam edin.
- İki küçük yapışkan bant parçası kesin ve dairesel deliğin etrafındaki hazneye yapıştırın. Daha sonra, bant üzerine biraz yapışkan yapıştırıcı uygulayın (sadece Petri kabının kaplayacağı alana).
- Petri kabını inkübatörden çıkar. Daha sonra, Petri kabını yavaşça odaya yerleştirin ve kabın tabanının tutkalla temas edelim.
- Yapıştırıcının Petri kabıyla tam temas etmesini ve katılaşması için Petri kabının kapağına 1 dakika bastırın. Daha sonra, Petri kabının haznede taşınamaz olduğunu onaylamak için Petri kabını yatay olarak hafifçe itin.
- Odanın kapağını kapatın.
- Parlak alan görüntüleme için görüntü alma parametrelerini ayarlayın.
- IntelliJ'i açın ve dosya Elements_script.java nın 93. Bu değerin, bir görünüm alanının (FOV) konfokal görüntülemesi için kullanılan Öğeler'de makronun çalışma süresinden daha büyük olduğundan emin olun. AMFIP IntelliJ projesini başlatmak için Çalıştır düğmesini tıklatın.
- μManager ana arabiriminde Canlı ve Çok D Acq. düğmesine tıklayın. Ardından, ters mikroskobun ışık yolunu parlak alan görüntüleme için sağa çevirin, 10x hedefine geçin ve ışık yayan diyot (LED) ışığını açın (parlak alan görüntüleme için ışık kaynağı; yoğunluk: % 5).
- Elementler Ti2 Panel'deki ışık yoluna, mikroskop hedefine ve LED lamba düğmesine tıklayın veya mikroskoptaki ilgili düğmelere manuel olarak basın.
- Petri kabındaki jelin doğru konumunu ve odak düzlemini bulmak için XY joystick'i ve Z düzleminin düğmesini ayarlayın. Jel bağlı birden fazla tek hücrenin uygun FOV'larını bulmak için 10x hedefi kullanın.
- Çok Boyutlu Alım penceresinde birden çok konum (XY) kutusunu işaretleyin. Konum Listesini Düzenle... düğmesine tıklayın ve açılan Sahne Alanı Konum Listesi penceresini gözlemleyin. Ardından, hedefi 40x olarak değiştirin, LED ışığının yoğunluğunu% 15'e çıkarın, FOV'ları bulmak için XY motorlu sahneyi yeniden ayarlayın ve Sahne Alanı Konum Listesi penceresindeki İşaretle düğmesine tıklayarak koordinatları kaydedin.
- 67 istenen FOV'ları kaydedin. Koordinatları kaydetmek için Sahne Alanı Konum Listesi penceresindeki Farklı Kaydet... düğmesini tıklatın. Çok Boyutlu Edinme penceresindeki Zaman Noktaları bölümünde T1'e görüntüleme alma zaman aralığına T1 (parametre, örneğin, adım 6.2.1'de tanımlanan 120 s) girin.
- 2D-YAP ve boncuk görüntüler için görüntü alımını ayarlayın.
- Öğeleri açın, konfokal görüntüleme için ışık yolunu sağa değiştirin ve LED ışığını kapatın. Ardından, Kilitlemeyi Kaldır düğmesine tıklayın ve FITC kutusunu işaretleyerek FITC lazer kanalını (YAP görüntüleme için) açın.
- 1/2 düğmesine tıklayarak tarama hızını 2 sn başına 1 kareye ayarlayın ve bağlı hücrelerin Z konumunu hızlı bir şekilde bulmak için Z düzleminin düğmesini döndürün. Z yığını için alt ve üst sınırları kaydedin.
- Üst şeritteki Makro'yu tıklatın, Makro açılan menüsünün altında Makro Düzenleyicisi'ni seçin ve 6.3.2 adımındaki değerleri makro dosyasına girin.
- Boncukların odaklanmış Z pozisyonunu bulmak ve kaydetmek için DAPI kutusunu kontrol ederek 4′, 6-diamidino-2-fenilindole ( DAPI ) lazer kanalını (boncuk görüntüleme için) açın. Makro düzenleyicisine gidin ve kaydedilen değerleri makro dosyasına girin.
- AMFIP kullanarak motorlu sahneyi taşıma görevini ayarlayın.
- μManager'a gidin ve Eklentiler | tıklayın AMFIP'nin grafik kullanıcı arabirimini (GUI) açmak için otomasyon. Seçilen TAM EV sayısını elde etmek için Nokta Ekle veya Noktayı Kaldır düğmelerini tıklatın. FOV'lerin kaydedilen koordinatlarını Koordinatlar Paneli'ne girin.
- Toplam Deneme Süresi metin alanında toplam deneme süresini tanımlayın.
- Ek Süre Yapılandırması düğmesine tıklayın ve motorlu sahneyi her FOV'a taşımanın T2 (örneğin, 30 dk) zaman aralığını tanımlayın.
- Öğelerin pencere boyutunu en üst düzeye çıkarın ve GUI'nin imlecin otomatik işlemlerini rahatsız etmesini önlemek için AMFIP GUI'sini ekranın sağ tarafına sürükleyin.
- Enter düğmesine tıklayın. İlk makro bittikten sonra, Çok Boyutlu Edinme penceresindeki Edin! düğmesini tıklatın.
- Görüntü alımından sonra hücreleri çözün.
- Uzun süreli görüntülemeyi bitirdikten sonra, otomasyon eklentisi penceresindeki Duraklat düğmesine ve Çok Boyutlu Edinme penceresindeki Durdur düğmesine tıklayarak AMFIP görevini durdurun.
- Öğeleri açın ve ND Edinme penceresindeki Üst ve Alt düğmelerini tıklatarak Z yığını görüntülemeyi ayarlayın (Z aralığını boncukların Z aralığından daha büyük olacak şekilde ayarlayın). Işık yolunu sağa doğru değiştirin ve LED ışığını açın (yoğunluk: %15).
- Odanın ve Petri kabının kapaklarını yavaşça ve dikkatlice çıkarın. Bu arada, FOV'un herhangi bir sürüklenmesi için parlak alan görünümünü izleyin.
- 0,5 mL sodyum dodecyl sülfat (SDS) çözeltisini almak için plastik bir pipet kullanarak, plastik pipetleri Petri kabındaki kültür ortamının biraz üzerinde tutun ve kültür ortamına SDS çözeltisinin 1-2 damlacığı ekleyin.
- Parlak alan görünümündeki hücreler çözüldükten sonra, ışık yolunu sola geçirin, LED ışığını kapatın, Kilitlemeyi Kaldır düğmesine tıklayın.
- Z yığını görüntülemesini çalıştırın. Görüntü yığınını kaydedin ve Reference_N olarak adlandırın (N, her FOV'un sıra numarasıdır).
- Çok Boyutlu Alım penceresindeki Birden Çok Konum (XY) düğmesine tıklayın. Ardından, bir sonraki FOV'u seçin ve motorlu sahneyi ikinci FOV'a taşımak için Git düğmesine tıklayın.
- Her FOV için 6.5.7 adımlarını yineleyin.
7. YAP N/C oranının ölçümü
- Fiji ImageJ yazılımını kullanarak YAP N/C oranını ölçmek için görüntü analizi yapın (Şekil 4).
- Fiji ImageJ'i açın. μManager tarafından alınan tüm FOV'lar için parlak alan görüntü yığınını içe aktarın.
- Resim açılan menüsünü açın ve Yığınlar | Araçlar | Dilim Bakıcısı. Ardından, her FOV için parlak alan görüntü yığınını dışa aktarın.
- FITC kanalının floresan görüntüsünü içe aktarın ve aynı FOV için parlak alan görüntüsüyle kaplayın. Bunu yapmak için floresan görüntüyü seçin ve Yer Paylaşımı'nı | Resim Ekle... (Eklenecek görüntü: parlak alan görüntüsü; X ve Y konumu, farklı kameralar tarafından elde edilen parlak alan görüntüsünün boyutuna bağlıdır; Opaklık: 60-70).
- Analiz et açılır menüsünü açın ve Ölçümleri Ayarla'yı seçin.... Alan'ı seçin; Entegre yoğunluk ve Ortalama gri değer.
- ImageJ'in ana arayüzündeki Serbest seçimler düğmesine tıklayın.
- Hücre gövdesinin ana hatlarını ve istenen çekirdeği çizin. Ardından, Analiz | Klavyedeki M düğmesini ölçün veya basın.
- Açılan Sonuçlar penceresini gözlemleyin. Alan sütununun altındaki değerlerin seçili bölgenin alanını (μm2) ve IntDen sütununun altındaki değerlerin seçili bölgenin floresan yoğunluğunu temsil ettiğini unutmayın.
- Aşağıdaki formülleri (1), (2) ve (3) kullanarak YAP YOK oranını hesaplayın:
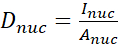 (1)
(1)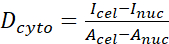 (2)
(2)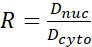 (3)
(3)
Burada Inuc ve İçel çekirdeğin ve hücre gövdesinin göreceli yoğunluğunu, Anuc ve Acel ise çekirdeğin ve hücre gövdesinin alanını temsil eder. R, YAP N/C oranıdır. - Dipol çekiş kuvveti ve peri hücre/peri-nükleer yer değiştirmenin gelecekteki hesaplaması için ana hatları saklayın. Bunu yapmak için Analiz | Araçlar | XY Koordinatlarını Kaydet...
8. Çekiş alanının ölçümü
- Fiji ImageJ eklentileri22,23 aracılığıyla çekiş kuvveti mikroskopisi uygulayın.
- Fiji ImageJ'i açın.
- FOV için boncukların görüntü yığınını içe aktarın.
- Boncukların en net dağılımını gösteren dilimi seçin ve Resim | tıklayarak ayıklayın Yığınlar | Araçlar | Dilim Bakıcısı.
- Aynı FOV için başvurunun görüntü yığınını içeri aktarın.
- 8.1.3 adımındaki dilimle aynı parlaklığa ve kontrasta sahip dilimi seçin. Ardından, referans görüntü olarak ayıklayın.
- Resim | Seç Yığınlar | Araçlar | 8.1.3 ve 8.1.5 adımlarındaki iki dilimi birleştirmek için birleştirin (ilk dilim olarak referans görüntüsünü seçin).
- Eklentiler |'ni seçin Şablon Eşleştirme | Yığındaki dilimleri hizalama veya Eklentiler | İki dilimi hizalamak için Görüntü Sabitleyici.
- Resim | Seç Yığınlar | Görüntülere Yığın. Ardından, Görüntü |'ni seçin Arama Tabloları | İlk dilimin rengini yeşile dönüştürmek için yeşil ve Görüntü | Arama Tabloları | İkinci dilimin rengini kırmızıya dönüştürmek için kırmızı.
- Resim | Seç Renk | İki görüntüyu birleştirmek için Kanalları birleştirin.
- Görüntüyü aynı FOV'un parlak alan görüntüsüyle örtün ve boncuk ötelemesini gözlemlemek için bu çakışımlı görüntüyü kullanın.
- Eklentiler |'ni seçin PIV | yinelemeli PIV (Temel).... Sorgulama penceresi boyutunu 128/256 olarak ayarlayın; 64/128; 32/64 (sorgulama penceresi başına en az dört boncuk). Korelasyon eşiğini 0,6 olarak ayarlayın.
- Tamam'a tıklayın. Hesaplama bittikten sonra, boncuk öteleme ham verileri ile metin dosyasını kullanıcı tarafından oluşturulan sıradan bir klasöre kaydedin.
- Eklentiler |'ni seçin FTTC | FTTC ve adım 8.1.9'da metin dosyasını seçin.
- Piksel boyutunu (μm), Young'ın jel modülünü (Pascal) ve deneye ve boncukların görüntüsüne göre çizim genişliğini ve yüksekliğini girin.
- 8.1.12 adımındaki metin dosyasıyla aynı dizinde çekiş kuvvetinin ham verilerini içeren metin dosyasını otomatik olarak kaydetmek için Tamam'ı tıklatın.
- Birden fazla hücre için çekiş alanını aynı ölçekle çizmek için grafik yazılımını (Malzeme Tablosu) kullanın (Şekil 1B, C ve Şekil 2B,C).
- Çekişin ham verilerini içeren metin dosyasını bir elektronik tabloya ekleyin.
- Yeni bir sayfa oluşturun, çekişin Y koordinatlarını ilk satıra girin (yüksek değerlerden düşük değerlere düzenleyin) ve X koordinatlarını ilk sütuna girin (düşükten yükseğe yerleştirin).
- Ham verilerden her koordinata çekiş değerini girin.
- Sayfayı 8.2.2 adımında *.csv dosyası olarak kaydedin.
- Açık Köken.
- Dosya | tıklayın 8.2.4 adımında *.csv dosyasını açın ve alın. Tüm hücreleri seçin ve Çiz | Kontur| Kontur - Renk Dolgusu.
- Çizim: plotvm penceresinde, Y değerlerini otomatik olarak ilk satıra ve X değerlerini ilk sütuna ayarlamak için sütunlar arasında Y'yi seçin. Ardından, başlığı adlandırın ve Tamam'a tıklayın.
- Açılan grafik penceresinde, ısı haritasına çift tıklayın.
- Renk Haritası/Konturlar penceresinde Düzeyler'i tıklatın. Ardından, ölçek düzeyini makul bir aralığa (bu analizde 0300) değiştirin ve Tamam'a tıklayın.
- Satırlar'a tıklayın, Yalnızca Ana Düzeylerde Göster'in işaretini kaldırın ve Tümlerini Gizle'yi işaretleyin. Ardından, Tamam'a tıklayın.
- Grafiğe sağ tıklayın ve Grafikleri Dışa Aktar'ı seçin.... Görüntüyü belirtilen yola kaydedin.
- Dipol hücre çekişini hesaplamak için MATLAB kullanın.
- Çekiş ham veri metin dosyasını (adım 8.1.12'den) ve hücre sınırı ilgi alanı (ROI) koordinat dosyasını (adım 7.1.9'dan itibaren) adım 8.1.12'de tanımlanan aynı klasöre kaydedin. AMFIP paketinde bulunan tüm MATLAB dosyalarını bu klasöre aktarın.
- MATLAB'ı açın. 8.1.12 adımında tanımlanan klasörü açın ve 8.3.1 adımında bu klasöre aktarılan dipol çekiş hesaplama işlevi dosyası absdipole.m açın.
- 8.3.1 adımındaki iki metin/csv dosyasını MATLAB çalışma alanına okuyun ve iki değişkene (örneğin, çekiş ve roi) bir matris atayın.
- İşlev absdiple (çekiş, roi) çalıştırın.
NOT: Çıkışın ilk sütunu nN'deki (nano-Newton) dipol çekiş kuvvetidir. Çıkışın ikinci sütunu, dipol çekiş kuvvetinin yatay eksene göre açısıdır.
Sonuçlar
Hücre yayılımı sırasında CRISPR/Cas9 tarafından tasarlanmış PC9 kanseri ve B2B normal hücrelerde farklı YAP dağılımı ve dinamikleri
Şekil 1A ve Şekil 2A'da 2, 5, 40 kPa PAA jelleri ve cam kapaklıktadır. B2B hücrelerde YAP'ın nükleer lokalizasyonu artan substrat sertliği ile artmıştır (Şekil 1A), PC9 hücreleri ise çekirdekte benzer YAP konsantrasyonu ve değişen sertlikteki substratlarda sitoplazma göstermiştir (Şekil 2A). YAP dağılımının tekli olarak temsili floresan görüntüleri, B2B ve PC9 hücrelerini 5 kPa hidrojel substrat üzerine yayar (substratlara bağlı hücrelerden sonra 0. s'den 10. h'ye kadar) sırasıyla Şekil 1B ve Şekil 2B'de gösterilmiştir. B2B hücresi, YAP N/C oranındaki azalma ile birlikte zaman içinde yayılma alanını monoton olarak artırdı (Şekil 1B), PC9 hücresi ise 10 h yayılma süreci boyunca nispeten değişmeyen hücre yayılma alanı, oryantasyon ve YAP N/C oranını korudu (Şekil 2B). Erken yayılmanın 10 saatlik süresi boyunca, temsili B2B hücresi, substrat yüzeyini tam olarak deforme etti ve tüm hücre alanı boyunca zaman gelişen hücre çekişi uyguladı (Şekil 1C ve Şekil 1D).
Buna karşılık, temsili PC9 hücresi sadece hücre gövdesinin iki ucunda yer değiştirme ve çekiş geliştirdi ve çekişi 7,5 saat sonra azaldı (Şekil 2C ve Şekil 2D). B2B ve PC9 hücrelerinin erken yayılma aşamasında daha fazla zaman atlamalı görüntü ve çekiş ölçümü Ek Şekil S2 ve Ek Şekil S3'te sağlanmaktadır. PC9 hücre dinamiklerinin diğer modları da gözlenmiştir (Şekil 6). Bu farklı yayılma özelliklerine paralel olarak B2B ve PC9 hücreleri farklı YAP dağılımı ve dinamikleri göstermiştir (Şekil 3). 5 kPa jel üzerinde, B2B hücrelerindeki YAP 0. Bununla birlikte, PC9 hücreleri, yayılma sürecinin 10 saat boyunca çekirdekte ve sitoplazmada YAP'ın daha homojen bir dağılımını göstermiştir. B2B ve PC9 hücrelerindeki YAP aktivitesini ve translokasyonını nicel olarak analiz etmek için, Şekil 4'te açıklanan algoritma kullanılarak YAP YOK oranı hesaplanmıştır.
Farklı YAP dinamiklerini daha fazla araştırmak için YAP N/C oranındaki zamansal değişiklikler, hücre/çekirdek alanı ve birden fazla tek B2B hücrenin (n = 10) ve PC9 hücrelerinin (n = 5) çekiş gücü karşılaştırıldı (Şekil 5). B2B hücrelerinin ortalama YAP N/C oranının 2,54'ten 0,22'± 0,21'± 1,79'a düştüğü bulunmuştur (n = 10; p = 0,0022**; Şekil 5A), PC9 hücrelerinin ortalama YAP N/C oranı 1,92'den 0,26'± 1,57'ye ± 0,07'ye (n = 5; p = 0,187 (anlamlı değildir (ns)); Şekil 5A). B2B hücrelerinin ortalama dipol çekişi 256,17 ± 123,69 nN'den 287,44'e ± 99,79 nN'ye (p = 0,7593 (ns); Şekil 5B). PC9 hücrelerinin ortalama dipol çekişi 141,19 ± 33,62 nN'den 168,52'ye ± 73,01 nN'ye (p = 0,7137 (ns); Şekil 5B). B2B hücrelerinin ortalama hücre yayılma alanı 613,89'dan 102,43 μm2'ye ± 942,51'e ± 226,71 μm2'ye (p = 0,0512 (ns); Şekil 5C).
PC9 hücrelerinin ortalama hücre yayılma alanı 495,78 ± 97,04 μm2'den 563,95'e ± 89,92 μm2'ye (p = 0,5804 (ns); Şekil 5C). B2B hücrelerinin ortalama çekirdek yayılma alanı 181,55 ± 36,18 μm2'den 239,38'e ± 43,12 μm2'ye (p = 0,1217 (ns); Şekil 5D) ve PC9 hücrelerinin ortalama çekirdek yayılma alanı 133,31 ± 30,05 μm2'den 151,93'e ± 22,49 μm2'ye (p = 0,5944 (ns); Şekil 5D). Bu sonuçlar, (1) B2B hücrelerinin konstrütive olarak substrat sertliğine bağımlı YAP N/C oranı gösterdiğini göstermektedir; (2) B2B hücrelerinin çekişi PC9 hücrelerinden daha yüksektir; ve (3) B2B hücrelerin aksine, PC9 hücreleri hücre alanında sınırlı bir artış ve 10 saat yayılma sürecinde YAP N/C oranında değişiklikler gösterir.
YAP dağılımı ve dinamiklerinin B2B hücrelerinin geçiş durumlarıyla korelasyonu
Hücre yayılma alanı ve çekirdek yayılma alanı fonksiyonu olarak tüm B2B (n=10) ve PC9 (n=5) hücrelerinin YAP N/C oranı ve dipol çekişi karşılaştırıldı. PC9 hücrelerinin YAP N/C oranı ve dipol çekişi, küçük hücre ve çekirdek yayılma alanı aralıkları ile açıkça ilişkili değildi (Şekil 6). Buna karşılık, B2B hücrelerinin YAP N/C oranı ve dipol çekişi iki farklı eğilimi takip ettiği ortaya çıkmıştır (Şekil 6A ve Şekil 6C), bu deneyde birlikte bulunan iki B2B hücre grubu olabileceğini düşündürmektedir. İlk grupta, YAP N/C oranı ve dipol çekişi, hücre yayılma alanının genişlemesiyle birlikte artar ve maksimalarına ~ 1000 μm2'de ulaşır (Şekil 6C ve Şekil 6D, sarı kesik çizgi ile gösterilir). İkinci grupta, HÜCRE yayılma alanının genişlemesiyle YAP N/C oranı ve dipol çekişi daha yavaş bir hızda artar ve hücre yayılma alanı artmaya devam ettiğinde neredeyse sabit değerleri korur (Şekil 6C,D, yeşil kesik çizgi ile gösterilir).
PC9 kanser hücreleri peri-nükleer bölgelerde çekiş üretir
Tek, yayılan PC9 hücreleri, kültürün 6. Hücre çekişinin neden olduğu peri-nükleer yer değiştirmeyi görselleştirmek için, hücrelerin alt tabakalardan çıkarılmasından önce (kırmızı) ve sonra (yeşil) alınan floresan boncukların görüntülerini üst üste koyduk (ayrıntılar için protokol bölümüne bakın). Yer değiştirmesi olmayan boncuklar, üst üste binen görüntülerde, yani kırmızı ve yeşil renklerin eklenmesinde sarı görünecektir. Buna karşılık, hücre çekişi nedeniyle dinlenme konumlarından yer değiştiren boncuklar ayrılmış yeşil ve kırmızı renkler gösterecektir.
Özellikle, hem PC9 (Şekil 7C,D) hem de B2B (Şekil 7E) hücrelerinde, hücre sınırında bulunanlara ek olarak sitoplazmada ve çekirdek içinde boncuk yer değiştirmesi gözlenmiştir. Peri-nükleer yer değiştirmeyi vurgulamak için, doğrusal elastikiyet teorisinden Boussinesq denklemi, hücre sınırında varsayımsal bir dipol kuvveti tarafından oluşturulan 2B teorik yer değiştirmeyi tahmin etmek için kullanılır (Şekil 7B'deki siyah kesik çizgi)24. Bu teorik eğriyi aynı eksen boyunca ölçülen gerçek substrat yer değiştirmesi ile karşılaştıran (Şekil 7D'deki beyaz kesikli çizgi), çekirdek içindeki gerçek yer değiştirmelerin peri-nükleer bölgelerde çekiş kuvvetinin varlığını gösteren teorik değerden 1,5-8 kat daha büyük olduğu bulunmuştur (Şekil 7B).

Şekil 1: B2B normal hücrenin YAP ekspresyonu/dağılımı, substrat yer değiştirme alanı ve çekiş alanındaki değişiklikler, değişen sertlikteki substratlarda ve erken yayılma sırasında. (A) 2, 5 ve 40 kPa PAA jelleri üzerinde tohumlanmış bir B2B hücresinin YAP ifadesi ve ilk hücre-substrat ataşmanından 60 saat sonra bir cam kapak sapması. (B) B2B hücresi 5 kPa PAA jel üzerine tohumlandı ve ilk hücre-substrat ataşmanı yapıldıktan sonra 10 saatin üzerinde görüntülendi. YAP ifadesi yeşil floresan yoğunluğu ile temsil edilir. Not: Çekirdeğin içindeki YAP yoğunluğu yavaş yavaş azalır, ancak zamanla sitoplazmdakinden daha yüksek kalır. Renk çubukları, (A) ve (B) öğelerindeki YAP ifade düzeylerini (yeşil = yüksek ifade; siyah = düşük ifade) gösterir. (C) Hücre konumundaki substrat deformasyonu (parlak alan görüntüsüyle çakışır) her zaman noktasında yer değiştirme alanı ile temsil edilir. Yer değiştirme yönü ve büyüklüğü sırasıyla ok yönü ve rengi ile gösterilir. Hücre yayılma alanı arttıkça B2B hücre gövdesinin uçlarında yer değiştirme daha büyük hale gelir. Renk çubuğu yer değiştirme büyüklüğünü gösterir (kıpkırmızı = yüksek büyüklük; siyah = düşük büyüklük). (D) Deplasman alanından hesaplanan çekiş alanı (parlak alan görüntüsüyle çakılır). Çekiş B2B hücrelerinin sınırında yoğunlaşmıştır. Beyaz ve sarı noktalı anahatlar sırasıyla hücre ve çekirdeğin sınırlarını çizmektedir. Renk çubuğu çekiş büyüklüğünü gösterir (kıpkırmızı = yüksek büyüklük; siyah = düşük büyüklük). Ölçek çubukları = 20 μm. Kısaltmalar: YAP = Evet ilişkili protein; PAA = poliakrilamid. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
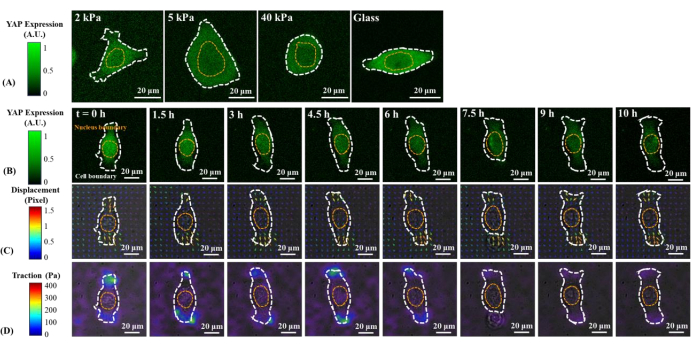
Şekil 2: Farklı sertlikteki substratlarda ve erken yayılma sırasında BIR PC9 kanser hücresinin YAP ekspresyonu/dağılımı, substrat yer değiştirme alanı ve çekiş alanındaki değişiklikler. (A) 2, 5 ve 40 kPa PAA jelleri ve cam kapak uçları üzerinde tohumlanmış bir PC9 hücresinin YAP ifadesi, ilk hücre-substrat ataşmanından 65 saat sonra. (B) PC9 hücresi 5 kPa PAA jel üzerine tohumlandı ve ilk hücre-substrat ataşmanı yapıldıktan sonra 10 saatin üzerinde görüntülendi. YAP ifadesi yeşil floresan yoğunluğu ile temsil edilir. Not: YAP yoğunluk platoları 1,5 saat sonrasına kadar. Renk çubukları, (A) ve (B) öğelerindeki YAP ifade düzeylerini (yeşil = yüksek ifade; siyah = düşük ifade) gösterir. Yer değiştirme yönü ve büyüklüğü sırasıyla ok yönü ve rengi ile gösterilir. PC9 hücrelerinin neden olduğu yer değiştirme alanı, B2B hücresinin neden olduğundan daha küçüktür. 10 h yayılma süreci boyunca, PC9 hücrelerinin alanı neredeyse sabit kalır. Renk çubuğu yer değiştirme büyüklüğünü gösterir (kıpkırmızı = yüksek büyüklük; siyah = düşük büyüklük). (D) Deplasman alanından hesaplanan çekiş alanı (parlak alan görüntüsüyle çakılır). Bu temsili PC9 hücresi tarafından üretilen çekiş yavaş yavaş 6th h'den 10th h'ye düşer. Beyaz ve sarı noktalı anahatlar sırasıyla hücre ve çekirdeğin sınırlarını çizmektedir. Renk çubuğu çekiş büyüklüğünü gösterir (kıpkırmızı = yüksek büyüklük; siyah = düşük büyüklük). Ölçek çubukları = 20 μm. Kısaltmalar: YAP = Evet ilişkili protein; PAA = poliakrilamid. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Erken yayılma aşamasında B2B ve PC9 hücrelerinde YAP dağılımı. (A) B2B hücresinin YAP yoğunluğu atanan kırmızı eksen boyunca 0. ve 10. sa olarak ölçülür. 10. saat, YAP yoğunluğu tüm hücre vücudunda daha homojen hale gelir. (C) PC9 hücresinin YAP yoğunluğu 0. ve 10. sa. (D) Atanan mavi eksen boyunca ölçülür. 10. saatte, çekirdekteki YAP yoğunluğu hala sitoplazmdakinden biraz daha yüksek görünür ve 0. Ölçek çubukları = 20 μm (A, C). Kısaltma: YAP = Evet ilişkili protein. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: YAP N/C oranının ölçülmesi. (1) Çekirdeğin ana hatlarını çizmek ve 2D öngörülen alanı Anuc'u ölçmek için Fiji ImageJ uygulayın. (2) Inuc çekirdeğinin içindeki floresan yoğunluğunu ölçün. (3) Hücre gövdesinin ana hatlarını çizin ve öngörülen alanı Acel'i ölçün. (4) İçel hücresinin içindeki floresan yoğunluğunu ölçün. (5) YAP çekirdek yoğunluğunu hesaplayın Dnuc, YAP sitoplazma yoğunluğu Dcyto ve bunların oranı R: Dnuc=Inuc/Anuc; Dcyto=(İçel-Inuc)/(Acel-Anuç); R=Dnuc/Dcyto. Renk çubuğu YAP ifadesinin düzeylerini gösterir (yeşil = yüksek ifade; siyah = düşük ifade). Ölçek çubuğu = 20 μm. Kısaltmalar: YAP = Evet ilişkili protein; N = çekirdek; C = sitoplazm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
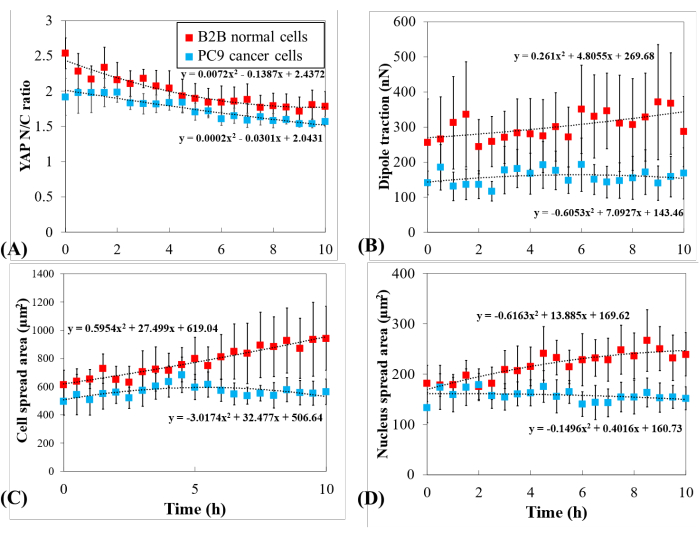
Şekil 5: Hücre yayılımı sırasında PC9 kanseri ve B2B normal hücrelerinde belirgin YAP ekspresyonu, hücre/çekirdek morfolojisi ve hücresel çekiş. (A) Tek hücreli yayılmanın ilk 10 saati sırasında YAP N/C oranı değişikliği. B2B hücrelerinin ortalama YAP Yok oranı (kırmızı sütun; n = 10) 2,54'ten 0,22'± 0,21'± 1,79'a (n = 10; p = 0.0022**) pc9 hücrelerinin ortalama YAP YOK oranı (mavi sütun; n = 5) 1.92'den 0.26'± 0.07'ye (p = 0.187 (ns)) ± 1.57'ye değişti. (B) Zamanın bir fonksiyonu olarak ortalama dipol çekişi. B2B hücrelerinin ortalama dipol çekişi 256,17 ± 123,69 nN'den 287,44'e ± 99,79 nN'ye (p = 0,7593 (ns)) değişti. ve PC9 hücrelerinin ortalama dipol çekişi 141,19 ± 33,62 nN'den 168,52'ye ± 73,01 nN'ye (p = 0,7137 (ns)) değişti. (C) Zamanın bir fonksiyonu olarak ortalama hücre alanı. B2B hücrelerinin ortalama hücre yayılma alanı 613,89'dan 102,43 μm2'ye ± 942,51'e ± 226,71 μm2'ye yükseldi (p = 0,0512 (ns)) ve PC9 hücrelerinin ortalama hücre yayılma alanı 495,78 ± 97,04 μm2'den 563,95'e ± 89,92 μm2'ye (p = 0,5804 (ns)) değişti. (D) Zamanın bir fonksiyonu olarak ortalama çekirdek alanı. B2B hücrelerinin ortalama çekirdek yayılma alanı 181,55 ± 36,18 μm2'den 239,38'e ± 43,12 μm2'ye (p = 0,1217 (ns)) ve PC9 hücrelerinin ortalama çekirdek yayılma alanı 133,31 ± 30,05 μm2'den 151,93'e ± 22,49 μm2'ye (p = 0,5944 (ns)) değişti. Kısaltmalar: YAP = Evet ilişkili protein; N = çekirdek; C = sitoplazm; ns = önemli değil. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Hücre ve çekirdeğin yayılma alanının bir fonksiyonu olarak YAP N/C oranı ve dipol çekiş kuvveti. YAP N/C oranı ve B2B hücrelerin dipol çekişi (n=10) ve PC9 hücrelerinin (n=5) substrata takıldıktan sonra 6. (A) Hücre yayılma alanının bir fonksiyonu olarak YAP N/C oranı. B2B hücrelerin YAP N/C oranları 1,16 ile 2,53 arasında değişirken, PC9 hücrelerinin YAP N/C oranları 1,27 ile 1,88 arasında değişmektedir. B2B hücrelerinin hücre yayılma alanı 391.94 μm2 ile 1986.40 μm2 arasında değişmektedir. PC9 hücrelerinin hücre yayılma alanı 284.46 μm2 ila 830.12 μm2 arasında değişmektedir. (B) Çekirdek yayılma alanının bir fonksiyonu olarak YAP N/C oranı. B2B hücrelerinin çekirdek yayılma alanı 107,09 μm2 ila 514,28 μm2 arasında değişmektedir. PC9 hücrelerinin çekirdek yayılma alanı 58,03 μm2 ila 259,65 μm2 arasında değişmektedir. Hücre yayılma alanı (C) ve çekirdek yayılma alanının (D) bir fonksiyonu olarak B2B hücrelerinin dipol çekişi. Yayılan ve göç etmeyen B2B hücreleri, alt hücre ve çekirdek alanı ile daha yüksek çekiş (47,50 nN'den 1051,48 nN'ye) gösterir. B2B hücreleri yayılırken ve göç ederken, daha geniş hücre ve çekirdek alanı aralıklarıyla daha düşük çekiş gücü (105,80 nN'den 310,28 nN'ye) gösterir. Kısaltmalar: YAP = Evet ilişkili protein; N = çekirdek; C = sitoplazm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
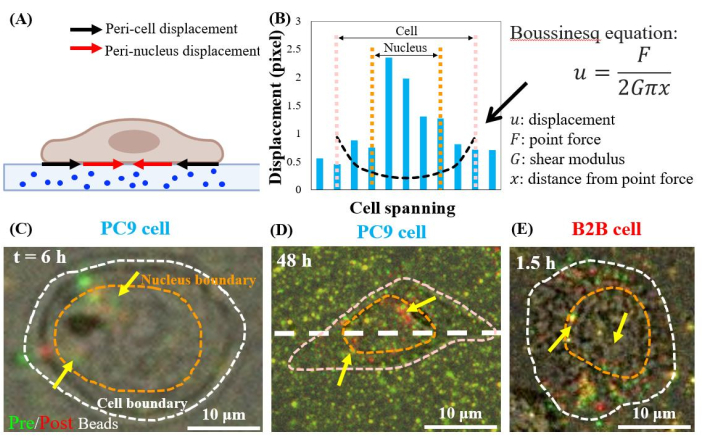
Şekil 7: Normal B2B ve kanser PC9 hücrelerinde peri-nükleer yer değiştirme. (A) Alt tabakadaki boncuk yer değiştirmesinden ölçülen peri-nükleer ve peri hücre yer değiştirme şeması. (B) PC9 hücresinin altındaki substrat yer değiştirmesi hücre ekseni boyunca ölçülür ( 7D beyaz kesik çizgi). Hücre sınırında dipol kuvveti tarafından oluşturulan teorik yer değiştirme Boussinesq denklemi (siyah kesikli eğri) tarafından gösterilir. (C) ve (D) Takıldıktan sonra 6. Sarı (kırmızı ve yeşil renklerin tam çakışması) boncuklar yer değiştirme olmadığını gösterir. Ayrılmış yeşil ve kırmızı boncuklar (sarı oklarla işaret edilen) peri-nükleer yer değiştirmeyi temsil eder. Sarı oklar, çekirdeğin çevresinde bulunan bu büzülmemiş peri-çekirdek lekelerini gösterir. (E) Hücre-substrat bağlanmasından sonra 1,5 saat içinde B2B hücresi tarafından oluşturulan peri-nükleer yer değiştirme. Ölçek çubukları = 10 μm (C–E). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil S1: YAP-mNeonGreen21-10/11'in genomik dizi haritası. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil S2: Erken yayılma sırasında B2B normal hücrelerinin YAP ekspresyonu/dağılımı, substrat yer değiştirme alanı ve çekiş alanındaki değişiklikler. (A, D, G, J, M) B2B hücresi 5 kPa PAA jel üzerine tohumlandı ve ilk hücre-substrat ataşmanı yapıldıktan sonra 10 saatin üzerinde görüntülendi. YAP ifadesi yeşil floresan yoğunluğu ile temsil edilir. Not: Çekirdeğin içindeki YAP yoğunluğu yavaş yavaş azalır, ancak zamanla sitoplazmdan daha yüksek kalır. Renk çubukları YAP ifadesinin düzeylerini gösterir (yeşil = yüksek ifade; siyah = düşük ifade) (A, D, G, J, M). (B, E, H, K, N) Hücre konumundaki substrat deformasyonu (parlak alan görüntüsüyle çakışıyor) her zaman noktasında yer değiştirme alanıyla temsil edilir. Yer değiştirme yönü ve büyüklüğü sırasıyla ok yönü ve rengi ile gösterilir. Hücre yayılma alanı arttıkça B2B hücre gövdesinin çevresinde yer değiştirme daha da artar. Renk çubukları yer değiştirme büyüklüğünü (kıpkırmızı = yüksek büyüklük; siyah = düşük büyüklük) (B, E, H, K, N) gösterir. (C, F, I, L, O) Çekiş Gücü Mikroskopisi kullanılarak deplasman alanından hesaplanan çekiş alanı (parlak alan görüntüsü ile üst üste biner). Çekiş, B2B hücrelerinin çevresinde yoğunlaşmıştır. Renk çubukları çekiş büyüklüğünü (kıpkırmızı = yüksek büyüklük; siyah = düşük büyüklük) (C, F, I, L, O) gösterir. Ölçek çubukları = 20 μm. Kısaltmalar: YAP = Evet ilişkili protein; PAA = poliakrilamid. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil S3: Erken yayılma sırasında PC9 kanser hücrelerinin YAP ekspresyonu/dağılımı, substrat yer değiştirme alanı ve çekiş alanındaki değişiklikler. (A, D, G, J) PC9 hücresi 5 kPa PAA jel üzerine tohumlandı ve ilk hücre-substrat ataşmanı yapıldıktan sonra 10 saatin üzerinde görüntülendi. YAP ifadesi yeşil floresan yoğunluğu ile temsil edilir. Not: Çekirdeğin içindeki YAP yoğunluğu yavaş yavaş azalır, ancak zamanla sitoplazmaya benzer veya biraz daha düşük kalır. Renk çubukları YAP ifadesinin düzeylerini gösterir (yeşil = yüksek ifade; siyah = düşük ifade) (A, D, G, J). (B, E, H, K) Hücre konumundaki substrat deformasyonu (parlak alan görüntüsüyle çakışıyor) her zaman noktasında yer değiştirme alanıyla temsil edilir. Yer değiştirme yönü ve büyüklüğü sırasıyla ok yönü ve rengi ile gösterilir. Hücre yayılma alanı arttıkça, YER DEĞIŞTIRME PC9 hücre gövdesinin çevresinde daha büyük hale gelir. Renk çubukları yer değiştirme büyüklüğünü (kıpkırmızı = yüksek büyüklük; siyah = düşük büyüklük) (B, E, H, K) gösterir. (C, F, I, L) Deplasman alanından hesaplanan çekiş alanı (parlak alan görüntüsüyle çakılır). Çekiş PC9 hücrelerinin çevresinde yoğunlaşmıştır. Renk çubukları çekiş büyüklüğünü (kıpkırmızı = yüksek büyüklük; siyah = düşük büyüklük) (C, F, I, L) gösterir. Ölçek çubukları = 20 μm. Kısaltmalar: YAP = Evet ilişkili protein; PAA = poliakrilamid. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Görüntüleme işlemi (adım 6.3), floresan görüntülerin geçerli nicelik sonuçları verecek kadar kaliteli olmasını sağlamak için kritik öneme sahiptir. Floresan protein veya boncukların z-stack görüntüleri, numunenin yayıldığı tüm Z konumları için odak içi görüntüleri içerecek kadar büyük bir z aralığına sahip olmalıdır. Bir diğer kritik adım, hücreleri çözdükten sonra floresan boncukların referans görüntülerini toplamaktır (adım 6.5). 6.3. adımda referans görüntülerinin aynı pozisyonlarda alınması gerektiğinden, Petri kabı, çevre odası ve mikroskop arasında göreceli bir yer değiştirme indüklenmemelidir. Çözünme adımını gerçekleştiren araştırmacılar, Petri kabının kapağını çıkarmaya ve uygulanan mekanik pertürbasyonun kabın çevre odasındaki yerini değiştirecek kadar büyük olmadığından emin olmaya dikkat etmelidir.
Denemeler sırasında oluşabilecek bazı hataları gidermek için çözümler aşağıda verilmiştir. 6.4 adımında Enter'u tıklattıktan sonra hiçbir makro etkinleştirilmezse, bunun nedeni büyük olasılıkla ekranın sol alt alanının Öğe olmayan bir pencere tarafından işgal edilmiş olmasıdır. Böyle bir durumda, makroların Öğeler'de etkinleştirilebilmesi için pencerenin sol alt alanının temizlenmesi gerekir. Bir başka yaygın hata, parlak alan görüntülerinin siyah görünmesidir. Bu sorun, floresan ve parlak alan görüntülerinin edinimi arasındaki yetersiz zaman aralığından kaynaklanır. Floresan görüntüleme süresi sayımındaki hafif gecikmeler zamanla birikebilir ve önemli gecikmelere neden olabilir ve parlak alan görüntülemesini engelleyebilir. Bir çözüm, tüm pozisyonların bir görüntüleme döngüsünün süresini, ardışık hareketlerin başlangıcı arasındaki zaman aralığından daha az (eşit olmayacak) olacak şekilde ayarlamaktır. Bu işlem zaman sayımını yeniler ve her görüntüleme döngüsünün başındaki kümülatif hatayı ortadan kaldırır.
Bu tamamen optik sorgulama teknolojisi (1) Nikon dahil ancak bunlarla sınırlı olmamak üzere çok çeşitli donanım/yazılımları, (2) jelatin, PEG, Matrigel ve kollajen I jelleri de dahil olmak üzere çeşitli doğrulanmış hidrojel sistemleri ve (3) araştırmacıların farklı ihtiyaçlarına dayalı programlanabilir özelleştirmeyi destekler. Ancak, alt düzey kontrol işlevlerinden herhangi biri ticari bir mikroskoptan kullanılamıyorsa, AMFIP kullanılarak işlevlerin özelleştirilmesi zorlaşır. Bu tekniğin bir diğer sınırlaması, numunenin hem XY hem de odak (Z) düzlemlerinde uzamsal sürüklenmesidir. Bu sınırlama görüntülerin işlenmesinden sonra aşılabilir, ancak örneklerin gerçek zamanlı sürüklenmesini düzeltmek için otomatik odaklama işlevini geliştirmek önemlidir. Bu iyileştirme, görüntüleme işleminin verimini artıracak ve deneyler sırasında sürüklenmenin neden olduğu olası hatayı azaltacaktır.
YAP gibi mekanotransdükerler, umut verici kanser tedavilerinin geliştirilmesi için yeni terapötik hedefler olarak hizmet edebilir25,26,27. Ortaya çıkan veriler, YAP'ın kanser hücrelerinin çoğalmasını ve istilasını desteklediğini göstermektedir. Sitoplazmadan çekirdeğe mekanik kaynaklı YAP translokasyonu hücre göçü, çoğalma, istila ve apoptoz ile ilgili genlerin transkripsiyonunu aktive ederek anormal hücre davranışlarına yol açar28,29,30,31. Bu çalışma, iki tipik insan akciğer kanseri ve normal hücre hattında YAP N/C oranı ve hücre mekaniğinin potansiyel korelasyonunu araştırmayı amaçlamaktadır. 10 saat hücre yayılma döneminde PC9 hücreleri çekirdek ve sitoplazmada benzer YAP konsantrasyonları gösterir (Şekil 3D ve Şekil 5A). B2B hücreleri çekirdekte sitoplazmadan daha yüksek yap konsantrasyonu gösterir (Şekil 3C ve Şekil 5A). Erken yayılma aşamasında bulunan bu ilişki, çekirdekteki YAP konsantrasyonunun normal ve kanser hücreleri arasında karşılaştırıldığı yayınlanan bulguların çoğundan farklıdır. Erken yayılma aşamasında olmasa da, yayınlanan bulguların çoğu YAP'ın normal hücrelerin çekirdeğine göre kanser hücrelerinin çekirdeğinde daha yoğun olduğunu göstermektedir27,28. Meme kanseri üzerine yapılan sadece bir çalışmada, YAP'ın sitoplazmda daha yoğun olduğunu gösteren bir istisna32 bildirilmiştir, bu da akciğer kanseri PC9 hücrelerinde yapılan mevcut gözlemlerimize uygundur. Yazarların bilgisine göre, bu çalışma bir insan akciğer kanseri hücre hattında daha düşük bir YAP N / C oranı gösteren ilk çalışmadır. Yazarlar, PC9 hücrelerinde stabil bir YAP N/C oranının nedeninin hücre/çekirdek yayılma alanındaki düşük varyasyondan ve erken yayılma aşamasında PC9 hücrelerindeki çekiş gücünden kaynaklanabileceğini vardır. PC9 ve B2B hücrelerde düşük YAP N/C oranının temel moleküler mekanizmalarının diseksiyonu devam etmektedir.
Yayılmanın ilk 10 saati boyunca, bu iki hücre çizgisi YAP YOK oranı, hücre çekişi ve yayılma alanı arasında belirgin bir ilişki gösterir (Şekil 5). B2B hücreleri için, daha yüksek bir YAP N/C oranı, diğer normal hücrelerin bildirilen verileriyle tutarlı olan daha yüksek bir hücre ve çekirdek yayılma alanı (Şekil 6A,B) ile ilişkilidir33. İlginçtir ki, bu ilişkinin gelişimsel eğilimi genellikle kaydedilen tüm B2B hücrelerinde bulunsa da, bu ilişkinin iki farklı derecesi (yüksek ve düşük) bulunur. Aynı anda yayılan ve göç eden B2B hücreler, daha yüksek YAP N/C oranına sahip daha düşük çekiş ve daha yüksek hücre ve çekirdek yayılma alanı gösterir (2,05 ± 0,32). Yayılan ve aynı yerde kalan B2B hücreleri için daha yüksek çekiş ve daha düşük yap N/C oranına sahip alt hücre ve çekirdek yayılma alanı gösterirler (1.74 ± 0.21). Bu iki derecelik ilişkiler, çatallanmış dağınık veri gruplarında gösterilmiştir (Şekil 6C,D). Literatürde bildirildiği gibi, embriyonik fibroblast NIH 3T3 hücreleri gibi sabit normal hücreler, göçmen hücrelerden daha yüksek çekiş gücüne sahiptir34. Bu makalede bildirilen veriler, yayılan ve göç etmeyen B2B hücrelerinin, B2B hücrelerinin yayılmasından ve taşınmasından daha yüksek çekiş uyguladığını, muhtemelen göç etmeyen hücrelerin substrat üzerinde stabilize olması için yüksek çekiş gerektiğini göstermektedir.
Ek olarak, bu veriler sabit normal B2B hücrelerinin daha yüksek bir peri-nükleer kuvvet ürettiğini gösterirken, diğer araştırmacılar tarafından yapılan önceki araştırmalar sabit hücrelerin çevresinde üretilen sadece daha yüksek hücre çekişi bildirdi34,35,36,37. Yazarlar, deneylerdeki içsel göç eğilimindeki farkın bu çelişkili sonuçlara neden olabileceğini düşünüyor. Yayınlanan deneylerde, tek hücrelerin yayılmasını sınırlamak ve göçü engellemek için kare şekilli mikropatterning kullanılmıştır; hücrelerin geçiş eğilimi olup olmadığı bilinmemektedir. Göçmen hücreler genellikle hücrelerin çevresinde yüksek çekiş kuvveti gösterdiğinden38, göç etme eğilimi olan hücrelerin göçleri kısıtlanmış olsa bile hala yüksek çevresel çekişi sürdürmeleri muhtemeldir. Bu çalışmada, sabit hücreler herhangi bir mikropattern tarafından kısıtlanmamaktadır, ancak hücrelerin göç etmeyen durumlarını koruma eğiliminde olduklarını gösteren göç etmezler. Diğer bir olasılık, mikropattern tarafından tanımlanan hücre şeklinin odak yapışıklıklarının ve çekiş kuvvetlerinin dağılımını etkileyebileceğidir39. Bu çalışmadaki sonuçlar herhangi bir mikropatterning olmadan oluşturulmuş ve sabit hücrelerin orijinal şekillerindeki kuvvet dağılımını temsil eder.
Yazarların bilgisine göre, bugüne kadar sadece bir yayın, çekirdek40'a yayılan akrin kapağının neden olabileceği normal hücrelerde (fare embriyonik fibroblastları) peri-nükleer kuvvetlerin bulunmasını özellikle bildirdi. YAP sitoplazma-çekirdek translokasyonu peri-nükleer kuvvet40'taki artışla ilişkilidir. İlgili literatürün kapsamlı bir araştırması, peri-nükleer kuvveti veya kanser hücrelerindeki akran kapağını bildiren herhangi bir yayın vermedi. Melanom kanser hücreleri üzerinde yapılan dolaylı bir çalışma, aktin jantının (etrafında bulunan ancak çekirdeği kapsamayan başka bir peri-nükleer aktin organizasyonu) hücre göç oranlarını düşürdüğünü göstermiştir41, dolaylı olarak bir peri-nükleer kuvvetin varlığını düşündürmektedir. Ancak, doğrudan deneysel veri bildirilmemektedir. Bu çalışmada, yazarlar hem PC9 hem de B2B hücrelerinin peri-nükleer yer değiştirme ve çekiş gösterdiğini buldular. Peri-nükleer kuvvetlerin üretim mekanizmaları ve etkileri tartışmalı olmaya devam ediyor. Normal hücrelerde, aktin kapağının çekirdek morfolojisi ve kromatin organizasyonunun düzenlenmesinde rol oynadığı bildirilmiştir42, odak yapışıklıklarından mekanik sinyallerin nükleoskeleton ve sitoskeleton (LINC) kompleksinin bağlayıcıları aracılığıyla çekirdeğe iletilmesi43 ve hücre göçlerinin düzenlenmesi44. Lamin Klima, akin kapağının oluşumu ve bozulması ile ilgilidir40,41,42,43,44. Bununla birlikte, aktiin kapağının peri-nükleer bir güç ürettiğini iddia eden rapor, actin rim40'ın potansiyel rolünü dikkate almadı. Kanser hücrelerinde, Lamin A'nın aşırı ifade etmesi bir akin jantı oluşumunu kolaylaştırır ve kanser hücresi göçini kısıtlar. Lamin B'nin aşırı ifade etmesi akredin jant oluşumunu azaltır ve göçü teşvik eder. Peri-nükleer aktivin örgütünün varlığı ve Lamin A'nın etkisiyle peri-nükleer gücü bu sürece dahil olabilir. Bununla birlikte, bu çalışmanın sonuçları, ölçülen peri-nükleer kuvvetlere veya akin kapağının davranışına dair herhangi bir kanıt göstermedi. Bu nedenle, bu çalışmada PC9 hücrelerinde peri-nükleer kuvvetlerin keşfi, akciğer kanseri hücrelerindeki peri-nükleer kuvvetleri ve yer değiştirmeleri gösteren ilk rapordur. Yazarlar şu anda CRISPR/Cas9 tarafından tasarlanmış PC9 ve B2B hücrelerinde peri-nükleer kuvvetlerin moleküler mekanizmalarını ve işlevlerini araştırmamaktadır.
Bu makalede gösterilen tüm optik mekanobiyoloji sorgulamasının ötesinde, entegre çok fonksiyonlu sistem, canlı sistemlerdeki sayısız diğer temel fizyolojik ve patobiyolojik sinyalleri optik olarak araştırmak için uygulanabilir. Örneğin, yazarların laboratuvarı son zamanlarda üç ışık duyarlı membran proteinini birlikte ifade eden birden fazla saptan transdüklenmiş insan kanseri hücre hattı kurdu: membran voltaj göstergesi QuasAr2 (heyecan: 640 nm; emisyon: 660 nm-740 nm), membran voltaj depolarizörü CheRiff (heyecan: 488 nm) ve membran voltajı hiperpolarizatör eNpHR3 (heyecan: 590 nm). Bu üç fonksiyonel protein spektrum-ortogonal lazer hatları ile çapraz konuşma içermeyen bir şekilde aktive edilebilir ve membran elektrofizyolojisinin tüm optik iki yönlü sinyal iletişimini (okuma ve kontrol) sağlar. Entegre bir opto-elektronik sistemi ve manuel bir yama kelepçesi kullanan yazarlar, tek insan kanser hücrelerinde ve çok hücreli tümör sferoidlerinde membran voltajının (Vm) tüm optik kontrolünü ve okunmasını doğruladılar. Tüm optik elektrofizyoloji sorgulaması, kanser hücrelerinde daha önce erişilemeyen biyoelektrikliğin ayrıntılı olarak araştırılması olasılığını açar ve bu da tümör biyolojisini yeni bir eksenden ilerletmeye yardımcı olabilir.
Açıklamalar
Beyan edecek çıkar çatışması yoktur.
Teşekkürler
Bu proje, UF Sağlık Kanseri Merkezi'nden (X. T. ve D. S.) Kanser Pilot Ödülü ve Gatorade Ödülü Başlangıç Paketi (X. T.) tarafından finansal olarak desteklenmektedir. Yazarlar, Dr. Jonathan Licht (UFHCC), Dr. Rolf Renne (UFHCC), Dr. Ji-Hyun Lee (Biyoistatistik, UF), Dr. Hugh Fan (MAE, UF), Dr. Warren Dixon (MAE, UF), Dr. Ghatu Subhash (MAE, UF), Dr. Mark Sheplak (MAE & ECE, UF), Dr. Malisa Sarntinoranont (MAE, UF), Dr. Scott Banks (MAE, UF), Dr. Matthew Traum (MAE, UF), Dr. David Hahn (Arizona Üniversitesi), Dr. Weihong Wang (Oracle Corporation), Dr. Youhua Tan (Hong Kong Politeknik Üniversitesi) ve Nikon Destek Ekibi (Dr. Jose Serrano-Velez, Larry Kordon ve Jon Ekman). Yazarlar, Tang's, Siemann's ve Guan'ın araştırma laboratuvarlarının tüm üyelerinden ve MAE & ECE & Fizik ve Radyasyon Onkolojisi Departmanları, UF'nin tüm personelinden gelen cömert ve etkili destek için derinden minnettardır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Sigma-aldrich | 440140 | |
| 0.05 % Trypsin | Corning | 25-051-CI | |
| 75 cm2 flask | Corning | 430641U | |
| 8 Benchtop Centrifuge | Thermo | 75007210 | |
| A1R confocal system | Nikon | HD25 | |
| Acetic acid | Sigma-aldrich | 695092 | glacial, ACS reagent, ≥99.7% |
| BEAS-2B (B2B) cells | Sigma-aldrich | 95102433 | human epithelial cells from lung tissue |
| Carboxylate-Modified Microspheres | Invitrogen | F8797 | |
| Culture medium (RPMI-1640) | Gibco | 11875093 | |
| Desktop Computer | Dell | 2018 | with Windows 10 operating system |
| Environmental chamber TIZB | Tokai Hit | TIZB | |
| Fetal bovine serum (FBS) | Gibco | 26140 | |
| Fibronectin Human Protein, Plasma | Gibco | 33016015 | |
| Fiji ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | 1.53k | |
| Glass-bottom petri dish | MatTek | P35G-1.5-14-C | |
| HEPES buffered saline | Sigma-aldrich | 51558 | |
| Hydrazine hydrate solution | Sigma-aldrich | 53847 | |
| IntelliJ IDEA | JetBrains | 2020 | Java development platform |
| Java Development Kit | Oracle | 14.0 | |
| Kimwipe | Kimtech Science | 3066-05 | |
| MATLAB | MathWorks | 2020b | |
| Monochrome Camera | FLIR | BFS-U3-70S7M-C | |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-218 | |
| N,N′-Methylenebisacrylamide solution | Sigma-aldrich | M1533 | |
| NIS-Elements software platform | Nikon | 4.50 | software platform |
| Origin | OriginLab | OriginPro 2017 (Learning Edition) | data analysis and graphing software |
| Penicillin-streptomycin | Gibco | 15140122 | |
| PC9 cells | Sigma-aldrich | 90071810 | human adenocarcinoma cells from lung tissue |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | F-553S | high-fidelity DNA polymerase |
| Scotch tape | Scotch | adhesive tape | |
| Sodium dodecyl sulfate solution | Sigma-aldrich | 05030 | |
| Super glue | Gorilla | cyanoacrylate glue | |
| Ti2-E inverted microscope | Nikon | MEA54000 | |
| TI2-S-SE-E Motorized Stage with Encoder | Nikon | MEC56120 | |
| μManager | version 2.0 gamma | open source microscopy software (https://micro-manager.org/) |
Referanslar
- Werley, C., Boccardo, S., Rigamonti, A., Hansson, E., Cohen, A. Multiplexed optical sensors in arrayed islands of cells for multimodal recordings of cellular physiology. Nature Communications. 11 (1), 3881 (2020).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Saraswathibhatla, A., Galles, E. E., Notbohm, J. Spatiotemporal force and motion in collective cell migration. Scientific Data. 7 (1), 197 (2020).
- Saraswathibhatla, A., Henkes, S., Galles, E. E., Sknepnek, R., Notbohm, J. Coordinated tractions control the size of a collectively moving pack in a cell monolayer. Extreme Mechanics Letters. 48, 101438 (2021).
- Wang, W., Kim, C. K., Ting, A. Y. Molecular tools for imaging and recording neuronal activity. Nature Chemical Biology. 15 (2), 101-110 (2019).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature Methods. 9 (7), 697-710 (2012).
- Carpenter, A. E., Kamentsky, L., Eliceiri, K. W. A call for bioimaging software usability. Nature Methods. 9 (7), 666-670 (2012).
- Skylaki, S., Hilsenbeck, O., Schroeder, T. Challenges in long-term imaging and quantification of single-cell dynamics. Nature Biotechnology. 34 (11), 1137-1144 (2016).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Luo, Q., et al. Automatic multi-functional integration program (AMFIP) towards all-optical mechanobiology interrogation. bioRxiv. , (2021).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer control of microscopes using manager. Current Protocols in Molecular Biology. 92 (1), 14-20 (2010).
- Tulpule, A., et al. Kinase-mediated RAS signaling via membraneless cytoplasmic protein granules. Cell. 184 (10), 2649-2664 (2021).
- Tang, X., Tofangchi, A., Anand, S. V., Saif, T. A. A novel cell traction force microscopy to study multi-cellular system. PLOS Computational Biology. 10 (6), 1003631 (2014).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews Materials. 5, 351-370 (2020).
- Phelps, E. A., et al. Maleimide cross-linked bioactive PEG hydrogel exhibits improved reaction kinetics and cross-linking for cell encapsulation and in situ delivery. Advanced Materials. 24 (1), 64-70 (2012).
- Bajaj, P., Tang, X., Saif, T. A., Bashir, R. Stiffness of the substrate influences the phenotype of embryonic chicken cardiac myocytes. Journal of Biomedical Materials Research. Part A. 95 (4), 1261-1269 (2010).
- Temples, M. N., Adjei, I. M., Nimocks, P. M., Djeu, J., Sharma, B. Engineered three-dimensional tumor models to study natural killer cell suppression. ACS Biomaterials Science & Engineering. 6 (7), 4179-4199 (2020).
- Feng, S., et al. Improved split fluorescent proteins for endogenous protein labeling. Nature Communications. 8, 370 (2017).
- Guan, J., Liu, H., Shi, X., Feng, S., Huang, B. Tracking multiple genomic elements using correlative CRISPR imaging and sequential DNA FISH. Biophysical Journal. 112 (6), 1077-1084 (2017).
- . Micro-Manager Available from: https://micro-manager.org/wiki/NikonTi2 (2021)
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Martiel, J. L., et al. Measurement of cell traction forces with ImageJ. Methods in Cell Biology. 125, 269-287 (2015).
- Okumurai, I. A. On the generalization of Cerruti's problem in an elastic half-space. Doboku Gakkai Ronbunshu. 1995, 1-10 (1995).
- Piccolo, S., Dupont, S., Cordenonsi, M. The biology of YAP/TAZ: hippo signaling and beyond. Physiological Reviews. 94 (4), 1287-1312 (2014).
- Hong, W. W., Guan, K. L. The YAP and TAZ transcription co-activators: Key downstream effectors of the mammalian Hippo pathway. Seminars in Cell and Developmental Biology. 23 (7), 785-793 (2012).
- Zanconato, F., Cordenonsi, M., Piccolo, S. YAP/TAZ at the roots of cancer. Cancer Cell. 29 (6), 783-803 (2016).
- Wang, Y., et al. Overexpression of yes-associated protein contributes to progression and poor prognosis of non-small-cell lung cancer. Cancer Science. 101 (5), 1279-1285 (2010).
- Li, H., et al. Inhibition of YAP suppresses CML cell proliferation and enhances efficacy of imatinib in vitro and in vivo. Journal of Experimental & Clinical Cancer Research. 35 (1), 134 (2016).
- Tang, X., et al. A mechanically-induced colon cancer cell population shows increased metastatic potential. Molecular Cancer. 13, 131 (2014).
- Panciera, T., Azzolin, L., Cordenonsi, M., Piccolo, S. Mechanobiology of YAP and TAZ in physiology and disease. Nature Reviews Molecular Cell Biology. 18 (12), 758-770 (2017).
- Yuan, M., et al. Yes-associated protein (YAP) functions as a tumor suppressor in breast. Cell Death and Differentiation. 15 (11), 1752-1759 (2008).
- Koushki, N., et al. Lamin A redistribution mediated by nuclear deformation determines dynamic localization of YAP. bioRxiv. , (2020).
- Chang, S. S., Rape, A. D., Wong, S. A., Guo, W. H., Wang, Y. L. Migration regulates cellular mechanical states. Molecular Biology of the Cell. 30 (26), 3104-3111 (2019).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Geometric guidance of integrin mediated traction stress during stem cell differentiation. Biomaterials. 69, 174-183 (2015).
- Lee, J., Abdeen, A., Tang, X., Saif, T. A., Kilian, K. A. Matrix directed adipogenesis and neurogenesis of mesenchymal stem cells derived from adipose tissue and bone marrow. Acta Biomaterialia. 42, 46-55 (2016).
- Tang, X., Bajaj, P., Bashir, R., Saif, T. A. How far cardiac cells can see each other mechanically. Soft Matter. 7 (13), 6151-6158 (2011).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Rape, A., Guo, W. H., Wang, Y. L. The regulation of traction force in relation to cell shape and focal adhesions. Biomaterials. 32 (8), 2043-2051 (2011).
- Shiu, J. Y., Aires, L., Lin, Z., Vogel, V. Nanopillar force measurements reveal actin-cap-mediated YAP mechanotransduction. Nature Cell Biology. 20 (3), 262-271 (2018).
- Fracchia, A., Asraf, T., Salmon-Divon, M., Gerlitz, G. Increased lamin B1 levels promote cell migration by altering perinuclear actin organization. Cells. 9 (10), 2161 (2020).
- Ramdas, N. M., Shivashankar, G. V. Cytoskeletal control of nuclear morphology and chromatin o1rganization. Journal of Molecular Biology. 427 (3), 695-706 (2015).
- Khatau, S. B., et al. A perinuclear actin cap regulates nuclear shape. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19017-19022 (2009).
- Kim, D. H., Cho, S., Wirtz, D. Tight coupling between nucleus and cell migration through the perinuclear actin cap. Journal of Cell Science. 127 (11), 2528-2541 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır