Method Article
Interrogation mécanobiologique entièrement optique de protéines associées au Oui dans le cancer humain et les cellules normales à l’aide d’un système multifonctionnel
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cet article présente un protocole détaillé par étapes sur la façon d’utiliser un système intégré multifonctionnel et programmable par l’utilisateur qui permet l’imagerie multicanal automatique et l’analyse mécanobiologique pour élucider la mécanosensibilité de la protéine associée au Oui (YAP).
Résumé
L’imagerie et l’analyse multifonctionnelles à long terme des cellules vivantes nécessitent une coordination fonctionnelle rationalisée de diverses plates-formes matérielles et logicielles. Cependant, le contrôle manuel de divers équipements produits par différents fabricants est laborieux et prend beaucoup de temps, ce qui peut réduire la précision, la reproductibilité et la qualité des données acquises. Par conséquent, un système tout-en-un et programmable par l’utilisateur qui permet l’acquisition d’images automatique, multifonctionnelle et à long terme et qui est compatible avec la plupart des plates-formes de microscopie fluorescente peut bénéficier à la communauté scientifique. Cet article présente les protocoles d’exploitation complets de l’utilisation d’un nouveau système logiciel intégré qui se compose de (1) un logiciel construit à la maison, intitulé « Programme d’intégration multifonctionnelle automatique (AMFIP) », qui permet l’acquisition automatique d’imagerie multicanal, et (2) une suite de packages d’analyse d’imagerie quantitative et de calcul de traction cellulaire.
Ce système intégré est appliqué pour révéler la relation auparavant inconnue entre la distribution spatio-temporelle de la protéine associée au Oui mécano-sensible (YAP) et la mécanique cellulaire, y compris l’étalement et la traction cellulaires, dans les cellules normales humaines (B2B) et les cellules cancéreuses du poumon (PC9) modifiées par CRISPR / Cas9. Tirant parti de la capacité de contrôle et de lecture multicanal de ce système, le résultat montre : (1) les cellules normales B2B et les cellules cancéreuses PC9 montrent une relation distincte entre l’expression YAP, la traction et la dynamique cellulaire pendant les processus de propagation et de migration cellulaires ; et (2) les cellules cancéreuses PC9 appliquent des forces périnucléaires notables sur les substrats. En résumé, cet article présente un protocole détaillé par étapes sur la façon d’utiliser un système intégré programmable par l’utilisateur qui permet l’imagerie et l’analyse multifonctionnelles automatiques pour élucider la mécanose YAP. Ces outils ouvrent la possibilité d’explorations détaillées de la dynamique de signalisation multiforme dans le contexte de la physiologie et de la pathologie cellulaires.
Introduction
L’objectif global de cette méthode est de permettre l’imagerie multifonctionnelle entièrement optique et l’analyse des cellules vivantes. Un programme d’imagerie tout-en-un qui permet la coordination automatique de dispositifs optoélectroniques multifonctionnels réduira les opérations manuelles à forte intensité de main-d’œuvre et sujettes aux erreurs et est essentiel pour que les chercheurs puissent effectuer une imagerie à long terme sur cellules vivantes1,2,3,4. Cependant, la plupart des programmes publics existants dans le milieu de la recherche biomédicale ne s’appliquent qu’à des dispositifs optoélectroniques limités ou nécessitent du matériel supplémentaire pour la coordination de différents équipements5,6,7,8,9. Récemment, un programme open source et logiciel a été développé, intitulé « Automatic Multi-functional Integration Program (AMFIP) », permettant l’imagerie multicanal et time-lapse. Basé sur le langage Java et l’interface de programmation d’application (API) de μManager11,12, AMFIP a été développé en tant que plugin dans μManager qui exécute des scripts Java personnalisés pour effectuer des communications logicielles de plusieurs plates-formes matérielles et logicielles optoélectroniques, y compris, mais sans s’y limiter, celles de Nikon. La mise en place de l’AMFIP ouvre la possibilité d’une interrogation programmable et multifonctionnelle des comportements cellulaires. Un système expérimental et informatique intégré est développé dans cet article et combine AMFIP avec l’analyse d’imagerie numérique et la microscopie à force de traction cellulaire. Le système permet d’élucider la mécanobiologie YAP distincte dans les lignées cellulaires B2B humaines normales (Figure 1) et PC9 du cancer du poumon (Figure 2) conçues par CRISPR/Cas9. Le système fournit à la communauté scientifique une solution complète qui évite la demande d’achat de dispositifs de contrôle supplémentaires qui peuvent ne pas être disponibles et / ou compatibles avec tous les systèmes d’imagerie.
Les protocoles présentés dans cet article présentent comment (1) appliquer l’AMFIP pour effectuer une imagerie automatique à long terme pour les lignées cellulaires crispr / Cas9 qui expriment le YAP marqué mNEonGreen2; et (2) combiner Fiji ImageJ, MATLAB et Origin pour l’analyse quantitative du rapport nucléaire/cytoplasme (N/C) YAP en fonction de leur intensité fluorescente (Figure 3 et Figure 4), du champ de déplacement cellulaire (Figure 1C et Figure 2C) et du champ de traction cellulaire (Figure 1D et Figure 2D) ). Les résultats suggèrent que (1) au cours des 10 premières heures d’étalement cellulaire sur les substrats qui ont une rigidité mécanique physiologiquement pertinente13,14,15,16,17,18, le rapport N/C YAP des cellules B2B simples montre une variation et une fluctuation plus notables en fonction du temps par rapport à celles des cellules PC9 individuelles (Figure 5 et Figure 6 ); et (2) les cellules cancéreuses PC9 génèrent une traction notable dans leurs régions périnucléaires (figure 7). Le système intégré et les méthodologies décrites dans ce protocole transcendent les types spécifiques de cellules et de molécules optogénétiques. Les chercheurs peuvent appliquer les protocoles pour personnaliser leurs expériences spécifiques d’interrogation de cellules vivantes et élucider la dynamique de signalisation multiforme dans le contexte de la physiologie et de la pathologie cellulaires.
Protocole
1. Génération d’une lignée cellulaire stable de cancer du poumon humain (PC9) et d’une lignée cellulaire épithéliale bronchique humaine (Beas2B) éditée par CRISPR/Cas9 qui exprime de manière endogène la protéine YAP marquée mNeonGreen21-10/11
- Effectuer une réaction en chaîne par polymérase (PCR) pour amplifier la séquence d’ADN codant le 11e brin de la protéine de fluorescence, mNeonGreen2, en utilisant l’ADN polymérase haute fidélité (voir le Tableau des matériaux).
- Knock-in la séquence d’ADN amplifiée dans le locus génomique YAP des lignées cellulaires PC9 et B2B à l’aide du système d’édition de gènes CRISPR-Cas9.
REMARQUE: Cette séquence d’ADN complète les brins 1 à 10 de mNeonGreen2 pour émettre de la fluorescence. La carte de séquence génomique de YAP-mNeonGreen21-10/11 est illustrée à la figure supplémentaire S1. La carte contient les séquences génomiques, donneuses et mNeonGreen2 étiquetées. - Vérifiez l’expression de mNeonGreen2 conçue par CRISPR/Cas9 à l’aide d’un microscope à épifluorescence (voir la table des matériaux). Parce que le mNeonGreen2 est marqué sur YAP chaque fois que les cellules expriment YAP dans le contexte de son réseau de régulation des gènes natifs, vérifiez la présence de l’intensité de fluorescence dans les deux cellules modifiées CRISPR / Cas9 et comparez-la à celle des cellules parentales (contrôle).
REMARQUE: Pour suivre ce protocole, utilisez (1) un laser de 488 nm (47,5 mW / mm2) pour l’excitation, (2) un objectif 40x (ouverture numérique (NA) = 0,95) et un filtre d’émission passe-bande (ET525/50 nm) pour la mesure de fluorescence, et (3) un logiciel ImageJ pour mesurer, quantifier et comparer les intensités de fluorescence. - Confirmer l’intégration correcte de mNeonGreen211 en extrayant l’ADN génomique des lignées cellulaires éditées par CRISPR/Cas9 ; effectuer une PCR à l’aide d’amorces flanquant l’insert génomique et le séquençage pour confirmer l’insertion aux loci19,20 génomiques corrects.
- Abaissez le mNeonGreen211 à l’aide du système d’édition de gènes CRISPR/Cas9 et vérifiez la réduction de l’intensité de fluorescence dans les cellules à l’aide des mêmes systèmes de microscope et des mêmes paramètres d’imagerie décrits à l’étape 1.3.
REMARQUE: Cette étape confirme l’intégration correcte de mNeonGreen211 par la comparaison des intensités de fluorescence. Les cellules conçues par CRISPR/Cas9 sans knock-down et cellules parentales sont utilisées comme contrôle. - Recueillir les cellules avec la protéine d’intérêt marquée par tri cellulaire activé par fluorescence (FACS).
- Pour préparer les cellules au tri FACS, essayez-les et remettez-les en suspension dans une solution saline tamponnée au phosphate (PBS).
- Collectez des cellules avec la fluorescence mNeonGreen2 au-dessus du niveau de fond des lignées cellulaires parentales dans deux cycles enrichissants de tri FACS.
REMARQUE: La chronologie pour générer les lignées cellulaires éditées par CRISPR / Cas9 décrites ici est de l’ordre de 1 à 2 mois. Toutes les lignées cellulaires sont mises à la disposition du public sur demande afin que d’autres laboratoires de recherche puissent reproduire les résultats.
2. Maintenance des cellules PC9 et B2B
- Maintenir les deux lignées cellulaires dans des incubateurs de culture tissulaire humidifiés avec 5% de CO2 à 37 °C.
- Culture 106 cellules PC9 et Beas2B marquées de manière endogène dans des flacons de 75 cm2 avec 12 mL de milieu RPMI-1640 complétés par 10 % de sérum bovin fœtal et 100 μg/mL de pénicilline-streptomycine. Sous-cultiver les deux lignées cellulaires lorsque la confluence cellulaire atteint ~ 80%.
- Testez les deux lignées cellulaires pour les mycoplasmes tous les 3 mois à l’aide d’un kit de détection de mycoplasmes, en suivant strictement tous les protocoles recommandés par le fabricant.
- Conservez les lignées cellulaires dans un congélateur à -80 °C.
- Utilisez les lignées cellulaires <20 passages du dégel pour toutes les expériences.
3. Configuration de l’environnement matériel et logiciel
- Configuration de l’environnement matériel de l’expérience
- Connectez le contrôleur confocal et le microscope inversé à l’ordinateur (voir le tableau des matériaux).
- Installez la plate-forme logicielle (Table des matériaux).
- Allumez le contrôleur confocal et le microscope inversé. Ensuite, lancez Elements.
- Ouvrez les panneaux de commande du microscope confocal, laser et inversé dans Elements. Ensuite, vérifiez si les trois panneaux fonctionnent correctement en testant le mouvement de l’étage motorisé, la commutation des objectifs du microscope et le balayage spatial des lignes laser.
- Configuration de l’environnement logiciel d’AMFIP
- Installez IntelliJ, Java Development Kit 14.0, μManager version 2.0 gamma et Fiji ImageJ sur l’ordinateur.
- Ouvrez le projet AMFIP téléchargé depuis GitHub (lien : https://github.com/njheadshotz/AMFIP) dans IntelliJ.
- Cliquez sur Paramètres | | du compilateur Processeurs d’annotation et cochez Activer le traitement des annotations.
- Cliquez sur Structure du projet | Artefacts et créez un fichier JAR. Définissez le répertoire de sortie sur mmplugins sous le répertoire μManager .
- Cliquez sur Structure du projet | Bibliothèques et ajoutez mmplugins et plugins sous le répertoire μManager .
- Cliquez sur Ajouter une configuration dans le menu déroulant Exécuter et créez une application.
- Entrez ij. ImageJ dans la classe Main.
- Entrez -Xmx3000m -Dforce.annotation.index=true dans l’option VM.
- Définissez le répertoire μManager sur le répertoire Travail.
- Cliquez sur Exécuter pour activer μManager avec le plugin AMFIP.
- Connectez μManager au microscope inversé.
- Ajoutez le pilote adaptatif du microscope inversé21 au répertoire μManager .
- Ouvrez μManager. Cliquez sur Appareils | Assistant Configuration matérielle et créez une nouvelle configuration.
- Ajoutez le pilote Ti2 sous Périphériques disponibles.
- Sélectionnez tous les périphériques et enregistrez le nouveau fichier de configuration.
- Redémarrez μManager et sélectionnez le fichier de configuration à l’étape 3.2.4 dans Configuration de démarrage de Micro-Manager.
4. Préparation du gel
- Traiter le couvercle en verre avec du 3-aminopropyltryméthoxysilane pendant 7 min à température ambiante (24 °C).
- Utilisez de l’eau désionisée (DI) pour rincer le couvercle en verre et sécher le couvercle pendant 20 min à 160 °C.
- Traiter le couvercle en verre avec 0,5% de glutaraldéhyde pendant 30 min et rincer à l’eau DI.
- Mélanger la solution d’acrylamide, la solution de N,N′-méthylènebisacrylamide (bis) et les billes fluorescentes en suspension dans une solution saline tamponnée HEPES de 10 mM. Utiliser une solution de persulfate d’ammonium à 10 % (p/v) et de N,N,N′,N′-tétraméthyléthylènediamine (TEMED) comme initiateurs de polymérisation. Modifier le pourcentage de chaque composant pour obtenir la rigidité mécanique souhaitée des hydrogels de polyacrylamide (PAA) en suivant les protocoles établis décrits précédemment13,14.
NOTE: Dans ce protocole, 2 kPa gel: acrylamide = 12,5% et bis-acrylamide = 6,5%; Gel de 5 kPa : acrylamide = 12,5 % et bis-acrylamide = 21,5 % ; et 40 kPa de gel : acrylamide = 12,5 % et bis-acrylamide = 31,5 %. Tous les % répertoriés sont des pourcentages de volume. - Après 35 min, pelez le couvercle en verre de l’hydrogel PAA solidifié et lavez l’hydrogel avec une solution saline tamponnée HEPES de 50 mM deux fois (5 min à chaque fois).
- Traiter la surface de l’hydrogel avec une solution hydratée d’hydrazine pendant 6 h.
- Rincer l’hydrogel avec de l’acide acétique pendant 30 min. Retirer l’acide acétique et rincer avec du PBS pendant 30 min.
- Oxyder la solution de fibronectine (50 μg/mL dans le PBS) avec du periodate de sodium pendant 30 min.
- Recouvrir la surface de l’hydrogel avec la solution de fibronectine oxydée et attendre 35 min.
- Ajouter le PBS pour immerger l’hydrogel et conserver à 4 °C. Couvrez toutes les boîtes de Petri qui contiennent les hydrogels avec du papier d’aluminium pour éviter toute exposition à la lumière aux hydrogels.
5. Culture cellulaire
REMARQUE: Effectuer une culture cellulaire en utilisant une technique aseptique.
- Collez les couvercles de verre avec les hydrogels PAA à la boîte de Petri à fond de verre de 35 mm pour éviter la dérive physique des gels pendant les processus d’ensemencement et d’imagerie cellulaires.
- À l’aide d’une pince à épiler propre stérilisée, soulevez le couvercle (avec l’hydrogel PAA sur le dessus) de la boîte de Pétri contenant les gels préparés.
- Utilisez une lingette sèche pour nettoyer les gouttelettes d’eau sur la surface inférieure du couvercle en verre.
- Utilisez la pince à épiler stérilisée pour maintenir le couvercle en verre.
- Placez de petites gouttelettes (1-5 μL) de colle cyanoacrylate aux deux coins diagonals de la surface inférieure.
- Utilisez des lingettes stérilisées pour éliminer l’excès de colle.
- Utilisez la pince à épiler stérilisée pour remplacer le couvercle dans la boîte de Petri à fond de verre. Appuyez légèrement sur les coins du couvercle pour vous assurer que les gouttelettes de colle entrent en contact complet avec la surface de la boîte de Pétri.
- Replacez le couvercle sur la boîte de Petri pour minimiser l’évaporation du PBS dans les hydrogels PAA. Attendez 3 min pour permettre à la colle de se solidifier et de sécher dans la boîte de Pétri.
- Remplissez la boîte de Petri avec 4 mL de PBS.
- Répétez les étapes ci-dessus 5.1.1-5.1.8 pour les échantillons d’hydrogel PAA restants dans les boîtes de Petri utilisées pour l’imagerie.
- Utilisez de l’éthanol à 75 % pour stériliser la surface extérieure de toutes les boîtes de Pétri et transférez-les dans l’armoire de biosécurité de culture tissulaire. Allumez la lumière ultraviolette pendant 5 min et stérilisez les échantillons.
- Ensemencez les cellules sur la surface supérieure du gel.
- Éteignez la lumière ultraviolette. Retirez la fiole (contenant des cellules B2B/PC9) de l’incubateur à 37 °C dans l’armoire de biosécurité. Utilisez une pipette reliée à une pompe à vide pour aspirer tout le milieu de culture et ajoutez 5 mL de PBS pour laver la fiole.
- Ajouter 2 mL de trypsine à 0,05 % pour détacher les cellules du fond de la fiole.
- Placez la fiole dans l’incubateur. Attendez 5 min.
- Transférer la fiole dans l’armoire de biosécurité. Ajouter 8 mL de milieu de culture frais à la fiole et pipeter plusieurs fois de haut en bas pour suspendre les cellules de manière homogène.
- Transférer tous les 10 mL de la suspension cellulaire dans un tube de 15 mL et centrifuger à 300 × g pendant 5 min.
- Vérifiez la pastille de cellule au fond du tube. Inclinez lentement le tube horizontalement et utilisez la pipette d’aspiration pour retirer tout le milieu de culture du tube sans toucher la pastille de cellule. Ensuite, ajoutez 8 mL de milieu de culture frais et pipetez plusieurs fois jusqu’à ce que toutes les cellules soient mélangées de manière homogène avec le milieu.
- Déposez 100 μL de la suspension cellulaire (150 cellules/μL) sur la surface du gel et attendez 5 min. Ensuite, ajoutez lentement 4 mL de milieu de culture frais aux boîtes de Pétri; éviter d’ajouter le milieu frais directement sur le gel.
- Placez la boîte de Petri dans l’incubateur à 37 °C. Attendez de laisser les cellules se fixer à la surface du gel (B2B: 0,5-1 h; PC9: 4-5 h).
6. Imagerie cellulaire
REMARQUE: AMFIP permet l’imagerie automatique, multicanal et à long terme en se coordonnant avec différents systèmes matériels et logiciels: (1) AMFIP manipule μManager pour déplacer automatiquement l’étage motorisé du microscope Ti2-E vers plusieurs champs de vision (FOV) et acquérir des images en champ lumineux grâce à une caméra monochrome (Table des matériaux); et (2) AMFIP active plusieurs fichiers de macro à l’intérieur d’Elements avec un script Java personnalisé pour effectuer des opérations automatiques pour l’imagerie confocale z-stack et la commutation de différents canaux laser (405 nm et 488 nm).
- Définissez l’environnement pour l’imagerie à long terme.
- Placez la chambre d’environnement sur l’étage motorisé du microscope inversé. Réglez le débit de CO2 à 160 mL/min et réglez la température de la chambre (en haut : 44 °C ; bain : 42 °C ; en scène : 40 °C). Ensuite, ajoutez 40 mL d’eau purifiée dans le bain de la chambre.
- Sortez la boîte de Petri à fond de verre avec les cellules de l’incubateur et placez-la dans la chambre de l’environnement.
- Allumez le contrôleur confocal et le microscope inversé. Basculez le trajet de la lumière vers la droite et observez les cellules qui se fixent à l’aide de μManager. Si suffisamment de cellules se sont attachées au gel, transférez la boîte de Petri dans l’incubateur. Si pas assez de cellules se sont attachées au gel, continuez l’incubation cellulaire pendant encore 30 minutes pour les cellules B2B et 60 minutes pour les cellules PC9.
- Coupez deux petits morceaux de ruban adhésif et collez-les sur la chambre autour du trou circulaire. Ensuite, appliquez un peu de colle adhésive sur le ruban adhésif (uniquement sur la zone que la boîte de Pétri couvrira).
- Sortez la boîte de Petri de l’incubateur. Ensuite, placez lentement la boîte de Petri dans la chambre et laissez le fond du plat entrer en contact avec la colle.
- Appuyez sur le couvercle de la boîte de Petri pendant 1 min pour permettre à la colle d’entrer en contact complet avec la boîte de Petri et de se solidifier. Ensuite, poussez doucement la boîte de Petri horizontalement pour confirmer que la boîte de Petri est inamovible dans la chambre.
- Fermez le couvercle de la chambre.
- Définissez les paramètres d’acquisition d’image pour l’imagerie en champ lumineux.
- Ouvrez IntelliJ et définissez un paramètre T1 (par exemple, 120 s) à la ligne 93 du fichier Elements_script.java. Assurez-vous que cette valeur est supérieure à la durée d’exécution de la macro dans les éléments utilisés pour l’imagerie confocale d’un champ de vision (FOV). Cliquez sur le bouton Exécuter pour démarrer le projet AMFIP IntelliJ.
- Cliquez sur les boutons Live et Multi-D Acq. sur l’interface principale de μManager. Ensuite, basculez le chemin lumineux du microscope inversé vers la droite pour l’imagerie en champ lumineux, passez à l’objectif 10x et ouvrez la lumière à diode électroluminescente (LED) (la source lumineuse pour l’imagerie en champ lumineux; intensité: 5%).
- Cliquez sur le chemin de la lumière, l’objectif du microscope et le bouton de la lampe LED dans le panneau Elements Ti2 ou appuyez manuellement sur les boutons correspondants du microscope.
- Réglez le joystick XY et le bouton du plan Z pour trouver la position correcte et le plan de mise au point du gel sur la boîte de Petri. Utilisez un objectif 10x pour trouver les FOV appropriés de plusieurs cellules uniques attachées au gel.
- Cochez la case Positions multiples (XY) dans la fenêtre Acquisition multidimensionnelle . Cliquez sur le bouton Modifier la liste des positions... et observez la fenêtre Liste des positions de la scène qui apparaît. Ensuite, changez l’objectif à 40x, augmentez l’intensité de la lumière LED à 15%, réajustez la scène motorisée XY pour localiser les FOV et enregistrez les coordonnées en cliquant sur le bouton Marquer dans la fenêtre Liste des positions de la scène .
- Enregistrez 67 FOV souhaités. Cliquez sur le bouton Enregistrer sous... dans la fenêtre Liste des positions de la scène pour enregistrer les coordonnées. Entrez T1 (le paramètre, par exemple, 120 s, défini à l’étape 6.2.1) dans l’intervalle de temps de l’acquisition de l’imagerie à T1 dans la section Points temporels de la fenêtre Acquisition multidimensionnelle .
- Définissez l’acquisition d’image pour les images 2D-YAP et perles.
- Ouvrez Éléments, modifiez le trajet de la lumière vers la droite pour l’imagerie confocale et éteignez la lumière LED. Ensuite, cliquez sur le bouton Retirer le verrouillage et allumez le canal laser FITC (pour l’imagerie YAP) en cochant la case FITC .
- Réglez la vitesse de numérisation à 1 image par 2 s en cliquant sur le bouton 1/2 et faites tourner le bouton du plan Z pour trouver rapidement la position Z des cellules attachées. Enregistrez les limites inférieure et supérieure de la pile Z.
- Cliquez sur Macro dans le ruban supérieur, sélectionnez Macro Editor dans le menu déroulant Macro et entrez les valeurs de l’étape 6.3.2 dans un fichier macro.
- Activez le canal laser 4′,6-diamidino-2-phénylindole (DAPI) (pour l’imagerie des billes) en cochant la case DAPI pour trouver et enregistrer la position Z focalisée des perles. Accédez à l’éditeur de macros et entrez les valeurs enregistrées dans le fichier de macro.
- Définissez la tâche de déplacement de la scène motorisée à l’aide de l’AMFIP.
- Allez dans μManager et cliquez sur Plugins | Automatisation pour ouvrir l’interface utilisateur graphique (GUI) d’AMFIP. Cliquez sur les boutons Ajouter un point ou Supprimer un point pour obtenir le nombre exact de FOV sélectionnés. Entrez les coordonnées enregistrées des FOV dans le panneau Coordonnées.
- Définissez la durée totale de l’expérience dans le champ de texte Durée totale de l’expérience .
- Cliquez sur le bouton Configuration du temps supplémentaire et définissez l’intervalle de temps T2 (par exemple, 30 min) de déplacement de la scène motorisée vers chaque champ de vision.
- Maximisez la taille de la fenêtre des éléments et faites glisser l’interface graphique d’AMFIP vers le côté droit de l’écran pour éviter que l’interface graphique ne perturbe les opérations automatiques du curseur.
- Cliquez sur le bouton Entrée . Une fois la première macro terminée, cliquez sur le bouton Acquérir! dans la fenêtre Acquisition multidimensionnelle .
- Dissoudre les cellules après l’acquisition de l’image.
- Après avoir terminé l’imagerie à long terme, arrêtez la tâche AMFIP en cliquant sur le bouton Pause dans la fenêtre du plugin d’automatisation et sur le bouton Arrêter dans la fenêtre Acquisition multidimensionnelle .
- Ouvrez Elements et définissez l’imagerie Z-stack en cliquant sur les boutons Haut et Bas dans la fenêtre Acquisition ND (définissez la plage Z pour qu’elle soit plus grande que la plage Z des perles). Basculez le chemin de la lumière vers la droite et ouvrez la lumière LED (intensité: 15%).
- Retirez lentement et soigneusement les couvercles de la chambre et de la boîte de Pétri. Pendant ce temps, surveillez la vue en champ lumineux pour toute dérive du champ de vision.
- À l’aide d’une pipette en plastique pour absorber 0,5 mL de solution de dodécylsulfate de sodium (SDS), maintenez soigneusement la pipette en plastique un peu au-dessus du milieu de culture dans la boîte de Pétri et ajoutez 1 à 2 gouttelettes de la solution SDS dans le milieu de culture.
- Une fois les cellules de la vue en champ lumineux dissoutes, basculez le chemin de la lumière vers la gauche, fermez la lumière LED, cliquez sur le bouton Supprimer le verrouillage .
- Exécutez l’imagerie Z-stack. Enregistrez la pile d’images et nommez-la comme Reference_N (N est le numéro de séquence de chaque champ de vision).
- Cliquez sur le bouton Positions multiples (XY) dans la fenêtre Acquisition multidimensionnelle . Ensuite, sélectionnez le prochain champ de vision et cliquez sur le bouton Aller à pour déplacer la scène motorisée vers le deuxième champ de vision.
- Répétez l’étape 6.5.7 pour chaque champ de vision.
7. Mesure du rapport N/C YAP
- Effectuer une analyse d’image pour mesurer le rapport N/C YAP à l’aide du logiciel Fiji ImageJ (Figure 4).
- Ouvrez Fidji ImageJ. Importez la pile d’images en champ lumineux pour tous les FOV acquis par μManager.
- Ouvrez le menu déroulant Image et sélectionnez Piles | Outils | Gardien de tranches. Ensuite, exportez la pile d’images en champ lumineux pour chaque champ de vision.
- Importez l’image de fluorescence du canal FITC et superposez-la avec l’image en champ lumineux pour le même champ de vision. Pour ce faire, choisissez l’image fluorescente et sélectionnez Superposition | Ajouter une image... (Image à ajouter: l’image en champ lumineux; L’emplacement X et Y dépend de la taille de l’image en champ lumineux acquise par différentes caméras; Opacité: 60-70).
- Ouvrez le menu déroulant Analyser et sélectionnez Définir les mesures.... Sélectionner une zone ; Densité intégrée et valeur de gris moyen.
- Cliquez sur le bouton Sélections à main levée sur l’interface principale d’ImageJ.
- Dessinez le contour du corps cellulaire et du noyau désiré. Ensuite, cliquez sur Analyser | Mesurez ou appuyez sur la touche M du clavier.
- Observez la fenêtre Résultats qui apparaît. Notez que les valeurs sous la colonne Surface représentent la zone de la région sélectionnée (μm2) et les valeurs sous la colonne IntDen représentent l’intensité de fluorescence de la région sélectionnée.
- Calculez le rapport N/C YAP à l’aide des formules suivantes (1), (2) et (3) :
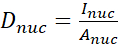 (1)
(1)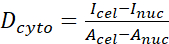 (2)
(2)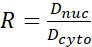 (3)
(3)
Où Inuc et Icel représentent l’intensité relative du noyau et du corps cellulaire, et Anuc et Acel représentent la zone du noyau et du corps cellulaire. R est le rapport N/C YAP. - Conservez les contours pour le calcul futur de la force de traction dipolaire et du déplacement péricellulaire/périnucléaire. Pour ce faire, cliquez sur Analyser | Outils | Enregistrer les coordonnées XY...
8. Mesure du champ de traction
- Appliquez la microscopie à force de traction via les plugins Fiji ImageJ22,23.
- Ouvrez Fidji ImageJ.
- Importez la pile d’images de perles pour un champ de vision.
- Sélectionnez la tranche qui montre la distribution la plus claire des perles et extrayez-la en cliquant sur Images | Piles | Outils | Gardien de tranches.
- Importez la pile d’images de la référence pour le même champ de vision.
- Choisissez la tranche avec la même luminosité et le même contraste que la tranche à l’étape 8.1.3. Ensuite, extrayez-le en tant qu’image de référence.
- Sélectionner des images | Piles | Outils | Concaténez pour combiner les deux tranches des étapes 8.1.3 et 8.1.5 (sélectionnez l’image de référence comme première tranche).
- Sélectionnez plugins | | de correspondance de modèles Aligner les tranches dans la pile ou les plug-ins | Stabilisateur d’image pour aligner les deux tranches.
- Sélectionnez image | Piles | Empiler aux images. Ensuite, sélectionnez | d’image Tables de choix | Vert pour convertir la couleur de la première tranche en vert et sélectionnez Image | Tables de choix | Rouge pour convertir la couleur de la deuxième tranche en rouge.
- Sélectionnez | d’image | de couleur Fusionner les couches pour fusionner les deux images.
- Chevauchez l’image avec l’image en champ lumineux du même champ de vision et utilisez cette image superposée pour observer le déplacement des billes.
- Sélectionnez plugins | | PIV PIV itératif (Basic).... Définissez la taille de la fenêtre d’interrogation sur 128/256 ; 64/128; 32/64 (au moins quatre perles par fenêtre d’interrogatoire). Définissez le seuil de corrélation sur 0,6.
- Cliquez sur OK. Une fois le calcul terminé, enregistrez le fichier texte avec les données brutes du déplacement des perles dans un dossier ordinaire créé par l’utilisateur.
- Sélectionnez plugins | | FTTC FTTC et choisissez le fichier texte à l’étape 8.1.9.
- Entrez la taille des pixels (μm), le module de Young du gel (Pascal), ainsi que la largeur et la hauteur du tracé en fonction de l’expérience et de l’image des perles.
- Cliquez sur OK pour enregistrer automatiquement le fichier texte contenant les données brutes de la force de traction dans le même répertoire que le fichier texte à l’étape 8.1.12.
- Utilisez un logiciel graphique (Table des matériaux) pour tracer le champ de traction avec la même échelle pour plusieurs cellules (Figure 1B,C et Figure 2B,C).
- Insérez le fichier texte qui contient les données brutes de traction dans une feuille de calcul.
- Créez une nouvelle feuille, entrez les coordonnées Y de traction dans la première ligne (organisez des valeurs élevées aux valeurs faibles) et les coordonnées X dans la première colonne (organisez de bas en haut).
- Entrez la valeur de traction dans chaque coordonnée à partir des données brutes.
- Enregistrez la feuille à l’étape 8.2.2 en tant que fichier *.csv.
- Ouvrez Origin.
- Cliquez sur File | Ouvrez et importez le fichier *.csv à l’étape 8.2.4. Sélectionnez toutes les cellules et cliquez sur Tracer | Contour| Contour - Remplissage de couleur.
- Dans la fenêtre Plotting: plotvm , sélectionnez Y dans les colonnes pour définir automatiquement les valeurs Y sur la première ligne et les valeurs X sur la première colonne. Ensuite, nommez le titre et cliquez sur OK.
- Dans la fenêtre graphique qui apparaît, double-cliquez sur la carte thermique.
- Cliquez sur Niveaux dans la fenêtre Colormap/Contours . Ensuite, modifiez le niveau d’échelle à une plage raisonnable (0300 dans cette analyse) et cliquez sur OK.
- Cliquez sur Lignes, décochez Afficher sur les niveaux principaux uniquement, puis cochez Masquer tout. Ensuite, cliquez sur OK.
- Cliquez avec le bouton droit sur le graphique et sélectionnez Exporter les graphiques.... Enregistrez l’image dans le chemin spécifié.
- Utilisez MATLAB pour calculer la traction de la cellule dipolaire.
- Enregistrez le fichier texte de données brutes de traction (à partir de l’étape 8.1.12) et le fichier de coordonnées de la région d’intérêt (ROI) de limite de cellule (à partir de l’étape 7.1.9) dans le même dossier défini à l’étape 8.1.12. Transférez tous les fichiers MATLAB en place dans le package AMFIP dans ce dossier.
- Ouvrez MATLAB. Ouvrez le dossier défini à l’étape 8.1.12 et ouvrez le fichier de calcul de la fonction de traction dipolaire absdipole.m transféré dans ce dossier à l’étape 8.3.1.
- Lisez les deux fichiers texte/csv de l’étape 8.3.1 dans l’espace de travail MATLAB et affectez une matrice à deux variables (par exemple, traction et roi).
- Exécutez la fonction absdiple (traction, roi).
REMARQUE: La première colonne de la sortie est la force de traction dipolaire en nN (nano-Newton). La deuxième colonne de la sortie est l’angle de la force de traction dipolaire par rapport à l’axe horizontal.
Résultats
Distribution et dynamique YAP distinctes dans le cancer PC9 et les cellules normales B2B conçues par CRISPR / Cas9 pendant la propagation cellulaire
Des images de fluorescence représentatives de la distribution du YAP dans des cellules B2B et PC9 simples sur des gels PAA de 2, 5, 40 kPa et des couvercles en verre sont présentées à la Figure 1A et à la Figure 2A. La localisation nucléaire du YAP dans les cellules B2B augmentait avec l’augmentation de la rigidité du substrat (Figure 1A), tandis que les cellules PC9 montraient une concentration similaire de YAP dans le noyau et le cytoplasme sur des substrats de rigidité variable (Figure 2A). Des images de fluorescence représentatives de la distribution YAP dans des cellules B2B et PC9 simples et étalées sur le substrat d’hydrogel de 5 kPa (de la 0e h à la 10e h après les cellules attachées aux substrats) sont montrées à la figure 1B et à la figure 2B, respectivement. La cellule B2B a augmenté de manière monotone la zone d’étalement au fil du temps ainsi qu’une diminution du rapport N/C YAP (Figure 1B), tandis que la cellule PC9 a maintenu une zone d’étalement cellulaire relativement immuable, une orientation et un rapport N/C YAP tout au long du processus d’étalement de 10 h (Figure 2B). Pendant les 10 heures d’étalement précoce, la cellule B2B représentative a déformé de manière constitutive la surface du substrat et a appliqué une traction cellulaire évolutive dans le temps sur toute la zone cellulaire (Figure 1C et Figure 1D).
En revanche, la cellule PC9 représentative n’a développé un déplacement et une traction qu’aux deux extrémités du corps de la cellule et sa traction a diminué après 7,5 h (Figure 2C et Figure 2D). D’autres images time-lapse et mesures de traction des cellules B2B et PC9 au stade précoce de l’épandage sont fournies dans la figure supplémentaire S2 et la figure supplémentaire S3. D’autres modes de dynamique cellulaire PC9 ont également été observés (figure 6). Parallèlement à ces différentes caractéristiques d’étalement, les cellules B2B et PC9 ont montré une distribution et une dynamique YAP distinctes (Figure 3). Sur un gel de 5 kPa, le YAP dans les cellules B2B était concentré dans le noyau à la 0ème h et est devenu plus homogène dans le corps cellulaire à la 10ème h. Cependant, les cellules PC9 ont montré une distribution plus homogène du YAP dans le noyau et le cytoplasme tout au long des 10 heures du processus de propagation. Pour analyser quantitativement l’activité YAP et la translocation dans les cellules B2B et PC9, le rapport N/C YAP a été calculé à l’aide de l’algorithme décrit à la figure 4.
Pour étudier plus en détail la dynamique YAP distincte, les changements temporels dans le rapport N/C YAP, la surface cellule/noyau et la traction de plusieurs cellules B2B simples (n = 10) et PC9 (n = 5) ont été comparés (Figure 5). Il a été constaté que le rapport N/C YAP moyen des cellules B2B diminuait de 2,54 ± 0,22 à 1,79 ± 0,21 (n = 10; p = 0,0022**; Figure 5A), alors que le rapport N/C YAP moyen des cellules PC9 est passé de 1,92 ± 0,26 à 1,57 ± 0,07 (n = 5; p = 0,187 (non significatif (ns)); Figure 5A). La traction dipolaire moyenne des cellules B2B est passée de 256,17 ± 123,69 nN à 287,44 ± 99,79 nN (p = 0,7593 (ns); Figure 5B). La traction dipolaire moyenne des cellules PC9 est passée de 141,19 ± 33,62 nN à 168,52 ± 73,01 nN (p = 0,7137 (ns); Figure 5B). La surface moyenne de propagation cellulaire des cellules B2B est passée de 613,89 ± 102,43 μm2 à 942,51 ± 226,71 μm2 (p = 0,0512 (ns); Figure 5C).
La surface moyenne d’étalement cellulaire des cellules PC9 est passée de 495,78 ± 97,04 μm2 à 563,95 ± 89,92 μm2 (p = 0,5804 (ns); Figure 5C). La surface moyenne d’étalement du noyau des cellules B2B est passée de 181,55 ± 36,18 μm2 à 239,38 ± 43,12 μm2 (p = 0,1217 (ns); Figure 5D) et la surface moyenne d’étalement du noyau des cellules PC9 est passée de 133,31 ± 30,05 μm2 à 151,93 ± 22,49 μm2 (p = 0,5944 (ns); Figure 5D). Ces résultats suggèrent que (1) les cellules B2B présentent un rapport N/C YAP dépendant de la rigidité constitutive du substrat ; (2) la traction des cellules B2B est supérieure à celle des cellules PC9; et (3) contrairement aux cellules B2B, les cellules PC9 montrent une augmentation limitée de la surface cellulaire et des changements dans le rapport N/C YAP au cours du processus d’étalement de 10 heures.
Corrélation de la distribution et de la dynamique YAP avec les états de migration des cellules B2B
Le rapport N/C YAP et la traction dipolaire de toutes les cellules B2B (n = 10) et PC9 (n = 5) en fonction de la zone d’étalement cellulaire et de la zone d’étalement du noyau ont été comparés. Le rapport N/C YAP et la traction dipolaire des cellules PC9 n’étaient pas clairement corrélés avec leurs plages de propagation des petites cellules et du noyau (Figure 6). En revanche, le rapport N/C YAP et la traction dipolaire des cellules B2B semblaient suivre deux tendances distinctes (Figure 6A et Figure 6C), suggérant qu’il pourrait y avoir deux groupes de cellules B2B qui coexistent dans cette expérience. Dans le premier groupe, le rapport N/C YAP et la traction dipolaire augmentent avec l’élargissement de la zone d’étalement cellulaire et atteignent leurs maxima à ~ 1000 μm2 (Figure 6C et Figure 6D, indiquées par la ligne pointillée jaune). Dans le deuxième groupe, le rapport N/C YAP et la traction dipolaire augmentent à un rythme plus lent avec l’élargissement de la zone d’étalement cellulaire et maintiennent des valeurs presque constantes lorsque la zone d’étalement cellulaire continue d’augmenter (Figure 6C,D, indiquée par la ligne pointillée verte).
Les cellules cancéreuses PC9 génèrent des tractions dans les régions périnucléaires
Les cellules PC9 simples et étalées déplacent les substrats dans les régions périnucléaires, à partir de la 6e heure de culture (Figure 7C). Pour visualiser le déplacement périnucléaire causé par la traction cellulaire, nous avons chevauché les images de perles fluorescentes prises avant (rouge) et après (vert) le retrait des cellules des substrats (voir la section protocole pour plus de détails). Les perles qui n’ont pas de déplacement apparaîtront jaunes dans les images superposées, c’est-à-dire l’ajout de couleurs rouges et vertes. En revanche, les perles qui sont déplacées de leurs positions de repos en raison de la traction cellulaire montreront des couleurs vertes et rouges séparées.
Notamment, dans les cellules PC9 (Figure 7C,D) et B2B (Figure 7E), un déplacement des billes a été observé dans le cytoplasme et dans le noyau, en plus de ceux à la limite cellulaire. Pour mettre en évidence le déplacement périnucléaire, l’équation de Boussinesq de la théorie de l’élasticité linéaire est utilisée pour prédire le déplacement théorique 2D généré par une force dipolaire hypothétique à la limite de la cellule (ligne pointillée noire sur la figure 7B)24. En comparant cette courbe théorique avec le déplacement réel du substrat mesuré le long du même axe (ligne pointillée blanche sur la figure 7D), les déplacements réels à l’intérieur du noyau se sont avérés 1,5 à 8 fois plus grands que la valeur théorique (figure 7B), indiquant l’existence d’une force de traction dans les régions périnucléaires.

Figure 1 : Changements dans l’expression/distribution YAP, le champ de déplacement du substrat et le champ de traction d’une cellule normale B2B sur des substrats de rigidité variable et lors de l’étalement précoce. (A) L’expression YAP d’une cellule B2B ensemencée sur des gels PAA 2, 5 et 40 kPa et un couvercle en verre après 60 h à partir de la fixation initiale du substrat cellulaire. (B) La cellule B2B a été ensemencée sur un gel PAA de 5 kPa et imagée plus de 10 h après la fixation initiale du substrat cellulaire. L’expression de YAP est représentée par l’intensité de la fluorescence verte. Remarque: L’intensité YAP à l’intérieur du noyau diminue progressivement mais reste supérieure à celle du cytoplasme au fil du temps. Les barres de couleur indiquent les niveaux d’expression YAP (vert = expression élevée; noir = expression faible) en (A) et (B). (C) La déformation du substrat (chevauchée avec l’image en champ lumineux) à l’emplacement de la cellule est représentée par le champ de déplacement à chaque point temporel. La direction et l’amplitude du déplacement sont indiquées respectivement par la direction et la couleur de la flèche. Le déplacement devient plus grand aux extrémités du corps cellulaire B2B à mesure que la zone de propagation cellulaire augmente. La barre de couleur indique l’amplitude du déplacement (pourpre = magnitude élevée; noir = faible magnitude). (D) Champ de traction (chevauchant l’image en champ lumineux) calculé à partir du champ de déplacement. La traction est concentrée sur la limite des cellules B2B. Les contours en pointillés blancs et jaunes délimitent les limites de la cellule et du noyau, respectivement. La barre de couleur indique l’amplitude de traction (pourpre = magnitude élevée; noir = faible magnitude). Barres d’échelle = 20 μm. Abréviations : YAP = Protéine associée au Oui; PAA = polyacrylamide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
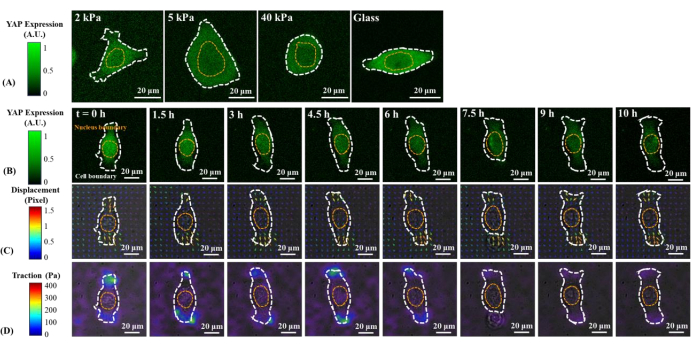
Figure 2 : Changements dans l’expression/distribution YAP, le champ de déplacement du substrat et le champ de traction d’une cellule cancéreuse PC9 sur des substrats de rigidité variable et lors de la propagation précoce. (A) L’expression YAP d’une cellule PC9 ensemencée sur des gels PAA de 2, 5 et 40 kPa et des couvercles en verre après 65 h de fixation initiale du substrat cellulaire. (B) La cellule PC9 a été ensemencée sur un gel PAA de 5 kPa et imagée plus de 10 h après la fixation initiale du substrat cellulaire. L’expression de YAP est représentée par l’intensité de la fluorescence verte. Note : L’intensité du YAP plafonne à partir de 1,5 h. Les barres de couleur indiquent les niveaux d’expression YAP (vert = expression élevée; noir = expression faible) dans (A) et (B). (C) La déformation du substrat (chevauchée avec l’image en champ lumineux) à l’emplacement de la cellule est représentée par un champ de déplacement de perle fluorescente à chaque point temporel. La direction et l’amplitude du déplacement sont indiquées respectivement par la direction et la couleur de la flèche. Le champ de déplacement causé par les cellules PC9 est plus petit que celui causé par la cellule B2B. Tout au long du processus d’étalement de 10 heures, la surface des cellules PC9 reste presque constante. La barre de couleur indique l’amplitude du déplacement (pourpre = magnitude élevée; noir = faible magnitude). (D) Champ de traction (chevauchant l’image en champ lumineux) calculé à partir du champ de déplacement. La traction générée par cette cellule PC9 représentative diminue progressivement de la 6ème h à la 10ème h. Les contours en pointillés blancs et jaunes délimitent les limites de la cellule et du noyau, respectivement. La barre de couleur indique l’amplitude de traction (pourpre = magnitude élevée; noir = faible magnitude). Barres d’échelle = 20 μm. Abréviations : YAP = Protéine associée au Oui; PAA = polyacrylamide. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Distribution YAP dans les cellules B2B et PC9 au stade précoce de la propagation. (A) L’intensité YAP de la cellule B2B est mesurée le long de l’axe rouge assigné à la 0ème et la 10ème h. (B) À la 0ème h, l’intensité YAP montre des différences de concentration dramatiques entre le noyau et le cytoplasme. Au 10ème h, l’intensité YAP devient plus homogène dans tout le corps cellulaire. (C) L’intensité YAP de la cellule PC9 est mesurée le long de l’axe bleu assigné aux 0e et 10e h. (D) À la 0e h, l’intensité YAP dans le noyau apparaît plus élevée que celle du cytoplasme, bien que la différence ne soit pas aussi remarquable que celle des cellules B2B. Au 10ème h, l’intensité YAP dans le noyau apparaît encore légèrement supérieure à celle du cytoplasme, avec une tendance de variation similaire à celle du 0ème h. Barres d’échelle = 20 μm (A, C). Abréviation : YAP = Protéine associée au Oui. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Mesure du rapport N/C YAP. (1) Appliquez Fiji ImageJ pour dessiner le contour du noyau et mesurer sa zone projetée en 2D Anuc. (2) Mesurer l’intensité de fluorescence à l’intérieur du noyau Inuc. (3) Dessinez le contour du corps cellulaire et mesurez sa zone projetée Acel. (4) Mesurer l’intensité de fluorescence à l’intérieur de la cellule Icel. (5) Calculer la densité du noyau YAP Dnuc, la densité du cytoplasme YAP Dcyto, et leur rapport R: Dnuc = Inuc / Anuc; Dcyto=(Icel-Inuc)/(Acel-Anuc); R=Dnuc/Dcyto. La barre de couleur indique les niveaux d’expression YAP (vert = expression élevée; noir = expression faible). Barre d’échelle = 20 μm. Abréviations : YAP = Protéine associée au Oui; N = noyau; C = cytoplasme. Veuillez cliquer ici pour voir une version agrandie de cette figure.
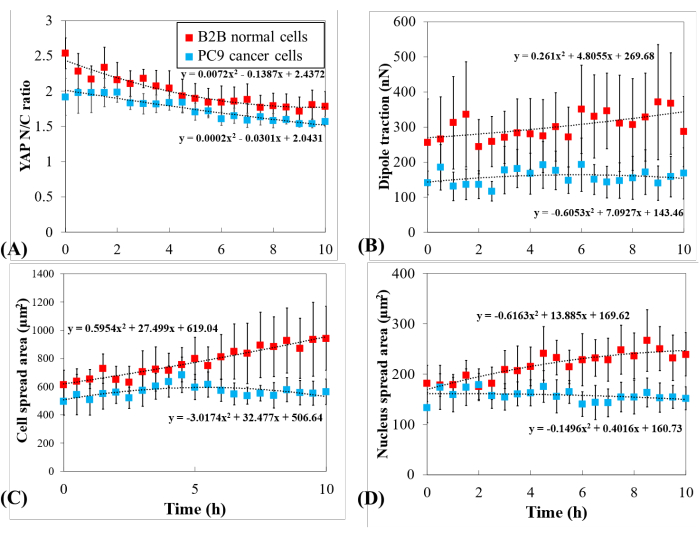
Figure 5 : Expression distincte du YAP, morphologie cellulaire/noyau et traction cellulaire dans le cancer PC9 et les cellules normales B2B pendant la propagation cellulaire. (A) Changement du rapport N/C YAP au cours des 10 premières heures d’épandage unicellulaire. Le rapport N/C YAP moyen des cellules B2B (colonne rouge; n = 10) est passé de 2,54 ± 0,22 à 1,79 ± 0,21 (n = 10; p = 0,0022**) tandis que le rapport N/C YAP moyen des cellules PC9 (colonne bleue; n = 5) est passé de 1,92 ± 0,26 à 1,57 ± 0,07 (p = 0,187 (ns)). (B) La traction dipolaire moyenne en fonction du temps. La traction dipolaire moyenne des cellules B2B est passée de 256,17 ± 123,69 nN à 287,44 ± 99,79 nN (p = 0,7593 (ns)) et la traction dipolaire moyenne des cellules PC9 est passée de 141,19 ± 33,62 nN à 168,52 ± 73,01 nN (p = 0,7137 (ns)). (C) La surface cellulaire moyenne en fonction du temps. La surface moyenne de propagation cellulaire des cellules B2B est passée de 613,89 ± 102,43 μm2 à 942,51 ± 226,71 μm2 (p = 0,0512 (ns)) et la zone moyenne de propagation cellulaire des cellules PC9 est passée de 495,78 ± 97,04 μm2 à 563,95 ± 89,92 μm2 (p = 0,5804 (ns)). (D) L’aire moyenne du noyau en fonction du temps. La surface moyenne d’étalement du noyau des cellules B2B est passée de 181,55 ± 36,18 μm2 à 239,38 ± 43,12 μm2 (p = 0,1217 (ns)) et la zone moyenne d’étalement du noyau des cellules PC9 est passée de 133,31 ± 30,05 μm2 à 151,93 ± 22,49 μm2 (p = 0,5944 (ns)). Abréviations : YAP = Protéine associée au Oui; N = noyau; C = cytoplasme; ns = non significatif. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Rapport N/C YAP et force de traction dipolaire en fonction de la zone d’étalement de la cellule et du noyau. Le rapport N/C YAP et la traction dipolaire des cellules B2B (n = 10) et des cellules PC9 (n = 5) sont calculés de la 6ème h à la 10ème h après fixation au substrat. (A) Rapport N/C YAP en fonction de la zone d’étalement cellulaire. Les rapports N/C YAP des cellules B2B varient de 1,16 à 2,53, tandis que les rapports N/C YAP des cellules PC9 varient de 1,27 à 1,88. La zone d’étalement cellulaire des cellules B2B varie de 391,94 μm2 à 1986,40 μm2. La zone d’étalement cellulaire des cellules PC9 varie de 284,46 μm2 à 830,12 μm2. (B) Rapport N/C YAP en fonction de la zone d’étalement du noyau. La zone d’étalement du noyau des cellules B2B varie de 107,09 μm2 à 514,28 μm2. La zone d’étalement du noyau des cellules PC9 varie de 58,03 μm2 à 259,65 μm2. Traction dipolaire des cellules B2B en fonction de la zone d’étalement cellulaire (C) et de la zone d’étalement du noyau (D). Les cellules B2B étalées et non migratrices montrent une traction plus élevée (de 47,50 nN à 1051,48 nN) avec la zone inférieure des cellules et du noyau. Lors de leur propagation et de leur migration, les cellules B2B présentent une traction plus faible (de 105,80 nN à 310,28 nN) avec de plus grandes plages de cellules et de noyaux. Abréviations : YAP = Protéine associée au Oui; N = noyau; C = cytoplasme. Veuillez cliquer ici pour voir une version agrandie de cette figure.
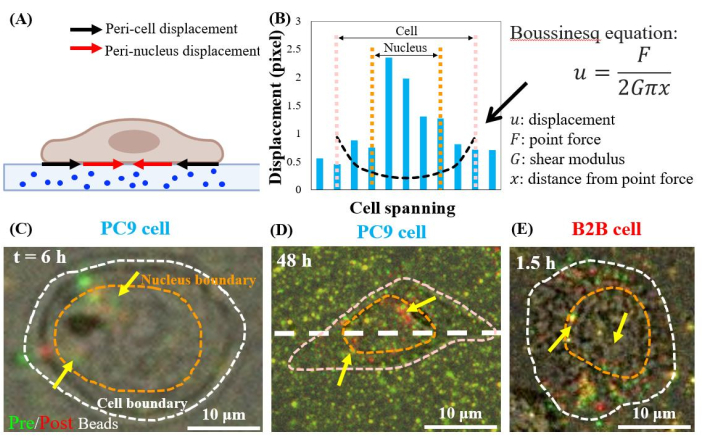
Figure 7 : Déplacement périnucléaire dans les cellules B2B normales et PC9 cancéreuses. (A) Schéma de vue latérale du déplacement périnucléaire et péricellulaire mesuré à partir du déplacement des billes dans le substrat. (B) Le déplacement du substrat sous la cellule PC9 est mesuré le long de l’axe de la cellule (ligne pointillée blanche en 7D). Le déplacement théorique généré par la force dipolaire à la limite de la cellule est montré par l’équation de Boussinesq (courbe pointillée noire). (C) et (D) Images de billes fluorescentes superposées avec des cellules (rouges) et sans cellules (vertes) pour les cellules PC9 à la 6ème h après la fixation (vue de dessus). Les perles jaunes (chevauchement exact des couleurs rouge et verte) indiquent qu’il n’y a pas de déplacement. Les perles vertes et rouges séparées (pointées par des flèches jaunes) représentent le déplacement périnucléaire. Des flèches jaunes indiquent ces taches péri-noyau contractées situées à la périphérie du noyau. (E) Déplacement périnucléaire généré par la cellule B2B à 1,5e h après la fixation cellule-substrat. Barres d’échelle = 10 μm (C–E). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire S1 : La carte de séquence génomique de YAP-mNeonGreen21-10/11. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire S2 : Changements dans l’expression/distribution du YAP, le champ de déplacement du substrat et le champ de traction des cellules normales B2B au début de la propagation. (A, D, G, J, M) La cellule B2B a été ensemencée sur un gel PAA de 5 kPa et imagée plus de 10 h après la fixation initiale du substrat cellulaire. L’expression de YAP est représentée par l’intensité de la fluorescence verte. Remarque: L’intensité YAP à l’intérieur du noyau diminue progressivement mais reste plus élevée que dans le cytoplasme au fil du temps. Les barres de couleur indiquent les niveaux d’expression YAP (vert = expression élevée; noir = expression faible) dans (A, D, G, J, M). (B, E, H, K, N) La déformation du substrat (chevauchée avec l’image en champ lumineux) à l’emplacement de la cellule est représentée par le champ de déplacement à chaque point temporel. La direction et l’amplitude du déplacement sont indiquées respectivement par la direction et la couleur de la flèche. Le déplacement devient plus important à la périphérie du corps cellulaire B2B à mesure que la zone de propagation cellulaire augmente. Les barres de couleur indiquent la magnitude du déplacement (pourpre = magnitude élevée; noir = faible magnitude) en (B, E, H, K, N). (C, F, I, L, O) Champ de traction (chevauché avec l’image en champ lumineux) calculé à partir du champ de déplacement à l’aide de la microscopie à force de traction. La traction est concentrée à la périphérie des cellules B2B. Les barres de couleur indiquent l’amplitude de traction (pourpre = magnitude élevée; noir = faible magnitude) en (C, F, I, L, O).). Barres d’échelle = 20 μm. Abréviations : YAP = Protéine associée au Oui; PAA = polyacrylamide. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire S3 : Changements dans l’expression/distribution du YAP, le champ de déplacement du substrat et le champ de traction des cellules cancéreuses PC9 au cours de la propagation précoce. (A, D, G, J) La cellule PC9 a été ensemencée sur un gel PAA de 5 kPa et imagée plus de 10 h après la fixation initiale du substrat cellulaire. L’expression de YAP est représentée par l’intensité de la fluorescence verte. Remarque: L’intensité YAP à l’intérieur du noyau diminue progressivement, mais reste similaire ou légèrement inférieure à celle du cytoplasme au fil du temps. Les barres de couleur indiquent les niveaux d’expression YAP (vert = expression élevée; noir = expression faible) dans (A, D, G, J). (B, E, H, K) La déformation du substrat (chevauchée avec l’image en champ lumineux) à l’emplacement de la cellule est représentée par le champ de déplacement à chaque point temporel. La direction et l’amplitude du déplacement sont indiquées respectivement par la direction et la couleur de la flèche. Le déplacement devient plus important à la périphérie du corps cellulaire PC9 à mesure que la zone de propagation cellulaire augmente. Les barres de couleur indiquent la magnitude du déplacement (pourpre = magnitude élevée; noir = faible magnitude) en (B, E, H, K). (C, F, I, L) Champ de traction (chevauchant l’image en champ lumineux) calculé à partir du champ de déplacement. La traction est concentrée à la périphérie des cellules PC9. Les barres de couleur indiquent la magnitude de traction (pourpre = magnitude élevée; noir = faible magnitude) en (C, F, I, L).. Barres d’échelle = 20 μm. Abréviations : YAP = Protéine associée au Oui; PAA = polyacrylamide. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le processus d’imagerie (étape 6.3) est essentiel pour s’assurer que les images de fluorescence sont de qualité suffisante pour donner des résultats de quantification valides. Les images z-stack de protéines fluorescentes ou de perles doivent avoir une plage z suffisamment grande pour inclure les images focalisées pour toutes les positions Z que l’échantillon couvre. Une autre étape critique consiste à collecter les images de référence des billes fluorescentes après dissolution des cellules (étape 6.5). Étant donné que les images de référence doivent être prises aux mêmes positions à l’étape 6.3, aucun déplacement relatif ne doit être induit entre la boîte de Pétri, la chambre d’environnement et le microscope. Les enquêteurs effectuant l’étape de dissolution doivent veiller à retirer le couvercle de la boîte de Pétri et à s’assurer que la perturbation mécanique appliquée n’est pas assez importante pour modifier l’emplacement de la boîte dans la chambre de l’environnement.
Des solutions sont fournies ci-dessous pour résoudre certaines erreurs qui peuvent se produire pendant les expériences. Si aucune macro n’est activée après avoir cliqué sur Entrée à l’étape 6.4, c’est probablement parce que la zone inférieure gauche de l’écran est occupée par une fenêtre non-Élément. Dans ce cas, la zone inférieure gauche de la fenêtre doit être effacée afin que les macros puissent être activées dans Elements. Une autre erreur courante est que les images en champ lumineux apparaissent en noir. Ce problème est dû à un intervalle de temps insuffisant entre les acquisitions d’images de fluorescence et d’images en champ lumineux. De légers retards dans le comptage du temps d’imagerie par fluorescence peuvent s’accumuler au fil du temps et causer des retards considérables et interférer avec l’imagerie en champ lumineux. Une solution consiste à ajuster la durée d’un cycle d’imagerie de toutes les positions pour qu’elle soit inférieure (non égale à) l’intervalle de temps entre le début des mouvements consécutifs. Cette opération actualise le comptage du temps et élimine l’erreur cumulative au début de chaque cycle d’imagerie.
Cette technologie d’interrogation entièrement optique prend en charge (1) une large gamme de matériel / logiciels, y compris, mais sans s’y limiter, Nikon, (2) divers types de systèmes d’hydrogel validés, y compris les gels de gélatine, peg, Matrigel et collagène I, et (3) la personnalisation programmable en fonction des différents besoins des chercheurs. Cependant, si l’une des fonctions de contrôle de niveau inférieur n’est pas disponible à partir d’un microscope commercial, la personnalisation des fonctions à l’aide d’AMFIP devient difficile. Une autre limitation de cette technique est la dérive spatiale de l’échantillon dans les plans XY et focal (Z). Bien que cette limitation puisse être surmontée lors du post-traitement des images, il est essentiel d’améliorer la fonction de mise au point automatique pour corriger la dérive en temps réel des échantillons. Cette amélioration augmentera le débit du processus d’imagerie et réduira l’erreur potentielle causée par la dérive pendant les expériences.
Les mécanotransducteurs, tels que le YAP, pourraient servir de nouvelles cibles thérapeutiques pour le développement de thérapies prometteuses contre le cancer25,26,27. Les données émergentes suggèrent que le YAP favorise la prolifération et l’invasion des cellules cancéreuses. La translocation YAP induite par la mécanique du cytoplasme au noyau active la transcription des gènes liés à la migration cellulaire, à la prolifération, à l’invasion et à l’apoptose, conduisant à des comportements cellulaires aberrants28,29,30,31. Ce travail visait à explorer la corrélation potentielle du rapport N/C YAP et de la mécanique cellulaire dans deux cancers du poumon humains typiques et des lignées cellulaires normales. Au cours de la période d’étalement cellulaire de 10 h, les cellules PC9 présentent des concentrations de YAP similaires dans le noyau et le cytoplasme (figure 3D et figure 5A). Les cellules B2B présentent une concentration de YAP plus élevée dans le noyau que dans le cytoplasme (Figure 3C et Figure 5A). Cette relation observée au stade précoce de la propagation est différente de la majorité des résultats publiés qui comparent la concentration de YAP dans le noyau entre les cellules normales et cancéreuses. Bien que pas nécessairement au stade précoce de la propagation, la plupart des résultats publiés montrent que le YAP est plus concentré dans le noyau des cellules cancéreuses que dans le noyau des cellules normales27,28. Une seule étude sur le cancer du sein a rapporté une exception32 qui montre que le YAP est plus concentré dans le cytoplasme, ce qui concorde avec nos observations actuelles faites dans les cellules PC9 du cancer du poumon. À la connaissance des auteurs, ce travail est le premier à montrer un rapport N/C YAP plus faible dans une lignée cellulaire de cancer du poumon humain. Les auteurs émettent l’hypothèse que la raison d’un rapport N/C YAP stable dans les cellules PC9 pourrait être due à la faible variation de la zone de propagation cellule/noyau et à la traction dans les cellules PC9 au stade précoce de la propagation. La dissection des mécanismes moléculaires sous-jacents du faible rapport N/C YAP dans les cellules PC9 et B2B est en cours.
Au cours des 10 premières heures d’étalement, ces deux lignées cellulaires montrent une relation distincte entre le rapport N/C YAP, la traction cellulaire et la zone d’étalement (figure 5). Pour les cellules B2B, un rapport N/C YAP plus élevé est corrélé à une zone de propagation plus élevée des cellules et du noyau (Figure 6A,B), ce qui est cohérent avec les données rapportées d’autres cellules normales33. Fait intéressant, bien que la tendance de développement de cette relation se retrouve généralement dans toutes les cellules B2B enregistrées, deux degrés différents (élevés et faibles) de cette relation sont trouvés. Les cellules B2B qui se propagent et migrent simultanément présentent une traction plus faible et une zone de propagation cellulaire et noyau plus élevée avec un rapport N/C YAP plus élevé (2,05 ± 0,32). Pour les cellules B2B qui se propagent et restent au même endroit, elles présentent une traction plus élevée et une zone de propagation plus faible des cellules et du noyau avec un rapport N/C YAP plus faible (1,74 ± 0,21). Ces deux degrés de relations sont démontrés dans les groupes de données dispersés bifurqués (Figure 6C,D). Comme indiqué dans la littérature, les cellules normales stationnaires, telles que les cellules embryonnaires de fibroblastes NIH 3T3, ont une traction plus élevée que les cellules migratrices34. Les données rapportées dans cet article suggèrent que les cellules B2B étalées et non migratrices ont appliqué une traction plus élevée que les cellules B2B étalées et en migration, ce qui suggère probablement qu’une traction élevée est nécessaire pour que les cellules non migratrices se stabilisent sur le substrat.
En outre, ces données montrent que les cellules B2B normales stationnaires génèrent une force périnucléaire plus élevée, alors que des recherches antérieures menées par d’autres chercheurs n’ont rapporté qu’une traction cellulaire plus élevée générée à la périphérie des cellules stationnaires34,35,36,37. Les auteurs pensent que la différence dans la tendance intrinsèque de la migration dans les expériences pourrait être à l’origine de ces résultats contradictoires. Dans les expériences publiées, des micromotifs de forme carrée avaient été utilisés pour confiner des cellules individuelles de la propagation et inhiber la migration; on ne sait pas si les cellules avaient tendance à migrer. Comme les cellules migratrices présentent souvent une force de traction élevée à la périphérie des cellules38, il est probable que les cellules ayant tendance à migrer conserveront toujours une traction périphérique élevée même si leur migration est limitée. Dans la présente étude, les cellules stationnaires ne sont limitées par aucun micromotif mais ne migrent pas, ce qui indique que les cellules ont tendance à maintenir leur état de non-migration. Une autre possibilité est que la forme de la cellule définie par le micromotif puisse affecter la distribution des adhérences focales et des forces de traction39. Les résultats de cette étude ont été générés sans aucun micromotif confinant et représentent la distribution de force des cellules stationnaires dans leur forme d’origine.
À la connaissance des auteurs, une seule publication à ce jour a spécifiquement rapporté la découverte de forces périnucléaires dans des cellules normales (fibroblastes embryonnaires de souris), potentiellement causées par le capuchon d’actine couvrant le noyau40. La translocation du cytoplasme au noyau YAP est corrélée à l’augmentation de la force périnucléaire40. Une recherche approfondie de la littérature pertinente n’a pas donné de publications qui rapportent une force périnucléaire ou le capuchon d’actine dans les cellules cancéreuses. Une étude indirecte sur les cellules cancéreuses du mélanome a démontré que le bord de l’actine (une autre organisation d’actine périnucléaire située autour du noyau mais ne le recouvrant pas) réduit les taux de migration cellulaire41, suggérant indirectement l’existence d’une force périnucléaire. Cependant, aucune donnée expérimentale directe n’est rapportée. Dans cette étude, les auteurs ont constaté que les cellules PC9 et B2B présentent un déplacement et une traction périnucléaires. Les mécanismes de génération des forces périnucléaires et leurs effets restent controversés. Dans les cellules normales, le capuchon d’actine a joué un rôle dans la régulation de la morphologie du noyau et de l’organisation de la chromatine42, la transmission des signaux mécaniques des adhérences focales dans le noyau par l’intermédiaire de liants du complexe nucléosquelette et cytosquelette (LINC)43, et la régulation de la migration cellulaire44. Lamin A / C est lié à la formation et à la perturbation du capuchon d’actine40,41,42,43,44. Cependant, le rapport qui affirmait que le bouchon d’actine génère une force périnucléaire ne tenait pas compte du rôle potentiel du bord d’actine40. Dans les cellules cancéreuses, la surexpression de Lamin A facilite la formation d’un bord d’actine et restreint la migration des cellules cancéreuses. La surexpression de Lamin B réduit la formation de bord d’actine et favorise la migration. La force périnucléaire pourrait être impliquée dans ce processus en raison de l’existence d’une organisation de l’actine périnucléaire et de l’effet de Lamin A. Cependant, les résultats de cette étude n’ont montré aucune preuve de forces périnucléaires mesurées ou du comportement du capuchon d’actine. Par conséquent, la découverte de forces périnucléaires dans les cellules PC9 dans cette étude est le premier rapport montrant les forces périnucléaires et les déplacements dans les cellules cancéreuses du poumon. Les auteurs étudient actuellement les mécanismes moléculaires et les fonctions des forces périnucléaires dans les cellules PC9 et B2B conçues par CRISPR / Cas9.
Au-delà de l’interrogation mécanobiologique entièrement optique démontrée dans cet article, le système multifonctionnel intégré peut être appliqué pour sonder optiquement une myriade d’autres signaux physiologiques et pathobiologiques essentiels dans les systèmes vivants. Par exemple, le laboratoire des auteurs a récemment établi plusieurs lignées cellulaires cancéreuses humaines transductées de manière stable qui co-expriment trois protéines membranaires sensibles à la lumière: l’indicateur de tension membranaire QuasAr2 (excitation: 640 nm; émission: 660 nm-740 nm), le dépolariseur de tension membranaire CheRiff (excitation: 488 nm) et l’hyperpolarisateur de tension membranaire eNpHR3 (excitation: 590 nm). Ces trois protéines fonctionnelles peuvent être activées par des lignes laser orthogonales à spectre sans diaphonie, permettant des communications de signalisation bidirectionnelles entièrement optiques (lecture et contrôle) de l’électrophysiologie membranaire. À l’aide d’un système opto-électronique intégré et d’une pince à patch manuelle, les auteurs ont validé le contrôle et la lecture entièrement optiques de la tension membranaire (Vm) dans des cellules cancéreuses humaines uniques et des sphéroïdes tumoraux multicellulaires. L’interrogation électrophysiologique entièrement optique ouvre la possibilité d’explorations détaillées de la bioélectricité auparavant inaccessible dans les cellules cancéreuses, ce qui peut aider à faire progresser la biologie tumorale à partir d’un nouvel axe.
Déclarations de divulgation
Il n’y a pas de conflits d’intérêts à déclarer.
Remerciements
Ce projet est soutenu financièrement par le Cancer Pilot Award de l’UF Health Cancer Center (X. T. et D. S.) et le Gatorade Award Start-up Package (X. T.). Les auteurs apprécient sincèrement les discussions intellectuelles avec et le soutien technique du Dr Jonathan Licht (UFHCC), du Dr Rolf Renne (UFHCC), du Dr Ji-Hyun Lee (Biostatistique, UF), du Dr Hugh Fan (MAE, UF), du Dr Warren Dixon (MAE, UF), du Dr Ghatu Subhash (MAE, UF), du Dr Mark Sheplak (MAE & ECE, UF), du Dr Malisa Sarntinoranont (MAE, UF), du Dr Scott Banks (MAE, UF), Dr Matthew Traum (MAE, UF), Dr David Hahn (Université de l’Arizona), Dr Weihong Wang (Oracle Corporation), Dr Youhua Tan (Université polytechnique de Hong Kong) et l’équipe de soutien de Nikon (Drs Jose Serrano-Velez, Larry Kordon et Jon Ekman). Les auteurs sont profondément reconnaissants pour le soutien généreux et efficace de tous les membres des laboratoires de recherche de Tang, Siemann et Guan et de tous les membres du personnel des départements MAE & ECE & Physics & Radiation Oncology, UF.
matériels
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Sigma-aldrich | 440140 | |
| 0.05 % Trypsin | Corning | 25-051-CI | |
| 75 cm2 flask | Corning | 430641U | |
| 8 Benchtop Centrifuge | Thermo | 75007210 | |
| A1R confocal system | Nikon | HD25 | |
| Acetic acid | Sigma-aldrich | 695092 | glacial, ACS reagent, ≥99.7% |
| BEAS-2B (B2B) cells | Sigma-aldrich | 95102433 | human epithelial cells from lung tissue |
| Carboxylate-Modified Microspheres | Invitrogen | F8797 | |
| Culture medium (RPMI-1640) | Gibco | 11875093 | |
| Desktop Computer | Dell | 2018 | with Windows 10 operating system |
| Environmental chamber TIZB | Tokai Hit | TIZB | |
| Fetal bovine serum (FBS) | Gibco | 26140 | |
| Fibronectin Human Protein, Plasma | Gibco | 33016015 | |
| Fiji ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | 1.53k | |
| Glass-bottom petri dish | MatTek | P35G-1.5-14-C | |
| HEPES buffered saline | Sigma-aldrich | 51558 | |
| Hydrazine hydrate solution | Sigma-aldrich | 53847 | |
| IntelliJ IDEA | JetBrains | 2020 | Java development platform |
| Java Development Kit | Oracle | 14.0 | |
| Kimwipe | Kimtech Science | 3066-05 | |
| MATLAB | MathWorks | 2020b | |
| Monochrome Camera | FLIR | BFS-U3-70S7M-C | |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-218 | |
| N,N′-Methylenebisacrylamide solution | Sigma-aldrich | M1533 | |
| NIS-Elements software platform | Nikon | 4.50 | software platform |
| Origin | OriginLab | OriginPro 2017 (Learning Edition) | data analysis and graphing software |
| Penicillin-streptomycin | Gibco | 15140122 | |
| PC9 cells | Sigma-aldrich | 90071810 | human adenocarcinoma cells from lung tissue |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | F-553S | high-fidelity DNA polymerase |
| Scotch tape | Scotch | adhesive tape | |
| Sodium dodecyl sulfate solution | Sigma-aldrich | 05030 | |
| Super glue | Gorilla | cyanoacrylate glue | |
| Ti2-E inverted microscope | Nikon | MEA54000 | |
| TI2-S-SE-E Motorized Stage with Encoder | Nikon | MEC56120 | |
| μManager | version 2.0 gamma | open source microscopy software (https://micro-manager.org/) |
Références
- Werley, C., Boccardo, S., Rigamonti, A., Hansson, E., Cohen, A. Multiplexed optical sensors in arrayed islands of cells for multimodal recordings of cellular physiology. Nature Communications. 11 (1), 3881 (2020).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Saraswathibhatla, A., Galles, E. E., Notbohm, J. Spatiotemporal force and motion in collective cell migration. Scientific Data. 7 (1), 197 (2020).
- Saraswathibhatla, A., Henkes, S., Galles, E. E., Sknepnek, R., Notbohm, J. Coordinated tractions control the size of a collectively moving pack in a cell monolayer. Extreme Mechanics Letters. 48, 101438 (2021).
- Wang, W., Kim, C. K., Ting, A. Y. Molecular tools for imaging and recording neuronal activity. Nature Chemical Biology. 15 (2), 101-110 (2019).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature Methods. 9 (7), 697-710 (2012).
- Carpenter, A. E., Kamentsky, L., Eliceiri, K. W. A call for bioimaging software usability. Nature Methods. 9 (7), 666-670 (2012).
- Skylaki, S., Hilsenbeck, O., Schroeder, T. Challenges in long-term imaging and quantification of single-cell dynamics. Nature Biotechnology. 34 (11), 1137-1144 (2016).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Luo, Q., et al. Automatic multi-functional integration program (AMFIP) towards all-optical mechanobiology interrogation. bioRxiv. , (2021).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer control of microscopes using manager. Current Protocols in Molecular Biology. 92 (1), 14-20 (2010).
- Tulpule, A., et al. Kinase-mediated RAS signaling via membraneless cytoplasmic protein granules. Cell. 184 (10), 2649-2664 (2021).
- Tang, X., Tofangchi, A., Anand, S. V., Saif, T. A. A novel cell traction force microscopy to study multi-cellular system. PLOS Computational Biology. 10 (6), 1003631 (2014).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews Materials. 5, 351-370 (2020).
- Phelps, E. A., et al. Maleimide cross-linked bioactive PEG hydrogel exhibits improved reaction kinetics and cross-linking for cell encapsulation and in situ delivery. Advanced Materials. 24 (1), 64-70 (2012).
- Bajaj, P., Tang, X., Saif, T. A., Bashir, R. Stiffness of the substrate influences the phenotype of embryonic chicken cardiac myocytes. Journal of Biomedical Materials Research. Part A. 95 (4), 1261-1269 (2010).
- Temples, M. N., Adjei, I. M., Nimocks, P. M., Djeu, J., Sharma, B. Engineered three-dimensional tumor models to study natural killer cell suppression. ACS Biomaterials Science & Engineering. 6 (7), 4179-4199 (2020).
- Feng, S., et al. Improved split fluorescent proteins for endogenous protein labeling. Nature Communications. 8, 370 (2017).
- Guan, J., Liu, H., Shi, X., Feng, S., Huang, B. Tracking multiple genomic elements using correlative CRISPR imaging and sequential DNA FISH. Biophysical Journal. 112 (6), 1077-1084 (2017).
- . Micro-Manager Available from: https://micro-manager.org/wiki/NikonTi2 (2021)
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Martiel, J. L., et al. Measurement of cell traction forces with ImageJ. Methods in Cell Biology. 125, 269-287 (2015).
- Okumurai, I. A. On the generalization of Cerruti's problem in an elastic half-space. Doboku Gakkai Ronbunshu. 1995, 1-10 (1995).
- Piccolo, S., Dupont, S., Cordenonsi, M. The biology of YAP/TAZ: hippo signaling and beyond. Physiological Reviews. 94 (4), 1287-1312 (2014).
- Hong, W. W., Guan, K. L. The YAP and TAZ transcription co-activators: Key downstream effectors of the mammalian Hippo pathway. Seminars in Cell and Developmental Biology. 23 (7), 785-793 (2012).
- Zanconato, F., Cordenonsi, M., Piccolo, S. YAP/TAZ at the roots of cancer. Cancer Cell. 29 (6), 783-803 (2016).
- Wang, Y., et al. Overexpression of yes-associated protein contributes to progression and poor prognosis of non-small-cell lung cancer. Cancer Science. 101 (5), 1279-1285 (2010).
- Li, H., et al. Inhibition of YAP suppresses CML cell proliferation and enhances efficacy of imatinib in vitro and in vivo. Journal of Experimental & Clinical Cancer Research. 35 (1), 134 (2016).
- Tang, X., et al. A mechanically-induced colon cancer cell population shows increased metastatic potential. Molecular Cancer. 13, 131 (2014).
- Panciera, T., Azzolin, L., Cordenonsi, M., Piccolo, S. Mechanobiology of YAP and TAZ in physiology and disease. Nature Reviews Molecular Cell Biology. 18 (12), 758-770 (2017).
- Yuan, M., et al. Yes-associated protein (YAP) functions as a tumor suppressor in breast. Cell Death and Differentiation. 15 (11), 1752-1759 (2008).
- Koushki, N., et al. Lamin A redistribution mediated by nuclear deformation determines dynamic localization of YAP. bioRxiv. , (2020).
- Chang, S. S., Rape, A. D., Wong, S. A., Guo, W. H., Wang, Y. L. Migration regulates cellular mechanical states. Molecular Biology of the Cell. 30 (26), 3104-3111 (2019).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Geometric guidance of integrin mediated traction stress during stem cell differentiation. Biomaterials. 69, 174-183 (2015).
- Lee, J., Abdeen, A., Tang, X., Saif, T. A., Kilian, K. A. Matrix directed adipogenesis and neurogenesis of mesenchymal stem cells derived from adipose tissue and bone marrow. Acta Biomaterialia. 42, 46-55 (2016).
- Tang, X., Bajaj, P., Bashir, R., Saif, T. A. How far cardiac cells can see each other mechanically. Soft Matter. 7 (13), 6151-6158 (2011).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Rape, A., Guo, W. H., Wang, Y. L. The regulation of traction force in relation to cell shape and focal adhesions. Biomaterials. 32 (8), 2043-2051 (2011).
- Shiu, J. Y., Aires, L., Lin, Z., Vogel, V. Nanopillar force measurements reveal actin-cap-mediated YAP mechanotransduction. Nature Cell Biology. 20 (3), 262-271 (2018).
- Fracchia, A., Asraf, T., Salmon-Divon, M., Gerlitz, G. Increased lamin B1 levels promote cell migration by altering perinuclear actin organization. Cells. 9 (10), 2161 (2020).
- Ramdas, N. M., Shivashankar, G. V. Cytoskeletal control of nuclear morphology and chromatin o1rganization. Journal of Molecular Biology. 427 (3), 695-706 (2015).
- Khatau, S. B., et al. A perinuclear actin cap regulates nuclear shape. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19017-19022 (2009).
- Kim, D. H., Cho, S., Wirtz, D. Tight coupling between nucleus and cell migration through the perinuclear actin cap. Journal of Cell Science. 127 (11), 2528-2541 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon