Method Article
Interrogatório de Mecanobiologia totalmente óptica de proteína associada a sim em câncer humano e células normais usando um sistema multifuncional
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este artigo apresenta um protocolo passo a passo detalhado sobre como utilizar um sistema multifuncional e programável integrado ao usuário que permite que a imagem multicanal e a análise mecanobiológica automática e a elucidação da mecano-sensibilidade da proteína associada ao Sim (YAP).
Resumo
Imagens multifuncionais de longo prazo e análises de células vivas requerem coordenação funcional e simplificada de várias plataformas de hardware e software. No entanto, o controle manual de vários equipamentos produzidos por diferentes fabricantes é intensivo em mão-de-obra e demorado, potencialmente diminuindo a precisão, reprodutibilidade e qualidade dos dados adquiridos. Portanto, um sistema all-in-one e programável ao usuário que permite a aquisição automática, multifuncional e de longo prazo de imagens e é compatível com a maioria das plataformas de microscopia fluorescentes pode beneficiar a comunidade científica. Este artigo introduz os protocolos operacionais completos de utilização de um novo sistema de software integrado que consiste em (1) um programa de software construído em casa, intitulado "Automatic Multi-funcional Integration Program (AMFIP)", que permite a aquisição automática de imagens multicanais e (2) um conjunto de análise quantitativa de imagens e pacotes de computação de tração celular.
Este sistema integrado é aplicado para revelar a relação até então desconhecida entre a distribuição espaço-temporal da proteína associada à mecano-sensível ao Sim (YAP) e a mecânica celular, incluindo a disseminação e tração celular, em células normais humanas (B2B) e células cancerígenas de pulmão (PC9). Aproveitando a capacidade deste sistema de controle e leitura multicanal, o resultado mostra: (1) células normais B2B e células cancerígenas PC9 mostram uma relação distinta entre a expressão, tração e dinâmica celular do YAP durante os processos de disseminação e migração de células; e (2) as células cancerígenas PC9 aplicam forças peri-nucleares perceptíveis em substratos. Em resumo, este artigo apresenta um protocolo passo a passo detalhado sobre como utilizar um sistema integrado de programável ao usuário que permite que imagens e análises multifuncionais automáticas elucidam a sensibilidade mecano. Essas ferramentas abrem a possibilidade de explorações detalhadas da dinâmica de sinalização multifacetada no contexto da fisiologia celular e patologia.
Introdução
O objetivo geral deste método é permitir imagens multifuncionais ópticas e análises de células vivas. Um programa de imagem all-in-one que permite a coordenação automática de dispositivos optoeletrônicos multifuncionais reduzirá operações manuais intensivas em mão-de-obra e propensas a erros e é essencial para os pesquisadores realizarem imagens de células vivas de longo prazo1,2,3,4. No entanto, a maioria dos programas públicos existentes na comunidade de pesquisa biomédica só se aplica a dispositivos optoeletrônicos limitados ou exige hardware adicional para a coordenação de diferentes equipamentos5,6,7,8,9. Recentemente, um programa de código aberto e baseado em software foi desenvolvido, intitulado "Automatic Multi-funcional Integration Program (AMFIP)", permitindo imagens multicanal e time-lapse. Com base na linguagem Java e na API (Application Programming Interface) de μManager11,12, a AMFIP foi desenvolvida como um plugin em μManager que executa scripts Java personalizados para realizar comunicações baseadas em software de múltiplas plataformas de hardware e software optoeletrônicas, incluindo, mas não se limitando às da Nikon. A criação da AMFIP abre a possibilidade de interrogatório programável e multifuncional de comportamentos celulares. Um sistema experimental e computacional integrado é desenvolvido neste artigo e combina AMFIP com análise de imagem digital e microscopia de força de tração celular. O sistema permite a elucidação da distinta mecanobiologia YAP em linhas celulares B2B normais (Figura 1) e pc9 (Figura 2) projetadas por CRISPR/Cas9. O sistema fornece à comunidade científica uma solução abrangente que evita a demanda de compra de dispositivos de controle adicionais que podem não estar disponíveis e/ou compatíveis com todos os sistemas de imagem.
Os protocolos apresentados neste artigo introduzem como (1) aplicar a AMFIP para realizar imagens automáticas de longo prazo para ambas as linhas celulares projetadas pelo CRISPR/Cas9 que expressam o YAP com etiqueta mNEonGreen2; e (2) combinam Fiji ImageJ, MATLAB e Origin para a análise quantitativa da razão YAP nuclear/citoplasma (N/C) com base em sua intensidade fluorescente (Figura 3 e Figura 4), campo de deslocamento celular (Figura 1C e Figura 2C) e campo de tração celular (Figura 1D e Figura 2D ). Os resultados sugerem que (1) durante as primeiras 10h de disseminação celular nos substratos que possuem rigidez mecânica fisiologicamente relevante13,14,15,16,17,18, a razão YAP N/C de células B2B únicas apresenta variação e flutuação mais perceptível dependente do tempo em comparação com a de células PC9 únicas (Figura 5 e Figura 6 ); e (2) células cancerígenas PC9 geram tração perceptível em suas regiões peri-nucleares (Figura 7). O sistema integrado e as metodologias descritas neste protocolo transcendem os tipos específicos de células e moléculas optogenéticas. Os pesquisadores podem aplicar os protocolos para personalizar seus experimentos específicos de interrogatório em células vivas e elucidar dinâmicas de sinalização multifacetadas no contexto da fisiologia celular e patologia.
Protocolo
1. Geração de linha de células cancerígenas de pulmão humanas editadas por CRISPR/Cas9 (PC9) e linha de células epiteliais brônquias humanas (Beas2B) que expressam endógenamente mNeonGreen21-10/11-tagged proteína YAP
- Realize a reação em cadeia de polimerase (PCR) para amplificar a sequência de DNA codificando o 11º fio da proteína da fluorescência, mNeonGreen2, usando a polimerase de DNA de alta fidelidade (ver a Tabela dos Materiais).
- Knock-in a sequência de DNA amplificada no lócus genômico YAP das linhas celulares PC9 e B2B usando o sistema de edição de genes CRISPR-Cas9.
NOTA: Esta sequência de DNA complementa os fios 1-10 de mNeonGreen2 para emitir fluorescência. O mapa de sequência genômica de YAP-mNeonGreen21-10/11 é mostrado na Figura Suplementar S1. O mapa contém as sequências genômicas, doadoras e mNeonGreen2 rotuladas. - Verifique a expressão mNeonGreen2 projetada pelo CRISPR/Cas9 usando um microscópio de epifluorescência (veja a Tabela de Materiais). Como o mNeonGreen2 é marcado para YAP sempre que as células expressam YAP no contexto de sua rede reguladora genética nativa, verifique a presença da intensidade da fluorescência em ambas as células projetadas pelo CRISPR/Cas9 e compare-a com a das células parentais (controle).
NOTA: Para seguir este protocolo, use (1) um laser de 488 nm (47,5 mW/mm2) para excitação, (2) um objetivo de 40x (abertura numérica (NA) = 0,95) e um filtro de emissão de passe de banda (ET525/50 nm) para medição de fluorescência e (3) software ImageJ para medir, quantificar e comparar as intensidades de fluorescência. - Confirmar a integração correta do mNeonGreen211 extraindo DNA genômico das linhas celulares editadas pelo CRISPR/Cas9; executar PCR usando primers flanqueando a inserção genômica e sequenciamento para confirmar a inserção na loci 19,20 genômica correta.
- Derrube o mNeonGreen211 usando o sistema de edição de genes CRISPR/Cas9 e verifique a redução da intensidade da fluorescência nas células usando os mesmos sistemas de microscópio e parâmetros de imagem descritos na etapa 1.3.
NOTA: Esta etapa confirma a integração correta do mNeonGreen211 pela comparação das intensidades de fluorescência. As células projetadas pelo CRISPR/Cas9 sem knock-down e as células parentais são usadas como controle. - Colete as células com a proteína marcada de interesse através da classificação celular ativada por fluorescência (FACS).
- Para preparar células para a triagem FACS, tentesinizá-las e resuspensá-las em soro fisiológico tamponado com fosfato (PBS).
- Coletar células com fluorescência mNeonGreen2 acima do nível de fundo das linhas celulares parentais em duas rodadas enriquecedoras de classificação FACS.
NOTA: A linha do tempo para gerar as linhas de celular editadas pelo CRISPR/Cas9 descritas aqui está na ordem de 1 a 2 meses. Todas as linhas de celular são disponibilizadas publicamente mediante solicitação para que outros laboratórios de pesquisa possam reproduzir os resultados.
2. Manutenção de células PC9 e B2B
- Mantenha ambas as linhas celulares em incubadoras de cultura tecidual umidificada com 5% de CO2 a 37 °C.
- Cultura 106 etiquetadas endógenamente células PC9 e Beas2B em frascos de 75 cm2 com 12 mL de RPMI-1640 médio suplementado com soro bovino fetal de 10% e 100 μg/mL penicilina-estreptomicina. Subcultura ambas as linhas celulares quando a confluência celular atinge ~80%.
- Teste ambas as linhas de celular para mycoplasma a cada 3 meses usando um kit de detecção de mycoplasma, seguindo rigorosamente todos os protocolos recomendados pelo fabricante.
- Armazene as linhas de celular em um congelador de -80 °C.
- Use as linhas celulares que estão <20 passagens do degelo para todos os experimentos.
3. Configuração do ambiente de hardware e software
- Configuração do ambiente de hardware do experimento
- Conecte o controlador confocal e o microscópio invertido ao computador (veja a Tabela dos Materiais).
- Instale a plataforma de software (Tabela de Materiais).
- Ligue o controlador confocal e o microscópio invertido. Em seguida, lançar Elements.
- Abra os painéis de controle do confocal, laser e do microscópio invertido em Elementos. Em seguida, verifique se os três painéis funcionam corretamente testando o movimento do estágio motorizado, a comutação dos objetivos do microscópio e a varredura espacial das linhas laser.
- Configuração do ambiente de software do AMFIP
- Instale o IntelliJ, Java Development Kit 14.0, μManager versão 2.0 gamma e Fiji ImageJ no computador.
- Abra o projeto AMFIP baixado do GitHub (link: https://github.com/njheadshotz/AMFIP) no IntelliJ.
- Clique em Configurações | | de compilação Processadores de anotação e verifique Ativar processamento de anotação.
- Clique em | de Estrutura de Projetos Artefatos e criar um arquivo JAR. Defina o diretório de saída para mmplugins sob o diretório μManager .
- Clique em | de Estrutura de Projetos Bibliotecas e adicionar mmplugins e plugins sob o diretório μManager .
- Clique em adicionar Configuração no menu suspenso executar e criar um aplicativo.
- Entre ij. ImageJ para a classe principal.
- Digite -Xmx3000m -Dforce.anotação.index=true na opção VM.
- Defina o diretório μManager para o diretório work.
- Clique em Executar para ativar μManager com o plugin AMFIP.
- Conecte μManager com o microscópio invertido.
- Adicione o driver adaptativo do microscópio invertido21 ao diretório μManager .
- Abra μManager. Clique em Dispositivos | Assistente de configuração de hardware e criar uma nova configuração.
- Adicione o driver Ti2 em Dispositivos Disponíveis.
- Selecione todos os dispositivos periféricos e salve o novo arquivo de configuração.
- Reinicie μManager e selecione o arquivo de configuração na etapa 3.2.4 na configuração de inicialização do Micro-Manager.
4. Preparação do gel
- Trate a tampa de vidro com 3-aminopropiltrymethoxysilane por 7 minutos à temperatura ambiente (24 °C).
- Use água deionizada (DI) para enxaguar a tampa de vidro e secar a tampa por 20 min a 160 °C.
- Trate a tampa de vidro com 0,5% de glutaraldeído por 30 min e enxágue com água DI.
- Misture a solução de acrilamida, solução N,N'-metilenebisacrylamida (bis) e contas fluorescentes suspensas em soro fisiológico tampão hepes de 10 mM. Utilize 10% (p/v) solução de persulfeto de amônio e N,N,N′,N'-tetrametilenediamina (TEMED) como iniciadores de polimerização. Altere a porcentagem de cada componente para alcançar a rigidez mecânica desejada dos hidrogéis de poliacrilamida (PAA) seguindo protocolos estabelecidos descritos anteriormente13,14.
NOTA: Neste protocolo, gel de 2 kPa: acrilamida = 12,5% e bis-acrilamida = 6,5%; Gel de 5 kPa: acrilamida = 12,5% e bis-acrilamida = 21,5%; e gel de 40 kPa: acrilamida = 12,5% e bis-acrilamida = 31,5%. Todos os % listados são porcentagem de volume. - Após 35 min, descasque a tampa de vidro do hidrogel PAA solidificado e lave o hidrogel com soro fisiológico tamponado hepes de 50 mM duas vezes (5 min cada vez).
- Trate a superfície do hidrogel com uma solução de hidrazina-hidrato por 6 h.
- Enxágüe o hidrogel com ácido acético por 30 minutos. Retire o ácido acético e enxágue com PBS por 30 minutos.
- Oxidar a solução de fibronectina (50 μg/mL em PBS) com periodato de sódio por 30 min.
- Cubra a superfície do hidrogel com a solução de fibronectina oxidada e espere por 35 min.
- Adicione PBS para imergir o hidrogel e armazene a 4 °C. Cubra todas as placas de Petri que contenham os hidrogéis com papel alumínio para evitar qualquer exposição à luz aos hidrogéis.
5. Cultura celular
NOTA: Realize a cultura celular utilizando técnica asséptica.
- Conecte as tampas de vidro com os hidrogéis PAA à placa de Petri de fundo de vidro de 35 mm para evitar a deriva física dos géis durante os processos de semeadura celular e imagem.
- Usando pinças limpas esterilizadas, levante o deslizamento (com o hidrogel PAA em cima) da placa de Petri contendo os géis preparados.
- Use uma limpeza a seco para limpar gotículas de água na superfície inferior da mancha de vidro.
- Use a pinça esterilizada para segurar a tampa de vidro.
- Coloque pequenas gotículas (1-5 μL) de cola cianoacrilato nos dois cantos diagonais na superfície inferior.
- Use lenços esterilizados para remover o excesso de cola.
- Use as pinças esterilizadas para substituir o deslizamento de tampas na placa de Petri de fundo de vidro. Pressione ligeiramente os cantos da tampa para garantir que as gotículas de cola façam contato total com a superfície da placa de Petri.
- Coloque a tampa de volta na placa de Petri para minimizar a evaporação do PBS nos hidrogéis PAA. Aguarde 3 minutos para permitir que a cola se solidifique e seque na placa de Petri.
- Encha a placa de Petri com 4 mL de PBS.
- Repita as etapas acima 5.1.1-5.1.8 para as amostras restantes de hidrogel PAA nas placas de Petri utilizadas para imagem.
- Use 75% de etanol para esterilizar a superfície externa de todas as placas de Petri e transferi-las para o armário de biossegurança da cultura tecidual. Ligue a luz ultravioleta por 5 minutos e esterilize as amostras.
- Semear as células na superfície superior do gel.
- Desligue a luz ultravioleta. Retire o frasco (contendo células B2B/PC9) da incubadora de 37 °C para o armário de biossegurança. Use uma pipeta conectada a uma bomba de vácuo para aspirar todo o meio de cultura e adicionar 5 mL de PBS para lavar o frasco.
- Adicione 2 mL de 0,05% de trippsina para separar as células da parte inferior do frasco.
- Coloque o frasco na incubadora. Espere por 5 min.
- Transfira o frasco para o armário de biossegurança. Adicione 8 mL de cultura fresca ao frasco e pipeta para cima e para baixo várias vezes para suspender as células de forma homogênea.
- Transfira todos os 10 mL da suspensão celular para um tubo de 15 mL e centrífuga a 300 × g por 5 min.
- Verifique a pelota da célula na parte inferior do tubo. Incline lentamente o tubo horizontalmente e use a pipeta aspirante para remover todo o meio de cultura do tubo sem tocar na pelota celular. Em seguida, adicione 8 mL de cultura fresca média e pipeta para cima e para baixo várias vezes até que todas as células sejam misturadas de forma homogênea com o meio.
- Deposite 100 μL da suspensão celular (150 células/μL) na superfície do gel e espere por 5 min. Em seguida, adicione lentamente 4 mL de cultura fresca ao petri pratos; evite adicionar o meio fresco diretamente no gel.
- Coloque a placa de Petri na incubadora de 37 °C. Aguarde para permitir que as células se conectem à superfície do gel (B2B: 0,5-1 h; PC9: 4-5 h).
6. Imagem celular
NOTA: A AMFIP permite imagens automáticas, multicanais e de longo prazo, coordenando com diferentes sistemas de hardware e software: (1) O AMFIP manipula o μManager para mover automaticamente o estágio motorizado do microscópio Ti2-E para vários campos de visão (FOVs) e adquirir imagens de campo brilhante através de uma câmera monocromática (Tabela de Materiais); e (2) O AMFIP ativa vários arquivos macro dentro de Elements com um script Java personalizado para realizar operações automáticas para imagens de pilha z confocal e a comutação de diferentes canais laser (405 nm e 488 nm).
- Defina o ambiente para imagens de longo prazo.
- Coloque a câmara ambiental sobre o estágio motorizado do microscópio invertido. Ajuste a vazão de CO2 para 160 mL/min e ajuste a temperatura da câmara (superior: 44 °C; banho: 42 °C; etapa: 40 °C). Em seguida, adicione 40 mL de água purificada no banho da câmara.
- Retire a placa de Petri com células da incubadora e coloque-a na câmara do ambiente.
- Ligue o controlador confocal e o microscópio invertido. Alterne o caminho da luz para a direita e observe as células anexadas usando μManager. Se células suficientes tiverem se ligado ao gel, transfira a placa de Petri de volta para a incubadora. Se não houver células suficientes ligadas ao gel, continue a incubação celular por mais 30 minutos para células B2B e 60 min para células PC9.
- Corte dois pequenos pedaços de fita adesiva e coloque-os na câmara ao redor do buraco circular. Em seguida, aplique um pouco de cola adesiva na fita (apenas na área que a placa de Petri cobrirá).
- Tire a placa de Petri da incubadora. Em seguida, coloque lentamente a placa de Petri na câmara e deixe o fundo da placa fazer contato com a cola.
- Pressione a tampa da placa de Petri por 1 minuto para permitir que a cola faça contato total com a placa de Petri e solidifique. Em seguida, empurre suavemente a placa de Petri horizontalmente para confirmar que a placa de Petri é imóvel na câmara.
- Feche a tampa da câmara.
- Defina os parâmetros de aquisição de imagens para imagens de campo brilhante.
- Abra o IntelliJ e defina um parâmetro T1 (por exemplo, 120 s) na linha 93 do arquivo Elements_script.java. Certifique-se de que esse valor seja maior do que o tempo de execução da macro em Elementos utilizados para a imagem confocal de um campo de visão (FOV). Clique no botão Executar para iniciar o projeto AMFIP IntelliJ.
- Clique no botão Live e Multi-D Acq. na interface principal do μManager. Em seguida, alterne o caminho de luz do microscópio invertido para a direita para imagens de campo brilhante, mude para o objetivo de 10x e abra a luz do diodo emissor de luz (LED) (a fonte de luz para imagens de campo brilhante; intensidade: 5%).
- Clique no caminho da luz, objetivo do microscópio e botão de lâmpada LED no Painel Elementos Ti2 ou pressione manualmente os botões correspondentes no microscópio.
- Ajuste o joystick XY e o botão do plano Z para encontrar a posição correta e o plano em foco do gel na placa de Petri. Use um objetivo de 10x para encontrar os FOVs apropriados de várias células únicas ligadas ao gel.
- Verifique a caixa Várias Posições (XY) na janela Aquisição Multidimensional . Clique no botão Editar lista de posição... e observe a janela Lista de posição do palco que aparece. Em seguida, altere o objetivo para 40x, aumente a intensidade da luz LED para 15%, reajustar o estágio motorizado XY para localizar os FOVs e gravar as coordenadas clicando no botão Marcar na janela Lista de Posição do Palco .
- Registo 67 FOVs desejados. Clique no botão Salvar como... na janela Lista de posição do palco para gravar as coordenadas. Entrada T1 (parâmetro, por exemplo, 120 s, definido na etapa 6.2.1) no intervalo de tempo de aquisição de imagens para T1 na seção Pontos de Tempo na janela aquisição multidimensional .
- Defina a aquisição de imagens para imagens 2D-YAP e contas.
- Abra elementos, altere o caminho da luz para a direita para imagens confocal e desligue a luz LED. Em seguida, clique no botão Remover intertravamento e ligue o canal laser FITC (para imagem YAP) verificando a caixa FITC .
- Ajuste a velocidade de digitalização para 1 quadro por 2 s clicando no botão 1/2 e gire o botão do plano Z para encontrar a posição Z das células anexadas rapidamente. Regissua os limites inferiores e superiores para a pilha Z.
- Clique em Macro na fita superior, selecione Editor de macro no menu suspenso do Macro e insira os valores da etapa 6.3.2 em um arquivo macro.
- Ligue o canal laser 4′,6-diamidino-2-phenylindole (DAPI) (para imagem de contas) verificando a caixa DAPI para encontrar e registrar a posição Z focada das contas. Vá para o editor Macro e insira os valores registrados no arquivo macro.
- Defina a tarefa de mover o estágio motorizado usando AMFIP.
- Vá para μManager e clique em Plugins | Automação para abrir a interface gráfica do usuário (GUI) do AMFIP. Clique em Adicionar botões de ponto ou remover pontos para adquirir o número exato de FOVs selecionados. Insira as coordenadas gravadas de FOVs no Painel de Coordenadas.
- Defina o tempo total de experiência no campo de texto Total Experiment Time .
- Clique no botão Configuração de Tempo Adicional e defina o intervalo de tempo T2 (por exemplo, 30 min) de mover o estágio motorizado para cada FOV.
- Maximize o tamanho da janela dos elementos e arraste a GUI de AMFIP para o lado direito da tela para evitar que a GUI perturna as operações automáticas do cursor.
- Clique no botão Entrar . Após o primeiro término de macro, clique no botão Adquirir! na janela Aquisição Multidimensional .
- Dissolva as células após a aquisição da imagem.
- Depois de terminar a imagem de longo prazo, pare a tarefa AMFIP clicando no botão Pausa na janela do plugin de automação e no botão Stop na janela Aquisição Multidimensional .
- Abra elementos e defina imagens de pilha de Z clicando nos botões Superior e Inferior na janela ND Acquisition (defina o intervalo Z para ser maior que o intervalo Z das contas). Mude o caminho da luz para a direita e abra a luz LED (intensidade: 15%).
- Devagar e cuidadosamente remova as tampas da câmara e da placa de Petri. Enquanto isso, monitore a visão de campo brilhante para qualquer deriva do FOV.
- Usando uma pipeta plástica para pegar 0,5 mL de solução de sulfato de dodecyl de sódio (SDS), segure cuidadosamente a pipeta plástica um pouco acima do meio de cultura na placa de Petri e adicione 1-2 gotículas da solução SDS no meio da cultura.
- Uma vez que as células na visão de campo brilhante sejam dissolvidas, alterne o caminho da luz para a esquerda, feche a luz LED, clique no botão Remover intertravamento .
- Execute a imagem da pilha Z. Salve a pilha de imagens e nomeie-a como Reference_N (N é o número de sequência de cada FOV).
- Clique no botão Várias Posições (XY) na janela Aquisição Multidimensional . Em seguida, selecione o próximo FOV e clique no botão Ir ao botão para mover o estágio motorizado para o segundo FOV.
- Repita o passo 6.5.7 para cada FOV.
7. Medição da razão YAP N/C
- Realize a análise de imagem para medir a razão YAP N/C usando o software Fiji ImageJ (Figura 4).
- Abra Fiji ImageJ. Importe a pilha de imagens de campo brilhante para todos os FOVs adquiridos pelo μManager.
- Abra o menu suspenso da imagem e selecione Stacks | Ferramentas | Slice Keeper. Em seguida, exporte a pilha de imagens de campo brilhante para cada FOV.
- Importe a imagem de fluorescência do canal FITC e sobreponha-a com a imagem de campo brilhante para o mesmo FOV. Para isso, escolha a imagem fluorescente e selecione Sobreposição | Adicione imagem... (Imagem a adicionar: a imagem de campo brilhante; A localização de X e Y depende do tamanho da imagem de campo brilhante adquirida por diferentes câmeras; Opacidade: 60-70).
- Abra o menu suspenso analisar e selecione Definir medidas.... Selecione Área; Densidade integrada e valor cinza médio.
- Clique no botão seleções Freehand na interface principal do ImageJ.
- Desenhe o contorno do corpo celular e do núcleo desejado. Em seguida, clique em Analisar | Meça ou pressione o botão M no teclado.
- Observe a janela Resultados que aparece. Observe que os valores sob a coluna Área representam a área da região selecionada (μm2) e os valores sob a coluna IntDen representam a intensidade de fluorescência da região selecionada.
- Calcule a razão YAP N/C utilizando as seguintes fórmulas (1), (2) e (3):
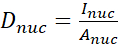 (1)
(1)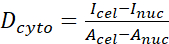 (2)
(2)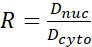 (3)
(3)
Onde o Inuc e o Icel representam a intensidade relativa do núcleo e do corpo celular, e Anuc e Acel representam a área do núcleo e do corpo celular. R é a razão YAP N/C. - Guarde os contornos para o cálculo futuro da força de tração do dipolo e do deslocamento peri-célula/peri-nuclear. Para fazer isso, clique em Analisar | Ferramentas | Salve coordenadas XY...
8. Medição do campo de tração
- Aplique microscopia de força de tração através de plugins Fiji ImageJ22,23.
- Abra Fiji ImageJ.
- Importe a pilha de contas de imagem para um FOV.
- Selecione a fatia que mostra a distribuição mais clara das contas e extraia-a clicando em Imagens | Pilhas | Ferramentas | Slice Keeper.
- Importe a pilha de imagens da referência para o mesmo FOV.
- Escolha a fatia com o mesmo brilho e contraste que a fatia na etapa 8.1.3. Em seguida, extraia-o como uma imagem de referência.
- Selecione Imagens | Pilhas | Ferramentas | Concatenar para combinar as duas fatias das etapas 8.1.3 e 8.1.5 (selecione a imagem de referência como a primeira fatia).
- Selecione Plugins | Correspondência de modelos | Alinhe fatias na pilha ou plugins | Estabilizador de imagem para alinhar as duas fatias.
- Selecione | de imagem Pilhas | Stack to Images. Em seguida, selecione | de imagem Tabelas de procura | Verde para converter a cor da primeira fatia em verde e selecionar Imagem | Tabelas de procura | Vermelho para converter a cor da segunda fatia em vermelho.
- Selecione | de imagem | de cor Mescle canais para mesclar as duas imagens.
- Sobreponha a imagem com a imagem de campo brilhante do mesmo FOV e use esta imagem sobreposta para observar o deslocamento das contas.
- Selecione Plugins | piv | PIV iterativo (Básico).... Ajuste o tamanho da janela de interrogatório para 128/256; 64/128; 32/64 (pelo menos quatro contas por janela de interrogatório). Defina o limiar de correlação para 0,6.
- Clique em OK. Após o término do cálculo, salve o arquivo de texto com os dados brutos do deslocamento de contas em uma pasta comum criada pelo usuário.
- Selecione Plugins | | FTTC FTTC e escolha o arquivo de texto na etapa 8.1.9.
- Insira o tamanho do pixel (μm), o módulo do Jovem do gel (Pascal), e a largura e altura da trama com base no experimento e na imagem das contas.
- Clique em OK para salvar automaticamente o arquivo de texto contendo os dados brutos da força de tração no mesmo diretório que o arquivo de texto na etapa 8.1.12.
- Use software de grafagem (Tabela de Materiais) para traçar o campo de tração com a mesma escala para múltiplas células (Figura 1B,C e Figura 2B,C).
- Insira o arquivo de texto que contém os dados brutos de tração em uma planilha.
- Crie uma nova folha, insira as coordenadas Y de tração na primeira linha (organize de valores altos a valores baixos) e as coordenadas X na primeira coluna (organize de baixo a alto).
- Insira o valor da tração para cada coordenada a partir dos dados brutos.
- Salve a folha na etapa 8.2.2 como um arquivo *.csv.
- Origem Aberta.
- Clique em | de Arquivo Abra e importe o arquivo *.csv na etapa 8.2.4. Selecione todas as células e clique em Plot | Contorno| Contorno - Preenchimento de cores.
- Na plotting: plotvm window, selecione Y através das colunas para definir automaticamente os valores Y para a primeira linha e valores X para a primeira coluna. Em seguida, nomeie o título e clique em OK.
- Na janela de gráfico que aparece, clique duas vezes no mapa de aquecimento.
- Clique em Levels in the Colormap/Contours window. Em seguida, altere o nível de escala para uma faixa razoável (0300 nesta análise) e clique em OK.
- Clique em Linhas, desmarque mostrar apenas nos principais níveis e verifique Ocultar tudo. Em seguida, clique em OK.
- Clique com o botão direito do mouse no gráfico e selecione Gráficos de Exportação.... Salve a imagem no caminho especificado.
- Use o MATLAB para calcular a tração celular do dipolo.
- Salvar o arquivo de texto de dados brutos de tração (da etapa 8.1.12) e a região de interesse da célula (ROI) coordena o arquivo (a partir da etapa 7.1.9) na mesma pasta definida na etapa 8.1.12. Transfiram todos os arquivos MATLAB que estão no pacote AMFIP para esta pasta.
- Abra o MATLAB. Abra a pasta definida na etapa 8.1.12 e abra o arquivo de função de tração do dipolo.m transferido para esta pasta na etapa 8.3.1.
- Leia os dois arquivos text/csv na etapa 8.3.1 no espaço de trabalho DO MATLAB e atribua uma matriz a duas variáveis (por exemplo, tração e roi).
- Execute a função absdiple (tração,roi).
NOTA: A primeira coluna da saída é a força de tração do dipolo em nN (nano-Newton). A segunda coluna da saída é o ângulo da força de tração do dipolo em relação ao eixo horizontal.
Resultados
Distribuição e dinâmica yap distintas no câncer PC9 projetado por CRISPR/Cas9 e células normais B2B durante a disseminação celular
Imagens representativas de fluorescência da distribuição yap em células B2B e PC9 únicas em 2, 5, 40 kPa Géis PAA e deslizamento de tampa de vidro são mostrados na Figura 1A e Figura 2A. A localização nuclear de YAP em células B2B aumentou com o aumento da rigidez do substrato (Figura 1A), enquanto as células PC9 apresentaram concentração de YAP semelhante no núcleo e citoplasma em substratos de rigidez variada (Figura 2A). Imagens representativas de fluorescência da distribuição yap em células únicas, espalhando células B2B e PC9 no substrato de hidrogel de 5 kPa (do 0º h ao 10º h após as células ligadas aos substratos) são mostradas na Figura 1B e Figura 2B, respectivamente. A célula B2B aumentou monotonicamente a área de disseminação ao longo do tempo, juntamente com uma diminuição na razão YAP N/C (Figura 1B), enquanto a célula PC9 manteve uma área de difusão celular comparativamente imutável, orientação e razão YAP N/C durante todo o processo de disseminação de 10 horas (Figura 2B). Durante a duração de 10 horas de disseminação precoce, a célula B2B representativa deformou constitutivamente a superfície do substrato e aplicou tração celular em evolução de tempo em toda a área celular (Figura 1C e Figura 1D).
Em contraste, a célula PC9 representativa só desenvolveu deslocamento e tração nas duas extremidades do corpo celular e sua tração diminuiu após 7,5 h (Figura 2C e Figura 2D). Mais imagens de lapso de tempo e medidas de tração de células B2B e PC9 no estágio de disseminação inicial são fornecidas em Figura Suplementar S2 e Figura Suplementar S3. Outros modos de dinâmica celular PC9 também foram observados (Figura 6). Paralelamente a essas diferentes características de disseminação, as células B2B e PC9 apresentaram distribuição e dinâmica yap distintas (Figura 3). Em um gel de 5 kPa, o YAP em células B2B concentrou-se no núcleo no 0º h e tornou-se mais homogeneamente distribuído pelo corpo celular no décimo h. No entanto, as células PC9 apresentaram uma distribuição mais homogênea de YAP no núcleo e o citoplasma durante todo o processo de disseminação. Para analisar quantitativamente a atividade yap e translocação em células B2B e PC9, a razão YAP N/C foi calculada utilizando-se o algoritmo descrito na Figura 4.
Para investigar melhor a dinâmica distinta do YAP, foram comparadas alterações temporais na razão YAP N/C, área celular/núcleo e tração de múltiplas células B2B únicas (n = 10) e células PC9 (n = 5) (Figura 5). Verificou-se que a razão média YAP N/C das células B2B diminuiu de 2,54 ± 0,22 para 1,79 ± 0,21 (n = 10; p = 0,0022*; Figura 5A), enquanto a razão média YAP N/C das células PC9 passou de 1,92 ± 0,26 para 1,57 ± 0,07 (n = 5; p = 0,187 (não significativo (ns)); Figura 5A). A tração média do dipolo das células B2B passou de 256,17 ± 123,69 nN para 287,44 ± 99,79 nN (p = 0,7593 (ns); Figura 5B). A tração média de dipoles das células PC9 passou de 141,19 ± 33,62 nN para 168,52 ± 73,01 nN (p = 0,7137 (ns); Figura 5B). A área média de disseminação celular das células B2B aumentou de 613,89 ± 102,43 μm2 para 942,51 ± 226,71 μm2 (p = 0,0512 (ns); Figura 5C).
A área média de disseminação celular das células PC9 passou de 495,78 ± 97,04 μm2 para 563,95 ± 89,92 μm2 (p = 0,5804 (ns); Figura 5C). A área média de disseminação do núcleo das células B2B aumentou de 181,55 ± 36,18 μm2 para 239,38 ± 43,12 μm2 (p = 0,1217 (ns); Figura 5D) e a área média de disseminação do núcleo das células PC9 passou de 133,31 ± 30,05 μm2 para 151,93 ± 22,49 μm2 (p = 0,5944 (ns); Figura 5D). Esses resultados sugerem que (1) as células B2B apresentam uma razão YAP N/C dependente da rigidez constitutivamente substrato; (2) a tração das células B2B é maior que a das células PC9; e (3) em contraste com as células B2B, as células PC9 apresentam um aumento limitado na área celular e alterações na razão YAP N/C durante o processo de disseminação de 10 horas.
Correlação da distribuição e dinâmica do YAP com os estados migratórios das células B2B
Foram comparadas a razão YAP N/C e a tração do dipolo de todas as células B2B (n=10) e PC9 (n=5) em função da área de disseminação celular e da área de propagação do núcleo. A razão YAP N/C e a tração do dipolo das células PC9 não se correlacionam claramente com suas pequenas faixas de área de abramonamento celular e núcleo (Figura 6). Em contraste, a razão YAP N/C e a tração do dipolo das células B2B pareciam seguir duas tendências distintas (Figura 6A e Figura 6C), sugerindo que poderia haver dois grupos de células B2B que coexistem neste experimento. No primeiro grupo, a razão YAP N/C e a tração do dipolo aumentam junto com o alargamento da área de abramonamento celular e atingem sua máxima em ~ 1000 μm2 (Figura 6C e Figura 6D, indicada pela linha tracejada amarela). No segundo grupo, a razão YAP N/C e a tração do dipolo aumentam a uma taxa mais lenta com o alargamento da área de propagação celular e mantêm valores quase constantes quando a área de propagação celular continua a aumentar (Figura 6C,D, indicada pela linha verde tracejada).
Células cancerígenas PC9 geram trações em regiões peri-nucleares
Células PC9 únicas, que espalham, deslocam os substratos nas regiões peri-nucleares, a partir da 6ªh de cultura (Figura 7C). Para visualizar o deslocamento peri-nuclear causado pela tração celular, sobrepomos as imagens de contas fluorescentes tiradas antes (vermelha) e depois (verde) da remoção das células dos substratos (veja a seção de protocolo para obter detalhes). As contas que não tiverem qualquer deslocamento aparecerão amarelas nas imagens sobrepostas, ou seja, a adição das cores vermelha e verde. Em contraste, as contas que são deslocadas de suas posições de descanso devido à tração celular mostrarão cores separadas verde e vermelha.
Notavelmente, tanto nas células PC9 (Figura 7C,D) quanto em B2B (Figura 7E), observou-se deslocamento de contas no citoplasma e dentro do núcleo, além daquelas no limite celular. Para destacar o deslocamento peri-nuclear, a equação boussinesq da teoria linear-elasticidade é usada para prever o deslocamento teórico 2D gerado por uma força de dipolo hipotética no limite celular (linha tracejada preta na Figura 7B)24. Comparando esta curva teórica com o deslocamento real do substrato medido ao longo do mesmo eixo (linha traço branca na Figura 7D), os deslocamentos reais dentro do núcleo foram encontrados como 1,5-8 vezes maiores do que o valor teórico (Figura 7B), indicando a existência de força de tração nas regiões peri-nucleares.

Figura 1: Alterações na expressão/distribuição yap, campo de deslocamento de substrato e campo de tração de uma célula normal B2B em substratos de rigidez variada e durante a propagação precoce. (A) A expressão YAP de uma célula B2B semeada em 2, 5 e 40 kPa PAA géis e um deslizamento de tampa de vidro após 60 h de fixação inicial de célula-substrato. (B) A célula B2B foi semeada em um gel PAA de 5 kPa e visualizada acima de 10 h após o apego inicial do substrato celular. A expressão YAP é representada pela intensidade da fluorescência verde. Nota: A intensidade yap dentro do núcleo diminui gradualmente, mas permanece maior do que a do citoplasma ao longo do tempo. As barras de cor indicam os níveis de expressão YAP (verde = alta expressão; preto = baixa expressão) em (A) e (B). (C) A deformação do substrato (sobreposta com a imagem de campo brilhante) no local da célula é representada pelo campo de deslocamento em cada ponto de tempo. A direção e a magnitude de deslocamento são mostradas pela direção e cor da seta, respectivamente. O deslocamento torna-se maior nas extremidades do corpo celular B2B à medida que a área de propagação celular aumenta. A barra de cor indica magnitude de deslocamento (vermelho = alta magnitude; preto = baixa magnitude). (D) Campo de tração (sobreposto à imagem de campo brilhante) calculado a partir do campo de deslocamento. A tração está concentrada no limite das células B2B. Os contornos pontilhados brancos e amarelos delineiam os limites da célula e do núcleo, respectivamente. A barra de cor indica magnitude de tração (carmesim = alta magnitude; preto = baixa magnitude). Barras de escala = 20 μm. Abreviaturas: YAP = Proteína associada a sim; PAA = poliacrilamida. Clique aqui para ver uma versão maior desta figura.
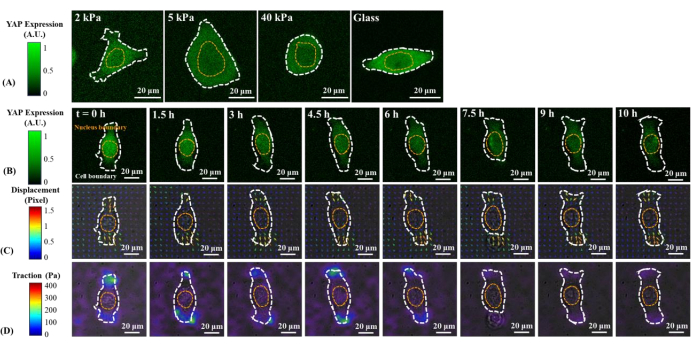
Figura 2: Alterações na expressão/distribuição yap, campo de deslocamento de substrato e campo de tração de uma célula cancerígena PC9 em substratos de rigidez variada e durante a disseminação precoce. (A) A expressão YAP de uma célula PC9 semeada em 2, 5 e 40 kPa Géis PAA e deslizamento de vidro após 65 h do acessório inicial de substrato celular. (B) A célula PC9 foi semeada em um gel PAA de 5 kPa e visualizada acima de 10 h após o apego inicial do substrato celular. A expressão YAP é representada pela intensidade da fluorescência verde. Nota: O platô de intensidade YAP é de 1,5 h em diante. As barras de cor indicam os níveis de expressão YAP (verde = alta expressão; preto = baixa expressão) em (A) e (B) Deformação de substrato (sobreposta com a imagem de campo brilhante) no local da célula é representada pelo campo de deslocamento fluorescente de contas em cada ponto de tempo. A direção e a magnitude de deslocamento são mostradas pela direção e cor da seta, respectivamente. O campo de deslocamento causado pelas células PC9 é menor do que o causado pela célula B2B. Ao longo do processo de disseminação de 10 horas, a área de células PC9 permanece quase constante. A barra de cor indica magnitude de deslocamento (vermelho = alta magnitude; preto = baixa magnitude). (D) Campo de tração (sobreposto com a imagem de campo brilhante) calculado a partir do campo de deslocamento. A tração gerada por esta célula PC9 representativa diminui gradualmente da 6ª h para a 10ª h. Os contornos pontilhados brancos e amarelos delineiam os limites da célula e do núcleo, respectivamente. A barra de cor indica magnitude de tração (carmesim = alta magnitude; preto = baixa magnitude). Barras de escala = 20 μm. Abreviaturas: YAP = Proteína associada a sim; PAA = poliacrilamida. Clique aqui para ver uma versão maior desta figura.

Figura 3: Distribuição YAP em células B2B e PC9 no estágio de disseminação inicial. (A) Intensidade YAP da célula B2B é medida ao longo do eixo vermelho atribuído no 0º e 10º h. (B) No 0º h, a intensidade de YAP mostra diferenças dramáticas de concentração entre o núcleo e o citoplasma. Na 10ª h, a intensidade yap torna-se mais homogênea em todo o corpo celular. (C) Intensidade YAP da célula PC9 é medida ao longo do eixo azul atribuído no 0º e 10º h. (D) No 0º h, a intensidade de YAP no núcleo aparece maior do que na citoplasma, embora a diferença não seja tão notável quanto a das células B2B. Na 10ª h, a intensidade yap no núcleo ainda aparece ligeiramente maior do que na citoplasma, com uma tendência de variação semelhante à da 0ª h. Barras de escala = 20 μm (A, C). Abreviação: YAP = Proteína associada a sim. Clique aqui para ver uma versão maior desta figura.

Figura 4: Medindo a razão YAP N/C. (1) Aplique o Fiji ImageJ para desenhar o contorno do núcleo e medir sua área projetada 2D Anuc. (2) Meça a intensidade da fluorescência dentro do núcleo Inuc. (3) Desenhe o contorno do corpo celular e meça sua área projetada Acel. (4) Meça a intensidade da fluorescência dentro da célula Icel. (5) Calcule a densidade do núcleo YAP Dnuc, a densidade do citoplasma YAP Dcyto e sua razão R: Dnuc=Inuc/Anuc; Dcyto=(Icel-Inuc)/(Acel-Anuc); R=Dnuc/Dcyto. A barra de cor indica os níveis de expressão YAP (verde = alta expressão; preto = baixa expressão). Barra de escala = 20 μm. Abreviaturas: YAP = Proteína associada a sim; N = núcleo; C = citoplasma. Clique aqui para ver uma versão maior desta figura.
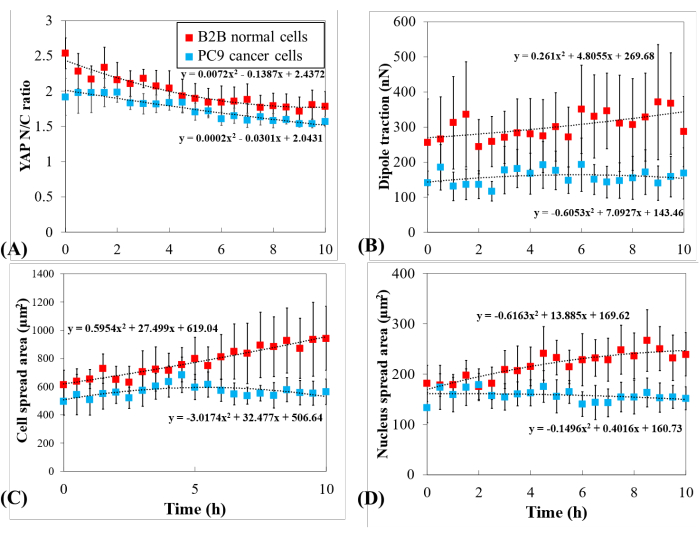
Figura 5: Expressão YAP distinta, morfologia celular/núcleo e tração celular no câncer PC9 e células normais B2B durante a disseminação celular. (A) Variação da relação YAP N/C durante as primeiras 10h de propagação de células únicas. A razão média YAP N/C das células B2B (coluna vermelha; n = 10) passou de 2,54 ± 0,22 para 1,79 ± 0,21 (n = 10; p = 0,0022**) enquanto a razão média YAP N/C das células PC9 (coluna azul; n = 5) passou de 1,92 ± 0,26 para 1,57 ± 0,07 (p = 0,187 (ns)). (B) A tração média do dipolo em função do tempo. A tração média do dipolo das células B2B passou de 256,17 ± 123,69 nN para 287,44 ± 99,79 nN (p = 0,7593 (ns)) e a tração média do dipolo das células PC9 passou de 141,19 ± 33,62 nN para 168,52 ± 73,01 nN (p = 0,7137 (ns)). (C) A área celular média em função do tempo. A área média de disseminação celular das células B2B aumentou de 613,89 ± 102,43 μm2 para 942,51 ± 226,71 μm2 (p = 0,0512 (ns)) e a área média de disseminação celular das células PC9 passou de 495,78 ± 97,04 μm2 para 563,95 ± 89,92 μm2 (p = 0,5804 (ns)). (D) A área média do núcleo em função do tempo. A área média de disseminação do núcleo das células B2B aumentou de 181,55 ± 36,18 μm2 para 239,38 ± 43,12 μm2 (p = 0,1217 (ns)) e a área média de disseminação do núcleo das células PC9 passou de 133,31 ± 30,05 μm2 para 151,93 ± 22,49 μm2 (p = 0,5944 (ns)). Abreviaturas: YAP = Proteína associada a sim; N = núcleo; C = citoplasma; ns = não significativo. Clique aqui para ver uma versão maior desta figura.

Figura 6: Relação YAP N/C e força de tração do dipolo em função da área de propagação da célula e do núcleo. A razão YAP N/C e a tração do dipolo das células B2B (n=10) e pc9 (n=5) são calculadas da 6ª h ao 10º h após a fixação ao substrato. (A) Razão YAP N/C em função da área de disseminação celular. As razões YAP N/C das células B2B variam de 1,16 a 2,53, enquanto as razões YAP N/C das células PC9 variam de 1,27 a 1,88. A área de disseminação celular das células B2B varia de 391,94 μm2 a 1986,40 μm2. A área de disseminação celular das células PC9 varia de 284,46 μm2 a 830,12 μm2. (B) Relação YAP N/C em função da área de disseminação do núcleo. A área de disseminação do núcleo das células B2B varia de 107,09 μm2 a 514,28 μm2. A área de disseminação do núcleo das células PC9 varia de 58,03 μm2 a 259,65 μm2. Tração dipolo de células B2B em função da área de propagação celular (C) e da área de propagação do núcleo (D). As células B2B disseminadas e não migratórias apresentam maior tração (de 47,50 nN a 1051,48 nN) com célula inferior e área do núcleo. Ao se espalhar e migrar, as células B2B apresentam menor tração (de 105,80 nN a 310,28 nN) com faixas maiores de células e áreas de núcleo. Abreviaturas: YAP = Proteína associada a sim; N = núcleo; C = citoplasma. Clique aqui para ver uma versão maior desta figura.
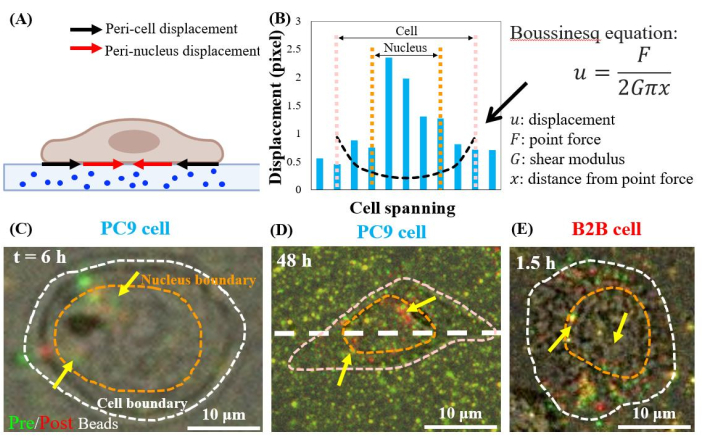
Figura 7: Deslocamento peri-nuclear em células B2B normais e câncer PC9. (A) Diagrama de visão lateral esquemática do deslocamento peri-nuclear e peri-célula medido a partir do deslocamento de contas no substrato. (B) O deslocamento do substrato sob a célula PC9 é medido ao longo do eixo celular (linha branca tracejada em 7D). O deslocamento teórico gerado pela força do dipolo no limite celular é mostrado pela equação de Boussinesq (curva tracejada preta). (C) e (D) Imagens de contas fluorescentes sobrepostas com células (vermelhas) e sem (verde) para as células PC9 na 6ª h após a fixação (visão superior). As contas amarelas (sobreposição exata das cores vermelha e verde) não indicam nenhum deslocamento. As contas verdes e vermelhas separadas (apontadas por setas amarelas) representam o deslocamento peri-nuclear. Setas amarelas indicam esses pontos peri-núcleo contraídos localizados na periferia do núcleo. (E) Deslocamento peri-nuclear gerado pela célula B2B a 1,5ª h após a fixação do substrato celular. Barras de escala = 10 μm (C–E). Clique aqui para ver uma versão maior desta figura.
Figura suplementar S1: O mapa de sequência genômica de YAP-mNeonGreen21-10/11. Clique aqui para baixar este Arquivo.
Figura suplementar S2: Alterações na expressão/distribuição yap, campo de deslocamento de substrato e campo de tração de células normais B2B durante a disseminação precoce. (A, D, G, J, M) A célula B2B foi semeada em um gel PAA de 5 kPa e visualizada mais de 10 h após o anexo inicial do substrato celular. A expressão YAP é representada pela intensidade da fluorescência verde. Nota: A intensidade yap dentro do núcleo diminui gradualmente, mas permanece maior do que no citoplasma ao longo do tempo. As barras de cor indicam os níveis de expressão YAP (verde = alta expressão; preto = baixa expressão) em (A, D, G, J, M). (B, E, H, K, N) A deformação do substrato (sobreposta à imagem de campo brilhante) no local da célula é representada pelo campo de deslocamento em cada ponto de tempo. A direção e a magnitude de deslocamento são mostradas pela direção e cor da seta, respectivamente. O deslocamento torna-se maior na periferia do corpo celular B2B à medida que a área de propagação celular aumenta. As barras de cor indicam magnitude de deslocamento (vermelho = alta magnitude; preto = baixa magnitude) em (B, E, H, K, N). (C, F, I, L, O) Campo de tração (sobreposto com a imagem de campo brilhante) calculado a partir do campo de deslocamento usando microscopia de força de tração. A tração está concentrada na periferia das células B2B. As barras de cor indicam magnitude de tração (vermelho = alta magnitude; preto = baixa magnitude) em (C, F, I, L, O). Barras de escala = 20 μm. Abreviaturas: YAP = Proteína associada a sim; PAA = poliacrilamida. Clique aqui para baixar este Arquivo.
Figura suplementar S3: Alterações na expressão/distribuição yap, campo de deslocamento de substrato e campo de tração de células cancerígenas PC9 durante a disseminação precoce. (A, D, G, J) A célula PC9 foi semeada em um gel PAA de 5 kPa e visualizada mais de 10 h após o anexo inicial do substrato celular. A expressão YAP é representada pela intensidade da fluorescência verde. Nota: A intensidade yap dentro do núcleo diminui gradualmente, mas permanece semelhante ou ligeiramente inferior à do citoplasma ao longo do tempo. As barras de cor indicam os níveis de expressão YAP (verde = alta expressão; preto = baixa expressão) em (A, D, G, J). (B, E, H, K) A deformação do substrato (sobreposta à imagem de campo brilhante) no local da célula é representada pelo campo de deslocamento em cada ponto de tempo. A direção e a magnitude de deslocamento são mostradas pela direção e cor da seta, respectivamente. O deslocamento torna-se maior na periferia do corpo celular PC9 à medida que a área de propagação celular aumenta. As barras de cor indicam magnitude de deslocamento (vermelho = alta magnitude; preto = baixa magnitude) em (B, E, H, K). (C, F, I, L) Campo de tração (sobreposto com a imagem de campo brilhante) calculado a partir do campo de deslocamento. A tração está concentrada na periferia das células PC9. As barras de cor indicam magnitude de tração (vermelho = alta magnitude; preto = baixa magnitude) em (C, F, I, L). Barras de escala = 20 μm. Abreviaturas: YAP = Proteína associada a sim; PAA = poliacrilamida. Clique aqui para baixar este Arquivo.
Discussão
O processo de imagem (etapa 6.3) é fundamental para garantir que as imagens de fluorescência sejam de qualidade suficiente para produzir resultados de quantificação válidos. As imagens de z-stack de proteína fluorescente ou contas devem ter um z-range que é grande o suficiente para incluir as imagens em foco para todas as posições Z que a amostra abrange. Outro passo crítico é coletar as imagens de referência de contas fluorescentes após dissolver as células (etapa 6.5). Como as imagens de referência precisam ser tomadas nas mesmas posições na etapa 6.3, nenhum deslocamento relativo deve ser induzido entre a placa de Petri, a câmara de ambiente e o microscópio. Os investigadores que realizam a etapa de dissolução devem ter cuidado para remover a tampa da placa de Petri e garantir que a perturbação mecânica aplicada não seja grande o suficiente para alterar a localização da placa na câmara de ambiente.
As soluções são fornecidas abaixo para resolver alguns erros que podem ocorrer durante os experimentos. Se nenhuma macro for ativada após clicar em Enter na etapa 6.4, é mais provável que a área inferior esquerda da tela esteja ocupada por uma janela não-Elemento. Nesse caso, a área inferior esquerda da janela precisa ser limpa para que as macros possam ser ativadas em Elementos. Outro erro comum é que as imagens de campo brilhante parecem pretas. Este problema é causado por um intervalo de tempo insuficiente entre as aquisições de fluorescência e imagens de campo brilhante. Pequenos atrasos na contagem de tempo de imagem da fluorescência podem se acumular ao longo do tempo e causar atrasos consideráveis e interferir com a imagem de campo brilhante. Uma solução é ajustar a duração de um ciclo de imagem de todas as posições a ser menor do que (não igual a) o intervalo de tempo entre o início de movimentos consecutivos. Esta operação atualiza a contagem de tempo e elimina o erro cumulativo no início de cada ciclo de imagem.
Esta tecnologia de interrogatório totalmente óptica suporta (1) uma ampla gama de hardware/software, incluindo, mas não se limitando à Nikon, (2) diversos tipos de sistemas de hidrogel validados, incluindo gelatina, PEG, Matrigel e géis de colágeno I, e (3) a personalização programável com base em diferentes necessidades dos pesquisadores. No entanto, se alguma das funções de controle de nível inferior não estiver disponível a partir de um microscópio comercial, a personalização das funções usando o AMFIP se torna desafiadora. Outra limitação desta técnica é a deriva espacial da amostra tanto nos planos XY quanto em foco (Z). Embora essa limitação possa ser superada durante o pós-processamento das imagens, é essencial melhorar a função de foco automático para corrigir a deriva em tempo real das amostras. Essa melhoria aumentará o rendimento do processo de imagem e reduzirá o erro potencial causado pela deriva durante os experimentos.
Mechanotransdutores, como o YAP, podem servir como novos alvos terapêuticos para o desenvolvimento de terapias promissoras contra o câncer25,26,27. Dados emergentes sugerem que a YAP promove a proliferação e invasão de células cancerígenas. A translocação yap induzida pela mecânica do citoplasma para o núcleo ativa a transcrição de genes relacionados à migração celular, proliferação, invasão e apoptose, levando a comportamentos celulares aberrantes28,29,30,31. Este trabalho teve como objetivo explorar a correlação potencial da razão YAP N/C e da mecânica celular em duas linhas típicas de câncer de pulmão humano e células normais. Durante o período de disseminação celular de 10 h, as células PC9 apresentam concentrações semelhantes de YAP no núcleo e citoplasma (Figura 3D e Figura 5A). As células B2B apresentam maior concentração de YAP no núcleo do que no citoplasma (Figura 3C e Figura 5A). Essa relação encontrada durante o estágio de disseminação precoce é diferente da maioria dos achados publicados que comparam a concentração de YAP no núcleo entre células normais e cancerígenas. Embora não necessariamente em estágio inicial de disseminação, a maioria dos achados publicados mostram que o YAP está mais concentrado no núcleo das células cancerosas do que no núcleo das células normais27,28. Apenas um estudo sobre câncer de mama relatou uma exceção32 que mostra que o YAP está mais concentrado no citoplasma, o que concorda com nossas observações atuais feitas em células pc9 de câncer de pulmão. Para o melhor do conhecimento dos autores, este trabalho é o primeiro a mostrar uma menor proporção de N/C yap em uma linha de células cancerígenas de pulmão humana. Os autores afirmam que a razão para uma relação YAP N/C estável nas células PC9 pode ser devido à baixa variação na área de propagação celular/núcleo e tração nas células PC9 no estágio de disseminação precoce. A dissecção dos mecanismos moleculares subjacentes da baixa relação YAP N/C em células PC9 e B2B está em andamento.
Durante as primeiras 10 horas de propagação, essas duas linhas de células mostram uma relação distinta entre a razão YAP N/C, tração celular e área de propagação (Figura 5). Para as células B2B, uma maior razão YAP N/C está correlacionada com uma área de disseminação de células e núcleos mais altas (Figura 6A,B), o que é consistente com os dados relatados de outras células normais33. Curiosamente, embora a tendência de desenvolvimento dessa relação seja geralmente encontrada em todas as células B2B registradas, dois graus diferentes (altos e baixos) dessa relação são encontrados. As células B2B que se espalham e migram simultaneamente mostram menor tração e maior área de disseminação celular e núcleo com maior proporção YAP N/C (2,05 ± 0,32). Para as células B2B que se espalham e permanecem no mesmo local, elas apresentam maior tração e área de propagação celular e núcleo inferior com uma menor razão YAP N/C (1,74 ± 0,21). Esses dois graus de relacionamento são demonstrados nos grupos de dados dispersos bifurcados (Figura 6C,D). Conforme relatado na literatura, células normais estacionárias, como as células do fibroblasto embrionário NIH 3T3, têm tração maior que as células migratórias34. Os dados relatados neste artigo sugerem que as células B2B disseminadas e não migratórias aplicaram tração maior do que a disseminação e migração de células B2B, provavelmente sugerindo que alta tração é necessária para que células não migratórias se estabilizem no substrato.
Além disso, esses dados mostram que as células B2B normais estacionárias geram uma força perinuclear maior, enquanto pesquisas anteriores realizadas por outros pesquisadores relataram apenas maior tração celular gerada na periferia de células estacionárias34,35,36,37. Os autores acham que a diferença na tendência intrínseca da migração nos experimentos pode causar esses resultados contraditórios. Nos experimentos publicados, a micropatters em forma quadrada foi usada para limitar a propagação e inibir a migração; se as células tinham a tendência de migrar é desconhecida. Como as células migratórias frequentemente mostram alta força de tração na periferia das células38, é provável que as células com tendência a migrar ainda mantenham alta tração periférica, mesmo que sua migração seja restrita. Neste presente estudo, as células estacionárias não são restritas por qualquer micropattern, mas não migram, indicando que as células tendem a manter seu estado não migratório. Outra possibilidade é que a forma celular definida pelo micropattern possa afetar a distribuição de aderências focais e forças de tração39. Os resultados deste estudo foram gerados sem qualquer micropatterning confinante e representam a distribuição de força das células estacionárias em sua forma original.
Para o melhor do conhecimento dos autores, apenas uma publicação até o momento relatou especificamente a descoberta de forças peri-nucleares em células normais (fibroblastos embrionários de camundongos), potencialmente causadas pela tampa de actina que abrange todo o núcleo40. A translocação yap citoplasma-núcleo está correlacionada com o aumento da força peri-nuclear40. Uma busca minuciosa da literatura relevante não produziu nenhuma publicação que relatasse uma força peri-nuclear ou a tampa de actin em células cancerosas. Um estudo indireto sobre células cancerígenas de melanoma demonstrou que a borda da actina (outra organização de actina peri-nuclear localizada ao redor, mas não cobrindo o núcleo) reduz as taxas de migração celular41, sugerindo indiretamente a existência de uma força peri-nuclear. No entanto, nenhum dado experimental direto é relatado. Neste estudo, os autores descobriram que tanto as células PC9 quanto B2B apresentam deslocamento e tração peri-nuclear. Os mecanismos de geração das forças peri-nucleares e seus efeitos permanecem controversos. Em células normais, foi relatado que a tampa de actina desempenha um papel na regulação da morfologia do núcleo e da organização cromatina42, transmitindo sinais mecânicos de aderências focais para o núcleo através de linkers do complexo nucleoesqueleto e citoesqueleto (LINC)43, e regulando a migração celular44. Lamin A/C está relacionado à formação e interrupção do actin cap40,41,42,43,44. No entanto, o relatório que alegou que o tampão actin gera uma força peri-nuclear não considerou o papel potencial do actin rim40. Nas células cancerosas, a superexpressão de Lamin A facilita a formação de uma borda de actina e restringe a migração de células cancerosas. A superexpressão de Lamin B reduz a formação de aro actin e promove a migração. A força peri-nuclear pode estar envolvida neste processo devido à existência da organização peri-nuclear actin e ao efeito de Lamin A. No entanto, os resultados deste estudo não mostraram qualquer evidência de forças peri-nucleares medidas ou o comportamento do actin cap. Portanto, a descoberta de forças peri-nucleares em células PC9 neste presente estudo é o primeiro relatório mostrando forças peri-nucleares e deslocamentos em células cancerígenas de pulmão. Os autores estão atualmente investigando os mecanismos moleculares e funções das forças peri-nucleares nas células PC9 e B2B projetadas pelo CRISPR/Cas9.
Além do interrogatório de mecanobiologia totalmente óptica que é demonstrado neste artigo, o sistema multifuncional integrado pode ser aplicado para sondar opticamente uma miríade de outros sinais fisiológicos e patobiológicos essenciais em sistemas vivos. Por exemplo, o laboratório dos autores estabeleceu recentemente múltiplas linhas celulares de câncer humano que co-expressam três proteínas de membrana sensível à luz: indicador de tensão de membrana QuasAr2 (excitação: 640 nm; emissão: 660 nm-740 nm), despolarizador de tensão de membrana CheRiff (excitação: 488 nm) e hiperpolarizador de tensão de membrana eNpHR3 (excitação: 590 nm). Essas três proteínas funcionais podem ser ativadas por linhas laser ortogonais de espectro de forma livre de crosstalk, permitindo comunicações de sinalização bidirecional ópticas (leitura e controle) da eletrofisiologia da membrana. Utilizando um sistema opto-eletrônico integrado e um grampo manual, os autores validaram o controle e leitura totalmente óptico da tensão de membrana (Vm) em células cancerígenas humanas únicas e esferoides tumorais multicelulares. O interrogatório de eletrofisiologia óptica abre a possibilidade de explorações detalhadas da bioeletricidade anteriormente inacessível em células cancerosas, o que pode ajudar a avançar a biologia tumoral a partir de um novo eixo.
Divulgações
Não há conflitos de interesse para declarar.
Agradecimentos
Este projeto é apoiado financeiramente pelo Prêmio Piloto de Câncer do Centro de Câncer da UF Saúde (X. T. e D. S.) e pelo Pacote de Início do Prêmio Gatorade (X. T.). Os autores agradecem sinceramente as discussões intelectuais e os suportes técnicos do Dr. Jonathan Licht (UFHCC), Dr. Rolf Renne (UFHCC), Dr. Ji-Hyun Lee (Bioestatística, UF), Dr. Hugh Fan (MAE, UF), Dr. Warren Dixon (MAE, UF), Dr. Ghatu Subhash (MAE, UF), Dr. Mark Sheplak (MAE & ECE, UF), Dr. Malisa Sarntinoranont (MAE, UF), Dr. Scott Banks (MAE, MAE), Dr. UF), Dr. Matthew Traum (MAE, UF), Dr. David Hahn (Universidade do Arizona), Dr. Weihong Wang (Oracle Corporation), Dr. Youhua Tan (Hong Kong Polytechnic University), e a Equipe de Apoio de Nikon (Drs. Jose Serrano-Velez, Larry Kordon e Jon Ekman). Os autores estão profundamente gratos pelo apoio generoso e eficaz de todos os membros dos laboratórios de pesquisa de Tang, Siemann e Guan e todos os membros da equipe dos Departamentos de Oncologia MAE & ECE & Physics & Radiation, UF.
Materiais
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Sigma-aldrich | 440140 | |
| 0.05 % Trypsin | Corning | 25-051-CI | |
| 75 cm2 flask | Corning | 430641U | |
| 8 Benchtop Centrifuge | Thermo | 75007210 | |
| A1R confocal system | Nikon | HD25 | |
| Acetic acid | Sigma-aldrich | 695092 | glacial, ACS reagent, ≥99.7% |
| BEAS-2B (B2B) cells | Sigma-aldrich | 95102433 | human epithelial cells from lung tissue |
| Carboxylate-Modified Microspheres | Invitrogen | F8797 | |
| Culture medium (RPMI-1640) | Gibco | 11875093 | |
| Desktop Computer | Dell | 2018 | with Windows 10 operating system |
| Environmental chamber TIZB | Tokai Hit | TIZB | |
| Fetal bovine serum (FBS) | Gibco | 26140 | |
| Fibronectin Human Protein, Plasma | Gibco | 33016015 | |
| Fiji ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | 1.53k | |
| Glass-bottom petri dish | MatTek | P35G-1.5-14-C | |
| HEPES buffered saline | Sigma-aldrich | 51558 | |
| Hydrazine hydrate solution | Sigma-aldrich | 53847 | |
| IntelliJ IDEA | JetBrains | 2020 | Java development platform |
| Java Development Kit | Oracle | 14.0 | |
| Kimwipe | Kimtech Science | 3066-05 | |
| MATLAB | MathWorks | 2020b | |
| Monochrome Camera | FLIR | BFS-U3-70S7M-C | |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-218 | |
| N,N′-Methylenebisacrylamide solution | Sigma-aldrich | M1533 | |
| NIS-Elements software platform | Nikon | 4.50 | software platform |
| Origin | OriginLab | OriginPro 2017 (Learning Edition) | data analysis and graphing software |
| Penicillin-streptomycin | Gibco | 15140122 | |
| PC9 cells | Sigma-aldrich | 90071810 | human adenocarcinoma cells from lung tissue |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | F-553S | high-fidelity DNA polymerase |
| Scotch tape | Scotch | adhesive tape | |
| Sodium dodecyl sulfate solution | Sigma-aldrich | 05030 | |
| Super glue | Gorilla | cyanoacrylate glue | |
| Ti2-E inverted microscope | Nikon | MEA54000 | |
| TI2-S-SE-E Motorized Stage with Encoder | Nikon | MEC56120 | |
| μManager | version 2.0 gamma | open source microscopy software (https://micro-manager.org/) |
Referências
- Werley, C., Boccardo, S., Rigamonti, A., Hansson, E., Cohen, A. Multiplexed optical sensors in arrayed islands of cells for multimodal recordings of cellular physiology. Nature Communications. 11 (1), 3881 (2020).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Saraswathibhatla, A., Galles, E. E., Notbohm, J. Spatiotemporal force and motion in collective cell migration. Scientific Data. 7 (1), 197 (2020).
- Saraswathibhatla, A., Henkes, S., Galles, E. E., Sknepnek, R., Notbohm, J. Coordinated tractions control the size of a collectively moving pack in a cell monolayer. Extreme Mechanics Letters. 48, 101438 (2021).
- Wang, W., Kim, C. K., Ting, A. Y. Molecular tools for imaging and recording neuronal activity. Nature Chemical Biology. 15 (2), 101-110 (2019).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature Methods. 9 (7), 697-710 (2012).
- Carpenter, A. E., Kamentsky, L., Eliceiri, K. W. A call for bioimaging software usability. Nature Methods. 9 (7), 666-670 (2012).
- Skylaki, S., Hilsenbeck, O., Schroeder, T. Challenges in long-term imaging and quantification of single-cell dynamics. Nature Biotechnology. 34 (11), 1137-1144 (2016).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Luo, Q., et al. Automatic multi-functional integration program (AMFIP) towards all-optical mechanobiology interrogation. bioRxiv. , (2021).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer control of microscopes using manager. Current Protocols in Molecular Biology. 92 (1), 14-20 (2010).
- Tulpule, A., et al. Kinase-mediated RAS signaling via membraneless cytoplasmic protein granules. Cell. 184 (10), 2649-2664 (2021).
- Tang, X., Tofangchi, A., Anand, S. V., Saif, T. A. A novel cell traction force microscopy to study multi-cellular system. PLOS Computational Biology. 10 (6), 1003631 (2014).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews Materials. 5, 351-370 (2020).
- Phelps, E. A., et al. Maleimide cross-linked bioactive PEG hydrogel exhibits improved reaction kinetics and cross-linking for cell encapsulation and in situ delivery. Advanced Materials. 24 (1), 64-70 (2012).
- Bajaj, P., Tang, X., Saif, T. A., Bashir, R. Stiffness of the substrate influences the phenotype of embryonic chicken cardiac myocytes. Journal of Biomedical Materials Research. Part A. 95 (4), 1261-1269 (2010).
- Temples, M. N., Adjei, I. M., Nimocks, P. M., Djeu, J., Sharma, B. Engineered three-dimensional tumor models to study natural killer cell suppression. ACS Biomaterials Science & Engineering. 6 (7), 4179-4199 (2020).
- Feng, S., et al. Improved split fluorescent proteins for endogenous protein labeling. Nature Communications. 8, 370 (2017).
- Guan, J., Liu, H., Shi, X., Feng, S., Huang, B. Tracking multiple genomic elements using correlative CRISPR imaging and sequential DNA FISH. Biophysical Journal. 112 (6), 1077-1084 (2017).
- . Micro-Manager Available from: https://micro-manager.org/wiki/NikonTi2 (2021)
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Martiel, J. L., et al. Measurement of cell traction forces with ImageJ. Methods in Cell Biology. 125, 269-287 (2015).
- Okumurai, I. A. On the generalization of Cerruti's problem in an elastic half-space. Doboku Gakkai Ronbunshu. 1995, 1-10 (1995).
- Piccolo, S., Dupont, S., Cordenonsi, M. The biology of YAP/TAZ: hippo signaling and beyond. Physiological Reviews. 94 (4), 1287-1312 (2014).
- Hong, W. W., Guan, K. L. The YAP and TAZ transcription co-activators: Key downstream effectors of the mammalian Hippo pathway. Seminars in Cell and Developmental Biology. 23 (7), 785-793 (2012).
- Zanconato, F., Cordenonsi, M., Piccolo, S. YAP/TAZ at the roots of cancer. Cancer Cell. 29 (6), 783-803 (2016).
- Wang, Y., et al. Overexpression of yes-associated protein contributes to progression and poor prognosis of non-small-cell lung cancer. Cancer Science. 101 (5), 1279-1285 (2010).
- Li, H., et al. Inhibition of YAP suppresses CML cell proliferation and enhances efficacy of imatinib in vitro and in vivo. Journal of Experimental & Clinical Cancer Research. 35 (1), 134 (2016).
- Tang, X., et al. A mechanically-induced colon cancer cell population shows increased metastatic potential. Molecular Cancer. 13, 131 (2014).
- Panciera, T., Azzolin, L., Cordenonsi, M., Piccolo, S. Mechanobiology of YAP and TAZ in physiology and disease. Nature Reviews Molecular Cell Biology. 18 (12), 758-770 (2017).
- Yuan, M., et al. Yes-associated protein (YAP) functions as a tumor suppressor in breast. Cell Death and Differentiation. 15 (11), 1752-1759 (2008).
- Koushki, N., et al. Lamin A redistribution mediated by nuclear deformation determines dynamic localization of YAP. bioRxiv. , (2020).
- Chang, S. S., Rape, A. D., Wong, S. A., Guo, W. H., Wang, Y. L. Migration regulates cellular mechanical states. Molecular Biology of the Cell. 30 (26), 3104-3111 (2019).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Geometric guidance of integrin mediated traction stress during stem cell differentiation. Biomaterials. 69, 174-183 (2015).
- Lee, J., Abdeen, A., Tang, X., Saif, T. A., Kilian, K. A. Matrix directed adipogenesis and neurogenesis of mesenchymal stem cells derived from adipose tissue and bone marrow. Acta Biomaterialia. 42, 46-55 (2016).
- Tang, X., Bajaj, P., Bashir, R., Saif, T. A. How far cardiac cells can see each other mechanically. Soft Matter. 7 (13), 6151-6158 (2011).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Rape, A., Guo, W. H., Wang, Y. L. The regulation of traction force in relation to cell shape and focal adhesions. Biomaterials. 32 (8), 2043-2051 (2011).
- Shiu, J. Y., Aires, L., Lin, Z., Vogel, V. Nanopillar force measurements reveal actin-cap-mediated YAP mechanotransduction. Nature Cell Biology. 20 (3), 262-271 (2018).
- Fracchia, A., Asraf, T., Salmon-Divon, M., Gerlitz, G. Increased lamin B1 levels promote cell migration by altering perinuclear actin organization. Cells. 9 (10), 2161 (2020).
- Ramdas, N. M., Shivashankar, G. V. Cytoskeletal control of nuclear morphology and chromatin o1rganization. Journal of Molecular Biology. 427 (3), 695-706 (2015).
- Khatau, S. B., et al. A perinuclear actin cap regulates nuclear shape. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19017-19022 (2009).
- Kim, D. H., Cho, S., Wirtz, D. Tight coupling between nucleus and cell migration through the perinuclear actin cap. Journal of Cell Science. 127 (11), 2528-2541 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados